Method Article
Mesure souples de Reporters bioluminescents utilisant une luciférase longitudinale automatisé d’imagerie enregistreur de gaz et la température-optimisé (ALLIGATOR)
Dans cet article
Résumé
Luciférase génétiquement encodé est un journaliste populaire non invasif de l’expression génique. Utilisation d’une luciférase longitudinale automatisé d’imagerie enregistreur de gaz et la température-optimisé (ALLIGATOR) permet l’enregistrement longitudinal des cellules bioluminescentes sous un large éventail de conditions. Ici, nous montrons comment ALLIGATOR peut être utilisé dans le cadre de la recherche de rythmes circadiens.
Résumé
Axée sur la luciférase reporters de l’expression génique cellulaire sont largement utilisées depuis longitudinales et des analyses de point d’arrêt de l’activité biologique. Dans la recherche de rythmes circadiens, par exemple, fusions de gènes d’horloge avec luciférase firefly donnent lieu aux rythmes robustes bioluminescence cellulaire qui persistent pendant plusieurs jours. Limitations techniques associées aux tubes photomultiplicateurs (PMT) ou des méthodes classiques axées sur la microscopie pour la quantification de la bioluminescence ont généralement exigé que les cellules et les tissus soit maintenu dans des conditions tout à fait non physiologiques au cours de enregistrement, avec un compromis entre sensibilité et le débit. Nous rapportons ici un raffinement des méthodes antérieures qui permet à long terme d’imagerie de bioluminescence haute sensibilité et un débit qui prend en charge un large éventail de conditions de culture, y compris les gaz variable et régulateur d’humidité, et qui accepte plusieurs différents plaques de culture de tissus et de plats. Cette luciférase longitudinale automatisé imagerie enregistreur de gaz et la température-optimisé (ALLIGATOR) également permet l’observation des variations spatiales dans l’expression de la luciférase à travers une monocouche de cellules ou de tissus, qui ne peuvent être facilement observés par traditionnel Méthodes. Nous mettons en évidence comment l’ALLIGATOR fournit beaucoup plus de flexibilité pour la détection de l’activité de la luciférase en comparaison avec les méthodes existantes.
Introduction
L’utilisation de luciférases comme reporters de l’expression génique et l’activité de la protéine est devenue une technique populaire en recherche en biologie moléculaire et cellulaire. Cela est vrai dans le domaine circadien, où la cinétique de la synthèse de luciférase firefly et inactivation catalytique sont particulièrement bien adaptés pour avoir signalé les changements longitudinaux dans l’expression des gènes qui se produisent pendant environ 24 h cycle circadien. Par conséquent, luciférase travaille comme journaliste circadienne dans un large éventail d’organismes, y compris les champignons, les plantes, les mouches et les mammifères1,2,3,4.
Lors de la quantification circadienne gene expression in vitro, un tube photomultiplicateur (PMT) est couramment utilisé pour enregistrer le signal de bioluminescent. Mesures PMT ont peu de flexibilité cependant, habituellement étant limité à une taille prédéterminée d’assiette ou un plat. Il n’est également pas possible de recueillir toute information spatiale des échantillons contrôlés à l’aide d’un PMT, qui peut conduire à une perte d’information lors de l’imagerie des exemples qui montrent la variation spatiale dans l’expression de la luciférase. En outre, comme le PMT et électroniques associés ont tendance à mal fonctionner lorsqu’il est exposé à l’environnement humidifié d’un incubateur de culture cellulaire standard, enregistrement de luciférase longitudinales à l’aide de PMT est toujours effectuée dans des incubateurs non humidifié. En conséquence, les récipients de culture cellulaire doivent être scellés hermétiquement pour empêcher la perte d’humidité par évaporation et les milieux de culture doit donc être mis en mémoire tampon avec 3 - sulfonique (N- morpholino) (MOPS) ou 4-(2-hydroxyéthyl) -1- acide piperazineethanesulfonic (HEPES), plutôt que le CO2/bicarbonate mise en mémoire tampon de système qui fonctionne en vivo et est utilisé couramment en culture de tissus chez les mammifères.
En raison de ces limitations, mesure de la bioluminescence par PMTs met généralement des restrictions sévères sur les conditions dans lesquelles les cellules sont maintenues au cours d’expériences. Pour surmonter ces problèmes et aussi pour augmenter la portée des conditions expérimentales possibles, nous utilisons un standard CO2/N2 170 L vitroplants incubateur qui a été adapté par l’ajout d’un eau réfrigérée électron-multipliant dispositif à couplage de charge (EMCCD) appareil photo avec optique anti-buée et contrôle numérique des niveaux de température et de gaz. Il a été surnommé un automatique longitudinale luciférase Imaging gaz et Temperature-Optimized enregistreur ou ALLIGATOR. L’ALLIGATOR permet une flexibilité une augmentation substantielle de bioluminescent imaging, tant pour l’imagerie des plaques de culture de tissus standard haut-débit (jusqu'à 6 x 96 ou 384 puits plaques en même temps) et aussi pour les systèmes de culture de tissus non standard, ces comme les cellules perfusés en Dispositifs microfluidiques. Cet instrument permet également d’imagerie pour se produire dans des conditions humidifiées et avec contrôle variable de CO2 et O2 partielle pression tant que la température.
Le protocole ci-dessous décrit une méthode pour l’enregistrement bioluminescente de cellules de mammifères et de systèmes de culture de tissus à l’aide d’un ALLIGATOR (ci-après dénommé « incubateur de bioluminescence »). Toutefois, il est à noter que le système serait bien adapté à l’imagerie bioluminescente et aussi, avec quelques modifications, imagerie, dans un certain nombre d’autres systèmes biologiques et des contextes fluorescente.
Protocole
1. ensemencement et entraînement de la température des cellules
Remarque : Ce protocole a été rigoureusement testé à l’aide de fibroblastes de souris primaire et immortalisées exprimant la protéine de fusion PERIOD2::LUCIFERASE (PER2::LUC)4. Ajustements peuvent il faut faire des expériences avec d’autres lignées cellulaires.
- Avant de commencer la culture cellulaire, placer ce qui suit dans un bain d’eau de 37 ° C pour chauffer : tampon phosphate salin (PBS) (pH 7,4), PBS, additionné de l’acide éthylènediaminetétraacétique 0,68 mM, pH 7,2 (PBS + EDTA), milieux de culture cellulaire appropriée, par exemple, Medium (DMEM de l’aigle de la modification de Dulbecco) additionné de 10 % sérum fœtal (SVF), 100 U/mL de pénicilline et 100 µg/mL de streptomycine et solution de trypsine de 0,25 %.
- Diluer la trypsine 1:3 avec solution de PBS + EDTA préchauffée et retourner à l’eau du bain.
- Prenez une fiole de2 125 cm de cellules exprimant luciférase qui sont 70-90 % confluentes. Aspirer les médias. Ajouter 10 mL de PBS préchauffé.
- Aspirer le PBS. Ajouter 2,5 mL préchauffé trypsine-EDTA et retourner le ballon un incubateur à 37 ° C pendant 5 min.
- Éliminer les cellules de l’incubateur et la vue au microscope. Une fois que la majorité des cellules ont détaché du fond de la fiole, passez à l’étape suivante. Si la plupart des cellules restent attachées au fond de la fiole, retournez-le à l’incubateur jusqu'à ce que la plupart des cellules sont en suspension.
- Ajouter un nouveau 7,5 mL de milieu de culture cellulaire standard au ballon. Éventuellement, prélever 1 mL de cela encore du passage des cellules, comme l’exige.
- Compter la densité des cellules restantes à l’aide d’un hémocytomètre et le bleu trypan. Diluer les cellules de plus, le cas échéant de cette lignée cellulaire.
Remarque : Pour les expériences ci-dessous, les fibroblastes PERIOD2::LUC ont été ensemencées entre 6 x 103 cellules/cm2 et 1 x 104 cellules/cm2 dans des plaques à 96 puits, plats de 35 mm ou diapos de canal. - Cellules de semence sur la culture de tissus plats ou assiettes qui seront utilisés pour l’enregistrement.
Remarque : Utilisation de plaques noires de faces, fond clair est recommandée car cela permet à culture santé à évaluer avant les enregistrements commencent tout en réduisant les interférences entre les puits pendant l’enregistrement. Lorsque les niveaux de bioluminescence sont extrêmement bas, plats/plaques blanches devrait servir afin d’optimiser la détection de la lumière, pour bien que s’il vous plaît notez que phosphorescence peut conduire à augmenté de signal de fond qui persiste pendant plusieurs heures. - Remettez les plaques dans l’incubateur et laisser les monocouches atteindre 100 % confluence (environ 7 jours).
NOTE : Une fois confluentes, lignées cellulaires qui inhibent le contact peuvent être maintenues pendant trois semaines avant l’expérimentation pourvu que les médias sont actualisées régulièrement (tous les 5-7 jours). - Une fois que confluentes, synchroniser les rythmes cellulaires à l’aide de cycles de température appliquée (12 h à 32 ° C, 12 h à 37 ° C) pendant au moins 72 h avant expérimentation5,6 (à l’aide d’un incubateur de cyclisme préprogrammé, contrôlée par un ordinateur connecté à l’incubateur via un port RS-232 série).
Remarque : Le nombre de cycles de température requis pour la synchronisation des rythmes cellulaires peut-être varier entre les lignées de cellules et peut donc être optimisée pour les autres lignées cellulaires. Une stimulation pharmacologique aiguë à l’aide de la forskoline ou la dexaméthasone a également été utilisée précédemment pour synchroniser les rythmes cellulaires7,8.
2. NS21 préparation
Remarque : NS21 est un supplément sans sérum pour le maintien des cultures de cellules neuronales et d’autres. C’est un raffinement d’un supplément semblable appelé B27, qui est disponible et peut être utilisé comme substitut de sérum au cours de la bioluminescence circadienne enregistrements9. Chaque supplément peut être utilisé indifféremment dans les supports d’enregistrement pour les protocoles expérimentaux décrits ci-dessous. Il est tout à fait faisable et rentable de faire NS21 internes, comme Chen et al. 10et comme décrit ici.
- Equilibrer tous les composants décrits dans le tableau 1 à température ambiante pendant 1 h avant le début.
- Dissoudre l’albumine bovine 50 g en milieu basal de 324 mL (p. ex., neurobasal) sur la glace. Agiter le mélange aussi peu que possible.
- Ajouter tous les autres composants, en remuant au minimum après chaque composant, mais en veillant à ce mélange. But de dissoudre tous les composants dans les 90 min de démarrage.
- Aliquote du mélange final et conserver à-20 ° C jusqu'à leur utilisation. Éviter les cycles de gel-dégel répétés.
Remarque : Le mélange est trop visqueux pour filtrer à ce stade, mais sera stérile filtré en dilution avec les médias avant de l’ajouter aux cellules.
3. enregistrement Media préparation
Remarque : Un avantage principal de l’incubateur de bioluminescence sur autre équipement d’enregistrement bioluminescence longitudinale est que, en vertu du pouvoir humidifier l’incubateur et de varier la pression partielle d’O2 et CO2, il est possible d’utiliser un large éventail de conditions du milieu pour enregistrement bioluminescence — y compris les conditions qui plus rapprochent étroitement la niche physiologique occupée par différentes cellules types in vivo. Ci-dessous, nous décrivons l’élaboration de supports adaptés de Hastings et al. 9, que nous avons utilisé couramment avec des fibroblastes et d’autres types de cellules. Le premier concerne les conditions de culture scellé (sans échange de gaz), et le second est pour conditions physiologiquement pertinentes et doit être utilisé dans des conditions humidifiées avec 5 % de CO2.Nombreuses autres variantes sont possibles et souhaitables, selon l’application exacte et le type de cellule.
- Préparation de médias hyperglycémie tampon MOPS
NOTE : Solution (1 L) mère : poudre de DMEM (8,3 g/L), glycémie de 5 mg/mL 0,35 mg/mL de bicarbonate de sodium, , 0,02 M vadrouilles, 100 U/mL de pénicilline, 100 µg/mL de streptomycine.- Dissoudre la poudre DMEM 8,3 g dans 900 mL d’eau ultrapure dans une éprouvette graduée de 1 000 mL et remuer pendant 30 min jusqu'à ce que toutes les particules sont dissolvent.
- Ajouter 50 mL d’une solution de glucose (100 g/L), 20 mL de MOPS (1 M, pH 7,6), 10 mL de 100 x solution de stylo/strep et remuez pendant 10 minutes supplémentaire.
- Ajouter 4,7 mL de solution de bicarbonate de sodium 7,5 % et remuez pendant 5 minutes supplémentaire.
- Ajuster le pH de médias à 7,6 (si à température ambiante) ou 7,4 (37 ° C) avec du HCl/NaOH.
- Ajouter de l’eau ultrapure pour produire un volume final de 1 000 mL.
- Stériliser par filtration à travers un 0,22 µm filtre et conserver à 4 ° C jusqu'à leur utilisation.
- Avant expérimentation, compléter un volume approprié de solution-mère avec 10 % de sérum, 2 mM L-alanyl-L-glutamine, luciférine 2 % NS21 et 1 mM pour faire un stock de travail. Traverser un filtre stérile de 0,22 µm de ce stock.
- Mesurer l’osmolalité des médias à l’aide d’un osmomètre.
- Allumez l’osmomètre.
- Calibrer l’osmomètre, tout d’abord avec l’eau ultrapure. Ajouter 50 µL d’eau au fond d’un navire de la mesure. S’assurer qu'il n’y a pas de bulles dans le liquide. Fixez le navire sur la sonde. Appuyez sur « Zéro » et Déposez délicatement le bras de l’osmomètre jusqu’au point le plus bas. Attendez que la lecture est terminée et le voyant vert « resultat » est allumé avant levant le bras ou de retirer le navire.
- Répétez l’opération pour calibrer l’osmomètre à 300 mOsmol/kg en utilisant 50 µL d’étalonnage standard. Appuyez sur « Cal » avant d’abaisser le bras.
- Mesurer l’osmolalité de l’échantillon en ajoutant 50 µL de médias au fond d’un récipient de mesure et mesure comme indiqué ci-dessus. Appuyez sur « goûter » avant d’abaisser le bras de l’osmomètre.
- Ajuster l’osmolalité de 350 mOsmol à l’aide de 5 M de NaCl.
- HCO3-tampon préparation de médias (milieu de perfusion) de faible concentration de glucose
NOTE : Solution (1 L) mère : poudre de DMEM (8,3 g/L), 3,7 mg/mL de bicarbonate de sodium, glucose 1 mg/mL, 100 U/mL de pénicilline, 100 µg/mL de streptomycine.- Dissoudre la poudre DMEM 8,3 g dans 900 mL d’eau ultrapure dans une éprouvette graduée de 1 000 mL et remuer pendant 30 min jusqu'à ce que toutes les particules sont dissolvent.
- Ajouter 50 mL d’une solution de glucose (100 g/L), 10 mL de solution de stylo/strep x 100 et remuez pendant 10 minutes supplémentaire.
- Ajouter 49,4 mL de solution de bicarbonate de sodium 7,5 % et remuez pendant 5 minutes supplémentaire.
- Ajuster le pH de médias à 7,6 (à température ambiante) ou 7,4 (37 ° C) avec du HCl/NaOH.
- Ajouter de l’eau ultrapure pour donner un volume final de 1 000 mL.
- Passer la solution à travers un 0,22 µm filtre stérile et conserver à 4 ° C jusqu'à l’utilisation.
- Avant expérimentation, compléter un volume approprié de solution contenant 2 % de sérum, 2 mM L-alanyl-L-glutamine, 2 % NS21 et luciférine de 1 mM pour faire un stock de travail. Traverser un filtre stérile de 0,22 µm de ce stock.
- Mesurer et régler l’osmolalité de 350 mOsmol utilisant 5 M NaCl, en ce qui concerne les médias MOPS-tampon.
NOTE : Luciférine concentration doit être déterminée empiriquement pour chaque type de cellule et le contexte. Pour plus d’informations, voir Feeney et al. Les concentrations de 11 sérum et NS21 (ou B27 si utilisé) peuvent varier selon l’application. Toutefois, nous conseillons, à moins que testé empiriquement pour montrer dans le cas contraire, sérum et NS21 (ou autre supplément sans sérum) d’utiliser, comme ces promouvoir l’attachement et la survie des cellules. Dans les lignées cellulaires qui ne touchent pas inhiber bien, il peut être nécessaire abaisser la concentration de sérum dans les supports d’enregistrement pour prévenir des effets confondants de prolifération, également favorisé par le sérum.
4. enregistrement
- Avant de commencer l’enregistrement, placer le stock de médias de travail approprié (à l’étape 3.1 ou 3.2 selon l’expérience) dans un bain d’eau de 37 ° C pour chauffer.
- Alors que les médias se réchauffe, se concentrer la caméra dans l’incubateur de bioluminescence.
- Dévisser le filtre à densité neutre imperméable à l’eau, chauffée et mettre de côté.
- Configurez le logiciel pour enregistrer une vidéo avec une fréquence d’acquisition élevée. Cliquez sur « Acquisition | Acquisition Setup ». La valeur « Temps d’exposition » 0,2 s et temps de cycle cinétiques à 0,3 secondes. Assurez-vous que le gain de l’EM est éteint.
- Fermez la fenêtre « Acquisition Setup » et cliquez sur l’icône « prendre la vidéo ».
- Le cylindre se concentrant, faire tourner la lentille de la caméra jusqu'à ce que les éléments sur le plateau à la hauteur pour être enregistrés sont clairement en bref dans la vidéo.
- Arrêter la vidéo en cliquant sur l’icône « arrêter la vidéo ».
- Visser le filtre de densité neutre chauffé en place ; faute de quoi se traduira par des dommages à l’EM-CCD caméra et/ou la buée de l’objectif en raison de la condensation.
- O2, CO2et la température sur les conditions expérimentales désirées à l’aide du panneau de commande à l’avant de l’incubateur de bioluminescence.
Remarque : Si vous effectuez perfusé culture cellulaire passez directement à la Section 5 à ce stade. - Supprimer les cellules de l’incubateur de culture de tissus et aspirer hors des médias. Remplacer les médias avec un stock de travail préchauffé.
- Si l’incubateur de bioluminescence ne doit ne pas être humidifié pendant l’expérience, puis sceller les plats et les plaques avec un joint imperméable au gaz.
NOTE : L’Humidification est assurée en remplissant le bac de l’eau à la base de l’incubateur.
- Cliquez sur « Acquisition | Acquisition Setup ».
- Dans le panneau « Camera Setup », définissez : « Mode d’Acquisition » à « Cinétique » ; « Durée de l’exposition » à désiré temps d’exposition, en secondes (voir note ci-dessous) ; « Accumulations » 1 ; « Longueur de série cinétique » au nombre de cycles d’acquisition souhaitée ; « Temps de cycle cinétique » à intervalle d’imagerie désiré (s’assurer que c’est supérieure à la durée d’exposition) ; « Changer de vitesse » à 4,33 µsecs ; « Gain » 1 ; et em gagner ' le désiré (voir note ci-dessous)
- Dans le panneau « Autosave », définissez le type de fichier .sif ou .tif. Fournissez un nom de fichier et échéant sauver la situation.
- Dans le panneau de « En attente », définissez le type de fichier au format tiff. Fournissez un nom de fichier et échéant sauver la situation. Fermez la fenêtre de paramètres d’acquisition.
NOTE : Comme l’incubateur de bioluminescence peut être utilisé pour un grand nombre de cellules différentes et de types de tissus, qui ont différents niveaux de la bioluminescence, le temps d’exposition tenu percevoir un signal de bioluminescent approprié peut varier entre expériences. Il est également possible de faire varier le gain (EM) électron-multipliant d’imagerie afin d’augmenter l’amplitude du signal recueilli. Pour les nouvelles applications de luminosité inconnue, nous proposons tout d’abord prendre une seule image avec un temps de pose relativement courte (environ 10 min) sans gain EM et ensuite ajuster les temps d’exposition et EM gain jusqu'à ce que les conditions d’enregistrement désiré ont été atteint. Dans la plupart des cas, un signal moyen de 10 à 20 % de l’intensité maximale possible pixels pour l’appareil photo est un bon niveau de viser. Lorsqu’un ensemble de paramètres de l’enregistrement a été trouvé, démarrez longitudinale acquisition d’images, comme décrit ci-dessus.
5. perfusé Culture tissulaire (facultatif)
Remarque : Comme indiqué dans l’introduction, l’incubateur de bioluminescence est adapté pour l’imagerie des systèmes de culture de tissus non standard. Ceci est illustré dans le développement d’un système de culture cellulaire perfusé.
- Graines les cellules dans seule voie glisse avec raccords Luer avec une profondeur du chenal de 0,6 ou 0,8 mm, de DMEM avec 10 % FBS et stylo/strep, tel que décrit dans la Section 1. Faire le support de perfusion comme indiqué au point 3.2.
- Avant l’enregistrement, préparer la tuyauterie pour le système de perfusion requis à l’aide de 1 mm de diamètre interne (D.I.) Tubes d’ETFE et tube en silicone 1 mm I.D., raccords Luer de coude, mâle et femelle, comme illustré à la Figure 2 a.
NOTE : La majorité de la longueur du tube est ETFE tube, avec des sections de 2 cm de tube de silicone utilisé pour brancher le tuyau de l’ETFE pour les raccords Luer, qui par la suite un lien dans les glissières de canal. - Stériliser le tube de rinçage avec de l’éthanol à 70 %, suivie de PBS stérile.
- Sortir les cultures cellulaires dans les diapositives de canal de l’incubateur. Aspirer les médias et les remplacer par des médias de perfusion préchauffé.
- Remplissez une seringue de 20 mL avec les médias de perfusion préchauffé.
- Raccordez le tuyau à la mémoire tampon de glisser (voir Figure 2), mais pas à la diapositive contenant des cellules et rincer le tube et la diapositive avec les médias (3 à 5 mL) de la perfusion.
- Connectez la diapositive contenant des cellules et rincer le système entier avec 1 mL d’une autre des médias pour enlever les bulles d’air.
- Placer l’ensemble du système dans l’étuve de bioluminescence.
- Fit les seringues remplies de médias à la seringue sans déconnecter le tuyau de pompe et rincer 1 mL d’une autre des médias à travers l’ensemble du système à l’aide de la pompe pour assurer il n’y aucune bulle d’air dans le système.
- Définir le diamètre de la pompe à celle de la seringue utilisée.
Remarque : Pour les seringues de 20 mL utilisés ici, le diamètre est 19,13 mm. - Régler le débit de la pompe à 50 µL/h et mettre en marche.
- S’assurer qu’il n’y a pas de bulles dans les diapositives ou le tube avant le début de l’enregistrement, comme ceux-ci influenceront expression luciférase quand ils passent à travers la couche de cellules. Si nécessaire, rincer autres médias à travers les cellules pour y parvenir.
- Fermer la porte d’incubateur de bioluminescence et continuer comme au point 4.7 pour lancer l’enregistrement.
6. traitement pendant l’enregistrement
Remarque : Il est parfois souhaitable de traiter les cellules mi-chemin un enregistrement, que ce soit avec des agents pharmacologiques ou hormonales. Dans ce cas, il est impératif que les cellules sont manipulés avec soin afin d’éviter l’oscillation cellulaire de réinitialisation pendant le traitement. Pour cette raison, il est particulièrement important que les cellules sont maintenues à une température constante, puisqu’il s’agit d’un repère majeur embarquement pour les rythmes circadiens cellulaire5,6.
- Préparer tous les composants de traitement avant d’arrêter l’enregistrement.
- Préparer un tampon chimique isotherme à 37 ° C.
- Arrêter l’enregistrement de l’appareil, retirer les plats à traiter et le placer sur la bouillote isotherme.
- Traiter les cultures au besoin et retour à l’incubateur de bioluminescence au même endroit qu’avant.
- Re-démarrer l’enregistrement.
7. analyse
Remarque : L’incubateur de bioluminescence génère des données sous la forme d’une série d’images individuelles.Nous employons principalement des Fidji12 pour gérer ces images et puis exporter les données d’intensité moyenne pixel pour chaque région d’intérêt (ROI) pour une analyse ultérieure.
- Ouvrez la pile de l’image dans les îles Fidji et ajuster la luminosité et le contraste en cliquant sur « Image | Ajuster | Brightness/Contrast » et les barres de glissière de réglage jusqu'à ce que les images sont dans une gamme appropriée pour l’affichage du signal de bioluminescent.
- Sélectionnez les domaines d’intérêt en utilisant le gestionnaire de ROI disponible sous « Analyze | Outils | Gestionnaire de ROI ».
- Exportation de signal moyenne pour la zone sélectionnée en cliquant sur « gestionnaire de ROI | Plus | Multimeasure ».
- Copiez les données résultantes dans le logiciel d’analyse.
- Régler manuellement la base de temps des données pour l’intervalle de temps d’imagerie, (c.-à-d., 15, 30 ou 60 min intervalles, qualifiées de 0,25, 0,5 ou 1 h) plutôt que le nombre d’images fournies par Fidji.
Remarque : Une analyse plus approfondie peut maintenant être effectuée, notamment la détermination de la période. Pour ce faire, l’équation suivante est utilisée pour effectuer une analyse de régression non linéaire :

où y est le signal, x le temps correspondant, m est la pente de la courbe de tendance, c est l’ordonnée de la courbe de tendance, l’Amplitude est la hauteur du pic de l’onde au-dessus de la ligne de tendance, k est la constante de désintégration ou le taux d’amortissement (telle que 1 /k est la demi-vie), phase est le décalage en x de la vague de cosinus, et la période est le temps pris pour un cycle complet de se produire le13. R2 valeur est utilisée comme indicateur de la qualité de l’ajustement. Autres méthodes d’analyse sont également possibles. Les premières 24 h de l’acquisition devraient être exclue de l’analyse, comme bioluminesence cellulaire peut-être présenter des changements transitoires et non circadienne durant cette période. C’est le résultat d’une réaction aiguë à un changement de support.
Résultats
Cet article décrit un protocole pour l’imagerie bioluminescente de cellules de mammifères à l’aide d’un ALLIGATOR (incubateur de bioluminescence). Cette technique donne une flexibilité de configuration physique et conditions extracellulaires bioluminescentes systèmes d’imagerie. Méthodes pour simple culture de tissus statique (Figure 1, supplémentaire vidéo 1) et culture de cellules perfusé (Figure 2, supplémentaires vidéo 2) sont décrits, mais de nombreuses autres configurations pourraient être photographiées à l’aide de ce système. Toutes les données ont été quantifiées en utilisant les méthodes décrites dans la Section 7.
Figure 1 a montre un exemple de vidéo d’une bioluminescence enregistrement à partir de plaques 6 x 96 puits contenant de fibroblastes PER2::LUC4. Les puits ultrapériphériques ne contiennent pas de cellules car elles n’étaient pas requis pour cette expérience. Les cellules ont subi l’entraînement différentiel de température, par lequel ils subissent un cycle de température de 12 h, à 32 ° C, suivie à 12 h 37 ° C pendant 72 h ou l’inverse (12 h, à 37 ° C, suivie à 12 h, à 32 ° C pendant 72 h), avant se tient à la constante de 37 ° C pour l’enregistrement. 60 min expositions étaient prises toutes les heures. Deux de ces conditions sont quantifiés dans la Figure 1 b.
Figure 2 a montre une représentation schématique de l’installation d’un système de culture de tissus perfusé. Il s’agit de deux diapositives canal connectés avec la tuyauterie. Media est conduit à travers les cellules par un pousse-seringue. Le premier de ces diapositives agit comme un barboteur perméable de gaz (diapositive tampon) et ne contient aucune cellule, avec le second contenant les cellules d'où la bioluminescence est enregistré. Un représentant d’enregistrement vidéo de ce système est illustré à la Figure 2 b. 15 min expositions étaient prises toutes les 15 min. Ici, les cellules sont maintenues dans des conditions standard de perfusion ou en présence de l’inhibiteur de la kinase caséine PF670462, qui a déjà été démontré que rallonger la période circadienne et réduire l’amplitude des horloge gene expression rythmes en élevage les cellules de mammifères,14. L’effet sur l’expression PER2::LUC est illustré dans la Figure 2 (panneau supérieur) contre les cellules traitées avec la même concentration de médicament dans les conditions de culture de cellules statiques standard illustré à la Figure 2 (panneau inférieur), avec la quantification de la période illustré à la Figure 2D. Il ressort clairement de ce que le traitement avec PF670462 influence PER2::LUC expression sous les deux ensembles de conditions. Cependant, tandis que les cellules traitées avec PF670462 sous conditions perfusées Voir la période allongement d’environ 3 h (3 h de ±0.9), des cellules dans des conditions statiques, traitées avec le médicament montrent un allongement période nettement supérieur à une période de > 48 h. Ceci peut être adapté par un cosinus amorti, tel que décrit dans la Section 7, (F extra-somme des carrés d’essai par rapport à une ligne droite, p < 0,0001). Fait intéressant, l’ampleur de l’allongement période sous perfusion est beaucoup plus proche de celle observée in vivo14.
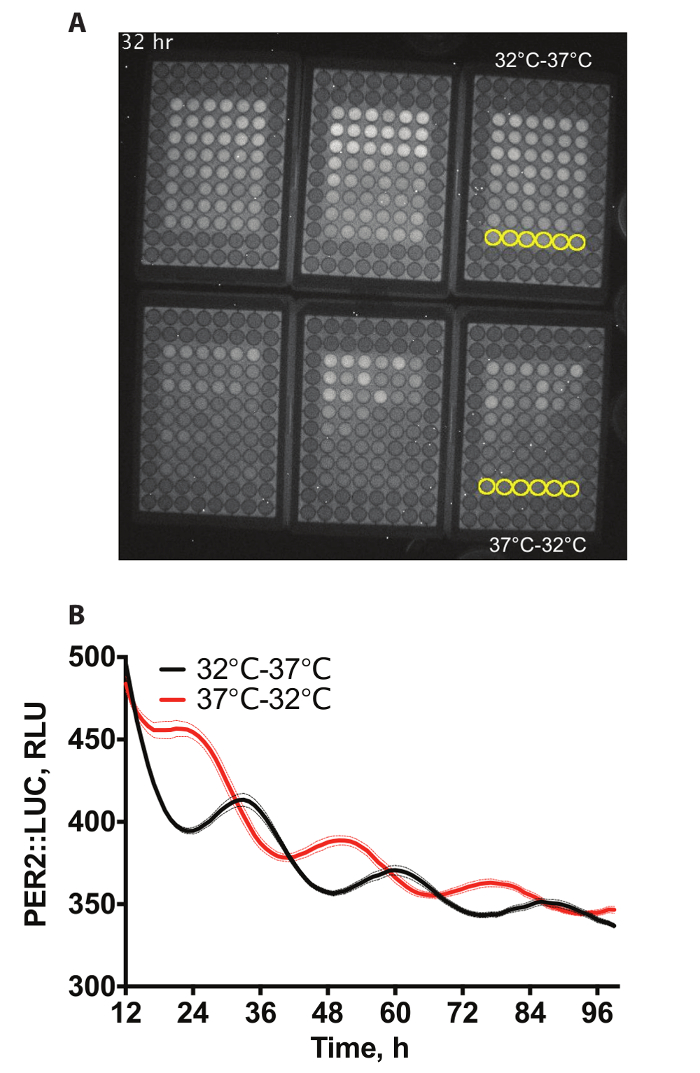
Figure 1 : exemple de données. (A) exemple de capture vidéo de la bioluminescence de PER2::LUC immortalisées dans 6 x 96 plaques bien dans l’incubateur de bioluminescence. Puits à quantifier ont été surlignés en jaune dans le supplémentaire vidéo 1. (B) Quantification de la bioluminescence chez A. Deux ensembles de 3 plaques de cellules ont été entraînés à l’aide des cycles de température (12 h, à 32 ° C ; 12 h, à 37° C) qui étaient anti-phasiques mutuellement pour produire en face des phases d’expression de protéine PER2 (n = 6, moyenne ± et). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
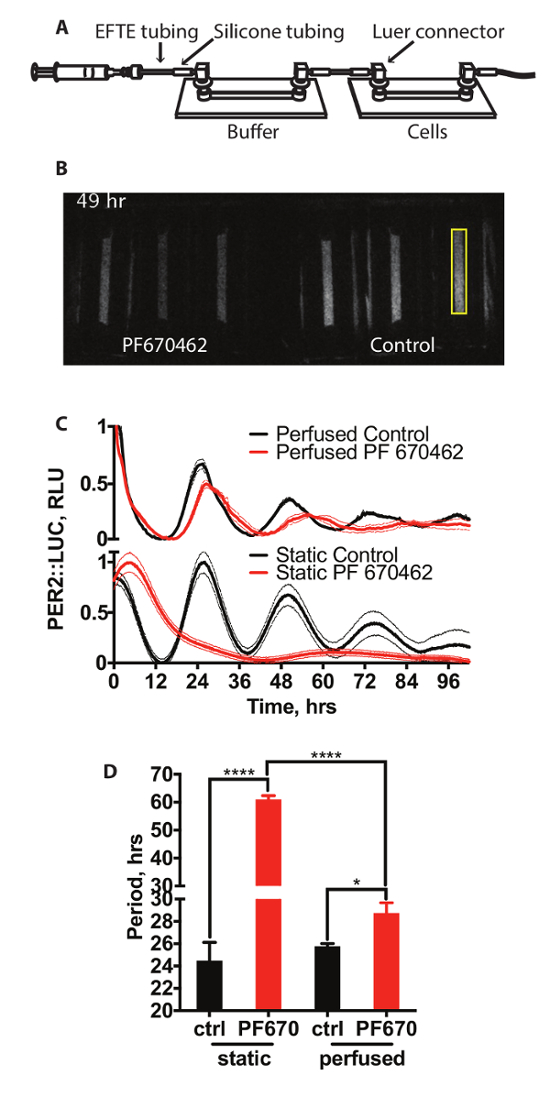
Figure 2 : Perfusion avec inhibiteurs de la CK1δ. (A) Représentation schématique du système de perfusion. (B) exemple de vidéo instantané d’une bioluminescence enregistrement de PER2::LUC cellules sous perfusion. Une zone de prélèvement de quantification est surlignée en jaune. (C) Quantification de la bioluminescence des fibroblastes PER2::LUC sous perfusion et dans des conditions statiques avec ou sans inhibiteur de CK1 µM 3 PF670462 (n = 3, moyenne ± et). Bioluminescence a été normalisée aux valeurs minimales et maximales. (D) l’analyse de la période (Two-Way ANOVA, test de comparaisons multiples de Holm-Sidak).S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Composant | Concentration moyenne finale (μM) | Stock (mg/mL) | Pour 400 mL NS21 |
| Albumine bovine | 37 | - | 50 g |
| Catalase | 0,01 | - | 50 mg |
| Glutathion | 3.2 | - | 20 mg |
| Insuline | 0,6 | 10 | 8 mL |
| Superoxyde dismutase | 0,077 | - | 50 mg |
| Holo-transferrine | 0,062 | - | 100 mg |
| T3 (triiodo-L-thyronine) | 0,0026 | 2 | 20 ΜL |
| L-Carnitine | 12 | - | 40 mg |
| Éthanolamine | 16 | Liquide (1 g/ml) | 20 ΜL |
| D (+)-Galactose | 83 | - | 300 mg |
| Putrescine | 183 | - | 322 mg |
| Sélénite de sodium | 0,083 | 1 | 280 ΜL |
| Corticostérone | 0,058 | 2 | 0,2 mL |
| Acide linoléique | 3.5 | 100 | 0,2 mL |
| Acide linolénique | 3.5 | 100 | 0,2 mL |
| Acide lipoïque | 0,2 | 4.7 | 0,2 mL |
| Progestérone | 0,02 | 3.2 | 0,04 mL |
| Acétate de rétinol | 0,2 | 20 | 0,1 mL |
| Rétinol, toutes les trans | 0,3 | 10 | 0,2 mL |
| D, L-alpha-tocophérol | 2.3 | 100 | 0. 2 mL |
| D, L-alpha-tocophérol | 2.1 | 100 | 0,2 mL |
Tableau 1 : NS21 préparation.
Supplémentaire 1 vidéo : vidéo d’exemple de la bioluminescence de plats. Exemple vidéo instantané de bioluminescence de PER2::LUC immortalisée en plaques bien 6 x 96 dans l’incubateur de bioluminescence. Puits à doser sont surlignés en jaune. S’il vous plaît cliquez ici pour télécharger ce fichier.
Complémentaire 2 vidéo : capture vidéo exemple d’une bioluminescence enregistrement de PER2::LUC cellules sous perfusion. Une zone de prélèvement de quantification est surlignée en jaune. S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Le protocole décrit ici est pour la culture de cellules de mammifères, aussi bien dans des conditions statiques et perfusées. Toutefois, l’ALLIGATOR peut être facilement adaptée à d’autres systèmes de modèle. En effet, il a déjà été démontré pour fournir une excellente plate-forme pour une surveillance simultanée de locomotion, de sommeil et rythmes d’expression de gène périphériques chez Drosophila melanogaster , maintenus dans l’obscurité totale15. On notera également que, selon l’application, les types d’appareil photo autre que celui mentionné ici peuvent être appropriés. Nous envisageons qu’avec les filtres appropriés, une version modifiée de la configuration actuelle pourrait en principe être utilisée pour la quantification de la fluorescence.
Seules les applications pour lesquelles l’ALLIGATOR pourrait ne pas convenir sont celles pour lesquelles particulièrement haute résolution spatiale est nécessaire, comme l’imagerie d’organisation spatio-temporelle de l’expression PER2::LUC en tranches organotypique des mammifères noyau suprachiasmatique, ou autres petites tranches.
L’ALLIGATOR permet de nombreuses expériences à réaliser qui jusqu’ici n’ont pas été facile du faire par des techniques d’enregistrement classiques. Par rapport aux méthodes actuelles de mesure de la bioluminescence, l’ALLIGATOR fournit une plus grande souplesse à la fois le type de boîte de Petri de cellule ou diapositive qui peut être utilisé, les conditions du milieu externe, sensibilité et processivité.
Cela est particulièrement vrai à la fois lorsqu’il y a un éloignement des modèles de culture cellulaire 2D standard vers des systèmes de culture organoïde et flux 3D. Par conséquent, il est prévu que l’ALLIGATOR fournira une méthode adaptable par laquelle, bioluminescence peut être mesurée pendant plusieurs jours et des semaines sous un large éventail de conditions.
Déclarations de divulgation
Aucun conflit d’intérêt n’existe.
Remerciements
Nous tenons à remercier Cairn recherche pour travailler avec nous pour développer ce système, en particulier Mark Henson, Jeremy Graham et Joao Correia. Nous remercions également David Welsh et Reddy Akhilesh discussion précieuse pendant la phase de conception, ainsi que Peter Laskey (anciennement de Hamamatsu) pour organiser le prêt d’un appareil de démo et David Wong pour son apport critique du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM (1x) + GlutaMAX | Gibco | 31966-021 | |
| Hyclone FetalClone III Serum | GE Healthcare | SH30109.03 | |
| Neurobasal medium | Thermofisher | 21103049 | basal medium |
| Bovine Serum Albumin | Sigma | A4919 | |
| Catalase | Sigma | C40 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I1882 | |
| Superoxide Dismutase | Sigma | S5395 | |
| Holo-transferrin | Calbiochem | 616424 | |
| T3 (triiodo-L-thyronine | Sigma | T6397 | |
| L-Carnitine | Sigma | C7518 | |
| Ethanolamine | Sigma | E9508 | |
| D (+)-Galactose | Sigma | G0625 | |
| Putrescine | Sigma | P5780 | |
| Sodium Selenite | Sigma | S9133 | |
| Corticosterone | Sigma | C2505 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| Lipoic Acid | Sigma | T1395 | |
| Progesterone | Sigma | P8783 | |
| Retinol Acetate | Sigma | R7882 | |
| Retinol, all trans | Sigma | 95144 | |
| D,L-alpha-Tocopherol | Sigma | 95240 | |
| D,L-alpha-Tocopherol acetate | Sigma | T3001 | |
| Sodium Bicarbonate Solution | Sigma | S8761-100ML | |
| GlutaMAX (100x) | Gibco | 35050-038 | |
| Penicillin-Streptomycin | Sigma | P4333 | |
| Galaxy 170R incubator | Eppendorf | CO17301001 | |
| Luciferin | Biosynth | L-8220 | |
| D -(+)-Glucose solution | Sigma | G8644-100ML | |
| DMEM powder | Sigma | D5030 | |
| MOPS | Sigma | PHG0007 | |
| 1 mm I.D. silicone tubing | GE Healthcare | 19-4692-01 | |
| Elbow luer connector | Ibidi | 10802 | |
| Male luer fittings | Ibidi | 10826 | |
| Female luer fittings | Ibidi | 10825 | |
| µ-slide luer I 0.6 | Ibidi | 80196 | |
| BD plastipak 20ml syringe | Becton Dickinson | 300613 | |
| 1mm I.D. ETFE tubing | GE Healthcare | 18-1142-38 | |
| PF670462 | Sigma | SML0795 | |
| B27 Supplement (50x) | ThermoFisher | 17504044 | |
| iXon Ultra EMCCD camera | Andor | iXon 888 | |
| Fiji | ImageJ | N/A | |
| Prism 7.0 | Graphpad Software | N/A | |
| Trypan blue | Sigma | T8154 | |
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Heated neutral density filter | Cairn Research | Custom item | |
| Osmomat 030 | Gonotech | Discontinued | |
| 300 mOsmol/kg calibration standard | Gonotech | 30.9.0020 | |
| Measuring vessel | Gonotech | 30.9.0010 | |
| Focusing cylinder | Cairn Research | Custom item | |
| NE-1600 programmable syringe pump | Pump Systems inc. | NE-1600 | |
| Andor Solis Software | Andor | N/A |
Références
- Morgan, L. W., Greene, A. V., Bell-Pedersen, D. Circadian and light-induced expression of luciferase in Neurospora crassa. Fungal Genet. and Biol. 38 (3), 327-332 (2003).
- Millar, A. J. A Novel Circadian Phenotype Based on Firefly Luciferase Expression in Transgenic Plants. Plant Cell Online. 4 (9), 1075-1087 (1992).
- Yu, W., Hardin, P. E. Use of Firefly Luciferase Activity Assays to Monitor Circadian Molecular Rhythms In Vivo and In Vitro. Circadian Rhythms: Methods and Protocols. , 465-480 (2007).
- Yoo, S. -. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc Natl Acad Sci. 101 (15), 5339-5346 (2004).
- Buhr, D. E., Yoo, S. -. H., Takahashi, J. S. Temperature as a universal resetting cue for mammalian circadian oscillators. Science. 330 (6002), 379-385 (2010).
- Brown, S. A., Zumbrunn, G., Fleury-Olela, F., Preitner, N., Schibler, U. Rhythms of mammalian body temperature can sustain peripheral circadian clocks. Current Biology. 12 (18), 1574-1583 (2002).
- Balsalobre, A., et al. Resetting of circadian time in peripheral tissues by glucocorticoid signaling. Science. 289 (5488), 2344-2347 (2000).
- Balsalobre, A., Marcacci, L., Schibler, U. Multiple signaling pathways elicit circadian gene expression in cultured Rat-1 fibroblasts. Curr. Biol. CB. 10 (20), 1291-1294 (2000).
- Hastings, M. H., Reddy, A. B., McMahon, D. G., Maywood, E. S. Analysis of circadian mechanisms in the suprachiasmatic nucleus by transgenesis and biolistic transfection. Methods Enzymol. 393, 579-592 (2005).
- Chen, Y., Stevens, B., Chang, J., Milbrandt, J., Ba Barres, ., Hell, J. W. NS21: re-defined and modified supplement B27 for neuronal cultures. J. Neurosci Methods. 171 (2), 239-247 (2008).
- Feeney, K. A., Putker, M., Brancaccio, M., ONeill, J. S. In-depth Characterization of Firefly Luciferase as a Reporter of Circadian Gene Expression in Mammalian Cells. J. Biol. Rhythms. 31 (6), 540-550 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hirota, T., Lewis, W. G., Liu, A. C., Lee, J. W., Schultz, P. G., Kay, S. A. A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3beta. Proc Natl Acad Sci. 105 (52), 20746-20751 (2008).
- Meng, Q., Maywood, E. S., Bechtold, D. A., Lu, W., Li, J., Gibbs, J. E. Entrainment of disrupted circadian behavior through inhibition of casein kinase 1 ( CK1 ) enzymes. Proc Natl Acad Sci. 1, 1-6 (2010).
- Khabirova, E., Chen, K. -. F., O'Neill, J. S., Crowther, D. C. Flyglow: Single-fly observations of simultaneous molecular and behavioural circadian oscillations in controls and an Alzheimer's model. Sci. Rep. 6, 33759 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon