Method Article
Medição flexível de repórteres bioluminescentes usando um Luciferase Longitudinal automatizado de imagem gravador de gás e temperatura-otimizado (jacaré)
Neste Artigo
Resumo
Luciferase geneticamente codificado é um repórter popular não-invasivo da expressão do gene. Uso de um automatizado do longitudinal luciferase gravador de gás e temperatura-otimizado (jacaré) de imagem permite gravação longitudinal das células bioluminescentes sob uma ampla gama de condições. Aqui nós mostramos como jacaré pode ser usado no contexto de pesquisa de ritmos circadianos.
Resumo
Repórteres do luciferase-baseado da expressão gênica celular estão em uso difundido para ambos longitudinal e ensaios de ponto de extremidade de atividade biológica. Na pesquisa de ritmos circadianos, por exemplo, fusões de gene relógio com luciferase de vaga-lume dar origem a ritmos robustos em bioluminescência celular que persistem por muitos dias. Limitações técnicas associadas com tubos fotomultiplicador (PMT) ou os métodos baseados em microscopia convencionais para quantificação de bioluminescência tipicamente exigiram que as células e tecidos ser mantida sob condições bastante não-fisiológicas durante gravação, com um trade-off entre a sensibilidade e a taxa de transferência. Aqui, nós relatamos um refinamento dos métodos anteriores que permite imagens de bioluminescência a longo prazo com alta sensibilidade e taxa de transferência que suporta uma ampla gama de condições de cultura, incluindo gás variável e controle de umidade, e que aceita muitos diferentes placas de cultura de tecido e pratos. Este luciferase longitudinal automatizada de imagem gravador de gás e temperatura-otimizado (jacaré) também permite a observação das variações espaciais na expressão do luciferase em uma monocamada de células ou tecido, que não pode ser observado prontamente pelo tradicional métodos. Destaca-se como o jacaré fornece uma flexibilidade muito maior para a detecção de atividade de luciferase quando comparado com os métodos existentes.
Introdução
O uso de luciferases como repórteres da expressão gênica e atividade de proteína tornou-se uma técnica popular em pesquisa da biologia molecular e celular. Isto é verdadeiro no campo circadiano, onde a cinética da síntese de luciferase de vaga-lume e inativação catalítica são particularmente adequados para relatar as mudanças longitudinais na expressão gênica que ocorrem durante o ciclo circadiano h aproximadamente 24. Como tal, luciferase é empregado como um repórter circadiano em uma ampla gama de organismos, incluindo plantas, fungos, moscas e mamíferos1,2,3,4.
Quando quantifying genética circadian expressão em vitro, um tubo fotomultiplicador (PMT) é comumente usado para gravar o sinal bioluminescente. Medições baseadas em PGTO tem flexibilidade limitada no entanto, geralmente sendo restrito para um tamanho de placa ou prato pré-determinado. Também não é possível recolher qualquer informação espacial das amostras monitoradas usando um PGTO, que pode levar a uma perda de informação quando imagens de amostras que mostram a variação espacial na expressão de luciferase. Além disso, como o pgto e electrónicos associados são propensos a mau funcionamento quando expostos ao ambiente de uma incubadora de cultura de célula padrão umidificado, gravação longitudinal do luciferase usando PMTs é sempre executada em incubadoras não-umedecido. Em consequência, pratos de cultura de células devem ser selados estanque para evitar a perda de umidade por evaporação e os meios de cultura, portanto, deve ser tamponado com 3 - ácido (N- Morpholinos) (MOPS) ou 4-(2-hidroxietil) -1- ácido piperazineethanesulfonic (HEPES), ao invés do CO2/bicarbonate buffer sistema que funciona na vivo e é usado rotineiramente em cultura de tecidos de mamíferos.
Como resultado dessas limitações, medição de bioluminescência por PMTs geralmente lugares fortes restrições sobre as condições sob as quais as células são mantidas durante as experiências. Para superar esses problemas e também para aumentar o leque de possíveis condições experimentais, usamos uma padrão CO2/N2 170L tecido cultura incubadora que foi adaptada pela adição de uma água-refrigerados elétron-multiplicando dispositivo de carga acoplada (EMCCD) câmera com antinévoa óptica e controle digital de níveis de temperatura e gasolina. Isto tem sido apelidado um automatizado Longitudinal Luciferase Imaging gás e Temperature-Optimized gravador ou jacaré. O jacaré permite flexibilidade um aumento substancial de imaging bioluminescentes, ambos para a imagem latente da elevado-produção de placas de cultura de tecido padrão (até 6 x 96 ou 384-poços chapas simultaneamente) e também para os sistemas de cultura de tecidos não-padrão, tais como perfundidas células cultivadas em dispositivos microfluídicos. Este instrumento permite também a imagem para ocorrer sob condições umidificadas e com controle variável de CO2 e O2 parcial pressão tanto da temperatura.
O protocolo abaixo descreve um método para a gravação bioluminescente de células de mamíferos e sistemas de cultura de tecidos utilizando um jacaré (doravante referido como 'incubadora de bioluminescência'). Convém, no entanto, que o sistema seria bem adequado para imagens bioluminescentes e também, com algumas modificações, fluorescente de imagem, em um número de outros contextos e sistemas biológicos.
Protocolo
1. semeadura e arrastamento de temperatura das células
Nota: Este protocolo foi rigorosamente testado usando fibroblastos de rato primário e imortalizado expressando o de proteína de fusão de PERIOD2::LUCIFERASE (PER2::LUC)4. Ajustes podem precisam ser feitas para experimentos usando outras linhas celulares.
- Antes de começar a cultura celular, coloque o seguinte em um banho de água de 37 ° C para aquecer: tampão fosfato salino (PBS) (pH 7,4), PBS, suplementado com ácido etilenodiaminotetracético de 0,68 mM, pH 7,2 (PBS + EDTA), meios de cultura de célula apropriada, por exemplo, Médio (DMEM modificado águia de Dulbecco) suplementado com 10% de soro fetal bovino (FBS), 100 U/mL penicilina e estreptomicina 100 de µ g/mL e solução de tripsina 0,25%.
- Diluir a tripsina 1:3 com solução de EDTA + PBS pré-aquecido e retornar para o banho de água.
- Tome um frasco de2 125 cm de luciferase-expressando as células que são 70-90% confluentes. Aspire os meios de comunicação. Adicione 10 mL PBS pré-aquecido.
- Aspire a PBS. Adicionar 2,5 mL previamente aquecido do trypsin-EDTA e retornar o frasco para uma incubadora de 37 ° C por 5 min.
- Remova as células da incubadora e vista sob um microscópio. Uma vez que a maioria das células ter retirado o fundo do frasco, continue para a próxima etapa. Se a maioria das células continuam a ser anexado à parte inferior do balão, devolvê-lo para a incubadora até que a maioria das células em suspensão.
- Adicione mais 7,5 mL de meio de cultura de célula padrão para o balão. Opcionalmente, remova 1ml de isso ainda mais a passagem das células, conforme necessário.
- Conte a densidade das células restantes usando um hemocytometer e trypan azul. Dilua as células ainda mais, conforme apropriado para essa linha de celular.
Nota: Para os experimentos abaixo, PERIOD2::LUC fibroblastos foram semeados entre 6 x 103 células/cm2 e 1 x 104 células/cm2 em placas de 96 poços, pratos de 35mm ou slides de canal. - Células de semente para a cultura de tecidos pratos ou travessas que serão usadas para gravação.
Nota: Recomenda o uso de placas de faces, clear-com fundo pretos como este permite a cultura da saúde ser avaliado antes de começar as gravações e reduzir a interferência entre poços durante a gravação. Onde os níveis de bioluminescência são extremamente baixos, pratos/placas brancas deve ser usadas para maximizar a detecção de luz, embora, por favor note que a fosforescência pode levar a aumento sinal de fundo que persiste por várias horas. - O para a incubadora e permitir monocamadas alcançar a confluência de 100% (aproximadamente 7 dias).
Nota: Uma vez confluente, linhas celulares que inibem o contato podem ser mantidas por até três semanas antes da experimentação desde que a mídia é atualizada regularmente (a cada 5-7 dias). - Uma vez confluente, sincronizar celulares ritmos usando ciclos de temperatura aplicada (12 h a 32 ° C, 12 h a 37 ° C) durante um mínimo de 72 h imediatamente antes da experimentação5,6 (utilizando uma incubadora de ciclismo pré-programados, controlada por um computador conectado a incubadora através da porta serial RS-232).
Nota: O número de ciclos de temperatura necessárias para a sincronização de ritmos celulares pode variar entre as linhas de células e pode, portanto, precisa ser otimizado para outras linhas de célula. Aguda estimulação farmacológica usando forskolin ou dexametasona também tenha sido usada anteriormente para sincronizar o celular ritmos7,8.
2. NS21 preparação
Nota: NS21 é um suplemento isento de soro para a manutenção de culturas de células neuronais e outros. É um refinamento de um suplemento semelhante conhecido como B27, que é comercialmente disponível e pode ser usado como um substituto do soro durante gravações de bioluminescência circadian9. Ou outro suplemento pode ser usado permutavelmente na mídia de gravação para os protocolos experimentais descritos abaixo. É bastante viável e rentável para fazer NS21 in-house, como Chen et al 10e conforme descrito aqui.
- Equilibrar todos os componentes descritos na tabela 1 , à temperatura ambiente durante 1 h antes de começar.
- Dissolva a albumina bovina de 50g em meio basal 324 mL (por exemplo, neurobasal) no gelo. Agite a mistura tão pouco quanto possível.
- Adicione todos os outros componentes, mexendo minimamente após cada componente mas ainda assegurar uma mistura completa. Objectivo de dissolver todos os componentes em 90 min da partida.
- Alíquota a mistura final e armazenamento a-20 º C até necessária. Evite ciclos repetidos de congelamento-descongelamento.
Nota: A mistura é demasiado viscosa para filtrar nesta fase, mas será estéril filtrado quando diluído com mídia antes de adicioná-lo às células.
3. preparação de mídia de gravação
Nota: Uma vantagem principal da incubadora a bioluminescência sobre outros equipamentos para gravação longitudinal bioluminescência é que, em virtude de ser capaz de umidificar a incubadora e variar as pressões parciais de O2 e CO2, é possível a utilização de uma ampla gama de condições de mídia para gravação bioluminescência — incluindo as condições que mais intimamente aproximam o fisiológico nicho ocupado pela célula diferente tipos na vivo. Abaixo descrevemos a formulação de gravação de mídia adaptada de Hastings et al 9, que usamos rotineiramente com fibroblastos cultivados e outros tipos de células. O primeiro é para condições de cultura selado (sem troca de gás), e o segundo é para condições fisiologicamente relevantes e deve ser utilizado sob condições umidificadas com 5% de CO2.Muitas outras variações são possíveis e aconselháveis, dependendo da aplicação exata e o tipo de célula.
- Preparação de meios de comunicação de tampão MOPS glicose alta
Nota: Estoque de solução (1 L): pó DMEM (8,3 g/L), glicose de 5 mg/mL 0,35 mg/mL de bicarbonato de sódio, , 0,02 M MOPS, 100 U/mL penicilina, estreptomicina 100 de µ g/mL.- Dissolver o pó DMEM 8,3 g em água ultrapura 900 mL em uma proveta de 1.000 mL e agitar por 30 min, até que todas as partículas são dissolvidas.
- Adicionar 50 mL de solução de glicose (100 g/L), 20 mL de MOPS (1 M, pH 7,6), 10 mL de 100 x solução de caneta/inflamada e mexa por um mais 10 min.
- Adicionar 4,7 mL de solução de bicarbonato de sódio 7,5% e mexa por um mais 5 min.
- Ajuste o pH de mídia a 7,6 (se em temperatura ambiente) ou 7,4 (37 ° C) com HCl/NaOH.
- Adicione água ultrapura para produzir um volume final de 1.000 mL.
- Esterilize por filtração através de um 0,22 µm filtro e armazenar a 4 ° C até necessária.
- Antes da experimentação, completar um volume adequado de solução com 10% de soro, 2 mM L-alanil-L-glutamina, luciferina 2% NS21 e 1 mM para fazer um estoque de trabalho. Passe este estoque através de um filtro de 0,22 µm estéril.
- Medir a pressão osmótica da mídia usando um aparelhos.
- Ligue os aparelhos.
- Calibre os aparelhos, primeiro com água ultrapura. Adicione 50 µ l água no fundo de um recipiente de medição. Certifique-se de que há não há bolhas no líquido. Clip do navio sobre a sonda. Pressione 'Zero' e cuidadosamente Abaixe o braço de aparelhos para o ponto mais baixo. Espere até ler é completa e uma luz verde 'resultado' antes de levantar o braço e retirar a embarcação.
- Repita o procedimento para calibrar os aparelhos para 300 mOsmol/kg usando 50 µ l calibração padrão. Pressione 'Cal' antes de baixar o braço.
- Medir a osmolalidade amostra pela adição de 50 µ l de mídia para o fundo de um recipiente de medição e medida como acima. Pressione 'provar' antes de abaixar o braço de aparelhos.
- Ajuste a pressão osmótica para 350 mOsmol usando 5 M NaCl.
- HCO3-tampão preparação de mídia (meio de perfusão) de glicose baixa
Nota: Estoque de solução (1 L): pó DMEM (8,3 g/L), 3,7 mg/mL de bicarbonato de sódio, glicose de 1 mg/mL, 100 penicilina U/mL, 100 estreptomicina µ g/mL.- Dissolver o pó DMEM 8,3 g em água ultrapura 900 mL em uma proveta de 1.000 mL e agitar por 30 min, até que todas as partículas são dissolvidas.
- Adicionar 50 mL de solução de glicose (100 g/L), 10 mL de solução de caneta/estreptococo x 100 e mexa por um mais 10 min.
- Adicionar o 49,4 mL de solução de bicarbonato de sódio 7,5% e mexa por um mais 5 min.
- Ajuste o pH de mídia a 7,6 (à temperatura ambiente) ou 7,4 (37 ° C) com HCl/NaOH.
- Adicione água ultrapura para dar um volume final de 1.000 mL.
- Passe a solução através de um 0,22 µm filtro estéril e loja a 4 ° C até o uso.
- Antes da experimentação, completar um volume adequado de solução estoque com 2% de soro, 2 mM L-alanil-L-glutamina, 2% NS21 e Luciferina de 1 milímetro para fazer um estoque de trabalho. Passe este estoque através de um filtro de 0,22 µm estéril.
- Medir e ajustar a pressão osmótica para 350 mOsmol usando 5 M NaCl, quanto a mídia tampão MOPS.
Nota: Concentração de luciferina deve ser determinada empiricamente para cada tipo de célula e contexto. Para mais informações veja Feeney et al Concentrações de 11 soro e NS21 (ou B27 se utilizado) podem ser variadas dependendo da aplicação. No entanto, aconselhamos que, a não ser empiricamente testadas para mostrar o contrário, soro e NS21 (ou alternativo suplemento isento de soro) sejam utilizados, como estes promovem a fixação e a sobrevivência da pilha. Na linha celular que não contate inibir bem, pode ser necessário diminuir a concentração sérica da mídia de gravação para evitar efeitos de confundimento de proliferação, que também é promovido pelo soro.
4. gravação
- Antes de iniciar a gravação, coloque as ações de mídia trabalho apropriado (da etapa 3.1 ou 3.2 dependendo do experimento) em banho-maria 37 ° C para aquecer.
- Enquanto a mídia está aquecendo, foco da câmera na incubadora de bioluminescência.
- Desaperte o filtro de densidade neutra impermeáveis a água, aquecida e reserve.
- Ajustar o software para gravar um vídeo com uma taxa elevada de aquisição. Clique em "aquisição | Instalação de aquisição". Defina o 'Tempo de exposição' 0,2 s e tempo de ciclo cinética para 0,3 segundos. Certifique-se de que o ganho EM está desligado.
- Feche a janela 'Configuração de aquisição' e clique no ícone "fazer um vídeo".
- Usando o cilindro com foco, gire a lente da câmera até itens na prateleira na altura que gravassem claramente estão em foco no vídeo.
- Pare o vídeo clicando no ícone 'parar de vídeo'.
- Parafuso do filtro de densidade neutra aquecida para a posição; Falha ao fazer isso irá resultar em danos para a câmera do CCD-EM e/ou nebulização do objectivo devido à condensação.
- Conjunto O2, CO2e temperatura para as condições experimentais desejadas usando o painel de controle na parte frontal da incubadora a bioluminescência.
Nota: Se realizando perfundidos cultura celular passar directamente à secção 5 nesta fase. - Remova as células da incubadora de cultura de tecidos e aspirado fora da mídia. Substitua a mídia com ações de trabalho previamente aquecido.
- Se a incubadora de bioluminescência é para não ser umedecido durante o experimento, então foca os pratos e placas com um selo impermeável-gás.
Nota: Humidificação é alcançada através do preenchimento da bandeja de água na base da incubadora.
- Clique em "aquisição | Instalação de aquisição".
- No painel 'Configuração', defina: 'Modo de aquisição' para 'Cinética'; 'Tempo de exposição ao tempo de exposição, na pretendida segundos (ver nota abaixo); 'Acumulações' para 1; 'Comprimento série cinética' para o número de ciclos de aquisição desejada; 'Tempo de ciclo cinética' para o intervalo de imagem desejado (certifique-se de que este é maior que o tempo de exposição); 'Velocidade shift' para 4,33 µsecs; 'Ganhar' para 1; e eles ganham ' para o desejado nível (ver nota abaixo)
- No painel 'Autosave', defina o tipo de arquivo. sif ou. tif. Fornecer um nome de arquivo e necessário da economia local.
- No painel 'Spool', defina o tipo de arquivo para tiff. Fornecer um nome de arquivo e necessário da economia local. Feche a janela de configuração de aquisição.
Nota: Como a incubadora de bioluminescência pode ser usada para um grande número de diferente tipos de célula e tecido, os quais terão diferentes níveis de bioluminescência, o tempo de exposição necessário para coletar um sinal adequado bioluminescente pode variar entre experimentos. Também é possível variar o ganho (EM) elétron-multiplicação de imagens, a fim de aumentar a magnitude do sinal coletado. Para novas aplicações de brilho desconhecido, sugerimos que primeiro tomar uma única imagem com um tempo de exposição relativamente curto (em torno de 10 min) sem ganho EM e posteriormente ajustando o tempo de exposição e EM ganham até que as condições de gravação desejado tem sido alcançado. Na maioria dos casos, um sinal médio de 10-20% da intensidade máxima possível de pixel para a câmera é um bom nível de apontar. Quando é atingido um conjunto apropriado de parâmetros de gravação, inicie longitudinal aquisição de imagens, como descrito acima.
5. perfundidos cultura de tecidos (opcional)
Nota: Conforme descrito na introdução, a incubadora de bioluminescência é adequada para a imagem latente dos sistemas de cultura de tecidos não-padrão. Isto é exemplificado no desenvolvimento de um sistema de cultura de células perfundidos.
- Sementes das células para canal único desliza com conectores Luer, com uma profundidade de canal de 0,6 ou 0,8 mm, em DMEM com 10% FBS e caneta/estreptococos, conforme descrito na seção 1. Fazer a mídia de perfusão, conforme descrito no passo 3.2.
- Antes da gravação, preparar tubos para o sistema de perfusão necessária usando 1 mm de diâmetro interno (ID) ETFE tubos e tubos de silicone 1mm identificação, cotovelo, macho e fêmea Luer encaixes, como mostrado na Figura 2A.
Nota: A maioria do comprimento da tubulação é tubulação de ETFE, com seções de 2 cm de tubo de silicone usado para conectar o tubo de ETFE ao arranjo Luer, que posteriormente se ligam em slides o canal. - Esterilize a tubulação por lavagem com etanol 70%, seguido de PBS estéril.
- Remova as culturas de células de slides canal da incubadora. Aspirar os meios de comunicação e substituir com mídia de perfusão previamente aquecido.
- Encha uma seringa de 20 mL com a mídia de perfusão previamente aquecido.
- Conecte o tubo para o buffer de deslize (ver Figura 2), mas não para o slide que contém a célula e limpar a tubulação e deslize com a mídia de perfusão (3-5 mL).
- Conectar o slide que contém a célula e liberar todo o sistema com mais 1 mL de mídia para remover quaisquer bolhas de ar.
- Transferi todo o sistema para a incubadora de bioluminescência.
- Ajuste as seringas cheias de mídia para a seringa da bomba sem desconectar da tubagem e irrigue mais 1 mL de mídia através de todo o sistema usando a bomba para garantir lá não são nenhuma bolha de ar no sistema.
- Defina o diâmetro da bomba para que da seringa sendo usada.
Nota: Para as seringas de 20 mL usadas aqui, o diâmetro é 19,13 mm. - Definir a taxa de fluxo da bomba de 50 µ l/h e iniciá-lo executando.
- Certifique-se de que não há nenhuma bolha em slides ou tubulação antes do início da gravação, como estes irão influenciar a expressão do luciferase quando eles passam através da monocamada de células. Se necessário, lave mais mídia através das células para alcançar este objectivo.
- Feche a porta de incubadora de bioluminescência e continuar como na etapa 4.7 para começar a gravação.
6. tratamento durante a gravação
Nota: Às vezes é desejável para tratar a meio caminho de células por meio de uma gravação, seja com agentes farmacológicos ou hormonais. Em tais casos, é imperativo que as células são tratadas com cuidado para evitar a oscilação celular de redefinição durante o tratamento. Por esta razão, é de particular importância que as células são mantidas a uma temperatura constante, pois esta é uma grande deixa arrasta para celular circadiano5,6.
- Preparem-se todos os componentes de tratamento antes de parar a gravação.
- Prepare uma almofada isotérmica química a 37 ° C.
- Parar a gravação do dispositivo, remova os pratos para ser tratada e coloque sobre a almofada isotérmica de calor.
- Trate as culturas como necessário e retorno para a incubadora de bioluminescência no mesmo local como antes.
- Re-inicie a gravação.
7. análise
Nota: A incubadora de bioluminescência produz dados sob a forma de uma série de imagens individuais.Usamos principalmente Fiji12 para gerenciar essas imagens e em seguida, exportar os dados de intensidade média pixel para cada região de interesse (ROI) para posterior análise.
- Abra a pilha de imagem em Fiji e ajustar o brilho e contraste, clicando em "imagem | Ajustar | Brilho/contraste"e ajuste as barras deslizantes até imagens estão dentro do intervalo adequado para a visualização do sinal bioluminescente.
- Selecione as áreas de interesse usando o Gerenciador de ROI disponível sob "Analyze | Ferramentas | Gerente de ROI".
- Mau sinal de exportação para a área selecionada, clicando em "Gerenciador de ROI | Mais | Multi".
- Copie os dados resultantes para o software de análise.
- Ajustar manualmente a base de tempo dos dados para o intervalo de tempo da imagem, (i.e., 15, 30 ou 60 min intervalos, descritos como 0,25, 0,5, 1 h) em vez do número de imagens fornecidas por Fiji.
Nota: Uma análise mais aprofundada pode agora ser realizada, tais como a determinação do período. Por isso, a seguinte equação é usada para executar a análise de regressão não-linear:

onde y é o sinal, x o tempo correspondente, m é a inclinação da linha de tendência, c é a intercepção de y da linha de tendência, Amplitude é a altura do pico da forma de onda acima da linha de tendência, k é a constante de decaimento ou taxa de amortecimento (tal que 1 /k é o Half-Life), a fase é a mudança no x da onda co-seno e o período é o tempo necessário para um ciclo completo ocorrer a13. R2 valor é usado como um indicador de bondade de ajuste. Outros métodos de análise são também possíveis. As primeiras 24 horas da aquisição devem ser excluídas da análise, como bioluminesence celular pode apresentar alterações transitórias, não-circadian durante este tempo. Este é o resultado de uma resposta aguda à mudança de mídia.
Resultados
Este artigo descreve um protocolo para a imagem latente bioluminescente de pilhas mamíferas usando um jacaré (incubadora de bioluminescência). Esta técnica permite flexibilidade de configuração física e condições extracelulares quando sistemas bioluminescentes de imagens. Métodos para cultura de tecidos estática simples (Figura 1, complementar Video 1) e cultura de pilha perfundidos (Figura 2, vídeo complementar 2) são descritos, mas muitas outras configurações poderiam ser fotografadas usando este sistema. Todos os dados foram quantificados usando os métodos descritos na seção 7.
A figura 1A mostra um exemplo de vídeo de uma gravação de chapas de 6 x 96 poços contendo PER2::LUC fibroblastos4de bioluminescência. Os poços ultraperiféricas não contêm células como estes não eram necessários para esta experiência. Células sofreram arrastamento de temperatura diferencial, pelo qual passam por qualquer ciclo de temperatura de 12 h, a 32 ° C, seguido por 12 h 37 ° C, durante 72 h ou o inverso (12 h, a 37 ° C, seguido de 12 h, a 32 ° C, durante 72 h), antes sendo realizada a constante de 37 ° C para a gravação. exposições de 60 min foram tiradas a cada hora. Duas dessas condições são quantificadas na figura 1B.
Figura 2A mostra um esquema da instalação de um sistema de cultura de tecidos perfundido. Isto consiste em dois slides canal conectados com a tubulação. Mídia de células é atravessada por uma bomba de seringa. O primeiro destes slides atua como um borbulhador permeável (slide reserva) gás e contém sem células, com o segundo contendo as células do qual bioluminescência é gravada. Um representante de gravação de vídeo a partir deste sistema é mostrado na Figura 2B. 15 min exposições foram tiradas a cada 15 min. Aqui, as células são mantidas em condições padrão de perfusão ou na presença de inibidor de caseína quinase PF670462, que foi mostrado anteriormente para alongar o período circadiano e reduzir a amplitude dos ritmos de expressão de gene de relógio no culto células de mamíferos,14. O efeito na expressão de PER2::LUC é mostrado na Figura 2 (painel superior) contra células tratadas com a mesma concentração de drogas em condições de cultura celular estático padrão mostrado na Figura 2 (painel inferior), com a quantificação do período mostrado na Figura 2D. É claro com isso que o tratamento com PF670462 influências PER2::LUC expressão sob os dois conjuntos de condições. No entanto, enquanto células tratadocom com PF670462 sob condições perfundidas mostrar período alongamento de aproximadamente 3 h (3h ±0.9), as células em condições estáticas, tratadas com a droga apresentam substancialmente maior período de alongamento para um período de > 48 h. Isto pode ser cabido por um cosseno amortecido, conforme descrito na seção 7, (extrasoma-das-praças F teste contra uma linha reta, p < 0,0001). Curiosamente, a magnitude do alongamento do período sob perfusão está mais próxima às observadas na vivo14.
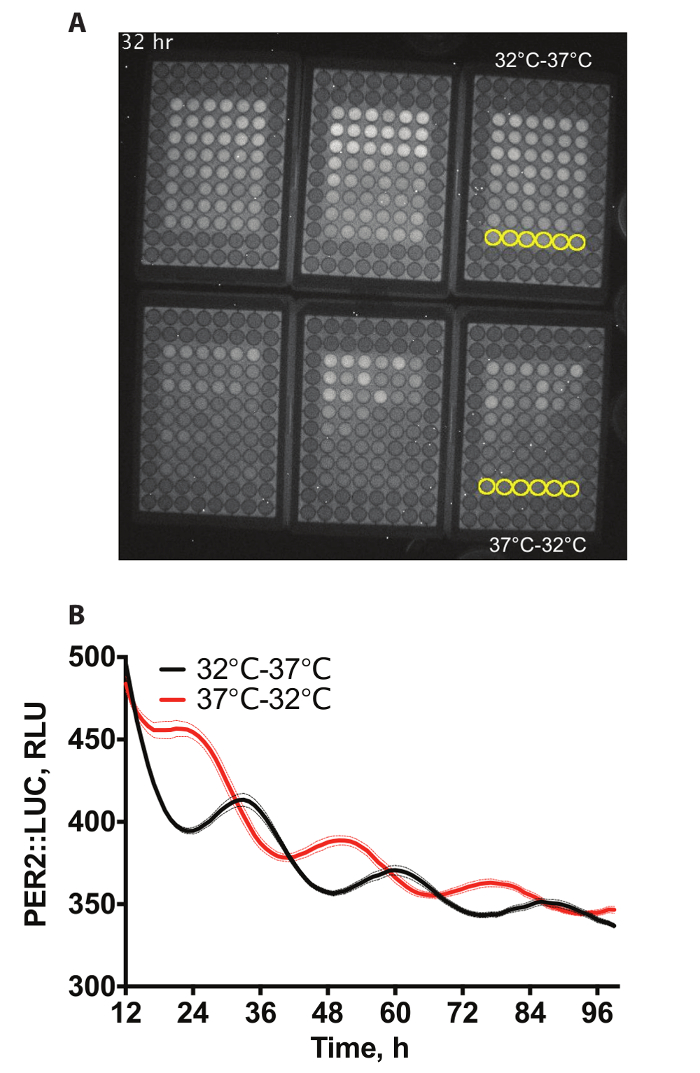
Figura 1: exemplo de dados. (A) exemplo de placas de vídeo instantâneo de bioluminescência de PER2::LUC imortalizado em 6 x 96 bem na incubadora de bioluminescência. Poços para ser quantificada foram destacados em amarelo no complementar Video 1. (B) quantificação de bioluminescência da. Dois conjuntos de 3 placas de células foram arrastados usando ciclos de temperatura (12 h, a 32 ° C; 12 h, a 37° C) que eram antifásicos uns aos outros para produzir em frente as fases de expressão de proteínas PER2 (n = 6, quer dizer ± SEM). Clique aqui para ver uma versão maior desta figura.
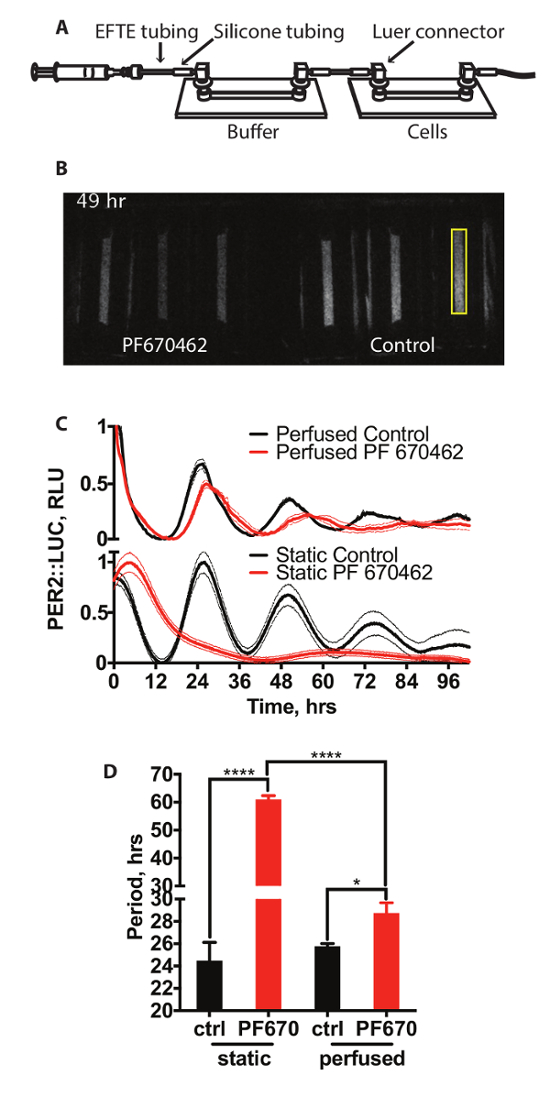
Figura 2: perfusão com inibidores de CK1δ. (A) diagrama esquemático do sistema de perfusão. (B) exemplo de vídeo instantâneo de uma gravação de PER2::LUC de bioluminescência células sob perfusão. Uma área de amostra de quantificação é realçada em amarelo. (C) a quantificação da bioluminescência dos fibroblastos PER2::LUC em perfusão e em condições estáticas com e sem inibidor de CK1 3 µM PF670462 (n = 3, significa ± SEM). Bioluminescência tem sido normalizada para os valores mínimos e máximos. (D) a análise do período (Two-Way ANOVA, teste de comparações múltiplas do Holm-Sidak).Por favor clique aqui para ver uma versão maior desta figura.
| Componente de | Concentração média final (μM) | Estoque (mg/mL) | Para NS21 400ml |
| Albumina bovina | 37 | - | 50 g |
| Catalase | 0.01 | - | 50 mg |
| Glutationa | 3.2 | - | 20 mg |
| Insulina | 0.6 | 10 | 8 mL |
| Superóxido dismutase | 0.077 | - | 50 mg |
| Holo-transferrina | 0,062 | - | 100 mg |
| T3 (triiodo-L-Tironina) | 0.0026 | 2 | 20 Μ l |
| L-carnitina | 12 | - | 40 mg |
| Etanolamina | 16 | Líquido (1 g/ml) | 20 Μ l |
| D (+)-Galactose | 83 | - | 300 mg |
| Putrescina | 183 | - | 322-mg |
| Selenito de sódio | 0.083 | 1 | Μ L 280 |
| Corticosterona | 0.058 | 2 | 0,2 mL |
| Ácido linoleico | 3.5 | 100 | 0,2 mL |
| Ácido linolênico | 3.5 | 100 | 0,2 mL |
| Ácido lipoico | 0.2 | 4.7 | 0,2 mL |
| Progesterona | 0.02 | 3.2 | 0,04 mL |
| Acetato de retinol | 0.2 | 20 | 0,1 mL |
| Retinol, todos os trans | 0.3 | 10 | 0,2 mL |
| D, L-alfa-tocoferol | 2.3 | 100 | 0. 2 mL |
| D, acetato de L-alfa-tocoferol | 2.1 | 100 | 0,2 mL |
Tabela 1: NS21 preparação.
Suplementares vídeo 1: vídeo de exemplo de bioluminescência de placas bem. Vídeo instantâneo de exemplo de bioluminescência de PER2::LUC imortalizado em 6 x 96 placas bem na incubadora de bioluminescência. Poços para ser quantificados são realçados em amarelo. Clique aqui para baixar este arquivo.
Vídeo complementar 2: vídeo instantâneo de exemplo de uma gravação de PER2::LUC de bioluminescência células sob perfusão. Uma área de amostra de quantificação é realçada em amarelo. Clique aqui para baixar este arquivo.
Discussão
O protocolo descrito aqui é para cultura de células de mamíferos, tanto em condições estáticas e perfundidas. No entanto, o jacaré pode ser facilmente adaptado para outros sistemas de modelo. Com efeito, já mostrou para fornecer uma excelente plataforma para monitoramento simultâneo de locomoção, sono e ritmos de expressão do gene periférica em Drosophila melanogaster , mantida sob constante escuridão15. É também de notar que, dependendo da aplicação, tipos de câmera diferentes que mencionados aqui podem ser adequados. Prevemos que com os filtros adequados, uma versão modificada da instalação do atual poderia em princípio ser usada para quantificação de fluorescência.
Os aplicativos só por que o jacaré não pode ser apropriado são aqueles para os quais particularmente alta resolução espacial é necessária, como a imagiologia de organização spatiotemporal de expressão PER2::LUC em fatias organotypic dos mamíferos núcleo supraquiasmático, ou outras fatias pequenas de tecido.
O jacaré permite muitas experiências a serem executadas que até então não foram facilmente alcançáveis por técnicas convencionais de gravação. Comparado com os métodos atuais para a medição de bioluminescência, o jacaré fornece maior flexibilidade em ambos o tipo de prato de cultura celular ou slide que pode ser usado, as condições de mídia externa, sensibilidade e processivity.
Isto é particularmente relevante num momento quando há um movimento longe de modelos de cultura padrão celular 2D para 3D organoides e fluxo sistemas de cultura. Como tal, prevê-se que o jacaré irá fornecer um método adaptável pelo qual bioluminescência pode ser medida ao longo de muitos dias e semanas sob uma ampla gama de condições.
Divulgações
Não há conflitos de interesses existentes.
Agradecimentos
Gostaríamos de agradecer o Cairn pesquisa por trabalhar para desenvolver este sistema, em especial Mark Henson, Jeremy Graham e Joao Correia. Agradecemos também David Welsh e Adriano Reddy para discussão valioso durante a fase de projeto, bem como Peter Laskey (anteriormente de Hamamatsu) para organizar o empréstimo de uma câmera de demo e David Wong para sua entrada crítica ao manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM (1x) + GlutaMAX | Gibco | 31966-021 | |
| Hyclone FetalClone III Serum | GE Healthcare | SH30109.03 | |
| Neurobasal medium | Thermofisher | 21103049 | basal medium |
| Bovine Serum Albumin | Sigma | A4919 | |
| Catalase | Sigma | C40 | |
| Glutathione | Sigma | G6013 | |
| Insulin | Sigma | I1882 | |
| Superoxide Dismutase | Sigma | S5395 | |
| Holo-transferrin | Calbiochem | 616424 | |
| T3 (triiodo-L-thyronine | Sigma | T6397 | |
| L-Carnitine | Sigma | C7518 | |
| Ethanolamine | Sigma | E9508 | |
| D (+)-Galactose | Sigma | G0625 | |
| Putrescine | Sigma | P5780 | |
| Sodium Selenite | Sigma | S9133 | |
| Corticosterone | Sigma | C2505 | |
| Linoleic Acid | Sigma | L1012 | |
| Linolenic Acid | Sigma | L2376 | |
| Lipoic Acid | Sigma | T1395 | |
| Progesterone | Sigma | P8783 | |
| Retinol Acetate | Sigma | R7882 | |
| Retinol, all trans | Sigma | 95144 | |
| D,L-alpha-Tocopherol | Sigma | 95240 | |
| D,L-alpha-Tocopherol acetate | Sigma | T3001 | |
| Sodium Bicarbonate Solution | Sigma | S8761-100ML | |
| GlutaMAX (100x) | Gibco | 35050-038 | |
| Penicillin-Streptomycin | Sigma | P4333 | |
| Galaxy 170R incubator | Eppendorf | CO17301001 | |
| Luciferin | Biosynth | L-8220 | |
| D -(+)-Glucose solution | Sigma | G8644-100ML | |
| DMEM powder | Sigma | D5030 | |
| MOPS | Sigma | PHG0007 | |
| 1 mm I.D. silicone tubing | GE Healthcare | 19-4692-01 | |
| Elbow luer connector | Ibidi | 10802 | |
| Male luer fittings | Ibidi | 10826 | |
| Female luer fittings | Ibidi | 10825 | |
| µ-slide luer I 0.6 | Ibidi | 80196 | |
| BD plastipak 20ml syringe | Becton Dickinson | 300613 | |
| 1mm I.D. ETFE tubing | GE Healthcare | 18-1142-38 | |
| PF670462 | Sigma | SML0795 | |
| B27 Supplement (50x) | ThermoFisher | 17504044 | |
| iXon Ultra EMCCD camera | Andor | iXon 888 | |
| Fiji | ImageJ | N/A | |
| Prism 7.0 | Graphpad Software | N/A | |
| Trypan blue | Sigma | T8154 | |
| Deltaphase Isothermal Pad | Braintree Scientific | 39DP | |
| Heated neutral density filter | Cairn Research | Custom item | |
| Osmomat 030 | Gonotech | Discontinued | |
| 300 mOsmol/kg calibration standard | Gonotech | 30.9.0020 | |
| Measuring vessel | Gonotech | 30.9.0010 | |
| Focusing cylinder | Cairn Research | Custom item | |
| NE-1600 programmable syringe pump | Pump Systems inc. | NE-1600 | |
| Andor Solis Software | Andor | N/A |
Referências
- Morgan, L. W., Greene, A. V., Bell-Pedersen, D. Circadian and light-induced expression of luciferase in Neurospora crassa. Fungal Genet. and Biol. 38 (3), 327-332 (2003).
- Millar, A. J. A Novel Circadian Phenotype Based on Firefly Luciferase Expression in Transgenic Plants. Plant Cell Online. 4 (9), 1075-1087 (1992).
- Yu, W., Hardin, P. E. Use of Firefly Luciferase Activity Assays to Monitor Circadian Molecular Rhythms In Vivo and In Vitro. Circadian Rhythms: Methods and Protocols. , 465-480 (2007).
- Yoo, S. -. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proc Natl Acad Sci. 101 (15), 5339-5346 (2004).
- Buhr, D. E., Yoo, S. -. H., Takahashi, J. S. Temperature as a universal resetting cue for mammalian circadian oscillators. Science. 330 (6002), 379-385 (2010).
- Brown, S. A., Zumbrunn, G., Fleury-Olela, F., Preitner, N., Schibler, U. Rhythms of mammalian body temperature can sustain peripheral circadian clocks. Current Biology. 12 (18), 1574-1583 (2002).
- Balsalobre, A., et al. Resetting of circadian time in peripheral tissues by glucocorticoid signaling. Science. 289 (5488), 2344-2347 (2000).
- Balsalobre, A., Marcacci, L., Schibler, U. Multiple signaling pathways elicit circadian gene expression in cultured Rat-1 fibroblasts. Curr. Biol. CB. 10 (20), 1291-1294 (2000).
- Hastings, M. H., Reddy, A. B., McMahon, D. G., Maywood, E. S. Analysis of circadian mechanisms in the suprachiasmatic nucleus by transgenesis and biolistic transfection. Methods Enzymol. 393, 579-592 (2005).
- Chen, Y., Stevens, B., Chang, J., Milbrandt, J., Ba Barres, ., Hell, J. W. NS21: re-defined and modified supplement B27 for neuronal cultures. J. Neurosci Methods. 171 (2), 239-247 (2008).
- Feeney, K. A., Putker, M., Brancaccio, M., ONeill, J. S. In-depth Characterization of Firefly Luciferase as a Reporter of Circadian Gene Expression in Mammalian Cells. J. Biol. Rhythms. 31 (6), 540-550 (2016).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Hirota, T., Lewis, W. G., Liu, A. C., Lee, J. W., Schultz, P. G., Kay, S. A. A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3beta. Proc Natl Acad Sci. 105 (52), 20746-20751 (2008).
- Meng, Q., Maywood, E. S., Bechtold, D. A., Lu, W., Li, J., Gibbs, J. E. Entrainment of disrupted circadian behavior through inhibition of casein kinase 1 ( CK1 ) enzymes. Proc Natl Acad Sci. 1, 1-6 (2010).
- Khabirova, E., Chen, K. -. F., O'Neill, J. S., Crowther, D. C. Flyglow: Single-fly observations of simultaneous molecular and behavioural circadian oscillations in controls and an Alzheimer's model. Sci. Rep. 6, 33759 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados