Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En Vivo EPR evaluación de pH, pO2, estado Redox y concentraciones de fosfato y glutatión en el microambiente tumoral
En este artículo
Resumen
Resonancia paramagnética electrónica de bajo campo (banda L, 1.2 GHz) usando puntas de prueba nitroxyl y trityl soluble se demuestra para la evaluación de parámetros fisiológicamente importantes en el microambiente tumoral en modelos de ratón de cáncer de mama.
Resumen
Este protocolo demuestra la capacidad de resonancia paramagnética electrónica de bajo campo (EPR)-basado en técnicas en combinación con sondas paramagnéticas funcionales para proporcionar información cuantitativa sobre el microambiente tumoral química (TME), incluyendo p O2, pH, estado redox, concentraciones de fosfato inorgánico intersticial (Pi) e intracelulares del glutatión (GSH). En particular, una aplicación de una sonda de trityl multifuncional soluble recientemente desarrollado proporciona oportunidad sin igual para en vivo mediciones simultáneas de pH, pO2 y Pen E xtracellular espacio (sonda de esperanza). Las mediciones de tres parámetros con una sola sonda permiten sus análisis de la correlación independientes de distribución de la sonda y el tiempo de las mediciones.
Introducción
Un papel clave de lo TME en la progresión del cáncer y terapia es cada vez más apreciado1. Entre los parámetros fisiológicos importantes de TME en tumores sólidos tejidos hipoxia2, acidosis3,4, reducción alta capacidad5, concentraciones elevadas de GSH intracelular6,7, e intersticial Pi8 están bien documentados. No invasiva in vivo pO2, pH, Pi, GSH y redox evaluaciones proporcionan perspectivas únicas en los procesos biológicos en TME y ayudar a avance de herramientas para la detección preclínica de fármacos contra el cáncer y estrategias terapéuticas dirigidas de TME. Una profundidad de penetración razonable por radiofrecuencia en los tejidos por la proyección de imagen de resonancia magnética (MRI) y las técnicas basadas en la EPR bajo campo hace que los enfoques más apropiados para la evaluación no invasiva de estos parámetros TME. MRI se basa en gran medida en la proyección de imagen de los protones de agua y es ampliamente utilizado en contextos clínicos para proporcionar resolución anatómica pero carece de resolución funcional. Las mediciones de resonancia magnética fósforo-31 (31P-NMR) de extracelular concentración de Pi y de pH basado en una señal de fosfato endógeno son potencialmente atractivas para la caracterización de TME, pero normalmente son enmascaradas por varias veces mayor intracelular Pi concentraciones9,10. En contraste con esto, las medidas del EPR dependen de espectroscopia y proyección de imagen especialmente diseñado sondas paramagnéticas para proporcionar resolución funcional. Nota que exógeno EPR sondas tienen una ventaja sobre exógeno NMR sondas debido a la mucha mayor sensibilidad intrínseca de EPR y la ausencia de señales EPR fondo endógeno. El reciente desarrollo de una función dual pH y redox nitroxyl sonda11 y multifuncional trityl sonda12 ofrece oportunidades sin igual para en vivo mediciones simultáneas de varios parámetros TME y sus Análisis de correlación independientes en la distribución de la sonda y el tiempo de medición. A nuestro conocimiento, no existen otros métodos disponibles para evaluar simultáneamente en vivo parámetros TME químicos fisiológico importantes en temas de la vida, como pO2, pHe, Pi, redox y GSH.
Sondas para En Vivo Funcionales medidas:
La figura 1 muestra las estructuras químicas de las sondas paramagnéticas utilizadas para acceder a los parámetros TME, que incluyen sondas solubles y particuladas. Alta sensibilidad funcional, estabilidad en tejido vivo y mínima toxicidad son algunos de los beneficios que hacen sondeos partículas preferidos sobre sondas soluble para oximetría de EPR en vivo . Por ejemplo, sondas de partículas aumentaron tiempos de retención en el sitio de implante de tejido comparado con sondas soluble, lo que permite la medición longitudinal de tejido pO2 durante varias semanas. Por el contrario, solubles sondas superan sondas partículas proporcionando mediciones espacial resuelto mediante EPR-técnicas de imagen así como permitiendo análisis concomitantes de múltiples funcionalidades (pO2, pH, Pi, redox, y GSH).

Figura 1. Estructuras químicas de las sondas paramagnéticas que ensayo de evaluación de TME. Esto incluye la punta de prueba de partículas pO2 , LiNc-BuO (R = - O (CH2)3CH3) y solubles sondas: sonda de pH y redox de doble función, NR; GSH-sensible a la sonda, RSSR; y múltiples funciones pO2, pH y sonda de Pi del microambiente extracelular, la sonda de esperanza. La síntesis de estas sondas se ha descrito en las referencias proporcionado 11,12. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Todos los trabajos de animales se realizan según protocolo WVU IACUC aprobado.
1. síntesis y calibración de la sonda
- Partículas pO2-sonda sensible de LiNc-BuO
Nota: LiNc-BuO microcristales se sintetizan y preparados como se describe en la referencia13. Son muy estables y pueden conservarse a temperatura ambiente durante años. El EPR linewidth de la sonda partículas LiNc-BuO es una pO2-parámetro sensible. LiNc-BuO microcristales demuestran ideal dependencia linear de la grosor de línea en la concentración de oxígeno en la gama de las condiciones anóxicas hasta 760 mm Hg de pO2 presión parcial13, con los valores de linewidth intrínseca en ausencia de oxígeno y la pendiente de la dependencia oxígeno (medida en mG/mmHg) ligeramente diferentes para los diferentes lotes del preparado microcristalino. Por lo tanto, la calibración es necesaria para cada lote particular.- Pesar 60 mg de microcristales de LiNc-BuO.
- Para la calibración de la sensibilidad del oxígeno, suspender microcristales en 3 mL de medio de Dulbecco modificado Eagle Media (DMEM) (en una concentración de 20 mg/mL) y someter a ultrasonidos durante 5 minutos en hielo con un sonicador sonda a 20 kHz con 7 W de potencia en un tubo de fondo redondo de vidrio de 5 mL.
- Colocar 1 mL de la sonicación microcristales en un vaso de tubo en el resonador de la bobina de superficie del espectrómetro EPR de banda L (1,2 GHz) y adquirir espectros EPR de ondas continuas (CW) a la temperatura fisiológica de 37 ° C y oxígeno concentraciones de 0, 1, 2, 4, 8 y el 20,9%. Mantener la concentración de oxígeno mediante el burbujeo de la solución con mezcla de gas de un regulador de gas y mantener la temperatura con un baño de agua conectado a un termostato. Utilice los siguientes parámetros de adquisición de espectrómetro EPR: modulación de la amplitud, 100 mG; modulación de frecuencia, 100 kHz; anchura del barrido, 5 G; barrido de tiempo, 60 s.
- Para lograr una mejor relación señal a ruido (SNR), utilice un valor de amplitud de modulación del 60% del grosor de la línea (por ejemplo, utilizar una amplitud de modulación G 0,6 para el grosor de línea de 1 G).
- Alternativa simplificado el procedimiento de calibración: registrar los espectros EPR en soluciones de burbujas de aire y anóxico14. En este último caso, mantener la anoxia en las muestras mediante la adición de glucosa 10 mM y 100 U/mL glucosa oxidasa a soluciones de punta de prueba de 1 mL según referencia14.
- Ajuste de los espectros EPR con la función diferencial para encontrar el ancho de línea, LW. Evaluar la sensibilidad de microcristales a pO2 como una vertiente de la dependencia de LW pO2, es decir, como un valor de (LWaire−LWanoxia) /pO2air, donde LWaire y LWanoxia son espectros de grosor de línea en condiciones de aire y anoxia, respectivamente; p O2air = 152 mmHg.
- Sonda de pH y redox de doble función, NR
Nota: La sonda NR se sintetiza como se describe en la referencia11. Es estable a temperatura ambiente como un sólido y en disoluciones acuosas. La sonda NR sintetizada se mantiene a 4 ° C. La división hiperfina de nitrógeno,Ny la tasa de decaimiento de amplitud de señal son los parámetros espectrales de la sonda NR que son sensibles al pH (sonda pKa = 6.6 a 37 ° C, rango de sensibilidad del pH de 5.6 a 7.6) y a la capacidad reductora de la sonda microentorno, respectivamente.- Retirar el NR del congelador y dejar el recipiente a temperatura ambiente (10-15 min). Pesar 6,34 mg del NR, disolverlos en 1 mL de solución salina y ajustar el pH a 7.2 con pequeñas alícuotas de HCl o NaOH utilizando un medidor de pH. Usar la solución preparada de NR (10 mM) como una solución de reserva.
- Realizar la calibración de pH de la sonda NR como sigue (ver referencia11). En primer lugar, Añadir 0,1 mL de la solución madre de NR a 0,9 mL de tampón fosfato Na de 2 mM, 150 mM NaCl. Valorar la solución obtenida 1 mM NR con alícuotas de HCl o NaOH el pH requerido utilizando un medidor de pH. Control de la temperatura usando un baño de agua conectado a un termostato.
- Registrar los espectros EPR de las muestras en tubos de microcentrífuga de 1,5 mL utilizando el espectrómetro EPR de banda L. Utilice los siguientes parámetros de adquisición de espectrómetro EPR: modulación de la amplitud, 2,5 G; modulación de frecuencia, 100 kHz; anchura del barrido, 60 G; barrido de tiempo, 20 s.
- Medir la hiperfina separación constante (N) como la mitad de la distancia entre los componentes de bajo y alto campo de los espectros EPR y parcela versus pH, para proporcionar la curva de calibración para mediciones de banda L EPR de pH.
- Sonda RSSR GSH-sensible
Nota: La sonda RSSR se sintetiza como se describe en la referencia15. Almacene la sonda sintetizada de NR a 4 ° C. El lipofílico compuestos RSSR disulfuro biradical difunde fácilmente a través de la membrana de la célula para reaccionar con GSH intracelular y proporcionan un método confiable para la determinación de GSH en vivo usando EPR16,17. Este método se basa en las tarifas de alta reacción de la piscina intracelular predominante de tioles GSH con la sonda RSSR. La reacción de la biradical RSSR con divisiones GSH su disulfuro de bonos (véase esquema 1) resultando en la cancelación del intercambio de vuelta entre los dos fragmentos radical y que se manifiesta en una disminución de los componentes espectrales biradical y correspondiente el aumento de los componentes de monoradical. Para la sonda RSSR biradical, la tasa de aumento de la amplitud de la componente de monoradical es proporcional a la concentración de GSH y es un parámetro espectral conveniente de EPR GSH-sensible. Para evaluar la concentración de GSH de las mediciones de EPR en vivo , la calibración anterior del índice de la reacción de RSSR con GSH en la temperatura y el pH correspondiente deberá llevarse a cabo como sigue.- Retirar el RSSR del congelador y dejar el recipiente a temperatura ambiente (10-15 min). Pesar 4,05 mg del NR y disuelva en 1 mL de solución de DMSO. Usar la solución preparada de RSSR (10 mM) como una solución.
- Determinar el valor de la tasa constante, kobs, la reacción de RSSR con GSH a la temperatura deseable y pH como sigue.
- En primer lugar, añadir 20 μl de la solución madre de RSSR (10 mM) a 0,98 mL de tampón fosfato Na de 1 mM, pH 7.2, 150 mM NaCl, para obtener un 0,2 mM RSSR sonda solución.
- Preparar soluciones de concentraciones 1, 2 y 5 mM de GSH en 0.1 M tampón de Na-fosfato a pH 7.2. Para evaluar con precisión la concentración de GSH en las células del órgano objetivo de las mediciones en vivo , la calibración en vitro deberá llevarse a cabo a un pH cercano al valor del pH intracelular.
- Mezclar volúmenes iguales de solución RSSR de 0,2 mM y una de las soluciones GSH en paso 1.3.4. para una concentración final de la sonda a 0,1 mM y de GSH en 0,5, 1 o 2, 5 mM.
- Inmediatamente después de RSSR y GSH solución mezcla, coloque la muestra en el resonador EPR y registrar los espectros EPR cada 12 segundos durante 10 minutos. Luego calcular la cinética del aumento de la amplitud espectral monoradical. Utilice los siguientes parámetros de adquisición de espectrómetro EPR: modulación de la amplitud, 1 G; modulación de frecuencia, 100 kHz; anchura del barrido, 60 G; tiempo de barrido, s de 10-60.
- Ajuste la medida cinética EPR para la monoexponents y calcular la constante de tiempo de la cinética exponencial, τ. La regresión lineal (1/τ = kobs × [GSH]) proporciona el valor constante de la tasa observada de la reacción entre el GSH y RSSR (p. ej., a 34 ° C y pH 7.2, kobs = 2.8 ± 0.2 M-1s-1)11.
- Sonda de esperanza multifuncional para pO2, pH y la evaluación de Pi
Nota: Del trityl monophosphonated esperanza sonda se sintetiza como se describe en referencia a12 y se mantiene a 4 ° C. Los espectros de EPR de CW de la esperanza en pH << pKa (A - forma ácida) y pH >> pKa (B - forma básica) están representados por los dobletes por fósforo hiperfina partir, unP. Las opciones típicas son las siguientes: amplitud de modulación, 37,5 mG; modulación de frecuencia, 100 kHz; anchura del barrido, 0,9 G; tiempo de barrido, s 20-60. A pH intermedio (5 < pH < 8) el espectro EPR de sonda de esperanza se caracteriza por un cuarteto cuando dos A y B Estados están presentes. El linewidth EPR individual de la esperanza es un marcador de2 pO (exactitud, ≈ 1 mmHg; p O2 gama, 1-100 mmHg). La fracción de protonada esperanza (forma) es un marcador de pH en el rango de 6 a 8.0 (precisión, ± 0.05). El valor de la tasa de intercambio de protones (expresada en mG) con Pi obtenido por simulación de espectros es un marcador de Pi (precisión, ± 0,1 mM, rango de 0.1-20 mM). Procedimientos de calibración se realizan a temperatura fisiológica (37 º C), fuerza iónica de la solución (NaCl 150 mM) y concentración de sonda esperanza de 0,2 mM, como descrito en las referencias12,18y detallan a continuación.- Retire la sonda esperanza del congelador y deje el recipiente a temperatura ambiente (10-15 min).
- Pesar 10,7 mg de la sonda de esperanza, disolver en 1 mL de solución salina y ajustar el pH a 7.4. Añadir 20 μl de la solución preparada de la esperanza (10 mM) a 0,98 mL de la solución salina para obtener una esperanza de 0,2 mM sonda solución.
- Para la calibración de la sonda de pH, valorar 0.2 mM de la solución de sonda de esperanza por la adición de un pequeño volumen de NaOH o HCl, con la dilución final de la muestra menos del 1%. Medir el pH con un electrodo de pH calibrado a 37 ° C utilizando los valores de pH para la solución de referencia recomendada por la Oficina Nacional de estándares (EEUU). Utilizar un vaso de reacción con aislante unido a una bomba de circulación cuidadosamente mantener temperatura de la referencia y soluciones valoradas durante las mediciones de pH. Mantener las condiciones anóxicas por la adición de glucosa 10 mM y 100 U/mL glucosa oxidasa a las soluciones de la sonda.
- Adquisición de los espectros EPR de las formas A y B pH ≤ 5 y pH ≥ 8, respectivamente, en condiciones anóxicas en ausencia de fosfato.
- Utilizar los espectros correspondientes para obtener parámetros espectrales intrínsecos. Es decir, simular la línea espectral como la convolución de la función de Lorentz con la función Gaussiana que se aproxima a la pendiente estructura hiperfina super de la sonda de esperanza. El montaje de los espectros EPR calculados a los espectros experimentales da los valores deP y grosor de línea diferencial (ΔLpp), determinados por la tasa de relajación transversal, 1/T2 (donde 1/T2 = (√3/2) Lpp para el medida derivado de la línea de absorción de RF en CW EPR) y el grosor de línea de distribución gaussiana, G.
Nota: Los siguientes son los parámetros obtenidos de los espectros medidos en las condiciones especificadas en el paso 1.4.2:P(A) = 3,63 G,P(B) = 3,37 G; 1/T2(A) = 23,6 mG; (B) 1/T2= 9 mG; G = 40 mG; G(B) = 45 mG (ver referencia8). - Adquisición de los espectros EPR de la esperanza a pH intermedio (5 < pH < 8). Simular el componente presentó alta de los espectros EPR adquiridos utilizando la teoría de intercambio entre varios sitios en sistemas flojamente acoplados o no acoplados, adaptados de la referencia19 como se describió anteriormente18. Los parámetros intrínsecos obtenidos para un uso y B (ver paso 1.4.5) para disminuir el número de variables. Ajuste los espectros calculados para los experimentales para encontrar los valores de la fracción un (pA) y marca la dependencia deun valor de p pH. Utiliza la dependencia de pA pH en otros estudios como una curva de calibración de pH.
Nota: Montaje de la dependencia de pH del pA con una curva de titulación estándar proporciona el valor de la disociación constante, pKun (esperanza) = 6,98. En estudios en vivo , adquiriendo el completos espectros EPR de la sonda de esperanza es impráctico por el tiempo adicional necesario para adquirir la brecha entre los componentes de bajo y alto campo de la hiperfina de fósforo partir en el espectro EPR. Por lo tanto, en estudios posteriores ejemplo solamente el componente presentó alta del espectro EPR ha sido medido y analizado. - Para la calibración de la sonda de la pO2, adquirir espectros EPR de la sonda de esperanza a diferentes concentraciones de oxígeno.
- Valores de control pO2 de las soluciones de burbujeo con mezcla de gas entregan de un regulador de gas. Control de la temperatura de la solución (37 ° C) usando un baño de agua conectado a un termostato.
- Simular los espectros EPR y ajustarlas a los experimentales como se describe en el paso 1.4.6 para determinar los valores de las tasas de la relajación inducida por el oxígeno.
Nota: Los valores de las tasas de la relajación inducida por el oxígeno fueron 0.49 mG/mmHg tanto para la A y formas de B de la esperanza de la sonda ya medido a 37 ° C8. - Para la calibración de la sonda de [Pi], adquirir espectros EPR de la sonda de esperanza a diferentes concentraciones de fosfato. Utilice la solución radical de esperanza con un valor de pH cerca de pKa (pKa = 6.9 a 37 ° C)18 y valorar con diferentes concentraciones de fosfato. Mantener la composición del gas y la temperatura como se describe en pasos anteriores.
- Simular los espectros EPR y ajustarlas a los experimentales, como se describe en el paso 1.4.6 para determinar los valores Pi-inducida del tipo de cambio.
Nota: La dependencia de la tasa de cambio inducido por la Pi [Pi] se utiliza como calibración en estudios posteriores.
2. ratón modelos de cáncer de mama
- Modelo de MMTV-pago espontánea del tumor
- Uso de 4 a 8 semanas-vieja hembra amigo virus tipo B susceptibilidad/NIH (FVB/N) ratón tumor mamario virus promotor (MMTV) polyoma middle-T antígeno (pago +) ratones con tumores mamarios espontáneamente formados en vivo estudios de EPR.
- Para la comparación de microambientes de tejido de las glándulas mamarias normales y tumores, utilizar hembras de edad comparable littermate deficientes en el oncogén (PyMT−, "tipo salvaje") de pago20.
- Someter a los ratones a espectroscopia EPR banda L una vez por semana durante cuatro semanas durante la anestesia isoflurano (véase punta de prueba de entrega a continuación).
- Anestesiar el ratón utilizando una mezcla de aire-isoflurano (3% isoflurano) y coloque el ratón sobre una mesa ajustable en una posición lateral derecha con el tumor (glándulas mamarias) cerca el resonador de la bobina de superficie.
- Después de la colocación del ratón, administrar la sonda de inyección intratissual (i.t.), sintonizar el espectrómetro EPR y adquirir los espectros EPR de 5-10 minutos.
- Medir 2-3 tumores mamarios (de MMTV-pago + ratones) o no tumor glándulas mamarias (de los ratones PyMT−) durante el mismo período de sesiones EPR.
- Modelo de tumor orthotopic MET-1
- Cultivar células de cáncer de mama murino FVB/N fondo Met-1 a 37 ° C, 5% CO2y humedad relativa de 95% en DMEM con 10% suero bovino fetal (FBS), 10 μg/mL insulina, rhEGF 5 ng/mL y 1% PSA (penicilina G sodio, sulfato de estreptomicina y anfotericina B) a ~ confluencia de 80% en un matraz T175.
- Los medios de comunicación de aspirar y lavar las células adherentes con 10 mL de PBS (1,54 mM KH2PO4, 155 mM NaCl y 2,71 mM Na2HPO4-7 H2O sin cloruro de calcio o cloruro de magnesio, pH = 7,4).
- Separar las células, agregar 5 mL de solución al 0.25% tripsina-EDTA y mecer el frasco. Cuando las células son separadas, añadir 10 mL DMEM con 10% FBS al matraz y recoger las células.
- Centrifugue la suspensión de células a 132 x g por 10 min a 4 ° C. Contar las células usando un hemocitómetro y suspender a 1 x 106 células por 100 μl DMEM mínimo.
- Utilizando una jeringa de insulina (aguja de 29 1/2), lentamente inyecte 100 μl de suspensión de células de tumor en las almohadillas de grasa mamaria número 4 de los ratones de tipo salvaje FVB/N hembra 8 semanas de edad.
- Supervisar la iniciación del tumor mediante palpación (aparece después de aproximadamente 2-3 semanas), crecimiento (visual) y brezo de ratón (visual) cada dos días.
- Medir las dimensiones del tumor una vez por semana utilizando pinzas y determinar volúmenes de tumor usando la ecuación:
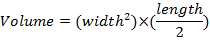
3. punta de prueba de entrega para las medidas In Vivo funcional
- Sonda de LiNc-BuO partículas de uso (Protocolo I) para mediciones de pO2 en modelos de tumores ortotópicos por implantación de células tumorales con LiNc-BuO internalizada microcristales anteriormente descrito14,21 y detallan a continuación.
- En el caso del modelo de MET-1 tumor, para internalización de microcristales de LiNc-BuO en MET-1 células, suspender el LiNc-BuO microcristales en DMEM a una concentración de 20 mg/mL y someter a ultrasonidos con un sonicador sonda a 20 kHz con 7 W de potencia en un tubo de fondo redondo de vidrio de 5 mL durante 5 minutos en hielo.
- Añada 100 μl (2 mg de LiNc-BuO) de la suspensión a un matraz T75 con medios de cultivo de 10 mL que contiene células de MET-1 (aproximadamente 30% confluente). Todos los procedimientos en un gabinete de seguridad de la biotecnología y los medios de comunicación contiene penicilina y estreptomicina para minimizar la potencial infección.
- Incube las células a 37 ° C por 72 h o hasta llegar a ~ 80% de confluencia.
- Aspire los medios de comunicación. Lavar las células cinco veces con 10 mL de PBS. Separar las células con 5 mL de tripsina-EDTA. Recoger las células. Centrifugar como se describió anteriormente en el paso 2.2.4. Una muestra de células con el colorante de exclusión para determinar la cantidad y viabilidad de las células de la mancha.
- Suspender las células a una concentración de 1 x 106 por 100 μl DMEM mínimo.
- Utilizando una jeringa de insulina, inyecte lentamente 100 μl de suspensión celular con los microcristales de LiNc-BuO internalizada en las almohadillas de grasa mamaria número 4 de ratones de tipo salvaje FVB/N hembra de 8 semanas de edad como se describe en el paso 2.2.5.
- Supervisar la iniciación del tumor y crecimiento como se describe en los pasos 2.2.6 y 2.2.7.
- Uso partículas LiNc-BuO punta de prueba (Protocolo II) ya sea espontánea o modelos ortotópicos. Inyecte LiNc-OBu microcristales en el sitio de interés, por ejemplo, en las glándulas mamarias normales o tumores mamarios, usando una jeringa de insulina.
- Puntas de prueba de solubilidad
- Anestesiar los ratones por la inhalación de una mezcla de aire-isoflurano (entrega de 1.0 L/min y 2-3% de isoflurano) usando una anestesia de la máquina y colóquelos en la ranura de la espectrómetro EPR.
- Afinar el instrumento, a continuación, inyectar la NR (10-30 μL, 10 mM), sonda de esperanza (10−30 μL, 0.5-2 mM) en solución salina, pH 7.2 o sonda RSSR en soluciones de DMSO (10 μl, 10 m m) (informática).
4. en Vivo las mediciones funcionales
- Para las mediciones espectroscópicas de EPR, anestesiar los ratones por la inhalación de aire-isoflurano mezcla usando una máquina de anestesia como se describe en el paso 3.3.1.
- Realizar mediciones funcionales usando espectrómetro EPR de banda L (1,2 GHz) como sigue.
- Coloque el resonador de la bobina de superficie en una glándula mamaria normal o un tumor mamario y sintonizar el espectrómetro.
- Adquisición de los espectros EPR de la sonda partículas implantada por 5−10 min durante varias semanas después de la implantación. En el caso de sondas soluble, adquirir los espectros EPR inmediatamente después de la inyección de la sonda durante 5-10 minutos.
- Analizar los espectros EPR de la sonda NR para encontrar la hiperfina partir, unaNy la amplitud de la señal, I(t). Convertir el valor deN en el valor de pH usando la curva de calibración obtenida en el paso 1.2.4. Analizar la tasa de decaimiento de la amplitud de la señal I(t) como cambio relativo de la amplitud inicial, I(t = 0), calculado en unidades arbitrarias por segundo (s-1).
- Ajuste el incremento del componente monoradical del espectro EPR de sonda RSSR GSH-sensible a la monoexponents para obtener la constante de tiempo de la cinética exponencial para el cálculo de la concentración de GSH.
- Ajuste de los espectros EPR de componente de alto campo de la sonda multifuncional de esperanza a los experimentales tal como se describe en el (paso 1.4.5) para obtener los valores de pH, pO2 y Pi.
5. estadístico análisis
- Realizar análisis estadísticos y procesamiento de datos. Utilice la prueba de correlación r de Pearson (para conjuntos de datos normalmente distribuidos) y correlación de orden de rango de Spearman (para conjuntos de datos con normalidad rechazada de la distribución de los datos) para los análisis de correlación.
Resultados
Tejido p O 2 Puntas de prueba de evaluación utilizando el LiNc-BuO:
Utilizando el procedimiento descrito en el paso 1.1, se realizó la calibración de la suspensión de microcristales de LiNc-BuO recién preparada. La figura 2 muestra la dependencia de oxígeno típica del grosor de la línea d...
Discusión
Los métodos presentados permiten para la evaluación no invasiva en vivo de los parámetros críticos de la TME química, es decir pO2, pH, estado redox y concentraciones de GSH intracelular y Pi intersticial. Técnicas de resonancia magnética, MRI como EPR bajo campo, son los métodos de elección para no invasiva en vivo perfiles de estos parámetros TME. MRI visualiza estructuras anatómicas pero carece de sensibilidad funcional. En contraste con RMN, EPR técnicas proporcionan ...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue parcialmente financiado por los NIH concede CA194013, CA192064 y U54GM104942. El WVCTSI es reconocido para la puesta en marcha para VVK, AB y TDE. Los autores agradecen la ayuda con los experimentos ilustrativos Dr. M. Gencheva y K. Steinberger. El contenido es responsabilidad exclusiva de los autores y no representan necesariamente la opinión oficial de los NIH.
Materiales
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Referencias
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados