このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
生体内でPH、 pO2、酸化還元状態とリン酸濃度および腫瘍微小環境におけるグルタチオンの EPR 評価
要約
乳がんのマウス ・ モデルにおける腫瘍微小環境における重要な生理学的パラメーターの評価のため水溶性次亜硝酸、トリチル プローブを用いた低磁場 (L バンド、1.2 GHz) 電子常磁性共鳴を示した。
要約
このプロトコルは、低磁場電子スピン共鳴 (EPR) の機能を示します-化学がん微小環境 (TME) の定量的な情報を提供するために機能の常磁性プローブとの組み合わせで技術をベースを含むpO2pH、酸化還元状態、間質性無機リン酸 (Pi) および細胞内グルタチオン (GSH) の濃度。特に、最近開発された水溶性多機能トリチル プローブのアプリケーションを提供比類のない機会を生体内での pH pO2 P同時測定Eでxtracellular スペース (希望プローブ)。プローブの分布と測定の時間の独立した相関分析の単一のプローブを使用して 3 つのパラメーターの測定を許可します。
概要
がんの進行と治療における TME の重要な役割はますます高く評価1です。固形腫瘍、組織低酸素症2アシドーシス3,4、高還元能力5高濃度の細胞内 GSH6、7TME の重要な生理学的パラメーターの間で間質性 Pi8はよく記載されています。非侵襲体内 pO2pH、Pi、GSH、レドックス評価は TME、生物学的過程のユニークな洞察を提供し、抗がん剤と TME をターゲットとした治療戦略の前臨床スクリーニングのための事前のツールを助けます。磁気共鳴画像 (MRI) や低磁場 EPR ベース テクニックによる組織の合理的な高周波溶込み深さはこれらの TME パラメーターの非侵襲的評価への最も適切なアプローチとなります。MRI 画像水プロトンに頼ってと解剖学的解像度を提供するために臨床の現場で広く、機能解像度を欠いています。細胞外の Pi 濃度と内因性リン酸からの信号に基づいて pH のリン 31 磁気共鳴 (31P NMR) 測定は TME 特性評価の可能性がある魅力的なが、通常数回によってマスクされ高い細胞内 Pi 濃度9,10。対照をなして、EPR 測定分光法に依存し、常磁性プローブ機能解像度を提供するために設計された特別のイメージングします。外因性の EPR プローブは外因性優位 NMR プローブ EPR の多くの高い固有の感度と内因性背景 EPR 信号の不在のため。11プローブのデュアル機能 pH および酸化還元 nitroxyl の最近の開発と、多機能トリチル プローブ12 TME のいくつかのパラメーターの同時測定体内の比類のない機会を提供します、相関解析プローブ分布と測定の時間に依存しません。私たちの知る限り、体内 pO2pHePi、還元グルタチオンなど、被験者の生活で生理学的に重要な化学 TME パラメーターを同時に評価するために使用できる他の方法がないです。
用プローブ生体内で機能の測定:
常磁性プローブ粒子および溶性プローブ TME のパラメーターにアクセスするために使用の化学構造を図 1に示します。高感度機能、安定性、生体組織と最小限の毒性は、EPR パルスオキシメータ体内の水溶性プローブ優先粒子状のプローブを作るいくつかの利点です。たとえば、粒子プローブでは、数週間にわたって組織pO2の縦断的測定を可能にする可溶性のプローブと比較して組織インプラントのサイトで保持時間を増加しています。その一方で、可溶性プローブ EPR ベース イメージングできるよう複数の機能から併用解析を用いた空間分解測定を提供することにより粒子状のプローブをアウトパ フォームする (pO2pH、Pi、酸化還元とGSH)。

図 1。TME 評価分析を組み立てる常磁性プローブの化学構造。粒子pO2プローブ、LiNc BuO 含まれます (R = O (2CH) の3CH3)、および可溶性プローブ: デュアル機能 pH および酸化還元プローブ、NR;グルタチオン (gsh) 敏感なプローブ、RSSR;多機能pO2, pH, および細胞外微小環境、希望プローブ.の Pi プローブこれらのプローブの合成は、提供された参照11,12に記載されています。この図の拡大版を表示するのにはここをクリックしてください。
プロトコル
WVU IACUC 承認プロトコルに従ってすべての動物の仕事を行った。
1. プローブの合成と校正
- 粒子pO2-敏感な LiNc BuO プローブ
注:LiNc BuO 微結晶を合成して、参照13で説明されています。彼らは非常に安定して、年室温で保管することができます。LiNc BuO 粒子プローブの EPR 線幅はpO2-機密性の高いパラメーター。LiNc BuO 微結晶はpO2分圧13、不在で本質的な線幅の値 760 mmHg まで無酸素状態から酸素濃度範囲に線幅の理想的な線形依存性を示す酸素・酸素依存性 (単位 mG/mmHg) 若干スロープの微調製の異なるバッチの変化。したがって、校正は、特定のバッチごとに必要です。- LiNc BuO 微結晶の 60 mg の重量を量る。
- 酸素感度校正用 3 ml ダルベッコ変更イーグル メディア (DMEM) 中 (20 mg/mL の濃度) の微結晶を中断し、5 mL ガラス丸底チューブで 7 W の電力を使用して 20 の kHz でプローブ超音波発生装置で氷の上 5 分の超音波。
- ガラスの超音波破砕した微結晶の場所 1 mL L バンド (1.2 GHz) EPR 分光計の表面コイルの共振器のチューブし、0、1、2、4、8 の 37 ° C と酸素濃度の生理学的温連続波 (CW) EPR スペクトルを取得、と 20.9%。ガス混合ガスのコント ローラーから配信ソリューションをバブリングによって酸素濃度を維持し、サーモスタットに接続されている水浴を使用して温度を維持します。次の EPR 分光器集録パラメーターを使用: 変調振幅、100 mG。100 kHz の変調周波数スイープ幅、5 G;掃引時間、60 s。
- 良い信号対雑音比 (sn 比) を達成するために、線の幅の 60% の変調振幅値を使用 (例えば、変調振幅 0.6 G を使用して、1 G の線幅のため)。
- 代替校正手順を簡素化: 空気バブル、無酸素ソリューション14の EPR スペクトルを記録。後者の場合、10 mM グルコースと参照14によると 1 mL プローブに 100 U/mL のブドウ糖酸化酵素の添加によるサンプルで無酸素状態を維持します。
- 線幅、LW を検索するローレンツ関数を用いた EPR スペクトルに合います。PO2LW の (LW空気−LW無酸素) の値としてすなわち依存性斜面としてpO2微結晶の感度を評価/pO2air、どこ LW空気LW無酸素空気と無酸素条件でスペクトル線幅はそれぞれ;pO2air = 152 mmHg。
- デュアル機能の pH および酸化還元のプローブ、NR
注:NR プローブは、参照11で説明するように合成されています。固体および水溶液中で室温で安定しています。合成の NR プローブは 4 ° C に保たれて窒素の超微細分裂、N、および信号振幅の減衰率は、pH に敏感な NR プローブのスペクトルパラ メーター (pK、プローブ = 6.6 7.6 5.6 から pH 感受性の範囲、37 ° C で) およびプローブの還元能力に微小環境、それぞれ。- 冷凍庫から NR を削除でき、常温 (10-15 分) にするコンテナー。NR の 6.34 mg を量り、食塩液 1 mL に溶解し、塩酸または水酸化ナトリウム pH メーターを使用しての小さい因数で 7.2 pH を調整します。保存溶液として調製した NR 溶液 (10 mM) を使用します。
- (参照11参照) NR プローブの pH 校正をとおり実行します。まず、2 mM Na リン酸バッファー、150 mM の NaCl の 0.9 mL に NR の原液を 0.1 mL を追加します。塩酸または水酸化ナトリウムの pH メーターを使用して必要な ph の因数で得られた 1 ミリメートル NR のソリューションを滴定しなさい。サーモスタットに接続されている水浴を使用して温度を制御します。
- L-band EPR 分光器を用いた 1.5 mL 遠心チューブにサンプルの EPR スペクトルを記録します。次の EPR 分光器集録パラメーターを使用: 変調振幅、2.5 G;100 kHz の変調周波数スイープ幅、60 G掃引時間、20 s。
- EPR スペクトルの低と高フィールド コンポーネント間の距離の半分として超微細分裂定数 (N) を測定し、pH の L バンド EPR 測定の校正曲線を提供する pH とプロットします。
- グルタチオン (gsh) 敏感な RSSR プローブ
注:RSSR プローブは、参照15で説明したように合成されています。4 ° C で合成 NR プローブを格納します。脂溶性 RSSR 二硫化ビラジカル化合物が細胞膜と細胞内 GSH 反応グルタチオン (gsh)生体内でEPR16,17を使用して決定するため信頼性の高い方法を提供するの間で拡散しやすい。このメソッドは、RSSR プローブを用いたグルタチオン (gsh) のチオール基の優勢な細胞内プールの高反応速度に基づいています。グルタチオン (gsh) 分割、ジスルフィド結合 (方式 1参照) RSSR ビラジカルの反応 2 つの根本的なフラグメントとけんしょうビラジカルのスペクトル成分の減少と対応するスピン交換のキャンセルの結果monoradical コンポーネントの増加。ビラジカル RSSR プローブ用の monoradical 成分の振幅増加率は GSH 濃度に比例して、便利なグルタチオン (gsh) 敏感な EPR スペクトル パラメーター。生体内でEPR 測定から GSH 濃度を評価するには、と対応する温度と pH で GSH RSSR 反応の速度の上記の校正は次のように実行します。- 冷凍庫から、RSSR を外し、常温 (10-15 分) にコンテナーを許可します。NR の 4.05 mg を量り、DMSO 溶液 1 mL に溶かします。保存溶液として調製した RSSR 溶液 (10 mM) を使用します。
- とおり、速度定数、kobsと望ましい温度と pH で GSH RSSR の反応の値を確認します。
- まず、0.98 mL の 1 mM Na リン酸バッファーに RSSR 原液 (10 mM) の 20 μ L を追加、pH 7.2, 150 mM の NaCl、0.2 mM RSSR を取得するプローブ ・ ソリューション。
- 0.1 M リン酸 Na pH 7.2 buffer 内グルタチオン (gsh) の 1、2、および 5 mM の濃度の溶液を準備します。体内測定から標的器官の細胞内 GSH 濃度を正確に評価するため生体外で校正が細胞内の ph 値に近い pH で実行します。
- 0.2 mM RSSR ソリューション、1.3.4 の手順で準備するグルタチオン (gsh) ソリューションの 1 つの平等なボリュームをミックスします。0.5、1、または 2.5 mM で最終濃度 0.1 mm プローブ ・ グルタチオン (gsh)。
- 混合 RSSR とグルタチオン (gsh) のソリューション後すぐにサンプル EPR 共振器にし 10 分 12 秒ごと EPR スペクトルを記録します。Monoradical スペクトルの振幅の増加の速度を計算します。次の EPR 分光器集録パラメーターを使用: 変調振幅、1 G;100 kHz の変調周波数スイープ幅、60 Gスイープ時間、10-60 秒。
- Monoexponents に測定された EPR 動態をフィットし、指数関数的速度論、τ の時定数を計算します。線形回帰 (1/τ = kobs × [GSH]) グルタチオン (gsh) と RSSR 反応の観測率の定数値を提供します (例えば、34 ° C で pH 7.2 kobs = 2.8 ± 0.2 M-1の-1)11。
- PO2, pH, および Pi 評価用多機能希望プローブ
注:説明したように希望プローブを合成 monophosphonated トリチル12を参照され 4 ° C でPH << pKを(-酸フォーム) と pH >> pKは(B - 基本的なフォーム) で希望の CW EPR スペクトルは、分割、Pリン超微細のためダブレットで表されます。典型的な器械の設定は次のとおりです: 変調振幅、37.5 mG;100 kHz の変調周波数スイープ幅、0.9 G;スイープ時間、20-60 秒。中間 ph (5 < pH < 8) 希望プローブの EPR スペクトルはカルテットによって特徴付けられるとき両方の A と B の状態が存在。希望の個々 の EPR の線幅はpO2マーカー (精度、≈ 1 mmHg;pO2の範囲、1-100 mmHg)。プロトン化希望 (フォーム) の割合は、6 から 8.0 (精度、± 0.05) の範囲で pH マーカーです。スペクトルのシミュレーションによって抽出された Pi とのプロトン為替レート (mG 単位) の値は、Pi マーカー (精度、± 0.1 mM、0.1 〜 20 ミリメートルの範囲) です。校正は生理的温度 (37 ° C)、ソリューション イオン強度 (NaCl、150 mM)、および希望プローブ濃度 0.2 mM、参照12,18で記述されているし、下記のように実行されます。- 冷凍庫から希望プローブを削除でき、常温 (10-15 分) にするコンテナー。
- 10.7 mg 希望プローブの重量を量り、食塩液 1 mL に溶かして、pH 7.4 に調整。追加 20 μ L 0.2 mM 希望を取得する 0.98 mL の生理食塩水の溶液に希望 (10 mM) の準備の原液のプローブ ソリューション。
- PH のプローブ校正、サンプルの 1% 未満の最終希釈で少量の水酸化ナトリウムや塩酸の添加による希望プローブ溶液 0.2 mM 滴定しなさい。37 ° c で国立局の規格 (米国) をお勧めします参照ソリューションの pH 値を使って校正 pH 電極を pH を測定します。慎重に pH 測定中に参照および滴定されたソリューションの温度を維持するためにサーキュレータに接続されているジャケット反応ビーカーを使用します。10 mM グルコースの添加による無酸素状態と 100 U/mL グルコースオキシダーゼ プローブ ソリューションを維持します。
- リン酸のない無酸素状態でそれぞれ pH ≦ 5 で pH ≥ 8、A と B の形態の EPR スペクトルを取得します。
- 対応するスペクトルを使用して、組み込みのスペクトルパラ メーターを取得します。すなわち、ローレンツ関数の希望プローブの未解決超超微細構造に近づけるガウス関数の畳み込みとしてスペクトル線をシミュレートします。実験スペクトルを計算された EPR スペクトルのフィットが得られます横緩和率 1/T2のPとローレンツ幅 (ΔLpp) の値 (ここ 1/T2 = (√3/2) LppCW EPR の RF の吸収線の測定された派生物のため)、G. ガウス分布の幅
注:1.4.2 の手順で指定した条件で測定したスペクトルから得られたパラメーターを次に示します:P(A) = 3.63 G、P(B) = 3.37 G;1/T2(A) = 23.6 mG;1/T2(B) = 9 mG。G(A) = 40 mG。G(B) = 45 mG (文献8を参照)。 - 希望の EPR スペクトルを取得中間 ph (5 < < pH 8).前述18として参照19から適応非結合または疎結合システムの複数サイト間交流の理論を使用して取得した EPR スペクトルの高提出コンポーネントをシミュレートします。A の得られた本質的なパラメーターの使用と (手順 1.4.5 参照) B 状態変数の数を少なくします。(PA) の分数の値を検索する実験的に計算されたスペクトルに合うし、p 値の pH 依存性をプロットします。さらに pH の pH 校正曲線として pAの依存性を使用します。
注:解離定数、pK、 (希望) の値を提供標準的な滴定曲線で pAの pH 依存性をフィッティング = 6.98。生体内での研究で希望プローブにおける EPR スペクトルを取得実用的ではありません EPR スペクトル分割リン超微細の低と高フィールド コンポーネント間の間隔を取得するために必要な追加の時間のため。したがって、さらに代表される研究の EPR スペクトルの高提出のコンポーネントのみ測定、分析します。 - PO2のプローブ較正、酸素濃度で希望プローブの EPR スペクトルを取得します。
- 混合ガスをバブリングによってソリューションのコントロールpO2値はガスのコント ローラーから配信されます。サーモスタットに接続されている水浴を用いた溶液温度 (37 ° C) を制御します。
- EPR スペクトルをシミュレートし、1.4.6 酸素誘起緩和率の値を決定するための手順の説明に従って実験的にそれらに合います。
注:酸素誘起緩和率の値 0.49 mG/mmHg 両方 a と B フォーム希望のプローブ 37 ° C8にて測定。 - [Pi] のプローブの較正、種々 のリン酸濃度希望プローブの EPR スペクトルを取得します。PK、近く pH 値を希望の根本的な解決を使用して (pK、 37 ° C で 6.9 を =)18リン酸濃度を滴定。上記の手順で説明するように、温度、ガス組成を維持します。
- EPR スペクトルをシミュレートし、Pi による為替レートの値を決定する手順 1.4.6 で実験的にそれらに合います。
注:[Pi] Pi による為替レートの依存性は、さらなる研究の校正として使用されます。
2. 乳房癌のマウスモデル
- MMTV PyMT 自発腫瘍モデル
- 4-8 週を使用して-EPR 研究生体内で自発的に形作られる乳腺腫瘍の女性友人ウイルス ウイルス プロモーター (MMTV) polyoma 中間 T B 型感受性/NIH (FVB/N) マウス乳腺腫瘍抗原 (支払 +) マウスは古い。
- 正常の乳腺の腫瘍組織微小環境の比較、littermate の年齢をマッチさせた女性 PyMT 遺伝子 (PyMT−,「野生型」)20欠乏を使用します。
- イソフルラン麻酔中 4 週間週 1 回 l-band epr のマウスを対象 (プローブ配信の以下を参照してください)。
- 空気イソフルラン混合 (3% イソフルラン) を用いてマウスの麻酔し、表面コイルの共振に近い腫瘍 (乳腺) の右、横位置で調節可能なテーブルの上にマウスを置きます。
- マウス配置後に、intratissual (i.t.) の注入によってプローブを管理、EPR 分光計を調整 5-10 分の EPR スペクトルを取得します。
- 2-3 乳腺腫瘍を測定 (MMTV から-支払 + マウス) や非腫瘍性が同じの EPR セッション中に (PyMT− マウス) から乳腺を軸受します。
- 同所性同種メット 1 腫瘍モデル
- 37 ° C、5% CO210% 牛胎児血清 (FBS)、10 μ g/mL インスリン、5 ng/mL rhEGF および 1% を含む DMEM で 95% の相対湿度で FVB/N 背景メット 1 マウス乳癌細胞の成長に PSA (ペニシリン G ナトリウム、ストレプトマイシン硫酸塩およびアムホテリシン B)~ T175 フラスコの 80% 合流。
- メディアを吸引し、10 mL の PBS で付着性のセルをすすいでください (1.54 mM KH2PO 2.71 mM、155 mM の NaCl、4Na2HPO4-7 H2O 塩化カルシウムや塩化マグネシウム、pH 7.4 を =)。
- フラスコを揺動を 0.25% トリプシン-EDTA 溶液の 5 mL を追加してセルをデタッチします。10 mL 10% を含む DMEM を追加しセルを取り外したら、フラスコに FBS し細胞を収集します。
- 4 ° C で 10 分間 132 x gで細胞懸濁液を遠心分離します。診断を使用してセルを数えるし、100 μ L あたり 1 x 10 の6セルに再懸濁します最小限 DMEM。
- 8 週齢雌 FVB/N 野生型マウスの数 4 乳腺の脂肪パッドに腫瘍細胞懸濁液を 100 μ l 添加を注入インスリン注射器 (29 1/2 針) を使用して、ゆっくりと。
- 触診による腫瘍の開始を監視 (約 2-3 週間後表示されます) (ビジュアル) の成長とマウス ヒース (視覚) 他の毎日。
- ノギスを使用して週に 1 回の腫瘍の大きさを測定し、腫瘍体積の式を使用してを決定します。
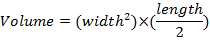
3.体内機能測定の配信をプローブします。
- 使用粒子 LiNc BuO プローブ (議定書 I) 内面 LiNc BuO で腫瘍細胞を植え付けることによって同所性同種腫瘍モデルにおける pO2測定の微結晶は前述説明14,21と以下に詳述します。
- メット 1 MET 1 セルにバイオス BuO 微結晶の内部の腫瘍モデルの場合 20 mg/mL の濃度に DMEM で LiNc BuO 微結晶を中断し、5 mL ガラス丸底チューブで 7 W の電力を使用して 20 の kHz でプローブ超音波発生装置と超音波氷の上の 5 分。
- T75 フラスコにメット 1 セル (約 30% 合流) を含む 10 mL の培地に懸濁液の 100 μ L (LiNc BuO の 2 mg) を追加します。すべてのプロシージャは安全キャビネットの場所を取る、ペニシリンとストレプトマイシン感染の可能性を最小限に抑えるためにメディアが含まれます。
- 37 ° c 72 h またはになるまで細胞をインキュベート ~ 80% の confluency。
- メディアを吸い出しなさい。5 倍を 10 mL の PBS セルを洗浄します。5 mL のトリプシン-EDTA と細胞を切り離します。細胞を収集します。2.2.4 の手順で上記のように遠心分離します。除外染付細胞生存率及び数量を決定する細胞のサンプルを染色します。
- 1 x 106ごとに 100 μ L の濃度で細胞を中断最小限 DMEM。
- 2.2.5 の手順に記載されている 8 週齢雌 FVB/N 野生型マウスの数 4 乳腺脂肪パッドに内面のバイオス BuO 微結晶を含む細胞懸濁液を 100 μ l 添加を注入するインスリン注射器を使用して、ゆっくりと。
- 2.2.6、2.2.7 の手順で説明するよう、腫瘍の発生・進展を監視します。
- 使用粒子 LiNc BuO プローブ (プロトコル II) いずれかの自発的なまたは直交異方性モデル。通常乳腺や乳腺腫瘍、インスリン注射器を使用して、例えば興味のあるサイトでリンク大府微結晶を注入します。
- 水溶性プローブ
- 空気イソフルラン混合物 (1.0 L/分配信とイソフルランの 2-3%) の吸入によるマウスを麻酔を麻酔を使用して機械、EPR 分光計のギャップにそれらを置きます。
- 、楽器をチューニングし、NR (10-30 μ L、10 mM)、希望プローブを注入 (10−30 μ L、0.5-2 mM) (10 μ L、10 mM) DMSO 溶液 (i.t.) RSSR プローブや pH 7.2, 生理食塩水に。
4.生体内機能測定
- EPR の分光学的測定手順 3.3.1 に記載された麻酔器を使用して空気イソフルラン混合物の吸入によるマウスを麻酔します。
- L バンド (1.2 GHz) EPR 分光計を使用して次のように機能の測定を実行します。
- 通常乳腺や乳腺腫瘍に表面コイルの共振器を置き、分光計を調整します。
- 5−10 分間注入粒子プローブから EPR スペクトルを取得すると、注入後数週間にわたって。水溶性プローブの場合に、5-10 分のプローブ注入後すぐに EPR スペクトルを取得します。
- 超微細分裂、N、および信号の振幅、I(t) を見つけよう NR プローブの EPR スペクトルを分析します。1.2.4 の手順で得られた検量線を使用して pH 値をNの値を変換します。初期振幅から相対的な変化として I(t) 信号振幅の減衰率の解析 I(t = 0)、毎秒 (s-1) 任意の単位で計算されます。
- GSH 濃度を計算する指数関数的速度論の時定数を取得する monoexponents に GSH 感応 RSSR プローブの EPR スペクトルの monoradical コンポーネントの増加に合わせて。
- PH、 pO2 Pi の値を生成する (ステップ 1.4.5) に記載されている実験的ものに多機能希望プローブの高電界成分の EPR スペクトルに合います。
5. 統計解析
- データ処理と統計分析を実行します。相関分析のピアソンの r 相関テスト (正規分布データセット向け) と (データ配布の拒否された正規性を持つデータセット) のスピアマンの順位相関を使用します。
結果
組織pO2プローブを用いた LiNc BuO 評価:
手順 1.1 で説明されている手順を使用して、作りたて LiNc BuO 微結晶懸濁液の校正を行った。図 2は、LiNc BuO プローブと測定バッファー懸濁液と細胞の注入によって腫瘍開始後成長して?...
ディスカッション
提示方法すなわちpO2pH、酸化還元状態、および間質性 Pi および細胞内 GSH 濃度化学 TME の重要なパラメーターの生体内非侵襲的評価を可能にします。MRI や低磁場 EPR などの磁気共鳴技術は、非侵襲体内のこれらの TME パラメーターのプロファイルの選択の方法です。MRI は、解剖学的構造を可視化するが、機能の感度を欠いています。MRI とは対照的 EPR 技術は微小環?...
開示事項
著者が明らかに何もありません。
謝辞
この作品は、NIH によって部分的に支持された CA194013、CA192064、U54GM104942 を付与します。VVK, ab 級, し、TDE の立ち上げのため、WVCTSI を認めた著者は、博士・ m ・ Gencheva、k. ・ シュタインバーガーを例示実験支援ありがちましょう。内容は著者の責任と NIH の公式見解を必ずしも表さない。
資料
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
参考文献
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved