Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
In Vivo Évaluation des EPR du pH, pO2, statut Redox et les Concentrations de Phosphate et de glutathion dans le microenvironnement tumoral
Dans cet article
Résumé
La résonance paramagnétique électronique champ faible (bande L, 1,2 GHz) à l’aide des sondes nitroxyles et trityle solubles est démontrée pour l’évaluation des paramètres physiologiques importants dans le microenvironnement tumoral dans des modèles murins de cancer du sein.
Résumé
Ce protocole démontre la capacité de résonance paramagnétique électronique de champ faible (RPE)-basé techniques en combinaison avec des sondes paramagnétiques fonctionnelles pour fournir des informations quantitatives sur le microenvironnement tumoral chimique (TME), y compris p O2, statut redox, pH, concentrations d’interstitielle phosphate inorganique (Pi) et intracellulaire glutathion (GSH). En particulier, une demande d’une sonde trityle multifonctionnel soluble récemment développés fournit une occasion inégalée pour in vivo des mesures simultanées de p,H, pO2 et Pi dans E espace mi (sonde d’espoir). Les mesures des trois paramètres à l’aide d’une seule sonde permettant leur analyse de corrélation indépendantes de distribution de la sonde et l’heure des mesures.
Introduction
Un rôle clé de la TME dans la progression du cancer et la thérapie est de plus en plus apprécié1. Parmi les paramètres physiologiques importants de la TME dans les tumeurs solides, d’une hypoxie tissulaire2, acidose3,4, réducteurs haute capacité5, des concentrations élevées de6,de GSH intracellulaire7, et interstitielle Pi8 sont bien documentés. Non invasif in vivo pO2, pH, Pi, BA et oxydo-réduction évaluations fournissent un aperçu unique des processus biologiques dans TME et outils d’avance pour le dépistage préclinique des médicaments anticancéreux et stratégies thérapeutiques ciblées TME. Une profondeur de pénétration de radiofréquence raisonnable dans les tissus par l’imagerie par résonance magnétique (IRM) et des techniques basées sur l’EPR de champ faible rend les approches les plus appropriées pour l’évaluation non invasive de ces paramètres TME. MRI dépend en grande partie d’imagerie protons de l’eau et est largement utilisé dans les milieux cliniques pour fournir une résolution anatomique mais manque de résolution fonctionnelle. Les mesures de 31P RMN (31P-NMR) de concentration de Pi et pH basé sur un signal de phosphate endogène extracellulaires sont potentiellement intéressants pour la caractérisation de la TME, mais sont habituellement masqués par plusieurs fois plus élevé intracellulaire Pi concentrations9,10. En revanche, mesures de l’EPR s’appuient sur la spectroscopie et imagerie de spécialement conçu des sondes paramagnétiques pour fournir une résolution fonctionnelle. Notez qu’exogène EPR sondes ont un avantage sur les exogènes NMR sondes en raison de la grande sensibilité intrinsèque plus élevée de l’EPR et l’absence de signaux RPE fond endogène. Le développement récent d’une nitroxyles double fonction de pH et redox probe11 et multifonctionnel trityle sonde12 offre des possibilités inégalées pour in vivo des mesures simultanées de plusieurs paramètres TME et leur analyses de corrélation dépend de la distribution de la sonde et l’heure de la mesure. À notre connaissance, il n’y a pas d’autres méthodes disponibles pour évaluer simultanément en vivo physiologiquement importants paramètres chimiques TME dans des sujets vivants, tels que pO2, pHe, Pi, oxydo-réduction et BA.
Sondes pour In Vivo Mesures fonctionnelles :
La figure 1 illustre les structures chimiques des sondes paramagnétiques utilisés pour accéder aux paramètres TME, incluent des sondes particulaires et solubles. Haute sensibilité fonctionnelle, de la stabilité dans les tissus vivants et toxicité minimale sont quelques avantages qui rendent les particules sondes préféraient plutôt que des sondes solubles pour in vivo l’oxymétrie EPR. Par exemple, particules sondes ont augmenté les temps de rétention sur le site de l’implant de tissus par rapport aux sondes solubles permettant la mesure longitudinale du tissu pO2 sur plusieurs semaines. En revanche, les sondes solubles surpassent particules sondes en fournissant des mesures spatiales résolues en utilisant EPR axée sur les techniques d’imagerie ainsi que permettant des analyses concomitantes de plusieurs fonctionnalités (pO2, pH, Pi, redox, et BA).

La figure 1. Structures chimiques des sondes paramagnétiques qui assemblent des test d’évaluation de TME. Cela inclut la sonde de2 particules pO, LiNc-BuO (R = - O (CH2)3CH3) et les sondes solubles : double fonction sonde pH et redox, NR ; BA-sensible à la sonde, RSER ; et multifonctionnel pO2, pH et sonde de Pi du microenvironnement extracellulaire, la sonde espoir. La synthèse de ces sondes a été décrite dans les références fournies 11,12. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocole
Tous les animaux travaux ont été réalisés conformément au protocole de WVU IACUC approuvé.
1. sonde de synthèse et étalonnage
- Particules pO2-sonde de LiNc-BuO sensible
Remarque : LiNc-BuO microcristaux est synthétisés et préparé comme indiqué en référence13. Ils sont très stables et peuvent être conservés à température ambiante pendant ans. La largeur des raies de la sonde de particules LiNc-BuO EPR sont une pO2-paramètre sensible. LiNc-BuO microcristaux démontre idéale dépendance linéaire de la largeur des raies sur la concentration d’oxygène dans la gamme des conditions anoxiques à 760 mmHg de pression partielle2 pO13, avec les valeurs de largeur de raie intrinsèque en l’absence de l’oxygène et la pente de la dépendance de l’oxygène (mesurée en mG/mmHg) légèrement différentes pour différents lots de la préparation de microcristallines. Il est donc nécessaire pour chaque lot notamment étalonnage.- Peser 60 mg de microcristaux de LiNc-BuO.
- Pour l’étalonnage de sensibilité de l’oxygène, suspendre des microcristaux dans 3 mL de milieu modifié Eagle Media (DMEM) de Dulbecco (à une concentration de 20 mg/mL) et laisser agir pendant 5 minutes sur la glace avec un sonicateur sonde à 20 kHz à l’aide de 7 W de puissance dans un tube fond rond en verre de 5 mL.
- Placez 1 mL de la microcristaux aux ultrasons dans un verre tube dans le résonateur de bobine de surface du spectromètre RPE bande L (1,2 GHz) et d’acquérir des spectres rpe des ondes continues (CW) à la température physiologique de 37 ° C et l’oxygène des concentrations de 0, 1, 2, 4, 8 et 20,9 %. Maintenir la concentration en oxygène par la propagation de la solution avec le mélange de gaz livré à partir d’un contrôleur de gaz et maintenir la température à l’aide d’un bain d’eau attaché à un thermostat. Utilisez les paramètres d’acquisition de spectromètre EPR suivants : modulation d’amplitude, 100 mG ; fréquence de modulation, 100 kHz ; largeur de balayage, 5 G ; balayage de temps, de 60 s.
- Pour obtenir un meilleur rapport signal sur bruit (SNR), utilisez une valeur d’amplitude modulation de 60 % de la largeur des raies (par exemple, utiliser une modulation d’amplitude 0,6 G pour la largeur des raies de 1 G).
- Remplacement simplifié la procédure d’étalonnage : enregistrer les spectres rpe en solutions air-barboter et anoxiques14. Dans ce dernier cas, maintenir l’anoxie dans les échantillons par l’addition de 10 mM de glucose et de 100 U/mL glucose oxydase aux solutions sonde 1 mL selon la référence14.
- Monter les spectres rpe avec la fonction lorentzienne pour trouver la largeur de la ligne, LW. Évaluer la sensibilité des microcristaux de pO2 comme une pente de la dépendance de LW sur pO2, à savoir comme une valeur de (LWair−LWanoxie) /pO2Le, oùaérienne de la LW et LWanoxie sont des spectres linewidth dans des conditions d’air et l’anoxie, respectivement ; p O2Le = 152 mm Hg.
- Double fonction sonde pH et redox, NR
Remarque : La sonde NR est synthétisée comme décrit dans référence11. Il est stable à température ambiante sous forme de solide et en solution aqueuse. La sonde NR synthétisée est maintenue à 4 ° C. La séparation hyperfine azote,Net la vitesse de décroissance d’amplitude de signal sont les paramètres spectraux de la sonde NR qui sont sensibles au pH (sonde pKun = 6,6 à 37 ° C, plage de sensibilité de pH de 5,6 à 7,6) et à la capacité réductrice de la sonde microenvironnement, respectivement.- Retirer le NR du congélateur et laisser le conteneur se réchauffer à température ambiante (10-15 min). Peser à 6,34 mg de la NR, dissoudre dans 1 mL de solution saline et ajuster le pH à 7,2 avec petites parties aliquotes de HCl ou NaOH à l’aide d’un pH-mètre. Utiliser la solution préparée de la NR (10 mM) comme une solution-mère.
- Effectuer l’étalonnage du pH de la sonde NR comme suit (voir référence11). Tout d’abord, ajouter 0,1 mL de la solution mère de NR à 0,9 mL de tampon de 2 mM Na-phosphate, NaCl 150 mM. Titrer la solution obtenue 1 mM NR avec parties aliquotes de HCl ou NaOH pour le pH requis à l’aide d’un pH-mètre. Contrôler la température à l’aide d’un bain d’eau attaché à un thermostat.
- Enregistrer les spectres rpe des échantillons dans des microtubes de 1,5 mL à en utilisant le spectromètre bande L EPR. Utilisez les paramètres d’acquisition de spectromètre EPR suivants : modulation d’amplitude, 2,5 G ; fréquence de modulation, 100 kHz ; largeur de balayage, 60 G ; balayage de temps, 20 s.
- Mesurer la structure hyperfine fractionnement constant (N) comme la moitié de la distance entre les composants de faible et grande pelouse de spectres rpe et il intrigue versus le pH, pour fournir la courbe d’étalonnage pour la mesure de la bande L EPR du pH.
- Sonde de RSER GSH-sensible
Remarque : La sonde RSER est synthétisée comme décrit dans référence15. Stockez la sonde NR synthétisée à 4 ° C. Le lipophiles RSER disulfure biradical composé diffuse facilement à travers la membrane cellulaire de réagir avec GSH intracellulaire et de fournir une méthode fiable pour déterminer BA in vivo à l’aide de REP16,17. Cette méthode est basée sur les vitesses de réaction forte du pool intracellulaire prédominant de thiols BA avec la sonde RSER. La réaction du RSER biradical avec fractionnements BA son disulfure bond (voir schéma 1) ce qui entraîne l’annulation de l’échange de spin entre les deux fragments radicales et qui manifeste une diminution des composantes spectrales biradical et correspondant augmentation des composants monoradical. Pour la sonde de RSER biradical, le taux de l’augmentation de l’amplitude de la composante monoradical est proportionnel à la concentration de GSH et est un paramètre spectral commode de GSH sensibles EPR. Pour évaluer la concentration de GSH des mesures in vivo EPR, l’étalonnage précédent de la vitesse de la réaction de RSER avec BA à la température et le pH correspondant doit être effectué comme suit.- Retirer le RSER du congélateur et laisser le conteneur se réchauffer à température ambiante (10-15 min). Peser 4,05 mg de la NR et dissoudre dans 1 mL de solution de DMSO. Utiliser la solution ainsi préparée RSER (10 mM) comme une solution-mère.
- Déterminer la valeur de la vitesse constante, kobs, de la réaction du RSER avec BA à la température désirable et à pH comme suit.
- Tout d’abord, ajouter 20 µL de la solution mère RSER (10 mM) à 0,98 mL de tampon de 1 mM Na-phosphate, pH 7,2, 150 mM NaCl, pour obtenir un 0,2 mM RSER sonde solution.
- Préparer des solutions de concentrations de 1, 2 et 5 mM de BA en tampon Na-phosphate 0,1 M à pH 7,2. Pour évaluer avec précision la concentration de GSH dans les cellules de l’organe ciblé des mesures in vivo , la calibration in vitro doit être exécuté à un pH proche de la valeur du pH intracellulaire.
- Mélanger des quantités égales de 0,2 mM RSER solution et une des solutions BA préparées à l’étape 1.3.4. pour une concentration finale de la sonde à 0,1 mM et de GSH à 0,5, 1 ou 2. 5 mM.
- Immédiatement après la solution RSER et BA mélanger, placer l’échantillon dans le résonateur de l’EPR et enregistrer les spectres rpe toutes les 12 secondes pendant 10 minutes. Puis calculer la cinétique de l’augmentation de l’amplitude spectrale de monoradical. Utilisez les paramètres d’acquisition de spectromètre EPR suivants : modulation d’amplitude, 1 G ; fréquence de modulation, 100 kHz ; largeur de balayage, 60 G ; temps de balayage, 10-60 s.
- Monter la cinétique d’EPR mesurée à la monoexponents et calculer la constante de temps de la cinétique exponentielle, τ. La régression linéaire (1/τ = k ×obs [BA]) fournit la valeur de constante de vitesse observée de la réaction entre BA et RSER (p. ex., à 34 ° C et à pH 7,2, kobs = 2,8 ± 0,2 M-1s-1)11.
- Sonde d’espoir multifonctionnel de pO2, pH et d’évaluation de la Pi
Remarque : Le monophosphonated trityle sonde espoir est synthétisé comme décrit dans référence12 et est conservé à 4 ° C. Spectres rpe CW de l’espoir à pH << pKa (A - forme acide) et pH >> pKa B - formulaire de base sont représentés par les doublets en raison de phosphore hyperfine fractionnement, uneP. Les paramètres de l’instrument typiques sont comme suit : modulation d’amplitude, de 37,5 mG ; fréquence de modulation, 100 kHz ; largeur de balayage, 0,9 G ; temps de balayage, 20-60 s. À pH intermédiaire (5 < pH < 8) le spectre RPE de sonde espoir se caractérise par un quatuor lorsque des A et B États sont présents. La largeur de raie EPR individuel de l’espoir est un marqueur de2 pO (précision, ≈ 1 mmHg ; p O gamme2 , 1-100 mmHg). La fraction de protoné HOPE (une forme) est un marqueur de pH compris entre 6 à 8.0 (précision : ± 0,05). La valeur du taux de change proton (exprimée en mG) avec Pi extraite par simulation des spectres est un marqueur de Pi (précision, ± 0,1 mM, gamme, 0,1 à 20 mM). Procédures d’étalonnage sont effectuées à température physiologique (37 ° C), force ionique de la solution (NaCl 150 mM) et la concentration de sonde espoir de 0,2 mM, comme décrit précédemment dans références12,18et détaillés ci-dessous.- Retirer la sonde espoir du congélateur et laisser le conteneur se réchauffer à température ambiante (10-15 min).
- Peser à 10,7 mg de la sonde de l’espoir, dissoudre dans 1 mL de solution saline et ajuster le pH à 7,4. Ajouter 20 µL de la solution mère préparée de l’espoir (10 mM) à 0,98 mL de la solution saline pour obtenir un espoir de 0,2 mM sonde solution.
- Pour l’étalonnage de la sonde de pH, titrer 0,2 mM de la solution de sonde espoir par l’ajout d’un petit volume de NaOH ou HCl, avec la dilution finale de l’échantillon de moins de 1 %. Mesurer le pH avec une électrode pH calibrée à 37 ° C, en utilisant les valeurs de pH de la solution de référence recommandée par National Bureau of Standards (US). Utilisez un bécher de réaction chemisé attaché à un circulateur pour maintenir la température de référence et des solutions titrées de soigneusement pendant les mesures de pH. Maintenir des conditions anoxiques par l’addition de 10 mM de glucose et 100 U/mL glucose oxydase pour les solutions de la sonde.
- Acquérir les spectres rpe des formes A et B ≤ pH 5 et pH ≥ 8, respectivement, dans des conditions anoxiques en l’absence de phosphate.
- Utilisez les spectres correspondants pour obtenir les paramètres spectraux intrinsèques. À savoir, simuler la raie spectrale comme le produit de convolution de la fonction lorentzienne avec la fonction gaussienne qui se rapproche de la structure hyperfine du suspens super de la sonde de l’espoir. Le montage des spectres rpe calculées à des spectres expérimentaux donne les valeurs deP et linewidth lorentzienne (ΔLpp), déterminés par le taux de relaxation transversale, 1/T2 (où 1/T2 = pp (/ 3/2) L pour la mesure dérivée de la raie d’absorption de RF dans CW EPR) et la largeur des raies de distribution gaussienne, G.
Remarque : Voici les paramètres obtenus à partir des spectres mesurés dans les conditions indiquées dans l’étape 1.4.2 : unP(A) = 3,63 G,P(B) = 3,37 G ; 1/T2(A) = 23,6 mG ; 1/T2(B) = 9 mG ; G(A) = 40 mG ; G(B) = 45 mG (voir référence8). - Acquérir les spectres rpe de l’espoir à pH intermédiaire (5 < pH < 8). Simuler la composante haute-déposer des spectres rpe acquis à l’aide de la théorie de l’échange entre plusieurs sites dans les systèmes faiblement couplés ou non couplés adaptés de référence19 comme décrit précédemment18. Utiliser les paramètres intrinsèques obtenus pour A et B États (voir étape 1.4.5) pour diminuer le nombre de variables. Monter les spectres calculés à celles expérimentales pour trouver les valeurs de la fraction une (pA) et tracer la dépendance à l’égard de la valeur deA p pH. Utiliser la dépendance de pA le pH dans d’autres études comme une courbe d’étalonnage pH.
Remarque : Montage de la dépendance au pH de p,A , avec une courbe de titrage standard fournit la valeur de la dissociation constante, pKun (HOPE) = 6,98. Dans des études in vivo , acquérir les spectres rpe complets de la sonde de l’espoir est impraticable en raison du temps supplémentaire nécessaire à l’acquisition de l’écart entre les composants de faible et grande pelouse de la séparation dans le spectre RPE hyperfine phosphore. Par conséquent, dans des études plus poussées dont témoigne seulement la composante haute-déposer du spectre RPE a été mesurée et analysée. - Pour l’étalonnage de la sonde de pO2, acquérir les spectres rpe de la sonde de l’espoir à différentes concentrations d’oxygène.
- Valeurs de contrôle pO2 des solutions par barbotage avec mélange de gaz livré d’un contrôleur de gaz. Contrôler la température de la solution (37 ° C) à l’aide d’un bain d’eau attaché à un thermostat.
- Simuler les spectres rpe et fixez-les sur les plus expérimentales, comme indiqué au point 1.4.6 pour déterminer les valeurs des taux de relaxation induite par l’oxygène.
Remarque : Les valeurs des taux de relaxation induite par l’oxygène étaient 0,49 mG/mmHg deux pour A et B des formulaires de l’espoir sonde mesurée à 37 ° C8. - Pour l’étalonnage de la sonde de [Pi], acquérir les spectres rpe de la sonde de l’espoir à différentes concentrations de phosphate. Utiliser la solution radicale de l’espoir avec un pH près de pKun (pKun = 6,9 à 37 ° C)18 et il titrer avec différentes concentrations de phosphate. Maintenir la composition de la température et des gaz comme ci-dessus en étapes.
- Simuler les spectres rpe et fixez-les sur les plus expérimentales, comme indiqué au point 1.4.6 pour déterminer les valeurs de Pi-induit des taux de change.
Remarque : La dépendance à l’égard du taux de change induite par la Pi [Pi] sert d’étalonnage dans d’autres études.
2. souris modèles de Cancer du sein
- Modèle de tumeurs spontanées MMTV-PyMT
- Utiliser les 4-8 semaine-vieux ami virus type B sensibilité/NIH (FVB/N) souris mammary tumor virus promoteur (MMTV) polyome middle-T antigène (PyMT +) des souris femelles avec des tumeurs mammaires spontanément formés pour des études in vivo EPR.
- Pour comparaison des micro-environnements tissus de tumeurs des glandes mammaires normales, utilisez femelles de même âge même portée déficientes en oncogène (PyMT−, « type sauvage ») daté du20.
- Sous réserve des souris à la spectroscopie RPE bande L une fois par semaine pendant quatre semaines durant l’anesthésie isoflurane (voir sonde livraison ci-dessous).
- Anesthésier la souris à l’aide d’un mélange air-isoflurane (3 % isoflurane) et placez la souris sur une table réglable en position droite, latérale avec la tumeur (glandes mammaires) près de la caisse de résonance de bobine de surface.
- Après le placement de la souris, administrer la sonde par injection d’intratissual (i.t.), tune le spectromètre EPR et acquérir les spectres rpe pendant 5-10 min.
- Mesurer les 2-3 tumeurs mammaires (de MMTV-PyMT + souris) ou non-tumeur portant des glandes mammaires (à partir de souris PyMT−) pendant la même session de l’EPR.
- Modèle de tumeur orthotopique MET-1
- FVB/N contexte Met-1 murin cellules mammaires cancéreuses à 37 ° C, 5 % de CO2et 95 % d’humidité relative en DMEM contenant 10 % sérum fœtal (SVF), 10 µg/mL d’insuline, rhEGF de 5 ng/mL et 1 % de croissance PSA (pénicilline G sodique, sulfate de streptomycine et amphotéricine B) à environ 80 % confluent dans une fiole de T175.
- Aspirer les médias et rincer les cellules adhérentes avec 10 mL de PBS (1,54 mM KH2PO4, 155 mM NaCl et 2,71 mM Na2HPO4-7 H2O sans chlorure de calcium ou le chlorure de magnésium, pH = 7,4).
- Détacher les cellules en ajoutant 5 mL de solution de trypsine-EDTA de 0,25 % et le ballon à bascule. Lorsque les cellules sont détachés, ajouter 10 mL DMEM contenant 10 % FBS dans le ballon et de recueillir les cellules.
- Centrifuger la suspension cellulaire à 132 x g pendant 10 min à 4 ° C. Compter les cellules à l’aide d’un hémocytomètre et remettre en suspension à 1 x 106 cellules / µL 100 DMEM minime.
- À l’aide d’une seringue à insuline (aiguille de 29 1/2), injecter lentement 100 µL de la suspension de cellules tumorales dans les coussinets adipeux mammaire numéro 4 de souris de type sauvage FVB/N femelles âgés de 8 semaines.
- Surveiller l’initiation tumorale par palpation (apparaît après environ 2-3 semaines), croissance (visuelle) et souris heath (visuel) tous les deux jours.
- Mesurer les dimensions de la tumeur une fois par semaine à l’aide d’étriers et de déterminer les volumes de la tumeur à l’aide de l’équation :
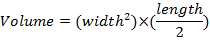
3. livraison sonde pour les mesures de fonctionnelles In Vivo
- Utilisation de la sonde LiNc-BuO particulaire (Protocole I) pour les mesures de2 pO dans les modèles de tumeur orthotopique par implantation de cellules tumorales avec intériorisée LiNc-BuO microcristaux comme précédemment décrit14,21 et détaillées ci-dessous.
- Dans le cas du modèle de tumeur MET-1, pour l’internalisation des microcristaux de LiNc-BuO MET-1 cellules, suspendre les microcristaux de LiNc-BuO dans DMEM à une concentration de 20 mg/mL et laisser agir avec un sonicateur sonde à 20 kHz à l’aide de 7 W de puissance dans un tube fond rond en verre de 5 mL pendant 5 min sur la glace.
- Ajouter 100 µL (2 mg de LiNc-BuO) de la suspension dans un ballon T75 avec 10 mL de milieu de culture contenant des cellules de MET-1 (environ 30 % anastomosé). Toutes les procédures se déroulent dans une enceinte de sécurité biologique et les médias contient la pénicilline et la streptomycine pour minimiser les infections potentielles.
- Incuber les cellules à 37 ° C pendant 72 h ou jusqu'à ce qu’ils atteignent ~ 80 % confluence.
- Aspirer les médias. Laver les cellules cinq fois avec 10 mL de PBS. Détacher les cellules avec 5 mL de trypsine-EDTA. Recueillir les cellules. Centrifugeuse comme indiqué ci-dessus au point 2.2.4. Tache d’un échantillon de cellules avec un colorant d’exclusion afin de déterminer la quantité et la viabilité cellulaire.
- Suspendre les cellules à une concentration de 1 x 106 par 100 µL DMEM minime.
- À l’aide d’une seringue à insuline, injecter lentement 100 µL de la suspension de cellules contenant les microcristaux de LiNc-BuO intériorisée dans les coussinets adipeux mammaire numéro 4 de souris de type sauvage FVB/N femelles de 8 semaines tel que décrit à l’étape 2.2.5.
- Surveiller l’initiation tumorale et la croissance comme indiqué aux paragraphes 2.2.6 et 2.2.7.
- Sonde de LiNc-BuO particulaire utilisation (Protocole II) en soit spontanée ou modèles orthotopiques. Injecter LiNc-OBu microcristaux sur le site d’intérêt, par exemple, dans les glandes mammaires normales ou des tumeurs mammaires, à l’aide d’une seringue à insuline.
- Sondes solubles
- Anesthésier les souris par inhalation d’un mélange air-isoflurane (livraison de 1,0 L/min et 2 à 3 % d’isoflurane) à l’aide d’une anesthésie de la machine et rangez-les dans le fossé du spectromètre EPR.
- Accorder l’instrument, puis injecter la NR (10-30 µL, 10 mM), la sonde de l’espoir (10−30 µL, 0,5 à 2 mM) dans une solution saline, pH 7,2 ou sonde RSER dans les solutions de DMSO (10 µL, 10 mM) (i.t.).
4. mesures de fonctionnelles in Vivo
- Pour des mesures spectroscopiques EPR, anesthésier les souris par inhalation d’air-isoflurane mélange à l’aide d’une machine d’anesthésie comme indiqué au point 3.3.1.
- Effectuer des mesures fonctionnelles utilisant le spectromètre RPE bande L (1,2 GHz) comme suit.
- Placez le résonateur de bobine de surface sur une glande mammaire normale ou d’une tumeur mammaire et capter le spectromètre.
- Acquérir les spectres rpe de la sonde de particules implantée pendant 5−10 min pendant plusieurs semaines après l’implantation. Dans le cas des sondes solubles, acquérir les spectres rpe immédiatement après l’injection de la sonde pendant 5-10 min.
- Analyser les spectres rpe de la sonde NR à trouver la structure hyperfine fractionnement, unNet l’amplitude du signal, i (t). Convertir la valeur d’unN à la valeur du pH à l’aide de la courbe d’étalonnage obtenue à l’étape 1.2.4. Analyser le taux de décomposition de l’amplitude du signal i (t) comme la variation relative de l’amplitude initiale, I(t = 0), calculés en unités arbitraires par seconde (s-1).
- S’adapter à l’augmentation de la composante monoradical du spectre RPE de sonde RSER BA sensibles à la monoexponents pour obtenir la constante de temps de la cinétique exponentielle pour calculer la concentration de GSH.
- Monter les spectres rpe de haut champ composant de la sonde espoir multifonctionnelle à celles expérimentales décrites (étape 1.4.5) pour obtenir les valeurs de pH, pO2 et Pi.
5. analyse statistique
- Effectuer le traitement des données et analyses statistiques. Utilisez le test de corrélation de Pearson, un r (pour les ensembles de données distribuées normalement) et ordre de rang de Spearman (pour les ensembles de données avec rejetés normalité de la distribution des données) pour des analyses de corrélation.
Résultats
Tissu p O 2 Évaluation en utilisant le clic-BuO sondes :
En utilisant la procédure décrite sous étape 1.1, nous avons effectué l’étalonnage de suspension de microcristaux LiNc-BuO fraîchement préparée. La figure 2 illustre la dépendance de l’oxygène typique de la largeur des raies...
Discussion
Les méthodes présentées permettent non invasif in vivo l’évaluation des paramètres critiques de la TME chimique, à savoir pO2, pH, statut redox et concentrations de Pi interstitielle et de GSH intracellulaire. Les techniques de résonance magnétique, tels que les IRM et champ faible EPR, sont les méthodes de choix non invasif in vivo par profilage de ces paramètres TME. MRI visualise les structures anatomiques mais manque de sensibilité fonctionnelle. Contrairement à l?...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été partiellement pris en charge par les NIH confèrent aux CA194013, CA192064 et U54GM104942. Le WVCTSI est reconnu pour le démarrage à VVK, AB et TDE. Les auteurs remercient Dr M. Gencheva et K. Steinberger pour l’aide avec les expériences illustratives. Le contenu est la seule responsabilité des auteurs et ne représente pas nécessairement les vues officielles des NIH.
matériels
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Références
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon