Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В естественных условиях ЭПР Оценка рН, pO2, окислительно-восстановительного состояния и концентрации фосфатов и глутатиона в микроокружения опухоли
В этой статье
Резюме
Низкий поле (L-band, 1,2 ГГц) электронного парамагнитного резонанса с использованием растворимых нитроксильных и trityl зондов продемонстрировала для оценки физиологически важных параметров в микроокружения опухоли в моделях мыши рака молочной железы.
Аннотация
Этот протокол демонстрирует возможности низкой поля электронного парамагнитного резонанса (EPR)-на основе методов в сочетании с функциональной парамагнитных зонды для обеспечения количественной информации о химической опухоли микроокружения (ТМЕ), включая p O2, pH, redox статус, концентрации интерстициальный неорганического фосфата (Pi) и внутриклеточных глутатиона (GSH). В частности, применение недавно разработанных растворимых многофункциональный trityl зонд обеспечивает непревзойденную возможность для в vivo параллельных измерений pH,2 pOи Pв E пространство xtracellular (Надежда зонд). Измерения трех параметров с помощью одного зонда позволяют их анализ корреляцию независимо от расположения датчика и время измерений.
Введение
Ключевую роль TME в прогрессии рака и терапии является все более высокую оценку1. Среди важных физиологических параметров TME в солидных опухолей, гипоксия тканей2, ацидоз3,4, высокое сокращение потенциала5, повышенные концентрации внутриклеточного GSH6,7, и интерстициальный Pi8 хорошо документированы. Неинвазивный в естественных условиях pO2, рН, Pi, GSH, редокс оценок и обеспечивают уникальное понимание биологических процессов в TME и помочь заранее инструменты для доклинических скрининга противораковых препаратов и TME-целевых терапевтических стратегий. Глубина проникновения разумные радиочастот в тканях, магнитно-резонансная томография (МРТ) и низкой поле ЭПР-методы на основе делает их наиболее подходящие подходы для неинвазивной оценки этих параметров TME. МРТ опирается главным образом на визуализации протонов воды и широко используется в клинических условиях предоставлять анатомические резолюции, но не хватает функциональной резолюции. Фосфор-31 ядерного магнитного резонанса (31P-NMR) измерения внеклеточной концентрации Pi и рН, основанные на сигнал от эндогенных фосфат потенциально привлекательным для характеризации TME, но обычно замаскированы несколько раз выше внутриклеточной Pi концентрации9,10. В отличие от этого ЭПР измерения полагаются на спектроскопии и изображений из специально разработан парамагнитных зонды для обеспечения функционального разрешения. Обратите внимание, что экзогенные ОРЭД зонды имеют преимущество перед экзогенных ЯМР зонды гораздо выше внутренняя чувствительность ОРЭД и отсутствия эндогенного фон ОРЭД сигналов. Недавнее развитие двойной функции pH и редокс нитроксильных зонда11 и многофункциональный trityl зонд12 обеспечивает непревзойденные возможности для в vivo параллельных измерений нескольких параметров TME и их анализ корреляции независимых датчика распределения и время измерения. Насколько нам известно существует без других методов, доступных для одновременно оценить в vivo физиологически важных химических TME параметров в живых субъектов, таких как pO2, рНe, Pi, окислительно-восстановительные и ГШ.
Датчики для В естественных условиях Функциональных измерения:
Рисунок 1 показывает химической структуры парамагнитные ПЭП, используется для доступа к параметрам TME, которые включают твердых частиц и растворимых зонды. Несколько преимуществ, которые делают частиц зонды, предпочтение растворимых зонды для в vivo оксиметрии ОРЭД являются высокая функциональная чувствительность, стабильности в живой ткани и минимальной токсичностью. Например твердых зонды увеличились раз удержания на месте ткани имплантантов по сравнению с растворимых зонды, позволяя для продольной измерения ткани pO2 в течение нескольких недель. С другой стороны, растворимые зонды превосходят частиц зонды, предоставляя пространственного разрешения измерений с помощью на основе ОРЭД методы визуализации, а также позволяя сочетанной анализов из нескольких функций (pO2, pH, Pi, редокс, и GSH).

Рисунок 1. Химические структуры парамагнитных преобразователей, которые собирают TME оценки пробирного. Это включает в себя частиц pO2 зонд, линк-BuO (R = - O (2CH)3CH3) и растворимых зондов: двойной функции pH и редокс зонд, NR; GSH-чувствительных зондов, RSSR; Многофункциональный pO2, рН и зонд Pi внеклеточного микроокружения, Надежда зонд. В условии ссылки 11,12был описан синтез этих датчиков. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
протокол
Все животные работа была выполнена в соответствии с протоколом WVU IACUC утверждения.
1. зонд синтеза и калибровка
- Твердых pO2-чувствительных линк-BuO зонд
Примечание: Линк-BuO микрокристаллов синтезируется и подготовлен как описано в ссылка13. Они очень стабильна и может храниться при комнатной температуре на протяжении лет. ЭПР linewidth линк-BuO пробоотборника твердых частиц является pO2-чувствительных параметр. Линк-BuO микрокристаллов продемонстрировать идеальное линейную зависимость linewidth на концентрацию кислорода в диапазоне от анаэробных условий pO2 парциальное давление13, с ценностями внутренней линией в отсутствие до 760 мм рт.ст. кислорода и наклон зависимость кислорода (измеряется в мг/мм рт.ст.) слегка различные для различных пакетов микрокристаллита подготовки. Таким образом для каждого конкретного пакета требуется калибровка.- Вешу 60 мг линк-BuO микрокристаллов.
- Для калибровки чувствительность кислорода приостановить микрокристаллы в 3 мл Дульбекко изменение орел СМИ (DMEM) среды (в концентрации 20 мг/мл) и sonicate за 5 минут на льду с зонда sonicator на 20 кГц с использованием 7 Вт мощности в 5-мл стеклянной трубки раунд снизу.
- Место 1 мл sonicated микрокристаллы в стеклянной трубки в резонаторе поверхности катушки L-диапазона (1,2 ГГц) ЭПР спектрометр и приобрести спектрам ЭПР непрерывной волны (CW) при физиологических температуре 37 ° C и кислорода концентрации 0, 1, 2, 4, 8 и 20,9%. Поддерживать концентрацию кислорода, восходящей решение с газовой смеси, доставлен из контроллера газ и поддержания температуры, с помощью водяной бане прилагается к термостату. Используйте следующие параметры приобретения ЭПР спектрометр: амплитуда модуляции, 100 мг; частота модуляции, 100 кГц; развертки ширина, 5 Г; развертки время, 60 s.
- Для достижения лучшего соотношения сигнал шум (SNR), используйте значение амплитудной модуляции 60% linewidth (например, использовать модуляции амплитуды 0.6 G для linewidth 1 G).
- Альтернатива упрощена процедура калибровки: запись спектров ЭПР в воздух пропускается и аноксии решения14. В последнем случае поддерживать аноксии в образцах с добавлением глюкозы 10 мм и 100 глюкозооксидаза ед/мл 1 мл зонд решения согласно ссылка14.
- Соответствовать спектрам ЭПР с функцией псевдоримановом найти ширину линии, дв. Оценивать чувствительность микрокристаллов pO2 как склоне зависимость LW pO2, а именно как значение (LWвоздуха−LWаноксии) /pO2Воздушный, где LWвоздуха и LWаноксии linewidth спектры в условиях воздуха и гипоксия, соответственно; p O2Воздушный = 152 мм рт.ст..
- Двойная функция pH и редокс зонд, NR
Примечание: Зонд NR синтезируется, как описано в ссылку11. Он устойчив при комнатной температуре и как твердых, так и в водных растворах. Синтезированный зонд NR хранится при 4 ° C. Расщепление дескриптивное азота,Nи скорость распада амплитуда сигнала являются спектральных параметров датчика NR, которые чувствительны к рН (зонд pK = 6.6 при 37 ° C, диапазон чувствительности рН от 5.6 до 7,6) и снижения способности зонд микроокружения, соответственно.- Удаление NR из морозильника и позволяют контейнеру нагреться до комнатной температуры (10-15 мин). Весят, 6.34 мг №, растворяют в 1 мл физиологического раствора и скорректировать рН 7,2 с небольшой аликвоты HCl или NaOH с помощью рН метр. Используйте приготовленный раствор NR (10 мм) как Стоковый раствор.
- Выполните калибровку рН зонд NR следующим (см. ссылку11). Во-первых добавьте 0,1 мл NR Стоковый раствор 0,9 мл 2 мм Na фосфатного буфера, 150 мм NaCl. Титруйте полученные 1 мм NR решение с аликвоты HCl или NaOH до требуемых pH с помощью рН метр. Контроль температуры с помощью водяной бане прилагается к термостату.
- Запись спектрам ЭПР образцов в 1,5 мл microcentrifuge труб с использованием L-band ЭПР спектрометр. Используйте следующие параметры приобретения ЭПР спектрометр: амплитуда модуляции, 2,5 Г; частота модуляции, 100 кГц; развертки ширина, 60 Г; развертки время, 20 s.
- Измерить сверхтонкая, разделение на постоянной (N) как половину расстояния между низким и высоким поля компоненты по спектрам ЭПР и заговор против рН, предоставлять Калибровочная кривая для ОРЭД L-диапазона измерения рН.
- GSH-чувствительных RSSR зонд
Примечание: RSSR зонд синтезируется, как описано в ссылка15. Хранить синтезированный зонд NR при 4 ° C. Липофильных RSSR дисульфида biradical соединения легко диффундирует через клеточную мембрану реагировать с внутриклеточного GSH и обеспечить надежный подход для определения GSH в естественных условиях с помощью ОРЭД16,17. Этот метод основан на высокой реакции ставки преобладающим внутриклеточного пула GSH тиолов с RSSR зонда. Реакция RSSR biradical с GSH разбивает его дисульфидными облигаций (см. Схема 1) привело к отмене спин обмену между двух радикальных фрагментов и проявляется в уменьшении biradical спектральных составляющих и соответствующий увеличение monoradical компонентов. Для biradical RSSR зонд увеличение амплитуды компонента monoradical пропорциональна к концентрации GSH и является удобным спектральный параметр GSH-чувствительных ОРЭД. Для оценки концентрации GSH ОРЭД в естественных условиях измерений, предыдущей калибровки скорости реакции RSSR с GSH при соответствующей температуре и рН должна выполняться следующим образом.- Удалить RSSR из морозильника и позволяют контейнеру нагреться до комнатной температуры (10-15 мин). Весят, 4.05 мг № и растворяют в 1 мл раствора ДМСО. Используйте приготовленный раствор RSSR (10 мм) как Стоковый раствор.
- Определите значение скорость постоянной, kobs, реакции RSSR с GSH желательно температуры и рН следующим образом.
- Во-первых, добавить 20 мкл раствора RSSR акций (10 мм) 0,98 мл 1 мм Na фосфатного буфера, рН 7,2, 150 мм NaCl, чтобы получить 0,2 мм RSSR зонд решение.
- Подготовка решений 1, 2 и 5 мм концентрации GSH в 0,1 М Na фосфатного буфера при рН 7,2. Для точной оценки концентрации GSH в клетках целевого органа в естественных условиях измерений, калибровки в пробирке должна выполняться при рН близок к значению внутриклеточный pH.
- Смесь равных объемов раствора RSSR 0,2 мм и одним из решений GSH, подготовленную на этапе 1.3.4. для окончательного концентрация зонда на 0,1 мм и GSH: 0,5, 1 или 2,5 мм.
- Сразу же после RSSR и ГШ решение смешивания Поместите образец в резонаторе ОРЭД и записывать спектрам ЭПР каждые 12 секунд на 10 минут. Затем вычислите Кинетика роста амплитуды спектральных monoradical. Используйте следующие параметры приобретения ЭПР спектрометр: амплитуда модуляции, 1 Г; частота модуляции, 100 кГц; развертки ширина, 60 Г; время развертки, 10-60 сек.
- Соответствовать Измеренная кинетика ОРЭД в monoexponents и рассчитать постоянная времени экспоненциального кинетики, τ. Линейная регрессия (1/τ = kobs × [ГШ]) обеспечивает постоянное значение Наблюдаемая скорость реакции между ГШ и RSSR (например, в 34 ° C и pH 7.2, kobs = 2,8 ± 0,2 М-1s-1)11.
- Многофункциональный Надежда зонд для pO2, рН и оценки Pi
Примечание: Trityl monophosphonated, которую Надежда зонд синтезируется, как описано в разделе ссылки12 и хранится при 4 ° C. Спектрам ЭПР CW надежды на pH << pKa (- форма) и рН >> pKa (B - основная форма) представлены Дуплеты благодаря дескриптивное фосфора, колки,P. Типичный инструмент параметры заключаются в следующем: амплитуда модуляции, 37,5 мг; частота модуляции, 100 кГц; развертки ширина, 0,9 Г; время развертки, 20-60 s. При промежуточных значениях рН (5 < рН < 8) спектра ЭПР надежды зонда характеризуется квартет когда оба A и B государства присутствуют. Индивидуальный ОРЭД linewidth надежды является маркером2 pO (точность, ≈ 1 мм рт.ст.; p O2 диапазон 1-100 мм рт.ст.). Фракция протонированных Надежда (форма) является маркером pH в диапазоне от 6 до 8.0 (точность, ± 0,05). Протон обменного курса (выражается в мг) с Pi, добытых моделирование спектров значение Pi маркер (точность, ± 0,1 мм, диапазон, 0,1-20 мм). Калибровочные процедуры выполняются на физиологические температура (37 ° C), ионной силы раствора (NaCl, 150 мм) и надежда зонд концентрации 0,2 мм, как описано ранее в ссылки на12,18и подробно излагаются ниже.- Удаление Надежда зонд из морозильника и позволяют контейнера, чтобы нагреть до комнатной температуры (10-15 мин).
- Весят, мг 10.7 надежды зонда, растворяют в 1 мл физиологического раствора и скорректировать рН 7,4. Добавить 20 мкл подготовленный раствор надежды (10 мм) до 0,98 мл физраствора получить 0,2 мм Надежда зонд решение.
- Для калибровки датчика рН Титруйте 0,2 мм Надежда зонд решения путем добавления небольшого количества NaOH или HCl, с окончательной разбавления образца менее 1%. Измерение pH с рН электрод, калиброванные при 37 ° C, с использованием значения рН для эталонного решения, рекомендованные, Национальное бюро стандартов (США). Используйте стакан с рубашкой реакции придают термостат тщательно поддерживать температуру ведения и титруемая решения во время измерения рН. Поддерживать бескислородные условия добавлением глюкозы 10 мм и 100 ед/мл глюкозооксидаза зонд решения.
- Приобрести спектрам ЭПР A и B форм при рН ≤ 5 и pH ≥ 8, соответственно, в анаэробных условиях при отсутствии фосфата.
- Используйте соответствующий спектры для получения внутренней спектральных параметров. А именно имитировать спектральной линии как свертка псевдоримановом функции с функцией Гаусса, моделирующей неразрешенные супер сверхтонкая структура Надежда зонда. Фитинга рассчитанных спектров ЭПР для экспериментальных спектров дает значенияP и псевдоримановом linewidth (ΔLpp), определяется уровень поперечной релаксации, 1/T2 (где 1/T2 = pp (√3/2) L для измеренных производной линии поглощения РФ в CW EPR) и linewidth распределения Гаусса, G.
Примечание: Ниже перечислены параметры, полученные из спектры измерялись на условиях, указанных в шаге 1.4.2:P(A) = 3.63 G,P(B) = 3,37 Г; 1/Т2(A) = 23,6 мг; 1/Т2(B) = 9 мг; G(A) = 40 мг; G(B) = 45 мг (см. ссылку8). - Приобрести спектрам ЭПР надежды при промежуточных значениях рН (5 < рН < 8). Имитировать поданной в высокий компонент приобретенных спектров ЭПР, с использованием теории обмена между несколькими сайтами в-сочетании или слабосвязанных системах адаптировано из19 ссылку как ранее описанных18. Использовать встроенные параметры, полученные для A и B государствам (см. шаг 1.4.5) для уменьшения числа переменных. Соответствовать расчетные спектры экспериментальными найти значения дроби (pA) и сюжет зависимость pA значение рН. Используйте зависимость pA на pH в дальнейших исследованиях как рН калибровочной кривой.
Примечание: Фитинг рН зависимость pA с кривой титрования стандартных предоставляет значение диссоциации постоянной, pK (надеюсь) = 6,98. В в vivo исследований приобретения полной спектрам ЭПР Надежда зонда нецелесообразно из-за дополнительное время, необходимое для приобретения разрыв между низкой и высокой области компонентов дескриптивное фосфора, разделение спектра ЭПР. Таким образом в дальнейших исследованиях, свидетельствует только поданной в Верховный компонент спектра ЭПР были измерены и проанализированы. - Для калибровки датчика pO2приобрести спектрам ЭПР Надежда зонда в различных концентрациях кислорода.
- Значения элементов управления pO2 решений по восходящей с газовой смеси доставлены из контроллера газ. Контроль температуры раствора (37 ° C) с помощью водяной бане прилагается к термостату.
- Моделировать спектрам ЭПР и подогнать их экспериментальными, как описано в шаге 1.4.6 для определения значений ставок кислорода индуцированной релаксации.
Примечание: Значения кислорода индуцированной релаксации ставки были 0,49 мг/мм рт.ст и для A и B формы надежды зонд, как измеряется при 37 ° C8. - Для калибровки датчика [п] приобрести спектрам ЭПР Надежда зонда в различных концентрациях фосфата. Используйте Надежда радикального решения с рН около pK (pK = 6,9 при 37 ° C)18 и титровать с различных концентраций фосфатов. Поддержания температуры и состава газа, как описано в выше шаги.
- Моделировать спектрам ЭПР и подогнать их экспериментальными, как описано в шаге 1.4.6 для определения значений Pi индуцированной обменного курса.
Примечание: Зависимость [Pi] Pi индуцированной обменный курс используется как калибровки в дальнейших исследованиях.
2. мыши модели рака молочной железы
- MMTV-PyMT спонтанные опухоли модель
- Используйте 4-8 недели-старая женщина друг вирус типа B восприимчивость/низ (FVB/N) мыши молочной железы опухоль вируса промоутер (MMTV) polyoma среднего T антигена (PyMT +) мышей с спонтанно сформированных опухолях молочной в vivo исследований ОРЭД.
- Для сравнения микросреды ткани нормальный молочные железы и опухолей используйте соответствует возрасту помёте самки дефицит в PyMT онкогенов (PyMT−, «дикий»)20.
- Тема мышей для L-band ЭПР спектроскопии один раз в неделю в течение четырех недель во время анестезии изофлюрановая (см. зонд поставка ниже).
- Анестезировать мыши, используя смесь воздуха изофлюрановая (3% изофлюрановая) и поместите указатель мыши на регулируемый стол в правой, боковые позиции с опухолью (молочных желез) близко к поверхности катушки резонатора.
- После размещения мыши администрирование зонда путем инъекций intratissual (и.т.), настроить ЭПР спектрометр и приобрести спектрам ЭПР для 5-10 мин.
- Мера 2-3 опухоли молочных желез (от MMTV-PyMT + мышь), или не опухоли молочных желез (от PyMT− мышей) в ходе той же сессии ОРЭД.
- Модель ортотопическая MET-1 опухоли
- Расти FVB/N фон Met-1 мышиных груди раковые клетки при 37 ° C, 5% CO2и 95% относительной влажности в среде DMEM, содержащие 10% плода бычьим сывороточным (ФБС), 10 мкг/мл инсулина, rhEGF 5 нг/мл и 1% СРП (пенициллин G натрия, Стрептомицина сульфат и амфотерицин B) ~ 80% слияния в T175 колбу.
- Аспирационная СМИ и промойте адэрентных клеток с 10 мл PBS (1.54 mM х2PO4, 155 мм NaCl и 2.71 мм Na2HPO4-7 H2O без хлорида кальция или магния хлорид, pH = 7,4).
- Отсоедините клетки, добавив 5 мл 0,25% раствора трипсина-ЭДТА и тряся колбу. Когда клетки отсоединены, добавляют 10 мл DMEM, содержащие 10% FBS в колбу и собирать клетки.
- Центрифуга суспензию клеток в 132 x g 10 мин при 4 ° C. Подсчитать ячейки, используя Горяева и Ресуспензируйте 1 х 106 клеток / 100 µL минимальным DMEM.
- С помощью шприца инсулина (игла сметы 1/2), медленно придать 100 мкл суспензии клеток опухоли молочной железы жировых отложений номер 4 8-недельных женские мышей дикого типа FVB/N.
- Контролировать опухоль начала при пальпации (появляются после приблизительно 2-3 недели), рост (визуальные) и мышь хит (визуально) каждый день.
- Измерение размеров опухоли один раз в неделю, при помощи штангенциркуля и определить объемы опухоли с помощью уравнения:
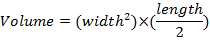
3. зонд поставка в естественных условиях функциональных измерений
- Использование твердых линк-BuO зонд (протокол I) для ро2 измерений в модели ортотопическая опухоли путем имплантации опухолевых клеток с внутренним линк-BuO микрокристаллов ранее описанных14,21 и подробно ниже.
- В случае опухоли модель MET-1, для интернализации линк-BuO микрокристаллы в МЕТРОПОЛИТЭН-1 клетки приостановить линк-BuO микрокристаллы в среде DMEM в концентрации 20 мг/мл и sonicate с sonicator зонд на 20 кГц с использованием 7 Вт мощности в 5-мл стеклянной трубки раунд снизу за 5 минут на льду.
- Добавьте 100 мкл (2 мг линк-BuO) подвески T75 флакон с 10 мл культуральных сред, содержащих MET-1 клетки (около 30% притока). Все процедуры проходят в кабинете биобезопасности и средства массовой информации содержит пенициллина и стрептомицина для сведения к минимуму потенциальной инфекции.
- Инкубировать клетки при 37 ° C за 72 ч или до тех пор, пока они достигают ~ 80% confluency.
- Аспирационная средств массовой информации. Вымойте клетки пять раз с 10 мл PBS. Отсоедините клетки с 5 мл трипсина ЭДТА. Соберите клетки. Центрифуги, как описано выше в шаге 2.2.4. Пятно образец клеток с красителем исключения для определения жизнеспособности клеток и количество.
- Приостановить клетки в концентрации 1 x 10-6 на 100 мкл минимальный DMEM.
- С помощью шприца инсулина, медленно вводить 100 мкл суспензии клеток, содержащих внутреннюю линк-BuO микрокристаллы в число 4 молочной жировых отложений из 8-week-old мышей дикого типа женского FVB/N как описано в шаге 2.2.5.
- Контролировать опухоль Воникновение и распространение, как описано в шагах 2.2.6 и 2.2.7.
- Использование твердых линк-BuO зонд (Протокол II) либо спонтанным или ортотопическая модели. Inject линк-OBu микрокристаллов на сайте интереса, например, в нормальных молочных желез или опухолях молочной, используя шприц инсулина.
- Растворимые зонды
- Анестезировать мышей при вдыхании воздуха изофлюрановая смеси (доставки 1,0 Л/мин и 2-3% изофлюрановая) с использованием анестезии машины и поместите их в разрыв ЭПР спектрометр.
- Настраивать инструмент, а затем придать NR (10-30 мкл, 10 мм), Надежда зонд (10−30 мкл, 0,5-2 мм) в солевой раствор, рН 7,2 или RSSR зонд в ДМСО (10 мкл, 10 мм) решения (и.т.).
4. в естественных условиях функциональных измерений
- Для ОРЭД Спектроскопические измерения, анестезировать мышей при вдыхании воздух изофлюрановая смеси с помощью анестезия машины, как описано в шаге 3.3.1.
- Выполнение функциональных измерений с использованием L-диапазона (1,2 ГГц) ЭПР спектрометр следующим образом.
- Поместите резонатор поверхности катушки на нормальной молочной железы или опухоль молочной железы и настраивать спектрометр.
- Приобрести спектрам ЭПР от имплантированных частиц зонд для 5−10 мин в течение нескольких недель после имплантации. В случае растворимых зонды приобрести спектрам ЭПР сразу же после введения зонда для 5-10 мин.
- Анализ спектров ЭПР NR зонда найти сверхтонкая, колки,Nи амплитуда сигнала, I(t). Преобразуйте значениеN в значение пэ-аша с помощью калибровочной кривой, полученной на шаге 1.2.4. Проанализировать скорость распада амплитуды сигнала I(t) как относительное изменение от первоначального амплитуды, I(t = 0), рассчитанного в произвольных единицах в секунду (s-1).
- Установите увеличение компонента monoradical спектра ЭПР GSH-чувствительных RSSR зонда для monoexponents для получения постоянной времени экспоненциального кинетики для расчета концентрации GSH.
- Соответствовать спектрам ЭПР высокой поле компонента многофункциональный Надежда зонда к экспериментальной, как описано в (шаг 1.4.5) для получения значений рН, pO2 и Пи.
5. Статистический анализ
- Выполните обработку данных и статистического анализа. Используйте тест корреляции r Пирсон (для нормально распределенных данных) и Спирмена в ранг порядок корреляции (для наборов данных с отклоненных нормальности распределения данных) для анализом корреляции.
Результаты
Ткани p O 2 Оценка с использованием линк BuO зондов:
С помощью процедуры, описанной в разделе Шаг 1.1, мы провели калибровка свежеприготовленные линк-BuO микрокристаллов подвеска.
Обсуждение
Представленные методы позволяют для неинвазивной в естественных условиях оценки критических параметров химического ТМЕ, а именно pO2, рН, окислительно-восстановительного состояния и концентрации интерстициальных Pi и внутриклеточного GSH. Магнитный резонанс методы, таки...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа частично поддерживается NIH предоставляет CA194013, CA192064 и U54GM104942. WVCTSI признается для запуска ВВК, AB, и TDE. Авторы благодарят за помощь с иллюстративным экспериментов доктор м. Gencheva и K. Steinberger. Содержание является исключительно ответственности авторов и не обязательно отражают официальную точку зрения NIH.
Материалы
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Ссылки
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены