Method Article
El cerebelo de ratón como modelo para el estudio de la neurogénesis embrionaria
En este artículo
Resumen
Este artículo demuestra cómo el cerebelo embrionarias de ratón se puede utilizar como un modelo para el estudio de la neurogénesis del desarrollo en tanto todo órgano y tejido sección preparados.
Resumen
El forebrain del embrión de ratón es el sistema más comúnmente empleado para el estudio de la neurogénesis mamífera durante el desarrollo. Sin embargo, el neuroepitelio de forebrain muy doblada no es susceptible de análisis wholemount para examinar patrones de neurogénesis todo el órgano. Además, la definición de los mecanismos de neurogénesis del cerebro anterior no es necesariamente predictivo de la neurogénesis en otras partes del cerebro; por ejemplo, debido a la presencia de subtipos específicos de forebrain progenitoras. El cerebelo del ratón ofrece un modelo alternativo para el estudio de la neurogénesis embrionaria que es susceptible de análisis wholemount, así como las secciones de tejido para observar la distribución espaciotemporal y el comportamiento de los progenitores neuronales. Por otra parte, es fácilmente disecada para otras aplicaciones posteriores, tales como análisis de aislamiento o de biología molecular de la célula. Como el cerebelo de ratón puede analizarse fácilmente en la gran cantidad de reportero de linaje celular y cepas de ratón mutante que se han convertido en disponibles, ofrece un modelo de gran alcance para estudiar los mecanismos celulares y moleculares de la neurogénesis del desarrollo en un mamífero organismo. Aquí, presentamos un método simple y rápido para usar el cerebelo de embriones de ratón para analizar comportamiento de mamíferos progenitoras neurales (NPC) de la célula en las preparaciones wholemount y las secciones de tejido.
Introducción
Durante el desarrollo embrionario de mamífero, PNJ se divide en ventricular (VZ) las zonas subventricular (SVZ) el neuroepitelio expansión para generar nuevas neuronas en un proceso denominado 'neurogénesis'. La generación de nuevas neuronas y sus precursores NPC se ha investigado extensivamente en el forebrain1, mientras que poco se sabe sobre este proceso en otras regiones.
El prosencéfalo es una estructura compleja e intrincadamente plegada que se estudia en gran parte con los métodos histológicos después de seccionar el tejido, que hace difícil comprender los patrones de la neurogénesis en el órgano entero. Además, estudios de la neurogénesis del cerebro anterior no son necesariamente predictivos del comportamiento neurogénico en otras regiones cerebrales o en la médula espinal. Por ejemplo, señalización señales pueden provocar respuestas diferentes en regiones distintas de la CNS, como se observa en el caso de factor neurotrófico ciliar y factor inhibidor de leucemia, que promover la renovación de uno mismo de NPCs en la eminencia ganglionar lateral, pero en coche diferenciación de progenitores de médula espinal2. Además, una sub-clase de NPCs que pueblan el cerebro anterior en desarrollo y contribuir significativamente a la expansión de la corteza cerebral1 están ausentes desde el cerebelo y la médula espinal3. Inversamente, es concebible que la médula espinal y cerebelo contienen alternativos subtipos NPC no está presentes en la corteza.
El cerebelo de embrión de ratón es la región más viejo evolutiva del cerebro mamífero y genera el cerebelo y el tronco encefálico. A pesar de su conservación a través de especie, relativamente poco se sabe sobre neurogénesis del cerebelo, incluyendo subtipos NPC o su Reglamento. La mayoría de las investigaciones de cerebelo en el ratón se ha centrado en el proceso de segmentación del tejido, impulsado por Hox genes4y el patrón de neuronas poste-mitotic5. Además, el cerebelo se ha utilizado como modelo para el estudio de los mecanismos de angiogénesis del desarrollo6.
En contraste con el cerebelo del ratón, el cerebelo del pez cebra se ha utilizado extensivamente para seguir CPN diferenciación y progresión de linaje en organismos modelo vertebrados (p. ej.,7,8). El cerebelo de pollo también se ha empleado para el estudio de la neurogénesis durante el desarrollo de vertebrados (e.g.,9,10). Similar al pez cebra cerebelo11, el cerebelo de pollo puede ser vivo imagen para estudiar el comportamiento NPC y regulación en tiempo12. Análoga observación longitudinal por proyección de imagen de vivo no es actualmente posible en organismos mamíferos, porque se convierten en el útero. Por otra parte, dirigida manipulación a través de técnicas como electroporación puede aplicarse fácilmente en embriones de pez cebra de vida libre o chick embriones de ovo (p. ej.,13), pero estas técnicas son también más complicado en la el útero.
Sin embargo, el cerebelo de embrión de ratón es exquisitamente adecuado para definir los mecanismos moleculares y celulares que regulan la neurogénesis. En primer lugar, análisis del cerebelo de ratón, en muchos casos, proporcionará información que es más relevante a la evolución de los seres humanos que la obtenida a través del estudio de vertebrados inferiores. Además, está disponible en un gran número de cepas de ratón genéticamente modificado que puede bien usarse para destino mapeo NPCs murinos o alterar mecanismos reguladores con alelos del mutante constitutivos o condicionales de los genes relevantes. Por último, se ha demostrado recientemente eso microinyección del hindbrain ventricular progenitores ex vivo permite al menos un breve examen del hindbrain NPC cinética14. Sin embargo, en la actualidad, se conoce muy poco sobre la organización espacio-temporal y comportamiento de los NPCs de cerebelo en un contexto de órgano entero.
Aquí, demostramos un método simple y rápido para usar el cerebelo como un poderoso modelo para analizar comportamiento NPC mamífero en preparaciones de wholemount y las secciones de tejido. Además ofrecemos protocolos para usar inmunomarcación para estudiar parámetros diferentes de la neurogénesis y a muestras de cerebelo de proceso adicional para aplicaciones moleculares posteriores tales como la transcriptasa inversa cuantitativa (qRT)-polimerización en cadena.
Protocolo
Todos los trabajos de animales se realizan según UK Home Office y directrices éticas locales.
1. Resumen de pasos y tiempo
- Realizar cruzamientos programado de ratones adultos de una cepa adecuada responder a la pregunta biológica bajo investigación para obtener embarazos de 9,5-e13.5 día embrionario (e); requiere 12-15 días.
- Opcionalmente, preparar 5-bromo-2'-desoxiuridina (BrdU) / solución 5-ethynyl-2'-desoxiuridina (EdU) y realizar la inyección (Protocolo, artículo 2); requiere ~ 1 h al día antes o el día de aislamiento de embriones, dependiendo de la longitud deseada de etiquetado EdU/BrdU.
- Realizar disección de embriones aislamiento y cerebelo (Protocolo, artículo 3); requiere ~ 10 min/embrión.
- Realizar inmunofluorescencia wholemount etiquetado (Protocolo de la sección 4); requiere de 3 días.
- Sección con un vibratome y cabo flotante inmunofluorescencia sección etiquetado (artículo 4 del Protocolo): requiere 2 días.
- Sección utilizando un criostato y realizar inmunofluorescencia etiquetado de cryosections (Protocolo, artículo 5); requiere de 2 días.
2. inyectar el ratón hembra embarazado con BrdU o EdU (opcional)
- Disolver BrdU o EdU en tampón de fosfato estéril salino (PBS) a concentraciones de 10 mg/mL y 1 mg/mL, respectivamente.
PRECAUCIÓN: BrdU y EdU son tóxicos; usar protección adecuada. - Pesar el ratón embarazado y calcular el volumen de solución BrdU o EdU que debe administrarse para llegar a 100 mg/kg BrdU o 5 mg/kg EdU.
- Inyectar la solución BrdU o EdU por vía intraperitoneal o 1 h o 1 día antes de recoger los embriones, dependiendo de la longitud necesaria de la etiqueta.
Nota: Etiquetado para 1 h visualiza las células del cerebelo en fase S. Etiquetado para el día 1 visualiza la progenie de hindbrain NPCs.
3. disección de Hindbrains de e9.5 - e13.5 embriones de ratón
- Eutanasia de un ratón hembra embarazada tiempo usando un procedimiento éticamente aprobado en la etapa gestacional requiere (p. ej., la dislocación cervical). Utilizando unas tijeras afiladas, abrir la cavidad peritoneal y suprimir cuidadosamente el útero. Lugar del suprimido útero que contiene los embriones en un plato de plástico de 60 mm que contiene 20 mL PBS helado.
Nota: No se requiere una técnica aséptica. - Realizar la disección más todos usando un microscopio de disección. Utilizando el número 5 de pinzas de relojero, romper la pared del músculo uterino para exponer los embriones, liberar cada embrión por cortar el cordón umbilical y quitar el saco vitelino.
- Utilizando una pipeta Pasteur estéril con un agujero en todo el apertura, transferir cada embrión en un plato plástico con PBS helado.
- Utilizando pinzas de relojero número 55, cortar la cabeza (Figura 1E).
- Opcionalmente, conservan un pequeño trozo de tejido (p. ej., 1/4 de un saco vitelino o punta de la cola de aproximadamente 2 mm) para el aislamiento de ADN genómico y posterior genotipado.
- Utilizando pinzas de relojero número 55, suprimir el tejido que contiene el cerebelo paralelo a e inmediatamente por debajo del neuroepitelio del cerebelo para separarlo del tejido facial y del cerebro anterior (Figura 1F).
- Coloque el lado dorsal caudal cabeza tejido y cerebelo hacia arriba e identificar el ventrículoth 4, que está cubierto por una capa de tejido delgado (placa del techo). Cuidadosamente perforar la placa del techo utilizando pinzas de relojero número 55 (figura 1) y pelar lejos exceso de tejido con pinzas, mover rostral a lo largo de la línea media sobre el cerebro medio y luego caudalmente sobre el posterior cerebelo y médula espinal (figura 1 ); el cerebelo se expondrá ahora en una preparación de libro abierto (figura 1 H).
- Preparar hindbrains wholemount inmunomarcación (opción 1).
- Con el número 55 de pinzas de relojero, tease cuidadosamente lejos mesenchyme cabeza restante y cualquier meninges atados por un lado pial del cerebelo usando fórceps (figura 1I). Retire el midbrain y el tejido de la médula espinal (Figura 1J) para dejar sólo el tejido del cerebelo (figura 1 K).
Nota: Este paso del procedimiento debe no ser seguido en e9.5 o e10.5, porque intentar hacerlo probablemente dañaría el neuroepitelio del cerebelo; por otra parte, quitando las meninges no es esencial porque el neuroepitelio del cerebelo es suficientemente fina en esta etapa para permitir la penetración eficiente de anticuerpos de inmunomarcación. Este paso debe, sin embargo, seguir de e11.5, cuando se consolida el tejido meníngeo, para mejorar la penetración del anticuerpo en el neuroepitelio del cerebelo. La disección es más fácil cuando se realiza en helada PBS (PBS limpio de uso para cada cerebelo).
- Con el número 55 de pinzas de relojero, tease cuidadosamente lejos mesenchyme cabeza restante y cualquier meninges atados por un lado pial del cerebelo usando fórceps (figura 1I). Retire el midbrain y el tejido de la médula espinal (Figura 1J) para dejar sólo el tejido del cerebelo (figura 1 K).
- Preparar hindbrains vibratome y cryosectioning (opción 2)
- Utilizando pinzas de relojero número 55, retire el midbrain y el tejido de la médula espinal (Figura 1J).
Nota: No es necesario sacar mesenchyme y meninges de hindbrains destinados a seccionar (como se muestra en la figura 1I).
- Utilizando pinzas de relojero número 55, retire el midbrain y el tejido de la médula espinal (Figura 1J).
- Hindbrains de transferencia desde el plato de plástico para tubos de fondo redondo de 2 mL con una pipeta Pasteur, aspirar todo PBS y fijar por 2 h a 4° C con suave agitación en recién descongelado formaldehído de w/v 4% disuelta en PBS.
PRECAUCIÓN: El formaldehído es tóxico; usar protección adecuada. - Enjuague hindbrains x 3 veces con PBS. Almacenar a 4 ° C en PBS si inmunomarcación, comienzan en 2-3 días o reemplazará PBS con 50% methanol/50% PBS durante 5 minutos antes de transferirlas al 100% metanol para un almacenaje más largo a-20° C.
4. Wholemount inmunofluorescencia
- Si es necesario, rehidratar hindbrains en la disminución en serie de diluciones de metanol en PBS (p. ej., 75% de metanol, metanol 50%, 25% metanol) a temperatura ambiente (RT) por 5 min y luego se transfieren a PBS.
Nota: Una serie gradual de metanol es necesaria rehidratar hindbrains suavemente y garantizar la preservación de tejido apropiado. - Permeabilizar hindbrains durante 30 min a 4 ° C en PBS con un 0.1% Tritón X-100 (PBT) con agitación suave.
- Incubar hindbrains por 1 h a 4 ° C en PBT conteniendo suero de cabra inactivadas por calor de 10% con agitación suave.
Nota: Use el suero de la especie que se han planteado los anticuerpos secundarios en. Anticuerpos primarios en cabra, incubar en suero proteína cuadra, por ejemplo 5% albúmina de suero bovino en PBS o en una alternativa comercial adecuada (véase Tabla de materiales). Esto reducirá no específicos de tinción observada con frecuencia al usar anticuerpos primarios en cabra. - Incubar hindbrains durante la noche a 4 ° C en PBT con 1% de suero inactivado con calor y anticuerpos primarios con agitación suave (por ejemplo, las histonas rabbit anti-phospho H3 [pHH3] diluido 1: 400).
Nota: Para anticuerpos primarios en cabra, utilice PBT sin suero. - Lavar las hindbrains a 4 ° C 5 x con PBT para 1 h.
- Incubar hindbrains durante la noche a 4 ° C en PBT conteniendo apropiados fluoróforo secundarios anticuerpos conjugados (por ejemplo, cabra anti-conejo Alexa Fluor 488) a 1: 200 en PBT dirigida contra los anticuerpos primarios utilizados. Evitar que hindbrains en la oscuridad aquí proteger fluoróforos de fotoblanqueo.
Nota: Para anticuerpos primarios en cabra, utilice cabras contra fragmentos Fab de anticuerpos secundarios para reducir la tinción inespecífica. - Lavar las hindbrains a 4 ° C 5 x con PBT para 1 h.
- Sufijo hindbrains en formaldehído al 4% en PBS durante 15 min a temperatura ambiente para la preservación a largo plazo de la Unión de anticuerpos. Enjuague dos veces en PBS.
- Cubrir un portaobjetos de vidrio con dos capas de cinta aislante negra y suprimir una plaza pequeña de la cinta de capas para crear un bolsillo lo suficientemente grande para un cerebelo.
- Transferir cada cerebelo en un bolsillo con una pipeta Pasteur, eliminar el exceso de líquido y añadir un reactivo apropiado antifade al bolsillo antes cubriendo lentamente con un cubreobjetos de vidrio para evitar burbujas de aire captura bajo el cubreobjetos. Sellar el cubreobjetos y añadir a la diapositiva con una fina capa de esmalte de uñas. Almacenar diapositivas a 4 ° C en la oscuridad hasta la adquisición de la imagen (artículo 7 del Protocolo).
5. Vibratome seccionamiento y flotantes sección inmunofluorescencia
- Si es necesario, rehidratar hindbrains de metanol como se describe en el paso 4.1.
- Insertar hindbrains en fundido 3% w/v agarosa al agua destilada.
Nota: Deje la agarosa fundida se enfríe a 55° C aproximadamente brevemente antes de incrustar para evitar daños al cerebelo. - Cortar secciones de cerebelo transversal con un grosor de 70 μm con un vibratome. Transferir cada sección recién cortada con un pincel en un pocillo de una placa de 24 pocillos con PBS helado.
- Las secciones flotantes de la etiqueta como se describe en pasos 4.2-4.7, pero modifique los pasos como sigue: lavar la flotación de las secciones a 4 ° C x 3 con PBT de 15 minutos cada uno, disminuir el tiempo de incubación para los anticuerpos secundarios a 2 h e incubar en anticuerpo secundario a TA.
- Opcionalmente, después de etiquetar con anticuerpos para otros epitopos como se describe en el paso 5.4, detectar núcleos de EdU+ con un EdU etiquetado kit según las instrucciones del fabricante. Incubar las secciones flotantes en la reacción cóctel durante 30 min a 37 ° C en la oscuridad. Cerebelo lavado secciones a 4 ° C x 3 con PBT de 15 minutos cada uno.
- Opcionalmente, después de etiquetar para otros epitopos como se describe en el paso 5.4, detectar núcleos de BrdU+ como sigue.
- Incubar las secciones flotantes en ácido clorhídrico de 2 N a 37 ° C por 30 min en la oscuridad.
- Incubar las secciones flotantes en tampón de borato de sodio 0,1 M pH 8.5 dos veces por 5 min a temperatura ambiente en la oscuridad para neutralizar el ácido clorhídrico.
- Lávese flotante las secciones 3 x brevemente en PBS a 4 ° C.
- Realizar inmunofluorescencia etiquetado de BrdU como se describe en el paso 5.4.
- Incubar las secciones flotantes por 2 min a temperatura ambiente en 10 μg/mL 4', diclorhidrato 6-diamidino-2-phenylindole (DAPI) en PBS a contratinción núcleos celulares.
- Postfix las secciones flotantes en formaldehído al 4% durante 15 min a TA.
- Lávese las secciones flotantes brevemente en PBS. Cuidadosamente transfiera secciones flotantes a un portaobjetos de vidrio con un pincel. Eliminar exceso PBS alrededor de la sección usando papel secante.
- Monte las secciones usando glicerol 80% en PBS y lentamente con un cubreobjetos de vidrio para evitar burbujas de aire captura. Almacenar diapositivas a 4 ° C en la oscuridad hasta la adquisición de la imagen (paso 7).
6. criostato de seccionamiento y criosección inmunofluorescencia etiquetado
- Si es necesario, rehidratar hindbrains de metanol como se describe en el paso 4.1.
- Incubar hindbrains en sacarosa 30% p/v en PBS a cryoprotect hindbrains antes de la congelación.
Nota: Hindbrains están listos para congelar cuando han hundido hasta el fondo del tubo, que por lo general toma ≤ 2 h e9.5-10.5 hindbrains y 3-6 h en e11.5-13.5 hindbrains. - Sumerja el hindbrains en la temperatura de corte óptico compuesto (OCT) y congelar rápidamente mediante la transferencia de moldes que contienen hindbrains en OCT a isopentano enfriado a entre-40 ° C y -50 ° C en hielo seco.
Nota: Hindbrains congelados, integrados pueden almacenarse a-20 ° C a corto plazo y a largo plazo-80 ° C hasta el seccionamiento. - Cortar secciones de cerebelo transversal con un grosor de 10 μm con un criostato y la transferencia a microscopio electrostático adhesivo.
Nota: Cerebelo cryosections pueden almacenarse a-20 ° C a corto plazo y a largo plazo-80 ° C hasta el etiquetado. - Incube los portaobjetos a TA por 15 min para secar las secciones a las diapositivas. Lavar cryosections con PBS disolver OCT y marca una barrera hidrofóbica alrededor cryosections usando una pluma PAP. Repita los pasos 5.4-5.8.
- Repita el paso 5.10 con un medio de montaje con base de alcohol polivinílico en lugar de glicerol.
7. adquisición de la imagen
- Muestras de la imagen utilizando una epifluorescente o un microscopio confocal de escaneo láser equipada con lentes adecuadas para diapositivas montado en medios acuosos y filtros ópticos adecuados para los fluoróforos utilizado para inmunomarcación.
- Para la imagen el cerebelo todo o una parte del cerebelo, utilizar una lente de 10 aumentos (p. ej., figura 2B); para visualizar las áreas hindbrains para la cuantificación, utilizar un 40 X magnificación (p. ej., Figura 2D) y para visualizar las células individuales, utilizar una lente con un aumento de 63 x (por ejemplo, figura 2).
8. otros métodos
- Siguiente paso 3.8, homogeneizar hindbrains interpretaciones para producir una suspensión unicelular por citometría de flujo aplicaciones15.
- Siguiente paso 3.8, homogeneizar interpretaciones hindbrains para extraer el RNA de suspensiones celulares solo para RT-qPCR (p. ej., 16).
Nota: Asegúrese de que todos los reactivos y equipos se mantienen estériles y libres de Rnasa a lo largo para evitar la degradación del ARN. - Siguiente paso 3.8, homogeneizar interpretaciones hindbrains para aislar NPCs y propagarlos en vitro como neuroesferas para análisis de hindbrain NPC comportamiento17.
Nota: Asegúrese de que todos los reactivos y equipos se mantienen estériles para prevenir la contaminación bacteriana/micótica de desarrolló culturas.
Resultados
Esta sección ilustra ejemplos de resultados que pueden obtenerse al estudiar la neurogénesis en el cerebelo embrionarias de ratón a través de análisis de la sección wholemount y tejido.
Mostramos inmunomarcación wholemount del cerebelo microdissected con un anticuerpo para el pHH3 de marcador mitótico visualiza dividiendo NPCs en VZ (figura 2B – D). Mostrar pHH3+ NPCs en un gran aumento para resaltar diferentes etapas de la mitosis (figura 2). Hemos ilustrado que este método de etiquetado es adecuado para llevar a cabo a través de varias etapas consecutivas de desarrollo del cerebelo para observar el curso temporal de la mitosis de la NPC en este órgano (Figura 2D).
Mostramos que imagen transversal immunolabeled vibratome secciones de cerebelo 1 h después de la inyección de EdU, visualiza la orientación escote de NPCs mitóticos (figura 3B), el patrón de migración nuclear seudoestratificado, interkinetic del ciclismo progenitores18 (figura 3B, D) y la estructura general de VZ (figura 3B – D). Tenga en cuenta que pHH3 mitótico+ NPCs están presentes sólo en la superficie ventricular y no más basally (figura 3), que contrasta el patrón de división basal de NPCs más comprometidos en el forebrain19.
También ilustramos cómo ciclo PNJs y su progenie diferenciada puede ser etiquetado con BrdU o EdU para evaluar progresión de linaje de CPN (figura 4). La inmunomarcación de cryosections transversal del cerebelo de ratón 1 día después de la inyección de BrdU BrdU y Ki67muestra el número y posicionamiento de ciclo PNJs en el neuroepitelio (Figura 4A, B), por el que el número de uno mismo-renovar NPCs puede ser definido por calcular el porcentaje de Ki67 BrdU+ + las células entre todas las células BrdU+ (Figura 4A, C).
Finalmente, mostramos un ejemplo de inmunomarcación de vibratome secciones de cerebelo de RC2, un antígeno en el filamento intermedio neuronal específica nestina, para visualizar NPC endfeet (figura 5B) y procesos (figura 5). Vibratome secciones, en lugar de cryosections delgada, permiten mayor observación de los PNJs muy ramificados y de estructura general neuroepiteliales.

Figura 1 : Pasos clave en la disección de un cerebelo de un embrión de ratón de e11.5. (A – D) Representación esquemática del microdissection del cerebelo. (A) el caudal cabeza tejido es removido por cortar a lo largo de la línea punteada roja. (B) la placa del techo está perforado y arrancado en dirección rostral y caudal a lo largo de la línea media (líneas rojas verticales) y luego lateralmente para revelar el neuroepitelio del cerebelo. (C) el neuroepitelio es apalancar a las meninges después de insertar el fórceps entre ambas estructuras, y los tejidos del mesencéfalo y la médula espinal son quitados por cortar el tejido con pinzas por la línea punteada roja. (D) este procedimiento produce un cerebelo aplanado. (E–K) Captura de la imagen de las etapas claves en el procedimiento de microdissection del cerebelo. (E) el embrión es decapitado por cortar a lo largo de la línea de puntos. (F) el cerebelo 4 ventrículoth , cerrado por la placa del techo, suprimido y son separadas de la cabeza por cortar a lo largo de la línea punteada. (G) el ventrículoth 4 está orientada hacia arriba antes de que se perfora un pequeño agujero en la placa del techo (asterisco). El agujero se ensancha por descamación del tejido cuidadosamente tanto rostral y caudalmente a lo largo de la línea media (flechas) para exponer el cerebelo. El cerebelo está colocado hacia pial abajo e izquierda para doblar hacia fuera en la preparación de un libro abierto (H; negro punta de flecha indica tejido neuronal del cerebelo). Si el cerebelo se requiere para wholemount inmunomarcación, se quita la membrana pial apalancando suavemente el neuroepitelio del cerebelo de las membranas meníngeas circundantes con unas pinzas (yo). El exceso de cerebro medio (mb) y la médula espinal (sc) el tejido es eliminadas (líneas punteadas en J) para aislar el cerebelo (K). Barra de escala: 500 μm para (E), 300 μm (F – K). Haga clic aquí para ver una versión más grande de esta figura.
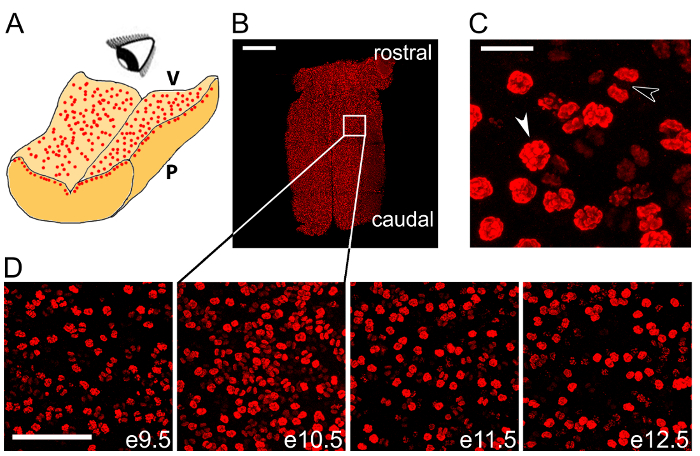
Figura 2 : Wholemount inmunomarcación puede utilizarse para cuantificar la mitosis NPC en el cerebelo. (A) diagrama esquemático ilustrando en enfrentar la proyección de imagen de NPCs mitóticas en la capa ventricular del cerebelo. V, lado ventricular hindbrain; P, lateral del cerebelo pial. (B) azulejo Confocal exploración z papeleria e10.5 cerebelo tras la inmunomarcación de wholemount para la pHH3 de marcador mitótico (rojo). El recuadro blanco indica la zona que se muestra a mayor aumento en el segundo panel en (D). (C) la anafase (flecha blanca) y la mitosis anafase (flecha negra) son distinguibles dentro de la cohorte total de mitotic NPCs. (D) curso del tiempo wholemount pHH3 etiquetado de e9.5-13.5. Barras de escala: 500 μm en (B); 20 μm (C); 100 μm en (D). Haga clic aquí para ver una versión más grande de esta figura.
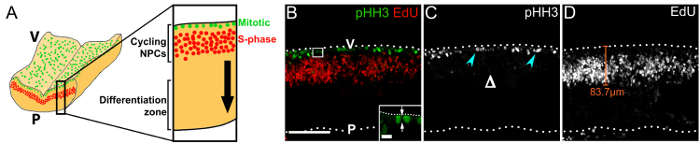
Figura 3 : Ciclo PNJs dentro de su zona germinal en el cerebelo rostral. (A) esquema que representa la posición de mitotic (verde) y NPCs de fase S (rojo) en la superficie ventricular del cerebelo y en la zona periventricular, respectivamente. Una sección virtual a través del cerebelo se muestra con un aumento superior a la derecha. La flecha negra indica la dirección de migración de la progenie NPC que ha cerrado el ciclo de la célula hacia la zona de diferenciación. Pila de z Confocal (B) de una sección de hindbrain e11.0 flotante de un embrión que recibe un 1 h EdU pulso; inmunomarcación para pHH3 y EdU fue utilizado para visualizar mitotic (verde) y NPCs de fase S (rojo), respectivamente. Superficies de cerebelo son denotadas por las líneas de puntos; V, lado ventricular hindbrain; P, lateral del cerebelo pial. La zona indicada por un cuadro blanco se muestra a mayor aumento en el margen; las flechas indican el plano de la hendidura de un NPC en la anafase, en relación con la superficie ventricular. (C) solo canal mostrando pHH3 inmunomarcación solamente. Mitótico CPN se indica mediante puntas de flecha de cian; Δ. (D) solo canal viendo EdU etiquetado sólo indica la falta de divisiones básicas. EdU+ NPCs adoptan una distribución seudoestratificada debido a su migración nuclear interkinetic. Se puede medir la distancia que NPCs migran de la superficie ventricular, como se indica con una línea naranja representante. Barras de escala: 100 μm (B -D); 10 μm en detalle en (B). Haga clic aquí para ver una versión más grande de esta figura.
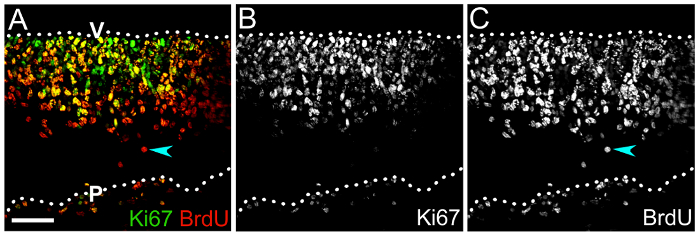
Figura 4 : BrdU combinando con Ki67 etiquetado para determinar capacidad de auto-renovación NPC hindbrain. (A) pila Confocal z de un e10.5 hindbrain criosección después de etiquetar para Ki67 (verde) y pulso de BrdU (rojo) después de un día 1 BrdU. Células doble positivas en la zona ventricular son NPCs que han incorporado BrdU y todavía se están moviendo a través del ciclo celular, como se indica en el etiquetado de Ki67. La proporción de células marcado con doble entre la población total de BrdU+ representa el porcentaje de renovado NPCs (B, C) solo canales con Ki67 (B) y la inmunomarcación de BrdU (C) solamente. Una célula de BrdU+ que carece de Ki67 y por lo tanto es probable que haya salido el ciclo celular se indica mediante una flecha cian en (A,C). Superficies de cerebelo son denotadas por las líneas de puntos; V, lado ventricular hindbrain; P, lateral del cerebelo pial. Barra de escala: 50 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 5 : Inmunomarcación nestina visualiza procesos NPC y endfeet. (A – C) Inmunofluorescencia para la RC2, que reconoce un epitopo en el filamento intermedio neuronal nestina, ilustra morfología NPC en el neuroepitelio del cerebelo. (A) pila de Confocal z de una sección flotante de un cerebelo de e11.5 siguiendo RC2 inmunomarcación; áreas en caja se muestran a mayor aumento en (B, B', región apical ventricular) y (C, C'; basal región). Superficies de cerebelo son denotadas por las líneas de puntos; V, lado ventricular hindbrain; P, lateral del cerebelo pial. (B, C) Pilas z confocal de zonas en caja (A); secciones ópticas solo se muestran en (B, C'), respectivamente. Una endfoot apical de NPC, anclado en la superficie ventricular está indicado por una flecha en (B'). Procesos NPC únicos y fasciculados se indican mediante puntas de flecha de blancos y negros en (C'), respectivamente. Barras de escala: 100 μm, (A); 25 μm (B, C). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe cómo utilizar el cerebelo embrionarias de ratón como modelo para estudiar los mecanismos de neurogénesis del desarrollo. Usando una variedad de métodos diferentes de inmunomarcación, cerebelo NPCs puede visualizarse y cuantificó su número en secciones del tejido fino u órgano wholemounts. La facilidad de disección y anatomía plana asegura que el cerebelo puede ser reflejado en una preparación 'libro abierto' para reunir información sobre los patrones de la neurogénesis de todo el órgano.
Además mostramos que morfología NPC y relacionadas con el ciclo celular CPN posicionamiento pueden ser fácilmente visualizados en flotantes- o cryosections del cerebelo. Ambos comportamientos pueden ser explotados para definir nuevas poblaciones progenitoras, como previamente se ha realizado en el telencéfalo mamíferos20. Por ejemplo, temprano formó Sox2+ neuroepithelia y Pax6+ apical glia radial están presentes en el cerebelo21,22, pero el cerebelo carece de progenitores basals Tbr2+ 3 .
El protocolo descrito aquí también puede adaptarse para observar el comportamiento de subpoblaciones específicas de NPC por etiquetado fluorescente para la proyección de imagen vivo o seguimiento de linaje en tejidos fijos. Esto puede lograrse, por ejemplo, mediante el estudio de hindbrains de ratones portando el transgén Sox1 iCreERT2 inducible por el tamoxifeno y el reportero Rosa26tdTomato del23.
Además de mejorar el conocimiento de la neurogénesis murina, estudiando el cerebelo puede dilucidar mecanismos neurogénicos ampliamente pertinentes que son compartidos entre especies, ya que el cerebelo es una región altamente conservada del cerebro que se espera que sea más similar entre las especies de vertebrados que el prosencéfalo.
Como neurogénesis cerebelo ocurre sobre una ventana de tiempo comparativamente más corta que el prosencéfalo neurogénesis23, es importante considerar la necesidad de comparar adecuadamente organizado embriones. Por consiguiente, sesgo experimental es evitado por contar y registrar el número de pares de la somite en un embrión antes de aislar su cerebelo. El propio tejido del cerebelo es frágil y fórceps deben por lo tanto, manejarse con cuidado al separar el tejido del cerebelo del mesénquima cabeza y meninges; un par de 'práctica corre' por lo tanto, podría ser aconsejable antes de la disección de embriones valiosos. Además, hindbrains deben ser transferidas de un tubo a otro utilizando una pipeta de Pasteur ancha en lugar de fórceps para evitar daños (abertura de la pipeta se puede dilatar por el corte de la punta con unas tijeras limpias). Por último, aunque sea infrecuente, el grado de EdU/BrdU incorporación a fase S NPCs puede ser variable, en particular durante pulsos cortos (es decir, 1 h). Para mejorar el etiquetado, asegurar que EdU/BrdU se disuelve correctamente antes de colocar la solución en la jeringa e inyecte cuidadosamente en la cavidad peritoneal. Inyecciones de pobres, como las realizadas por vía subcutánea por accidente, resultar en perder o atrapando la solución EdU/BrdU y evitar que entren en la circulación.
Divulgaciones
Ninguno de los autores tienen intereses en competencia o conflicto de intereses.
Agradecimientos
Agradecemos a Vasiliki Chantzara para llevar a cabo apareamientos programada y el personal de la unidad de recursos biológicos en el Instituto de Oftalmología de UCL para la cría de ratón. Este estudio fue apoyado por un Wellcome Trust investigador Award 095623/Z/11/Z a CR.
Materiales
| Name | Company | Catalog Number | Comments |
| Round-bottomed reagent tube, 2.0 ml (Safe-Lock) | VWR | 211-2120 | Also available from other commercial suppliers |
| Plastic cell culture dish, 60 mm | Thermo Fisher | 150288 | Also available from other commercial suppliers |
| Cell culture plates, 12-well | Thermo Fisher | 150628 | Also available from other commercial suppliers |
| Pasteur pipettes | Copan | 200C | Also available from other commercial suppliers |
| Dumont Watchmaker forceps, no. 5 | FST | 91150-20 | |
| Dumont Watchmaker forceps, no. 55 | FST | 11295-51 | |
| 29G needle/syringe | BD | BD Micro-Fine +1ml | |
| Anti-phospho-histone H3 primary antibody | Millipore | 06-570 | Goat, dilution 1:400 |
| Anti-BrdU primary antibody | Abcam | ab6326 | Rat, dilution 1:400 |
| Anti-Ki67 primary antibody | BD Biosciences | 550609 | Mouse, dilution 1:400 |
| Anti-RC2 primary antibody | Developmental Studies Hybridoma Bank | RC2 | Mouse (IgM), dilution 1:400 |
| Alexa Fluor 488-conjugated goat anti rabbit secondary antibody | Thermo Fisher | A11029 | Dilution 1:200 |
| Alexa Fluor 594-conjugated goat anti rabbit secondary antibody | Thermo Fisher | A11037 | Dilution 1:200 |
| Alexa Fluor 488-conjugated goat anti mouse IgM secondary antibody | Thermo Fisher | A21042 | Dilution 1:200 |
| Alexa Fluor 488-conjugated goat anti mouse secondary antibody | Thermo Fisher | A11001 | Dilution 1:200 |
| Alexa Fluor 594-conjugated goat anti rat secondary antibody | Thermo Fisher | A11007 | Dilution 1:200 |
| 4',6-Diamidino-2-Phenylindole, Dihydrochloride (DAPI) | Sigma | D9542 | Use at 10 μg per mL |
| 5-ethynyl-2’-deoxyuridine (EdU) | Sigma | 900584 | |
| 5-bromo-2´-deoxyuridine (BrdU) | Sigma | B5002 | |
| Click-iT EdU Alexa Fluor 594 Imaging Kit | Thermo Fisher | C10086 | |
| Heat-inactivated goat serum | Sigma | G9023 | |
| Bovine serum albumin | Sigma | A7906 | |
| DAKO protein-block serum free | Agilent | X0909 | |
| Triton X-100 | Sigma | T8787 | Also available from other commercial suppliers |
| Phosphate buffer saline | Sigma | P4417 | Also available from other commercial suppliers |
| Paraformaldehyde | Sigma | P6148 | Also available from other commercial suppliers |
| Sodium tetraborate | Sigma | B9876 | Also available from other commercial suppliers |
| Sucrose | Sigma | S0389 | Also available from other commercial suppliers |
| Agarose | Sigma | A9539 | Also available from other commercial suppliers |
| Super PAP pen liquid blocker | Ted Pella, Inc. | 22309 | |
| SlowFade Antifade Kit | Thermo Fisher | S-2828 | |
| Glycerol | Fisher Scientific | 10337700 | |
| Mowiol | Millipore | 475904 | |
| OCT | Scigen | 4583 | Also available from other commercial suppliers |
| Isopentane | Sigma | M32631 | Also available from other commercial suppliers |
| Methanol | Thermo Fisher | 10675112 | Also available from other commercial suppliers |
| Hydrochloric acid | Thermo Fisher | 10316380 | Also available from other commercial suppliers |
| Microscope slides | VWR | 631-0912 | |
| Superfrost microscope slides | VWR | 631-0108 | |
| Thermometer | VWR | 620-0858 | |
| Cover glass | VWR | 631-0137 | |
| Stereo Microscope, Leica MZ16 | Leica | not applicable | |
| Confocal laser scanning microscope LSM710 | Zeiss | not applicable |
Referencias
- Wilsch-Brauninger, M., Florio, M., Huttner, W. B. Neocortex expansion in development and evolution - from cell biology to single genes. Curr Opin Neurobiol. 39, 122-132 (2016).
- Gregg, C., Weiss, S. CNTF/LIF/gp130 receptor complex signaling maintains a VZ precursor differentiation gradient in the developing ventral forebrain. Development. 132 (3), 565-578 (2005).
- Kwon, G. S., Hadjantonakis, A. K. Eomes::GFP-a tool for live imaging cells of the trophoblast, primitive streak, and telencephalon in the mouse embryo. Genesis. 45 (4), 208-217 (2007).
- Krumlauf, R. Hox Genes and the Hindbrain: A Study in Segments. Curr Top Dev Biol. 116, 581-596 (2016).
- Guthrie, S. Patterning and axon guidance of cranial motor neurons. Nat Rev Neurosci. 8 (11), 859-871 (2007).
- Fantin, A., Vieira, J. M., Plein, A., Maden, C. H., Ruhrberg, C. The embryonic mouse hindbrain as a qualitative and quantitative model for studying the molecular and cellular mechanisms of angiogenesis. Nat Protoc. 8 (2), 418-429 (2013).
- Terriente, J., Gerety, S. S., Watanabe-Asaka, T., Gonzalez-Quevedo, R., Wilkinson, D. G. Signalling from hindbrain boundaries regulates neuronal clustering that patterns neurogenesis. Development. 139 (16), 2978-2987 (2012).
- Coolen, M., Thieffry, D., Drivenes, O., Becker, T. S., Bally-Cuif, L. miR-9 controls the timing of neurogenesis through the direct inhibition of antagonistic factors. Dev Cell. 22 (5), 1052-1064 (2012).
- Dias, J. M., Alekseenko, Z., Applequist, J. M., Ericson, J. Tgfbeta signaling regulates temporal neurogenesis and potency of neural stem cells in the CNS. Neuron. 84 (5), 927-939 (2014).
- Jacob, J., et al. Retinoid acid specifies neuronal identity through graded expression of Ascl1. Curr Biol. 23 (5), 412-418 (2013).
- Alexandre, P., Reugels, A. M., Barker, D., Blanc, E., Clarke, J. D. Neurons derive from the more apical daughter in asymmetric divisions in the zebrafish neural tube. Nat Neurosci. 13 (6), 673-679 (2010).
- Peretz, Y., et al. A new role of hindbrain boundaries as pools of neural stem/progenitor cells regulated by Sox2. BMC Biol. 14, 57 (2016).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. J Vis Exp. (26), (2009).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nat Neurosci. 15 (2), 329-337 (2011).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Hutton, S. R., Pevny, L. H. SOX2 expression levels distinguish between neural progenitor populations of the developing dorsal telencephalon. Dev Biol. 352 (1), 40-47 (2011).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing embryonic mouse neural stem cell culture using the neurosphere assay. J Vis Exp. (47), (2011).
- Sauer, F. Mitosis in the neural tube. The Journal of Comparative Neurology. 62 (2), 377-405 (1935).
- Sessa, A., Mao, C. A., Hadjantonakis, A. K., Klein, W. H., Broccoli, V. Tbr2 directs conversion of radial glia into basal precursors and guides neuronal amplification by indirect neurogenesis in the developing neocortex. Neuron. 60 (1), 56-69 (2008).
- Pilz, G. A., et al. Amplification of progenitors in the mammalian telencephalon includes a new radial glial cell type. Nat Commun. 4, 2125 (2013).
- Fantin, A., et al. Tissue macrophages act as cellular chaperones for vascular anastomosis downstream of VEGF-mediated endothelial tip cell induction. Blood. 116 (5), 829-840 (2010).
- Kayam, G., et al. A novel role for Pax6 in the segmental organization of the hindbrain. Development. 140 (10), 2190-2202 (2013).
- Tata, M., et al. Regulation of embryonic neurogenesis by germinal zone vasculature. Proc Natl Acad Sci U S A. 113 (47), 13414-13419 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados