Method Article
Le rhombencéphale de souris comme un modèle pour étudier la neurogenèse embryonnaire
Dans cet article
Résumé
Cet article explique comment le cerveau postérieur embryonnaires de souris peut servir comme modèle pour étudier la neurogenèse du développement dans les organes entiers et préparations de section de tissu.
Résumé
Le cerveau d’embryons de souris est le système le plus couramment utilisé pour étudier la neurogenèse chez les mammifères au cours du développement. Toutefois, le neuroépithélium prosencéphale fortement pliée n’est pas prête à l’analyse wholemount pour examiner les modèles de la neurogenèse de l’orgue à l’échelle. Par ailleurs, définir les mécanismes de la neurogenèse du cerveau antérieur n’est pas forcément prédictif de la neurogenèse dans d’autres parties du cerveau ; par exemple, en raison de la présence des sous-types spécifiques du prosencéphale progénitrices. Le rhombencéphale souris propose un modèle alternatif pour l’étude de la neurogenèse embryonnaire qui se prête à l’analyse de wholemount, ainsi que des sections de tissu d’observer la distribution spatio-temporelle et le comportement des cellules souches neurales. En outre, il est disséqué facilement pour d’autres applications en aval, telles que l’analyse isolément ou en biologie moléculaire de cellules. Comme le cerveau postérieur de souris peut être facilement analysé dans la multitude de journaliste de lignée cellulaire et des lignées de souris mutantes qui sont apparues, il offre un modèle puissant pour étudier les mécanismes cellulaires et moléculaires du développement neurogenèse chez un mammifère organisme. Nous présentons ici une méthode simple et rapide pour utiliser le rhombencéphale d’embryon de souris pour analyser le comportement cellulaire (NPC) mammifères progénitrices neurales dans les préparations de wholemount et de coupes de tissus.
Introduction
Au cours du développement embryonnaire chez les mammifères, PNJs divisent sous-ventriculaire (SVZ) zones du neuroépithélium en expansion et ventriculaire (VZ) pour générer de nouveaux neurones dans un processus appelé « neurogenèse ». La génération de nouveaux neurones et de leurs précurseurs NPC a étudié intensivement dans le prosencéphale1, alors qu’on connaît moins ce processus dans d’autres régions.
Le cerveau antérieur est une structure complexe et finement plissée qui est largement étudiée avec des méthodes histologiques après découpe de tissu, qui rend compréhension neurogenèse modèles à travers l’organe entier difficiles. En outre, les études de la neurogenèse du cerveau ne sont pas forcément prédictifs du comportement neurogène dans d’autres régions du cerveau ou la moelle épinière. Par exemple, signalisation repères peuvent provoquer des réponses différentes régions distinctes du CNS, tel qu’observé dans le cas du facteur neurotrophique ciliaire et facteur inhibiteur de leucémie, qui favorisent l’auto-renouvellement de PNJ dans l’éminence ganglionnaire latéral, mais le lecteur différenciation des cellules souches de la moelle épinière2. En outre, une sous-classe de PNJs qui peuplent le cerveau en développement et contribuent largement à l’expansion du cortex cérébral1 sont absents du cerveau postérieur et la moelle épinière3. Inversement, il est concevable que la moelle épinière et le cerveau postérieur contiennent les autres sous-types NPC non présents dans le cortex.
Le rhombencéphale d’embryon de souris est la plus ancienne région évolutive du cerveau chez les mammifères et génère le cervelet et le tronc cérébral. En dépit de sa conservation à travers les espèces, relativement est méconnu la neurogenèse du cerveau postérieur, y compris les sous-types de PNJ ou de leur règlement. La plupart des recherches de cerveau postérieur chez la souris a mis l’accent sur le processus de segmentation des tissus, pilotée par Hox gènes4et la structuration des neurones post-mitotiques5. En outre, le cerveau postérieur a servi comme modèle pour étudier les mécanismes d’angiogenèse développementale6.
Contraste avec le postérieur de la souris, le poisson-zèbre hindbrain a été largement utilisé pour suivre la différenciation NPC et la progression de la lignée dans un organisme modèle vertébrés (p. ex.,7,8). Le rhombencéphale poussin a aussi été employé pour étudier la neurogenèse au cours du développement des vertébrés (p. ex.,9,10). Comme pour le poisson-zèbre hindbrain11, le rhombencéphale poussin peut être direct imagés pour étudier le comportement NPC et la réglementation au fil du temps,12. Analogue observation longitudinale par imagerie live n’est pas actuellement possible chez les organismes mammifères, parce qu’ils se développent in utero. En outre, ciblées manipulation au moyen de techniques telles qu’électroporation peut s’appliquer facilement à des embryons de poisson-zèbre libres ou poussin embryons dans ovo (p. ex.,13), mais ces techniques sont également plus difficiles dans utero.
Néanmoins, le rhombencéphale d’embryon de souris est extraordinairement adapté pour définir les mécanismes moléculaires et cellulaires qui gouvernent la neurogenèse. Tout d’abord, analyse du rhombencéphale de souris, dans bien des cas, fournira des informations plus pertinentes à l’évolution de l’être humain que celle obtenue grâce à l’étude des vertébrés inférieurs. En outre, il existe un grand nombre de lignées de souris génétiquement modifiées que peuvent être utilisés pour sort PNJs murins de cartographie ou d’altérer les mécanismes de régulation avec des allèles mutants constitutives ou conditionnelles des gènes concernés. Enfin, il a récemment été démontré que la microinjection de ventriculaire postérieur progéniteurs ex vivo permet au moins un bref examen du rhombencéphale NPC cinétique14. Pourtant, à l’heure actuelle, très peu est connu sur l’organisation spatio-temporelle et le comportement du cerveau postérieur PNJs dans un contexte d’organes entiers.
Ici, nous démontrons une méthode simple et rapide pour utiliser le cerveau postérieur comme un puissant modèle pour analyser le comportement NPC mammifères dans les préparations de wholemount et de coupes de tissus. Nous fournissons également des protocoles pour utiliser immunomarquage pour l’étude des paramètres différents de la neurogenèse et processus postérieur des échantillons supplémentaires pour des applications moléculaires en aval comme la transcriptase inverse quantitative (qRT)-PCR.
Protocole
Tous les travaux d’animaux a été effectuée conformément aux UK Home Office et les directives éthiques locales.
1. Sommaire des étapes et calendrier
- Effectuer les accouplements chronométré de souris adultes provenant d’une souche apte à répondre à la question biologique incriminé afin d’obtenir des grossesses de jour embryonnaire (e) de 9,5-e13.5 ; Il faut 12 à 15 jours.
- Vous pouvez également préparer 5-bromo-2'-deoxyuridine (BrdU) / 5-éthynyl-2'-déoxyuridine (EdU) solution et effectuer l’injection (protocole section 2) ; nécessite ~ 1 h la veille ou le jour de l’isolement de l’embryon, selon la longueur désirée de EdU/BrdU étiquetage.
- Réaliser la dissection d’isolement et rhombencéphale embryon (protocole section 3) ; nécessite ~ 10 min/embryon.
- Exécuter wholemount immunofluorescence labeling (protocole section 4) ; Il faut 3 jours.
- L’article à l’aide d’un vibratome et effectuer flottant immunofluorescence section étiquetage (protocole 4 de l’article) : il faut 2 jours.
- L’article à l’aide d’un cryostat et effectuer l’immunofluorescence labeling des cryosections (protocole, article 5) ; Il faut 2 jours.
2. injecter des souris femelles enceintes avec BrdU ou EdU (facultatif)
- Dissoudre BrdU ou EdU dans salin stérile tamponnée au phosphate (PBS) à des concentrations de 10 mg/mL et 1 mg/mL, respectivement.
ATTENTION : BrdU et EdU sont toxiques ; porter une protection appropriée. - Peser la souris enceinte et calculer le volume de solution BrdU ou EdU qui doit être administré pour atteindre 100 mg/kg BrdU ou 5 mg/kg EdU.
- Injecter la solution BrdU ou EdU par voie intrapéritonéale soit 1 h ou 1 jour avant la collecte des embryons, selon la longueur requise de l’étiquetage.
NOTE : Étiquetage pendant 1 h visualise les cellules du cerveau postérieur en phase S. Étiquetage pour 1 jour visualise la progéniture du rhombencéphale PNJs.
3. dissection de Hindbrains de e9.5 - e13.5 des embryons de souris
- Euthanasier une souris femelle chronométré-enceintes utilisant une méthode éthiquement approuvée au stade de la gestation nécessaire (p. ex., dislocation cervicale). À l’aide de ciseaux pointus, fend la cavité péritonéale et soigneusement d’accise l’utérus. Placez l’utérus excisés contenant les embryons dans un plat en plastique 60 mm contenant 20 mL de PBS glacée.
Nota : Une technique aseptique n’est pas exigée. - Effectuer toute dissection supplémentaire à l’aide d’un microscope à dissection. À l’aide d’horloger numéro 5 de la pince, déchirer la paroi du muscle utérin pour exposer les embryons, de libérer chaque embryon en coupant le cordon ombilical et de retirer le sac vitellin.
- À l’aide d’une pipette Pasteur stérile avec un Canon large ouverture, transférer chaque embryon dans une boite plastique avec du PBS glacée.
- En utilisant horloger forceps numéro 55, trancher la tête (Figure 1E).
- Éventuellement, conserver un petit morceau de tissu (par exemple, ¼ d’un sac vitellin ou un bout de queue environ 2 mm) pour l’isolement d’ADN génomique et génotypage ultérieur.
- En utilisant horloger forceps numéro 55, exciser les tissus contenant le rhombencéphale parallèle et immédiatement au-dessous du neuroépithélium cerveau postérieur pour le séparer des tissus du visage et du prosencéphale (Figure 1F).
- Positionner le cerveau postérieur et le côté dorsal caudal tissu tête vers le haut et identifier le ventriculeth 4, qui est couverte par une couche de tissu mince (plaque de toit). Soigneusement percer la plaque de toit en utilisant horloger forceps numéro 55 (Figure 1) et peler les tissus en excès à l’extérieur avec une pince, déplaçant rostralement le long de la ligne médiane sur le mésencéphale, puis direction caudale sur le rhombencéphale postérieur et de la moelle épinière (Figure 1 ); le rhombencéphale doit maintenant être exposée dans une préparation de livre ouvert (Figure 1 H).
- Préparer hindbrains wholemount immunomarquage (Option 1).
- À l’aide d’horloger numéro 55 de la pince, taquiner soigneusement mésenchyme tête reste à l’extérieur et les méninges fixés sur le côté pial du cerveau postérieur à l’aide de pinces (Figure 1I). Retirez le mésencéphale et le tissu médullaire (Figure 1J) pour laisser seulement le tissu de cerveau postérieur (Figure 1 K).
Remarque : Cette étape de la procédure de ne doit pas être suivie au e9.5 ou e10.5, parce que d’essayer de le faire porterait atteinte probablement le neuroépithélium cerveau postérieur ; en outre, supprimant les méninges n’est pas indispensable car le neuroépithélium cerveau postérieur est suffisamment mince à ce stade pour permettre une pénétration efficace des anticorps pour l’immunomarquage. Cette étape devrait, toutefois, être suivi de e11.5, lorsque les tissus méningés regroupe, pour améliorer la pénétration d’anticorps dans le neuroépithélium rhombencéphale. La dissection est plus facile lorsque réalisé dans du PBS glacee (utilisation de PBS propre pour chaque cerveau postérieur).
- À l’aide d’horloger numéro 55 de la pince, taquiner soigneusement mésenchyme tête reste à l’extérieur et les méninges fixés sur le côté pial du cerveau postérieur à l’aide de pinces (Figure 1I). Retirez le mésencéphale et le tissu médullaire (Figure 1J) pour laisser seulement le tissu de cerveau postérieur (Figure 1 K).
- Préparer hindbrains vibratome et cryosectioning (Option 2)
- Nombre de pinces horloger 55 prélever le mésencéphale et le tissu médullaire (Figure 1J).
Remarque : Il n’est pas nécessaire d’enlever le mésenchyme et des méninges de hindbrains destinés à la découpe (tel qu’illustré dans Figure 1I).
- Nombre de pinces horloger 55 prélever le mésencéphale et le tissu médullaire (Figure 1J).
- Transfert hindbrains de la capsule en plastique pour tubes à fond rond de 2 mL à l’aide d’une pipette Pasteur, aspirer tous les PBS et Difficulté pendant 2 h à 4° C en douce-agitant dans fraîchement décongelés 4 % w/v de formaldéhyde dissous dans du PBS.
ATTENTION : Le formaldéhyde est toxique ; porter une protection appropriée. - Rincer hindbrains x 3 fois avec du PBS. Stocker à 4 ° C dans du PBS si immunomarquage va commencer dans les 2-3 jours ou remplacer des PBS avec 50 % methanol/50% PBS pendant 5 min avant de transférer 100 % de méthanol pour une conservation plus longue entre-20° C.
4. Wholemount Immunofluorescence
- Si nécessaire, réhydrater hindbrains en diminution en série de dilutions de méthanol dans du PBS (par exemple, 75 % de méthanol, méthanol à 50 %, 25 % de méthanol) à température ambiante (RT) de 5 min chacun et puis transfert à PBS.
Remarque : Il faut une série graduée de méthanol pour réhydrater les hindbrains en douceur et assurer la préservation des tissus appropriés. - Permeabilize hindbrains pendant 30 min à 4 ° C dans du PBS contenant 0,1 % Triton X-100 (PBT) avec agitation douce.
- Incuber les hindbrains pendant 1 h à 4 ° C en PBT contenant 10 % de sérum de chèvre inactivés par la chaleur avec agitation douce.
Remarque : Utilisez le sérum de l’espèce hôte que l’anticorps secondaires ont été soulevées dans. Pour des anticorps primaires chez les caprins, incuber en milieu sans sérum protéine bloquer, par exemple 5 % d’albumine sérique bovine dans PBS ou une alternative commerciale appropriée (voir Table des matières). Ceci réduira non-spécifiques coloration fréquemment observée lors de l’utilisation des anticorps primaires chez les caprins. - Incuber les hindbrains toute la nuit à 4 ° C en PBT contenant 1 % de sérum d’inactivés par la chaleur et des anticorps primaires avec agitation modérée (par exemple, de lapin anti-phospho histone H3 [pHH3] dilué 1 : 400).
Remarque : Pour des anticorps primaires chez les caprins, utilisez PBT sans sérum. - Laver les hindbrains à 4 ° C 5 x avec PBT pendant 1 h chaque.
- Incuber les hindbrains toute la nuit à 4 ° C en PBT contenant appropriés fluorophore conjugués Anticorps secondaires (p. ex., anti-lapin de chèvre Alexa Fluor 488) au 1 : 200 en PBT ciblée contre les anticorps primaires utilisés. Garder hindbrains dans l’obscurité d’ici sur pour protéger des fluorophores de photoblanchiment.
Remarque : Pour anticorps primaires chez les caprins, utilisez anti-chèvre fragments Fab d’anticorps secondaires pour réduire une coloration non spécifique. - Laver les hindbrains à 4 ° C 5 x avec PBT pendant 1 h chaque.
- Suffixe du hindbrains à 4 % de formaldéhyde dans du PBS pendant 15 min à RT pour la préservation à long terme des anticorps. Rincez brièvement deux fois dans du PBS.
- Couvrir une lame de microscope de verre avec deux couches de ruban isolant noir et une petite place de la cassette en couches pour créer une poche assez grande pour contenir un cerveau postérieur de l’accise.
- Transférer chaque cerveau postérieur dans une poche avec une pipette Pasteur, enlever l’excès de liquide et ajouter un réactif antifade approprié à la poche avant couvrant lentement avec une lamelle de verre pour éviter les bulles d’air de piégeage sous la lamelle. Sceller la lamelle et fixez-la à la diapositive avec une fine couche de vernis à ongles. Conserver toboggan à 4 ° C dans l’obscurité jusqu'à l’acquisition d’images (protocole, article 7).
5. Vibratome sectionnement et flottant Section Immunofluorescence
- Si nécessaire, réhydrater hindbrains du méthanol comme indiqué au point 4.1.
- Incorporez hindbrains en fondu 3 % p/v agarose dans l’eau distillée.
Remarque : Laissez fondu d’agarose refroidir jusqu'à environ 55° C brièvement avant l’intégration pour ne pas endommager de chaleur rhombencéphale. - Coupes transversales hindbrain jusqu'à une épaisseur de 70 µm en utilisant un vibratome. Transférer chaque section fraîchement coupée avec un pinceau dans un puits d’une plaque de 24 puits contenant PBS glacée.
- Étiqueter les sections flottantes comme décrit aux points 4.2-4.7, mais modifier les étapes comme suit : Lavez le flottement des sections à 4 ° C 3 x avec PBT pour diminuer les temps d’incubation pour les anticorps secondaires à 2 h 15 min chacun, et incuber dans l’anticorps secondaire à température ambiante.
- Éventuellement, après marquage avec des anticorps d’autres épitopes comme indiqué au point 5.4, détecter les noyaux EdU+ à l’aide d’un EdU labeling kit selon les instructions du fabricant. Incuber les sections flottantes dans la réaction cocktail pendant 30 min à 37 ° C dans l’obscurité. Hindbrain laver les sections à 4 ° C 3 x avec PBT pour chaque 15 min.
- Éventuellement, après marquage d’autres épitopes comme indiqué au point 5.4, détecter les noyaux BrdU+ comme suit.
- Incuber les sections flottantes dans l’acide chlorhydrique 2 N à 37 ° C pendant 30 min à l’obscurité.
- Incuber les sections flottantes en pH de tampon borate de sodium 0,1 M 8,5 deux fois plus de 5 min chacun à ta dans l’obscurité pour neutraliser l’acide chlorhydrique.
- Laver les sections flottantes 3 x brièvement dans du PBS à 4 ° C.
- Effectuer l’immunofluorescence labeling pour BrdU comme indiqué au point 5.4.
- Incuber les sections flottantes pendant 2 min à ta à 10 µg/mL 4', 6-diamidino-2-phenylindole dihydrochloride (DAPI) dans du PBS à contre-coloration noyaux cellulaires.
- Postfix les sections flottantes en formaldéhyde à 4 % pendant 15 min à température ambiante.
- Laver les sections flottantes brièvement dans du PBS. Transvaser avec soin les sections flottantes d’une lame de microscope de verre à l’aide d’un pinceau. Moppe PBS excès autour de la section à l’aide de papier buvard ou tissus.
- Monter les sections en utilisant 80 % de glycérol dans du PBS et couvercle lentement avec une lamelle de verre pour éviter les bulles d’air de piégeage. Conserver toboggan à 4 ° C dans l’obscurité jusqu'à l’acquisition d’images (étape 7).
6. cryostat sectionnement et Cryosection Immunofluorescence Labeling
- Si nécessaire, réhydrater hindbrains du méthanol comme indiqué au point 4.1.
- Incuber les hindbrains en saccharose 30 % p/v dans du PBS à cryoprotect hindbrains avant la congélation.
Remarque : Hindbrains sont prêts pour la congélation quand ils ont coulé au fond du tube, qui prend généralement ≤ 2 h pour e9.5-10,5 hindbrains et 3-6 h pour hindbrains de e11.5 à 13,5. - Immerger la hindbrains de température coupe optique composée (OCT) et congeler rapidement en transférant les moules contenant hindbrains en OCT pour isopentane refroidi à entre-40 ° C et -50 ° C sur la glace sèche.
Remarque : Hindbrains congelés, embedded peuvent être stockés à-20 ° C à court terme et à long terme de-80 ° C jusqu'à ce que la section. - Coupes transversales hindbrain jusqu'à une épaisseur de 10 µm à l’aide d’un cryostat et transfert à lames de microscope électrostatiquement adhésif.
Remarque : Hindbrain cryosections peuvent être stockées à-20 ° C à court terme et à long terme de-80 ° C jusqu'à ce que l’étiquetage. - Incuber les lames à ta pendant 15 minutes pour sécher des sections pour les diapositives. Laver des cryosections avec du PBS à dissoudre OCT et marque une barrière hydrophobe autour cryosections à l’aide d’un stylo PAP. Répétez les étapes 5,4 à 5,8.
- Répétez l’étape 5.10 utilisant un support de montage à base d’alcool polyvinylique en lieu et place de glycérol.
7. Acquisition d’image
- Échantillons d’image utilisant un épifluorescence ou microscope confocal à balayage laser équipé de lentilles convenant aqueuses diapositives montées sur médias et filtres optiques pour les fluorophores utilisés pour immunomarquage.
- Pour l’image le rhombencéphale toute ou une partie du cerveau postérieur, utiliser une lentille de grossissement de 10 x (par exemple, la Figure 2 b) ; pour visualiser les zones de hindbrains pour la quantification, utilisez un 40 X grossissement (par exemple, la Figure 2D) et de visualiser les cellules individuelles, utiliser un objectif avec un grossissement de 63 x (p. ex., Figure 2).
8. autres méthodes
- Après l’étape 3.8, homogénéiser ou hindbrains pour obtenir une suspension monocellulaire pour cytométrie demandes15.
- Après l’étape 3.8, homogénéiser les interprétations hindbrains extraie RNA de suspensions cellulaires unique pour la RT-qPCR (p. ex., 16).
Remarque : Assurez-vous que tous les réactifs et les équipements sont gardés stériles et sans RNase tout au long de prévenir la dégradation de l’ARN. - Après l’étape 3.8, homogénéiser les interprétations hindbrains pour isoler les PNJ et les propagent in vitro comme neurospheres pour l’analyse du cerveau postérieur NPC comportement17.
Remarque : Assurez-vous que tous les réactifs et les équipements restent stériles pour éviter la contamination bactérienne/fongiques des cultures Neurosphère.
Résultats
Cette section illustre des exemples de résultats qui peuvent être obtenus lorsque l'on étudie la neurogenèse dans le rhombencéphale embryonnaires de souris grâce à l’analyse de l’article wholemount et tissus.
Nous montrons qu’immunomarquage wholemount du rhombencéphale microdissected avec un anticorps pour la pHH3 marqueur mitotique visualise divisant les PNJ dans le VZ (Figure 2 b – D). Nous montrons pHH3+ PNJ à un fort grossissement pour mettre en évidence les différentes étapes de la mitose (Figure 2). Nous avons montré que cette méthode d’étiquetage est apte à être réalisée à travers plusieurs phases successives de développement postérieur d’observer l’évolution temporelle de la mitose NPC dans cet organe (Figure 2D).
Nous montrons qu’imaging immunomarquées transversale vibratome sections du rhombencéphale 1 h après l’injection EdU, visualise l’orientation de clivage des PNJs mitotiques (Figure 3 b), le modèle de migration nucléaire pseudostratifié, interkinetic du cyclisme progéniteurs18 (Figure 3 b, D) et la structure globale de la VZ (Figure 3 b – D). Notez que mitotique pHH3+ PNJ est présents seulement à la surface ventriculaire et non plus à la base (Figure 3), qui oppose le patron de la division basale des PNJs plus engagées dans le prosencéphale19.
Aussi, nous illustrons comment cyclisme PNJs et leur progéniture différenciés peut être étiqueté avec BrdU ou EdU pour évaluer la progression de lignée NPC (Figure 4). L’immunomarquage des cryosections transversales du rhombencéphale souris 1 jour après l’injection de BrdU BrdU et Ki67montre le nombre et le positionnement du cyclisme PNJ dans le neuroépithélium (Figure 4 a, B), par lequel le nombre de renouvelant les PNJs peut être définie en calculant le pourcentage de Ki67 BrdU+ + des cellules parmi toutes les cellules de BrdU+ (Figure 4 a, C).
Enfin, nous montrons un exemple d’immunomarquage des sections vibratome hindbrain pour RC2, un antigène dans les filaments intermédiaires neuronaux spécifiques nestin, afin de visualiser les NPC endfeet (Figure 5 b) et les processus (Figure 5). Vibratome sections, plutôt que de fines coupes cryogéniques, permettent l’observation améliorée des PNJ très ramifiées et de structure neuroépithéliales globale.

Figure 1 : Principales étapes de la dissection d’un cerveau postérieur d’un embryon de souris e11.5. (A – D) Représentation schématique du cerveau postérieur microdissection. (A), le tissu de siège caudal est supprimé en coupant le long des pointillés rouges. (B), la plaque de toit est percé et puis arrachés dans les rostrales caudales directions et le long de la ligne médiane (lignes verticales rouges) puis latéralement pour révéler le neuroépithélium rhombencéphale. (C) le neuroépithélium est fouillait loin les méninges après avoir inséré la pince entre les deux structures, et les tissus du mésencéphale et de la moelle épinière sont supprimés en coupant le tissu avec la pince le long des pointillés rouges. (D) cette procédure donne un cerveau postérieur aplati. (E–K) Capture d’images des étapes clés de la procédure de microdissection rhombencéphale. (E), l’embryon est décapité en coupant le long de la ligne pointillée. (F) le cerveau postérieur et le 4ème ventricule, délimitée par la plaque de toit, sont excisées et séparés de la tête en coupant le long des pointillés. (G) le ventriculeth 4 est orientée vers le haut avant un petit trou est percé dans la plaque de toit (astérisque). Le trou est élargi par le peeling les tissus soigneusement les rostralement et direction caudale le long de la ligne médiane (flèches) pour exposer le rhombencéphale. Le cerveau postérieur est positionnée côté pial vers le bas et gauche à incorporer à une préparation de livre ouvert (H; noir pointe de flèche indique tissu neural postérieur). Si le cerveau postérieur est nécessaire pour wholemount immunomarquage, la membrane pial est supprimée en soulevant délicatement le neuroépithélium cerveau postérieur des membranes méningés environnantes avec une pincette (j’ai). Mésencéphale (Mo) et la moelle épinière (sc) en excès tissulaire est supprimés (pointillés dans J) pour isoler le cerveau postérieur (K). Echelle : 500 µm pour (E), 300 µm pour ( KdeF – ). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
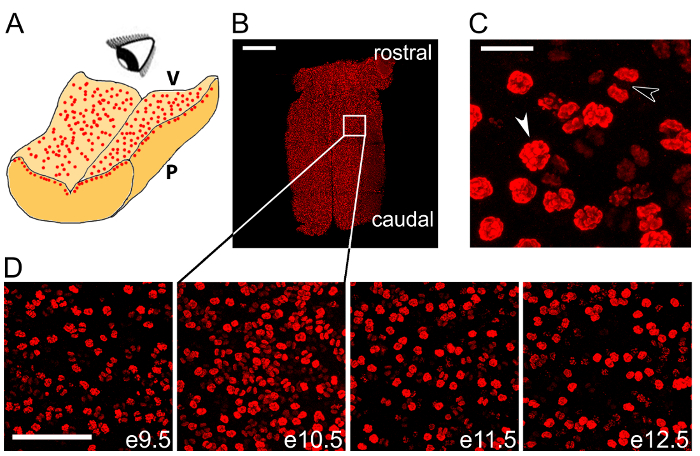
Figure 2 : Wholemount immunomarquage peut être utilisé pour quantifier les mitoses NPC dans le rhombencéphale. (A) schéma illustrant l’imagerie en face du PNJ mitotique dans la couche ventriculaire du cerveau postérieur. V, côté cerveau ventriculaire postérieur ; P, côté postérieur pie-mère. (B) tuile confocale balayage z pile de e10.5 cerveau postérieur après immunomarquage wholemount pour la pHH3 marqueur mitotique (rouge). La boîte blanche indique la zone indiquée à fort grossissement dans le deuxième panneau en (D). (C) avant l’anaphase (flèche blanche) et des figures mitotiques l’anaphase (flèche noire) peuvent être distinguées au sein de la cohorte totale mitotique PNJs. (D) le temps de formation wholemount pHH3 marquage de e9.5 à 13,5. Barreaux de l’échelle : 500 µm (B) ; 20 µm (C) ; 100 µm (D). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
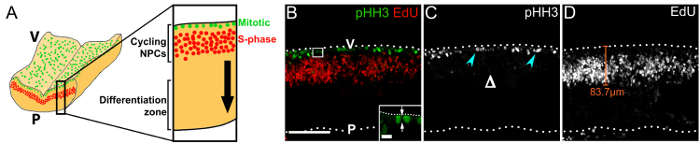
Figure 3 : Cyclisme PNJs dans leur zone de germinal dans le cerveau postérieur rostral. (A) schéma montrant la position de mitotique (vert) et les PNJ de la phase S (rouge) à la surface ventriculaire du cerveau postérieur et dans la région périventriculaire, respectivement. Un échantillon virtuel à travers le cerveau postérieur est affiché à un grossissement supérieur à droite. La flèche noire indique la direction de la migration de la progéniture NPC qui ont quitté le cycle cellulaire vers la zone de différenciation. Pile z confocale (B) d’une section flottante du rhombencéphale e11.0 d’un embryon qui a reçu 1 h EdU impulsion ; immunomarquage pour pHH3 et EdU servait à visualiser mitotique (vert) et les PNJ de la phase S (rouge), respectivement. Surfaces de cerveau postérieur sont dénotés en pointillés ; V, côté cerveau ventriculaire postérieur ; P, côté postérieur pie-mère. La zone indiquée par une boîte blanche apparaît à un grossissement plus élevé dans le médaillon ; les flèches indiquent le plan de clivage d’un PNJ à l’anaphase, par rapport à la surface ventriculaire. (C) monocanal affichant pHH3 immunomarquage seulement. Mitotiques PNJs sont indiqués par des flèches cyan ; le manque de divisions basales est indiqué par Δ. (D) monocanal affichant EdU étiquetage seulement. EdU+ PNJ adopte une distribution pseudostratifiée en raison de leur migration nucléaire interkinetic. La distance qui migrent vers le PNJ de la surface ventriculaire peut être mesurée, comme il est indiqué avec une ligne orange représentative. Barreaux de l’échelle : 100 µm (B -D) ; 10 µm en médaillon (B). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
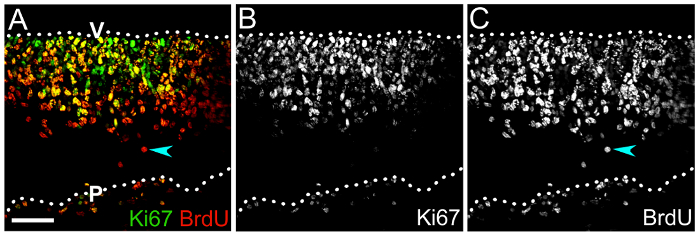
Figure 4 : Combinaison BrdU avec Ki67 étiquetage pour déterminer hindbrain NPC autorenouvellement capacité. Pile de z confocale (A) d’une cryosection e10.5 de cerveau postérieur après marquage Ki67 (vert) et pouls BrdU (rouge) après 1 jour de BrdU. Double-positifs cellules dans la zone ventriculaire sont les PNJ qui ont incorporé BrdU et sont toujours en mouvement à travers le cycle cellulaire, comme indiqué par Ki67 étiquetage. La proportion de cellules double marquée chez la population totale de BrdU+ représente le pourcentage de PNJs autorenouvellement. (B, C) Single canaux affichant Ki67 (B) et immunomarquage BrdU (C) seulement. Une cellule de BrdU+ qui manque de Ki67 et par conséquent a probablement quitté le cycle cellulaire est indiquée par une flèche cyan (A,C). Surfaces de cerveau postérieur sont dénotés en pointillés ; V, côté cerveau ventriculaire postérieur ; P, côté postérieur pie-mère. Barre d’échelle : 50 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Immunomarquage nestin visualise le processus NPC et endfeet. A – ( C) Immunofluorescence pour RC2, qui reconnaît un épitope sur les filaments intermédiaires neuronaux nestin, illustre la morphologie NPC à travers le neuroépithélium rhombencéphale. Pile z confocale (A) d’une section flottante d’un postérieur e11.5 suite RC2 immunomarquage ; boxed zones apparaissent à un grossissement supérieur à (B, B'; région apicale/ventriculaire) et (C, C'; basale région). Surfaces de cerveau postérieur sont dénotés en pointillés ; V, côté cerveau ventriculaire postérieur ; P, côté postérieur pie-mère. (B, C) Piles de z confocal de zones en boîte (A) ; optique seul sont indiqués en ('B, C'), respectivement. Un endfoot apical de PNC ancrée à la surface ventriculaire est indiqué par une flèche (B'). Unique et fasciculées NPC processus sont indiqués par des flèches blanches et noires en (C'), respectivement. Barreaux de l’échelle : 100 µm, (A) ; 25 µm à (B, C). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Ce protocole décrit comment utiliser le rhombencéphale embryonnaires de souris comme modèle pour étudier les mécanismes de la neurogenèse du développement. En utilisant une variété de méthodes différentes immunomarquage, rhombencéphale PNJ peut être visualisée et leur nombre quantifié dans des sections de tissu ou organe wholemounts. La facilité de dissection et anatomie plat fait en sorte que le cerveau postérieur peut être photographiée dans une préparation de « livre ouvert » pour recueillir des informations sur les habitudes de la neurogenèse de l’orgue à l’échelle.
De plus, nous montrons que morphologie NPC et axés sur le cycle cellulaire NPC positionnement peuvent être facilement visualisées en flottant- ou cryosections du rhombencéphale. Les deux comportements peuvent être exploitées pour définir de nouvelles populations de souches, a précédemment été interprété dans le télencéphale mammifères20. Par exemple, formé début Sox2+ neuroepithelia et la glie radiale apicale de Pax6+ sont présents dans le cerveau postérieur21,22, mais le cerveau postérieur manque progéniteurs basales Tbr2+ 3 .
Le protocole décrit ici peut être adapté pour observer le comportement de certaines sous-populations de NPC par marquage fluorescent pour imagerie live et/ou suivi de lignée en tissus fixés. Cela est possible, par exemple, par l’étude hindbrains des souris portant le transgène tamoxifène-induisible de Sox1-iCreERT2 et le journaliste de Rosa26tdTomato 23.
En plus d’améliorer la connaissance de la neurogenèse murine, étudier le cerveau postérieur peut élucider les mécanismes de neurogènes largement pertinentes qui sont partagés par toutes les espèces, car le cerveau postérieur est une région du cerveau hautement conservée qui est censée être plus proche entre espèces de vertébrés que le prosencéphale.
Comme la neurogenèse du cerveau postérieur se déroule sur une fenêtre de temps relativement plus courte que le prosencéphale neurogenèse23, il est important de tenir compte de la nécessité de comparer adéquatement mis en scène des embryons. En conséquence, les biais expérimentaux sont évité en comptant et en enregistrant le nombre de paires de segments dans un embryon avant d’isoler son cerveau postérieur. Le tissu de cerveau postérieur lui-même est fragile et pinces doit donc être manipulé avec soin en séparant le tissu de cerveau postérieur de la tête mésenchyme et des méninges ; un couple de « pistes de pratique » pourrait donc être souhaitable avant une dissection des embryons précieux. En outre, hindbrains doivent être transférés d’un tube à l’autre à l’aide d’une pipette Pasteur-échelle plutôt qu’avec une pince pour éviter tout dommage (ouverture de la pipette peut être élargi par le découpage de la pointe avec des ciseaux propre). Enfin, bien que rare, la mesure d’EdU/BrdU incorporation, phase S PNJ peut être variable, en particulier pendant les impulsions courtes (c.-à-d., 1 h). Pour améliorer l’étiquetage, veiller à ce que les EdU/BrdU est dissous correctement avant le chargement de la solution dans la seringue et injecter prudemment dans la cavité péritonéale. Injections de pauvres, comme ceux fabriqués par voie sous-cutanée par accident, provoquera en perdre ou en piégeant la solution EdU/BrdU et empêchez-le de pénétrer dans la circulation.
Déclarations de divulgation
Aucun des auteurs ont des intérêts divergents ou conflits d’intérêts.
Remerciements
Nous remercions Vasiliki Chantzara pour mener à bien les accouplements chronométré et le personnel de l’unité de ressources biologiques à l’Institut d’ophtalmologie de l’UCL pour élevage de souris. Cette étude a été financée par une bourse de chercheur de Wellcome Trust 095623/Z/11/Z à CR.
matériels
| Name | Company | Catalog Number | Comments |
| Round-bottomed reagent tube, 2.0 ml (Safe-Lock) | VWR | 211-2120 | Also available from other commercial suppliers |
| Plastic cell culture dish, 60 mm | Thermo Fisher | 150288 | Also available from other commercial suppliers |
| Cell culture plates, 12-well | Thermo Fisher | 150628 | Also available from other commercial suppliers |
| Pasteur pipettes | Copan | 200C | Also available from other commercial suppliers |
| Dumont Watchmaker forceps, no. 5 | FST | 91150-20 | |
| Dumont Watchmaker forceps, no. 55 | FST | 11295-51 | |
| 29G needle/syringe | BD | BD Micro-Fine +1ml | |
| Anti-phospho-histone H3 primary antibody | Millipore | 06-570 | Goat, dilution 1:400 |
| Anti-BrdU primary antibody | Abcam | ab6326 | Rat, dilution 1:400 |
| Anti-Ki67 primary antibody | BD Biosciences | 550609 | Mouse, dilution 1:400 |
| Anti-RC2 primary antibody | Developmental Studies Hybridoma Bank | RC2 | Mouse (IgM), dilution 1:400 |
| Alexa Fluor 488-conjugated goat anti rabbit secondary antibody | Thermo Fisher | A11029 | Dilution 1:200 |
| Alexa Fluor 594-conjugated goat anti rabbit secondary antibody | Thermo Fisher | A11037 | Dilution 1:200 |
| Alexa Fluor 488-conjugated goat anti mouse IgM secondary antibody | Thermo Fisher | A21042 | Dilution 1:200 |
| Alexa Fluor 488-conjugated goat anti mouse secondary antibody | Thermo Fisher | A11001 | Dilution 1:200 |
| Alexa Fluor 594-conjugated goat anti rat secondary antibody | Thermo Fisher | A11007 | Dilution 1:200 |
| 4',6-Diamidino-2-Phenylindole, Dihydrochloride (DAPI) | Sigma | D9542 | Use at 10 μg per mL |
| 5-ethynyl-2’-deoxyuridine (EdU) | Sigma | 900584 | |
| 5-bromo-2´-deoxyuridine (BrdU) | Sigma | B5002 | |
| Click-iT EdU Alexa Fluor 594 Imaging Kit | Thermo Fisher | C10086 | |
| Heat-inactivated goat serum | Sigma | G9023 | |
| Bovine serum albumin | Sigma | A7906 | |
| DAKO protein-block serum free | Agilent | X0909 | |
| Triton X-100 | Sigma | T8787 | Also available from other commercial suppliers |
| Phosphate buffer saline | Sigma | P4417 | Also available from other commercial suppliers |
| Paraformaldehyde | Sigma | P6148 | Also available from other commercial suppliers |
| Sodium tetraborate | Sigma | B9876 | Also available from other commercial suppliers |
| Sucrose | Sigma | S0389 | Also available from other commercial suppliers |
| Agarose | Sigma | A9539 | Also available from other commercial suppliers |
| Super PAP pen liquid blocker | Ted Pella, Inc. | 22309 | |
| SlowFade Antifade Kit | Thermo Fisher | S-2828 | |
| Glycerol | Fisher Scientific | 10337700 | |
| Mowiol | Millipore | 475904 | |
| OCT | Scigen | 4583 | Also available from other commercial suppliers |
| Isopentane | Sigma | M32631 | Also available from other commercial suppliers |
| Methanol | Thermo Fisher | 10675112 | Also available from other commercial suppliers |
| Hydrochloric acid | Thermo Fisher | 10316380 | Also available from other commercial suppliers |
| Microscope slides | VWR | 631-0912 | |
| Superfrost microscope slides | VWR | 631-0108 | |
| Thermometer | VWR | 620-0858 | |
| Cover glass | VWR | 631-0137 | |
| Stereo Microscope, Leica MZ16 | Leica | not applicable | |
| Confocal laser scanning microscope LSM710 | Zeiss | not applicable |
Références
- Wilsch-Brauninger, M., Florio, M., Huttner, W. B. Neocortex expansion in development and evolution - from cell biology to single genes. Curr Opin Neurobiol. 39, 122-132 (2016).
- Gregg, C., Weiss, S. CNTF/LIF/gp130 receptor complex signaling maintains a VZ precursor differentiation gradient in the developing ventral forebrain. Development. 132 (3), 565-578 (2005).
- Kwon, G. S., Hadjantonakis, A. K. Eomes::GFP-a tool for live imaging cells of the trophoblast, primitive streak, and telencephalon in the mouse embryo. Genesis. 45 (4), 208-217 (2007).
- Krumlauf, R. Hox Genes and the Hindbrain: A Study in Segments. Curr Top Dev Biol. 116, 581-596 (2016).
- Guthrie, S. Patterning and axon guidance of cranial motor neurons. Nat Rev Neurosci. 8 (11), 859-871 (2007).
- Fantin, A., Vieira, J. M., Plein, A., Maden, C. H., Ruhrberg, C. The embryonic mouse hindbrain as a qualitative and quantitative model for studying the molecular and cellular mechanisms of angiogenesis. Nat Protoc. 8 (2), 418-429 (2013).
- Terriente, J., Gerety, S. S., Watanabe-Asaka, T., Gonzalez-Quevedo, R., Wilkinson, D. G. Signalling from hindbrain boundaries regulates neuronal clustering that patterns neurogenesis. Development. 139 (16), 2978-2987 (2012).
- Coolen, M., Thieffry, D., Drivenes, O., Becker, T. S., Bally-Cuif, L. miR-9 controls the timing of neurogenesis through the direct inhibition of antagonistic factors. Dev Cell. 22 (5), 1052-1064 (2012).
- Dias, J. M., Alekseenko, Z., Applequist, J. M., Ericson, J. Tgfbeta signaling regulates temporal neurogenesis and potency of neural stem cells in the CNS. Neuron. 84 (5), 927-939 (2014).
- Jacob, J., et al. Retinoid acid specifies neuronal identity through graded expression of Ascl1. Curr Biol. 23 (5), 412-418 (2013).
- Alexandre, P., Reugels, A. M., Barker, D., Blanc, E., Clarke, J. D. Neurons derive from the more apical daughter in asymmetric divisions in the zebrafish neural tube. Nat Neurosci. 13 (6), 673-679 (2010).
- Peretz, Y., et al. A new role of hindbrain boundaries as pools of neural stem/progenitor cells regulated by Sox2. BMC Biol. 14, 57 (2016).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. J Vis Exp. (26), (2009).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nat Neurosci. 15 (2), 329-337 (2011).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Hutton, S. R., Pevny, L. H. SOX2 expression levels distinguish between neural progenitor populations of the developing dorsal telencephalon. Dev Biol. 352 (1), 40-47 (2011).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing embryonic mouse neural stem cell culture using the neurosphere assay. J Vis Exp. (47), (2011).
- Sauer, F. Mitosis in the neural tube. The Journal of Comparative Neurology. 62 (2), 377-405 (1935).
- Sessa, A., Mao, C. A., Hadjantonakis, A. K., Klein, W. H., Broccoli, V. Tbr2 directs conversion of radial glia into basal precursors and guides neuronal amplification by indirect neurogenesis in the developing neocortex. Neuron. 60 (1), 56-69 (2008).
- Pilz, G. A., et al. Amplification of progenitors in the mammalian telencephalon includes a new radial glial cell type. Nat Commun. 4, 2125 (2013).
- Fantin, A., et al. Tissue macrophages act as cellular chaperones for vascular anastomosis downstream of VEGF-mediated endothelial tip cell induction. Blood. 116 (5), 829-840 (2010).
- Kayam, G., et al. A novel role for Pax6 in the segmental organization of the hindbrain. Development. 140 (10), 2190-2202 (2013).
- Tata, M., et al. Regulation of embryonic neurogenesis by germinal zone vasculature. Proc Natl Acad Sci U S A. 113 (47), 13414-13419 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon