Method Article
萌芽期の神経を研究するためのモデルとしてのマウス脳
要約
この資料では、マウス胚の脳をモデルとして使用し、全体の器官およびティッシュ セクションの準備における発達神経新生を勉強するため方法を示します。
要約
マウス胚の脳は、開発中に哺乳類の神経を研究するため最も一般的に使用されるシステムです。しかし、非常に折られた脳神経上皮は器官全体神経パターンを調査する wholemount 分析に従う義務があるではないです。さらに、前脳神経新生のメカニズムの定義は必ずしも脳の他の部分における神経新生の予測などにより脳固有前駆細胞サブタイプの存在。マウスの脳は、時空間分布と神経前駆細胞の挙動を観察するための切片と同様、wholemount 分析、クレームが萌芽期の神経を研究するための代替モデルを提供します。さらに、それは簡単に細胞分離や分子生物学的分析などの他のダウン ストリーム アプリケーションを解剖しました。哺乳類で発達神経新生の分子・細胞メカニズムを勉強して、強力なモデルを提供していますセル リネージュ記者となりの変異マウス系統の膨大な数のマウス脳を容易に分析できます。生物。Wholemount 準備とティッシュ セクションで哺乳類の神経前駆細胞 (NPC) 動作の分析にマウス胚の脳を使用する簡単かつ迅速な方法を紹介します。
概要
哺乳類胚発生時に Npc を '神経' と呼ばれるプロセスで新しい神経細胞を生成する心室 (VZ) と拡大神経上皮の脳室下帯 (SVZ) ゾーンに分割します。新しいニューロンとその NPC の前駆体の生成を調べた広範囲脳1、以下はこのプロセスの他の地域について知られている間。
脳は複雑な複雑に折り畳まれた構造ですティッシュ後、組織学的方法について検討している主挑戦全臓器間神経パターンになります。さらに、脳神経の研究は、必ずしも他の頭脳領域または脊髄における神経因性の動作の予測。たとえば、外側の神経節隆起がドライブ Npc の自己複製を促進する毛様体神経栄養因子と白血病の抑制的な要因に手がかりは異なる中枢神経系領域にわたって異なる応答を引き出す可能性があります信号、2脊髄前駆細胞の分化。さらに、発展途上の脳を設定し大脳皮質1の拡大に大きく貢献することが出来る npc サブ クラス欠席している菱脳と脊髄の3から。逆に、脊髄と脳を含む皮質内に存在しない代替 NPC サブタイプが考えられます。
マウス胚の脳は哺乳類の脳の進化の最も古い地域で、小脳と脳幹を生成します。種を越えたその保全、にもかかわらず比較的少し知られている NPC のサブタイプまたはその規制を含む脳神経について。マウスの脳研究の大半は、Hox 遺伝子4とポスト mitotic ニューロン5のパターニングによって駆動される、組織の細分化のプロセスを重視しています。さらに、菱脳は発達的血管新生6のメカニズムを研究するためのモデルとして使用されています。
マウス脳と対照をなしてゼブラフィッシュ脳は、NPC の分化と脊椎動物のモデル生物 (例えば,7,8) の系統の進行に従うこと広く使用されています。ひよこ菱脳は、脊椎動物の開発 (例えば9,10) における神経新生にも採用されています。ゼブラフィッシュ脳11と同様に、ひよこの後脳することができますライブ時間12上 NPC の行動と規制を勉強するイメージします。ライブ イメージングによる類似の縦断的観察は、彼らが成長するので、哺乳類で、現在可能ではありません子宮内で。エレクトロポレーションは自由生活性のゼブラフィッシュ胚またはひよこの胚内 ovo (例えば、13) に容易に適用できますが、このような技術はまたより困難でようまた、技術によって操作を対象と子宮。
それにもかかわらず、マウス胚の脳、神経を支配する分子・細胞メカニズムを定義する絶妙な適しています。まず、マウス脳の分析、多くのインスタンスで情報提供されます下等脊椎動物の勉強を通じて得られたよりも人間の発展に関連しています。さらに、遺伝子組み換えマウスの膨大な数があります、いずれかまたは使用できますマウス Npc をマッピングの運命関連遺伝子の構成または条件付き変異対立遺伝子の調節機構を変更します。最後に、最近使用されているそのマイクロインジェクション後脳室の前のヴィヴォ前駆細胞により、菱脳 NPC 速度14の簡単な検査で、少なくとも。まだ、現時点では、時空間の組織と脳全体の臓器において Npc の挙動についてほとんど知られています。
ここでは、wholemount 準備とティッシュ セクションで哺乳類の NPC の行動を分析するための強力なモデルとして菱脳を使用する簡単かつ迅速な方法を示します。我々 はさらに、定量的逆転写酵素 (qRT) などの下流分子の反応の異なる神経パラメーターを勉強してプロセスの後脳サンプルをさらに使用するプロトコルを提供-PCR。
プロトコル
すべての動物の仕事は英国ホーム オフィスおよびローカル倫理指針に従って行われました。
1. 手順とタイミングの概要
- 日 (e) 9.5 e13.5 妊娠; を入手するための調査の下で生物学的質問に答える適切な緊張から成体マウスのわれわれのタイムアウトを実行します。12-15 日が必要です。
- 必要に応じて、準備 5-ブロモ-2'-デオキシウリジン (BrdU)/5-エチニル-2'-デオキシウリジン (EdU) ソリューション注入 (プロトコル セクション 2); を実行し、必要とする ~ 1 h 前に、の日にまたは胚分離、エドゥ/brdu 細胞標識の所望の長さに応じての日。
- 胚単離と菱脳解剖 (プロトコル セクション 3); を実行します。必要があります 〜 10 分/胚。
- Wholemount 蛍光分類の (プロトコル セクション 4); を実行します。3 日間が必要です。
- フローティング セクション蛍光分類の (プロトコル セクション 4) を行い、vibratome を使用してセクション: 2 日間が必要です。
- クライオスタットを使用してセクションし、凍結切片 (プロトコル セクション 5) の蛍光標識を実行2 日間が必要です。
2. BrdU とエドゥ (オプション) 妊娠中の雌マウスを注入します。
- それぞれ BrdU または EdU を滅菌リン酸緩衝生理食塩水 (PBS) 10 mg/mL と 1 mg/mL の濃度で溶解します。
注意: BrdU とエドゥが毒性適切な保護具を着用します。 - 妊娠マウスの重量を量るし、BrdU の 100 mg/kg に達するに投与されるべきである BrdU または EdU のソリューションの体積を計算または 5 mg/kg エドゥ。
- ラベルの必要な長さに応じて、胚を収集する前にいずれかの 1 時間または 1 日腹腔内のルートを通じて BrdU または EdU の溶液を注入します。
注: 1 h のラベル S 期に脳細胞を可視化します。1 日のために分類後脳 Npc の子孫を可視化します。
3. e9.5 - e13.5 マウス胚からの Hindbrains の郭清
- (例えば、頚部転位) 必要な妊娠段階で倫理的に承認された手順を使用してタイミング妊娠雌マウスを安楽死させます。鋭いはさみを使用して腹腔内を開いてカットし、慎重に子宮を切除します。20 mL の氷冷 PBS を含む 60 mm プラスチックの皿に胚を含む切除した子宮を配置します。
注: 無菌技術は必要ありません。 - 解剖顕微鏡を用いたさらに郭清のすべてを実行します。鉗子数 5 の時計を使用して、胚を公開、臍帯を切断してそれぞれの胚を解放および卵黄嚢を削除する子宮の筋肉の壁を引き裂きます。
- 滅菌パスツール ピペットを使用すると、ワイド穴の開くと、氷冷 PBS のきれいなプラスチック皿にそれぞれの胚を転送します。
- 時計鉗子数 55 を使用すると、(図 1E) 頭を断ちます。
- 必要に応じて、組織 (例えば卵黄嚢または約 2 mm 尾部先端の 1/4) ゲノムの DNA の隔離およびそれに続く遺伝子型解析のための小さな部分を保持します。
- 時計鉗子数 55 を使用して、菱脳とすぐに顔面と脳組織 (図 1 階) と区別するため後脳神経上皮下に並列を含む組織を切除します。
- 菱脳と尾側頭部組織の背側を (屋根板) の薄い組織層によって覆われている 4th心室を識別します。慎重に時計鉗子番号 55 (図 1) を使用して屋根に穴を開けるし、鉗子、中脳の正中線に沿って吻方移動で離れた余分な組織を剥離し、後部後脳と脊髄 (図 1 を尾側);菱脳は、開かれた本準備 (図 1 H) で今公開ください。
- Wholemount 反応 (オプション 1) の hindbrains を準備します。
- 離れて残り頭間充織と鉗子 (図 1I) による菱脳の軟膜の側に接続されている任意の髄膜をいじめる鉗子数 55 の時計を使用して、慎重に。菱脳組織 (図 1 K) だけを残して中脳、脊髄組織 (図 1 j) を削除します。
注: のこの手順をたどることが e9.5 または e10.5、そうしようと、菱脳神経上皮; に損傷を与える可能性が高いのでさらに、髄膜を削除する必要はありません後脳神経上皮は反応のための抗体の効率的な浸透を許可するようにこの段階で十分に薄いので。この手順は、必要があります、しかし、e11.5 以降から後脳神経上皮侵入抗体を強化する、硬膜の組織を統合する際に従います。郭清は、氷冷 PBS (各脳の使用きれいな PBS) で実行すると最も簡単です。
- 離れて残り頭間充織と鉗子 (図 1I) による菱脳の軟膜の側に接続されている任意の髄膜をいじめる鉗子数 55 の時計を使用して、慎重に。菱脳組織 (図 1 K) だけを残して中脳、脊髄組織 (図 1 j) を削除します。
- Hindbrains vibratome と cryosectioning (オプション 2) を備える
- 時計鉗子数 55 を使用して、中脳、脊髄組織 (図 1 j) を削除します。
注: 間充織と髄膜の区分 (図 1Iで示すように) のためのもの hindbrains を削除する必要はありません。
- 時計鉗子数 55 を使用して、中脳、脊髄組織 (図 1 j) を削除します。
- プラスチックの皿から hindbrains を 2 mL の丸底チューブ パスツール ピペットを使用して転送、すべての PBS を吸引し、PBS に溶解したて解凍 4 %w/v ホルムアルデヒドの穏やかな撹拌 4 ° C で 2 時間修正します。
注意: ホルムアルデヒドは有毒である;適切な保護具を着用します。 - PBS の hindbrains 3 倍をすすいでください。反応、2-3 日以内に開始または-20° c.で長期保管のため 100% メタノールに転送する前に 5 分間 50% methanol/50% PBS と PBS を置き換えると、PBS で 4 ° C で保存します。
4. Wholemount 蛍光抗体法
- 必要な場合は、連続 5 分間室温 (RT) で (例えば75% メタノール、メタノール 50%、25% メタノール) PBS でメタノールの希釈液を減少させる hindbrains を水分補給し、PBS に転送。
注: メタノールの一連の階級は優しく hindbrains を水分補給し、適切な組織保全の確保に必要です。 - 0.1% を含む PBS で 4 ° C で 30 分の hindbrains を permeabilize 穏やかな攪拌とトリトン X-100 (PBT)。
- Hindbrains 穏やかな攪拌を 10% 熱不活化ヤギ血清を含む PBT で 4 ° C で 1 時間インキュベートします。
注: は、二次抗体を上げた宿主動物種由来の血清を使用します。ヤギ、一次抗体を血清フリー孵化用蛋白質ブロック、たとえば PBS または適切な商業代替 5% ウシ血清アルブミン (材料の表を参照してください)。これは、非特定のヤギで発生した一次抗体を使用する場合に頻繁に観察された染色が低減されます。 - 一晩で 4 ° C 1% 熱非動化血清と穏やかな攪拌と一次抗体を含む PBT hindbrains を孵化させなさい (例えばウサギ抗リン ヒストン H3 [pHH3] 希釈 1: 400)。
注: ヤギの一次抗体、血清なし PBT を使用します。 - 4 ° c 5、hindbrains を洗う 1 h の PBT と x。
- 一晩で PBT を含む適切な蛍光標識二次抗体 (例えばヤギ抗うさぎ Alexa Fluor 488) PBT 使用一次抗体に対してターゲットで 1: 200 で 4 ° C hindbrains を孵化させなさい。退色から蛍光物質を保護するために、ここから暗闇の中で hindbrains を維持します。
注: ヤギの一次抗体、非特定の染色を抑えるアンチ山羊二次抗体の Fab 断片を使用します。 - 4 ° c 5、hindbrains を洗う 1 h の PBT と x。
- 抗体の結合の長期保全のため常温 15 分 PBS で 4% ホルムアルデヒドに hindbrains を後置します。簡単に PBS で 2 回すすいでください。
- 黒の絶縁テープの 2 つの層とガラス顕微鏡スライドをカバーし、1 つの脳を保持するために十分な大きさのポケットを作成する層状テープから小さな正方形の消費税します。
- パスツール ピペットでポケットにそれぞれ脳を転送、余分な液体を除去し、coverslip の下でトラップ空気泡を避けるためにガラス基板にゆっくりとそれをカバーする前にポケットに適切な antifade 試薬を追加します。Coverslip のシールやマニキュアの薄い層を使用してスライドに貼付。暗闇の中で画像の取得 (プロトコル セクション 7) まで 4 ° C でスライドを格納します。
5. Vibratome 区分およびセクション蛍光をフローティング
- 必要な場合は、手順 4.1 で説明したメタノールから hindbrains を水分補給します。
- 溶融 3% の w/v agarose 蒸留水の準備に hindbrains を埋め込みます。
注: は、後脳の熱損傷を防ぐへの埋め込み前に簡潔におよそ 55 ° C に冷却する溶解アガロースを許可します。 - 横菱脳のセクションを vibratome を使用して 70 μ m の厚さにカットします。各転送は新鮮な氷冷 PBS を含む 24 ウェル プレートの 1 つのウェルに絵筆を持つセクションをカットしました。
- フローティングのセクション 4.2 4.7 の手順で説明するようにラベルを付けるが、次のように手順を変更: セクション浮動の 4 ° C で PBT と 3 x 15 分 2 h に二次抗体の孵化時間を短縮し、二次抗体室温で孵化させなさい洗浄
- 必要に応じて、ステップ 5.4 で説明したように、他のエピトープに対する抗体のラベル付け後、ラベリング キット製造元の指示に従ってエドゥを用いたエドゥ+核を検出します。暗闇の中で 37 ° C で 30 分間カクテルの反応でフローティングのセクションを孵化させなさい。洗浄後脳は 4 ° C で 15 分 PBT と 3 x をセクションします。
- 必要に応じて、ステップ 5.4 で説明したように、他のエピトープのラベル付け後、とおり BrdU+核を検出します。
- 暗闇の中で 30 分の 37 ° C で 2 N 塩酸で浮動セクションを孵化させなさい。
- 0.1 M ナトリウム ホウ酸バッファー pH 8.5 5 分各 RT で塩酸を中和するために暗闇の中での 2 回の浮動セクションを孵化させなさい。
- フローティングのセクション 3 簡単に x PBS で 4 ° C でを洗う
- 蛍光 BrdU ステップ 5.4 で説明するようにラベル付けを実行します。
- フローティングのセクション 10 μ g/mL 4', 6-diamidino-2-phenylindole 二塩酸塩 (DAPI) 細胞核対比染色に PBS での RT で 2 分間、インキュベートします。
- 室温 15 分 4% のホルムアルデヒドのフローティングのセクションを後置します。
- 簡単に PBS の浮動セクションを洗います。慎重に絵筆を使ってガラス顕微鏡スライドにフローティングのセクションを転送します。あぶらとり紙やティッシュを使用してセクションの周り余分な PBS をモップでふきます。
- PBS とカバーの 80% グリセロールを使用するゆっくりとガラス基板とトラップの空気の泡を避けるためにセクションをマウントします。暗闇の中で画像の取得 (ステップ 7) まで 4 ° C でスライドを格納します。
6. クライオスタット切片と Cryosection 蛍光ラベリング
- 必要な場合は、手順 4.1 で説明したメタノールから hindbrains を水分補給します。
- Hindbrains cryoprotect hindbrains 凍結前に PBS で 30 w/v ショ糖で孵化させなさい。
注: Hindbrains、彼らは通常 ≤ 2 h は、管の底に沈んでいるときにフリーズの準備ができて e9.5 10.5 hindbrains と e11.5 13.5 hindbrains の 3-6 時間。 - 光切断温度化合物の hindbrains (OCT) が水没し、イソペンタン-40 ° C とドライアイスで-50 ° C の間に冷却する 10 月の hindbrains を含む鋳型を転送することによってすぐにフリーズします。
注: 短期的に-20 ° C と区分まで-80 ° C 長期冷凍、組み込み hindbrains を格納できます。 - クライオスタットと静電剥離防止用スライドへの転送を使用して 10 μ m の厚さに横菱脳のセクションをカットします。
注: 菱脳の凍結切片は-20 ° C 短期およびラベリングまで長期的に-80 ° C で保存できます。 - 常温 15 分スライドするセクションを乾燥するスライドを孵化させなさい。PBS の凍結切片を洗うディゾルブ 10 月とマーク PAP ペンを使って凍結切片のまわりで障壁を疎水性にします。5.4 5.8 の手順を繰り返します。
- 5.10 グリセリンの代わりにポリビニル アルコール ベース マウント媒体を使用して手順を繰り返します。
7. 画像の取得
- 画像のサンプルは、epifluorescent または水性メディア マウント スライドと反応に使用される蛍光物質に適した光学フィルターに適したレンズを搭載した共焦点レーザー走査顕微鏡を使用します。
- 全体の脳や脳セクションをイメージするには、(例えば図 2 b); 10 倍の倍率のレンズを使用します。定量化のための hindbrains 領域を視覚化するには、倍の倍率 (例図 2 D) 個々 の細胞を可視化する、(例えば図 2) 63 x 倍率とレンズを使用する 40 を使用します。
8. 代替方法
- 次のステップは、3.8、フローサイトメトリーアプリケーション15の単一細胞懸濁液を生成する固定されていない hindbrains をホモジナイズしてください。
- 次のステップは、3.8、固定されていない hindbrains RT qPCR (例えば、 16) の単一細胞懸濁液から RNA を抽出するホモジナイズしてください。
注: すべての試薬および機器は、維持滅菌と RNase フリーで RNA の分解を防ぐために。 - 次のステップは、3.8、Npc を分離し、体外の菱脳 NPC 動作17の分析のための神経幹細胞としてそれらを広めるに固定されていない hindbrains をホモジナイズしてください。
注: すべての試薬および機器は、維持 neurosphere 文化の細菌/真菌の汚染を防ぐために滅菌します。
結果
このセクションでは、wholemount と組織の断面解析によるマウス胚脳における神経新生を勉強して得られる結果の例を示しています。
分裂マーカー pHH3 VZ (図 2 b - D) の Npc を分割を可視化するため抗体 microdissected 菱脳の wholemount の反応を示します。PHH3 を示す+ Npc 有糸分裂 (図 2) のさまざまな段階を強調する高倍率で。我々 はこの臓器 (図 2 D) NPC 細胞分裂の時間的経過を観察するための脳の開発のいくつかの連続した段階にわたって実行するこの標識方法が適しているを説明しています。
我々 は、エドゥ注射後 1 h 後脳の横カルビンディン抗体 vibratome セクションをイメージング分裂 Npc (図 3 b)、サイクリングの偽重層上皮核移行パターンの胸の谷間方向を可視化する表示します。前駆細胞18 (図 3 b, D) と VZ の全体的な構造 (図 3 b - D)。その細胞分裂の pHH3 に注意してください+ Npc が心室の表面にのみ存在とないより肺尖 (図 3) を対照前脳19でもっと努力して Npc の基底部のパターン。
また Npc とその子孫な分化をサイクリングを分類 BrdU やエドゥ NPC 系統進行 (図 4) を評価することができる方法を示します。マウス脳 BrdU のキ67 BrdU 投与後 1 日目の横の凍結切片の反応という数の神経上皮 (図 4 a, B) で Npc をサイクリングの位置と数を示しますキ67 の割合を計算することで Npc を自己更新を定義できます (図 4 a、 C) すべての BrdU+細胞の中で細胞の+ BrdU+ 。
最後に、RC2、NPC 終足 (図 5 b)、プロセス (図 5) 視覚化すること、ネスチン神経固有の中間径フィラメント内の抗原の菱脳 vibratome セクションの反応の例を示します。Vibratome セクションではなく、薄い凍結切片改良された観測高度分岐の Npc とも全体的な上皮細胞内構造を許可します。

図 1: E11.5 マウス胚から、菱脳の解剖の重要なステップです。(A - D)菱脳レーザーマイクロダイ セクションの模式図。(A) 尾側頭部組織、赤点線に沿って切断することによって削除されます。(B) 屋根板のピアスし、正中線 (垂直の赤い線) に沿って吻側と尾側方向に引き裂かし、横菱脳神経上皮を明らかにします。(C) 神経上皮は、両方の構造体の間の鉗子を挿入後髄膜から pried、中脳、脊髄の組織は赤い点線に沿って鉗子で組織を切断することによって削除されます。(D) この手順には、平坦化された脳が得られます。(E-K)菱脳レーザーマイクロダイ セクション手順で主要な段階のイメージをキャプチャします。(E) 胚は点線に沿って切断することによって首を。(F) 菱脳と屋根板で囲まれた 4th心室を切除、点線に沿って切断することによって頭から分離します。(G) 4th心室は上向きに前に小さな穴 (アスタリスク) 屋根板に穴を開けています。菱脳を公開する正中線 (矢印) に沿って尾側と吻方両方慎重に組織を剥離により穴が拡大します。菱脳は軟膜側を下に配置、左に開いた本準備にさっと (H; 黒矢印は菱脳神経組織を示します)。菱脳は wholemount 反応のために必要がある場合、(私) 鉗子を使用して周囲の硬膜の膜から脳神経を優しくこじった軟膜が削除されます。中脳 (mb) と脊髄 (sc) を過剰な組織が削除された (点線j) 後脳 (K) を分離します。スケール バー: (E) 500 μ m、300 μ m (F - K) のため。この図の拡大版を表示するのにはここをクリックしてください。
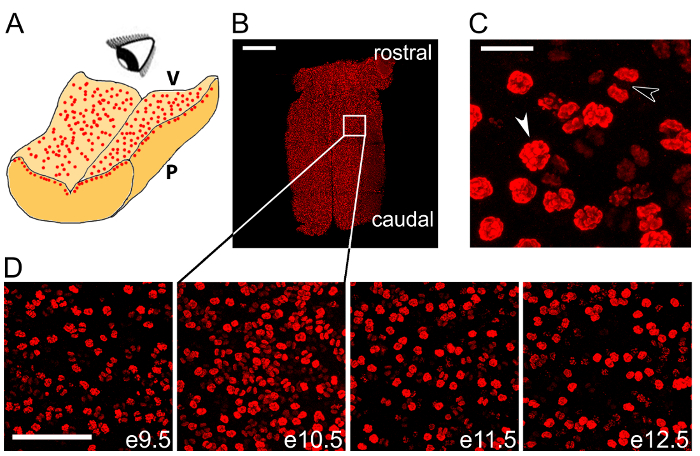
図 2: Wholemount 反応は菱脳の間で NPC の有糸分裂を定量化する使用ことができます。(A) 回路図は後脳室層で細胞分裂の Npc のアンの顔画像を示します。V、後脳室側。P、菱脳軟膜側。(B) タイル共焦点スキャン z スタック e10.5 後脳細胞分裂マーカー pHH3 (赤) の wholemount 反応を次の。白いボックスは、(D) で 2 番目のパネルで高倍率で表示される領域を示します。(C) 前後期 (白い矢印) と後期 (黒矢印) の核分裂像は、wholemount pHH3 の有糸分裂の Npc。 (D) 時間コース e9.5 13.5 からラベルの総コホート内で区別。スケール バー: (B) 500 μ m(C) 20 μ m(D) 100 μ m。この図の拡大版を表示するのにはここをクリックしてください。
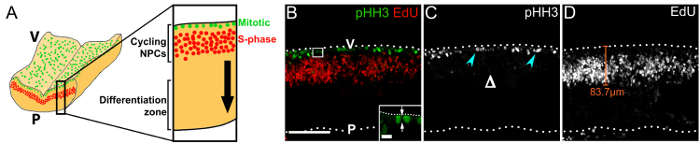
図 3: 内の吻側菱脳の胚ゾーン内サイクリング Npc 。(A) の回路図が分裂 (緑) と S 期 (赤) Npc 後脳室表面と脳室周囲地区の位置をそれぞれ描いた。菱脳を介して仮想断面が右側の高倍率で表示されます。黒い矢印は、分化ゾーンに向かって細胞周期が終了した NPC の子孫の移動の方向を示します。1 h エドゥ パルス; を受信した胚から浮動 e11.0 菱脳セクションの (B) 共焦点 z スタックpHH3 とエドゥの反応は、それぞれ分裂 (緑) と S 期 (赤) Npc を視覚化に使用されました。菱脳表面は点線で示されます。V、後脳室側。P、菱脳軟膜側。はめ込み; の高倍率に白いボックスで示された領域が表示されます。矢印は、後期では、心室の表面を基準にして NPC のへき開面を示しています。(C) シングル チャネルの pHH3 反応のみを表示します。有糸分裂の Npc は水色の矢印で示されます基底部門の欠如は、Δ。 (D) 単一チャネル エドゥ ラベルのみを表示するが表示されます。エドゥ+の Npc は、胎生期のため多分布を採用します。代表的なオレンジ色の線で示される、Npc が心室の表面から移行距離を測定できます。スケール バー: 100 μ m (B -D);(B) の挿入で 10 μ m。この図の拡大版を表示するのにはここをクリックしてください。
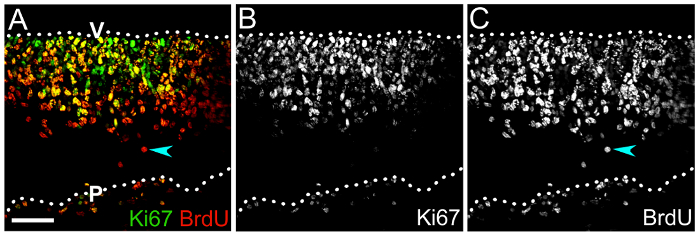
図 4: 脳 NPC 自己複製能力を決定するキ67 付け組み合わせ BrdU 。キ67 (緑) と BrdU (赤) 1 翌日 BrdU パルスにラベリングした後 e10.5 菱脳 cryosection の (A) 共焦点 z スタック。心室のゾーンで二重陽性細胞は、キ67 ラベルで示された BrdU を組み込まれている、まだ細胞周期を通って動いている Npc です。BrdU+の総人口の間で二重標識細胞の割合は、自己更新 Npc。 (B、 C) の割合を表すキ67 を表示するチャンネルをシングル (B) と BrdU (C) 反応のみ。キ67 を欠いている、したがって細胞周期を終了している可能性が高い BrdU+セルは、(A、C) 水色の矢印によって示されます。菱脳表面は点線で示されます。V、後脳室側。P、菱脳軟膜側。スケール バー: 50 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 5: NPC プロセスと終足特異反応を可視化します。(A - C)ネスチン神経の中間径フィラメントのエピトープを認識する RC2 の蛍光は、後脳神経上皮間 NPC 形態を示しています。次の RC2 反応; e11.5 菱脳からフローティング部 (A) 共焦点 z スタックボックス エリアに高倍率で表示されます (B、 B'; 頂/心室領域) と (C、 C'; 基底領域)。菱脳表面は点線で示されます。V、後脳室側。P、菱脳軟膜側。(B、 C)(A) でボックス化された地域の共焦点 z スタック光学セクションの一つは, (B' C')、それぞれ。心室の表面に停泊している NPC 頂 endfoot (B') の矢印で示されます。シングル、しかしいくつかの NPC プロセスで白と黒の矢印で示されます (C')、それぞれ。スケール バー: 100 μ m、(A);(B、C) の 25 μ m。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
このプロトコルでは、発達神経新生のメカニズムを研究するモデルとしてマウス胚後脳を使用する方法について説明します。さまざまな異なる反応方法を使用して、菱脳の Npc を視覚化できるし、自分の番号定量化ティッシュ セクション内またはオルガン wholemounts。郭清とフラット構造の容易さは、菱脳器官全体神経パターンに関する情報を収集する「開いた本」準備ために視覚化されることを保証します。
さらに、NPC の形態と細胞周期関連 NPC 位置フローティングで簡単に視覚化することを示す- または菱脳の凍結切片。哺乳類終20以前行った新しい前駆細胞集団を定義する両方の動作が悪用される可能性があります。たとえば、 Sox2+原基の初期形成とPax6+頂放射状グリア細胞が脳21,22、存在ですが菱脳Tbr2+基底前駆細胞3 が欠けています。.
ここで説明されているプロトコルは、ライブ イメージングや固定組織でトレースする血統の蛍光標識によって特定の NPC 集団の行動を観察することができます。たとえば、タモキシフェン誘導Sox1 iCreERT2遺伝子とRosa26tdTomato記者23運ぶマウスから hindbrains を研究することによってこの実現できます。
マウス神経新生の知識を高めるだけでなく菱脳の勉強が広く関連する神経因性機構解明、種の間で共有される菱脳が非常に節約された脳の領域と似ていると予想されるため脳よりも脊椎動物種は。
脳神経は脳神経新生23より比較的短い時間帯にわたって起こる、十分に比較する必要がある段階胚を考慮することが重要です。したがって、実験的バイアスを回避してからカウント、その後脳を分離する前に胚の体節のペアの数を記録します。菱脳組織自体は壊れやすく、ヘッド間充織と髄膜; から脳組織を分離する時、鉗子は慎重に処理するかではそのため「練習実行」のカップルをお勧めしたがって場合があります貴重な胚の解剖を試みる前に。さらに、hindbrains は、鉗子 (ピペットの開口部は清潔なハサミで先端の切断によって拡張できる) 損傷を避けるためではなく、ワイドボア パスツール ピペットを使用して別の 1 つの管から移送すべき。最後に、稀に、S 相 Npc へのエドゥ/BrdU 取り込みの範囲変数があります、特に (すなわち、1 h) 短いパルスの中に。標識を改善するためにエドゥ/BrdU を注射器にソリューションを読み込む前に正しく解散を確認、慎重に腹腔内に注入します。貧しい注射、皮下の事故によって作られたものなどで失ったり、エドゥ/BrdU 溶液をトラップと循環に入るからそれを防ぐ。
開示事項
作者が競合する利益または矛盾した興味あります。
謝辞
ヴァシリキ Chantzara にありがとう時限とマウスの飼育のための眼科学 UCL 研究所で生物学的リソースの単位のスタッフを運ぶします。この研究は、Wellcome の信頼賞 095623/Z/11/z CR に支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Round-bottomed reagent tube, 2.0 ml (Safe-Lock) | VWR | 211-2120 | Also available from other commercial suppliers |
| Plastic cell culture dish, 60 mm | Thermo Fisher | 150288 | Also available from other commercial suppliers |
| Cell culture plates, 12-well | Thermo Fisher | 150628 | Also available from other commercial suppliers |
| Pasteur pipettes | Copan | 200C | Also available from other commercial suppliers |
| Dumont Watchmaker forceps, no. 5 | FST | 91150-20 | |
| Dumont Watchmaker forceps, no. 55 | FST | 11295-51 | |
| 29G needle/syringe | BD | BD Micro-Fine +1ml | |
| Anti-phospho-histone H3 primary antibody | Millipore | 06-570 | Goat, dilution 1:400 |
| Anti-BrdU primary antibody | Abcam | ab6326 | Rat, dilution 1:400 |
| Anti-Ki67 primary antibody | BD Biosciences | 550609 | Mouse, dilution 1:400 |
| Anti-RC2 primary antibody | Developmental Studies Hybridoma Bank | RC2 | Mouse (IgM), dilution 1:400 |
| Alexa Fluor 488-conjugated goat anti rabbit secondary antibody | Thermo Fisher | A11029 | Dilution 1:200 |
| Alexa Fluor 594-conjugated goat anti rabbit secondary antibody | Thermo Fisher | A11037 | Dilution 1:200 |
| Alexa Fluor 488-conjugated goat anti mouse IgM secondary antibody | Thermo Fisher | A21042 | Dilution 1:200 |
| Alexa Fluor 488-conjugated goat anti mouse secondary antibody | Thermo Fisher | A11001 | Dilution 1:200 |
| Alexa Fluor 594-conjugated goat anti rat secondary antibody | Thermo Fisher | A11007 | Dilution 1:200 |
| 4',6-Diamidino-2-Phenylindole, Dihydrochloride (DAPI) | Sigma | D9542 | Use at 10 μg per mL |
| 5-ethynyl-2’-deoxyuridine (EdU) | Sigma | 900584 | |
| 5-bromo-2´-deoxyuridine (BrdU) | Sigma | B5002 | |
| Click-iT EdU Alexa Fluor 594 Imaging Kit | Thermo Fisher | C10086 | |
| Heat-inactivated goat serum | Sigma | G9023 | |
| Bovine serum albumin | Sigma | A7906 | |
| DAKO protein-block serum free | Agilent | X0909 | |
| Triton X-100 | Sigma | T8787 | Also available from other commercial suppliers |
| Phosphate buffer saline | Sigma | P4417 | Also available from other commercial suppliers |
| Paraformaldehyde | Sigma | P6148 | Also available from other commercial suppliers |
| Sodium tetraborate | Sigma | B9876 | Also available from other commercial suppliers |
| Sucrose | Sigma | S0389 | Also available from other commercial suppliers |
| Agarose | Sigma | A9539 | Also available from other commercial suppliers |
| Super PAP pen liquid blocker | Ted Pella, Inc. | 22309 | |
| SlowFade Antifade Kit | Thermo Fisher | S-2828 | |
| Glycerol | Fisher Scientific | 10337700 | |
| Mowiol | Millipore | 475904 | |
| OCT | Scigen | 4583 | Also available from other commercial suppliers |
| Isopentane | Sigma | M32631 | Also available from other commercial suppliers |
| Methanol | Thermo Fisher | 10675112 | Also available from other commercial suppliers |
| Hydrochloric acid | Thermo Fisher | 10316380 | Also available from other commercial suppliers |
| Microscope slides | VWR | 631-0912 | |
| Superfrost microscope slides | VWR | 631-0108 | |
| Thermometer | VWR | 620-0858 | |
| Cover glass | VWR | 631-0137 | |
| Stereo Microscope, Leica MZ16 | Leica | not applicable | |
| Confocal laser scanning microscope LSM710 | Zeiss | not applicable |
参考文献
- Wilsch-Brauninger, M., Florio, M., Huttner, W. B. Neocortex expansion in development and evolution - from cell biology to single genes. Curr Opin Neurobiol. 39, 122-132 (2016).
- Gregg, C., Weiss, S. CNTF/LIF/gp130 receptor complex signaling maintains a VZ precursor differentiation gradient in the developing ventral forebrain. Development. 132 (3), 565-578 (2005).
- Kwon, G. S., Hadjantonakis, A. K. Eomes::GFP-a tool for live imaging cells of the trophoblast, primitive streak, and telencephalon in the mouse embryo. Genesis. 45 (4), 208-217 (2007).
- Krumlauf, R. Hox Genes and the Hindbrain: A Study in Segments. Curr Top Dev Biol. 116, 581-596 (2016).
- Guthrie, S. Patterning and axon guidance of cranial motor neurons. Nat Rev Neurosci. 8 (11), 859-871 (2007).
- Fantin, A., Vieira, J. M., Plein, A., Maden, C. H., Ruhrberg, C. The embryonic mouse hindbrain as a qualitative and quantitative model for studying the molecular and cellular mechanisms of angiogenesis. Nat Protoc. 8 (2), 418-429 (2013).
- Terriente, J., Gerety, S. S., Watanabe-Asaka, T., Gonzalez-Quevedo, R., Wilkinson, D. G. Signalling from hindbrain boundaries regulates neuronal clustering that patterns neurogenesis. Development. 139 (16), 2978-2987 (2012).
- Coolen, M., Thieffry, D., Drivenes, O., Becker, T. S., Bally-Cuif, L. miR-9 controls the timing of neurogenesis through the direct inhibition of antagonistic factors. Dev Cell. 22 (5), 1052-1064 (2012).
- Dias, J. M., Alekseenko, Z., Applequist, J. M., Ericson, J. Tgfbeta signaling regulates temporal neurogenesis and potency of neural stem cells in the CNS. Neuron. 84 (5), 927-939 (2014).
- Jacob, J., et al. Retinoid acid specifies neuronal identity through graded expression of Ascl1. Curr Biol. 23 (5), 412-418 (2013).
- Alexandre, P., Reugels, A. M., Barker, D., Blanc, E., Clarke, J. D. Neurons derive from the more apical daughter in asymmetric divisions in the zebrafish neural tube. Nat Neurosci. 13 (6), 673-679 (2010).
- Peretz, Y., et al. A new role of hindbrain boundaries as pools of neural stem/progenitor cells regulated by Sox2. BMC Biol. 14, 57 (2016).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. J Vis Exp. (26), (2009).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nat Neurosci. 15 (2), 329-337 (2011).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Hutton, S. R., Pevny, L. H. SOX2 expression levels distinguish between neural progenitor populations of the developing dorsal telencephalon. Dev Biol. 352 (1), 40-47 (2011).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing embryonic mouse neural stem cell culture using the neurosphere assay. J Vis Exp. (47), (2011).
- Sauer, F. Mitosis in the neural tube. The Journal of Comparative Neurology. 62 (2), 377-405 (1935).
- Sessa, A., Mao, C. A., Hadjantonakis, A. K., Klein, W. H., Broccoli, V. Tbr2 directs conversion of radial glia into basal precursors and guides neuronal amplification by indirect neurogenesis in the developing neocortex. Neuron. 60 (1), 56-69 (2008).
- Pilz, G. A., et al. Amplification of progenitors in the mammalian telencephalon includes a new radial glial cell type. Nat Commun. 4, 2125 (2013).
- Fantin, A., et al. Tissue macrophages act as cellular chaperones for vascular anastomosis downstream of VEGF-mediated endothelial tip cell induction. Blood. 116 (5), 829-840 (2010).
- Kayam, G., et al. A novel role for Pax6 in the segmental organization of the hindbrain. Development. 140 (10), 2190-2202 (2013).
- Tata, M., et al. Regulation of embryonic neurogenesis by germinal zone vasculature. Proc Natl Acad Sci U S A. 113 (47), 13414-13419 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved