Method Article
O rombencéfalo Mouse como um modelo para o estudo embrionário neurogênese
Neste Artigo
Resumo
Este artigo demonstra como o rombencéfalo embrionário do mouse pode ser usado como um modelo para o estudo do desenvolvimento neurogênese em todo órgão e preparações em tecido.
Resumo
O prosencéfalo de embrião de rato é o sistema mais comumente empregado para estudar mamíferos neurogênese durante o desenvolvimento. No entanto, o prosencéfalo altamente dobrado neuroepithelium não é passível de análise de wholemount para examinar os padrões de todo o órgão neurogênese. Além disso, definir os mecanismos da neurogênese prosencéfalo não é necessariamente preditivo da neurogênese em outras partes do cérebro; por exemplo, devido à presença de subtipos específicos do prosencéfalo progenitoras. O rombencéfalo rato fornece um modelo alternativo para estudar neurogênese embrionário que é passível de análise wholemount, bem como cortes de tecido para observar a spatiotemporal distribuição e comportamento de progenitores neurais. Além disso, ele é facilmente dissecado para outras aplicações a jusante, tais como análise de isolamento ou biologia molecular de células. Como o rombencéfalo do mouse pode ser prontamente analisado no vasto número de repórter de linhagem de células e cepas de rato mutante que se tornaram disponíveis, oferece um poderoso modelo para o estudo dos mecanismos celulares e moleculares da neurogênese no desenvolvimento em um mamífero organismo. Aqui, apresentamos um método simples e rápido para usar o rombencéfalo de embrião de rato para analisar o comportamento de célula (NPC) mamíferos progenitoras neurais em preparações wholemount e cortes de tecido.
Introdução
Durante o desenvolvimento embrionário dos mamíferos, NPCs dividem o ventricular (VZ) e subventricular zonas (SVZ) do neuroepithelium em expansão para gerar novos neurônios em um processo denominado 'neurogênese'. A geração de novos neurônios e seus precursores do NPC foi investigada extensivamente no prosencéfalo1, embora menos é sabido sobre este processo em outras regiões.
O prosencéfalo é uma estrutura complexa e intricada dobrada que é largamente estudada com métodos histológicos após corte de tecido, que faz os padrões de neurogênese compreensão horizontal o órgão inteiro desafiador. Além disso, estudos de neurogênese prosencéfalo não são necessariamente preditivos de comportamento neurogênico em outras regiões do cérebro ou na medula espinhal. Por exemplo, sinalização de pistas podem eliciar respostas diferentes em regiões distintas do CNS, como observado no caso do fator neurotrófico ciliar e fator inibitório de leucemia, que promovem a auto-renovação de NPCs na eminência ganglionar lateral, mas de carro diferenciação da medula espinhal progenitores2. Além disso, uma subclasse dos NPCs que preencher o prosencéfalo em desenvolvimento e contribuir significativamente para a expansão do córtex cerebral1 estão ausentes do rombencéfalo e a medula espinhal3. Inversamente, é concebível que a medula espinhal e o rombencéfalo contenham subtipos NPC alternativos não está presentes no córtex.
O rombencéfalo de embrião de rato é a região mais antiga evolutiva dos cérebros dos mamíferos e gera o cerebelo e o tronco cerebral. Apesar de sua conservação em toda a espécie, relativamente pouco é conhecido sobre a neurogênese rombencéfalo, incluindo subtipos NPC ou seu regulamento. A maioria das pesquisas rombencéfalo no mouse centrou-se sobre o processo de segmentação de tecido, guiado por Hox genes4e a padronização dos neurônios pós mitóticas5. Além disso, o rombencéfalo tem sido usado como um modelo para estudar os mecanismos da angiogênese no desenvolvimento6.
Em contraste com o rombencéfalo de rato, o zebrafish rombencéfalo tem sido amplamente utilizado para seguir a diferenciação do NPC e progressão da linhagem de um organismo modelo vertebrados (por exemplo,7,8). O rombencéfalo miúda também tem sido empregado para estudar a neurogênese durante o desenvolvimento de vertebrados (por exemplo,9,,10). Semelhante do zebrafish rombencéfalo11, o rombencéfalo garota pode ser ao vivo fotografada para estudar o comportamento do NPC e o Regulamento sobre tempo12. Análoga observação longitudinal de imagem ao vivo não é atualmente possível em organismos mamíferos, porque eles desenvolvem no útero. Além disso, alvo de manipulação através de técnicas como electroporation pode ser facilmente aplicado a vida livre do zebrafish embriões ou garota embriões no ovo (por exemplo,13), mas tais técnicas são também mais desafiador em utero.
Não obstante, o rombencéfalo de embrião de rato é requintadamente adequado para definir os mecanismos moleculares e celulares que governam a neurogênese. Em primeiro lugar, análise do rombencéfalo rato, em muitos casos, fornecerá informações mais relevantes à evolução de seres humanos do que o obtido através do estudo de vertebrados inferiores. Além disso, dispomos de um vasto número de estirpes de rato geneticamente modificado que pode também ser usado para mapeamento murino NPCs de destino ou alterar mecanismos reguladores com alelos mutantes constitutivos ou condicionais de genes relevantes. Finalmente, recentemente tem sido demonstrado que microinjeção de ventricular rombencéfalo progenitores ex vivo permite que pelo menos um breve exame do rombencéfalo NPC cinética14. No entanto, actualmente, muito pouco é conhecido sobre a spatiotemporal organização e comportamento do rombencéfalo NPCs em um contexto de órgão inteiro.
Aqui, vamos demonstrar um método simples e rápido para usar o rombencéfalo como um poderoso modelo para analisar o comportamento dos mamíferos de NPC em preparações wholemount e cortes de tecido. Nós fornecemos mais protocolos para usar immunolabeling para estudar parâmetros diferentes neurogênese e processo rombencéfalo amostras adicionais para aplicações moleculares a jusante como transcriptase reversa quantitativa (qRT)-PCR.
Protocolo
Todo o trabalho animal foi transportado UK Home Office e diretrizes éticas locais.
1. Resumo das etapas e sincronismo
- Realizar acasalamentos cronometrados de ratos adultos de uma tensão adequada para responder à questão biológica sob investigação para obter gestações de 9,5-e13.5 dia embrionário (e); requer 12 a 15 dias.
- Opcionalmente, preparar 5-bromo-2'-desoxiuridina (BrdU) / solução de 5-ethynyl-2'-desoxiuridina (EdU) e realizar a injeção (protocolo seção 2); requer ~ 1h no dia anterior ou no dia do isolamento do embrião, dependendo o comprimento desejado do EdU/BrdU rotulagem.
- Faz embrião dissecação de isolamento e rombencéfalo (protocolo seção 3); requer ~ 10 min/embrião.
- Executar wholemount imunofluorescência rotulagem (protocolo seção 4); necessita de 3 dias.
- Seção usando um vibratome e executar flutuante imunofluorescência de seção (seção 4 de protocolo): necessita de 2 dias.
- Seção usando um criostato e realizar imunofluorescência rotulagem de cryosections (protocolo seção 5); requer 2 dias.
2. injetar rato fêmea grávido com BrdU ou EdU (opcional)
- Dissolva BrdU ou EdU em solução salina estéril tamponada de fosfato (PBS) para as concentrações de 10 mg/mL e 1 mg/mL, respectivamente.
Cuidado: BrdU e EdU são tóxicos; Use proteção adequada. - Pesar o mouse grávido e calcular o volume de solução de BrdU ou EdU que deve ser administrado para chegar a 100 mg/kg BrdU ou 5 mg/kg, EdU.
- Injecte a solução de BrdU ou EdU através da rota intraperitoneal ou 1 h ou 1 dia antes de coletar os embriões, dependendo do comprimento necessário de rotulagem.
Nota: Rotulagem para 1h visualiza rombencéfalo as células em fase S. Rotulagem para 1 dia visualiza a progenitura do rombencéfalo NPCs.
3. dissecação de Hindbrains de e9.5 - e13.5 Mouse embriões
- Eutanásia em um mouse feminino cronometrado-grávida usando um procedimento eticamente aprovado na fase gestacional exigida (por exemplo, deslocamento cervical). Com uma tesoura afiada, abrir a cavidade peritoneal e com cuidado retirar o útero. Coloque o útero extirpado contendo os embriões em um prato plástico de 60 mm, contendo 20 mL PBS gelado.
Nota: Não é necessária uma técnica asséptica. - Faz todos dissecação mais usando um microscópio de dissecação. Usando o relojoeiro fórceps n º 5, rasgar a parede do músculo uterino para expor os embriões, liberar cada embrião por cortar o cordão umbilical e remover o saco vitelino.
- Usando uma pipeta Pasteur estéril com um furo largo abertura, transferi cada embrião para um prato de plástico limpo com PBS gelado.
- Usando pinças de relojoeiro número 55, cortar a cabeça (Figura 1E).
- Opcionalmente, manter um pequeno pedaço de tecido (por exemplo, ¼ de um saco vitelino ou ponta de cauda aproximadamente 2 mm) para isolamento de DNA genômico e genotipagem subsequente.
- Usando pinças de relojoeiro número 55, excisar o tecido contendo o rombencéfalo paralelo e imediatamente abaixo o rombencéfalo neuroepithelium para separá-lo do tecido facial e prosencéfalo (Figura 1F).
- Posição o rombencéfalo e lado dorsal caudal tecido de cabeça para cima e identificam ventrículoth 4, que é coberta por uma camada de tecido fino (placa de telhado). Cuidadosamente, furar a placa do telhado usando pinça de relojoeiro número 55 (Figura 1) e descascar fora excesso de tecido com fórceps, movendo-se rostralmente ao longo da linha mediana sobre o mesencéfalo e depois caudalmente sobre o posterior rombencéfalo e a medula espinhal (Figura 1 ); o rombencéfalo agora deve ser exposto em uma preparação de livro aberto (Figura 1 H).
- Prepare o hindbrains para wholemount immunolabeling (opção 1).
- Usando o número 55 da pinça de relojoeiro, cuidadosamente tease mesênquima cabeça restante longe e qualquer meninges anexadas ao lado pial do rombencéfalo usando fórceps (Figura 1I). Remova o mesencéfalo e o tecido da medula espinhal (Figura 1J) para deixar apenas o tecido rombencéfalo (Figura 1 K).
Nota: Esta etapa do procedimento não deve ser seguida no e9.5 ou e10.5, porque a tentativa de fazê-lo provavelmente prejudicaria o rombencéfalo neuroepithelium; Além disso, remover as meninges não é essencial porque o rombencéfalo neuroepithelium é suficientemente fina nesta fase para permitir a penetração eficiente de anticorpos para immunolabeling. Esta etapa deve, no entanto, ser seguido de e11.5 em diante, quando o tecido meníngeo consolida, para melhorar a penetração do anticorpo na neuroepithelium rombencéfalo. Dissecação é mais fácil quando realizada em PBS gelado (uso limpo PBS para cada rombencéfalo).
- Usando o número 55 da pinça de relojoeiro, cuidadosamente tease mesênquima cabeça restante longe e qualquer meninges anexadas ao lado pial do rombencéfalo usando fórceps (Figura 1I). Remova o mesencéfalo e o tecido da medula espinhal (Figura 1J) para deixar apenas o tecido rombencéfalo (Figura 1 K).
- Preparar o hindbrains para vibratome e cryosectioning (opção 2)
- Usando pinças de relojoeiro número 55, remova o mesencéfalo e tecido da medula espinhal (Figura 1J).
Nota: Não é necessário remover o mesênquima e meninges de hindbrains destinados ao corte (como mostrado na Figura 1I).
- Usando pinças de relojoeiro número 55, remova o mesencéfalo e tecido da medula espinhal (Figura 1J).
- Transferência de hindbrains do prato de plástico para tubos redondo 2 mL com uma pipeta Pasteur, aspirar todos os PBS e corrigir por 2 h a 4° C, com agitação suave-recém descongelado formaldeído do w/v 4% dissolvido em PBS.
Cuidado: O formol é tóxico; Use proteção adequada. - Enxágue vezes de hindbrains 3x com PBS. Armazenar a 4 ° C em PBS se immunolabeling vai começar dentro de 2-3 dias ou substituir PBS com 50% methanol/50% PBS por 5 min antes de transferir para 100% de metanol para mais armazenamento entre-20° C.
4. Wholemount imunofluorescência
- Se necessário, hidratar hindbrains em série decrescente diluições de metanol em PBS (por exemplo, 75% de metanol, metanol a 50%, 25% metanol) à temperatura ambiente (RT) por 5 min cada e então transfira para PBS.
Nota: Uma série graduada de metanol é necessária suavemente hindbrains Re-hidratar e garantir a conservação adequada de tecido. - Permeabilize hindbrains por 30 min a 4 ° C em PBS contendo 0,1% Triton X-100 (PBT), com leve agitação.
- Incube a hindbrains por 1 h a 4 ° C em PBT contendo 10% de soro de cabra inactivados por calor, com leve agitação.
Nota: Usar soro provenientes das espécies de anfitrião que os anticorpos secundários foram levantados em. Para anticorpos primários gerados na cabra, incubar em isento de soro proteína bloquear, por exemplo 5% albumina de soro bovino em PBS ou uma alternativa comercial apropriada (consulte a Tabela de materiais). Isso irá reduzir a coloração frequentemente observado quando usando anticorpos primários, erguidos em cabra não-específica. - Incubar a hindbrains durante a noite a 4 ° C, em PBT contendo 1% inactivadas pelo calor de soro e anticorpos primários com agitação suave (por exemplo, histona de coelho antifosfo H3 [pHH3] diluído 1: 400).
Nota: Para os anticorpos primários gerados na cabra, use PBT sem soro. - Lavar os hindbrains a 4 ° C 5 x com PBT de 1h cada.
- Incube a hindbrains durante a noite a 4 ° C, em PBT contendo apropriados fluoróforo conjugado anticorpos secundários (por exemplo, cabra anticoelho Alexa Fluor 488) em 1: 200 em PBT direcionado contra os anticorpos primários usados. Manter hindbrains no escuro daqui para proteger fluorophores fotobranqueamento.
Nota: Para os anticorpos primários gerados na cabra, use anticabras Fab fragmentos de anticorpos secundários para reduzir a mancha não específica. - Lavar os hindbrains a 4 ° C 5 x com PBT de 1h cada.
- Os hindbrains em formol 4% em PBS por 15 min em RT para preservação de longo prazo da ligação de anticorpos o postfix. Brevemente, lave duas vezes em PBS.
- Cobrir com um vidro de microscópio com duas camadas de fita isolante preta e uma pequena praça da fita em camadas para criar um bolso grande o suficiente para segurar um rombencéfalo impostos especiais de consumo.
- Transferir cada rombencéfalo em um bolso com uma pipeta Pasteur, retire o excesso de líquido e adicionar um reagente adequado antidesgaste para o bolso antes de cobri-lo lentamente com uma lamela de vidro para evitar bolhas de ar captura sob a lamínula. Selar a lamela e afixá-lo para o slide com uma fina camada de esmalte. Armazenar o slide a 4 ° C no escuro até a aquisição de imagens (protocolo seção 7).
5. Vibratome de seccionamento e flutuante seção imunofluorescência
- Se necessário, hidratar hindbrains do metanol, conforme descrito na etapa 4.1.
- Incorpore hindbrains fundido 3% w/v agarose preparado em água destilada.
Nota: Permita fundido agarose esfriar a aproximadamente a 55° C brevemente antes de incorporação para evitar dano de calor rombencéfalo. - Corte seções transversais rombencéfalo a uma espessura de 70 µm usando um vibratome. Transferi cada seção recém cortada com um pincel em um poço de uma placa de 24 contendo PBS gelado.
- Rotular as seções flutuantes como descrito nos passos 4.2-4.7, mas modificar os passos da seguinte maneira: Lave o flutuante seções 3x com PBT a 4 ° C por 15 min cada, diminuir o tempo de incubação para anticorpos secundários para 2 h e incubar em anticorpo secundário no RT
- Opcionalmente, após a rotulagem com anticorpos para outros resumos conforme descrito na etapa 5.4, detecta núcleos EdU+ usando um EdU rotulagem kit de acordo com as instruções do fabricante. Incube as seções flutuantes na reação de coquetel para 30 min a 37 ° C, no escuro. Rombencéfalo lavagem das seções a 4 ° C 3x com PBT por 15 min cada.
- Opcionalmente, após a rotulagem para outros resumos conforme descrito na etapa 5.4, detecta núcleos BrdU+ da seguinte forma.
- Incube seções flutuantes em 2 N de ácido clorídrico a 37 ° C por 30 min no escuro.
- Incube as seções flutuantes em tampão pH 8,5 do borato de sódio 0,1 M duas vezes durante 5 min cada à RT no escuro para neutralizar o ácido clorídrico.
- Lavar flutuantes seções 3 x brevemente em PBS a 4 ° C.
- Realize imunofluorescência rotulagem para BrdU conforme descrito na etapa 5.4.
- Incube as secções flutuantes por 2 min em RT em 10 µ g/mL 4', dicloridrato de 6-diamidino-2-phenylindole (DAPI) em PBS para counterstain do núcleo de células.
- As seções flutuantes em formol 4% por 15 min em RT o postfix
- Lave flutuantes seções brevemente em PBS. Transferi com cuidado, seções flutuantes para um vidro de microscópio usando um pincel. Limpa o excesso PBS em torno de seu usando um toalhete de papel ou tecido.
- Monte seções usando 80% glicerol em PBS e tampa lentamente com uma lamela de vidro para evitar bolhas de ar de armadilhagem. Slide de loja a 4 ° C, no escuro até a aquisição de imagens (etapa 7).
6. criostato seccionamento e Cryosection imunofluorescência rotulagem
- Se necessário, hidratar hindbrains do metanol, conforme descrito na etapa 4.1.
- Incube a hindbrains em sacarose 30% p/v em PBS para crioproteção hindbrains antes da congelação.
Nota: Hindbrains estão prontos para congelamento quando eles tem afundado no fundo do tubo, que normalmente leva ≤ 2 h para hindbrains de e9.5-10.5 e 3-6 h para hindbrains de e11.5-13,5. - Mergulhe o hindbrains da temperatura de corte óptico composta (OCT) e congelar rapidamente através da transferência de moldes contendo hindbrains na OCT para isopentano arrefecido a entre-40 ° C e -50 ° C, em gelo seco.
Nota: Hindbrains congelados, incorporados podem ser armazenados a-20 ° C a curto prazo e longo prazo de-80 ° C até seccionamento. - Corte seções transversais rombencéfalo a uma espessura de 10 µm usando um criostato e transferência para corrediças do microscópio eletrostaticamente adesivo.
Nota: O rombencéfalo cryosections podem ser armazenados no curto prazo-20 ° C e -80 ° C a longo prazo até rotulagem. - Incube em RT por 15 min para secar as seções para os slides. Lavar cryosections com PBS para dissolver OCT e marca uma barreira hidrofóbica ao redor de cryosections usando uma caneta PAP. Repita as etapas de 5.4-5.8.
- Repita a etapa 5.10 usando um meio de montagem à base de álcool polivinílico no lugar de glicerol.
7. aquisição de imagem
- Amostras de imagem usando um epifluorescente ou microscópio de varredura a laser confocal equipados com lentes apropriadas para slides montados mídia aquosas e filtros ópticos adequados para o fluorophores usado para immunolabeling.
- Para imagem o rombencéfalo inteiro ou uma seção do rombencéfalo, usar uma lente de ampliação de 10x (por exemplo, Figura 2B); para visualizar áreas hindbrains para quantificação, use um 40 X ampliação (por exemplo, Figura 2D) e para visualizar células individuais, use uma lente com uma ampliação de 63 x (por exemplo, a Figura 2).
8. alternativos métodos
- Seguindo passo 3.8, homogeneizar unfixed hindbrains para produzir uma suspensão única célula por citometria de fluxo aplicações15.
- Seguindo passo 3.8, homogeneizar unfixed hindbrains para extrair o RNA de suspensões celulares simples para RT-qPCR (e.g., 16).
Nota: Certifique-se de todos os reagentes e equipamentos são mantidos estéril e livre de RNase em toda para prevenir a degradação do RNA. - Seguindo passo 3.8, homogeneizar unfixed hindbrains para isolar NPCs e propagá-los em vitro como neurospheres para análise do rombencéfalo NPC comportamento17.
Nota: Certifique-se de todos os reagentes e equipamentos são mantidos estéril para evitar a contaminação bacteriana/fúngica das culturas neurosphere.
Resultados
Esta seção ilustra exemplos de resultados que podem ser obtidos quando estudando neurogênese no rombencéfalo embrionárias de rato através da análise de seção de wholemount e tecido.
Mostramos que immunolabeling de wholemount do rombencéfalo microdissected com um anticorpo para o marcador mitótica pHH3 visualiza dividindo NPCs no VZ (Figura 2B – D). Mostrar pHH3+ NPCs em uma ampliação alta para destacar as diferentes fases da mitose (Figura 2). Podemos ter ilustrado que este método de rotulagem é adequado para ser executadas em várias fases consecutivas de desenvolvimento rombencéfalo para observar o curso do tempo de mitose NPC neste órgão (Figura 2D).
Mostramos que imagem transversal immunolabeled vibratome seções do rombencéfalo 1 h após a injeção de EdU, visualiza a orientação de clivagem de NPCs mitóticas (Figura 3B), o padrão de migração nuclear pseudoestratificado, interkinetic de ciclismo progenitores18 (Figura 3B, D) e a estrutura geral de VZ (Figura 3B – D). Observe que mitótica pHH3+ NPCs estão presentes apenas na superfície ventricular e não mais basalmente (Figura 3), que contrasta o padrão de divisão basal de NPCs mais empenhados no posencéfalo19.
Podemos também ilustrar como ciclismo NPCs e seus descendentes diferenciados pode ser rotulado com BrdU ou EdU para avaliar a progressão de linhagem NPC (Figura 4). O immunolabeling de cryosections transversal do rombencéfalo rato 1 dia após a injeção de BrdU para BrdU e Ki67demonstra o número e posicionamento de ciclismo NPCs no neuroepithelium (Figura 4A, B), segundo o qual o número de auto renovação NPCs pode ser definida através do cálculo da percentagem de Ki67 células de BrdU+ + entre todas as células de BrdU+ (Figura 4A, C).
Finalmente, mostramos um exemplo de immunolabeling de seções de vibratome rombencéfalo para RC2, um antígeno no filamento intermediário neural específico nestin, para visualizar o NPC endfeet (Figura 5B) e processos (Figura 5). Seções de vibratome, ao invés de cryosections fina, permitir melhor observação dos NPCs altamente ramificados e também de estrutura geral neuroepithelial.

Figura 1 : Chave entra a dissecação de um rombencéfalo de um embrião de rato e11.5. ( – D) Representação esquemática do rombencéfalo microdissection. (A) o caudal cabeça tecido é removido pelo rompimento na linha pontilhada vermelha. (B), a placa do telhado é perfurado e em seguida arrancadas em sentidos rostrais e caudais ao longo da linha mediana (linhas vermelhas verticais) e depois lateralmente para revelar o rombencéfalo neuroepithelium. (C), o neuroepithelium é Erguido longe das meninges depois de inserir a pinça entre ambas as estruturas e os tecidos do mesencéfalo e medula espinhal são removidos pelo rompimento do tecido com a pinça ao longo das linhas pontilhadas vermelhas. (D), esse procedimento produz um rombencéfalo achatado. (E–K) Captura de imagem das principais fases do procedimento de microdissection rombencéfalo. (E), o embrião é decapitado por ruptura ao longo da linha pontilhada. (F) o rombencéfalo 4th ventrículo, delimitada pela placa do telhado, extirpado e estão separados da cabeça por cortando ao longo das linhas pontilhadas. (G) 4th ventrículo é orientado para cima antes de um pequeno buraco é perfurado na placa do telhado (asterisco). O buraco é ampliado por descascar o tecido cuidadosamente tanto rostral e caudalmente ao longo da linha mediana (setas) para expor o rombencéfalo. O rombencéfalo é lado pial posicionado para baixo e da esquerda para dobrar para fora em uma preparação de livro aberto (H; preto seta indica tecido neural do rombencéfalo). Se o rombencéfalo é necessário para wholemount immunolabeling, a membrana pial é removida por curiosos suavemente o rombencéfalo neuroepithelium partir das membranas meníngeas circundantes usando fórceps (eu). Mesencéfalo (mb) e da medula espinhal (sc) o excesso de tecido é removidas (linhas pontilhadas em J) para isolar o rombencéfalo (K). Barra de escala: 500 µm para (E), 300 µm para (F – K). Clique aqui para ver uma versão maior desta figura.
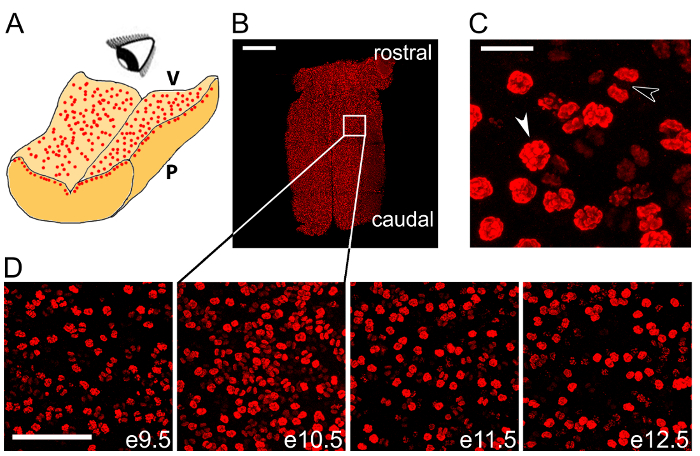
Figura 2 : Wholemount immunolabeling pode ser usado para quantificar mitoses NPC do outro lado o rombencéfalo. (A) esquema ilustrando o pt encarar imagens dos NPCs mitóticas na camada ventricular rombencéfalo. V, lado do rombencéfalo ventricular; P, lado pial rombencéfalo. (B) telha Confocal varredura pilha z do rombencéfalo e10.5 immunolabeling de wholemount para o pHH3 de marcador mitótica (vermelho) a seguir. Caixa branca indica a área mostrada na maior ampliação no segundo painel em (D). (C) pré-anáfase (seta branca) e figuras de mitose anáfase (seta preta) são diferenciadas dentro da coorte total claro mitótica NPCs. (D) o tempo de wholemount pHH3 de rotulagem de e9.5-13.5. Barras de escala: 500 µm em (B); 20 µm em (C); 100 µm em (D). Clique aqui para ver uma versão maior desta figura.
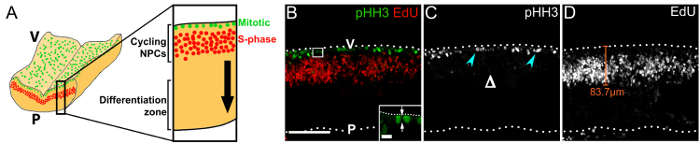
Figura 3 : Ciclismo NPCs dentro de sua zona germinal no rombencéfalo rostral. (A) esquema mostrando a posição do mitótica (verde) e fase S (vermelho) NPCs na superfície ventricular rombencéfalo e na área periventricular, respectivamente. Um corte transversal virtual através do rombencéfalo é exibida na maior ampliação à direita. A seta preta indica a direção da migração dos descendentes NPC que tenham saído do ciclo celular para a zona de diferenciação. Pilha de z Confocal (B) de uma seção de rombencéfalo e11.0 flutuante de um embrião que recebeu uma 1h EdU pulso; Immunolabeling para pHH3 e EdU foi usado para visualizar mitótica (verde) e NPCs de fase S (vermelho), respectivamente. Superfícies do rombencéfalo são indicadas por linhas pontilhadas; V, lado do rombencéfalo ventricular; P, lado pial rombencéfalo. A área indicada por uma caixa branca é mostrada na maior ampliação no baixo-relevo; as setas indicam o plano de clivagem de um NPC na anáfase, em relação à superfície ventricular. (C) único canal exibindo pHH3 immunolabeling apenas. NPCs mitóticas são indicadas por setas ciana; a falta de divisões basais é indicada pelo Δ (D) único canal exibindo EdU rotulagem apenas. EdU+ NPCs adotam uma distribuição pseudoestratificada devido a sua migração nuclear interkinetic. A distância que NPCs migram longe da superfície ventricular pode ser medida, conforme indicado com uma representante linha laranja. Barras de escala: 100 µm em (B -D); 10 µm em baixo-relevo em (B). Clique aqui para ver uma versão maior desta figura.
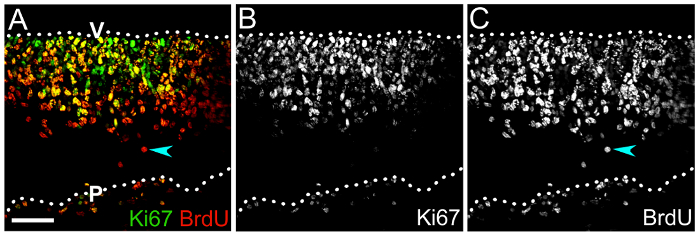
Figura 4 : BrdU combinando com Ki67 rotulagem para determinar a capacidade de auto-renovação NPC rombencéfalo. (A) pilha de z Confocal de um e10.5 rombencéfalo cryosection depois de rotulagem para Ki67 (verde) e BrdU (vermelho), após 1 dia de BrdU pulso. Duplo-positivo células na zona ventricular são NPCs que incorporaram BrdU e ainda estão se movendo através do ciclo celular, conforme indicado pelo Ki67 rotulagem. A proporção de células duplo-rotulado entre a população total de BrdU+ representa a porcentagem de NPCs auto renovadora. (B, C) único canais exibindo Ki67 (B) e immunolabeling de BrdU (C) somente. Uma célula de BrdU+ que carece de Ki67 e, portanto, provavelmente foi encerrado o ciclo celular é indicada por uma seta ciana em (A,C). Superfícies do rombencéfalo são indicadas por linhas pontilhadas; V, lado do rombencéfalo ventricular; P, lado pial rombencéfalo. Barra de escala: 50 µm. clique aqui para ver uma versão maior desta figura.

Figura 5 : Immunolabeling nestin visualiza NPC processos e endfeet. ( – C) Imunofluorescência para RC2, que reconhece um epítopo sobre o filamento intermediário neural nestin, ilustra a morfologia do NPC do outro lado o rombencéfalo neuroepithelium. Pilha de Confocal z (A) de uma seção de flutuação de um e11.5 rombencéfalo seguindo RC2 immunolabeling; áreas de box são mostradas na maior ampliação em (B, B'; região apical/ventricular) e (C, C'; basal região). Superfícies do rombencéfalo são indicadas por linhas pontilhadas; V, lado do rombencéfalo ventricular; P, lado pial rombencéfalo. (B, C) Pilhas de z confocal de box áreas no (A); única seções óticas são mostradas em ('B, C'), respectivamente. Um endfoot apical NPC ancorado na superfície ventricular é indicado por uma seta no (B'). Único e fasciculados NPC processos são indicados por setas brancas e pretas em (C'), respectivamente. Barras de escala: 100 µm, (A); 25 µm para (B, C). Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve como usar o rombencéfalo embrionárias de rato como modelo para estudar os mecanismos da neurogênese no desenvolvimento. Usando uma variedade de métodos diferentes immunolabeling, rombencéfalo NPCs pode ser visualizado e o número deles quantificado em cortes de tecido ou órgão wholemounts. A facilidade de dissecção e anatomia plana garante que o rombencéfalo pode ser fotografado em uma preparação de 'livro aberto' para reunir informações sobre os padrões de todo o órgão neurogênese.
Ainda mais, mostramos que NPC morfologia e posicionamento de NPC relacionados ao ciclo celular podem ser facilmente visualizados em flutuante- ou cryosections do rombencéfalo. Ambos os comportamentos podem ser explorados para definir novas populações de progenitor, como anteriormente foi realizado no telencéfalo mamíferos20. Por exemplo, cedo formado Sox2+ neuroepithelia e Pax6+ apical glia radial estão presentes no rombencéfalo21,22, mas o rombencéfalo carece de progenitores basais de Tbr2+ 3 .
O protocolo descrito aqui também pode ser adaptado para observar o comportamento de subpopulações de NPC específicos através da marcação fluorescente para geração de imagens ao vivo e/ou rastreamento de linhagem em tecidos fixos. Isto pode ser conseguido, por exemplo, através do estudo hindbrains de ratos carregando o tamoxifeno-inducible do transgene Sox1-iCreERT2 e o Rosa26tdTomato repórter23.
Além de melhorar o conhecimento da neurogênese murino, estudar o rombencéfalo pode elucidar mecanismos neurogênicos amplamente relevantes que são compartilhados entre espécies, porque o rombencéfalo é uma região do cérebro altamente conservadas que é esperada para ser o mais semelhante entre espécies de vertebrados do prosencéfalo.
Neurogênese rombencéfalo se exerce sobre uma janela de tempo comparativamente mais curta que prosencéfalo neurogênese23, é importante considerar a necessidade de comparar adequadamente encenado embriões. Por conseguinte, viés experimental é evitada contando e registrando o número de pares de somite em um embrião antes de isolar seu rombencéfalo. O próprio tecido do rombencéfalo é frágil e fórceps deve portanto ser manuseado com cuidado quando separa o tecido rombencéfalo o mesênquima cabeça e meninges; um par de 'prática pistas', portanto, seria aconselhável antes de dissecação de embriões valiosos é tentada. Além disso, hindbrains devem ser transferidos de um tubo para outro usando uma pipeta Pasteur de largo diâmetro, em vez de com a pinça para evitar danos (abertura da pipeta pode ser alargada por corte da ponta com uma tesoura limpa). Finalmente, apesar de incomum, a extensão da incorporação de EdU/BrdU na fase S NPCs pode ser variável, em especial durante pulsos curtos (ou seja, 1 h). Para melhorar a rotulagem, certifique-se de que o EdU/BrdU é dissolvido corretamente antes de carregar a solução para a seringa e injete cuidadosamente na cavidade peritoneal. Injeções de pobres, como aqueles feitos por via subcutânea, por acidente, irão resultar em perda ou prendendo a solução EdU/BrdU e impedi-lo de entrar em circulação.
Divulgações
Nenhum dos autores tem interesses concorrentes ou interesses conflitantes.
Agradecimentos
Agradecemos a Vasiliki Chantzara para a realização de acasalamentos cronometrados e o pessoal da unidade de recursos biológicos no Instituto de oftalmologia a UCL para criação de rato. Este estudo foi suportado por um Wellcome Trust Investigator Award 095623/Z/11/Z para CR.
Materiais
| Name | Company | Catalog Number | Comments |
| Round-bottomed reagent tube, 2.0 ml (Safe-Lock) | VWR | 211-2120 | Also available from other commercial suppliers |
| Plastic cell culture dish, 60 mm | Thermo Fisher | 150288 | Also available from other commercial suppliers |
| Cell culture plates, 12-well | Thermo Fisher | 150628 | Also available from other commercial suppliers |
| Pasteur pipettes | Copan | 200C | Also available from other commercial suppliers |
| Dumont Watchmaker forceps, no. 5 | FST | 91150-20 | |
| Dumont Watchmaker forceps, no. 55 | FST | 11295-51 | |
| 29G needle/syringe | BD | BD Micro-Fine +1ml | |
| Anti-phospho-histone H3 primary antibody | Millipore | 06-570 | Goat, dilution 1:400 |
| Anti-BrdU primary antibody | Abcam | ab6326 | Rat, dilution 1:400 |
| Anti-Ki67 primary antibody | BD Biosciences | 550609 | Mouse, dilution 1:400 |
| Anti-RC2 primary antibody | Developmental Studies Hybridoma Bank | RC2 | Mouse (IgM), dilution 1:400 |
| Alexa Fluor 488-conjugated goat anti rabbit secondary antibody | Thermo Fisher | A11029 | Dilution 1:200 |
| Alexa Fluor 594-conjugated goat anti rabbit secondary antibody | Thermo Fisher | A11037 | Dilution 1:200 |
| Alexa Fluor 488-conjugated goat anti mouse IgM secondary antibody | Thermo Fisher | A21042 | Dilution 1:200 |
| Alexa Fluor 488-conjugated goat anti mouse secondary antibody | Thermo Fisher | A11001 | Dilution 1:200 |
| Alexa Fluor 594-conjugated goat anti rat secondary antibody | Thermo Fisher | A11007 | Dilution 1:200 |
| 4',6-Diamidino-2-Phenylindole, Dihydrochloride (DAPI) | Sigma | D9542 | Use at 10 μg per mL |
| 5-ethynyl-2’-deoxyuridine (EdU) | Sigma | 900584 | |
| 5-bromo-2´-deoxyuridine (BrdU) | Sigma | B5002 | |
| Click-iT EdU Alexa Fluor 594 Imaging Kit | Thermo Fisher | C10086 | |
| Heat-inactivated goat serum | Sigma | G9023 | |
| Bovine serum albumin | Sigma | A7906 | |
| DAKO protein-block serum free | Agilent | X0909 | |
| Triton X-100 | Sigma | T8787 | Also available from other commercial suppliers |
| Phosphate buffer saline | Sigma | P4417 | Also available from other commercial suppliers |
| Paraformaldehyde | Sigma | P6148 | Also available from other commercial suppliers |
| Sodium tetraborate | Sigma | B9876 | Also available from other commercial suppliers |
| Sucrose | Sigma | S0389 | Also available from other commercial suppliers |
| Agarose | Sigma | A9539 | Also available from other commercial suppliers |
| Super PAP pen liquid blocker | Ted Pella, Inc. | 22309 | |
| SlowFade Antifade Kit | Thermo Fisher | S-2828 | |
| Glycerol | Fisher Scientific | 10337700 | |
| Mowiol | Millipore | 475904 | |
| OCT | Scigen | 4583 | Also available from other commercial suppliers |
| Isopentane | Sigma | M32631 | Also available from other commercial suppliers |
| Methanol | Thermo Fisher | 10675112 | Also available from other commercial suppliers |
| Hydrochloric acid | Thermo Fisher | 10316380 | Also available from other commercial suppliers |
| Microscope slides | VWR | 631-0912 | |
| Superfrost microscope slides | VWR | 631-0108 | |
| Thermometer | VWR | 620-0858 | |
| Cover glass | VWR | 631-0137 | |
| Stereo Microscope, Leica MZ16 | Leica | not applicable | |
| Confocal laser scanning microscope LSM710 | Zeiss | not applicable |
Referências
- Wilsch-Brauninger, M., Florio, M., Huttner, W. B. Neocortex expansion in development and evolution - from cell biology to single genes. Curr Opin Neurobiol. 39, 122-132 (2016).
- Gregg, C., Weiss, S. CNTF/LIF/gp130 receptor complex signaling maintains a VZ precursor differentiation gradient in the developing ventral forebrain. Development. 132 (3), 565-578 (2005).
- Kwon, G. S., Hadjantonakis, A. K. Eomes::GFP-a tool for live imaging cells of the trophoblast, primitive streak, and telencephalon in the mouse embryo. Genesis. 45 (4), 208-217 (2007).
- Krumlauf, R. Hox Genes and the Hindbrain: A Study in Segments. Curr Top Dev Biol. 116, 581-596 (2016).
- Guthrie, S. Patterning and axon guidance of cranial motor neurons. Nat Rev Neurosci. 8 (11), 859-871 (2007).
- Fantin, A., Vieira, J. M., Plein, A., Maden, C. H., Ruhrberg, C. The embryonic mouse hindbrain as a qualitative and quantitative model for studying the molecular and cellular mechanisms of angiogenesis. Nat Protoc. 8 (2), 418-429 (2013).
- Terriente, J., Gerety, S. S., Watanabe-Asaka, T., Gonzalez-Quevedo, R., Wilkinson, D. G. Signalling from hindbrain boundaries regulates neuronal clustering that patterns neurogenesis. Development. 139 (16), 2978-2987 (2012).
- Coolen, M., Thieffry, D., Drivenes, O., Becker, T. S., Bally-Cuif, L. miR-9 controls the timing of neurogenesis through the direct inhibition of antagonistic factors. Dev Cell. 22 (5), 1052-1064 (2012).
- Dias, J. M., Alekseenko, Z., Applequist, J. M., Ericson, J. Tgfbeta signaling regulates temporal neurogenesis and potency of neural stem cells in the CNS. Neuron. 84 (5), 927-939 (2014).
- Jacob, J., et al. Retinoid acid specifies neuronal identity through graded expression of Ascl1. Curr Biol. 23 (5), 412-418 (2013).
- Alexandre, P., Reugels, A. M., Barker, D., Blanc, E., Clarke, J. D. Neurons derive from the more apical daughter in asymmetric divisions in the zebrafish neural tube. Nat Neurosci. 13 (6), 673-679 (2010).
- Peretz, Y., et al. A new role of hindbrain boundaries as pools of neural stem/progenitor cells regulated by Sox2. BMC Biol. 14, 57 (2016).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. J Vis Exp. (26), (2009).
- Taverna, E., Haffner, C., Pepperkok, R., Huttner, W. B. A new approach to manipulate the fate of single neural stem cells in tissue. Nat Neurosci. 15 (2), 329-337 (2011).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Hutton, S. R., Pevny, L. H. SOX2 expression levels distinguish between neural progenitor populations of the developing dorsal telencephalon. Dev Biol. 352 (1), 40-47 (2011).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing embryonic mouse neural stem cell culture using the neurosphere assay. J Vis Exp. (47), (2011).
- Sauer, F. Mitosis in the neural tube. The Journal of Comparative Neurology. 62 (2), 377-405 (1935).
- Sessa, A., Mao, C. A., Hadjantonakis, A. K., Klein, W. H., Broccoli, V. Tbr2 directs conversion of radial glia into basal precursors and guides neuronal amplification by indirect neurogenesis in the developing neocortex. Neuron. 60 (1), 56-69 (2008).
- Pilz, G. A., et al. Amplification of progenitors in the mammalian telencephalon includes a new radial glial cell type. Nat Commun. 4, 2125 (2013).
- Fantin, A., et al. Tissue macrophages act as cellular chaperones for vascular anastomosis downstream of VEGF-mediated endothelial tip cell induction. Blood. 116 (5), 829-840 (2010).
- Kayam, G., et al. A novel role for Pax6 in the segmental organization of the hindbrain. Development. 140 (10), 2190-2202 (2013).
- Tata, M., et al. Regulation of embryonic neurogenesis by germinal zone vasculature. Proc Natl Acad Sci U S A. 113 (47), 13414-13419 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados