Method Article
Un método de cultura cooperación para investigar la interferencia entre rayos x irradia PBMC y células Caco-2
* Estos autores han contribuido por igual
En este artículo
Resumen
Presentamos un protocolo para investigar la diafonía entre Caco-2 irradiadas por rayos X y las células mononucleares de sangre periférica (PBMC). El protocolo comienza con la irradiación de Caco-2 y puesta en marcha de la cultura junto con PBMC; Posteriormente, trans epitelial resistencia eléctrica se mide regularmente durante 48 h y occidental la mancha blanca /negra en Caco-2 y PBMC.
Resumen
El protocolo adoptado en este trabajo tiene como objetivo desentrañar cómo rayos x perturba el funcionamiento de la barrera intestinal, centrándose en la interacción entre las células del tumor colorrectal y el sistema inmunológico. El carcinoma colorrectal es entre el tipo más común de cáncer, por lo general tratados por cirugía, quimioterapia y radioterapia. Ventajas de la radioterapia en la orientación del tumor son bien conocidos. Sin embargo, incluso limitada exposición de tejidos sanos es de gran preocupación, particularmente con respecto a los efectos sobre la barrera intestinal y el sistema inmunológico. La configuración adoptada permite para estudiar la interacción entre dos poblaciones de la célula en una situación más similar a la fisiológica, en comparación con cultivos de células normales. Para ello, recurrimos a diferentes técnicas y nos un en vitro cultura Co modelo, basado en las células Caco-2 diferenciadas como una monocapa y PBMC, compartiendo el mismo medio de cultivo. Este protocolo ha sido desarrollado para centrarse en los efectos macroscópicos, es decir, la viabilidad celular y resistencia eléctrica Trans epitelial (TEER) y, a través de western blot, alteraciones moleculares, es decir, la activación de la vía inflamatoria en las células inmunes y la expresión de la proteína de Unión estrecha en células Caco-2. Evaluación inicial de los efectos de la radiación sobre la viabilidad de las células Caco-2 se evaluó mediante el bromuro de 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium (MTT) y ensayos de azul de tripano, mientras que TEER se midió a intervalos de tiempo fijo con un ohmímetro específicamente diseñado para sistemas de co-cultivo. De esta manera, los efectos debido a la radiación, la presencia de células mononucleares los sangre periférica (PBMC) y, finalmente, su efecto sinérgico, se pueden demostrar. A través de estas técnicas complementarias, se observó una alta radio-resistencia de Caco-2 dentro del rango de 2 a 10 Gy de rayos y un aumento de la permeabilidad Caco-2 del monocapa cuando PBMCs fueron agregadas. En particular, presencia PBMC fue encontrado para ser asociado a la variación en la expresión de proteínas andamio tight junction.
Introducción
La metodología adoptada en este trabajo fue diseñada para investigar la interacción entre las células de cáncer colorrectal y el sistema inmunológico, explotando una puesta a punto más cercano a la condición fisiológica en comparación con las culturas de célula normal de 2 dimensiones.
Carcinoma colorrectal (CCR) es considerado el tercero más frecuente tipo de cáncer, con más de 1 millón de casos en todo el mundo (Observatorio de cáncer mundial, Agencia Internacional para investigación sobre cáncer, Organización Mundial de la salud, http://gco.iarc.fr). Administración de CRC se realiza habitualmente mediante cirugía, quimioterapia o radioterapia1. En comparación con técnicas invasivas como la cirugía o la quimioterapia, radioterapia en gran parte evita el típico reacciones sistémicas perjudiciales derivadas de los enfoques clínicos, gracias a la entrega localizada de dosis de radiación. Sin embargo, pueden surgir efectos secundarios en los tejidos sanos circundantes, provocando inflamación con daño directo a las células sanas y el daño mediado por efectos no dirigidos2,3,4. Centrándose en los efectos adversos debido a la radiación durante el tratamiento de cáncer colorrectal, dos aspectos deben ser investigados. En primer lugar, los mecanismos de impermeabilidad intestinal podrían verse alterados por la administración de radiación provocando, a su vez, la posibilidad de efectos secundarios debido a una alteración contención de población bacteriana y el paso paracelular de moléculas y solutos. En segundo lugar, la presencia de tejido linfático asociado a intestino (GALT) actúa como un puesto avanzado del sistema inmune, con la función de controlar el crecimiento bacteriano y mediando la respuesta inmune general5,6,7. Para cumplir estas funciones, se mantiene la impermeabilidad intestinal debido a la función de complejos de unión entre las membranas de las células. Por estas razones, las consecuencias perjudiciales inducidas debido a diferentes dosis de rayos x fueron investigadas en las células Caco-2 solamente y en co-cultivos con PBMC.
Aunque estudios en cultivos celulares es la primera hecha de investigación en la investigación biomédica, la falta de conocimiento detallado de los mecanismos celulares biología recíprocas interacciones entre diferentes tipos de células de conducción podría ser crítico cuando abordar el estudio de la fisiología de los órganos, sistemas y aparatos que no pueden crearse fácilmente en el laboratorio. Por lo tanto, se decidió adoptar una configuración de la cultura, permitiendo el estudio de dos poblaciones celulares juntos y la disección de los aspectos relacionados con mecanismos intercelulares y extracelulares.
La cultura es una técnica explotada al estudiar las funciones epiteliales y la interacción entre diferentes tipos de células. En particular, el uso de esta técnica se convierte en obligatorio en nuestro caso, porque los epitelios están formados por las células caracterizadas por polaridad. En el caso de la barrera intestinal, enterocitos muestran una polarización bien definida, con apical y basolateral polos normalmente separaron debido a la presencia de moléculas de adhesión creación de ensambladura apretada. Esta compartimentación es necesario para la fisiología del tejido, evitando paracelular tráfico y permite el paso de determinadas moléculas sólo. Esta característica es por supuesto imposible de recrear con una instalación de cultivo normal de la célula. Por otra parte, la adopción de la configuración de la cultura reproduce la presencia de células inmunes en la superficie basolateral, mientras que la superficie apical (correspondiente al lumen intestinal) no está directamente en contacto con otras células.
Recientemente, líneas de células Caco-2 cobró más importancia como modelo en vitro de la barrera intestinal. Aunque deriva de adenocarcinoma de colon humano, las células Caco-2 mantienen la capacidad de diferenciación y crean una monocapa polarizada funcional8, que permite la investigación de las propiedades de la membrana de la célula cuando se cultiva en un inserto de co-cultivo.
Cultivo de Caco-2 en una membrana porosa es un modelo bien establecido en vitro de monocapa intestinal, una mejora ha sido la cultura Co entre otras células y Caco-2. Este montaje se ha adoptado con frecuencia a medida de la diafonía entre diferentes tipos9 de la célula y puede utilizarse para desentrañar Caco-2 perturbado ante estímulos exógenos en la cultura, con respecto al Caco-2 cultivadas solo.
Muchos estudios han abordado Caco-2 comportamiento cuando Co culto con dos bacterias no patógenas y periférica de la sangre las células mononucleares, en particular aclarar la interferencia con el sistema inmune10. Pozo Rubio et al. 11 estudios de la expresión de varias citoquinas en un co-cultivo Caco-2/PBMC con bifidobacterias estimulando a las células Caco-2. Su trabajo destacó modificación sustancial a los perfiles de expresión de citoquinas dependiendo del estímulo bacteriano en presencia o ausencia de PBMC. Sus resultados llevan a la conclusión de que la presencia de PBMC sensibiliza Caco-2 a las bifidobacterias.
Diferentes respuestas de las células Caco-2 a las bacterias patógenas y no patógenas han sido evaluadas por equipos de investigación diferentes. Parlesak et al. 12 demostró los efectos inmunosupresores de células Caco-2 en Escherichia coli-estimulado PBMC. Por otra parte, Haller et al. 13 estudió la respuesta de las células Caco-2 estimuladas con ambos lipopolysaccharide (LPS) de enteropatógeno spp. de e. coli o bacterias no enteropatógeno I.e.e coli spp., Lactobacillus spp., fortalecer la conjetura que respuesta de las células Caco-2 depende estrictamente de la presencia de leucocitos en la configuración de la cultura.
Mediante la realización de ensayos de laboratorio complementarios diferentes (por ejemplo, western blot, resistencia eléctrica trans epitelial, MTT, etc.), además del análisis de diferentes tipos de células cultivadas en cocultivo, promete la metodología toda resultados que pueden considerarse a más representativo de lo que realmente sucede en vivo. Por otra parte, esta configuración permite la separación de los compartimentos de diferente cultura Co, permitiendo no sólo el estudio de los tipos celulares involucrados, sino también las moléculas de señalización intercelulares liberadas en el compartimiento superior vs. inferior o en la presencia vs ausencia de la cultura.
Protocolo
El siguiente protocolo implica el retiro de la sangre de voluntarios sanos. Los donantes proporcionaron consentimiento informado escrito antes de la inscripción. Este procedimiento es conforme a la declaración de Helsinki y extracciones de sangre fueron realizadas por un asistente profesional de la salud.
1. cultura y configuración de cocultivo de células
- Una semana antes de la irradiación, preparar una suspensión de células Caco-2 que contiene 2,5 × 105 células/mL en medio RPMI1640 fresco suplementado con 10% suero bovino fetal (FBS), 2 mM L-glutamina, 100 U/mL de penicilina y 100 de μg/mL estreptomicina.
- Semilla de 2 mL de la suspensión celular en 1 poro μm diámetro celular cultivo estériles insertos para placas de 6 pocillos y pone el relleno en una placa de 6 pozos.
Nota: Partes movibles de cultura celular deba activarse mediante incubación con medio completo estéril antes de la siembra de células. En este caso, medios de cultivo debe ser descartados y reemplazados con los medios de suspensión de la célula. - Añadir 3 mL de medio RPMI1640 fresco suplementado con 10% SFB, 2 mM L-glutamina, 100 UI/mL de penicilina y estreptomicina 100 μg/mL en cada compartimiento de la parte inferior y la cultura de las células a 37 ° C en una incubadora con atmósfera humidificada con 5% CO2.
- El mismo día de la irradiación de células Caco-2, recoger sangre entera humana en tubos con heparina de litio disponible en el mercado cubierto 6 mL (tamaño del tubo: 13 x 100 mm).
- Posteriormente, aislar las células mononucleares de sangre periférica (PBMC) utilizando gradiente de Ficoll. Separar PBMC, poner 25 mL de Ficoll en un tubo de centrífuga cónico de 50 mL y capa un volumen igual de sangre entera diluida 1:1 con RPMI1640 sobre la superficie de Ficoll.
Nota: Un donante sano normal generalmente tiene aproximadamente 4-10 × 106 PBMC/mL. - Centrifugar los tubos de 50 mL a 400 x g durante 30 min a temperatura ambiente.
- Recoger la PBMC en la interfase entre el plasma y el Ficoll por aspiración con una pipeta Pasteur y colocarlos en un tubo cónico de 15 mL.
- Lave la PBMC dos veces por agregar 10 mL de tampón fosfato salino (PBS) y centrifugación PBMC en 250 x g durante 10 minutos.
- Cultura de PBMC durante un máximo de 3-5 h en T25 frascos de2 cm en completan medio RPMI1640, como se describió antes, a 37 ° C en una atmósfera humidificada con 5% CO2.
Nota: Recoger PBMC en el día del experimento y semilla de 2 × 106 células/pozo, suspendido en 3 mL de medio RPMI1640 completo, en el compartimento inferior de la cultura de cooperación. Insertos con células Caco-2 se transfieren en los pozos que contienen PBMC 30 min después de su irradiación. PBMC de sangre entera no se mantienen en cultivo por más de aproximadamente 72 h si no estimulado con por ejemplo. fitohemaglutinina (PHA), después de lo cual se pierde la viabilidad de las células.
PRECAUCIÓN: La calidad y la seguridad de toda la sangre y productos sanguíneos deben garantizarse durante todo el proceso.
2. irradiación configuración
Nota: La irradiación de células Caco-2 se realizó en el Departamento de radioterapia del Istituto di Ricovero e Cura a Carattere Scientifico (IRCCS) S. Maugeri (Pavía, Italia) con un acelerador lineal que se utiliza habitualmente para tratar a diversos tipos de cánceres.
- Sistema energía de rayos x fotones al pico MV 6. El acelerador lineal opera en un régimen de pulso (tiempo entre dos pulsos consecutivos aproximadamente de 4 ms, tasa de duración de un solo pulso sobre 5 μs con una dosis de hasta 1 × 10-3 Gy/p).
- Coloque las placas de 6 pozos con injertos con Caco-2 en la trayectoria de los rayos x en un 1,4 cm de espesor Plexiglás hoja (correspondiente a una distancia ligeramente mayor que la acumulación de la radiación usada) a 100 cm de la fuente de radiación.
- Poner un bolo de cm de espesor 0,5 en cada muestra antes de la irradiación se produce garantizar el componente de retrodispersión de la radiación y el equilibrio de las partículas cargadas.
- Irradian las células (dosis en el rango de 2 a 10 Gy) con un plano y simétrico (± 2%) campo de radiación de 20 x 20 cm2 y una tasa de dosis de 3 Gy/min.
Nota: Control de "farsa"-las células irradiadas experimentaron las mismas condiciones procesales de los irradiados, sin entrar a la sala de irradiación (dosis recibida: 0 Gy).
PRECAUCIÓN: aparatos productores de radiaciones ionizantes deben ser utilizados sólo por personal especializado.
3. Análisis de viabilidad célula (ensayo MTT)
Nota: Actividad metabólica de la célula de Caco-2 se evaluó mediante el análisis de bromuro de 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium (MTT)14.
- Semilla 2 × 105 Caco-2 en una placa de 24 pozos 24 h antes de la irradiación en 1,25 mL de medio completo.
- Irradian las células como se describe en los pasos 2.1-2.4 luego incubar las células a 37 ° C en una atmósfera humidificada con 5% CO2.
- 21 h después de la irradiación, añada 100 μl de solución MTT de 5 mg/mL y mantener las células a 37 ° C en una atmósfera humidificada con 5% CO2 para 3 h.
- Deseche el sobrenadante y lavar las células con 1 mL de PBS.
- Disolver cristales de formazán por agregar 500 μl de dimetilsulfóxido (DMSO) en cada pocillo y evaluar la absorbancia con un lector de placas de varios pocillos en λ = 570 nm.
- Repita el paso 3.3-3.4 - 3.5-3.6 en 45 h después de la irradiación.
Nota: Los resultados se muestran como una perturbación de la correspondiente condición de impostor, que se normalizó al 100%.
PRECAUCIÓN: DMSO es agente inflamable e irritante para piel, ojos y sistema respiratorio (GHS07, GHS08). En caso de contacto con los ojos, lavar inmediatamente con abundante agua y acúdase al médico. MTT es un agente irritante para la piel, ojos y sistema respiratorio (GHS07, GHS08). En caso de contacto con los ojos, enjuague inmediatamente con abundante agua y acúdase al médico.
4. porcentaje de determinación de células viables (prueba de exclusión azul de tripano colorante)
Nota: El porcentaje de células viables se evaluó por análisis de la exclusión de colorante azul de Trypan.
- Semilla 2 × 105 Caco-2 en placa de 24 pozos 24 h antes de la irradiación en 1,25 mL de medio completo.
- Irradian las células con dosis en el intervalo de 0 - 10 Gy (vea los pasos 2.1-2.4) entonces Incube las células a 37 ° C en una atmósfera humidificada con 5% CO2 para 24-48 h.
- Después de que el tiempo escogido dos puntos, lavan las células con PBS, descartarla, luego agregar 100 μl de solución de tripsina-etilendiaminotetracético ácido (EDTA). Poner las células a 37 ° C en una atmósfera humidificada con 5% CO2 para 2 minutos luego agregar medio completo para detener la reacción enzimática.
- Recoger las células en un tubo de 1.5 mL y centrifugar el tubo a 500 x g durante 5 min., descartar el sobrenadante y resuspender las células en 50 μl de PBS.
- La suspensión de células se mezclan con 50 μl de solución de colorante azul de tripano e incubar la mezcla por 3 minutos a temperatura ambiente.
- Cuenta el manchado (no viables) y sin mancha (viables) células con la cámara de Bürker.
5. resistencia eléctrica Trans-epitelial (TEER)
- Células de semilla 5 × 105 Caco-2 una semana antes de la irradiación en placa de 6 pozos Co cultura insertos (tereftalato de polietileno (PET), 2 x 106 poros/cm2).
- 1 h antes de la irradiación, medir el TEER con un voltímetro/ohmiómetro.
- Irradian las células como se describe en los pasos 2.1-2.4.
- Incube las células Caco-2 en la presencia o ausencia de co-cultivo con PBMC a 37 ° C en una atmósfera humidificada con 5% CO2.
- Para la primera pocas horas post-irradiation, medir TEER cada hora y posteriormente cada 3 h hasta 48 h.
6. Western Blot análisis de Claudin-1, Occludin, Afadin, ZO-1, ZO-2, NF-kB y XIAP
- Semilla 5 × 105 células 1 semana antes de la exposición de rayos x en la cultura Co placa de 6 pozos inserta (PET, 2 x 106 poros/cm2) e irradiar células como se describe en los pasos 2.1-2.4.
- Incube las células Caco-2 en la presencia o ausencia de co-cultivo con PBMC a 37 ° C en una atmósfera humidificada con 5% CO2.
- 48 h después de la irradiación, preparar Caco-2 y lisados de células PBMC tratando células con lisis celular del almacenador intermediario y almacenan las muestras a-20 ° C.
Nota: el protocolo se puede detener aquí. - Cuantificar la cantidad de proteínas totales por el método de bicinchoninic ácido (BCA).
Nota: el protocolo se puede detener aquí. - Mezcle cantidades iguales de proteínas totales con tampón Laemli añadido con β-mercaptoetanol (concentración final de β-mercaptoetanol es 5%), calentar las muestras a 95 ° C por 5 min y centrifugado a 10.000 x g.
- Carga de muestras en un 4-20% prefabricados de gel y realizan la electroforesis a 120 V para las proteínas de transferencia de 1 h. en una membrana de fluoruro (PVDF) de polyvinildiene.
- Bloquear sitios de Unión inespecífica, incubar la membrana PVDF a temperatura ambiente con el 5% sin grasa leche en polvo (NFDM) en PBS adicionado con 0.2% Tween-20 (PBT). Lavar la membrana tres veces con 10 mL de 0.2% PBT durante 5 minutos.
- Incubar la membrana con agitación suave durante 1 hora a temperatura ambiente antes de ser colocado durante la noche a 4 ° C con los anticuerpos primarios siguientes: anti-claudin-1 anti-ZO-1, anti-ZO-2, anti-afadin, anti-occludin, anti-NF-kB, anti-XIAP y anti-actina. Lavar la membrana tres veces con 10 mL de 0.2% PBT durante 5 minutos.
- Incubar las membranas con anticuerpos secundarios conjugados con peroxidasa HRP por 1 h a temperatura ambiente con agitación suave. Lavar la membrana tres veces con 10 mL de 0.2% PBT durante 5 minutos.
- A temperatura ambiente, desarrollar películas fotográficas por incubación de las membranas con mayor kit quimio-luminiscente.
- Adquirir películas fotográficas con un sistema de digitalización y cuantificar las bandas obtenidas con el software de análisis de imagen adecuado.
Nota: La evaluación de Claudin-1 Occludin, Afadin, ZO-1 y ZO-2 se realiza en células Caco-2. Se realiza la evaluación de NF-kB y XIAP en PBMC.
PRECAUCIÓN: β-mercaptoetanol es tóxico (GHS05, GHS06, GHS08, GHS09). No respire los vapores, evitar en el ambiente y usar protección respiratoria y equipos de protección individual. En caso de ingestión, pedir inmediatamente consejo médico.
7. estadístico análisis
- Para determinar si la exposición a la radiación y la cultura Co inducen una perturbación estadísticamente significativa, realizar una prueba de dos vías de análisis de varianza (ANOVA) con comparaciones múltiples para medidas repetidas (con pruebas post-hoc de Bonferroni para comparar repetición significa).
- Si no indique lo contrario, calcular la significación estadística (p) por la prueba t de Student dos colas. Cada valor es el promedio de ≥ 3 experimentos independientes ± Error estándar de la media (SEM).
Resultados
Una semana antes del experimento, las células son sembradas sobre la membrana porosa del inserto y permitió que creciera durante los días siguientes. El nivel de la confluencia puede comprobarse utilizando un microscopio invertido o a través de la medición de los valores TEER. De hecho, durante la fase de crecimiento, TEER sigue aumentando hasta que toda la membrana porosa se ha cubierto por las células y forman una monocapa de células diferenciadas. Si las células proliferan más rápido/más lento, el experimento podría empezar en los puntos de tiempo antes/después después de ser sembradas. Cuando en confluencia, las células son entonces trajo a las instalaciones de irradiación, reduciendo al mínimo el estrés ambiental impartido (temperatura o pH), antes de comenzar el co-cultivo con o sin PBMC, cabeza de serie en el compartimiento inferior (figura 1A), o evaluación de la proliferación de células Caco-2. Dada la densidad de siembra inicial, en el día 0 células deben llegar a confluencia 100% y crear un distinguido monocapa de células epiteliales, que pueden ser observados por la meseta de TEER se muestra en la figura 1B. Una vez que las células alcanzan tal condición, el valor TEER se mantiene relativamente constante durante la semana siguiente, como el medio de cultivo viejo se reemplaza con medio fresco, por lo menos una vez por semana (figura 1B). Como se muestra en la figura 1C, el ensayo MTT no muestra ninguna alteración estadísticamente significativa del estado proliferativo de las células Caco-2 a las 24 h ni a las 48 h, independientemente de la dosis recibida (hasta 10 Gy).
Se observó un resultado diferente con respecto a la mortalidad a corto plazo de las células Caco-2. En ambos puntos del tiempo, tinción Trypan azul muestran un aumento dosis-dependiente en la mortalidad celular. Estos resultados muestran un claro efecto de la exposición a la radiación, aunque los porcentajes de células muertas parecen muy bajas, particularmente al considerar que la mayor dosis entregada (10 Gy) produce sólo aproximadamente 20% de muerte celular (figura 1D).
Las muestras fueron co cultivadas con o sin PBMC en el compartimento inferior. Dado que PBMC no recibió ningún estímulo externo para proliferar, un experimento de 48 h se consideró ideal para evitar el sesgo introducido por PBMC empezando a morir. Por lo tanto, desde inmediatamente antes de la irradiación, TEER regularmente se midió durante 48 h, para realizar un seguimiento de posibles efectos transitorios causados por el protocolo de irradiación. Como se muestra en la figura 1 E-F, TEER valores se presentan como variaciones relativas con respecto a la condición de tratamiento previo (que eran del orden de 1200-1500 Ω·cm2) mejor resaltar la perturbación inducida por la irradiación de rayos x y o por la presencia/ausencia de PBMC en la cultura de cooperación. En ambos casos, un pico transitorio inicial puede verse claramente en el primer momento después de la exposición a la radiación, que puede atribuirse al procedimiento de irradiación.
Cuando no en co-cultivo con PBMC (figura 1E), valores TEER casi constantes hasta a las 48 h, después de 10 Gy de rayos x, las células muestran una disminución prolongada de TEER comenzando en post-irradiation 3 h. La presencia de PBMCs modifica completamente la dinámica temporal de TEER (figura 1F). Para todas las dosis, una reducción en el TEER es claramente observable de 3 h hasta aproximadamente 30 h post-irradiation, cuando TEER parece ubicarse en un valor constante (figura 1F).
Niveles de expresión de complejos de Unión estrecha fueron investigados en lisados de células Caco-2 a través de análisis de western blot. Las células Caco-2 fueron expuestas a la radiación ionizante (con dosis de 0, 2 y 10 Gy) y posteriormente crecen solos o en co-cultivo con PBMCs en el compartimiento inferior para 48 h (como se muestra en la figura 2A-F). Claudin-1 y Occludin (figura 2A, 2B) fueron encontrados para no ser alterado por los rayos x y/o co-cultivo con PBMC. Grandes fluctuaciones en su lugar se observaron en las proteínas del andamio ZO-1, ZO-2 y Afadin (figura 2C, 2D, 2E). En particular, una reducción en los niveles de expresión de ZO-2 se observa ya después de 2 Gy en co-cultivo con PBMC sólo a 10 Gy al Caco-2 fueron creciendo solos. Niveles de expresión de Afadin en su lugar se ven afectados sólo después de 10 Gy de rayos x, con una reducción adicional al Caco-2 se cultivan conjuntamente con PBMCs.
PBMCs cultivadas conjuntamente con Caco-2 se analizaron en relación con el estado inflamatorio, en particular, el Factor de transcripción Nuclear kB (NF-kB) y el inhibidor X-ligado de la niveles de apoptosis (XIAP) de la proteína han sido investigados (figura 2 G-I). Cantidad total de NF-kB no fue afectado por el co-cultivo Caco-2 expuestas a diferentes dosis (figura 2G). Por el contrario, los niveles XIAP eran 4 para arriba-regulados en los 2 Gy y 10 Gy co-cultivos, aunque las grandes variaciones demandan un mayor número de muestras analizadas para reducir tales fluctuaciones y obtener un poder estadístico mejor.
Como se muestra en la figura 2F y 2I, algunas bandas no específicos pueden aparecer junto al esperada peso molecular de la proteína de interés. A menos que bandas de verdad y no específicas son fácilmente distinguibles, deben considerarse diferentes anticuerpos o concentraciones de BSA o NFDM.
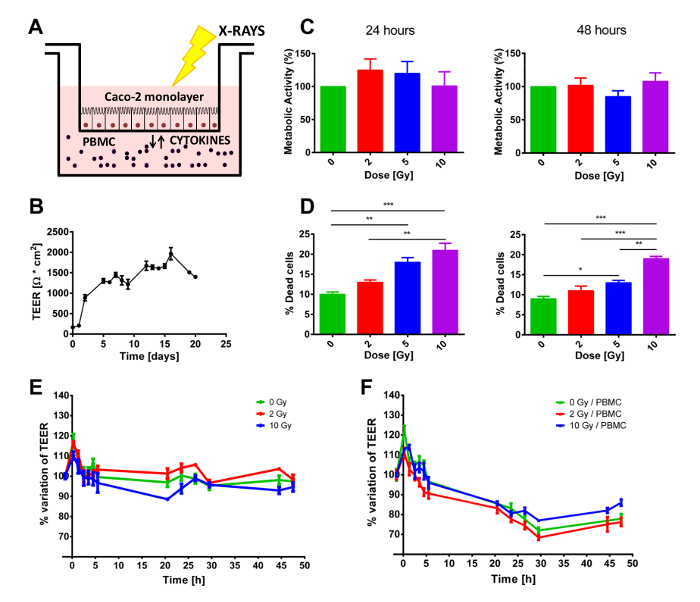
Figura 1 . Disposición general experimental y efectos macroscópicos de la exposición a la radiación o cocultivo PBMC. A) representación esquema del modelo de la cultura. B) TEER valores medidos diariamente de la semilla inicial de células Caco-2 para evaluar el estado de crecimiento y la diferenciación adecuado de la monocapa. Viabilidad de las células C) y D) mortalidad de Caco-2 expuestos a los rayos x (0, 2, 5 y 10 Gy). Mediciones de TEER E) en las células Caco-2 irradiaron con 0, 2 y 10 Gy de rayos x cultivadas sin o F) con PBMCs. Cada valor es la media de ≥ 3 experimentos independientes ± SEM. * val p < 0.05; ** p-va l < 0,01; val p < 0.001. Gráficos de Morini et al. 15. haga clic aquí para ver una versión más grande de esta figura.
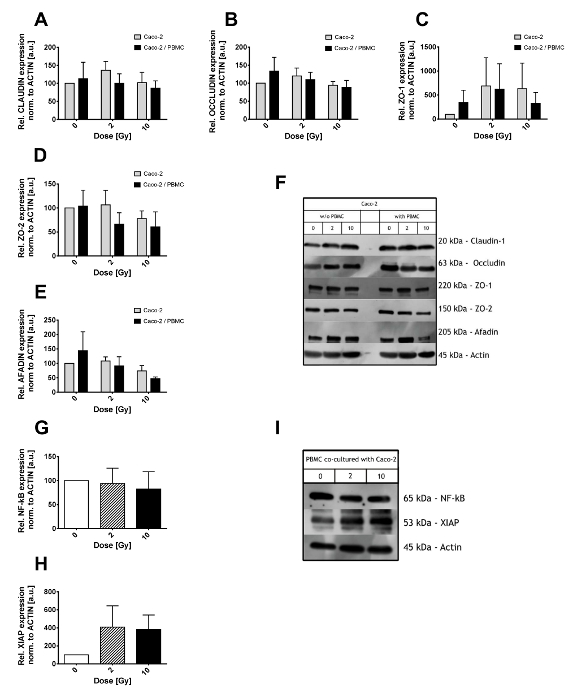
Figura 2. Resultados de Western Blot de lisados de Caco-2 y PBMC. Nivel de expresión de las proteínas de la ensambladura apretada (Claudin-1 (A), Occludin (B), ZO-1 (C), ZO-2 (D) y Afadin (E)) en el Caco-2 después de 0, 2 y 10 Gy de rayos x y en presencia o ausencia de PBMC en co-cultivo. Los valores se normalizan en nivel de actina. Películas ilustrativas para cada proteína de Unión estrecha y condiciones se muestran en el panel (F). Nivel de expresión de NF-κB (G) y XIAP (H) en PBMCs Co cultivadas con células Caco-2. Películas representativas para la actinia, XIAP y NF-kB se muestran en el panel. Cada valor es el promedio de ≥ 3 experimentos independientes ± SEM. gráficos de Morini et al. 15. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Cáncer colorrectal, con su alta ocurrencia en países desarrollados, es una de las causas más frecuentes de morbilidad y mortalidad en la población. Se maneja generalmente por cirugía, quimioterapia y radioterapia1. En el marco de los tratamientos de radioterapia, se debe prestar especial atención a los efectos de la exposición de tejidos sanos4; por otra parte, son fundamentales para el desarrollo de enfoques de radio inmunoterapia3estudios sistemáticos sobre la relación entre la exposición a la radiación y el sistema inmunológico.
La metodología que adoptamos en este trabajo se ha adaptado a la investigación de células Caco-2 y la diafonía PBMC. Nos hemos centrado en el efecto de la exposición de rayos x de las células del tumor, pero el mismo protocolo puede ser adaptado a los estudios con agentes farmacológicos. Estar más cerca de las condiciones fisiológicas con respecto al estándar de la célula de cultivo, la gran ventaja de este método es la posibilidad de una disección completa de un sistema complejo, dada la posibilidad de analizar diferentes tipos de células y la liberación de moléculas de señal en los dos compartimientos de la propia cultura de cooperación. De esta manera, sistemáticamente aplicados métodos biológicos pueden ayudar a la comprensión de celulares relacionados con mecanismos de interacción.
La caracterización inicial de los efectos inducidos por rayos X en las células Caco-2 se basó en dos medidas complementarias, es decir, el análisis colorimétrico de MTT y la exclusión de colorante azul de Trypan prueba. Los resultados aparentemente incoherentes podrían explicarse por el diferente enfoque de estos dos ensayos. MTT evalúa la actividad de enzimas oxidorreductasas, mientras el Trypan azul tinte se basa en un mecanismo de exclusión de la célula viva tinte.
La investigación de la interacción de Caco-2-PBMC requiere la creación de una monocapa epitelial capaz de conducir a una separación completa entre los dos compartimientos de la cultura de cooperación. La posibilidad de sembrar células Caco-2 en la inserción de la cultura permite la irradiación de sólo esta población celular. Puesto que la cultura Co comienza después de la irradiación, no hay ningún sesgo debido a cualquier exposición accidental de PBMC. Esta configuración debe ser manipulado con cuidado para evitar daño (o contaminación) a la monocapa celular durante los movimientos de la inserción de una placa de 6 pozos al otro. Cuando se realiza cuidadosamente, TEER las medidas son un método simple y no invasivo para investigar la permeabilidad de la monocapa. Este ensayo está estrictamente relacionado con la configuración de la cultura, y no es la única opción para la investigación de la permeabilidad de la monocapa. Permite una buena reproducibilidad de las medidas una vez que está bien calibrado con medio completo fresco. Ensayos comunes se centran en la difusión de los tintes químicos del compartimiento superior "apical" en la parte inferior "basolateral" uno (por ejemplo isotiocianato de fluoresceína (FITC)-ensayo de dextrán)16. Sin embargo, puesto que PBMC están presentes en el compartimiento basolateral en este estudio, decidimos evitar la introducción de reactivos químicos en los experimentos.
Entre las diferentes técnicas adoptadas en este trabajo, medición de TEER es el único que requiere el co-cultivo configuración17,18. Sin embargo, las otras técnicas de laboratorio comunes proporcionan resultados más informativos cuando se aplica a células en cultivo Co, permiten la investigación de las condiciones fisiológicas más cerca configuración y los datos tienen un significado biológico más fuerte. Por otra parte, debe señalarse que el uso de las células cultivadas sobre un soporte poroso podría conducir a algunas dificultades en las operaciones necesarias para preparar las muestras, tales como la lisis de la célula para la preparación de los extractos celulares que se analizaron mediante western blot.
El sistema adoptado en el presente estudio tiene el potencial para ser más mejorado, por ejemplo con el uso de sustancias capaces de recrear el ambiente de la matriz extracelular. Sin embargo, esto también resultará en un aumento de la complejidad del sistema, y una disección completa de la instalación será más difícil de lograr.
Configuraciones para el cocultivo de células representan sin duda una potente herramienta para el avance de la investigación en vitro y para la comprensión de sistemas complejos. Esta técnica tiene el potencial de aumentar el conocimiento sobre los mecanismos fundamentales, proporcionando nuevas entradas a los estudios de investigación básica de señalización molecular y con posibles aplicaciones para la modulación de la actividad del sistema inmune en el marco de manejo de paciente clínico oncológico.
Divulgaciones
Los autores no declaran conflicto de intereses.
Agradecimientos
Instituto Italiano de Física Nuclear (INFN) parcialmente financiado este trabajo a través del proyecto de INFN-MERIDIAN. Los autores reconocen Prof. Edoardo Milotti (Departamento de física, Universidad de Trieste, Italia) para la coordinación del proyecto de INFN-meridiano; Dr. Roberto Chignola (Departamento de biotecnología, Universidad de Verona, Italia) para proporcionar las células Caco-2, el óhmetro y por su valiosa ayuda y formación. También reconocemos Agnese Solari para asistencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| ThinCert 6 Well Cell Culture Inserts for Multiwell Plates | Greiner Bio-one | 657610 | Equipment |
| Cell Culture Multiwell Plate, 6 Well | Greiner Bio-one | 657160 | Plastic |
| Cell Culture Multiwell Plate, 24 Well | Greiner Bio-one | 662160 | Plastic |
| RPMI 1640 without L-Glutamine | Lonza | 12-167F | Reagents |
| Foetal Bovine Serum | Lonza | DE14-801 | Reagents |
| L-Glutamine 200 mM | Lonza | 17-605C | Reagents |
| Penicillin/Streptomycin 10K/10K | Lonza | 17-602E | Reagents |
| CO2 Incubator | Heal Force | HF240 | Equipment |
| Ficoll Histopaque-1077 | Sigma-Aldrich | 10771 | Reagents |
| Tube, 50 mL, PP, Conical Bottom | Greiner Bio-one | 227261 | Plastic |
| Tube, 15 mL, PP, Conical Bottom | Greiner Bio-one | 188261 | Plastic |
| Centrifuge | ThermoScientific | CL31R | Equipment |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | P3813 | Reagents |
| Cell Culture Flask, 25 cm2, PS | Greiner Bio-one | 690175 | Plastic |
| Clinac 2100 Linear Accelerator | Varian | CLINAC 2100C/D | Equipment |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) | Sigma-Aldrich | M5655 | Reagents |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | Reagents |
| Multiwell Plate Reader | GDV | DV990BV6 | Equipment |
| Trypan Blue Solution 0,4 % | Amresco | K940 | Reagents |
| Trypsin-EDTA Solution | Sigma-Aldrich | T4049 | Reagents |
| 1.5 mL tubes | Eppendorf | 0030125150 | Reagents |
| Millicell-ERS voltmeter/ohmeter | Millipore | MERS 00001 | Equipment |
| Cell Lysis Buffer (10x) | Cell Signalling Technology | #9803 | Reagents |
| Bürker Hemocytometer | Sigma-Aldrich | BR719520 | Equipment |
| BCA Protein Quantification Kit | Abcam | ab102536 | Reagents |
| 2x Laemmli Sample Buffer | BioRad | #1610737 | Reagents |
| 2-Mercaptoethanol | BioRad | #1610710 | Reagents |
| Accublock Digital Dry Bath | Labnet International Inc. | D1100 | Equipment |
| 4–20% Mini-PROTEAN TGX Stain-Free Protein Gels, 10 well, 30 µL | BioRad | #4568093 | Reagents |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels, 4-gel | BioRad | #1658004 | Equipment |
| PowerPac HC High-Current Power Supply | BioRad | #1645052 | Equipment |
| Precision Plus Protein WesternC Blotting Standards | BioRad | #1610385 | Reagents |
| 10x Tris/Glycine/SDS Running Buffer | BioRad | #1610732 | Reagents |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BioRad | #1704156 | Reagents |
| Trans-Blot Turbo Transfer System | BioRad | #1704150 | Equipment |
| Blotting-Grade Blocker | BioRad | #1706404 | Reagents |
| Tween-20 | Sigma-Aldrich | 93773 | Reagents |
| Claudin-1 (D5H1D) XP Rabbit mAb | Cell Signalling Technology | #13255 | Reagents |
| Bovine Serum Albumine | Sigma-Aldrich | A7906 | Reagents |
| ZO-1 (D7D12) Rabbit mAb | Cell Signalling Technology | #8193 | Reagents |
| ZO-2 Antibody | Cell Signalling Technology | #2847 | Reagents |
| Afadin (D1Y3Z) Rabbit mAb | Cell Signalling Technology | #13531 | Reagents |
| Anti-Occludin Antibody | Millipore | ABT146 | Reagents |
| Anti-NF-kB p65 antibody [E379] | Abcam | ab32536 | Reagents |
| Anti-XIAP antibody | Abcam | ab21278 | Reagents |
| Amersham ECL Mouse IgG, HRP-linked whole Ab (from sheep) | GE Healthcare Life Sciences | NA931V | Reagents |
| Amersham ECL Rabbit IgG, HRP-linked whole Ab (from donkey) | GE Healthcare Life Sciences | NA934V | Reagents |
| Clarity Western ECL Substrate, 200 mL | BioRad | #1705060 | Reagents |
| Carestream Kodak autoradiography GBX developer/replenisher | Sigma-Aldrich | P7042 | Reagents |
| Carestream Kodak autoradiography GBX fixer/replenisher | Sigma-Aldrich | P7167 | Reagents |
| Carestream Kodak BioMax light film | Sigma-Aldrich | Z370401 | Reagents |
| Gel Doc EZ System | BioRad | #1708270 | Equipment |
Referencias
- Cunningham, D., et al. Colorectal cancer. Lancet. 375 (9719), 1030-1047 (2010).
- Mancuso, M., et al. Oncogenic bystander radiation effects in Patched heterozygous mouse cerebellum. PNAS. 105 (34), 12445-12450 (2008).
- Demaria, S., Formenti, S. C. Can abscopal effects of local radiotherapy be predicted by modeling T cell trafficking. J Immunother Cancer. 4 (1), 29 (2016).
- Trott, K. R., et al. Biological mechanisms of normal tissue damage: Importance for the design of NTCP models. Radiother Oncol. 105 (1), 79-85 (2012).
- Derer, A., Deloch, L., Rubner, Y., Fietkau, R., Frey, B., Gaipl, U. S. Radio-immunotherapy-induced immunogenic cancer cells as basis for induction of systemic anti-tumor immune responses - pre-clinical evidence and ongoing clinical applications. Front Immunol. 6, 505 (2015).
- Frey, B., Gaipl, U. S. Radio-immunotherapy: The focused beam expands. Lancet Oncol. 16 (7), 742-743 (2015).
- Prise, K. M., O'Sullivan, J. M. Radiation-induced bystander signalling in cancer therapy. Nat Rev Cancer. 9 (5), 351-360 (2009).
- Sambuy, Y., De Angelis, I., Ranaldi, G., Scarino, M. L., Stammati, A., Zucco, F. The Caco-2 cell line as a model of the intestinal barrier: Influence of cell and culture-related factors on Caco-2 cell functional characteristics. Cell Biol Toxicol. 21 (1), 1-26 (2005).
- Babini, G., et al. Mechanisms of the induction of apoptosis mediated by radiation-induced cytokine release. Radiat Prot Dosim. 166 (1-4), 165-169 (2015).
- Pellegrina, C. D., et al. Effects of wheat germ agglutinin on human gastrointestinal epithelium: Insights from an experimental model of immune/epithelial cell interaction. Toxicol Appl Pharm. 237 (2), 146-153 (2009).
- Pozo-Rubio, T., et al. Immunostimulatory effect of faecal Bifidobacterium species of breast-fed and formula-fed infants in a peripheral blood mononuclear cell/Caco-2 co-culture system. Brit J Nutr. 106 (8), 1216-1223 (2011).
- Parlesak, A., Haller, D., Brinz, S., Baeuerlein, A., Bode, C. Modulation of cytokine release by differentiated CACO-2 cells in a compartmentalized coculture model with mononuclear leucocytes and nonpathogenic bacteria. Scand J Immunol. 60 (5), 477-485 (2004).
- Haller, D. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assay. J Immunol Methods. 65 (1-2), 55-63 (1983).
- Morini, J., Babini, G., Barbieri, S., Baiocco, G., Ottolenghi, A. The Interplay between Radioresistant Caco-2 Cells and the Immune System Increases Epithelial Layer Permeability and Alters Signaling Protein Spectrum. Front Immunol. 8, 1-12 (2017).
- Dittmar, S., Harms, H., Runkler, N., Maisner, A., Kim, K. S., Schneider-Schaulies, J. Measles virus-induced block of transendothelial migration of T lymphocytes and infection-mediated virus spread across endothelial cell barriers. J Virol. 82 (22), 11273-11282 (2008).
- Srinivasan, B., Kolli, A. R., Esch, M. B., Abaci, H. E., Shuler, M. L., Hickman, J. J. TEER Measurement Techniques for In Vitro Barrier Model Systems. J Lab Autom. 20 (2), 107-126 (2015).
- Moyes, S. M., Killick, E. M., Morris, J. F., Kadhim, M. A., Hill, M. A., Carr, K. E. Changes produced by external radiation in parameters influencing intestinal permeability and microparticle uptake in vitro. Int J Radiat Biol. 84 (6), 467-486 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados