Method Article
Une méthode de culture mixte d’enquêter sur les interférences entre les rayons x irradiés PBMC et cellules Caco-2
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous présentons un protocole afin d’étudier la diaphonie entre Caco-2 X-ray-irradiés et les cellules mononucléées du sang périphérique (PBMC). Le protocole commence par irradiation de Caco-2 et de la mise en place de la co-culture avec PBMC ; par la suite, trans-épithéliales résistance électrique est régulièrement mesurée 48 tache h et occidentale exécutée en Caco-2 et PBMC.
Résumé
Le protocole adopté en ce travail vise à éclaircir comment radiographies perturbent le fonctionnement de la barrière intestinale, en se concentrant sur l’interaction entre les cellules de tumeur cancer colorectal et le système immunitaire. Carcinome colorectal est le type le plus commun du cancer, généralement traité par chirurgie, chimiothérapie et radiothérapie. Avantages de la radiothérapie dans le ciblage de la tumeur sont bien connus. Cependant, même limitée exposition des tissus sains est très préoccupante, particulièrement en ce qui concerne les effets sur la barrière intestinale et le système immunitaire. La configuration adoptée permet d’étudier l’interaction entre les deux populations de cellules dans un État plus semblable à celui physiologique, par rapport à des cultures de cellules normales. Pour ce faire, nous avons recours à des techniques différentes et nous avons utilisé un modèle de co-culture in vitro , basé sur les cellules Caco-2 différenciées comme monocouche et PBMC, partage le même milieu de culture. Ce protocole a été élaboré pour se concentrer sur les effets macroscopiques, c'est-à-dire la viabilité cellulaire et résistance électrique Trans épithélial (TEER) et, par le biais de la tache occidentale, des altérations moléculaires, c'est-à-dire l’activation d’une voie inflammatoire dans les cellules immunitaires et l’expression de protéines de jonction serrée dans les cellules Caco-2. Première évaluation des effets des radiations sur la viabilité des cellules Caco-2 a été évaluée par 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) et essais de bleu Trypan, tandis que TEER a été mesurée à intervalles de temps fixes par un ohmmètre spécialement conçu pour des systèmes de co-culture. De cette façon, les effets dus aux radiations, la présence de cellules mononucléées à périphérique sang (PBMC) et éventuellement leur effet synergique, peuvent être démontrées. Grâce à ces techniques complémentaires, nous avons observé une forte radio-résistance de Caco-2, au sein de la gamme de 2 à 10 Gy de rayons x et d’une perméabilité accrue de monocouche Caco-2 quand PBMC est ajoutés. En particulier, la présence PBMC s’est avéré pour être associée à la variation dans l’expression de protéines échafaudage jonction serrée.
Introduction
La méthodologie adoptée dans cet ouvrage a été conçue pour étudier l’interaction entre les cellules de cancer colorectal et le système immunitaire, exploitant d’une installation plus près à l’état physiologique par rapport aux cultures cellulaires 2 dimensions normales.
Carcinome colorectal (CRC) est considéré comme le troisième plus fréquent type de cancer, avec plus de 1 million de cas dans le monde (Observatoire mondial des Cancer, Centre International de recherche sur le Cancer, Organisation mondiale de la santé, http://gco.iarc.fr). Gestion du CRC est assurée grâce à une chirurgie, chimiothérapie ou radiothérapie1. Par rapport à des techniques invasives comme la chirurgie ou la chimiothérapie, radiothérapie évite en grande partie les réactions typiques de systémiques préjudiciables découlant de ces approches cliniques, grâce à la livraison localisée de dose de rayonnement. Cependant, les effets secondaires peuvent survenir dans les tissus sains environnants, déclenchant l’inflammation avec dommages directs aux cellules saines et les dommages par effets indifférenciés2,3,4. Mettant l’accent sur les effets indésirables en raison de l’irradiation pendant le traitement du cancer colorectal, deux aspects doivent être étudiées. Tout d’abord, les mécanismes responsables d’imperméabilité intestinale pourraient être modifiés par la livraison de rayonnement ce qui provoque, à son tour, la possibilité d’effets secondaires en raison d’un confinement altérée de population bactérienne et le passage paracellulaire des molécules et des solutés. En second lieu, la présence de tissu lymphatique tube digestif (GALT) agit comme un avant-poste du système immunitaire, avec la fonction de contrôler la croissance bactérienne et de médiation de la réponse immunitaire générale5,6,7. Pour remplir ces fonctions, imperméabilité intestinale est maintenue grâce à la fonction des complexes de jonction entre les membranes des cellules. Pour ces raisons, les conséquences induites préjudiciables en raison de différentes doses de rayons x ont été étudiés dans les cellules Caco-2 seuls ou en co-cultures avec PBMC.
Bien que la réalisation d’études sur cultures cellulaires est le premier setline d’enquête dans la recherche biomédicale, l’absence d’une connaissance approfondie des mécanismes conduisant les interactions cellulaires de la biologie et réciproque entre les différents types de cellules pourrait devenir critique quand approche de l’étude de la physiologie des organes, systèmes et appareils qui ne peuvent pas être facilement recréés dans le laboratoire. Donc, nous avons décidé d’adopter une structure de culture mixte, permettant aussi bien l’étude de deux populations de cellules ensemble et la dissection des aspects liés aux mécanismes intercellulaires et extracellulaires.
Co-culture est une technique à exploiter lors de l’étude des fonctions épithéliales et l’interaction entre les différents types de cellules. En particulier, l’utilisation de cette technique devienne obligatoire dans notre cas, parce que les épithéliums sont constitués de cellules caractérisées par la polarité. Dans le cas de la barrière intestinale, entérocytes montrent une polarisation bien définie, avec apicale et basolatérale pôles séparément normalement en raison de la présence des molécules d’adhésion-création de jonction serrée. Ce cloisonnement est nécessaire pour la physiologie tissulaire, évitant paracellulaire traite et permettant le passage de molécules déterminées seulement. Cette fonctionnalité est bien sûr impossible de recréer avec une cellule normale, mise en place de la culture. En outre, l’adoption de la mise en place de co-culture reproduit la présence de cellules immunitaires que dans la surface basolatérale, tandis que la surface apicale (correspondant à la lumière intestinale) n’est pas directement en contact avec d’autres cellules.
Récemment, les lignées de cellules Caco-2 acquis plus d’importance comme un modèle in vitro de barrière intestinale. Bien que dérivé d’adénocarcinome du côlon humain, cellules Caco-2 maintiennent la capacité de différenciation et de créer une monocouche polarisée fonctionnelle8, qui permet l’étude des propriétés de la membrane cellulaire lorsqu’il est cultivé dans un insert de culture mixte.
Caco-2 mise en culture sur une membrane poreuse étant un modèle bien établi in vitro de monocouche intestinale, une amélioration a été la co-culture entre Caco-2 et d’autres cellules. Cette configuration a été adoptée fréquemment à mesure la diaphonie entre les différents types9 de cellules et peut être utilisé pour démêler Caco-2 perturbé à un stimulus exogène en culture mixte, en ce qui concerne la Caco-2 cultivé seul.
De nombreuses études ont abordé Caco-2 comportement lorsque cultivées conjointement avec les deux bactéries non pathogènes et périphérique des cellules mononucléaires, d’élucider en particulier les interférences avec le système immunitaire10de sang. Pozo-Rubio et al. 11 a étudié l’expression des cytokines plusieurs en une co-culture de Caco-2/PBMC avec bifidobactéries stimulant les cellules Caco-2. Leur travail a mis en évidence une modification substantielle aux profils d’expression des cytokines selon stimulation bactérienne réalisée en présence/absence de PBMC. Leurs résultats conduisent à la conclusion que la présence de PBMC sensibilise Caco-2 aux bifidobactéries.
Des réponses différentes des cellules Caco-2 aux bactéries pathogènes et non pathogènes ont été évalués par des équipes de recherche différentes. Parlesak et al. 12 a démontré les effets immunosuppresseurs de cellules Caco-2 sur Escherichia coli-stimulée PBMC. En outre, Haller et al. 13 a étudié la réponse des cellules Caco-2 stimulés par les lipopolysaccharides (LPS) d’entéropathogène spp d’e. coli ou bactéries entéropathogènes-non i.e.E. coli spp., Lactobacillus spp., renforcer la conjecture que réponse des cellules Caco-2 dépend strictement de la présence de leucocytes dans le Setup de co-culture.
En effectuant des analyses de laboratoire complémentaires différents (p. ex. la tache occidentale, résistance électrique trans épithélial, MTT, etc.), outre l’analyse des différents types de cellules cultivées en co-culture, promet la méthodologie toute résultats qui peuvent être considéré comme plus représentatif de ce qui passe vraiment en vivo. En outre, cette configuration permet la séparation des compartiments différents de co-culture, permettant non seulement l’étude des types de cellules impliquées, mais aussi les molécules de signalisation intercellulaires libérés dans le compartiment inférieur supérieur vs ou en présence de vs absence de co-culture.
Protocole
Le protocole suivant implique le prélèvement de sang humain de volontaires sains. Les donateurs ont fourni le consentement éclairé avant l’inscription. Cette procédure est conforme à la déclaration d’Helsinki et prélèvements de sang ont été effectués par un auxiliaire de soins de santé professionnel.
1. Culture et culture mixte mise en place de cellules
- Une semaine avant l’irradiation, préparer une suspension de cellules Caco-2 contenant 2,5 × 105 cellules/mL dans un milieu frais RPMI1640 additionné de 10 % sérum fœtal (SVF), 2 mM de L-glutamine, 100 U/mL de pénicilline et 100 μg/mL de streptomycine.
- Graine 2 mL de suspension cellulaire en culture de cellules stériles du 1 µm-pore diamètre insère pour plaques 6 puits et mettre l’insert dans une plaque de 6 puits.
NOTE : Les inserts de culture cellulaire peut-être besoin d’être activé par incubation avec stérile milieu complet avant l’ensemencement de la cellule. Dans ce cas, les milieux de culture doit être jeté et remplacé par milieux de suspension de cellules. - Ajouter 3 mL de milieu RPMI1640 frais additionné de 10 % FBS, 2 mM de L-glutamine, 100 UI/mL de pénicilline et 100 µg/mL de streptomycine dans chaque compartiment inférieur et la culture, les cellules à 37 ° C dans un incubateur avec atmosphère humidifiée contenant 5 % de CO2.
- Le jour même de l’irradiation des cellules Caco-2, recueillir le sang total humain dans des tubes de 6 mL disponible dans le commerce au lithium-héparinés (taille de tube : 13 x 100 mm).
- Par la suite, isoler les cellules mononucléaires de sang périphérique (PBMC) en utilisant le gradient de Ficoll. Séparer les PBMC, mettre 25 mL de Ficoll dans un tube à centrifuger conique de 50 mL et couche un volume égal de sang dilué 1:1 avec RPMI1640 sur la surface de Ficoll.
Remarque : Un donneur sain normal a habituellement environ 4 à 10 × 106 PBMC/mL. - Centrifuger les tubes de 50 mL à 400 g pendant 30 min à température ambiante.
- Doucement, recueillir le PBMC à l’interface entre le gradient de Ficoll et plasma par aspiration avec une pipette Pasteur et mettez-les dans un tube conique de 15 mL.
- Lavez le PBMC deux fois en ajoutant 10 mL de solution saline tamponnée au phosphate (PBS) et centrifugation PBMC à 250 x g pendant 10 min.
- Culture PBMC pour un maximum de 3-5 h en T25 flacons de2 cm dans toutes les médias RPMI1640, tel que décrit précédemment, à 37 ° C en atmosphère humidifiée contenant 5 % de CO2.
NOTE : Retirer PBMC le jour de l’expérience et 2 × 106 cellules/puits, suspendu dans 3 mL de milieu complet de RPMI1640, dans le compartiment inférieur de la co-culture de graines. Inserts avec cellules Caco-2 sont transférés dans les puits contenant des PBMC 30 min après leur irradiation. PBMC prélevé dans le sang ne peut pas être maintenue en culture pendant 72 h plus d’environ, sinon stimulée avec par exemple. phytohémagglutinine (PHA), après quoi la viabilité des cellules est perdue.
ATTENTION : La qualité et la sécurité de tous les sang et produits sanguins doivent être garanties pendant tout le processus.
2. l’irradiation Set-up
Remarque : L’Irradiation des cellules Caco-2 a été réalisée au département de radiothérapie de l’Istituto di Ricovero e Cura a Carattere Scientifico (IRCCS) S. Maugeri (Pavie, Italie) avec un accélérateur linéaire couramment utilisé pour traiter différents types de cancers.
- Valeur énergie des photons rayons x 6 pic de MV. L’accélérateur linéaire fonctionne à un régime "pulsé" (le temps entre deux impulsions consécutives environ de 4 ms ; taux de durée d’une impulsion unique sur 5 µs avec une dose de 1 × 10-3 Gy/p).
- Placer les plaques 6 puits contenant des inserts avec Caco-2 sur la trajectoire des rayons x sur un 1,4 cm d’épaisseur Plexiglas feuille (correspondant à une distance légèrement supérieure à l’accroissement du rayonnement utilisé) à 100 cm de la source de rayonnement.
- Placez un bolus de cm d’épaisseur 0,5 sur chaque échantillon avant l’irradiation se produit afin de garantir la composante de rayonnement rétrodiffusé et l’équilibre de particules chargées.
- Irradier les cellules (doses dans la gamme 2-10 Gy) avec un plat et symétrique (± 2 %) champ de rayonnement2 20 x 20 cm et un débit de dose de 3 Gy/min.
NOTE : Contrôler « trompe-l'œil »-cellules irradiées ont subi les mêmes conditions procédurales des irradiés, sans entrer dans la chambre d’irradiation (dose reçue : 0 Gy).
ATTENTION : les dispositifs générateurs de rayonnements ionisants doivent être utilisés que par personnel spécialisé.
3. cellule analyse de viabilité (test MTT)
Remarque : L’activité métabolique des cellules Caco-2 a été évaluée par le dosage de 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT)14.
- Graine 2 × 105 Caco-2 dans une assiette de 24 puits 24h avant l’irradiation en 1,25 mL de milieu complet.
- Irradier les cellules comme décrit aux points 2.1 à 2.4 puis incuber les cellules à 37 ° C en atmosphère humidifiée contenant 5 % de CO2.
- 21 h après irradiation, ajouter 100 µL de solution de MTT de 5 mg/mL et de garder les cellules à 37 ° C en atmosphère humidifiée contenant 5 % de CO2 pendant 3 h.
- Jeter le surnageant et laver les cellules avec 1 mL de PBS.
- Dissoudre les cristaux de formazan en ajoutant 500 µL de diméthylsulfoxyde (DMSO) dans chaque puits et évaluer l’absorbance avec un lecteur de plaque multipuits à λ = 570 nm.
- Répétez l’étape 3.3-3,4 - 3,5 à 3,6 à 45 h après l’irradiation.
Remarque : Les résultats sont présentés comme une perturbation de la condition de sham correspondante, qui est normalisée à 100 %.
ATTENTION : DMSO est agent inflammable et irritant pour la peau, des yeux et des voies respiratoires (GHS07, GHS08). En cas de contact avec les yeux, laver immédiatement abondamment à l’eau et consulter un médecin. MTT est un agent irritant pour la peau, des yeux et des voies respiratoires (GHS07, GHS08). En cas de contact avec les yeux, rincer immédiatement et abondamment avec de l’eau et consulter un médecin.
4. pourcentage de cellules viables de détermination (le bleu Trypan Dye Exclusion Assay)
NOTE : Le pourcentage de cellules viables a été évaluée par dosage de l’Exclusion du colorant bleu Trypan.
- Graine 2 × 105 Caco-2 en plaque 24 puits 24h avant l’irradiation en 1,25 mL de milieu complet.
- Irradier les cellules avec des doses dans l’intervalle 0 - 10 Gy (voir étapes 2.1 à 2.4) puis incuber les cellules à 37 ° C en atmosphère humidifiée contenant 5 % de CO2 pendant 24 à 48 heures.
- Après le temps choisi deux points, laver les cellules avec du PBS, jetez-le, puis ajouter 100 µL de solution de trypsine-tétraacétique (EDTA) d’acide. Mettre les cellules à 37 ° C en atmosphère humidifiée contenant 5 % de CO2 pendant 2 min, puis ajouter le milieu complet pour arrêter la réaction enzymatique.
- Recueillir les cellules dans un tube 1,5 mL et centrifuger le tube à 500 g pendant 5 min. jeter le surnageant et remettre en suspension les cellules dans 50 µL de PBS.
- Mélanger la suspension cellulaire avec 50 µL de solution de colorant bleu Trypan et incuber le mélange pendant 3 min à température ambiante.
- Compter les tachées (non viable) et non souillées enregistré de cellules (viables) avec une chambre Bürker.
5. Trans-épithéliales résistance électrique (TEER)
- Cellules Caco-2 du5 graines 5 × 10, une semaine avant l’irradiation en plaque 6 puits de co-culture d’insertions (polyéthylène téréphtalate (PET), 2 x 106 pores/cm2).
- 1 h avant l’irradiation, mesurer la TEER avec un voltmètre/ohmmètre.
- Irradier les cellules comme décrit aux points 2.1 à 2.4.
- Incuber les cellules Caco-2 en présence/absence de co-culture avec PBMC à 37 ° C en atmosphère humidifiée contenant 5 % de CO2.
- Pour la première quelques heures après l’irradiation, mesure TEER toutes les heures et par la suite toutes les 3 h jusqu'à 48 h.
6. Western Blot analyse de Claudin-1, Occludin, Afadin, ZO-1, ZO-2, NF-kB et XIAP
- Graines de 5 × 105 cellules 1 semaine avant l’exposition au rayons x en co-culture plaque 6 puits insère (PET, 2 x 106 pores/cm2) et irradier les cellules comme décrit aux points 2.1 à 2.4.
- Incuber les cellules Caco-2 en présence/absence de co-culture avec PBMC à 37 ° C en atmosphère humidifiée contenant 5 % de CO2.
- 48 h après l’irradiation, préparer Caco-2 et les lysats cellulaires PBMC en traitant les cellules avec la lyse des cellules de la mémoire tampon et conserver les échantillons à-20 ° C.
Remarque : le protocole peut être suspendu ici. - Quantifier les protéines totales par la méthode bicinchoninic à l’acide (BCA).
Remarque : le protocole peut être suspendu ici. - Mélanger une quantité égale de protéines totales avec Laemli solution tampon ajouté avec le β-mercaptoéthanol (concentration finale de β-mercaptoéthanol est de 5 %), faire chauffer les échantillons à 95 ° C pendant 5 min et elles tournent à 10 000 x g.
- Charge les échantillons dans un 4-20 % préfabriqués en gel et effectuent l’électrophorèse à 120 V pour les protéines de 1 h. transfert sur une membrane de vinylidène (PVDF) polyvinildiene.
- Bloquer les sites de fixation non spécifique en incubant des membranes PVDF à température ambiante avec 5 % lait écrémé (LPE) dans du PBS ajouté avec 0,2 % Tween-20 (PBT). Laver la membrane trois fois avec 10 mL de 0,2 % PBT pendant 5 min.
- Incuber la membrane avec une agitation modérée pendant 1 h à température ambiante avant d’être utilisés pendant la nuit à 4 ° C avec les anticorps primaires suivantes : anti-claudin-1, anti-ZO-1, anti-ZO-2, anti-afadin, anti-occludin, anti-NF-kB, anti-XIAP et anti-actine. Laver la membrane trois fois avec 10 mL de 0,2 % PBT pendant 5 min.
- Incuber les membranes avec anticorps secondaires conjugué à la peroxydase de raifort HRP pendant 1 h à température ambiante avec agitation douce. Laver la membrane trois fois avec 10 mL de 0,2 % PBT pendant 5 min.
- À température ambiante, développer les films photographiques en incubant les membranes avec kit chimio-luminescents améliorée.
- Acquérir des films photographiques avec un système de balayage et de quantifier les bandes obtenues avec logiciel d’analyse image approprié.
NOTE : L’évaluation de Claudin-1, Occludin, Afadin, ZO-1 et ZO-2 est effectuée dans les cellules Caco-2. L’évaluation de NF-kB et XIAP est effectuée dans les PBMC.
ATTENTION : β-mercaptoéthanol est toxique (GHS06, GHS08, GHS05, GHS09). Ne pas respirer les vapeurs, éviter le rejet dans l’environnement et de porter des appareils individuels de protection et la protection des voies respiratoires. En cas d’ingestion, demander immédiatement un avis médical.
7. analyse statistique
- Pour déterminer si l’exposition aux rayonnements et la co-culture induisent une perturbation significative, effectuer un test de bidirectionnelle analyse de variance (ANOVA) avec des comparaisons multiples pour des mesures répétées (avec les tests post hoc Bonferroni pour comparer REPLICATE on entend).
- Si sauf disposition contraire, calculer la signification statistique (p) par test t de Student bilatéral. Chaque valeur est la moyenne de ≥ 3 expériences indépendantes ± écart-type de la moyenne (SEM).
Résultats
Une semaine avant l’expérience, les cellules sont semées sur la membrane poreuse de l’insert et permis de se développer au cours des jours suivants. Le niveau de la confluence peut être vérifié, soit à l’aide d’un microscope inversé ou par l’intermédiaire de la mesure des valeurs TEER. En effet, au cours de la phase de croissance, TEER continue d’augmenter jusqu'à ce que toute la membrane poreuse a été couvert par les cellules et ils forment une monocouche de cellules différenciées. Si les cellules prolifèrent plus rapide/lent, l’expérience pourrait commencer à points dans le temps avant/après après être tête de série. Quand à la confluence, cellules sont ensuite présentées à l’installation d’irradiation, réduisant au minimum le stress environnemental conféré (température ou pH), avant de commencer la co-culture avec/sans PBMC, ensemencée dans le compartiment inférieur (Figure 1A), ou l’évaluation de la prolifération des cellules Caco-2. Compte tenu de la densité de semis initiale, le jour 0 cellules devraient atteindre 100 % confluence et créer une monocouche différenciée de cellules épithéliales, qui peut être observé par le plateau de TEER illustré à la Figure 1B. Une fois que les cellules atteint ce statut, la valeur TEER demeure relativement constante au cours de la semaine suivante, aussi longtemps que l’ancien milieu de culture est remplacé par un milieu frais, au moins une fois par semaine (Figure 1B). Comme illustré à la Figure 1C, le test MTT ne montre pas toute modification significative du statut proliférative des cellules Caco-2 ni après 24 h à 48 h, indépendamment de la dose reçue (jusqu'à 10 Gy).
Un résultat différent a été observé concernant la mortalité à court terme des cellules Caco-2. Aux deux périodes, une coloration bleu Trypan montrent une augmentation dose-dépendante la mortalité cellulaire. Ces résultats montrent un effet certain de l’exposition aux rayonnements, bien que les pourcentages de cellules mortes semblent être très faible, surtout si l'on considère que la dose administrée plus élevée (10 Gy) produit seulement environ 20 % de mort cellulaire (Figure 1D).
Des échantillons ont été conjointement cultivées avec ou sans PBMC dans le compartiment inférieur. Compte tenu du fait que les PBMC n’a pas reçu tout stimulus externe à proliférer, une expérience de 48 h était considéré comme idéale pour éviter le biais introduit par PBMC commence à mourir. Par conséquent, immédiatement avant l’irradiation, TEER était régulièrement mesuré pendant 48 h, pour suivre d’éventuels effets transitoires provoquées par le protocole de l’irradiation. Tel qu’illustré en Figure 1 E-F, TEER valeurs sont présentées comme des variations relatives par rapport à l’État prétraité (qui étaient de l’ordre de 1200-1500 Ω·cm2) afin de mieux mettre en évidence la perturbation induite par l’irradiation aux rayons x et et/ou de la présence/absence de PBMC dans la co-culture. Dans les deux cas, un pic transitoire initial peut être vu clairement au premier point de temps après l’exposition aux rayonnements, qui peut être attribuée à la procédure de l’irradiation.
Quand pas en co-culture avec PBMC (Figure 1E), les valeurs TEER sont quasi-constants jusqu'à 48 h alors que, après 10 Gy de rayons x, les cellules présentent une diminution prolongée de TEER partant après irradiation de 3 h. La présence de PBMC modifie totalement la dynamique temporelle de TEER (Figure 1F). Pour toutes les doses, une réduction de la TEER est clairement observable dans 3 h jusqu'à environ 30 h après l’irradiation, lorsque TEER semble s’établir à une valeur constante (Figure 1F).
Niveaux d’expression de jonction serrée complexes ont été étudiés dans les lysats de cellules Caco-2 grâce à l’essai par transfert western. Cellules Caco-2 ont été exposés à des rayonnements ionisants (avec des doses de 0, 2 et 10 Gy) et par la suite cultivés seul ou en co-culture avec PBMC dans le compartiment inférieur pendant 48 h (comme indiqué dans la Figure 2A-F). Tant Claudin-1 et Occludin (Figure 2A, 2 b) se sont révélés n’être ne pas significativement modifié par rayons x ou de co-culture avec PBMC. Des fluctuations importantes ont été observées au lieu de cela en protéines échafaudage ZO-1, ZO-2 et Afadin (Figure 2C, 2D, 2E). En particulier, une réduction des niveaux d’expression ZO-2 observe déjà après 2 Gy en culture mixte avec PBMC tandis que seulement à 10 Gy quand Caco-2 ont été de plus en plus seul. Afadin niveaux d’expression sont affectés au lieu de cela seulement après 10 Gy de rayons x, avec une réduction supplémentaire quand Caco-2 sont cultivées conjointement avec PBMC.
PBMC co cultivées avec Caco-2 ont été analysées au sujet de l’état inflammatoire, en particulier, le facteur de Transcription nucléaire kB (NF-kB) et l’inhibiteur lié à le X de l’apoptose des taux de protéines (XIAP) ont été étudiés (Figure 2 G-I). Montant total de NF-kB n’est pas affectée par la co-culture avec Caco-2 exposés à des doses de rayonnement différents (Figure 2G). Au contraire, des niveaux XIAP ont été régulée 4 fois dans les 2 Gy et 10 Gy co-cultures, bien que les grandes variations exigent un plus grand nombre d’échantillons analysés afin de réduire ces fluctuations et d’acquérir une meilleure puissance statistique.
Comme le montre la Figure 2F et 2I, certaines bandes non spécifiques peuvent apparaître à côté de la masse moléculaire attendue de la protéine d’intérêt. À moins que les bandes de vrais et non spécifiques sont facilement reconnaissables, anticorps différents et des concentrations de BSA ou LPE devraient considérer.
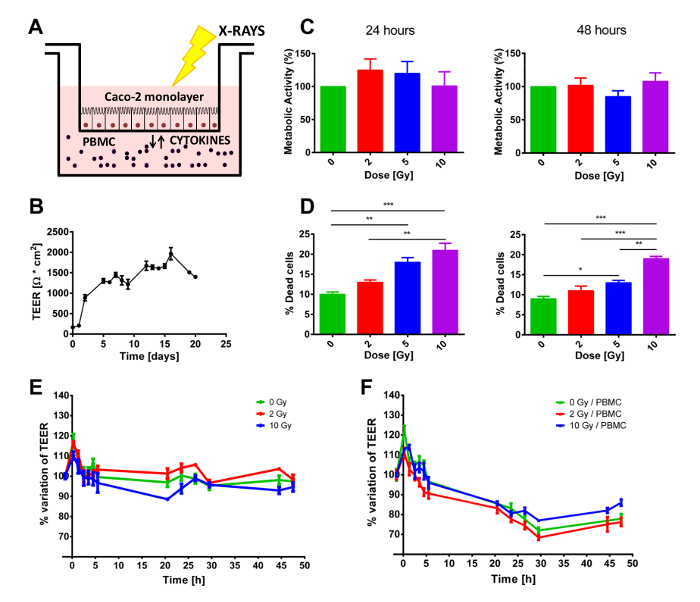
Figure 1 . Dans l’ensemble expérimental et effets macroscopiques d’exposition aux rayonnements et/ou de co-culture PBMC. A) Représentation schématique du modèle de co-culture. B) les valeurs de TEER mesurées quotidiennement de la graine initiale de cellules Caco-2 pour évaluer le statut approprié de croissance et la différenciation de la monocouche. La viabilité des cellules C) et D) mortalité en Caco-2 exposés aux rayons x (0, 2, 5 et 10 Gy). Mesures de TEER E) dans les cellules Caco-2 irradiés avec 0, 2 et 10 Gy de radiographies cultivés sans ou F) avec PBMC. Chaque valeur est la moyenne de ≥ 3 expériences indépendantes ± SEM. * p-val < 0,05 ; ** p-va l < 0,01 ; p-val < 0,001. Graphes adaptés de Morini et al. 15. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
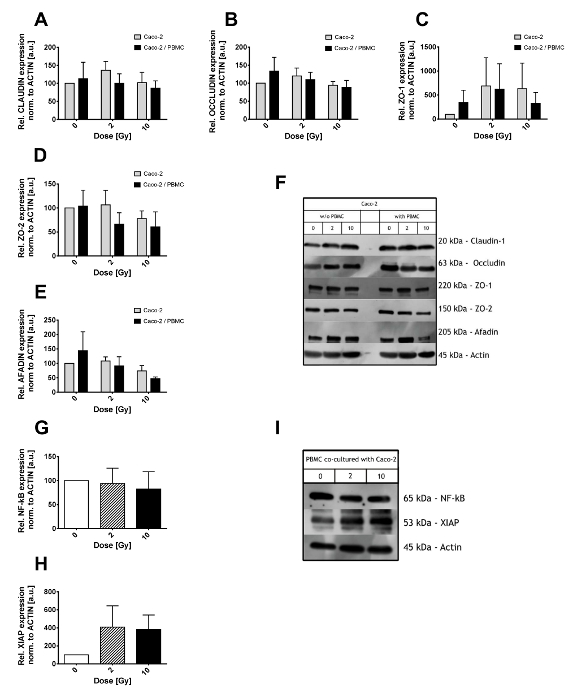
La figure 2. Résultats de Western Blot des lysats Caco-2 et de PBMC. Niveau d’expression des protéines de jonction serrée (Claudin-1 (A), Occludin (B), ZO-1 (C), ZO-2 (D) et Afadin (E)) en Caco-2 après 0, 2 et 10 Gy de rayons x et en présence/absence de PBMC en co-culture. Les valeurs sont normalisées au niveau de l’actine. Films illustratifs pour chaque protéine de jonction serrée et conditions apparaissent dans le panneau (F). Niveau d’expression de NF-κB (G) et XIAP (H) dans les PBMC co cultivées avec cellules Caco-2. Films représentatifs pour NF-kB et XIAP actine apparaissent dans le panneau. Chaque valeur est la moyenne de ≥ 3 expériences indépendantes ± SEM. graphiques adapté de Morini et al. 15. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Le cancer colorectal, avec sa présence forte dans les pays développés, est une des causes plus fréquentes de morbidité et de mortalité dans la population. Il est généralement géré par chirurgie, chimiothérapie et radiothérapie1. Dans le cadre de traitements de radiothérapie, une attention particulière doit être accordée aux effets de l' exposition des tissus sains4; en outre, des études systématiques sur la relation entre l’exposition aux radiations et le système immunitaire sont fondamentaux pour le développement d’approches de la radio-immunothérapie3.
La méthodologie que nous avons adoptées dans ce travail a été adaptée à l’étude des cellules Caco-2 et de la diaphonie PBMC. Nous nous sommes concentrés sur l’effet de l’exposition de rayons x des cellules tumorales, mais le même protocole peut être adapté aux études avec agents pharmacologiques. Être plus proches des conditions physiologiques, en ce qui concerne la mise en culture cellulaire standard, l’avantage de cette méthode est la possibilité d’une dissection complète d’un système complexe, compte tenu de la possibilité d’analyser les différents types de cellules et la libération de molécules de signalisation dans les deux compartiments de la co-culture lui-même. De cette façon, méthodes biologiques systématiquement appliquées peuvent aider à la compréhension de systèmes cellulaires interplay mécanismes connexes.
La caractérisation initiale des effets induits par X-ray sur cellules Caco-2 était basée sur deux mesures complémentaires, c'est-à-dire l’analyse colorimétrique de MTT et l’exclusion du colorant bleu Trypan test. Les résultats apparemment contradictoires pourraient s’expliquer par l’orientation différente de ces deux essais. MTT évalue l’activité d’enzymes d’oxydoréductase, tandis que le Trypan colorant bleu repose sur un mécanisme de colorant d’exclusion de la cellule vivante.
L’étude de l’interaction de Caco-2-PBMC nécessite la création d’une monocouche épithéliale capable de conduire à une séparation complète entre les deux compartiments de la co-culture. La possibilité de l’ensemencement des cellules Caco-2 dans l’encart de co-culture permet l’irradiation d’uniquement cette population de cellules. Puisque la co-culture commence après l’irradiation, il n’y a aucun biais dû à une exposition accidentelle de PBMC. Ce set-up doit être manipulées avec soin pour éviter d’endommager (ou contamination) à la couche cellulaire pendant les mouvements de l’insertion d’une plaque de 6 puits à l’autre. En effectuant avec soin, les mesures de TEER sont une méthode simple et non invasif d’enquêter sur la perméabilité de la monocouche. Ce test est strictement lié à la mise en place de culture mixte, et ce n’est pas le seul choix pour l’étude de la perméabilité de la monocouche. Il permet une bonne reproductibilité des mesures une fois qu’il est bien calibré avec un milieu complet frais. Analyses courantes se concentrent sur la diffusion des teintures chimiques du compartiment supérieur « apical » pour le fond « basolatérale » un (par exemple l’isothiocyanate de fluorescéine (FITC)-dosage de dextran)16. Cependant, depuis PBMC sont présents dans le compartiment basolatéral dans cette étude, nous avons décidé d’éviter l’introduction des réactifs chimiques dans les expériences.
Parmi les différentes techniques adoptées dans ce travail, mesure TEER est le seul qui exige la co-culture montage17,18. Toutefois, les autres techniques courantes de laboratoire donnent des résultats plus informatifs lorsqu’il est appliqué aux cellules en culture mixte, car ils permettent à l’enquête d’un rapprocher physiologique les conditions d’installation et les données ont une importance biologique plus forte. En revanche, il est à noter que l’utilisation de cellules cultivées sur un support poreux pourrait conduire à des difficultés pour les opérations requises pour préparer les échantillons, tels que la lyse de la cellule pour la préparation d’extraits cellulaires à analyser par western-blot.
Le système adopté dans la présente étude a le potentiel d’être encore améliorée, par exemple avec l’application de substances capables de recréer le milieu de la matrice extracellulaire. Toutefois, cela se traduira également par une complexité accrue du système et une dissection complète de l’installation sera plus difficile à atteindre.
Configurations de co-culture de cellules représentent certainement un outil puissant pour la promotion de la recherche en vitro et pour la compréhension des systèmes complexes. Cette technique a le potentiel d’accroître les connaissances sur les mécanismes fondamentaux, fournissant des nouvelles entrées aux études de recherche fondamentale sur la signalisation moléculaire et avec des applications possibles de la modulation de l’activité du système immunitaire dans le cadre de gestion des patients clinique oncologique.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Institut italien de physique nucléaire (INFN) financé en partie ce travail à travers le projet INFN-méridien. Les auteurs remercient Prof. Edoardo Milotti (département de physique, Université de Trieste, Italie) pour la coordination du projet INFN-méridien ; Dr Roberto Chignola (département de biotechnologie, Université de Vérone, Italie) pour fournir les cellules Caco-2, l’ohmmètre et pour son aide précieuse et de la formation. Nous remercions également Agnese Solari pour l’assistance technique.
matériels
| Name | Company | Catalog Number | Comments |
| ThinCert 6 Well Cell Culture Inserts for Multiwell Plates | Greiner Bio-one | 657610 | Equipment |
| Cell Culture Multiwell Plate, 6 Well | Greiner Bio-one | 657160 | Plastic |
| Cell Culture Multiwell Plate, 24 Well | Greiner Bio-one | 662160 | Plastic |
| RPMI 1640 without L-Glutamine | Lonza | 12-167F | Reagents |
| Foetal Bovine Serum | Lonza | DE14-801 | Reagents |
| L-Glutamine 200 mM | Lonza | 17-605C | Reagents |
| Penicillin/Streptomycin 10K/10K | Lonza | 17-602E | Reagents |
| CO2 Incubator | Heal Force | HF240 | Equipment |
| Ficoll Histopaque-1077 | Sigma-Aldrich | 10771 | Reagents |
| Tube, 50 mL, PP, Conical Bottom | Greiner Bio-one | 227261 | Plastic |
| Tube, 15 mL, PP, Conical Bottom | Greiner Bio-one | 188261 | Plastic |
| Centrifuge | ThermoScientific | CL31R | Equipment |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | P3813 | Reagents |
| Cell Culture Flask, 25 cm2, PS | Greiner Bio-one | 690175 | Plastic |
| Clinac 2100 Linear Accelerator | Varian | CLINAC 2100C/D | Equipment |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) | Sigma-Aldrich | M5655 | Reagents |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | Reagents |
| Multiwell Plate Reader | GDV | DV990BV6 | Equipment |
| Trypan Blue Solution 0,4 % | Amresco | K940 | Reagents |
| Trypsin-EDTA Solution | Sigma-Aldrich | T4049 | Reagents |
| 1.5 mL tubes | Eppendorf | 0030125150 | Reagents |
| Millicell-ERS voltmeter/ohmeter | Millipore | MERS 00001 | Equipment |
| Cell Lysis Buffer (10x) | Cell Signalling Technology | #9803 | Reagents |
| Bürker Hemocytometer | Sigma-Aldrich | BR719520 | Equipment |
| BCA Protein Quantification Kit | Abcam | ab102536 | Reagents |
| 2x Laemmli Sample Buffer | BioRad | #1610737 | Reagents |
| 2-Mercaptoethanol | BioRad | #1610710 | Reagents |
| Accublock Digital Dry Bath | Labnet International Inc. | D1100 | Equipment |
| 4–20% Mini-PROTEAN TGX Stain-Free Protein Gels, 10 well, 30 µL | BioRad | #4568093 | Reagents |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels, 4-gel | BioRad | #1658004 | Equipment |
| PowerPac HC High-Current Power Supply | BioRad | #1645052 | Equipment |
| Precision Plus Protein WesternC Blotting Standards | BioRad | #1610385 | Reagents |
| 10x Tris/Glycine/SDS Running Buffer | BioRad | #1610732 | Reagents |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BioRad | #1704156 | Reagents |
| Trans-Blot Turbo Transfer System | BioRad | #1704150 | Equipment |
| Blotting-Grade Blocker | BioRad | #1706404 | Reagents |
| Tween-20 | Sigma-Aldrich | 93773 | Reagents |
| Claudin-1 (D5H1D) XP Rabbit mAb | Cell Signalling Technology | #13255 | Reagents |
| Bovine Serum Albumine | Sigma-Aldrich | A7906 | Reagents |
| ZO-1 (D7D12) Rabbit mAb | Cell Signalling Technology | #8193 | Reagents |
| ZO-2 Antibody | Cell Signalling Technology | #2847 | Reagents |
| Afadin (D1Y3Z) Rabbit mAb | Cell Signalling Technology | #13531 | Reagents |
| Anti-Occludin Antibody | Millipore | ABT146 | Reagents |
| Anti-NF-kB p65 antibody [E379] | Abcam | ab32536 | Reagents |
| Anti-XIAP antibody | Abcam | ab21278 | Reagents |
| Amersham ECL Mouse IgG, HRP-linked whole Ab (from sheep) | GE Healthcare Life Sciences | NA931V | Reagents |
| Amersham ECL Rabbit IgG, HRP-linked whole Ab (from donkey) | GE Healthcare Life Sciences | NA934V | Reagents |
| Clarity Western ECL Substrate, 200 mL | BioRad | #1705060 | Reagents |
| Carestream Kodak autoradiography GBX developer/replenisher | Sigma-Aldrich | P7042 | Reagents |
| Carestream Kodak autoradiography GBX fixer/replenisher | Sigma-Aldrich | P7167 | Reagents |
| Carestream Kodak BioMax light film | Sigma-Aldrich | Z370401 | Reagents |
| Gel Doc EZ System | BioRad | #1708270 | Equipment |
Références
- Cunningham, D., et al. Colorectal cancer. Lancet. 375 (9719), 1030-1047 (2010).
- Mancuso, M., et al. Oncogenic bystander radiation effects in Patched heterozygous mouse cerebellum. PNAS. 105 (34), 12445-12450 (2008).
- Demaria, S., Formenti, S. C. Can abscopal effects of local radiotherapy be predicted by modeling T cell trafficking. J Immunother Cancer. 4 (1), 29 (2016).
- Trott, K. R., et al. Biological mechanisms of normal tissue damage: Importance for the design of NTCP models. Radiother Oncol. 105 (1), 79-85 (2012).
- Derer, A., Deloch, L., Rubner, Y., Fietkau, R., Frey, B., Gaipl, U. S. Radio-immunotherapy-induced immunogenic cancer cells as basis for induction of systemic anti-tumor immune responses - pre-clinical evidence and ongoing clinical applications. Front Immunol. 6, 505 (2015).
- Frey, B., Gaipl, U. S. Radio-immunotherapy: The focused beam expands. Lancet Oncol. 16 (7), 742-743 (2015).
- Prise, K. M., O'Sullivan, J. M. Radiation-induced bystander signalling in cancer therapy. Nat Rev Cancer. 9 (5), 351-360 (2009).
- Sambuy, Y., De Angelis, I., Ranaldi, G., Scarino, M. L., Stammati, A., Zucco, F. The Caco-2 cell line as a model of the intestinal barrier: Influence of cell and culture-related factors on Caco-2 cell functional characteristics. Cell Biol Toxicol. 21 (1), 1-26 (2005).
- Babini, G., et al. Mechanisms of the induction of apoptosis mediated by radiation-induced cytokine release. Radiat Prot Dosim. 166 (1-4), 165-169 (2015).
- Pellegrina, C. D., et al. Effects of wheat germ agglutinin on human gastrointestinal epithelium: Insights from an experimental model of immune/epithelial cell interaction. Toxicol Appl Pharm. 237 (2), 146-153 (2009).
- Pozo-Rubio, T., et al. Immunostimulatory effect of faecal Bifidobacterium species of breast-fed and formula-fed infants in a peripheral blood mononuclear cell/Caco-2 co-culture system. Brit J Nutr. 106 (8), 1216-1223 (2011).
- Parlesak, A., Haller, D., Brinz, S., Baeuerlein, A., Bode, C. Modulation of cytokine release by differentiated CACO-2 cells in a compartmentalized coculture model with mononuclear leucocytes and nonpathogenic bacteria. Scand J Immunol. 60 (5), 477-485 (2004).
- Haller, D. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assay. J Immunol Methods. 65 (1-2), 55-63 (1983).
- Morini, J., Babini, G., Barbieri, S., Baiocco, G., Ottolenghi, A. The Interplay between Radioresistant Caco-2 Cells and the Immune System Increases Epithelial Layer Permeability and Alters Signaling Protein Spectrum. Front Immunol. 8, 1-12 (2017).
- Dittmar, S., Harms, H., Runkler, N., Maisner, A., Kim, K. S., Schneider-Schaulies, J. Measles virus-induced block of transendothelial migration of T lymphocytes and infection-mediated virus spread across endothelial cell barriers. J Virol. 82 (22), 11273-11282 (2008).
- Srinivasan, B., Kolli, A. R., Esch, M. B., Abaci, H. E., Shuler, M. L., Hickman, J. J. TEER Measurement Techniques for In Vitro Barrier Model Systems. J Lab Autom. 20 (2), 107-126 (2015).
- Moyes, S. M., Killick, E. M., Morris, J. F., Kadhim, M. A., Hill, M. A., Carr, K. E. Changes produced by external radiation in parameters influencing intestinal permeability and microparticle uptake in vitro. Int J Radiat Biol. 84 (6), 467-486 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon