Method Article
Um método de co-cultura para investigar o Crosstalk entre raio-x irradiados PBMC e células Caco-2
Neste Artigo
Resumo
Apresentamos um protocolo para investigar o crosstalk entre Caco-2 X-ray-irradiados e células mononucleares do sangue periférico (PBMC). O protocolo começa com a instalação e Caco-2 irradiação da cultura co com PBMC; posteriormente, resistência elétrica trans-epitelial é medida regularmente durante 48 h e ocidental do borrão realizados em PBMC e Caco-2.
Resumo
O protocolo adotado neste trabalho visa desvendar como radiografias perturbam o funcionamento da barreira intestinal, enfocando a interação entre as células do tumor colorretal e sistema imunológico. O carcinoma colorectal é entre o tipo mais comum de câncer, normalmente tratado pela cirurgia, quimioterapia e radioterapia. Vantagens de radioterapia em alvejar o tumor são bem conhecidas. No entanto, mesmo limitadas exposições de tecidos saudáveis são de grande preocupação, nomeadamente sobre os efeitos sobre a barreira intestinal e sistema imunológico. A configuração adotada permite estudar a interação entre duas populações de células em uma condição mais semelhante ao fisiológico, quando comparado com culturas de células normais. Para esse efeito, podemos recorrer a técnicas diferentes e usamos um modelo co-cultura em vitro , baseado em células Caco-2 diferenciadas como uma monocamada e PBMC, compartilhando o mesmo meio de cultura. Este protocolo foi desenvolvido com foco em ambos efeitos macroscópicos, ou seja, a viabilidade celular e resistência elétrica Trans-epitelial (TEER) e, através de borrão ocidental, alterações moleculares, ou seja, a ativação da via inflamatória em células do sistema imunológico e a expressão da proteína de junção apertada em células Caco-2. Primeira avaliação dos efeitos de radiação sobre a viabilidade de células Caco-2 foi avaliada através do brometo de 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium (MTT) e ensaios de Trypan azul, enquanto TEER foi medido em intervalos de tempo fixo através de um ohmímetro projetado especificamente para sistemas de co-cultura. Desta forma, os efeitos devido à radiação, a presença da células mononucleares de periférico sangue (PBMC) e eventualmente seu efeito sinérgico, podem ser demonstrados. Através destas técnicas complementares, observamos uma rádio-resistência elevada do Caco-2 dentro do intervalo de 2-10 Gy de raios-x e um aumento da permeabilidade monocamada de Caco-2 quando PBMC foram adicionado. Em particular, a presença PBMC foi encontrada para ser associado com a variação na expressão de proteínas do andaime de junção apertada.
Introdução
A metodologia adotada neste trabalho foi desenhada para investigar a interação entre as células de cancro colo-rectal e o sistema imunológico, explorando um passo mais perto para o estado fisiológico quando comparado a culturas de célula normal 2-dimensional.
Carcinoma colorretal (CRC) é considerado o terceiro mais frequente tipo de câncer, com mais de 1 milhão de casos em todo o mundo (Observatório Global de câncer, a Agência Internacional para pesquisa sobre câncer, a Organização Mundial de saúde, http://gco.iarc.fr). Gestão do CRC é rotineiramente realizada através de cirurgia, quimioterapia ou radioterapia1. Quando comparado a técnicas invasivas como a cirurgia ou quimioterapia, radioterapia em grande medida evita as reações sistêmicas prejudiciais típicas decorrentes dessas abordagens clínicas, graças a entrega localizada da dose de radiação. No entanto, os efeitos colaterais podem surgir nos tecidos saudáveis circundantes, provocando inflamação com dano direto às células saudáveis e danos mediada pelos efeitos não específico2,3,4. Enfocando os efeitos adversos devido a irradiação durante o tratamento do cancro colo-rectal, dois aspectos precisam ser investigadas. Em primeiro lugar, os mecanismos responsáveis de impermeabilidade intestinal podem ser alterados por entrega de radiação, fazendo com que, por sua vez, a possibilidade de efeitos colaterais devido a uma contenção alterada da população bacteriana e a passagem de paracellular de moléculas e solutos. Em segundo lugar, a presença de tecido linfático associado intestino (GALT) atua como um posto avançado do sistema imunológico, com a função de controlar o crescimento bacteriano e mediando a resposta imune geral5,6,7. Para cumprir essas funções, impermeabilidade intestinal é mantida devido à função de complexos juncionais entre as membranas das células. Por estas razões, as consequências prejudiciais induzidas devido a diferentes doses de raios-x foram investigadas em células Caco-2 em paz e em culturas co com PBMC.
Embora a realização de estudos sobre culturas de pilha é o primeiro setline de investigação na investigação biomédica, a falta de conhecimento detalhado dos mecanismos de condução célula biologia e recíprocas interações entre diferentes tipos de células pode se tornar crítico quando aproximando-se o estudo da fisiologia dos órgãos, sistemas e aparelhos que não podem ser recriados facilmente no laboratório. Por isso, decidimos adotar uma afinação de co-cultura, permitindo que tanto o estudo de duas populações de células juntos e a dissecção de aspectos relacionados aos mecanismos intercelulares e extracelulares.
Co-cultura é uma técnica explorada quando estudando funções epiteliais e a interação entre diferentes tipos de células. Em particular, o uso de tal técnica torna-se obrigatória no nosso caso, porque os epitélios são constituídos por células, caracterizadas por polaridade. No caso da barreira intestinal, enterócitos mostram uma polarização bem definida, com apical e basolateral poloneses normalmente separaram devido à presença de moléculas de adesão de junção-criando apertado. Esta compartimentalização é necessária para a fisiologia do tecido, evitando paracellular tráfico e permitindo a passagem de determinadas moléculas apenas. Esse recurso é naturalmente impossível recriar com uma célula normal, cultivo de set-up. Além disso, a adoção de set-up a co-cultura reproduz a presença de células do sistema imunológico apenas na superfície basolateral, enquanto a superfície apical (correspondente ao lúmen intestinal) não é directamente em contacto com outras células.
Recentemente, linhas de células Caco-2 ganharam mais importância como um modelo in vitro da barreira intestinal. Embora derivado do adenocarcinoma de cólon humano, células Caco-2 mantêm a capacidade de diferenciação e criar uma monocamada polarizada funcional8, que permite a investigação das propriedades da membrana celular, quando cultivada em uma inserção de co-cultura.
Caco-2 cultivo numa membrana porosa é um modelo bem estabelecida em vitro de monocamada intestinal, uma melhoria desde a co-cultura entre Caco-2 e outras células. Esta instalação foi adoptada com frequência para medir o crosstalk entre diferentes tipos9 de célula e pode ser usado para desvendar o Caco-2 perturbado resposta aos estímulos exógenos quando em co-cultura, em relação a Caco-2 cultivadas em paz.
Muitos estudos têm abordado Caco-2 comportamento quando co cultivadas com ambas as bactérias não-patogênicas e periférica de sangue células mononucleares, para elucidar, em particular, a interferência com o sistema imunológico10. Pozo Rubio et al . 11 estudaram a expressão de diversas citocinas em co-cultura um Caco-2/PBMC com bifidobactérias estimulando células Caco-2. Seu trabalho destacado modificação substancial para perfis de expressão de citocinas dependendo da estimulação bacteriana realizada na presença/ausência de PBMC. Seus resultados levam à conclusão de que a presença de PBMC sensibiliza Caco-2 de bifidobactérias.
Diferentes respostas de Caco-2 células de bactérias patogénicas e não patogénicas foram avaliadas por equipes de pesquisa diferente. Parlesak et al. 12 demonstrado os efeitos imunossupressores das células Caco-2 em Escherichia coli-estimulada PBMC. Além disso, Haller et al. 13 estudou a resposta das células Caco-2 estimuladas com ambos lipopolissacarídeo (LPS) de enteropatogênica Escherichia coli spp. ou bactérias não-enteropatogênica i.e.E. coli spp., Lactobacillus spp., reforçando o conjectura de que a resposta das células Caco-2 estritamente depende da presença de leucócitos na confi guração do co-cultura.
Através da realização de ensaios laboratoriais complementares diferentes (por exemplo, borrão ocidental, resistência elétrica trans-epitelial, MTT, etc), além da análise dos diferentes tipos de células cultivadas em co-cultura, promete a metodologia toda resultados que podem ser considerados mais representativo do que realmente acontece em vivo. Além disso, esta configuração permite a separação dos compartimentos diferentes co-cultura, permitindo não só o estudo dos tipos de célula envolvidos, mas também as moléculas de sinalização intercelulares lançadas no compartimento inferior superior vs ou na presença de vs ausência de co-cultura.
Protocolo
O protocolo seguinte envolve a retirada de sangue humano de voluntários saudáveis. Os doadores fornecida escrito consentimento informado antes da inscrição. Este procedimento está em conformidade com a declaração de Helsínquia e as retiradas de sangue foram realizadas por um profissional de saúde assistente.
1. cultura e set-up co-cultura de células
- Uma semana antes da irradiação, prepare uma suspensão de células Caco-2 contendo 2,5 × 105 células/mL em fresco RPMI1640 suplementado com 10% de soro fetal bovino (FBS), 2 mM L-glutamina, 100 U/mL penicilina e estreptomicina 100 de μg/mL.
- Semente de 2 mL de suspensão de células estéreis 1 µm-poro cultura de pilha de diâmetro insere para placas 6-poços e colocar a inserção em uma placa de 6.
Nota: Inserções de cultura de célula talvez precise ser ativado pela incubação com meio completo estéril antes da semeadura de célula. Nesse caso, meios de cultura deve ser descartado e substituído com mídia de suspensão celular. - Adicionar 3 mL de meio fresco RPMI1640, suplementado com 10% FBS, 2 mM L-glutamina, 100 UI/mL penicilina e estreptomicina 100 µ g/mL em cada compartimento inferior e cultura de células a 37 ° C numa incubadora com umidificado atmosfera contendo 5% de CO2.
- No mesmo dia de irradiação de células Caco-2, coletar sangue total humano em tubos de 6 mL comercialmente disponível heparina de lítio-revestido (tamanho do tubo: 13 x 100 mm).
- Posteriormente, isole células mononucleares de sangue periférico (PBMC) usando gradiente de Ficoll. Para separar PBMC, colocar 25 mL de Ficoll em um tubo de centrifuga conico de 50 mL e camada igual volume de sangue total diluído 1:1 com RPMI1640 para a superfície de Ficoll.
Nota: Um doador saudável normal geralmente tem aproximadamente 4-10 × 106 PBMC/mL. - Centrifuga os tubos de 50 mL a 400 x g durante 30 min à temperatura ambiente.
- Delicadamente, recolher o PBMC na interface entre o Ficoll e plasma por aspiração com uma pipeta Pasteur e colocá-los em um tubo cônico de 15 mL.
- Lave o PBMC duas vezes, adicionando 10 mL de salina tamponada fosfato (PBS) e centrifugação PBMC em 250 x g durante 10 minutos.
- Cultura PBMC por um período máximo de 3-5 h em T25 frascos de2 cm em concluir RPMI1640 mídia, como descrito antes, a 37 ° C numa atmosfera umidificada contendo 5% de CO2.
Nota: Coletar PBMC no dia do experimento e propagar a 2 × 106 células/poço, suspenso em 3 mL de meio RPMI1640 completo, no compartimento inferior da cultura co. Pastilhas com células Caco-2 são transferidas em poços de PBMC contendo 30 min após sua irradiação. PBMC coletada do sangue inteiro não pode ser mantida em cultura por mais de cerca de 72 h, se não estimulada com por exemplo. fitoemaglutina (PHA), após o qual a viabilidade das células é perdida.
Cuidado: A qualidade e a segurança de todo o sangue e hemoderivados devem ser garantidas durante todo o processo.
2. irradiação set-up
Nota: Irradiação de células Caco-2 foi realizada no departamento de radioterapia do Istituto di Ricovero e Cura um Carattere Scientifico (IRCCS) S. Maugeri (Pavia, Itália), com um acelerador linear rotineiramente usado para tratar diferentes tipos de cancros.
- Defina energia de raios-x de fóton para 6 pico de MV. O acelerador linear opera em regime pulsante (tempo entre dois pulsos consecutivos, aproximadamente de 4 ms; duração de pulso único sobre 5 µs com uma dose de taxa até 1 × 10-3 Gy/p).
- Coloca as placas de 6-poços contendo inserções com Caco-2 sobre a trajetória dos raios-x em um 1.4 cm de espessura Plexiglas folha (correspondente a uma distância ligeiramente maior que a acumulação da radiação utilizada) a 100 cm da fonte de radiação.
- Coloque 0,5 cm de espessura em bolus em cada amostra antes da irradiação ocorre para garantir que o componente da radiação retroespalhados e o equilíbrio de partículas carregadas.
- Irradiar as células (doses na faixa de 10-2 Gy) com um pneu furado e simétrica (± 2%) campo de radiação2 20 x 20 cm e uma taxa de dose de 3 Gy/min.
Nota: Controlar "sham"-células irradiadas foi submetido as mesmas condições processuais dos irradiados, sem entrar no quarto de irradiação (dose recebida: 0 Gy).
Cuidado: dispositivos produtores de radiações ionizantes devem ser usados somente por pessoal especializado.
3. célula ensaio da viabilidade (MTT Assay)
Nota: Atividade metabólica das células Caco-2 foi avaliada através do ensaio de brometo de 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium (MTT)14.
- Semente de 2 × 105 Caco-2 em uma placa de 24 24 h antes da irradiação em 1,25 mL de meio completo.
- Irradiar as células como descrito nos passos 2.1-2.4 então incubar as células a 37 ° C numa atmosfera umidificada contendo 5% de CO2.
- 21 h após a irradiação, adicionar 100 µ l de 5 mg/mL de solução de MTT e manter as células a 37 ° C numa atmosfera umidificada contendo 5% de CO2 por 3 h.
- Desprezar o sobrenadante e lavar as células com 1 mL de PBS.
- Dissolver os cristais de formazan adicionando 500 µ l de Dimetilsulfóxido (DMSO) em cada poço e avaliar a absorvância com um leitor de placa multi bem no λ = 570 nm.
- Repita a etapa 3.3-3.4 - 3.5-3.6 a 45 h após a irradiação.
Nota: Os resultados são mostrados como uma perturbação da condição Souza correspondente, que é normalizada a 100%.
Atenção: O DMSO é agente inflamável e irritante para a pele, olhos e sistema respiratório (GHS07, GHS08). Em caso de contato com os olhos, lavar imediata e abundantemente com água e consultar um médico. MTT é um agente irritante para a pele, olhos e sistema respiratório (GHS07, GHS08). Em caso de contato com os olhos, lavar imediata e abundantemente com água e consultar um médico.
4. percentagem de determinação de células viáveis (ensaio de exclusão de corante Trypan azul)
Nota: A percentagem de células viáveis foi avaliada por ensaio de exclusão de corante azul Trypan.
- Semente de 2 × 105 Caco-2 em placa de 24 24 h antes da irradiação em 1,25 mL de meio completo.
- Irradiar as células com doses na faixa de 0 - 10 Gy (ver passos 2.1-2.4) então incubar as células a 37 ° C numa atmosfera umidificada contendo 5% de CO2 por 24-48 h.
- Depois o tempo escolhido dois pontos, lavar as células com PBS, descartá-lo e, em seguida, adicionar 100 µ l de tripsina-ácido etilenodiaminotetracético (EDTA) da solução de ácido. Colocar as células a 37 ° C numa atmosfera umidificada contendo 5% de CO2 por 2 min, em seguida, adicione meio completo para prender a reação enzimática.
- Coletar as células em um 1,5 mL-tubo e centrifugar o tubo a 500 x g por 5 min. descartar o sobrenadante e ressuspender as células em 50 µ l de PBS.
- Misturar a suspensão de células com 50 µ l de solução de corante azul de Trypan e incubar a mistura por 3 min à temperatura ambiente.
- Contar o manchado (não viáveis) e inocente (viáveis) células com uma câmara de Bürker.
5. resistência elétrica Trans-epitelial (TEER)
- Semente de 5 × 105 Caco-2 células uma semana antes da irradiação em placa de 6 co cultura inserções (polietileno tereftalato (PET), 2 x 106 poros/cm2).
- 1 h antes da irradiação, medir a TEER com um voltímetro/ohmímetro.
- Irradiar as células como descrito nos passos 2.1-2.4.
- Incube as células Caco-2 em presença/ausência de co-cultura com PBMC a 37 ° C numa atmosfera umidificada contendo 5% de CO2.
- Para o primeiro poucas horas pós-irradiação, medir TEER cada hora e subsequentemente a cada 3 h até 48 h.
6. Western Blot análise de Claudin-1, Occludin, Afadin, ZO-1, ZO-2, NF-kB e XIAP
- Células de semente 5 × 105 1 semana antes da exposição ao raios-x em co-cultura 6 placa insere (PET, 2 x 106 poros/cm2) e irradiar as células como descrito nos passos 2.1-2.4.
- Incube as células Caco-2 em presença/ausência de co-cultura com PBMC a 37 ° C numa atmosfera umidificada contendo 5% de CO2.
- 48 h após a irradiação, preparar Caco-2 e PBMC lisados celulares, tratando as células com lise celular buffer e armazenam amostras a-20 ° C.
Nota: o protocolo pode ser pausado aqui. - Quantificar a quantidade de proteínas totais pelo método de bicinchoninic ácido (BCA).
Nota: o protocolo pode ser pausado aqui. - Misture quantidades iguais de proteínas totais com tampão de amostra Laemli adicionado com β-mercaptoetanol (concentração final de β-Mercaptoetanol é de 5%), aqueça as amostras a 95 ° C por 5 min e girá-los a 10.000 x g.
- Amostras de carga em um 4-20% prefabricados de gel e realizar a eletroforese em 120 V para proteínas de transferência de 1 h. em uma membrana de flúor (PVDF) polyvinildiene.
- Bloquear sites inespecificas incubando a membrana PVDF em temperatura ambiente com 5% sem gordura leite (NFDM) em PBS adicionado com 0,2% Tween-20 (PBT). Lavar a membrana três vezes com 10ml de 0,2% PBT por 5 min.
- Incubar a membrana com agitação suave por 1h à temperatura ambiente antes de serem colocados durante a noite a 4 ° C, com os seguintes anticorpos primários: anti-claudin-1, anti-ZO-1, anti-ZO-2, anti-afadin, anti-occludin, anti-NF-kB, anti-XIAP e anti actina. Lavar a membrana três vezes com 10ml de 0,2% PBT por 5 min.
- Incube as membranas com anticorpos secundarios conjugados a HRP Peroxidase de rábano por 1h à temperatura ambiente com agitação suave. Lavar a membrana três vezes com 10ml de 0,2% PBT por 5 min.
- À temperatura ambiente, desenvolva filmes fotográficos incubando as membranas com kit de quimio-luminescente reforçada.
- Adquirir filmes fotográficos com um sistema de digitalização e quantificar as bandas obtidas com software de análise de imagem adequada.
Nota: A avaliação de Claudin-1, Occludin, Afadin, ZO-1 e 2-ZO é realizada nas células Caco-2. A avaliação de NF-kB e XIAP é realizada em PBMC.
Cuidado: β-Mercaptoetanol é tóxico (GHS05, GHS06, GHS08, GHS09). Não respirar vapores, evitar a libertação no ambiente e usar dispositivos de proteção individual e proteção respiratória. Se ingerido, imediatamente pedi aconselhamento médico.
7. análise estatística
- Para determinar se a exposição à radiação e a co-cultura induzir uma perturbação significativa, executar um teste de duas vias de análise de variância (ANOVA) com comparações múltiplas para medidas repetidas (com testes de post-hoc de Bonferroni para comparar replicar significa).
- Caso contrário, calcule a significância estatística (p) pelo teste-t de Student bicaudal. Cada valor é a média de experimentos independentes de ≥3 ± erro padrão do dizer (SEM).
Resultados
Uma semana antes do experimento, as células são semeadas para a membrana porosa da inserção e permitiu a crescer durante os dias seguintes. O nível da confluência pode ser verificado ou usando um microscópio invertido ou através da medição dos valores de TEER. Com efeito, durante a fase de crescimento, TEER continua a aumentar até que toda a membrana porosa foi coberta por células e eles formam uma monocamada de células diferenciadas. Se as células se proliferam mais rápido/mais lento, o experimento poderia começar em pontos de tempo anterior/posterior após ser semeado. Quando na confluência, as células são então trazidas para as instalações de irradiação, minimizando o estresse ambiental transmitido (temperatura ou pH), antes de iniciar a co-cultura com/sem PBMC, semeado no compartimento inferior (Figura 1A), ou avaliando a proliferação de células Caco-2. Tendo em conta a densidade de semeadura inicial, no dia 0 células devem atingir 100% de confluência e criar um monolayer diferenciado de células epiteliais, que pode ser observado pelo planalto de TEER mostrado na Figura 1B. Uma vez que as células atingir tal status, o valor TEER é mantido relativamente constante ao longo da semana seguinte, enquanto o velho meio de cultura é substituído com meio fresco, pelo menos uma vez por semana (Figura 1B). Como mostrado na Figura 1C, o ensaio de MTT não mostra qualquer alteração estatisticamente significativa do estatuto proliferativa das células Caco-2 em 24 horas, nem a 48 h, independentemente da dose recebida (até 10 Gy).
Observou-se um resultado diferente sobre a mortalidade a curto prazo das células Caco-2. Em ambos os pontos de tempo, a coloração azul Trypan mostrar um aumento dose-dependente na mortalidade de célula. Estes resultados mostram um claro efeito de exposição a radiação, embora as porcentagens de células mortas parecem ser muito baixa, especialmente quando se considera que a dose mais elevada entregue (10 Gy) produz somente aproximadamente 20% de morte celular (Figura 1D).
As amostras foram co cultivadas com ou sem PBMC no compartimento inferior. Dado o fato que PBMC não recebeu qualquer estímulo externo para proliferar, um experimento de 48 h foi considerado ideal para evitar o viés introduzido por PBMC começando a morrer. Portanto, de imediatamente antes da irradiação, TEER foi regularmente medido por 48 h, para manter o controle de possíveis efeitos transitórios causados pelo protocolo de irradiação. Como mostrado na Figura 1 E-F, valores TEER são apresentados como variações relativas no que diz respeito a condição previamente tratada (que eram da ordem de 1200-1500 Ω·cm2) para melhor realçar a perturbação induzida pela irradiação do raio-x e / ou pela presença/ausência de PBMC na cultura co. Em ambos os casos, um pico de transiente inicial pode ser claramente observado no primeiro ponto de tempo após a exposição à radiação, que pode ser atribuída ao processo de irradiação.
Quando não em co-cultura com PBMC (Figura 1E), valores TEER são quase constantes acima de 48 h ao mesmo tempo, depois de 10 Gy de raios-x, as células apresentam uma diminuição prolongada de TEER começando no pós-irradiação 3h. A presença de PBMC modifica completamente a dinâmica temporal de TEER (Figura 1-F). Para todas as doses, é uma redução a TEER claramente observáveis de 3h até aproximadamente 30 h pós-irradiação, quando TEER aparece ao acordo em um valor constante (Figura 1-F).
Níveis de expressão de complexos de junção apertada foram investigados em lysates de células Caco-2 através do ensaio de borrão ocidental. Células caco-2 foram expostas a radiações ionizantes (com doses de 0, 2 e 10 Gy) e posteriormente cultivadas isoladamente ou em co-cultura com PBMCs no compartimento inferior para 48 h (como mostrado na Figura 2A-F). Para não ser significativamente alteradas por raio-x e/ou co-cultura com PBMC, acharam-se tanto Claudin-1 e Occludin (Figura 2A, 2B). Em vez disso, grandes flutuações observaram-se em proteínas andaime ZO-1, ZO-2 e Afadin (Figura 2C, 2D, 2E). Em particular, uma redução nos níveis de expressão ZO-2 é observada já depois de 2 Gy quando em co-cultura com PBMC enquanto apenas em 10 Gy quando Caco-2 foram crescendo sozinho. Níveis de expressão de Afadin em vez disso são afetados somente após 10 Gy de raios-x, com uma redução adicional quando Caco-2 são co cultivadas com PBMC.
PBMC co cultivada com Caco-2 foram analisado em relação o estado inflamatório, em particular, o fator de transcrição Nuclear kB (NF-kB) e o inibidor ligadas ao X da apoptose níveis de proteína (XIAP) têm sido investigados (Figura 2 G-eu). Quantidade total de NF-kB não foi afetada pela cultura co com Caco-2 expostos a doses de radiação diferentes (Figura 2G). Ao contrário, níveis XIAP eram 4-fold acima-está regulada em ambos a 2 Gy e 10 Gy co culturas, embora as grandes variações exigem um maior número de amostras analisadas para reduzir estas flutuações e ganhar um melhor poder estatístico.
Como mostrado na Figura 2F e 2I, algumas bandas inespecíficas podem aparecer ao lado do esperado peso molecular da proteína de interesse. A menos que bandas de verdadeiras e não-específica são facilmente distinguíveis, anticorpo diferente e/ou concentrações de BSA ou NFDM devem ser consideradas.
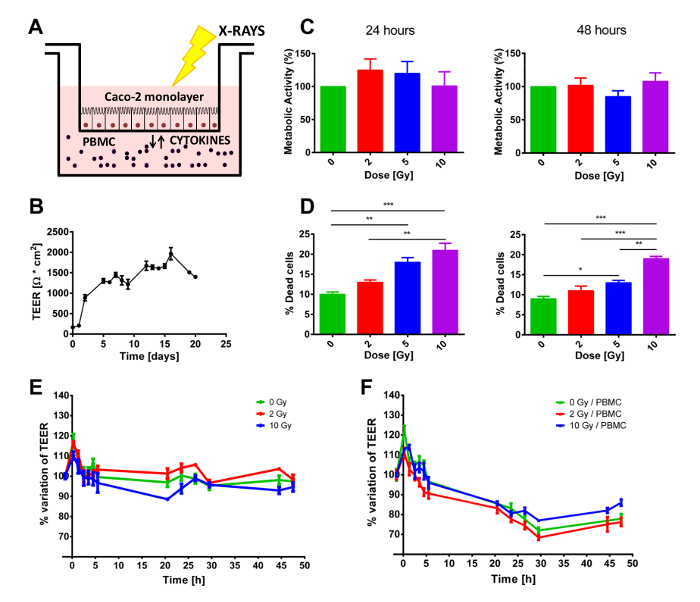
Figura 1 . Configuração geral experimental e efeitos macroscópicos da exposição à radiação e/ou co-cultura PBMC. A) esquemática representação do modelo co-cultura. B) TEER valores medidos diariamente da semente inicial de células Caco-2 para avaliar o status de crescimento e diferenciação adequado da monocamada. Viabilidade celular C) e D) mortalidade em Caco-2 expostos aos raios x (0, 2, 5 e 10 Gy). Medições E) TEER em Caco-2 células irradiadas com 0, 2 e 10 Gy de raios-x cultivadas sem ou F) com PBMC. Cada valor é a média de experimentos independentes de ≥3 ± SEM. * p-val < 0,05; * * p-va l < 0,01; p-val < 0,001. Gráficos adaptados de Morini et al. 15. clique aqui para ver uma versão maior desta figura.
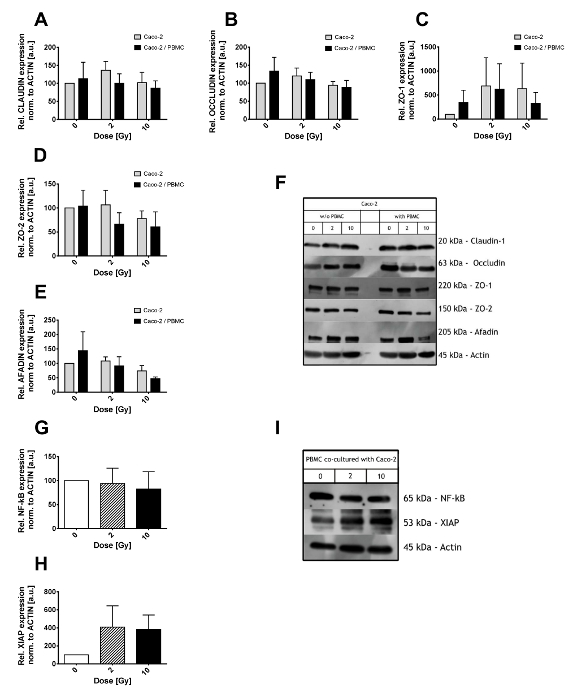
Figura 2. Resultados Western Blot de Caco-2 e PBMC lysates. Nível de expressão das proteínas de junção apertada (Claudin-1 (A), (B) Occludin, ZO-1 (C), ZO-2 (D) e Afadin (E)) no Caco-2 após 0, 2 e 10 Gy de raios-x e na presença/ausência de PBMC em co-cultura. Os valores são normalizados no nível de actina. Filmes ilustrativos para cada proteína junção apertada e condições são mostradas no painel (F). Nível de expressão de NF-κB (G) e XIAP (H) em PBMCs co cultivadas com células Caco-2. Filmes representativos para NF-kB, XIAP e actina são mostradas no painel. Cada valor é a média de experimentos independentes de ≥3 ± gráficos SEM. adaptado de Morini et al. 15. clique aqui para ver uma versão maior desta figura.
Discussão
Câncer colorretal, com sua alta ocorrência em países desenvolvidos, é uma das causas mais frequentes de morbidade e mortalidade na população. Geralmente é gerido pela cirurgia, quimioterapia e radioterapia1. No âmbito de tratamentos de radioterapia, deve prestar especial atenção aos efeitos da exposição de tecido saudável4; Além disso, estudos sistemáticos sobre a relação entre a exposição à radiação e o sistema imunológico são fundamentais para o desenvolvimento de abordagens de radio-imunoterapia3.
A metodologia que adotamos neste trabalho foi adaptada para a investigação de células Caco-2 e diafonia PBMC. Enfocamos os efeitos da exposição de raios-x de células tumorais, mas o mesmo protocolo pode ser adaptado para estudos com agentes farmacológicos. Sendo mais perto de condições fisiológicas em relação ao cultivo de célula padrão, a forte vantagem deste método é a possibilidade de uma dissecação completa de um sistema complexo, dada a possibilidade de analisar os diferentes tipos de células e a liberação de moléculas de sinal em dois compartimentos da cultura co em si. Desta forma, métodos biológicos rotineiramente aplicados podem ajudar a compreensão do celular interplay mecanismos relacionados.
A caracterização inicial dos efeitos de X-ray induzida em células Caco-2 foi baseada em duas medidas complementares, ou seja, o ensaio colorimétrico de MTT e a exclusão do corante azul de Tripan teste. Os resultados aparentemente inconsistentes poderiam ser explicados pelo foco destes dois ensaios diferente. MTT avalia a atividade de enzimas oxidorredutase, enquanto o Trypan corante azul é baseado em um mecanismo de tintura de célula viva exclusão.
A investigação da interação de Caco-2-PBMC requer a criação de uma monocamada epitelial capaz de conduzir a uma separação completa entre os dois compartimentos da cultura co. A possibilidade de semear células Caco-2 em inserção da co-cultura permite a irradiação apenas dessa população celular. Desde a co-cultura começa após a irradiação, não há nenhum viés devido a qualquer exposição acidental de PBMC. Esta configuração precisa ser manipulado com cuidado para evitar danos (ou contaminação) a monocamada celular durante os movimentos da inserção de uma placa de 6 para o outro. Quando realizada com cuidado, TEER medições são um método simples e não-invasiva para investigar a permeabilidade monocamada. Este ensaio está estritamente relacionado com a configuração de cultura co, e não é a única escolha para a investigação de permeabilidade monocamada. Uma vez que é bem calibrado com meio fresco completo permite uma boa reprodutibilidade das medidas. Ensaios comuns focar a difusão dos corantes químicos do compartimento superior "apical" para o fundo "basolateral" um (por exemplo o isotiocianato de fluoresceína (FITC)-ensaio de dextrano)16. No entanto, desde que PBMC estão presentes no compartimento basolateral neste estudo, decidimos evitar a introdução de reagentes químicos nos experimentos.
Entre as diferentes técnicas adoptadas neste trabalho, medição de TEER é o único que requer a configuração de co-cultura17,18. No entanto, as outras técnicas comuns de laboratório fornecem resultados mais informativos quando aplicados às células em co-cultura, que permitem a investigação de um condições mais perto de fisiológicos de configuração e os dados têm um forte significado biológico. Por outro lado, deve-se notar que o uso de células cultivadas em um suporte poroso pode levar a algumas dificuldades nas operações necessárias para preparar as amostras, tais como o lysis da pilha para a preparação de extratos celulares ser analisado através da mancha ocidental.
O sistema adotado neste estudo tem potencial para ser ainda mais melhorada, por exemplo, com a aplicação de substâncias capazes de recriar o ambiente da matriz extracelular. No entanto, isso também resultará em um aumento da complexidade do sistema, e uma dissecação completa de afinação será mais difícil de ser alcançado.
Configurações para cultura de células co certamente representam uma ferramenta poderosa para o avanço da pesquisa em vitro e para a compreensão de sistemas complexos. Esta técnica tem o potencial de aumentar o conhecimento sobre os mecanismos fundamentais, fornecendo novas entradas para estudos de pesquisa básica em sinalização molecular e com possíveis aplicações para a modulação da atividade do sistema imunológico, no âmbito da manejo de paciente clínico oncológico.
Divulgações
Os autores declaram não haverá conflito de interesses.
Agradecimentos
Instituto italiano de Física Nuclear (INFN) parcialmente financiado este trabalho através do projeto INFN-MERIDIAN. Os autores reconhecem Prof Edoardo Milotti (departamento de física, Universidade de Trieste, Itália) para coordenação do projeto INFN-meridiano; Dr. Roberto Chignola (departamento de biotecnologia, Universidade de Verona, Itália) para fornecer as células Caco-2, o ohmímetro e por sua valiosa ajuda e treinamento. Também reconhecemos Agnese Solari para assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| ThinCert 6 Well Cell Culture Inserts for Multiwell Plates | Greiner Bio-one | 657610 | Equipment |
| Cell Culture Multiwell Plate, 6 Well | Greiner Bio-one | 657160 | Plastic |
| Cell Culture Multiwell Plate, 24 Well | Greiner Bio-one | 662160 | Plastic |
| RPMI 1640 without L-Glutamine | Lonza | 12-167F | Reagents |
| Foetal Bovine Serum | Lonza | DE14-801 | Reagents |
| L-Glutamine 200 mM | Lonza | 17-605C | Reagents |
| Penicillin/Streptomycin 10K/10K | Lonza | 17-602E | Reagents |
| CO2 Incubator | Heal Force | HF240 | Equipment |
| Ficoll Histopaque-1077 | Sigma-Aldrich | 10771 | Reagents |
| Tube, 50 mL, PP, Conical Bottom | Greiner Bio-one | 227261 | Plastic |
| Tube, 15 mL, PP, Conical Bottom | Greiner Bio-one | 188261 | Plastic |
| Centrifuge | ThermoScientific | CL31R | Equipment |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | P3813 | Reagents |
| Cell Culture Flask, 25 cm2, PS | Greiner Bio-one | 690175 | Plastic |
| Clinac 2100 Linear Accelerator | Varian | CLINAC 2100C/D | Equipment |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) | Sigma-Aldrich | M5655 | Reagents |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | Reagents |
| Multiwell Plate Reader | GDV | DV990BV6 | Equipment |
| Trypan Blue Solution 0,4 % | Amresco | K940 | Reagents |
| Trypsin-EDTA Solution | Sigma-Aldrich | T4049 | Reagents |
| 1.5 mL tubes | Eppendorf | 0030125150 | Reagents |
| Millicell-ERS voltmeter/ohmeter | Millipore | MERS 00001 | Equipment |
| Cell Lysis Buffer (10x) | Cell Signalling Technology | #9803 | Reagents |
| Bürker Hemocytometer | Sigma-Aldrich | BR719520 | Equipment |
| BCA Protein Quantification Kit | Abcam | ab102536 | Reagents |
| 2x Laemmli Sample Buffer | BioRad | #1610737 | Reagents |
| 2-Mercaptoethanol | BioRad | #1610710 | Reagents |
| Accublock Digital Dry Bath | Labnet International Inc. | D1100 | Equipment |
| 4–20% Mini-PROTEAN TGX Stain-Free Protein Gels, 10 well, 30 µL | BioRad | #4568093 | Reagents |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels, 4-gel | BioRad | #1658004 | Equipment |
| PowerPac HC High-Current Power Supply | BioRad | #1645052 | Equipment |
| Precision Plus Protein WesternC Blotting Standards | BioRad | #1610385 | Reagents |
| 10x Tris/Glycine/SDS Running Buffer | BioRad | #1610732 | Reagents |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BioRad | #1704156 | Reagents |
| Trans-Blot Turbo Transfer System | BioRad | #1704150 | Equipment |
| Blotting-Grade Blocker | BioRad | #1706404 | Reagents |
| Tween-20 | Sigma-Aldrich | 93773 | Reagents |
| Claudin-1 (D5H1D) XP Rabbit mAb | Cell Signalling Technology | #13255 | Reagents |
| Bovine Serum Albumine | Sigma-Aldrich | A7906 | Reagents |
| ZO-1 (D7D12) Rabbit mAb | Cell Signalling Technology | #8193 | Reagents |
| ZO-2 Antibody | Cell Signalling Technology | #2847 | Reagents |
| Afadin (D1Y3Z) Rabbit mAb | Cell Signalling Technology | #13531 | Reagents |
| Anti-Occludin Antibody | Millipore | ABT146 | Reagents |
| Anti-NF-kB p65 antibody [E379] | Abcam | ab32536 | Reagents |
| Anti-XIAP antibody | Abcam | ab21278 | Reagents |
| Amersham ECL Mouse IgG, HRP-linked whole Ab (from sheep) | GE Healthcare Life Sciences | NA931V | Reagents |
| Amersham ECL Rabbit IgG, HRP-linked whole Ab (from donkey) | GE Healthcare Life Sciences | NA934V | Reagents |
| Clarity Western ECL Substrate, 200 mL | BioRad | #1705060 | Reagents |
| Carestream Kodak autoradiography GBX developer/replenisher | Sigma-Aldrich | P7042 | Reagents |
| Carestream Kodak autoradiography GBX fixer/replenisher | Sigma-Aldrich | P7167 | Reagents |
| Carestream Kodak BioMax light film | Sigma-Aldrich | Z370401 | Reagents |
| Gel Doc EZ System | BioRad | #1708270 | Equipment |
Referências
- Cunningham, D., et al. Colorectal cancer. Lancet. 375 (9719), 1030-1047 (2010).
- Mancuso, M., et al. Oncogenic bystander radiation effects in Patched heterozygous mouse cerebellum. PNAS. 105 (34), 12445-12450 (2008).
- Demaria, S., Formenti, S. C. Can abscopal effects of local radiotherapy be predicted by modeling T cell trafficking. J Immunother Cancer. 4 (1), 29 (2016).
- Trott, K. R., et al. Biological mechanisms of normal tissue damage: Importance for the design of NTCP models. Radiother Oncol. 105 (1), 79-85 (2012).
- Derer, A., Deloch, L., Rubner, Y., Fietkau, R., Frey, B., Gaipl, U. S. Radio-immunotherapy-induced immunogenic cancer cells as basis for induction of systemic anti-tumor immune responses - pre-clinical evidence and ongoing clinical applications. Front Immunol. 6, 505 (2015).
- Frey, B., Gaipl, U. S. Radio-immunotherapy: The focused beam expands. Lancet Oncol. 16 (7), 742-743 (2015).
- Prise, K. M., O'Sullivan, J. M. Radiation-induced bystander signalling in cancer therapy. Nat Rev Cancer. 9 (5), 351-360 (2009).
- Sambuy, Y., De Angelis, I., Ranaldi, G., Scarino, M. L., Stammati, A., Zucco, F. The Caco-2 cell line as a model of the intestinal barrier: Influence of cell and culture-related factors on Caco-2 cell functional characteristics. Cell Biol Toxicol. 21 (1), 1-26 (2005).
- Babini, G., et al. Mechanisms of the induction of apoptosis mediated by radiation-induced cytokine release. Radiat Prot Dosim. 166 (1-4), 165-169 (2015).
- Pellegrina, C. D., et al. Effects of wheat germ agglutinin on human gastrointestinal epithelium: Insights from an experimental model of immune/epithelial cell interaction. Toxicol Appl Pharm. 237 (2), 146-153 (2009).
- Pozo-Rubio, T., et al. Immunostimulatory effect of faecal Bifidobacterium species of breast-fed and formula-fed infants in a peripheral blood mononuclear cell/Caco-2 co-culture system. Brit J Nutr. 106 (8), 1216-1223 (2011).
- Parlesak, A., Haller, D., Brinz, S., Baeuerlein, A., Bode, C. Modulation of cytokine release by differentiated CACO-2 cells in a compartmentalized coculture model with mononuclear leucocytes and nonpathogenic bacteria. Scand J Immunol. 60 (5), 477-485 (2004).
- Haller, D. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assay. J Immunol Methods. 65 (1-2), 55-63 (1983).
- Morini, J., Babini, G., Barbieri, S., Baiocco, G., Ottolenghi, A. The Interplay between Radioresistant Caco-2 Cells and the Immune System Increases Epithelial Layer Permeability and Alters Signaling Protein Spectrum. Front Immunol. 8, 1-12 (2017).
- Dittmar, S., Harms, H., Runkler, N., Maisner, A., Kim, K. S., Schneider-Schaulies, J. Measles virus-induced block of transendothelial migration of T lymphocytes and infection-mediated virus spread across endothelial cell barriers. J Virol. 82 (22), 11273-11282 (2008).
- Srinivasan, B., Kolli, A. R., Esch, M. B., Abaci, H. E., Shuler, M. L., Hickman, J. J. TEER Measurement Techniques for In Vitro Barrier Model Systems. J Lab Autom. 20 (2), 107-126 (2015).
- Moyes, S. M., Killick, E. M., Morris, J. F., Kadhim, M. A., Hill, M. A., Carr, K. E. Changes produced by external radiation in parameters influencing intestinal permeability and microparticle uptake in vitro. Int J Radiat Biol. 84 (6), 467-486 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados