Method Article
Un metodo di co-coltura di indagare il Crosstalk tra raggi x irradiati PBMC e cellule Caco-2
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Vi presentiamo un protocollo per studiare il crosstalk tra X-ray-irradiati Caco-2 e cellule mononucleari del sangue periferico (PBMC). Il protocollo inizia con irradiazione di Caco-2 e set-up della co-cultura con PBMC; Successivamente, trans-epiteliale resistenza elettrica è misurata regolarmente nel corso di 48 h e occidentale della macchia eseguita in Caco-2 e PBMC.
Abstract
Il protocollo adottato questo lavoro si propone di svelare come i raggi x perturbare il funzionamento della barriera intestinale, concentrandosi sull'interazione tra le cellule del tumore del colon-retto e il sistema immunitario. Il carcinoma colorettale è fra il più comune tipo di cancro, in genere trattato con chirurgia, chemioterapia e radioterapia. Vantaggi della radioterapia nel tumore di targeting sono ben noti. Tuttavia, anche limitate esposizione dei tessuti sani sono di grande preoccupazione, specialmente per quanto riguarda gli effetti sulla barriera intestinale e il sistema immunitario. L'impostazione adottata permette di studiare l'interazione tra le due popolazioni di cellule in una condizione più simile a quello fisiologico, rispetto alle colture cellulari normali. Per questo scopo, si ricorre a tecniche diverse e abbiamo usato un in vitro cocultura, basato su cellule Caco-2 differenziate come monostrato e PBMC, condividendo lo stesso mezzo di cultura. Questo protocollo è stato sviluppato per mettere a fuoco sia gli effetti macroscopici, cioè la vitalità cellulare e resistenza elettrica Trans-epiteliale (TEER) e, attraverso western blot, alterazioni molecolari, cioè l'attivazione del pathway infiammatorio in cellule del sistema immunitario e l'espressione della proteina di giunzione stretta in cellule Caco-2. La valutazione iniziale degli effetti di radiazione su attuabilità delle cellule Caco-2 è stata valutata tramite la 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromuro (MTT) e analisi del blu di Trypan, mentre TEER è stata misurata ad intervalli di tempo attraverso un ohmetro specificamente progettato per i sistemi di co-coltura. In questo modo, gli effetti dovuti a radiazioni, la presenza di periferiche sangue mononucleari cellule (PBMC) e alla fine loro effetto sinergico, possono essere dimostrati. Attraverso queste tecniche complementari, abbiamo osservato una radio-resistenza alta di Caco-2 all'interno della gamma di 2-10 Gy di raggi x e una permeabilità aumentata del monostrato Caco-2 Quando PBMC sono stati aggiunti. In particolare, presenza PBMC è stato trovato per essere associato con la variazione nell'espressione di proteine di giunzione stretta dell'impalcatura.
Introduzione
La metodologia adottata in questo lavoro è stata progettata per studiare l'interazione tra le cellule tumorali del colon-retto e il sistema immunitario, sfruttando un set-up più vicino alla condizione fisiologica rispetto alle colture cellulari 2-dimensionale normale.
Carcinoma colorettale (CRC) è considerato il terzo più frequente tipo di cancro, con più di 1 milione di casi in tutto il mondo (Global cancro Observatory, Agenzia internazionale per ricerca sul cancro, organizzazione mondiale della sanità, http://gco.iarc.fr). Gestione del CRC è effettuata ordinariamente attraverso la chirurgia, la chemioterapia o la radioterapia1. Rispetto a tecniche invasive come la chirurgia o la chemioterapia, la radioterapia in gran parte evita le reazioni sistemiche dannose tipiche derivanti da questi approcci clinici, grazie alla consegna localizzata della dose di radiazione. Tuttavia, gli effetti collaterali possono verificarsi nei tessuti sani circostanti, innescando l'infiammazione con danni diretti alle cellule sane e danno mediato da effetti non mirati2,3,4. Messa a fuoco sugli effetti negativi a causa l'irradiazione durante il trattamento di cancro colorettale, due aspetti devono essere studiati. In primo luogo, i meccanismi responsabili di impermeabilità intestinale potrebbero essere alterati dalla consegna di radiazione che causa, a sua volta, la possibilità di effetti collaterali dovuti a un alterato contenimento della popolazione batterica e il passaggio paracellulare di molecole e soluti. In secondo luogo, la presenza di tessuto linfatico associato all'intestino (GALT) agisce come un avamposto del sistema immunitario, con la funzione di controllare la crescita batterica e che mediano la risposta immunitaria generale5,6,7. Per adempiere a queste funzioni, impermeabilità intestinale è mantenuto grazie alla funzione dei complessi giunzionali tra le membrane delle cellule. Per queste ragioni, le conseguenze pregiudizievoli indotte a causa di diverse dosi di raggi x sono state studiate in cellule Caco-2 da solo e in co-colture con PBMC.
Anche se lo svolgimento di studi su colture cellulari è il primo setLine () di indagine nella ricerca biomedica, la mancanza di conoscenza dettagliata dei meccanismi guida interazioni cellula biologia e reciproca tra diversi tipi di cellule potrebbe diventare critica quando si avvicina lo studio della fisiologia di organi, sistemi e apparati che non possono essere facilmente ricreati in laboratorio. Pertanto, abbiamo deciso di adottare un set-up di co-coltura, consentendo sia lo studio di due popolazioni di cellule insieme e la dissezione degli aspetti legati ai meccanismi intercellulari ed extracellulari.
Co-coltura è una tecnica sfruttata quando studiare funzioni epiteliali e l'interazione tra diversi tipi di cellule. In particolare, l'uso di tale tecnica diventa obbligatorio nel nostro caso, perché epiteli sono costituiti da cellule caratterizzate dalla polarità. Nel caso la barriera intestinale, enterociti mostrano una polarizzazione ben definita, con apicale e basolaterale poli normalmente separati per la presenza di molecole di adesione-creazione di giunzione stretta. Questa compartimentazione è necessaria per la fisiologia del tessuto, evitando paracellulare traffico e consentendo il passaggio di determinate molecole solo. Questa funzione è ovviamente impossibile da ricreare con una cellula normale coltura set-up. Inoltre, l'adozione dell'assetto co-coltura riproduce la presenza di cellule immuni solo nella superficie basolaterale, mentre la superficie apicale (corrispondente al lume intestinale) non è direttamente a contatto con altre cellule.
Recentemente, linee di cellule Caco-2 acquisito maggiore importanza come modello in vitro di barriera intestinale. Anche se derivato da adenocarcinoma del colon umano, cellule Caco-2 mantengono la capacità di differenziazione e creare un funzionale polarizzata monostrato8, che permette lo studio delle proprietà della membrana cellulare se coltivate in un inserto di co-coltura.
Poiché Caco-2 coltura su una membrana porosa è un modello ben consolidata in vitro di monostrato intestinale, un miglioramento è stato il co-coltura fra Caco-2 e di altre cellule. Questo set-up è stato adottato frequentemente a misura il crosstalk tra diversi cellulari tipi9 e può essere utilizzato per svelare Caco-2 perturbato risposta a stimoli esogeni quando in co-coltura, rispetto al Caco-2 coltivate da solo.
Molti studi hanno affrontato Caco-2 comportamento quando co-coltivate con entrambi batteri non patogeni e periferico del sangue cellule mononucleari, per chiarire in particolare l'area interattiva con il sistema immunitario10. Pozo-Rubio et al. 11 studiato l'espressione di diverse citochine in una co-coltura di Caco-2/PBMC con bifidobacteria stimolando le cellule Caco-2. Loro lavoro ha evidenziato modifiche sostanziali ai profili di espressione di citochine a seconda stimolazione batterica effettuata in presenza/assenza di PBMC. I risultati portano alla conclusione che la presenza di PBMC sensibilizza Caco-2 al bifidobatteri.
Diverse risposte delle cellule Caco-2 ai batteri patogeni e non patogeni sono state valutate da vari gruppi di ricerca. Parlesak et al. 12 ha dimostrato gli effetti immunosopressivi delle cellule Caco-2 sul batterio Escherichia coli-stimolato PBMC. Inoltre, Haller et al. 13 ha studiato la risposta delle cellule Caco-2 stimolate con entrambi lipopolysaccharide (LPS) da enteropatogeni spp. e. coli o batteri enteropatogeni-non prevenuto coli spp., Lactobacillus spp., rafforzare la congettura che la risposta delle cellule Caco-2 dipende strettamente dalla presenza di leucociti nella confi gurazione di co-coltura.
Eseguendo diverse complementari del laboratorio analisi (ad es. western blot, resistenza elettrica trans-epiteliale, MTT, ecc.), oltre all'analisi dei diversi tipi di cellule in co-coltura, promette l'intera metodologia risultati che possono essere considerati più rappresentativo di ciò che realmente accade in vivo. Inoltre, questo set-up consente la separazione dei compartimenti diversi co-coltura, consentendo non solo lo studio dei tipi cellulari coinvolti, ma anche le molecole di segnalazione intercellulare rilasciate nel vano inferiore superiore vs o in presenza di vs assenza di co-coltura.
Protocollo
Il seguente protocollo comporta il prelievo di sangue umano da volontari sani. Donatori fornito il consenso informato scritto prima dell'iscrizione. Questa procedura è in conformità con la dichiarazione di Helsinki e prelievi di sangue sono stati eseguiti da un assistente sanitario professionale.
1. cultura e set-up di co-coltura delle cellule
- Una settimana prima l'irradiazione, preparare una sospensione di cellule Caco-2 contenente 2,5 × 105 cellule/mL in fresco RPMI1640 supplementato con 10% siero bovino fetale (FBS), 2 mM L-Glutammina, 100 U/mL di penicillina e 100 μg/mL di streptomicina.
- Semi 2 mL della sospensione di cellule in coltura sterile di cella di 1 µm-poro diametro inserti per piastre da 6 pozzetti e mettere l'inserto in una piastra a 6 pozzetti.
Nota: Inserti di cultura cellulare potrebbe essere necessario essere attivato tramite incubazione con terreno sterile completo prima della semina delle cellule. In questo caso, i mezzi di coltura dovrebbe essere scartato e sostituito con media sospensione delle cellule. - Aggiungere 3 mL di fresco RPMI1640 supplementato con 10% FBS, 2 mM L-Glutammina, 100 UI/mL di penicillina e streptomicina 100 µ g/mL in ogni vano inferiore e cultura le cellule a 37 ° C in un incubatore con atmosfera umidificata contenente 5% CO2.
- Lo stesso giorno di irradiazione delle cellule Caco-2, raccogliere il sangue umano intero in provette di 6 mL commercialmente disponibili al litio-eparina rivestito (formato del tubo: 13 x 100 mm).
- Successivamente, è possibile isolare cellule mononucleari del sangue periferico (PBMC) mediante gradiente di Ficoll. Per separare PBMC, mettere 25 mL di Ficoll in una provetta conica per centrifuga da 50 mL e strato un uguale volume di sangue intero diluito 1:1 con RPMI1640 sulla superficie di Ficoll.
Nota: Un donatore sano normale di solito ha circa 4-10 × 106 PBMC/mL. - Centrifugare le provette da 50 mL a 400 x g per 30 min a temperatura ambiente.
- Delicatamente raccogliere i PBMC all'interfaccia tra Ficoll e plasma dall'aspirazione con una pipetta Pasteur e metterli in una provetta conica da 15 mL.
- Lavare i PBMC due volte, l'aggiunta di 10 mL di tampone fosfato salino (PBS) e centrifugazione PBMC a 250 x g per 10 min.
- Cultura PBMC per un massimo di 3-5 h T25 boccette di2 cm nel completano RPMI1640 media, come descritto prima, a 37 ° C in atmosfera umidificata contenente 5% CO2.
Nota: Raccogliere PBMC il giorno dell'esperimento e seme 2 × 106 cellule/pozzetto, sospesa in 3 mL di terreno completo di RPMI1640, nel vano inferiore della co-cultura. Inserti con cellule Caco-2 sono trasferiti nei pozzetti contenenti PBMC 30 min dopo loro irradiazione. PBMC raccolti da sangue intero non mantenute in coltura per più di circa 72 ore, se non stimolato con ad esempio. fitoemagglutinina (PHA), dopo di che l'attuabilità delle cellule è perso.
Attenzione: La qualità e la sicurezza di tutto il sangue e prodotti sanguigni devono essere garantite durante tutto il processo.
2. l'irradiazione set-up
Nota: L'irradiazione delle cellule Caco-2 è stata effettuata presso il dipartimento di radioterapia dell'Istituto di Ricovero e Cura a Carattere Scientifico (IRCCS) S. Maugeri (Pavia, Italia) con un acceleratore lineare abitualmente utilizzato per trattare diversi tipi di tumori.
- Impostare fotoni di energia di raggi x di 6 MV picco. L'acceleratore lineare opera in un regime di pulsazione (tempo tra due impulsi consecutivi approssimativamente di 4 ms; la durata di un singolo impulso di 5 µs con una dose rate fino a 1 × 10-3 Gy/p).
- Posizionare le piastre 6 pozzetti contenenti inserti con Caco-2 sulla traiettoria dei raggi x su un 1,4 cm di spessore Plexiglas foglio (corrispondente ad una distanza leggermente maggiore l'accumulo della radiazione usata) a 100 centimetri dalla fonte di radiazione.
- Posizionare un bolo di 0,5 cm di spessore su ogni campione prima l'irradiazione si verifica per garantire la componente di radiazione retrodiffusa e l'equilibrio di particelle cariche.
- Irradiare le cellule (dosi nel range 2-10 Gy) con un piatto e simmetrica (± 2%) campo di radiazione di 20x20 cm2 e un tasso di dose di 3 Gy/min.
Nota: Controllare la "farsa"-cellule irradiate ha subito le stesse condizioni procedurale di quelli irradiati, senza entrare nella stanza di irradiazione (dose ricevuta: 0 Gy).
Attenzione: dispositivi di produzione di radiazioni ionizzanti devono essere utilizzati solo da personale specializzato.
3. cella analisi di attuabilità (analisi di MTT)
Nota: L'attività metabolica delle cellule Caco-2 è stata valutata tramite il test di 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromuro (MTT)14.
- Semi 2 × 105 Caco-2 in una piastra a 24 pozzetti 24 h prima di irradiazione in 1,25 mL di terreno completo.
- Irradiare le cellule come descritto ai punti 2.1-2.4 poi incubare le cellule a 37 ° C in atmosfera umidificata contenente 5% CO2.
- 21 h dopo irradiazione, aggiungere 100 µ l di 5 mg/mL soluzione MTT e mantenere le cellule a 37 ° C in atmosfera umidificata contenente 5% CO2 per 3 h.
- Scartare il surnatante e lavare le cellule con 1 mL di PBS.
- Sciogliere i cristalli di formazano aggiungendo 500 µ l di solfossido dimetilico (DMSO) in ciascun pozzetto e valutare la capacità di assorbimento con un lettore di piastre multi-pozzetto a λ = 570 nm.
- Ripetere il passaggio 3.3-3.4 - 3.5-3.6 a 45 h dopo irradiazione.
Nota: I risultati sono mostrati come una perturbazione dalla condizione di sham corrispondente, che si è normalizzata al 100%.
Attenzione: DMSO è agente infiammabile e irritante per pelle, occhi e Apparato respiratorio (GHS07, GHS08). In caso di contatto con gli occhi, lavare immediatamente con abbondante acqua e consultare un medico. MTT è un agente irritante per pelle, occhi e Apparato respiratorio (GHS07, GHS08). In caso di contatto con gli occhi, sciacquare immediatamente con abbondante acqua e consultare un medico.
4. percentuale di cellule vitali determinazione (tripan blu colorante esclusione Assay)
Nota: Percentuale di cellule vitali è stata valutata dall'analisi di esclusione del colorante blu di Trypan.
- Semi 2 × 105 Caco-2 in piastra a 24 pozzetti 24 h prima di irradiazione in 1,25 mL di terreno completo.
- Irradiare le cellule con dosi nell'intervallo 0 - 10 Gy (vedere i passaggi 2.1-2.4) poi incubare le cellule a 37 ° C in atmosfera umidificata contenente 5% CO2 per 24-48 h.
- Dopo il tempo scelto due punti, lavare le cellule con PBS, eliminarlo, poi aggiungere 100 µ l di soluzione di tripsina-Etilendiamminotetraacetico acido (EDTA). Mettere le cellule a 37 ° C in atmosfera umidificata contenente 5% CO2 per 2 min poi aggiungere terreno completo per arrestare la reazione enzimatica.
- Raccogliere le cellule in un tubo di 1,5 mL e centrifugare la provetta a 500 x g per 5 min, scartare il supernatante e risospendere le cellule in 50 µ l di PBS.
- Mescolare la sospensione cellulare con 50 µ l di soluzione colorante Trypan Blue e incubare la miscela per 3 min a temperatura ambiente.
- Contare il macchiato (non vitali) e senza macchia di cellule (vitali) con una camera di Bürker.
5. resistenza elettrica Trans-epiteliale (TEER)
- Cellule di seme 5 × 105 Caco-2 una settimana prima dell'irradiazione in piastra a 6 pozzetti co-coltura inserti (polietilene tereftalato (PET), 2 x 106 pori/cm2).
- 1 h prima di irradiamento, misurare la TEER con un voltmetro/ohmetro.
- Irradiare le cellule come descritto ai punti 2.1-2.4.
- Incubare le cellule Caco-2 in presenza/assenza di co-coltura con PBMC a 37 ° C in atmosfera umidificata contenente 5% CO2.
- Per il primo poche ore dopo irradiazione, misurare TEER ogni ora e successivamente ogni 3 ore fino a 48 ore.
6. Western Blot analisi di Claudina-1, occludina, Afadin, ZO-1, ZO-2, NF-kB e XIAP
- Cellule di seme 5 × 105 1 settimana prima dell'esposizione di raggi x in co-coltura piastra a 6 pozzetti inserti (PET, 2 x 106 pori/cm2) e irradiare le cellule come descritto ai punti 2.1-2.4.
- Incubare le cellule Caco-2 in presenza/assenza di co-coltura con PBMC a 37 ° C in atmosfera umidificata contenente 5% CO2.
- 48 h dopo irradiazione, preparare Caco-2 e lisati cellulari PBMC trattando le cellule con lisi cellulare buffer e conservare i campioni a-20 ° C.
Nota: il protocollo può essere messo in pausa qui. - Quantificare la quantità di proteine totali dal metodo (BCA) l'acido bicinconinico.
Nota: il protocollo può essere messo in pausa qui. - Mescolare la stessa quantità di proteine totali con Laemli Sample Buffer aggiunto con β-mercaptoetanolo (concentrazione finale di β-mercaptoetanolo è 5%), riscaldare i campioni a 95 ° C per 5 min e li spin a 10.000 x g.
- Campioni di carico in un 4-20% prefabbricate in gel ed eseguire l'elettroforesi a 120 V per proteine di trasferimento di 1 h. su una membrana di fluoruro (PVDF) polyvinildiene.
- Bloccare i siti di legame non specifico incubando membrana PVDF a temperatura ambiente con 5% senza grassi del latte secco (NFDM) in PBS addizionato di 0,2% Tween-20 (PBT). Lavare la membrana tre volte con 10ml di 0,2% PBT per 5 min.
- Incubare la membrana con delicata agitazione per 1 h a temperatura ambiente prima di essere messi durante la notte a 4 ° C con i seguenti anticorpi primari: anti-claudin-1, anti-ZO-1, anti-ZO-2, anti-afadin, anti-occludina, anti-NF-kB, anti-XIAP e anti-actina. Lavare la membrana tre volte con 10ml di 0,2% PBT per 5 min.
- Incubare le membrane con anticorpi secondari coniugati HRP perossidasi di rafano per 1 h a temperatura ambiente con agitazione delicata. Lavare la membrana tre volte con 10ml di 0,2% PBT per 5 min.
- A temperatura ambiente, sviluppare pellicole fotografiche incubando le membrane con kit chemio-luminescenti avanzata.
- Acquisire pellicole fotografiche con un sistema di scansione e quantificare le bande ottenute con software di analisi di immagine adatta.
Nota: La valutazione di Claudina-1, Occludin, Afadin, ZO-1, ZO-2 e viene eseguita in cellule Caco-2. La valutazione di NF-kB e XIAP viene eseguita in PBMC.
Attenzione: il β-mercaptoetanolo è tossico (GHS05, GHS06, GHS08 GHS09). Non respirare i vapori, non disperdere nell'ambiente e indossare dispositivi di protezione individuale e protezione delle vie respiratorie. In caso di ingestione, immediatamente chiedere consiglio medico.
7. elaborazione statistica
- Per determinare se l'esposizione alle radiazioni e la co-cultura indurre una perturbazione statisticamente significativa, eseguire un test di analisi della varianza (ANOVA) bidirezionale con i confronti multipli per misure ripetute (con test post-hoc di Bonferroni per confrontare replicare significa).
- Se non diversamente specificato, è possibile calcolare la significatività statistica (p) di test t di Student a due code. Ogni valore è la media di ≥ 3 esperimenti indipendenti ± errore Standard di dire (SEM).
Risultati
Una settimana prima dell'esperimento, le cellule sono seminate sulla membrana porosa dell'inserto e ha permesso di crescere nei giorni successivi. Il livello della confluenza può essere controllato utilizzando un microscopio invertito o tramite la misurazione dei valori di TEER. Infatti, durante la fase di crescita, TEER continua ad aumentare fino a quando tutti la membrana porosa è stato coperto dalle cellule e formano un monostrato di cellule differenziate. Se le cellule proliferano più veloce/più lento, l'esperimento potrebbe iniziare a intervalli di tempo prima/dopo dopo essendo testa di serie. Quando alla confluenza, le cellule vengono poi portate al centro di irradiazione, riducendo al minimo lo stress ambientale impartito (temperatura o pH), prima di iniziare la co-cultura con/senza PBMC, testa di serie nel vano inferiore (Figura 1A), o valutando la proliferazione delle cellule Caco-2. Data la densità di semina iniziale, il giorno 0 cellule dovrebbero raggiungere 100% confluenza e creare un monostrato differenziato delle cellule epiteliali, che può essere osservato dall'altopiano in TEER illustrato nella Figura 1B. Una volta che le cellule raggiungono tale status, viene mantenuto relativamente costante nel corso della settimana seguente, il valore TEER, purché il vecchio mezzo di coltura viene sostituito con terreno nuovo, almeno una volta alla settimana (Figura 1B). Come illustrato nella Figura 1C, l'analisi di MTT non mostra alcun'alterazione statisticamente significativa dello stato proliferativo delle cellule Caco-2 a 24 h, né a 48 h, indipendentemente dalla dose ricevuta (fino a 10 Gy).
Un risultato diverso è stato osservato riguardo la mortalità a breve termine delle cellule Caco-2. In entrambi i punti di tempo, colorazione blu di Trypan mostrano un aumento dose-dipendente nella mortalità delle cellule. Questi risultati mostrano un chiaro effetto di esposizione a radiazioni, anche se le percentuali di cellule morte sembrano essere molto bassa, soprattutto se si considera che la dose più alta (10 Gy) produce soltanto circa 20% di morte delle cellule (Figura 1D).
I campioni erano co-coltivati con o senza PBMC nel vano inferiore. Dato il fatto che PBMC non ha ricevuto alcun stimolo esterno a proliferare, un esperimento di 48 h è stato considerato ideale per evitare la distorsione introdotta da PBMC iniziando a morire. Pertanto, da immediatamente prima l'irradiazione, TEER era regolarmente misurati per 48 h, per tenere traccia di possibili effetti transitori causati dal protocollo di irradiazione. Come illustrato nella Figura 1 E-F, TEER valori sono presentati come relativi variazioni rispetto la condizione pre-trattata (che erano dell'ordine di 1200-1500 Ω·cm2) per meglio evidenziare la perturbazione indotta dall'irradiazione di raggi x e / o di presenza/assenza di PBMC in co-coltura. In entrambi i casi, un picco transitorio iniziale può essere visto chiaramente nel primo punto di tempo dopo l'esposizione a radiazioni, che possa essere attribuito alla procedura di irradiazione.
Quando non in co-coltura con PBMC (Figura 1E), valori di TEER sono quasi costanti fino a 48 h mentre, dopo 10 Gy di raggi x, le cellule mostrano una diminuzione prolungata della TEER inizio alle post-irradiazione h 3. La presenza di PBMCs modifica completamente la dinamica temporale di TEER (Figura 1,F). Per tutte le dosi, una riduzione del TEER è chiaramente osservabile da 3 h fino a circa dopo irradiazione h 30, quando TEER sembra attestarsi a un valore costante (Figura 1,F).
I livelli di espressione di stretta della giunzione complessi sono stati studiati nei lisati di cellule Caco-2 attraverso analisi occidentale della macchia. Cellule Caco-2 sono stati esposti a radiazioni ionizzanti (con dosi di 0, 2 e 10 Gy) e successivamente sviluppate da soli o in co-coltura con PBMCs nel vano inferiore per 48 h (come mostrato nella Figura 2A-F). Claudina-1 sia Occludin (Figura 2A, 2B) sono stati trovati per non essere alterati significativamente da raggi x e/o di co-coltura con PBMC. Grandi fluttuazioni sono state invece osservate in proteine impalcatura ZO-1, ZO-2 e Afadin (Figura 2C, 2D, 2E). In particolare, una riduzione nei livelli di espressione del ZO-2 è osservata già dopo 2 Gy quando in co-coltura con PBMC mentre solo a 10 Gy quando Caco-2 stavano crescendo da solo. I livelli di espressione di Afadin sono invece interessati solo dopo 10 Gy di raggi x, con una riduzione supplementare quando Caco-2 sono co-coltivate con PBMCs.
PBMCs co-coltivate con Caco-2 sono stati analizzati per quanto riguarda lo stato infiammatorio, in particolare, il fattore di trascrizione nucleare kB (NF-kB) e l'inibitore X-collegato apoptosi (XIAP) di livelli di proteine sono state studiate (Figura 2 G-io). Importo totale di NF-kB non è stata colpita dalla co-cultura con Caco-2 esposto a dosi di radiazioni differenti (Figura 2G). Al contrario, i livelli XIAP erano 4 volte up-regolate in entrambi i 2 Gy e 10 Gy co-culture, anche se le grandi variazioni richiedono un maggior numero di campioni analizzati per ridurre tali fluttuazioni e acquisire una migliore potenza statistica.
Come illustrato nella Figura 2F e 2I, alcune fasce non specifiche potrebbero apparire accanto il previsto peso molecolare della proteina di interesse. A meno che bande di vere e non-specifici sono facilmente distinguibili, diversi anticorpi e/o concentrazioni di BSA o NFDM dovrebbero essere considerate.
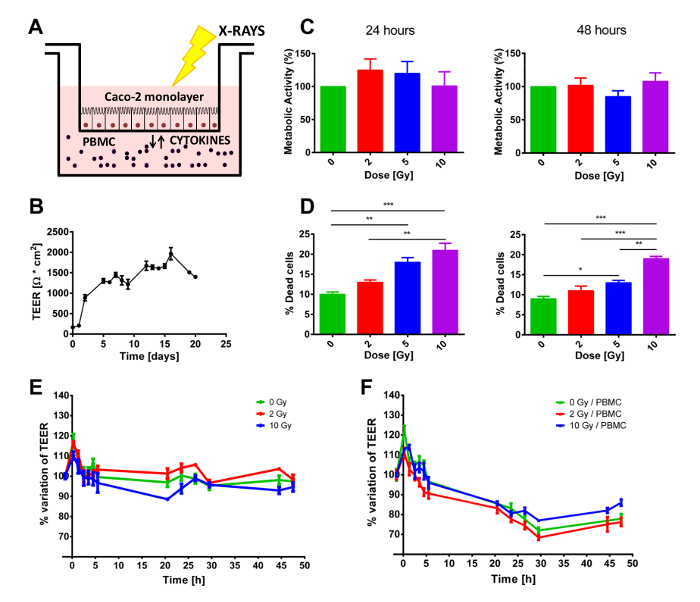
Figura 1 . Messa a punto generale sperimentale e macroscopici effetti di esposizione a radiazioni e/o di co-coltura PBMC. A) rappresentazione del modello di co-coltura. B) TEER valori misurati quotidianamente dal seme iniziale delle cellule Caco-2 per valutare lo stato di crescita e differenziazione corretta di strato monomolecolare. Attuabilità delle cellule C) e D) mortalità in Caco-2 esposto ai raggi x (0, 2, 5 e 10 Gy). Misurazioni E) TEER in cellule Caco-2 irradiati con 0, 2 e 10 Gy di raggi x coltivate senza o F) con PBMCs. Ogni valore è la media di ≥ 3 esperimenti indipendenti ± SEM. * p-val < 0.05; * * p-va l < 0.01; p-val < 0,001. Grafici adattati da Morini et al. 15. Clicca qui per visualizzare una versione più grande di questa figura.
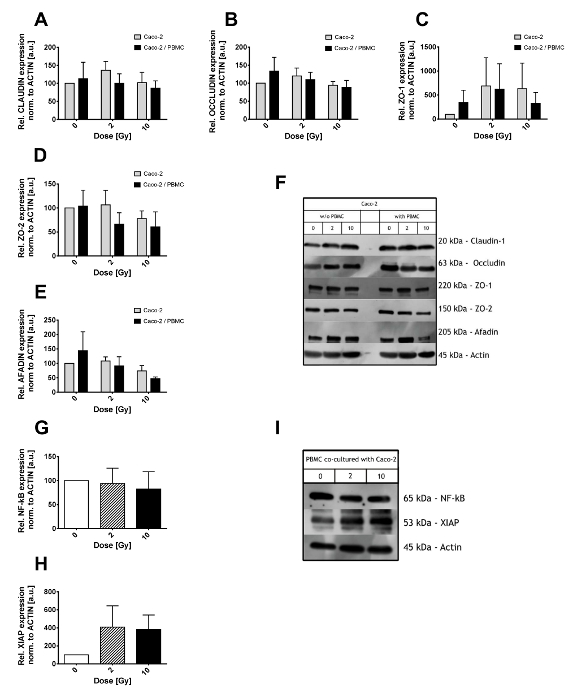
Nella figura 2. Risultati di Western Blot di Caco-2 e PBMC lysates. Livello di espressione delle proteine stretta della giunzione (Claudina-1 (A), Occludin (B), ZO-1 (C), ZO-2 (D) e Afadin (E)) in Caco-2 dopo 0, 2 e 10 Gy di raggi x e in presenza/assenza di PBMC in co-coltura. I valori vengono normalizzati a livello di actina. Illustrative pellicole per ogni proteina di giunzione stretta e le condizioni sono indicate nel pannello (F). Livello di espressione di NF-κB (G) e XIAP (H) in PBMCs co-coltivate con cellule Caco-2. Nel pannello vengono proiettati film rappresentativo per NF-kB, XIAP e actina. Ogni valore è la media di ≥ 3 esperimenti indipendenti ± SEM. grafici adattato da Morini et al. 15. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Cancro colorettale, con il relativo avvenimento alta nei paesi sviluppati, è una delle cause più frequenti di morbilità e mortalità nella popolazione. Di solito è gestito dalla chirurgia, chemioterapia e radioterapia1. Nell'ambito dei trattamenti di radioterapia, è necessario prestare particolare attenzione agli effetti del tessuto sano esposizione4; Inoltre, gli studi sistematici sul rapporto tra l'esposizione a radiazioni e il sistema immunitario sono fondamentali per lo sviluppo di approcci di radio-immunoterapia3.
La metodologia adottata in questo lavoro è stata adattata all'investigazione delle cellule Caco-2 e PBMC diafonia. Ci siamo concentrati sull'effetto dell'esposizione a raggi x delle cellule del tumore, ma lo stesso protocollo può essere adattato agli studi con agenti farmacologici. Essere più vicini a condizioni fisiologiche rispetto alla coltura cellulare standard, il grande vantaggio di questo metodo è la possibilità di una dissezione completa di un sistema complesso, dato la possibilità di analizzare sia i diversi tipi di cellule e il rilascio di molecole di segnale in due scomparti della co-cultura stessa. In questo modo, ordinariamente applicati metodi biologici possono aiutare la comprensione dei cellulari correlati meccanismi di interazione.
La caratterizzazione iniziale degli effetti indotti da X-ray su cellule Caco-2 era basata su due misure complementari, cioè l'analisi colorimetrica di MTT e l'esclusione del colorante blu di Trypan test. I risultati apparentemente incoerenti potrebbero spiegarsi con la messa a fuoco diverso di questi due test. MTT valuta l'attività di enzimi ossidoriduttasi, mentre il Trypan blu della tintura è basato su un meccanismo di tintura esclusione cellula vivente.
L'inchiesta di interazione Caco-2-PBMC richiede la creazione di un monostrato epiteliale in grado di condurre una completa separazione tra i due compartimenti della co-cultura. La possibilità di semina di cellule Caco-2 in co-coltura inserto permette l'irradiazione di questa popolazione di cellule. Poiché la co-coltura comincia dopo irradiazione, non c'è nessun pregiudizio a causa di qualsiasi esposizione accidentale di PBMC. Questo set-up deve essere maneggiato con attenzione per evitare danni (o contaminazione) per il monostrato cellulare durante i movimenti dell'inserto da 6 uno pozzetti a altro. Quando eseguito con cura, le misure TEER sono un metodo semplice e non invasivo per studiare la permeabilità dello strato monomolecolare. Questo test è strettamente funzionale all'allestimento di co-coltura, e non è l'unica scelta per le indagini di permeabilità dello strato monomolecolare. Una volta che esso è ben calibrata con medium fresco completo permette una buona riproducibilità delle misure. Comuni saggi concentrano sulla diffusione dei coloranti chimici dal vano superiore "apicale" a fondo "basolateral" uno (ad esempio isotiocianato di fluoresceina (FITC)-analisi dextrano)16. Tuttavia, poiché PBMC sono presenti nel vano basolateral in questo studio, abbiamo deciso di evitare l'introduzione di reagenti chimici negli esperimenti.
Tra le diverse tecniche adottate in questo lavoro, TEER misura è l'unico che richiede il set-up di co-coltura17,18. Tuttavia, le altre comuni tecniche di laboratorio forniscono risultati più informativi quando applicata a celle in co-coltura, in quanto consentono l'indagine delle condizioni più vicino al fisiologico di installazione e i dati hanno un significato biologico più forte. D'altra parte, si deve constatare che l'uso di cellule cresciute su un supporto poroso potrebbe portare a qualche difficoltà nelle operazioni necessarie per la preparazione dei campioni, come la lisi cellulare per la preparazione di estratti cellulari essere analizzati mediante western blotting.
Il sistema adottato in questo studio ha il potenziale per essere ulteriormente migliorata, ad esempio con l'applicazione di sostanze in grado di ricreare l'ambiente extracellulare. Tuttavia, anche questo si tradurrà in un aumento della complessità del sistema e una dissezione completa dell'assetto sarà più difficile da raggiungere.
Configurazioni per la co-coltura cellulare certamente rappresentano un potente strumento per l'avanzamento della ricerca in vitro e per la comprensione di sistemi complessi. Questa tecnica ha il potenziale di aumentare le conoscenze sui meccanismi fondamentali, fornendo nuovi ingressi agli studi di ricerca di base sulla segnalazione molecolare e con possibili applicazioni alla modulazione dell'attività del sistema immunitario nel quadro del gestione di pazienti clinici oncologici.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Istituto Italiano di fisica nucleare (INFN) parzialmente finanziato questo lavoro attraverso il progetto INFN-MERIDIAN. Gli autori riconoscono la Prof. ssa Edoardo Milotti (dipartimento di fisica, Università di Trieste, Italia) per il coordinamento del progetto INFN-MERIDIAN; Dr. Roberto Chignola (dipartimento di biotecnologia, Università di Verona, Italia) per fornire le cellule Caco-2, l'ohmmetro e per il suo prezioso aiuto e la formazione. Riconosciamo anche Agnese Solari per assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| ThinCert 6 Well Cell Culture Inserts for Multiwell Plates | Greiner Bio-one | 657610 | Equipment |
| Cell Culture Multiwell Plate, 6 Well | Greiner Bio-one | 657160 | Plastic |
| Cell Culture Multiwell Plate, 24 Well | Greiner Bio-one | 662160 | Plastic |
| RPMI 1640 without L-Glutamine | Lonza | 12-167F | Reagents |
| Foetal Bovine Serum | Lonza | DE14-801 | Reagents |
| L-Glutamine 200 mM | Lonza | 17-605C | Reagents |
| Penicillin/Streptomycin 10K/10K | Lonza | 17-602E | Reagents |
| CO2 Incubator | Heal Force | HF240 | Equipment |
| Ficoll Histopaque-1077 | Sigma-Aldrich | 10771 | Reagents |
| Tube, 50 mL, PP, Conical Bottom | Greiner Bio-one | 227261 | Plastic |
| Tube, 15 mL, PP, Conical Bottom | Greiner Bio-one | 188261 | Plastic |
| Centrifuge | ThermoScientific | CL31R | Equipment |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | P3813 | Reagents |
| Cell Culture Flask, 25 cm2, PS | Greiner Bio-one | 690175 | Plastic |
| Clinac 2100 Linear Accelerator | Varian | CLINAC 2100C/D | Equipment |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) | Sigma-Aldrich | M5655 | Reagents |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | Reagents |
| Multiwell Plate Reader | GDV | DV990BV6 | Equipment |
| Trypan Blue Solution 0,4 % | Amresco | K940 | Reagents |
| Trypsin-EDTA Solution | Sigma-Aldrich | T4049 | Reagents |
| 1.5 mL tubes | Eppendorf | 0030125150 | Reagents |
| Millicell-ERS voltmeter/ohmeter | Millipore | MERS 00001 | Equipment |
| Cell Lysis Buffer (10x) | Cell Signalling Technology | #9803 | Reagents |
| Bürker Hemocytometer | Sigma-Aldrich | BR719520 | Equipment |
| BCA Protein Quantification Kit | Abcam | ab102536 | Reagents |
| 2x Laemmli Sample Buffer | BioRad | #1610737 | Reagents |
| 2-Mercaptoethanol | BioRad | #1610710 | Reagents |
| Accublock Digital Dry Bath | Labnet International Inc. | D1100 | Equipment |
| 4–20% Mini-PROTEAN TGX Stain-Free Protein Gels, 10 well, 30 µL | BioRad | #4568093 | Reagents |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels, 4-gel | BioRad | #1658004 | Equipment |
| PowerPac HC High-Current Power Supply | BioRad | #1645052 | Equipment |
| Precision Plus Protein WesternC Blotting Standards | BioRad | #1610385 | Reagents |
| 10x Tris/Glycine/SDS Running Buffer | BioRad | #1610732 | Reagents |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BioRad | #1704156 | Reagents |
| Trans-Blot Turbo Transfer System | BioRad | #1704150 | Equipment |
| Blotting-Grade Blocker | BioRad | #1706404 | Reagents |
| Tween-20 | Sigma-Aldrich | 93773 | Reagents |
| Claudin-1 (D5H1D) XP Rabbit mAb | Cell Signalling Technology | #13255 | Reagents |
| Bovine Serum Albumine | Sigma-Aldrich | A7906 | Reagents |
| ZO-1 (D7D12) Rabbit mAb | Cell Signalling Technology | #8193 | Reagents |
| ZO-2 Antibody | Cell Signalling Technology | #2847 | Reagents |
| Afadin (D1Y3Z) Rabbit mAb | Cell Signalling Technology | #13531 | Reagents |
| Anti-Occludin Antibody | Millipore | ABT146 | Reagents |
| Anti-NF-kB p65 antibody [E379] | Abcam | ab32536 | Reagents |
| Anti-XIAP antibody | Abcam | ab21278 | Reagents |
| Amersham ECL Mouse IgG, HRP-linked whole Ab (from sheep) | GE Healthcare Life Sciences | NA931V | Reagents |
| Amersham ECL Rabbit IgG, HRP-linked whole Ab (from donkey) | GE Healthcare Life Sciences | NA934V | Reagents |
| Clarity Western ECL Substrate, 200 mL | BioRad | #1705060 | Reagents |
| Carestream Kodak autoradiography GBX developer/replenisher | Sigma-Aldrich | P7042 | Reagents |
| Carestream Kodak autoradiography GBX fixer/replenisher | Sigma-Aldrich | P7167 | Reagents |
| Carestream Kodak BioMax light film | Sigma-Aldrich | Z370401 | Reagents |
| Gel Doc EZ System | BioRad | #1708270 | Equipment |
Riferimenti
- Cunningham, D., et al. Colorectal cancer. Lancet. 375 (9719), 1030-1047 (2010).
- Mancuso, M., et al. Oncogenic bystander radiation effects in Patched heterozygous mouse cerebellum. PNAS. 105 (34), 12445-12450 (2008).
- Demaria, S., Formenti, S. C. Can abscopal effects of local radiotherapy be predicted by modeling T cell trafficking. J Immunother Cancer. 4 (1), 29 (2016).
- Trott, K. R., et al. Biological mechanisms of normal tissue damage: Importance for the design of NTCP models. Radiother Oncol. 105 (1), 79-85 (2012).
- Derer, A., Deloch, L., Rubner, Y., Fietkau, R., Frey, B., Gaipl, U. S. Radio-immunotherapy-induced immunogenic cancer cells as basis for induction of systemic anti-tumor immune responses - pre-clinical evidence and ongoing clinical applications. Front Immunol. 6, 505 (2015).
- Frey, B., Gaipl, U. S. Radio-immunotherapy: The focused beam expands. Lancet Oncol. 16 (7), 742-743 (2015).
- Prise, K. M., O'Sullivan, J. M. Radiation-induced bystander signalling in cancer therapy. Nat Rev Cancer. 9 (5), 351-360 (2009).
- Sambuy, Y., De Angelis, I., Ranaldi, G., Scarino, M. L., Stammati, A., Zucco, F. The Caco-2 cell line as a model of the intestinal barrier: Influence of cell and culture-related factors on Caco-2 cell functional characteristics. Cell Biol Toxicol. 21 (1), 1-26 (2005).
- Babini, G., et al. Mechanisms of the induction of apoptosis mediated by radiation-induced cytokine release. Radiat Prot Dosim. 166 (1-4), 165-169 (2015).
- Pellegrina, C. D., et al. Effects of wheat germ agglutinin on human gastrointestinal epithelium: Insights from an experimental model of immune/epithelial cell interaction. Toxicol Appl Pharm. 237 (2), 146-153 (2009).
- Pozo-Rubio, T., et al. Immunostimulatory effect of faecal Bifidobacterium species of breast-fed and formula-fed infants in a peripheral blood mononuclear cell/Caco-2 co-culture system. Brit J Nutr. 106 (8), 1216-1223 (2011).
- Parlesak, A., Haller, D., Brinz, S., Baeuerlein, A., Bode, C. Modulation of cytokine release by differentiated CACO-2 cells in a compartmentalized coculture model with mononuclear leucocytes and nonpathogenic bacteria. Scand J Immunol. 60 (5), 477-485 (2004).
- Haller, D. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assay. J Immunol Methods. 65 (1-2), 55-63 (1983).
- Morini, J., Babini, G., Barbieri, S., Baiocco, G., Ottolenghi, A. The Interplay between Radioresistant Caco-2 Cells and the Immune System Increases Epithelial Layer Permeability and Alters Signaling Protein Spectrum. Front Immunol. 8, 1-12 (2017).
- Dittmar, S., Harms, H., Runkler, N., Maisner, A., Kim, K. S., Schneider-Schaulies, J. Measles virus-induced block of transendothelial migration of T lymphocytes and infection-mediated virus spread across endothelial cell barriers. J Virol. 82 (22), 11273-11282 (2008).
- Srinivasan, B., Kolli, A. R., Esch, M. B., Abaci, H. E., Shuler, M. L., Hickman, J. J. TEER Measurement Techniques for In Vitro Barrier Model Systems. J Lab Autom. 20 (2), 107-126 (2015).
- Moyes, S. M., Killick, E. M., Morris, J. F., Kadhim, M. A., Hill, M. A., Carr, K. E. Changes produced by external radiation in parameters influencing intestinal permeability and microparticle uptake in vitro. Int J Radiat Biol. 84 (6), 467-486 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon