Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El análisis genético de Transthyretin Ala97Ser hereditario relacionadas con amiloidosis
En este artículo
Resumen
Aquí, presentamos un protocolo para confirmar la presencia de la mutación de punto para la diagnosis del amyloidosis de transthyretin hereditario, con Ala97Ser, la mutación más común endémica de Taiwán, por ejemplo.
Resumen
Las pruebas genéticas están la prueba más fiable para hereditaria por transtiretina relacionada con amiloidosis y debe realizarse en la mayoría de los casos del amyloidosis de transthyretin (ATTR). ATR es una enfermedad rara pero fatal con fenotipos heterogéneos; por lo tanto, la diagnosis se retrasa a veces. Con el aumento de atención y el reconocimiento más amplio de manifestaciones tempranas de atributos, así como tratamientos emergentes, estudios diagnóstico apropiados, incluyendo el genética del transthyretin (TTR) de prueba, para confirmar los tipos y variantes del ATR son por lo tanto fundamental para mejorar el pronóstico. Análisis genéticos con métodos de reacción en cadena (PCR) polimerasa confirman la presencia de mutaciones puntuales TTR mucho más rápido y más seguro que los métodos convencionales como la mancha blanca /negra meridional. Aquí, demostramos la confirmación genética de la mutación Ala97Ser ATTR, la mutación más común endémica de Taiwán. El protocolo consta de cuatro pasos principales: recogiendo muestras de sangre entera, la extracción de ADN, el análisis genético de los cuatro exones TTR con PCR y secuenciación de ADN.
Introducción
Amyloidosis de transthyretin (TTR) (ATTR) es la forma más común de amiloidosis sistémica hereditaria1y puede ser causado por una mutación autosómica dominante heredada en la del gene del transthyretin (TTR)2. Mutaciones de TTR desestabilizan la estructura de la proteína tetramérica y conducen a su disociación en monómeros que vuelve a montar en2de las fibrillas amiloideas. Más de 100 mutaciones de TTR amyloidogenic han sido reportados en todo el mundo1. Análisis genéticos con métodos de reacción en cadena (PCR) polimerasa confirman la presencia de la mutación de punto TTR y tienen ventajas como evitar la manipulación de sondas marcadas radiactivamente en comparación con la mancha blanca /negra meridional3. PCR es una técnica rápida, fácil, barata y confiable que se ha aplicado a diversos campos de las ciencias modernas4.
El diagnóstico precoz de esta enfermedad progresiva y fatal es difícil dada su heterogeneidad fenotípica. Con el aumento de atención y el reconocimiento más amplio de las manifestaciones tempranas de atributos así como los emergentes de los tratamientos5, estudios diagnóstico apropiados incluyendo pruebas genéticas TTR son críticamente fundamentales para mejorar el pronóstico. Además, diversas mutaciones se asocian con diferentes penetrancia del rasgo, edad de inicio, patrones de evolución, severidad de la enfermedad, mediana de la supervivencia, eficacia del trasplante del hígado, o TTR estabilizadores2,6, y grados variables de la implicación neurológica y cardiológica, que tienen grandes implicaciones para el asesoramiento genético7,8,9. Además, una prueba genética altamente exacta es la única herramienta que distingue los dos tipos de atributos: hereditario (mutante) y tipo salvaje (no-mutante forma, amyloidosis systemic senil, SSA)7. Es imprescindible confirmar los tipos de atributos, porque los tratamientos varían ampliamente2. Por lo tanto, hay una creciente necesidad para describir el protocolo paso a paso de la prueba genética de TTR.
La aproximación molecular para detectar la mutación será ilustrada con Ala97Ser, la mutación más común endémica de Taiwán, por ejemplo. Modificaciones en el paso de extracción de ADN reducen la cantidad de las tres soluciones que utiliza y produce una cantidad suficiente de ADN. En este protocolo, se analizaron los cuatro exones TTR, mientras incluyendo 5' contra la corriente, 3' abajo, promotores, intrones, regiones y regiones sin traducir (UTR) no fueron ordenadas.
Protocolo
Las pruebas realizadas en el laboratorio se llevó a cabo conforme a las prescripciones de los clínicos laboratorio mejora enmiendas (CLIA) de 1988, las normas aprobadas por el institucional de Junta de Chang Gung Memorial Hospital y Universidad (licencia no. 100 - 4470A3 y 104-2462A3). Se obtuvo consentimiento informado de todos los pacientes.
1. sangre recogida
- Recoja la sangre en tubos de tratados con EDTA disponibles comercialmente. Mezclar suavemente y almacenar la muestra de sangre a 4 ° C hasta el procesamiento.
2. ADN extracción de sangre periférica
Utilice un Kit de extracción de ADN para la extracción de ADN genómica (véase Tabla de materiales).
- Añadir 10 mL de solución 1 para la muestra de sangre de 4,0 mL. Incubar la muestra en hielo durante 10 minutos.
- Centrifugar la muestra a 2.000 x g durante 5 min a 4 ° C. Retire y descarte el sobrenadante cuidadosamente. Resuspender el precipitado en 3 mL de solución 1.
- Centrifugar la muestra a 2.000 x g durante 5 min a 4 ° C otra vez y descartar el sobrenadante. Resuspender el precipitado en 3 mL de solución 2.
- Añadir 10 μl de la solución madre de pronasa (225 mg/mL) para obtener una concentración final de 100 μg/mL y mezclar bien. Incubar a 37 ° C durante la noche.
- Enfriar el tubo en hielo durante 10 minutos agregar 0,8 mL de solución 3 a la muestra e invertir 3 - 5 veces. Coloque la muestra en hielo durante 5 minutos.
- Centrifugar la muestra a 3.000 x g durante 15 min a 4 ° C. Cuidadosamente transfiera el sobrenadante a un tubo de centrifugadores cónicos estériles de 15 mL.
- Añadir 6 μl de solución stock de Rnasa (10 mg/mL) para obtener una concentración final de 20 μg/mL. Incubar a 37 ° C durante 15 minutos.
- Añadir 2,5 mL de alcohol isopropílico y mezclar bien invirtiendo suavemente varias veces para precipitar DNA (se forman filamentos de material blanco, floculante). Utilizando una pipeta de gran diámetro, transferir el precipitado de ADN a un nuevo tubo de centrífuga de 1.5 mL.
- Centrifugar a 12.000 x g durante 3 min a 4 ° C. Descartar el sobrenadante cuidadosamente. Pellet de ADN lavar añadiendo 500 μl de etanol al 70%.
- Centrifugar a 12.000 x g durante 1 min y descartar el sobrenadante. Secar el pellet de ADN a temperatura ambiente. Añada 100 μl de ddH2O e incubar a 65 ° C por 15 min a Resuspender el ADN.
3. cuantificación de ADN genómica
Use un espectrofotómetro (véase Tabla de materiales) para detectar la cantidad y calidad de la DNA genomic.
- Inicie sesión en el ordenador conectado a la máquina de espectrofotómetro. Abrir el software.
- Inicializar la máquina del espectrofotómetro:
- Haga clic en "Ácidos nucleicos" en el software de espectrofotómetro.
- Limpie el pedestal con una toallita de papel desechable y agua purificada.
- En blanco el espectrofotómetro:
- 2 μl de agua purificada en el pedestal de la carga.
- Baje el brazo superior del espectrofotómetro y haga clic en "En blanco" para calibrarlo.
- Cuando esté hecho, levante el brazo y seque el pedestal con una toallita.
- Medida de la muestra:
- Haga clic en "ADN-50" en el tipo de muestra.
- 2 μl de muestra de ADN en el pedestal de la carga.
- Baje el brazo y haga clic en "Medida" para medir el cociente A260/A280 y la concentración de la muestra.
- Limpie el pedestal entre cada serie con un trapo y agua purificada.
- Haga clic en "Imprimir pantalla" para recoger los datos.
4. genéticos análisis de mutaciones
Amplificar el ADN diana con el PCR4. Realizar PCR en una reacción de 25 μl mezcla utilizando una polimerasa de la DNA kit (véase Tabla de materiales). La tabla 1 muestra el gen TTR intronic cartillas.
| gene | Secuencia de primer |
| Exon1 | F: 5'-TCAGATTGGCAGGGATAAGC-3' R: 5'-GCAAAGCTGGAAGGAGTCAC-3' |
| Exon2 | F: 5'-TCTTGTTTCGCTCCAGATTTC-3' R: 5'-TCTACCAAGTGAGGGGCAAA-3' |
| Exon3 | F: 5'-GTGTTAGTTGGTGGGGGTGT-3' R: 5'-TGAGTAAAACTGTGCATTTCCTG-3' |
| Exon4 | F: 5'-GACTTCCGGTGGTCAGTCAT-3' R: 5'-GCGTTCTGCCCAGATACTTT-3' |
Tabla 1. Cebadores intronic del gene de TTR. (Secuencia NCBI referencia: NC_000018.10)
- Añadir los reactivos en la tabla 2 a un tubo PCR de 0.2 mL.
| Componentes | Volumen (μL) | Concentración final |
| 10 x Buffer | 2.5 | 1 x |
| MgCl2 (25 mM) | 1.5 | 1,5 mM |
| Potenciador de GC 360 | 1 | - |
| Polimerasa de la DNA 360 | 0.2 | 2 reacción U |
| dNTP Mix (25 mM) | 2 | 2 mM |
| Primer F (10 μm) | 1 | 0.4 ΜM |
| Primer R (10 μm) | 1 | 0.4 ΜM |
| ADN (100 ng) | 2 | |
| Agua grado PCR | 13.8 | - |
| Volumen total | 25 | - |
Tabla 2. Condiciones de reacción de PCR.
- Mezclar suavemente y centrifugar brevemente en una centrífuga de mesa para recoger todos los componentes en la parte inferior del tubo. Coloque el tubo en un termociclador.
- Realizar PCR para 30 ciclos. Cada ciclo consiste en un paso de desnaturalización durante 30 s a 94 ° C, primer recocido durante 30 s a 58 ° C y la extensión de la polimerasa para 45 s a 72 ° C (ver tabla 3).
| Paso | Temperatura (° C) | Tiempo | ciclo |
| Desnaturalización inicial | 95 | 5 min | 1 |
| Paso de la desnaturalización de ADN | 94 | 30 s | 30 ciclos |
| Paso de recocido de la cartilla | 58 | 30 s | 30 ciclos |
| Paso de extensión de polimerasa | 72 | 45 s | 30 ciclos |
| Paso de elongación post | 72 | 10 min | 1 |
| Final de la polimerización en cadena bicicleta | 4 | Indefinida |
Tabla 3. Condiciones para la amplificación de productos de la PCR en bicicleta.
- Validar el producto PCR visualizando con electroforesis en gel:
- Preparar un gel de agarosa al 1.2%:
- 1.2 g de agarosa en polvo se mezclan con 100 mL de 0.5 x TBE en una mufla para microondas. Microondas durante 2 minutos hasta que la agarosa se disuelva completamente. Enfríe la mezcla de agarosa a 55 ° C.
- Añadir 2 μl de una solución de bromuro de etidio (10 mg/mL) a la mezcla de agarosa y mezclar suavemente. Vierta la mezcla de agarosa en una bandeja de gel a 5-7 mm, luego añadir la comb(s) en lugar. Deje que se solidifique (por lo menos 30 minutos) y retire con cuidado la comb(s).
- Las muestras de la carga y ejecuta un gel de agarosa:
- Coloque el gel y bandeja en la célula de electroforesis. Llenar la célula de electroforesis con 0.5 x TBE hasta cubre el gel.
- Cuidadosamente la carga 2 μl de 100 bp ADN ladder (véase Tabla de materiales) en el otro carril del gel como marcador de tamaño molecular. Mezcla de tinte/muestra de carga (5 μl de mezcla de productos PCR con 1 μl 6 x tinte de carga) en los carriles adicionales.
- Encienda la fuente de alimentación. Correr el gel durante 25 minutos a 100 V.
- Retirar el gel de la célula de electroforesis. Visualizar los fragmentos de ADN bajo luz de un sistema de proyección de imagen UV.
- Preparar un gel de agarosa al 1.2%:
5. secuencia de ADN
- Purificar productos PCR utilizando un kit comercial y secuencia comercialmente o con un secuenciador automático (véase Tabla de materiales).
- Enviar secuencias de nucleótidos en el servidor de NCBI BLAST para comparar la consulta nucleótidos los nucleótidos bases de datos10. Después de que los resultados se muestran, realizar alineaciones de la secuencia e identificar la mutación esperada.
Resultados
Electroforesis en agarosa de dos pacientes y bandas reveló individuales saludables uno de los tamaños previstos, incluyendo un producto PCR bp 454 para el exón 4 del gene de TTR (figura 1).
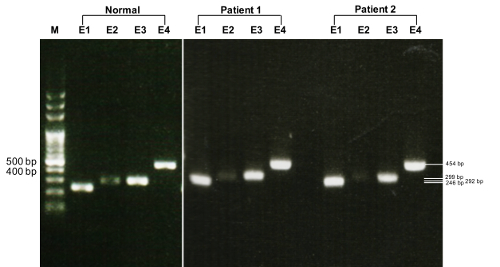
Figura 1 . Electroforesis en gel con PCR amplificaron el gen TTR. Normal: un i...
Discusión
Hay dos pasos críticos en el protocolo. En primer lugar, para tener el suficiente número de glóbulos blancos, un espécimen de hemodiluted debe ser evitada11. En segundo lugar, el uso de adecuados primers PCR es fundamental para obtener resultados fiables12. Utilizamos la herramienta de la web de cartilla-BLAST para diseñar los primers4,13; debe cubrir un mínimo de 40 pares de bases en cada lado de los cuatro e...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Deseamos agradecer a Miss Shin-Fun Wu por su ayuda en los experimentos. Este estudio fue apoyado por una beca del programa de investigación médica Chang Gung (CMRPG3C0371, CMRPG3C0372, CMRPG3C0373) y 100-4470A3 de la IRB, 104-2462A3, Taiwán.
Materiales
| Name | Company | Catalog Number | Comments |
| EDTA-treated tubes | BD | ||
| DNA Extraction Kit | Stratagen | 200600 | |
| NanoDrop ND2000 spectrophotometer | Thermo Fisher Scientific | NanoDrop 2000 | |
| Delicate Task Wipers | Kimberly-Clark | Kimtech Science Kimwipes | |
| AmpliTaq Gold 360 DNA Polymerase kit | Applied Biosystems | 4398823 | |
| TTR gene intronic primers | Exon1 | F: 5’-TCAGATTGGCAGGGATAAGC-3’ | |
| Exon1 | R: 5’-GCAAAGCTGGAAGGAGTCAC-3’ | ||
| Exon2 | F: 5’-TCTTGTTTCGCTCCAGATTTC-3’ | ||
| Exon2 | R: 5’-TCTACCAAGTGAGGGGCAAA-3’ | ||
| Exon3 | F: 5’-GTGTTAGTTGGTGGGGGTGT-3’ | ||
| Exon3 | R: 5’-TGAGTAAAACTGTGCATTTCCTG-3’ | ||
| Exon4 | F: 5’-GACTTCCGGTGGTCAGTCAT-3’ | ||
| Exon4 | R: 5’-GCGTTCTGCCCAGATACTTT-3’ | ||
| thermocycler | Applied Biosystems | GeneAmp PCR System 9700 | |
| electrophoresis cell | ADVANCE | Mupid-2plus | |
| DNA ladder | Protech | PT-M1-100 | |
| dye | BioLabs | B7021 | |
| AlphaImager EC | Alpha Innotech | AlphaImager EC | |
| automatic sequencer | Applied Biosystems | 3730xl DNA Analyzer |
Referencias
- Planté-Bordeneuve, V., Said, G. Familial amyloid polyneuropathy. The Lancet Neurology. 10 (12), 1086-1097 (2011).
- Planté-Bordeneuve, V., et al. Long-term treatment of transthyretin familial amyloid polyneuropathy with tafamidis: a clinical and neurophysiological study. Journal of Neurology. 264 (2), 268-276 (2017).
- Nichols, W. C., Benson, M. D. Hereditary amyloidosis: detection of variant prealbumin genes by restriction enzyme analysis of amplified genomic DNA sequences. Clinical Genetics. 37 (1), 44-53 (1990).
- Lorenz, T. C. Polymerase Chain Reaction: Basic Protocol Plus Troubleshooting and Optimization Strategies. Journal of Visualized Experiments. (63), e3998 (2012).
- Hsu, H. C., et al. Phenotypic expressions of hereditary Transthyretin Ala97Ser related Amyloidosis (ATTR) in Taiwanese. BMC Neurology. 17 (1), 178 (2017).
- Barroso, F. A., et al. Long-term safety and efficacy of tafamidis for the treatment of hereditary transthyretin amyloid polyneuropathy: results up to 6 years. Amyloid. 24 (3), 194-204 (2017).
- Rapezzi, C., et al. Disease profile and differential diagnosis of hereditary transthyretin-related amyloidosis with exclusively cardiac phenotype: an Italian perspective. European Heart Journal. 34 (7), 520-528 (2013).
- Mariani, L. L., et al. Genotype-phenotype correlation and course of transthyretin familial amyloid polyneuropathies in France. Annals of Neurology. 78 (6), 901-916 (2015).
- Hammarström, P., Jiang, X., Hurshman, A. R., Powers, E. T., Kelly, J. W. Sequence-dependent denaturation energetics: A major determinant in amyloid disease diversity. Proceedings of the National Academy of Sciences of the United States of America. 99, 16427-16432 (2002).
- Johnson, M., Zaretskaya, I., Raytselis, Y., Merezhuk, Y., McGinnis, S., Madden, T. L. NCBI BLAST: a better web interface. Nucleic Acids Research. 36, 5-9 (2008).
- Fox, A. J., et al. Next generation sequencing for the detection of actionable mutations in solid and liquid tumors. Journal of Visualized Experiments. (115), (2016).
- Date, Y., Nakazato, M., Kangawa, K., Shirieda, K., Fujimoto, T., Matsukura, S. Detection of three transthyretin gene mutations in familial amyloidotic polyneuropathy by analysis of DNA extracted from formalin-fixed and paraffin-embedded tissues. Journal of the Neurological Sciences. 150 (2), 143-148 (1997).
- Ye, J., Coulouris, G., Zaretskaya, I., Cutcutache, I., Rozen, S., Madden, T. L. Primer-BLAST: a tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics. 13, 134 (2012).
- Green, M. R., Sambrook, J. . Molecular cloning: A laboratory manual. , (2012).
- Buckingham, L., Flaws, M. L. . Molecular diagnostics: Fundamentals, methods, and clinical applications. , (2012).
- Tan, S. C., Yiap, B. C. DNA, RNA, and Protein Extraction: The Past and The Present. Journal of Biomedicine and Biotechnology. 2009, (2009).
- Rapezzi, C., et al. Systemic cardiac amyloidoses: disease profiles and clinical courses of the 3 main types. Circulation. 120 (13), 1203-1212 (2009).
- Gertz, M. A., Dispenzieri, A., Sher, T. Pathophysiology and treatment of cardiac amyloidosis. Nature Reviews Cardiology. 12 (2), 91-102 (2015).
- Vrana, J. A., et al. Clinical diagnosis and typing of systemic amyloidosis in subcutaneous fat aspirates by mass spectrometry-based proteomics. Haematologica. 99 (7), 1239-1247 (2014).
- Nakamura, M., et al. Identification of a new transthyretin variant (Ile49) in familial amyloidotic polyneuropathy using electrospray ionization mass spectrometry and nonisotopic RNase cleavage assay. Human Heredity. 49 (4), 186-189 (1999).
- Ueda, M., Ando, Y. Recent advances in transthyretin amyloidosis therapy. Translational Neurodegeneration. 3, 19 (2014).
- Brown, E. E., et al. Genetic testing improves identification of transthyretin amyloid (ATTR) subtype in cardiac amyloidosis. Amyloid. 24 (2), 92-95 (2017).
- Tasaki, M., et al. Rapid detection of wild-type and mutated transthyretins. Annals of Clinical Biochemistry. 53 (4), 508-510 (2015).
- Plante-Bordeneuve, V., et al. Diagnostic pitfalls in sporadic transthyretin familial amyloid polyneuropathy (TTR-FAP). Neurology. 69 (7), 693-698 (2007).
- Hsu, J. L., et al. A prospective, observational study of patients with uncommon distal symmetric painful small-fiber neuropathy. PLoS ONE. 12 (9), 0183948 (2017).
- Salvi, F., Pastorelli, F., Plasmati, R., Bartolomei, I., Dall'Osso, D., Rapezzi, C. Genotypic and phenotypic correlation in an Italian population of hereditary amyloidosis TTR-related (HA-TTR): Clinical and neurophysiological aids to diagnosis and some reflections on misdiagnosis. Amyloid. 19, 58-60 (2012).
- Suhr, O. B., Lundgren, E., Westermark, P. One mutation, two distinct disease variants: Unravelling the impact of transthyretin amyloid fibril composition. Journal of Internal Medicine. 281 (4), 337-347 (2017).
- Vilà-Rico, M., et al. Quantitative analysis of post-translational modifications in human serum transthyretin associated with familial amyloidotic polyneuropathy by targeted LC-MS and intact protein MS. Journal of Proteomics. 127, 234-246 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados