Method Article
Administración exógena de alfa-sinucleína asociada a microsomas agregados a las neuronas primarias como un modelo de celular de gran alcance de la formación de las fibrillas de
En este artículo
Resumen
El objetivo de este protocolo es proporcionar un sistema celular que imita la formación de alfa-sinucleína agregados en vivo. Inclusiones intracelulares de alfa-sinucleína se siembran en las neuronas primarias por la internalización y propagación de exógenos administrados agregados de alfa-sinucleína microsomas asociados nativos aislados de ratones transgénicos de alfa-sinucleína enfermo.
Resumen
Durante años, la incapacidad de replicar la formación de inclusiones insolubles alfa-sinucleína (αS) en cultivos celulares ha sido una gran limitación en el estudio de la agregación de αS en enfermedad de Parkinson (EP). Recientemente, el desarrollo de nuevos modelos animales mediante la inoculación exógena de extractos de cerebro de ratones transgénicos αS enfermos o pacientes con EP ha dado nuevas esperanzas a la posibilidad de crear modelos de celulares más adecuados de agregación αS. Desafortunadamente, cuando se trata de células en cultivos, administración de extractos de cerebro bruto no ha demostrado éxito en ratones y la fuente de elección de agregados exógenos sigue siendo en vitro preformado fibrillas αS.
Hemos desarrollado un método para inducir la formación de inclusiones de αS intracelular en las neuronas primarias mediante la administración exógena de αS microsomas asociados nativos agregados, una especie αS altamente tóxico aislada de las áreas enfermas de los ratones transgénicos. Esta fracción de agregados αS asociado a las vesículas de los microsomas, eficientemente es internalizado e induce la formación de inclusiones intracelulares positivas para agregados y fosforilada αS. En comparación con el vitro-fibrillas preformadas de αS recombinante, nuestro método es más rápido y garantiza que la patógena de la siembra se hace con agregados αS auténtico extraído de modelos animales enfermos de EP, mímico más estrechamente el tipo de las inclusiones obtienen in vivo. Como resultado, la disponibilidad de tejidos ricos en inclusiones de αS es obligatoria.
Creemos que este método proporcionará un modelo celular para estudiar los aspectos microscópicos de la agregación de αS y Fisiopatología celulares relacionados con en vivo y será un punto de partida para la creación de más preciso y sofisticado celular paradigma de la EP.
Introducción
Acumulación de alfa-sinucleína (αS) inclusiones proteínico es una característica prominente e importante de enfermedad de Parkinson enfermedad (PD) y alfa-synulceinopathies1. Desafortunadamente, mientras que los modelos animales son capaces de proporcionar un ambiente celular y bioquímico suficiente para inducir los pasos de agregación necesarios para la formación de las fibrillas de proteína2, replicar la formación del cuerpo de Lewy complejo (LB)-como agregados en cultivos de células es difícil y desafiante.
Aquí se describe un método para inducir la formación de inclusiones de αS, similares a agregados de proteína obtenidos en modelos animales y pacientes con EP, en células cultivadas, utilizando neuronas primarias de ratón cerebro aislado. Nuestro protocolo se basa en la administración exógena de agregados αS asociados en microsomas aislados de αS sintomáticos () los ratones transgénicos Tg neuronas primarias del hipocampo o cortical del ratón. Este método aprovecha la capacidad de difusión y propagación de especies tóxicas de αS que, una vez añadido al medio de cultivo, son capaces de ser internalizado e inducir la formación de agregados de αS-positivos maduro3,4, 5,6,7,8.
Originalmente, los métodos estándar para obtener la formación de fibrillas αS en cultivos celulares se basaron en la sobreexpresión de la cDNA αS correspondiente a través de los protocolos de la transfección regular o infección viral mediada por9. Mientras que en el primer caso obtención de αS LB-como agregados fueron fortuitos, mostraron baja eficiencia y dependía del tipo de célula, el segundo protocolo llevó a la formación de las fibrillas insolubles, incluyendo especies de alto peso molecular (HMW) en 24-48 h de la infección 10. en estos métodos, la formación de agregados era probablemente debido a un excesivo y desequilibrado en cantidad de proteína αS que se convierte en insoluble en lugar de una conversión patológica de la conformación de αS que dicta la agregación. En cambio, la técnica que presentamos aquí no altera el nivel de expresión de αS pero induce la agregación de proteína generalizada debido a la internalización de las fibrillas exógenas. Por otra parte, la formación de agregados αS mediante la administración de las fibrillas exógenas es un proceso largo que requiere días o semanas para ser exhaustivo que nos permite estudiar las etapas tempranas e intermedias de la formación de inclusiones de αS en un modo time-lapse y correlacionar con los cambios bioquímicos celulares. Así, nuestro método es una valiosa aplicación para crear modelos celulares de la agregación de αS que son útiles para el estudio de formación de fibrilas αS microscópico en relación con la fisiopatología celular.
Además aunque administración de cerebro bruto extrae de αS enfermo de ratones transgénicos (Tg)11,12 o humanos PD cerebros6,13 es capaz de inducir la deposición αS en Tg o wild-type (WT) animales, aplicación del mismo procedimiento a los cultivos celulares no ha demostrado para ser tan exitosos, posiblemente debido a la baja cantidad de agregados en las muestras utilizadas y la falta de un procedimiento estándar para aislar αS nativas especies tóxicas14. Debido a esto, en vitro preformado fibrillas (PFFs) de αS han sido la fuente de agregados de elección hasta ahora para la inducción de inclusiones de αS en células y modelos de animales3,4,6,7 ,15,16. Con nuestro protocolo, sin embargo, nos muestran que especies agregados αS asociados en microsomas aisladas de ratones Tg αS eficientemente pueden inducir la acumulación de inclusiones intracelulares de αS LB-como en las neuronas primarias.
En nuestro laboratorio, especies agregadas αS microsomas asociados son aisladas del tejido (SpC) de la médula espinal de los ratones enfermos de Tg expresando el gen humano de αS A53T bajo el control del ratón del prión (PrP) de la proteína promotor [Prp humana A53T αS Tg ratones, línea G2-3 de17]. Estos show de ratones un fenotipo neurodegenerativas dependientes de la edad que incluye disfunción del motor robusta y formación de inclusiones en el sistema nervioso central compuesto fosforilado, ubiquitinated y αS insoluble, a partir después de 9 meses de edad. Una vez que aparece la disfunción del motor, el fenotipo rápidamente evoluciona a parálisis, a partir de extremidades posteriores, que conduce a la muerte en 2 a 3 semanas. Acumulación de agregados αS es paralelo a manifestación de la enfermedad. Ratones sacrificados en el inicio de la disfunción del motor muestran un fuerte grado de agregación de αS en SpC, vástago de cerebro y cerebelo. No hay que esperar hasta parálisis establece a sacrificar el ratón. Ratones pre-sintomáticos toman en 9 meses de edad los animales que no muestran disfunción del motor.
Protocolo
El uso de animales WT y Tg fue aprobado y cumplido en todo por el nacional y las leyes internacionales de bienestar animal de laboratorio y experimentación (CEE Consejo Directiva 86/609, 12 de diciembre de 1987 y Directiva 2010/63/EU, 22 de septiembre de 2010). Todos los protocolos descritos en este documento siguen las pautas de cuidado de los animales de nuestra institución.
1. aislamiento de microsomas asociados αS agregados de los ratones enfermos A53T αS Tg
- Preparar el buffer de homogeneización que se compone de sacarosa 250 mM, 20 mM HEPES 10 mM KCl, 1.5 mM MgCl2, 2 mM EDTA y 1 x fosfatasa /-inhibidores de la proteasa. Guardar el buffer en el hielo.
- Homogeneizar el fresco o congelado tejido en un 1:10 volumen (w/v) de buffer de homogenización helada con un teflón Maja homogenizador, con 10-15 movimientos.
- Transferencia inicial homogeneizado (1-2 mL) a un tubo de microcentrífuga y centrifugar a 1.000 x g durante 10 min a 4 ° C utilizando una centrífuga refrigerada para quitar los núcleos y células intactas en el precipitado resultante (P1). Deseche el P1.
- Transferir el sobrenadante (S1) a un tubo de microcentrífuga limpio y S1 de centrifugar a 10.000 x g por 20 min a 4 ° C utilizando una centrífuga refrigerada para obtener el segundo sobrenadante (S10) y el pellet (P10).
Nota: P10 es un diábolo de membrana cruda que contiene mitocondrias y los sinaptosomas. Deseche el P10. - Transferir el sobrenadante (S10) a una botella de policarbonato (> 1 mL) y centrifugar S10 a 100.000 x g, durante 1 h a 4 ° C utilizando una ultracentrífuga y un rotor de ángulo fijo (90 Ti).
Nota: El sobrenadante es la fracción citosol puro mientras el diábolo, P100, contiene agregados αS microsomas asociados. - Resuspender el precipitado de la P100 con 500 μl del buffer de homogeneización. Transferencia P100 a un tubo de microcentrífuga limpio y centrifugar a 10.000 x g por 20 min a 4 ° C en una centrífuga refrigerada.
- Desechar el sobrenadante y resuspender P100 con 100 μl de buffer de homogenización.
Nota: Esta fracción está los agregados αS microsomas asociados. - Someter a ultrasonidos muestras de 2 s en el hielo [1 vatios (RMS) de potencia de salida set]. Almacenar las muestras a-80 ° C.
- Al día siguiente, determinar la cantidad de proteína mediante el análisis de la BCA.
2. Western Blot
Nota: Caracterización bioquímica de los agregados de los microsomas asociados αS es evaluado por Western Blot.
- Fundición de un gel de poliacrilamida de Tris glicina gradiente 4-20% en un aparato de electroforesis vertical.
- 1 μg de fracciones αS microsomas asociados, disuelto en el tampón de muestra de la desnaturalización de la carga.
- En un pozo diferente, carga 5 μl del marcador estándar de proteína.
- Correr el gel a 100 V en un Tris/glicina/SDS ejecuta buffer hasta que el marcador de la proteína llega al final del gel.
- Transferencia de proteínas a una membrana de nitrocelulosa con un tampón de carbonato básico (10 m m NaCO3, 3 mM NaHCO3, 20% metanol) O/N a 4 ° C, 200 mA, constante.
- Bloquear la membrana con PBS-no iónico surfactant 0,05% (PBS-T) con 5% leche en polvo descremada en un agitador orbital durante 30 min a TA.
- Enjuague la membrana con PBS-T.
- Incubar la membrana con Syn-1 (1:5, 000) o pSer129-αS anticuerpo (1:5, 000) en 2.5% leche desnatada en PBS-T, O/N a 4 ° C en un agitador orbital.
- Lavar la membrana por 10 min a temperatura ambiente con PBS-T en un agitador orbital.
- Incubar la membrana con el ratón o conejo anti anticuerpo conjugado con HRP secundaria (1:3, 000) en 2.5% sin grasa leche en polvo en PBS-T por 1 h a TA.
- Lavar la membrana por 10 min a temperatura ambiente con PBS-T en un agitador orbital. Repetir x 3.
- Obtener la señal a través de los juegos regulares de la quimioluminescencia.
3. principales culturas neuronales
Nota: Se prepararon cultivos primarios neuronales del hipocampo de ratón de (P0) recién WT o corteza (línea C57BL/6). Todo el procedimiento, menos los pasos de centrifugación, se realiza bajo una campana de cultivo de células, en condiciones estériles.
- Tratar el cubreobjetos (18 mm Ø) con solución de ácido nítrico 65% para menos de 12 h a TA.
- Eliminar el ácido nítrico. Cubre-objetos de enjuague dos veces con PBS 10 x y varias veces con agua destilación.
- Inserte el cubreobjetos de 24 pocillos platos y cubrir con poly-D-lisina (0,1 mg/mL en agua destilada estéril o PBS 1 x) por 1 h a 37 ° C.
- Poly-D-lisina Lave y el cubre-objetos tres veces con agua destilada. Almacenarlas a 4 º C hasta que se necesite.
- Eutanasia a las crías de ratón por decapitación y separe las cabezas de los cuerpos. Colocar las cabezas en los platos y disecar suavemente la piel.
- Mediante el uso de tijeras finas, abrir el cráneo haciendo una incisión en las bases de los cerebros. Separar las dos mitades de los cráneos y quitarlos con cuidado.
- Mediante el uso de pinzas, pellizcar apagado los cerebros de las bases y aislar la corteza y el hipocampo. Transferirlas en dos platos separados que contengan medio de solución sal balanceada (HBSS) de Hank que contiene 1% de penicilina/estreptomicina.
- Repita los pasos 3.6 y 3.7 de cada animal. Tenga en cuenta que el proceso no debe tomar más de 30-45 min.
- Picar los tejidos recogidos y transferirlas en dos tubos cónicos de 50 mL (uno para hipocampo) y otro de corteza con 10 mL de medio HBSS con tripsina 0.1%. Incubar en el baño de agua durante 7 minutos a 37 ° C.
Nota: Agitación no se requiere. - Añadir 1 mL de DMEM con 10% suero bovino fetal (FBS) y DNasa de 10 μg/mL para el homogeneizado para bloquear la actividad de la tripsina.
- El tejido resultante disociado a 200 x g durante 5 min a temperatura ambiente en una centrifugadora de centrífuga y eliminar el sobrenadante.
Nota: El sedimento representa las células disectadas de los tejidos. - Resuspender las células en el medio de la galjanoplastia, que contiene 2% B27, glutamina 2 mM, glucosa de 6 mg/mL, 10% FBS, 12,5 μm glutamato y gentamicina 10 μg/mL.
- Placa disociado las neuronas sobre cubreobjetos de poly-D-lisina en placas de 24 pozos según la proporción: 1 corteza/12 pozos y pozos de hipocampo 1/6, dando por resultado aproximadamente 150.000/200.000 células por pocillo. Mantener las células en la incubadora a 37 ° C.
- Al día siguiente (día en vitro, DIV 1), sustituir el medio de placas con el medio que contiene 2% B27, 10 μg/mL gentamicina y glutamina 2 mM.
- En DIV 2, retirar 1/3 medio y añadir 1/3 del medio fresco que contiene 2,5 μm arabinósido de la citosina por 48 h para reducir la contaminación glial.
- Mantener las neuronas a 37 ° C y vuelva a colocar la mitad del medio cada tres días.
4. neuronas tratamiento
Nota: El tratamiento se ha realizado en 7 DIV. Todos los pasos llevan bajo una campana de cultivo celular en condiciones estériles. Un ejemplo de la densidad de cultivo neuronal cortical en DIV 7 se ilustra en la figura 1.
- Agregados αS asociada a microsomas obtenidos de la médula espinal de ratones Tg de enfermos diferentes tres para tener una 1 μg/μl solución, usando el buffer de homogeneización original para la dilución de la piscina.
- Quite 1/3 del medio y sustituirla por suavemente el medio fresco que contiene 2% B27, 1 x gentamicina y 2 mM de glutamina.
- Añadir 1 μg de agregados combinados αS microsomas asociados al medio de la célula. Volver las neuronas en la incubadora a 37 ° C.
- Cada 3 días durante 1 semana, añadir 1/3 de medio fresco. No reemplace el medio. Sólo agregar.
- Después de 1 semana de tratamiento, eliminar 1/3 del medio y sustituirla por suavemente el medio fresco que contiene 2% B27, 10 μg/mL gentamicina y glutamina 2 mM. Repetir cada 3 días.
- Fijar las neuronas después de 2 semanas de tratamiento (DIV 21).
5. inmunofluorescencia
- Fijar las neuronas con paraformaldehído al 2% en PBS 1 x y solución sacarosa al 5% durante 15 min a temperatura ambiente sin agitar, debajo de un químico del humo campana.
- Eliminar la solución de fijación. Brevemente, lavado con PBS 1 x, 3 veces.
Nota: Realice todos los pasos de lavar suavemente porque las neuronas primarias no se pegan firmemente a poli-lisina cubreobjetos. - Permeabilizar las neuronas con 0.3% de surfactante no iónico en PBS 1 x durante 5 min a TA.
- Brevemente, lavado con PBS 1 x, 3 veces.
- Incubar las neuronas con el 3% FBS en PBS 1 x durante 30 min a temperatura ambiente, para bloquear sitios de Unión inespecíficos, en un agitador orbital.
- Incubar las neuronas con anticuerpo primario correspondiente disuelto en 3% FBS en PBS 1 x, O/N a 4 ° C en un agitador orbital.
Nota: syn303 (1:1, 000), ratón αS (1: 200), pser129-αS (1:1, 000) y Tau (1:10, 000) se utilizaron anticuerpos. - Retire la solución de anticuerpo y lavado, brevemente, con PBS 1 x, 3 veces.
- Neuronas de incubar con el anticuerpo secundario fluorescente adecuado disuelto en 3% FBS en PBS, durante 1 h a temperatura ambiente en la oscuridad en un agitador orbital.
- Retire la solución de anticuerpo y lavado, brevemente, con PBS 1 x, 3 veces.
- Mancha las neuronas con la solución de DAPI (0,1 μg/mL en PBS 1 x) por 15 min a temperatura ambiente en la oscuridad en un agitador orbital.
- Retire la solución de anticuerpo y lavado, brevemente, con PBS 1 x, 3 veces.
- Monte el cubreobjetos sobre un portaobjetos con medio de montaje antifade.
Resultados
Siguiendo el protocolo descrito y resumido en la figura 2hemos purificado, agregados αS microsomas asociados de tres enfermos A53T αS los ratones Tg (figura 3). Los microsomas son fracciones de pellets de crudo de la membrana que contienen el retículo endoplasmático, Golgi y vesículas sinápticas pequeñas. El grado de pureza del precipitado microsomal comparado con otras fracciones se evaluó previamente usando marcadores de organelas específicas18.
Una vez aislado, caracterización bioquímica de los agregados αS es evaluado a través de desnaturalización SDS-Page, seguido por la incubación con Syn-1 o αS fosforilada en serina 129 (pSer129-αS) anticuerpo. En comparación con ratones de edad comparable no-Tg (nTg), microsomas aislados de ratones enfermos co precipitado con agregados αS y presintomáticos (PreS). Especies αS microsomas asociados presentan las características típicas de los agregados αS, como acumulación de especies resistentes a los detergentes HMW, fosforilación en la serina 12919 y C- y N-terminal truncado fragmentos (para una caracterización completa de agregados de microsomas asociados αS ver referencia18,20,21). Estos son requisitos fundamentales desde αS monomérica no tener internalizado eficientemente y no induce la deposición de αS7,15,22. Es importante no utilizar cualquier detergente (iónico o no iónico) para suspender de nuevo P100 pellets ya que pueden ser perjudicial para las células. También, para evitar la variabilidad de la muestra, agregados αS microsomas asociados de tres ratones enfermos diferentes se agruparon para tratamiento neuronal.
Administración de 1 μg de agregados combinados αS microsomas asociados de ratones A53T enfermos al medio de cultivo de neuronas de hipocampales o corticales induce una formación dependiente del tiempo de las inclusiones de αS, positivas para los anticuerpos αS agregados específicos tales como Syn303 (figura 4, 5) o pser129-αS (figura 5). Después de dos días (2d) de tratamiento estos agregados aparecen como puncta pequeña y dispersa que será más abundante en más puntos del tiempo. Después de dos semanas, αS inclusiones se asemejan mucho y madurar granos-como las estructuras, muy extendido a lo largo de las culturas neuronales, siguiendo un patrón de neurita y parcialmente co localización con presinápticos y neuritas marcadores (figura 5). Ocasionalmente, se observan inclusiones αS recién formado Co localizar y mancha el soma de la célula o cubrir todo el proceso, parecido a neuritas necrótico.
Aunque fracciones de agregados de microsomas asociados αS pueden propagarse eficientemente en cultivos neuronales, su importe se tiene que estar finamente sintonizados en el número de neuronas plateado (figura 1). De hecho, superior a la proporción recomendada, μg de microsomas asociados agregados: número de neuronas, inducen muerte celular prematura en pocos días (figura 6), mientras que una cantidad insuficiente de agregados αS microsomas asociados dará lugar a una escaso y reducido el número de inclusiones después de dos semanas de tratamiento, similar a lo que se obtuvo en los anteriores puntos de tiempo (figura 4A).
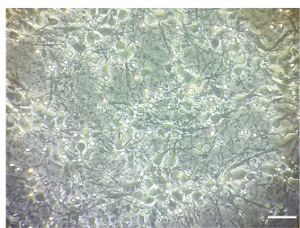
Figura 1 . Culturas neuronales corticales. Imagen representativa mostrando densidad 7 DIV de culturas neuronales corticales. Imágenes fueron tomadas con un microscopio de luz invertido, objetivo X 10. Barra de escala = 100 μm. haga clic aquí para ver una versión más grande de esta figura.
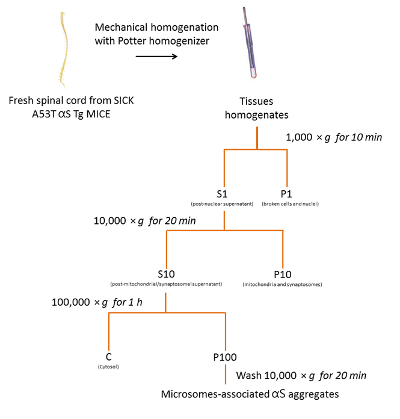
Figura 2 . Aislamiento de los microsomas asociados αS agregados de ratón SpC. Diagrama de flujo del Protocolo de purificación de los microsomas asociados αS agregados de SpC de ratones enfermos. Haga clic aquí para ver una versión más grande de esta figura.
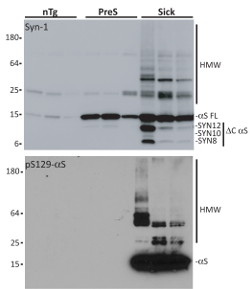
Figura 3 . Aislamiento de fracciones de microsomas de enfermos, presintomáticos A53T αS Tg nTg ratones y. Muestra de análisis de Western blot purificada agregados αS asociados en microsomas aislados de tres enfermos (enfermos), presintomáticos (PreS) y ratones de nTg pareados por edad. Ratones enfermos son ratones de Tg αS A53T que muestran la disfunción motora y neurológica, incluyendo la acumulación de inclusiones de αS, mientras que animales presintomáticos A53T saludable αS Tgs de 9 meses de edad que no muestran, sin embargo cualquier patología αS relacionados con el fenotipo. nTg ratones son hermanos de camada de ratones enfermos que no llevan el transgén αS y por lo tanto no desarrollan αS inducida por patología. 1 μg de cada fracciones purificadas se ejecuta en una desnaturalización SDS-, transferido a una membrana de nitrocelulosa y borrado con anticuerpo Syn-1 o pSer129-αS. Sólo fracciones de microsomas aislaron de ratones enfermos contenidos agregados αS resistente al detergente HMW fosforilados en serina 129 y mostró C- y truncamiento N-terminal. Esta figura ha sido adaptada de Colla et al. 18. haga clic aquí para ver una versión más grande de esta figura.
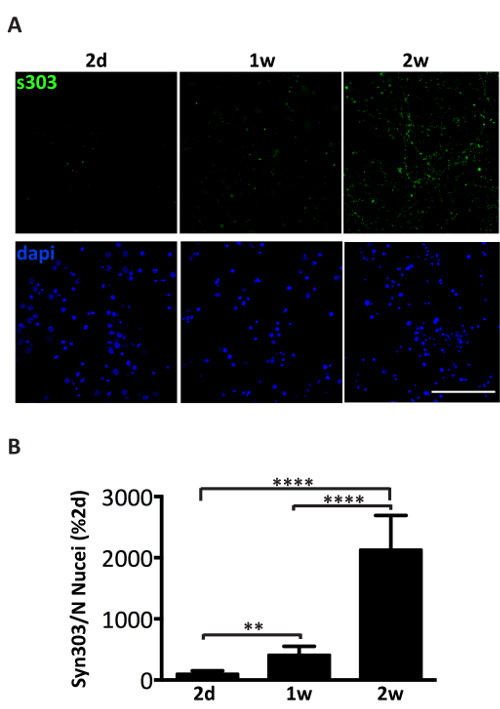
Figura 4 . Inducción dependiente del tiempo de la deposición de αS después de la administración de los agregados αS microsomas asociados. (A) inmunofluorescencia de neuronas hippocampal primarias tratados con 1 μg de microsomas asociados αS agregados fracciones de tres ratones enfermos diferentes. Las neuronas se fijaron en 2 días (2d) (1w) de 1 semana o 2 semanas (2w) de tratamiento y immunostained con syn303 (S303, 1: 1000), un anticuerpo específico para oxidado y agregado αS. Las células fueron contratinción con DAPI. Imágenes confocales fueron tomadas usando un laser del microscopio confocal, objetivo X 63. Barra de escala = 50 μm. (B) análisis cuantitativo de fluorescence total, después de fondo, se realizó utilizando el plugin de conteo de partículas del software Image J. Valores fueron normalizados para el número de núcleos por campo (cuenta DAPI) y expresados como el porcentaje de la señal de fluorescencia S303 en 2D. Los valores se dan como la media ± SD (n = 5). ** p < 0.001, *** p < 0.00001, One-Way ANOVA, seguido por la prueba de post-hoc LSD de Fisher. Haga clic aquí para ver una versión más grande de esta figura.
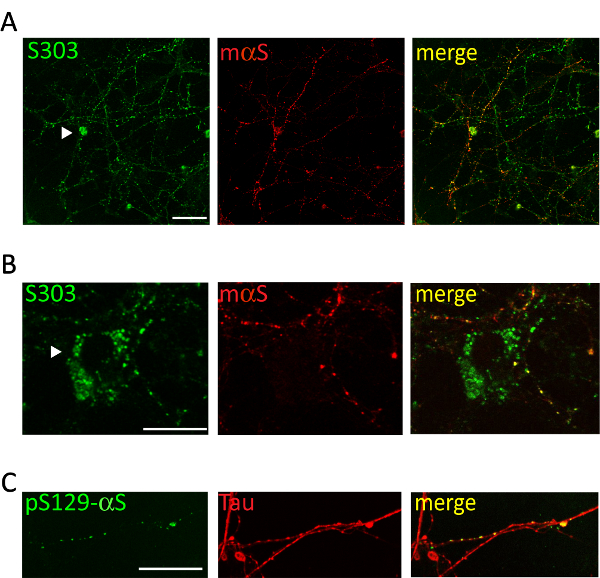
Figura 5 . Inclusiones intracelulares αS colocalize con red cortical neurites. Representativas imágenes confocales de neuronas corticales trataron con microsomas asociados αS agregados obtenidos de ratones enfermos de Tg. Después de 2 semanas de neuronas tratamiento fijo y doble teñido con anticuerpos específicos para agregados [S303 (A, B) o pser129-αS, 1:1,000 (C)] y los marcadores de neurita [ratón αS, 1: 200 (A, B) o Tau, 1: 10,000 (C)]. Etiquetado conjunto de señales fluorescentes demostró parcial co-localización de αS recién formado del grano-como las estructuras con la red de neuritas. Ocasionalmente inclusiones αS acumulan en el soma neuronal (A, B, puntas de flecha). Se adquirieron imágenes apiladas con un láser de barrido microscopio confocal, objetivo X 63. Barra de escala = 50 μm. Esta figura ha sido modificada desde Colla et al. 20. haga clic aquí para ver una versión más grande de esta figura.
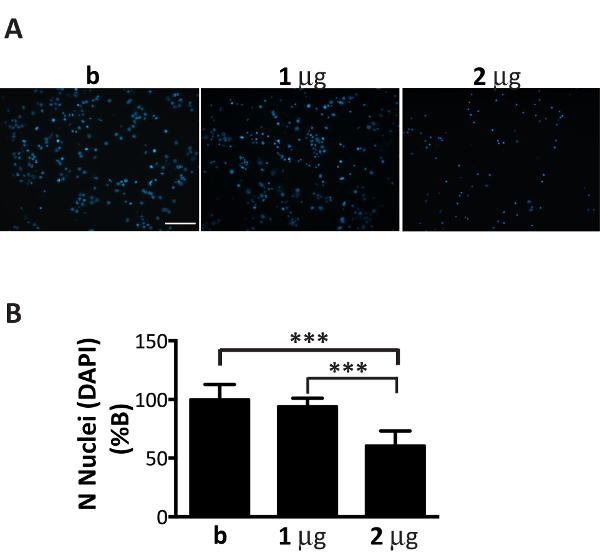
Figura 6 . Adición de una cantidad subóptima de agregados de microsomas asociados αS es tóxico para las neuronas. Coloración de DAPI de neuronas tratadas con aumento de la concentración de agregados αS microsomas asociados conduce a la muerte celular. (A) las neuronas corticales fueron tratadas con 1, 2 μg de agregados αS asociados de microsomas extraídos de ratones enfermos o sólo buffer que contiene agregados (B) y teñidos con DAPI. Se adquirieron imágenes fluorescentes con un microscopio de epifluorescencia con objetivo 20 X. Barra de escala = 100 μm. ()B) las células positivas DAPI se contaron con el software Image J. El gráfico muestra una reducción en el número de núcleos con aumento de la concentración de agregados αS microsomas asociados a los medios de comunicación neuronal. Valores expresados como % de b y se dan como la media ± SD (n = 5), *** p < 0.0001, One-Way ANOVA, seguido por la prueba de post-hoc LSD de Fisher. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hemos descrito un método para obtener la formación de inclusiones de αS en cultivos neuronales primarios derivado del cerebro de los ratones WT, mediante la adición de agregados αS microsomas asociados purificado aislado de modelos animales de αS Tg.
Pasos críticos de este protocolo son los siguientes: la relación del μg de los microsomas asociados αS agregados/las neuronas y la fuente de agregados αS. Como se muestra en la sesión de resultados, es crucial optimizar el cociente del μg de los microsomas asociados αS agregados/número de neuronas ya que trabaje en condiciones subóptimas puede conducir a la muerte celular prematura o demasiado escasa agregación intracelular (véase el Sección de resultados representativos). Debido a esto, es muy importante evaluar la densidad de la cultura neuronal en DIV 7 (se muestra en la figura 1) antes de iniciar el tratamiento. Además, agregados αS deban ser purificado de los ratones enfermos αS Tg, es decir. de modelos animales que se acumulan LB-como inclusiones caracterizan por αS insoluble fosforilada y detergente las fibrillas de la APM.
Posibles modificaciones en el presente Protocolo respecto del tejido, congelado o fresco, de que los microsomas pueden ser aislados y la cantidad de partida. Mientras que utilizamos ratones SpC de Tg por el alto contenido de agregados insolubles de αS, el protocolo es conveniente aislar agregados microsomas asociados de cualquier tejido, siempre que la zona tiene un alto contenido en áridos αS. Las muestras congeladas también pueden utilizarse ya que la congelación no afecta a los pasos de purificación de microsomas asociados áridos o los agregados por sí. Mientras que el peso inicial recomendado para los tejidos es aproximadamente de 100-150 mg, este protocolo es conveniente para la obtención de microsomas de tan bajas como 50 mg de materia prima (sin límite de peso máximo). En el caso de la cantidad menor de 100 mg, sin embargo, la relación adecuada homogeneización será 1:20 (p/v) para tener al menos 1 mL de sobrenadante S10 para cargar en la botella de policarbonato para la precipitación de la ultracentrífuga. De hecho, menor de 1 mL los volúmenes de carga puede resultar en el colapso de la pérdida de muestra y tubo. Aumento del volumen de homogeneización conducirá a un sobrenadante más diluida pero la concentración del precipitado microsomal seguirá siendo inafectada.
Una limitación de este protocolo refiere a la Cruz-siembra ineficiente en la formación de las inclusiones que se han divulgado recientemente en el caso administración de αS PFFs de origen humano a culturas neuronales murinas frente a ratón αS PFFs24αS. Ya que aumentando la cantidad de fibrillas αS exógeno a las culturas murinas puede pasar por alto este tema, le recomendamos ajustar la cantidad de agregados microsomas asociados en el caso de administración de las fibrillas de otras variantes αS o de diferentes especie a culturas neuronal de ratón que hemos descrito.
Agregados αS exógenos a los medios de cultivo pueden ser de diferentes fuentes. In vitro αS PFFs han utilizado previamente como plantilla de siembra de agregados intracelulares αS en cultivos de células, las neuronas primarias y modelos animales3,7,8,15. Comparado con nuestro método donde agregados microsomas asociados αS pueden aislarse en pocas horas, la formación de PFFs es largo y laborioso, que requiere varios pasos de purificaciones, seguidos de ensayos adicionales para comprobar αS agregados confomations25 . Además, PFFs obtenidas de humana bacteriano expresada o ratón αS, es decir, modificaciones del posttranslational típicos de eucariotas, pueden presentar conformaciones diferentes, con propiedades patógenas y siembra selectiva según los protocolos de nucleación habían seguido (es decir, cintas vs fibrillas)5,8 conduce a conclusiones y resultados diferentes. En cambio, administración única en vivo purificada αS agregados garantiza la transmisión de plantillas patógenas más auténticas, mímico de cerca el proceso de formación de inclusiones de αS en modelos animales y pacientes con EP.
Como una futura aplicación de esta técnica, creemos que este protocolo puede utilizar con éxito para aislar αS patógenos de las semillas el cerebro de pacientes con EP u otros modelos animales αS Tg, siempre que el área enferma de que aíslan los microsomas son ricos en αS inclusiones.
A nuestro conocimiento, éste es el primer método que permite la purificación de especies tóxicas de αS de en vivo modelos PD para ser utilizado como plantilla para obtener formación de αS inclusiones en las neuronas primarias de siembra.
Creemos que este método es extremadamente versátil y puede proporcionar un excepcional modelo celular para estudiar los diferentes aspectos de la agregación de αS y su influencia en la fisiopatología de la célula. Porque la formación de inclusiones de αS representa un proceso complejo que ha sido difícil de replicar en células cultivadas, confiamos en que este modelo le proporcionará gran conocimientos en mecanismos patogénicos agudos, difíciles de identificar en crónicas y más elaboradas los sistemas son como los modelos animales.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo ha sido apoyado por el Ministerio italiano de la Universidad y la investigación (MIUR) a través del esquema de concesión de reintegración de carrera (programa de RLM para joven investigador) y de la Scuola Normale Superiore. Agradecemos a Prof. Michael Lee de la Universidad de Minnesota, Estados Unidos, para proporcionar la Prp humana A53T αS ratones Tg, que agregados están aislados.
Materiales
| Name | Company | Catalog Number | Comments |
| Sucrose | Sigma-Aldrich | 84097-1KG | |
| Hepes | Sigma-Aldrich | H0887-100ML | 1M pH=7-7.6 |
| EDTA | Sigma-Aldrich | 0390-100ml | pH=8 0.5M |
| MgCl2 | Sigma-Aldrich | M8266-100G | |
| NaCO3 | Sigma-Aldrich | S7795-500G | |
| NAHCO3 | Sigma-Aldrich | S5761-500G | |
| Methanol | Sigma-Aldrich | 322415-6X1L | |
| KCl | Sigma-Aldrich | P9541-500G | |
| cOmplete Mini | Roche | 11836170001 | protease inhibitor |
| PhosStop | Roche | 4906837001 | phosphatase inhibitor |
| BCA Protein Assay Kit | Euroclone | EMPO14500 | |
| Criterion TGX 4-20% Stain Free, 18 wells | Biorad | 5678094 | |
| Supported Nitrocellulose membrane | Biorad | 1620097 | 0.2 μm |
| Blotting-Grade Blocker | Biorad | 1706404 | Non-fat dry milk |
| SuperSignal West Pico Chemiluminescent Substrate | Termo Fisher Scientific | 34077 | |
| Nitric acid | Sigma-Aldrich | 1004411000 | 65% |
| Glass Coverslips | Termo Fisher Scientific | 1014355118NR1 | 18 mm x |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | |
| Hank's Balanced Salt Solution | Termo Fisher Scientific | 14170-500 mL | |
| Penicillin/Streptomycin | Termo Fisher Scientific | 15140122 | 10,000 U/mL, 100 mL |
| Dulbecco’s Modified Eagle’s Medium | Termo Fisher Scientific | D5796-500 mL | |
| Trypsin-EDTA | Termo Fisher Scientific | 15400054 | 0.50% |
| B27 Supplement | Termo Fisher Scientific | 17504044 | 50X |
| Glutamax | Termo Fisher Scientific | 35050-038 | 100x |
| DNAse | Sigma-Aldrich | D5025 | |
| Fetal bovine serum | Euroclone | EC50182L | |
| Glutamate | Sigma-Aldrich | 1446600-1G | |
| Gentamicin | Termo Fisher Scientific | 15710 | 10 mg/ml |
| Neurobasal Medium | Termo Fisher Scientific | 10888-022 | |
| Cytosine arabinoside (AraC) | Sigma-Aldrich | C3350000 | |
| VECTASHIELD antifade mounting medium | Vector Laboratories | H-1000 | |
| DAPI | Termo Fisher Scientific | 62247 | |
| 90 Ti rotor | Beckman | N/A | Ultracentrifuge rotor |
| Optima L-90K Ultracentrifuge | Beckman | N/A | |
| Syn-1 antibody, clone 42 | BD Biosciences | 610786 | anti-mouse WB: 1:5000 |
| Syn303 antibody | BioLegend | 824301 | anti-mouse IF: 1:1000 |
| Tau antibody | Synaptic Systems | 314 002 | anti-rabbit IF: 1:10,000 |
| pser129-αS antibody | A gift from Fujiwara et al, reference 19 | anti-rabbit WB: 1:5000 | |
| pser129-αS antibody | Abcam | ab51253 | anti-rabbit IF: 1:1000 |
| Mouse αS (D37A6) XP | Cell Signaling | 4179 | anti-rabbit IF 1:200 |
| Alexa fluor 555-conjugated anti-rabbit antibody | Termo Fisher Scientific | A27039 | |
| Alexa fluor 488-conjugated anti-mouse antibody | Termo Fisher Scientific | A-11029 | |
| Microson XL-2000 | Misonix | Sonicator | |
| Ultra Bottles (Oakridge Bottles), PCB, 16x76mm, Assembly, Noryl Cap, Beckman-type | Science Service EU | S4484 | Ultracentrifuge tubes |
| AXIO Observer Inverted Light Microscope | Zeiss | N/A | |
| TCS SP2 laser scanning confocal microscope | Leica | N/A | |
| Inverted epi-fluorescence microscope | Nikon | N/A | |
| Triton x-100 | Sigma-Aldrich | X100-500ML | Nonionic surfactant |
Referencias
- Goedert, M., Spillantini, M. G., Del Tredici, K., Braak, H. 100 years of Lewy pathology. Nat. Rev. Neurol. 9, 13-24 (2012).
- Visanji, N. P., et al. α-Synuclein-Based Animal Models of Parkinson's Disease: Challenges and Opportunities in a New Era. Trends Neurosci. 39, 750-762 (2016).
- Luk, K. C., et al. Pathological α-Synuclein Transmission Initiates Parkinson-like Neurodegeneration in Nontransgenic Mice. Science. 338, 949-953 (2012).
- Rey, N. L., Petit, G. H., Bousset, L., Melki, R., Brundin, P. Transfer of human α-synuclein from the olfactory bulb to interconnected brain regions in mice. Acta Neuropathol. (Berl). 126, 555-573 (2013).
- Guo, J. L., et al. Distinct α-Synuclein Strains Differentially Promote Tau Inclusions in Neurons. Cell. 154, 103-117 (2013).
- Masuda-Suzukake, M., et al. Prion-like spreading of pathological α-synuclein in brain. Brain. 136, 1128-1138 (2013).
- Volpicelli-Daley, L. A., et al. Exogenous α-Synuclein Fibrils Induce Lewy Body Pathology Leading to Synaptic Dysfunction and Neuron Death. Neuron. 72, 57-71 (2011).
- Peelaerts, W., et al. α-Synuclein strains cause distinct synucleinopathies after local and systemic administration. Nature. 522, 340-344 (2015).
- Lázaro, D. F., Pavlou, M. A. S., Outeiro, T. F. Cellular models as tools for the study of the role of alpha-synuclein in Parkinson's disease. Exp. Neurol. 298, 162-171 (2017).
- Lee, H. -. J., Patel, S., Lee, S. -. J. Intravesicular localization and exocytosis of alpha-synuclein and its aggregates. J. Neurosci. Off. J. Soc. Neurosci. 25, 6016-6024 (2005).
- Luk, K. C., et al. Intracerebral inoculation of pathological α-synuclein initiates a rapidly progressive neurodegenerative α-synucleinopathy in mice. J. Exp. Med. 209, 975-986 (2012).
- Mougenot, A. -. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol. Aging. 33, 2225-2228 (2012).
- Recasens, A., et al. Lewy body extracts from Parkinson disease brains trigger α-synuclein pathology and neurodegeneration in mice and monkeys: LB-Induced Pathology. Ann. Neurol. 75, 351-362 (2014).
- Woerman, A. L., et al. Propagation of prions causing synucleinopathies in cultured cells. Proc. Natl. Acad. Sci. 112, 4949-4958 (2015).
- Luk, K. C., et al. Exogenous alpha-synuclein fibrils seed the formation of Lewy body-like intracellular inclusions in cultured cells. Proc. Natl. Acad. Sci. U. S. A. 106, 20051-20056 (2009).
- Sacino, A. N., et al. Intramuscular injection of α-synuclein induces CNS α-synuclein pathology and a rapid-onset motor phenotype in transgenic mice. Proc. Natl. Acad. Sci. U. S. A. 111, 10732-10737 (2014).
- Lee, M. K., et al. Human alpha-synuclein-harboring familial Parkinson's disease-linked Ala-53 --> Thr mutation causes neurodegenerative disease with alpha-synuclein aggregation in transgenic mice. Proc. Natl. Acad. Sci. U. S. A. 99, 8968-8973 (2002).
- Colla, E., et al. Endoplasmic Reticulum Stress Is Important for the Manifestations of -Synucleinopathy In Vivo. J. Neurosci. 32, 3306-3320 (2012).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nat. Cell Biol. 4, 160-164 (2002).
- Colla, E., et al. Toxic properties of microsome-associated alpha-synuclein species in mouse primary neurons. Neurobiol. Dis. 111, 36-47 (2018).
- Colla, E., et al. Accumulation of Toxic -Synuclein Oligomer within Endoplasmic Reticulum Occurs in -Synucleinopathy In Vivo. J. Neurosci. 32, 3301-3305 (2012).
- Volpicelli-Daley, L. A., Luk, K. C., Lee, V. M. -. Y. Addition of exogenous α-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous α-synuclein to Lewy body and Lewy neurite-like aggregates. Nat. Protoc. 9, 2135-2146 (2014).
- Li, W., et al. Aggregation promoting C-terminal truncation of alpha-synuclein is a normal cellular process and is enhanced by the familial Parkinson's disease-linked mutations. Proc. Natl. Acad. Sci. U. S. A. 102, 2162-2167 (2005).
- Luk, K. C., et al. Molecular and Biological Compatibility with Host Alpha-Synuclein Influences Fibril Pathogenicity. Cell Rep. 16, 3373-3387 (2016).
- Volpicelli-Daley, L. A., Kirik, D., Stoyka, L. E., Standaert, D. G., Harms, A. S. How can rAAV-α-synuclein and the fibril α-synuclein models advance our understanding of Parkinson's disease. J. Neurochem. 139, 131-155 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados