Method Article
線維形成の強力な細胞モデルとして α-シヌクレインのミクロソーム関連付けられた集計一次ニューロンの外因性投与
要約
このプロトコルの目的は、生体内でα-シヌクレインの形成を複製するセルベースのシステムを集約を提供することです。細胞内の α-シヌクレイン介在物は一次ニューロンに内面化することによって播かれ、伝搬の外因性投与罹患 α-シヌクレイン遺伝子組換えマウスから隔離されたネイティブのミクロソームによる α-シヌクレイン凝集体。
要約
年、細胞培養で不溶解性 α-シヌクレイン (αS) 介在物の生成を複製することができないことはパーキンソン病 (PD) の αS 集合の研究で大きな制限をされています。最近では、病気にかかった αS トランスジェニック マウスまたは PD 患者から脳抽出物の外因性接種による新しい動物モデルの開発は、αS 集約のより適切な細胞モデルを作成する可能性に新しい希望を与えています。残念ながら、文化のセルに関しては、生の脳抽出物の投与がないマウスのように成功実績のある、外因性骨材の選択したソースはまだ体外発泡 αS 線維。
我々 は、トランスジェニック マウスの病変部から分離された非常に有毒な αS 種ネイティブ ミクロソーム関連 αS 集計の外因性投与による一次ニューロンの細胞内 αS 介在物の形成を誘導する手法を開発しました。ミクロソームの小胞に関連付けられている αS 集計の分数は効率的に内面化し、集計データおよびリン酸化 αS の肯定的な細胞内封入体の形成を誘導します。体外と比較して-組換え αS、提案手法から作られている前もって形成された線維はより速くより多くを模倣した PD の病気の動物モデルから病原性播種は本格的な αS の集計で作られて保証抽出密接の種類介在物は、 in vivoを得られます。その結果、αS 包有物豊富な組織の可用性が必須です。
このメソッドは αS 集約と体内の関連細胞病態の顕微鏡的側面を研究する多彩な細胞ベースのモデルを提供しより正確で高度なセルを作成するための開始点になりますと考えていますPD のパラダイム。
概要
Α-シヌクレイン (αS) タンパク質の介在物の蓄積は、パーキンソン病 (PD) と α synulceinopathies1の顕著で、重要な機能です。残念ながら、動物モデルは、タンパク質線維2の形成のために必要な集計手順を誘導するために生化学的細胞の十分な環境を提供することができるが、レプリケート形成の複雑な Lewy ボディ (LB)-集計のような細胞培養は困難です。
ここで我々 は αS 介在物、動物モデルで PD の患者、培養細胞における脳分離されたマウスの一次ニューロンを使用して得られたタンパク質凝集体と同様の生成を誘導する方法をについて説明します。我々 のプロトコルは、マウスの海馬や大脳皮質の一次ニューロン αS 症候性トランスジェニック (Tg) マウスから分離されたミクロソーム関連 αS 集計の外因性投与に基づいています。この方法で培養液に追加された、内部的なものになるし、成熟した αS 肯定的な集計3,4の形成を誘導することができる、αS 有毒種の拡散・伝播能力の利点をが 5,6,7,8。
もともと、培養細胞における αS 線維形成を取得する標準的な方法は、正規のトランスフェクション プロトコル、ウイルス媒介感染9対応する αS cDNA の発現に基づいていた。低効率を示し, 細胞タイプに依存した LB のような αS を取得する最初のケースで集計された偶然、2 番目のプロトコルの感染から 24-48 h で高分子量分画法種を含む不溶性の線維形成につながって10です。 これらのメソッドの凝集体の形成はおそらく、過剰によるものと集計を指定する αS 構造の病理組織学的変換ではなく不溶性になり、αS 蛋白質量のアンバランス。代わりに、ここで紹介しているテクニックは αS 式レベルは変わりませんが、外因性線維の内面化による広範なタンパク質凝集を誘導します。また、外因性の線維の投与による αS 集合体の形成は数日または数週間徹底的なタイムラプス的 αS 介在物形成の初めと中間の段階を勉強することが可能になることを必要とする時間のかかるプロセスと細胞の生化学的変化とそれを関連付ける。したがって、本手法は、細胞の病態生理に関連して顕微鏡 αS 線維形成を研究するのに役立ちます αS 集計の携帯電話のモデルを作成する貴重なアプリケーションです。
さらに病気にかかった αS トランスジェニック (Tg) マウス11,から抽出する生の脳の管理12または人間 PD 脳6,13は Tg や野生型 (WT) 動物は、アプリケーションの αS の沈着を誘導することができます。培養細胞に同じプロシージャは、試料の骨材の少量とネイティブ αS 有毒種14を分離する標準的な手順の不足のためなる成功、証明されません。このため体外に前もって形成された線維 (サイズ) αS の αS 介在細胞の誘導のための今まで好みの集計の源となっている、動物モデルの3,4,6,7 ,,1516。しかし、我々 のプロトコルと αS Tg マウスから分離されたミクロソーム関連 αS 集約された種の一次ニューロンの細胞内のポンドのような αS 介在物の蓄積を誘発することが効率的をお紹介します。
私たちの研究室でミクロソーム関連 αS 集約された種は [Prp 人間 A53T αS Tg マウス、ライン G2 317] マウスのプリオン蛋白質 (PrP) プロモーターの制御の下で A53T αS の遺伝子を発現する病気 Tg マウスの脊髄 (SpC) 組織から分離されます。これらのマウスを見る中枢神経系におけるロバスト運動機能障害と介在物の生成を含む年齢依存性神経変性の表現型は、リン酸化、ユビキチン、および不溶性 αS、生後 9 ヶ月以降します。運動機能障害が表示されたら、表現型は後部の手足から麻痺で、2-3 週間で死に至るに急速に発展します。ΑS 骨材の蓄積は類似疾患症状です。マウスの運動機能障害の発症を犠牲には、SpC、脳幹、小脳に αS 集合の堅牢度を表示します。麻痺の設定、マウスを犠牲にするまで待機する必要はありません。発症前のマウスは、運動機能障害を表示しない 9 ヵ月齢動物で撮影されます。
プロトコル
WT と Tg 動物の使用が承認され、国家によって完全で実験動物の福祉と実験 (EEC 理事会指令 86/609、1987 年 12 月 12 日と 2010 年 9 月 22 日指令 2010年/63/EU) の国際法遵守。本稿に記載されているすべてのプロトコル当院の動物のケアのガイドラインに従ってください。
1. 病気 A53T αS Tg マウスからミクロソーム関連 αS 骨材の分離
- 250 mM ショ糖、20 mM HEPES、10 mM KCl、1.5 mM MgCl2、2 ミリメートルの EDTA、1 x ホスファターゼ/プロテアーゼインヒビターで構成されている均質化バッファーを準備します。氷の上のバッファーを保持します。
- 新鮮な均質化または、1:10 で組織を凍結 (w/v)、テフロンを使用して冷たい均質化バッファー量乳棒ホモジナイザー、10-15 回の打撃と。
- 微量遠心チューブと 1,000 × g で遠心する結果として得られるペレット (P1) の核と切れ目のない細胞を除去するために冷却遠心機を使用しての 4 ° C で 10 分間の初期のホモジネート (1-2 の mL) に転送します。P1 を破棄します。
- きれいな遠心チューブに上清 (S1) を転送および 4 ° c (S10) の 2 番目の上澄みとペレット (P10) を得るために冷却遠心機を使用して 20 分間 10,000 × g で遠心分離機の S1。
注: P10 はミトコンドリアとシナプトソームを含む粗膜ペレットです。P10 を破棄します。 - ポリカーボネートのボトルに上清 (S10) を転送 (> 1 mL) と、超遠心機と固定角ローターを使用しての 4 ° C で 1 時間のための 100,000 × g で遠心分離機の S10 (90 Ti)。
注: 上清は純粋な細胞質分画ペレット、P100、ミクロゾームの αS の集計が含まれています。 - 500 μ L の均質化バッファーと P100 のペレットを再懸濁します。きれいな遠心チューブ、10,000 × g で遠心する冷却遠心機で 4 ° C で 20 分間に P100 を転送します。
- 上澄みを廃棄し、均質化バッファーの 100 μ L で P100 を再懸濁します。
注: この分数はミクロゾームの αS の集計です。 - 2 のサンプルを超音波氷上 [設定出力電力 1 ワット (RMS)] s。-80 ° C で試料を保存します。
- 翌日は、BCA の分析を使用して蛋白質の量を決定します。
2 西部のしみ
注: 西部のしみのによるミクロソーム関連 αS 集計の生化学的解析の評価します。
- 垂直電気泳動装置にグラデーション 4 20% トリス-グリシン ポリアクリルアミドゲルをキャストします。
- 変性のサンプル バッファーに溶解、ミクロソーム関連 αS 分数の 1 μ g をロードします。
- 異なるよくタンパク質標準的なマーカーの 5 μ L をロードします。
- トリス/グリシン/SDS タンパク質マーカーがゲルの端に達するまで、バッファーを実行で 100 V でゲルを実行します。
- 塩基性炭酸バッファーを使用してニトロセルロース膜に蛋白質を転送 (10 mM NaCO3, 3 mM NaHCO3, 20% メタノール) O/N 4 ° c、200 mA、定数。
- PBS ノニオン性膜界面活性剤 0.05% (PBS-T) 室温 30 分間軌道シェーカーで 5% 脱脂乾燥したミルクをブロックします。
- 簡単に言えば、PBS T で膜を洗浄します。
- Syn 1 (1:5, 000) または pSer129 αS 抗体 (1:5, 000) PBS-T, O/N 軌道シェーカーで 4 ° c に 2.5% 脱脂乾燥したミルクの膜を孵化させなさい。
- PBS-T の軌道シェーカーと RT で 10 分間膜を洗浄します。
- 抗マウスまたは抗家兎 HRP 標識二次抗体と (1:3, 000) 室温 1 時間 PBS T での 2.5% 非脂肪乾燥ミルクの膜をインキュベートします。
- PBS-T の軌道シェーカーと RT で 10 分間膜を洗浄します。3 倍を繰り返します。
- 通常発光キットを介して信号を取得します。
3. 一次神経文化
注: 一次神経文化は WT 新生児 (P0) マウス海馬や皮質 (ライン C57BL/6) から調製しました。マイナスの遠心分離ステップ全体の手順は、無菌状態での細胞文化フードの下で行われます。
- 室温 coverslips (18 mm Ø) 少なくとも 12 時間の 65% 硝酸溶液での治療します。
- 硝酸を削除します。蒸留水 x 10 を PBS で 2 回と何回か coverslips をすすいでください。
- 24 ウェル料理 coverslips に挿入し、ポリ-D-リジンとそれらをコート (0.1 mg/mL 滅菌蒸留水または PBS 1 x) 37 ° C で 1 時間
- ポリ-D-リジンを取り外して coverslips 蒸留水で 3 回洗浄します。必要になるまで 4 ° C で保存します。
- 斬首でマウスの子犬を安楽死、遺体から頭部を分離します。料理に頭を置き、優しく皮膚を解剖します。
- 高級はさみを使って、脳の拠点で切開することで頭蓋骨を開きます。頭蓋骨の 2 つの半分を分離し、慎重にそれらを削除します。
- 鉗子を使用して、ピンチオフの拠点から脳、大脳皮質と海馬を隔離します。1% ペニシリン/ストレプトマイシンを含むハンクのバランスの取れた塩ソリューション (HBSS) 媒体を含んでいる 2 つの別々 の皿にそれらを転送します。
- 手順 3.6、3.7 をそれぞれの動物。全体のプロセスが 30-45 分以上にならないことに注意します。
- 収集した組織をミンチし、HBSS 培トリプシン 0.1 %10 mL で 2 つ 50 mL コニカル チューブ (海馬と皮質のいずれか) にそれらを転送します。37 ° C で 7 分間水浴でインキュベートします。
注: 攪拌は必要ありません。 - 1 mL のトリプシン活性をブロックする 10% 牛胎児血清 (FBS) と磨砕液を 10 μ g/mL DNase を含む DMEM を追加します。
- 200 の × g で遠心分離機常温 5 分で結果解離組織を遠心し、上清を除去します。
注: ペレット解剖組織から細胞を表します。 - めっき中、10% を含む 2 %b27、2 mM グルタミン、6 mg/mL 血糖値、細胞を再懸濁します FBS、12.5 μ M グルタミン酸と 10 μ G/ml ゲンタマイシン。
- プレート培養神経細胞比率に従って 24 ウェル プレートでポリ-D-リジン coverslips に: 1 野/12 井戸と井戸あたり約 150,000/200,000 セル、1 海馬/6 井戸。37 ° C でインキュベーターで細胞を維持します。
- (日生体外でDIV 1) 後、日 2 %b27、10 μ G/ml ゲンタマイシンと 2 mM グルタミンを含む培地めっき中に置き換えます。
- DIV 2, 1/3 メディアの削除し、グリアの汚染を減らすために 48 h の 2.5 μ M の成因を含む新鮮な培地の 1/3 を追加します。
- 37 ° C でニューロンを維持し、媒体の半分に 3 日ごとを置き換えます。
4. 神経治療
注: 治療は、DIV 7 において実施されています。無菌状態でセル文化フードの下ですべてのステップを続けたDIV 7 で皮質神経養殖密度の例は図 1に示します。
- プール ミクロゾームの αS 集合体、希釈の元の均質化バッファーを使用して 1 μ g/μ L ソリューションを持つために 3 つの別の病気にかかった Tg マウスの脊髄から得られます。
- 媒体の 1/3 を削除し、2 %b27、ゲンタマイシンと 2 mM グルタミン x 1 を含む新鮮な培地で優しくそれを置き換えます。
- 細胞培地にプールされたミクロソーム関連 αS 集計の 1 μ g を追加します。37 ° C でインキュベーターでニューロンを返す
- 1 週間ごとに 3 日間は、新鮮な媒体の 1/3 を追加します。メディアを交換しないでください。それを追加します。
- 治療 1 週間後培地の 1/3 を削除し、2 %b27、10 μ G/ml ゲンタマイシンと 2 mM グルタミンを含む新鮮な培地で優しく置き換えます。3 日おきに繰り返します。
- 後 2 週間の治療 (DIV 21) ニューロンを修正します。
5. 蛍光抗体法
- ニューロンを PBS で 2% パラホルムアルデヒドで固定 1 x と振盪せずに室温で 15 分間 5% ショ糖溶液化学下ヒューム フード。
- 定着液を削除します。簡単に言えば、PBS 1 x、3 回洗います。
注: 一次ニューロンはポリ リジン coverslips にしっかりと付着しないので優しくすべての洗濯の手順に従います。 - PBS 1 の非イオン性界面活性剤の 0.3% のニューロンを permeabilize 室温 5 分 x
- 簡単に言えば、PBS 1 x、3 回洗います。
- 3% のニューロンを孵化させなさい PBS 1 で FBS 軌道シェーカーで、非特異的結合部位をブロックする RT で 30 分の x。
- ニューロンを 3% に溶解した適切な一次抗体とインキュベート FB PBS 1 の x、O/N 軌道シェーカーで 4 ° c。
注: syn303 (1:1, 000)、マウス αS (1: 200)、pser129-αS (1:1, 000)、タウ (1:10, 000) 抗体が使用されました。 - PBS 1 倍、3 倍と簡単に言えば、抗体溶液や洗浄を削除します。
- ニューロンを 3% に溶解した適切な蛍光二次抗体とインキュベート FB 軌道シェーカーで暗闇の中で常温 1 時間 PBS の。
- PBS 1 倍、3 倍と簡単に言えば、抗体溶液や洗浄を削除します。
- 染色 DAPI 溶液でニューロン (0.1 μ g/mL の PBS 1 で x) 軌道シェーカーで暗闇の中で常温 15 分間。
- PBS 1 倍、3 倍と簡単に言えば、抗体溶液や洗浄を削除します。
- Antifade マウント媒体を使用してスライドのマウント coverslips。
結果
上記で説明したプロトコルに従うと図 2にまとめて、3 つ病気 A53T αS Tg マウス (図 3) からミクロソーム関連 αS 集計を精製しました。ミクロソームは、小胞体、ゴルジ体、および小さいシナプスの小胞を含む粗膜ペレット分数です。他の分画に比べミクロソームのペレットの純度の程度を特定のオルガネラ マーカー18を使用して以前行った。
一度分離、αS 集合体の生化学的解析は Syn 1 またはセリン 129 (pSer129-αS) 抗体でのリン酸化 αS の孵化が続く変化の SDS ページを通じて評価されます。発症 (プレ) と年齢をマッチさせた非 Tg (nTg) マウス、αS の集計に沈殿物を共同病気のマウスから分離されたミクロソームと比較。ミクロゾームの αS 種 αS 集計、HMW 洗剤耐性種、リン酸化セリン 12919 C での蓄積などの典型的な特徴を表示-N 末端フラグメント (用の全特徴は切り捨てとミクロゾームの αS 集計参照参照18,20,21)。単量体 αS が効率的に、内面を取得しない αS 蒸着7,15,22を誘発しないので、これらは基本的な要件です。それは細胞に有害なことができるので、P100 ペレットを再懸濁しますに (イオン性または非イオン性) すべての洗剤を使用しないことが重要です。また、サンプルのばらつきを避けるためには、3 つの異なる病気にかかったマウスからミクロソーム関連 αS 集計は神経治療のためプールされます。
大脳皮質や海馬の神経細胞の培養液中に病気の A53T マウスからプールされたミクロソーム関連 αS 集計の 1 μ g の投与が αS 包有物、骨材固有 αS 抗体陽性の時間依存形成を誘導します。Syn303 (図 4、 5) または pser129 αS (図 5)。2 日後 (2 d) 治療後の時点でより豊かになる小さい、散在の涙点としてこれらの集計値が表示されます。2 週間後、αS の介在物が長いようし、ビーズのような構造を大きく成熟した神経突起のパターンと部分的に共同のシナプス前のローカライズ神経の文化全体に広がると神経突起マーカー (図 5)。時折、共存しセル相馬を汚すかえそ突起に似ているプロセス全体をカバー、新たに形成された αS 包有物を見ることができます。
ミクロゾームの αS 集計分画は神経文化で効率的に広がることができる、その量はメッキのニューロン (図 1) の数を細かくチューニングします。実際には、推奨の比率、ミクロソームによる骨材の μ g を超える: ニューロン数ミクロソーム関連 αS 集計の不十分な量につながる中 (図 6)、数日以内の未熟細胞死を誘発する、何と同様の治療の 2 週間後に、包有物の乏しいと削減数は、以前の時点 (図 4A) で得られました。
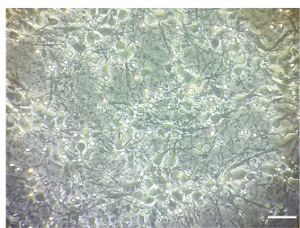
図 1.皮質神経細胞文化。皮質神経文化の DIV 7 で密度を示す代表的なイメージ。画像は倒立顕微鏡対物レンズ 10 倍で撮影されました。スケールバー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
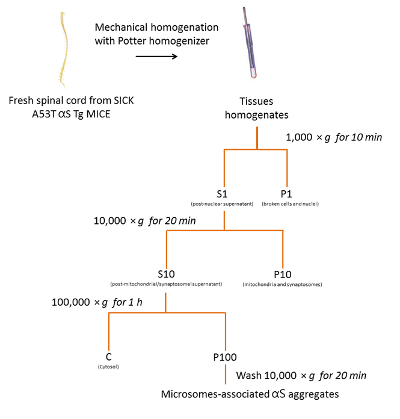
図 2.マウス SpC のミクロゾームの αS の分離を集計します。ミクロゾーム関連付けられている αS の浄化のプロトコルのフローチャートは、病気にかかったマウスの SpC から集計します。この図の拡大版を表示するのにはここをクリックしてください。
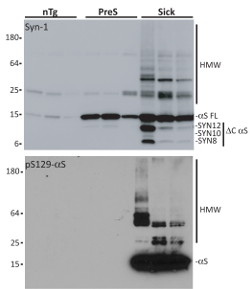
図 3.病気発症前 A53T αS Tg と nTg マウスからミクロソーム画分の分離します。西部のしみの分析示す精製 3 病気 (病気) から分離されたミクロソーム関連 αS 集計発症 (プレ) と高齢者一致 nTg マウス。病気にかかったマウスは、一方、発症前の動物の健康 A53T αS 包有物の蓄積を含むモーターおよび神経学的障害を示す A53T αS Tg マウス αS を表示しない年齢まだ任意 αS 病理学の 9 ヶ月の Tgs 関連表現型。nTg のマウスは、αS 遺伝子を運ばないし、従って αS を開発しない病気にかかったマウスの同腹子による病理が。1 μ g 精製画分の変性の SDS ページ上で実行、ニトロセルロース膜に転送され Syn 1 または pSer129 αS 抗体のしみについています。129 セリンのリン酸化され、C を示した HMW 剤抵抗性 αS 集計を含まれている病気のマウスから分離されたミクロソーム画分だけ- および N 末端切り捨て。この図は、Collaらから適応されています。18.この図の拡大版を表示するのにはここをクリックしてください。
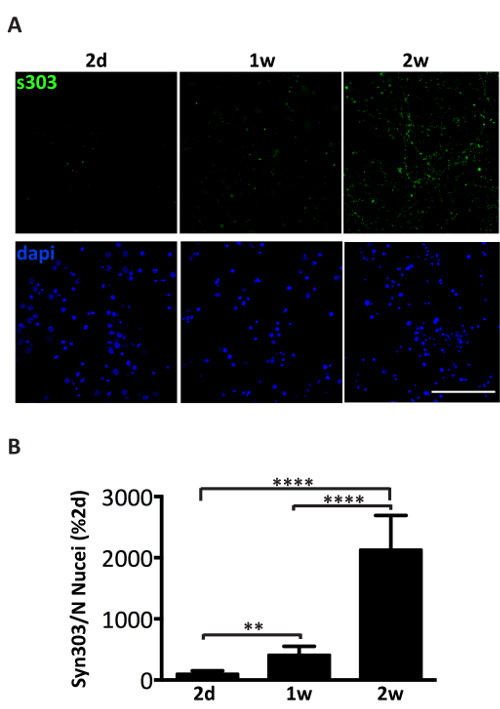
図 4.ミクロゾームの αS 集計の投与後 αS 沈着の時間依存型誘導。(A)一次海馬ニューロンの蛍光抗体で治療のミクロゾームの αS μ g 集計分数が 3 つの別の病気にかかったマウスからプールします。ニューロンは、2 日間で固定した (2 d)、1 週間 (1 w) または 2 週間 (2 w) の治療と syn303 と immunostained (S303、1: 1000) の抗体が酸化され、αS を集約。セルは、DAPI で counterstained いた。共焦点画像は走査型レーザー共焦点顕微鏡、63 X 目的を使用して撮影されました。スケール バー = 50 μ m (B)定量的合計 fluorescence のバック グラウンド減算後、行われたイメージ J ソフトウェアの粒子数のプラグインを使用しています。値は、フィールド (DAPI カウント) ごと核数の正規化、2 D で S303 の蛍光信号の割合を示します。値は平均 ± SD として与えられた (n = 5)。* * p < 0.001、* * * p < 0.00001、一方向の分散分析, フィッシャーの LSD 事後テストが続きます。この図の拡大版を表示するのにはここをクリックしてください。
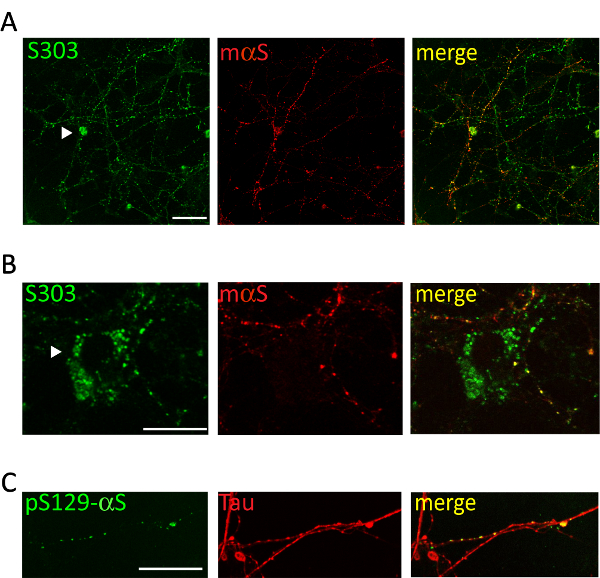
図 5.細胞内 αS 包有物は皮質突起ネットワークと colocalize します。皮質ニューロンの代表的な共焦点画像処理ミクロソーム関連 αS 集計病気 Tg マウスから得られました。治療ニューロンの 2 週間は固定され、二重後集計特異的抗体 [S303 (a, B)や pser129-αS、縮尺 (C)] と [マウス αS、1: 200 (a, B) またはタウ、1: 10,000 (C)] 突起マーカー染色。新たに形成された αS ビーズ状突起ネットワークの部分の共局在を示した共同蛍光信号のラベルします。時折 αS 包有物 (A、B、矢印) 神経相馬内に蓄積します。スタックのイメージは、レーザー共焦点顕微鏡、63 X 目的に買収されました。スケールバー = 50 μ m。この図は、Collaらから変更されています。20.この図の拡大版を表示するのにはここをクリックしてください。
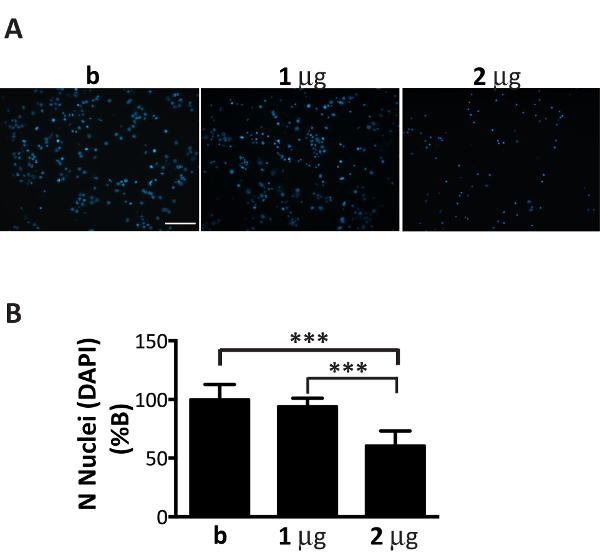
図 6.ミクロゾームの αS 集計の最適量の添加はニューロンに有毒であります。DAPI 染色ミクロソーム関連 αS 集計の濃度増加とともに扱われるニューロンの細胞死に 。(A)皮質ニューロンが扱われた 1、病気にかかったマウスから抽出されたミクロソーム関連 αS 集計の 2 μ g または含まれていない唯一のバッファー (B)を集約し、DAPI 染色します。20 × 対物を使用してエピ蛍光顕微鏡を用いた蛍光画像に買収されました。スケールバー = 100 μ m.(B)画像 J ソフトウェアを使用して DAPI 陽性細胞を数えられました。グラフは、神経のメディアに追加されたミクロソーム関連 αS 集計の濃度増加とともに核の数の減少を示します。値 b の % として表現し、平均 ± SD として与えられている (n = 5)、* * * p < 0.0001、一方向の分散分析, フィッシャーの LSD 事後テストが続きます。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ΑS Tg 動物モデルから分離精製されたミクロソーム関連 αS 集計の追加により、WT マウス脳由来初代神経細胞培養 αS 介在物の生成を取得する方法について述べる。
このプロトコルの重要な手順次のとおりです: ミクロソーム関連 αS 集計/ニューロンの μ g と αS 集計のソースの比率。結果表示セッションのように、未熟細胞死やあまりにも乏しい細胞内凝集につながる最適な条件で働くのでミクロソーム関連 αS 集計/ニューロン数の μ g の比を最適化することが重要です (を参照してください、代表的な結果のセクション)。このため、治療を開始する前に (図 1に示すように) DIV 7 神経文化の密度を評価するために非常に重要です。さらに、αS 集計は病気 αS Tg マウス、すなわちから浄化する必要があります。蓄積動物モデルからは、ポンドのような介在物は、HMW 線維をリン酸化と洗剤の不溶性の αS によって特徴付けられます。
このプロトコルへの可能な変更は、組織、どのミクロソームは分離できるので、開始金額から、新鮮なまたは冷凍を考えています。ΑS 状の凝集体の含有量が高いため SpC の Tg マウスを使用、プロトコルは、地域 αS 集計の高いコンテンツを持っている任意の組織からミクロソーム関連付けられた集計を分離に適しています。凍結にミクロソームによる集計や、集計自体の精製工程は影響しませんので、凍結試料を使用もできます。このプロトコルはミクロソームの取得に適した組織に推奨される開始の重量は約 100-150 mg が、原料 (最大重量制限なし) 50 mg 並み。100 mg 以下の量の場合ただし、均質化の適切な比率になります 1:20 (w/v) 遠心沈殿物のためのポリカーボネート瓶にロードする清 S10 の少なくとも 1 ミリリットルを持っているために。実際には、1 mL よりも小さいボリュームをロードすると、チューブやサンプルの損失の崩壊可能性があります。希薄化後の上清につながる均質化ボリュームを増やすことが、ミクロソームのペレット濃度には影響しません。
このプロトコルの制限にかかわる最近マウス αS サイズ24ではなくマウス神経文化にひと由来の αS サイズのケースの管理で報告されている αS の介在物の形成における非効率的なクロス播種します。他の αS 亜種別から得られた線維の管理の場合ミクロソームによる骨材の量を微調整するをお勧めしますこの問題をバイパスできますマウス文化に与えられる外因性 αS 線維の量を増やすので我々 の説明よりもマウス神経細胞培養する種。
文化メディアに追加外因性 αS の凝集体は、さまざまなソースからすることができます。ΑS サイズ体外は以前動物モデル3,7,8,15一次ニューロン細胞培養の細胞内 αS 骨材のシード処理テンプレートとして使用されています。ミクロゾームの αS 集計を数時間で分離できること私たちのメソッドと比較して、サイズの形成は長く、骨の折れる、浄化、αS confomations25 の集計を確認する追加の試金に続いて複数のステップを必要とします。.さらに、細菌の表現人間またはマウス αS から取得されるサイズ、すなわち欠けている翻訳後修飾、真核生物の典型的な異なる立体構造と提示できます選択的シード病原性プロパティによると核プロトコルの後 (すなわちリボン対線維)5,8異なる結果と結論に至る。代わりに、αS 集計体内浄化の単回投与より本格的な病原性のテンプレート、動物モデルで PD 患者 αS 介在物の生成のプロセスを密接に模倣の伝送を保証します。
この手法の応用としてミクロソームが分離から病変が αS で豊かなこのプロトコルを正常に PD 患者の脳や他の αS の Tg 動物モデルから αS 病原性種子を分離する使用することができますと考えてください。介在物。
私たちの知る限り、これはシード処理一次ニューロンにおける αS 介在物の生成を取得するためのテンプレートとして使用する PD モデル体内から αS のネイティブの有毒種の浄化を可能にする最初の方法です。
この方法は非常に多目的、αS 集計と細胞病態への影響の様々 な側面を研究する例外的な細胞ベースのモデルを提供できることと考えています。ΑS 介在物の生成は、培養細胞で複製することは困難している複雑なプロセスを表しているので我々 はこのモデルが急性発症のメカニズム、慢性でより精巧な識別が困難で偉大な洞察力を提供することを期待しています。システムは、動物モデルなど。
開示事項
著者が明らかに何もありません。
謝辞
この作品は、キャリア再付与制度 (若手研究者の RLM プログラム) をイタリア大学省と研究 (MIUR) によってサポートされてはスクオーラ師範スペリオーレから。骨材が分離から Tg マウス Prp 人間 A53T αS を提供するため米国・ ミネソタ大学から教授マイケル ・ リーをありがちましょう。
資料
| Name | Company | Catalog Number | Comments |
| Sucrose | Sigma-Aldrich | 84097-1KG | |
| Hepes | Sigma-Aldrich | H0887-100ML | 1M pH=7-7.6 |
| EDTA | Sigma-Aldrich | 0390-100ml | pH=8 0.5M |
| MgCl2 | Sigma-Aldrich | M8266-100G | |
| NaCO3 | Sigma-Aldrich | S7795-500G | |
| NAHCO3 | Sigma-Aldrich | S5761-500G | |
| Methanol | Sigma-Aldrich | 322415-6X1L | |
| KCl | Sigma-Aldrich | P9541-500G | |
| cOmplete Mini | Roche | 11836170001 | protease inhibitor |
| PhosStop | Roche | 4906837001 | phosphatase inhibitor |
| BCA Protein Assay Kit | Euroclone | EMPO14500 | |
| Criterion TGX 4-20% Stain Free, 18 wells | Biorad | 5678094 | |
| Supported Nitrocellulose membrane | Biorad | 1620097 | 0.2 μm |
| Blotting-Grade Blocker | Biorad | 1706404 | Non-fat dry milk |
| SuperSignal West Pico Chemiluminescent Substrate | Termo Fisher Scientific | 34077 | |
| Nitric acid | Sigma-Aldrich | 1004411000 | 65% |
| Glass Coverslips | Termo Fisher Scientific | 1014355118NR1 | 18 mm x |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | |
| Hank's Balanced Salt Solution | Termo Fisher Scientific | 14170-500 mL | |
| Penicillin/Streptomycin | Termo Fisher Scientific | 15140122 | 10,000 U/mL, 100 mL |
| Dulbecco’s Modified Eagle’s Medium | Termo Fisher Scientific | D5796-500 mL | |
| Trypsin-EDTA | Termo Fisher Scientific | 15400054 | 0.50% |
| B27 Supplement | Termo Fisher Scientific | 17504044 | 50X |
| Glutamax | Termo Fisher Scientific | 35050-038 | 100x |
| DNAse | Sigma-Aldrich | D5025 | |
| Fetal bovine serum | Euroclone | EC50182L | |
| Glutamate | Sigma-Aldrich | 1446600-1G | |
| Gentamicin | Termo Fisher Scientific | 15710 | 10 mg/ml |
| Neurobasal Medium | Termo Fisher Scientific | 10888-022 | |
| Cytosine arabinoside (AraC) | Sigma-Aldrich | C3350000 | |
| VECTASHIELD antifade mounting medium | Vector Laboratories | H-1000 | |
| DAPI | Termo Fisher Scientific | 62247 | |
| 90 Ti rotor | Beckman | N/A | Ultracentrifuge rotor |
| Optima L-90K Ultracentrifuge | Beckman | N/A | |
| Syn-1 antibody, clone 42 | BD Biosciences | 610786 | anti-mouse WB: 1:5000 |
| Syn303 antibody | BioLegend | 824301 | anti-mouse IF: 1:1000 |
| Tau antibody | Synaptic Systems | 314 002 | anti-rabbit IF: 1:10,000 |
| pser129-αS antibody | A gift from Fujiwara et al, reference 19 | anti-rabbit WB: 1:5000 | |
| pser129-αS antibody | Abcam | ab51253 | anti-rabbit IF: 1:1000 |
| Mouse αS (D37A6) XP | Cell Signaling | 4179 | anti-rabbit IF 1:200 |
| Alexa fluor 555-conjugated anti-rabbit antibody | Termo Fisher Scientific | A27039 | |
| Alexa fluor 488-conjugated anti-mouse antibody | Termo Fisher Scientific | A-11029 | |
| Microson XL-2000 | Misonix | Sonicator | |
| Ultra Bottles (Oakridge Bottles), PCB, 16x76mm, Assembly, Noryl Cap, Beckman-type | Science Service EU | S4484 | Ultracentrifuge tubes |
| AXIO Observer Inverted Light Microscope | Zeiss | N/A | |
| TCS SP2 laser scanning confocal microscope | Leica | N/A | |
| Inverted epi-fluorescence microscope | Nikon | N/A | |
| Triton x-100 | Sigma-Aldrich | X100-500ML | Nonionic surfactant |
参考文献
- Goedert, M., Spillantini, M. G., Del Tredici, K., Braak, H. 100 years of Lewy pathology. Nat. Rev. Neurol. 9, 13-24 (2012).
- Visanji, N. P., et al. α-Synuclein-Based Animal Models of Parkinson's Disease: Challenges and Opportunities in a New Era. Trends Neurosci. 39, 750-762 (2016).
- Luk, K. C., et al. Pathological α-Synuclein Transmission Initiates Parkinson-like Neurodegeneration in Nontransgenic Mice. Science. 338, 949-953 (2012).
- Rey, N. L., Petit, G. H., Bousset, L., Melki, R., Brundin, P. Transfer of human α-synuclein from the olfactory bulb to interconnected brain regions in mice. Acta Neuropathol. (Berl). 126, 555-573 (2013).
- Guo, J. L., et al. Distinct α-Synuclein Strains Differentially Promote Tau Inclusions in Neurons. Cell. 154, 103-117 (2013).
- Masuda-Suzukake, M., et al. Prion-like spreading of pathological α-synuclein in brain. Brain. 136, 1128-1138 (2013).
- Volpicelli-Daley, L. A., et al. Exogenous α-Synuclein Fibrils Induce Lewy Body Pathology Leading to Synaptic Dysfunction and Neuron Death. Neuron. 72, 57-71 (2011).
- Peelaerts, W., et al. α-Synuclein strains cause distinct synucleinopathies after local and systemic administration. Nature. 522, 340-344 (2015).
- Lázaro, D. F., Pavlou, M. A. S., Outeiro, T. F. Cellular models as tools for the study of the role of alpha-synuclein in Parkinson's disease. Exp. Neurol. 298, 162-171 (2017).
- Lee, H. -. J., Patel, S., Lee, S. -. J. Intravesicular localization and exocytosis of alpha-synuclein and its aggregates. J. Neurosci. Off. J. Soc. Neurosci. 25, 6016-6024 (2005).
- Luk, K. C., et al. Intracerebral inoculation of pathological α-synuclein initiates a rapidly progressive neurodegenerative α-synucleinopathy in mice. J. Exp. Med. 209, 975-986 (2012).
- Mougenot, A. -. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol. Aging. 33, 2225-2228 (2012).
- Recasens, A., et al. Lewy body extracts from Parkinson disease brains trigger α-synuclein pathology and neurodegeneration in mice and monkeys: LB-Induced Pathology. Ann. Neurol. 75, 351-362 (2014).
- Woerman, A. L., et al. Propagation of prions causing synucleinopathies in cultured cells. Proc. Natl. Acad. Sci. 112, 4949-4958 (2015).
- Luk, K. C., et al. Exogenous alpha-synuclein fibrils seed the formation of Lewy body-like intracellular inclusions in cultured cells. Proc. Natl. Acad. Sci. U. S. A. 106, 20051-20056 (2009).
- Sacino, A. N., et al. Intramuscular injection of α-synuclein induces CNS α-synuclein pathology and a rapid-onset motor phenotype in transgenic mice. Proc. Natl. Acad. Sci. U. S. A. 111, 10732-10737 (2014).
- Lee, M. K., et al. Human alpha-synuclein-harboring familial Parkinson's disease-linked Ala-53 --> Thr mutation causes neurodegenerative disease with alpha-synuclein aggregation in transgenic mice. Proc. Natl. Acad. Sci. U. S. A. 99, 8968-8973 (2002).
- Colla, E., et al. Endoplasmic Reticulum Stress Is Important for the Manifestations of -Synucleinopathy In Vivo. J. Neurosci. 32, 3306-3320 (2012).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nat. Cell Biol. 4, 160-164 (2002).
- Colla, E., et al. Toxic properties of microsome-associated alpha-synuclein species in mouse primary neurons. Neurobiol. Dis. 111, 36-47 (2018).
- Colla, E., et al. Accumulation of Toxic -Synuclein Oligomer within Endoplasmic Reticulum Occurs in -Synucleinopathy In Vivo. J. Neurosci. 32, 3301-3305 (2012).
- Volpicelli-Daley, L. A., Luk, K. C., Lee, V. M. -. Y. Addition of exogenous α-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous α-synuclein to Lewy body and Lewy neurite-like aggregates. Nat. Protoc. 9, 2135-2146 (2014).
- Li, W., et al. Aggregation promoting C-terminal truncation of alpha-synuclein is a normal cellular process and is enhanced by the familial Parkinson's disease-linked mutations. Proc. Natl. Acad. Sci. U. S. A. 102, 2162-2167 (2005).
- Luk, K. C., et al. Molecular and Biological Compatibility with Host Alpha-Synuclein Influences Fibril Pathogenicity. Cell Rep. 16, 3373-3387 (2016).
- Volpicelli-Daley, L. A., Kirik, D., Stoyka, L. E., Standaert, D. G., Harms, A. S. How can rAAV-α-synuclein and the fibril α-synuclein models advance our understanding of Parkinson's disease. J. Neurochem. 139, 131-155 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved