Method Article
Somministrazione esogena di microsomi-collegato dell'alfa-synuclein aggregati di neuroni primari come un modello potente delle cellule di formazione di fibrille
In questo articolo
Riepilogo
L'obiettivo del presente protocollo è quello di fornire un sistema basato su cellule che replica la formazione dell'alfa-synuclein aggrega in vivo. Le inclusioni intracellulari dell'alfa-synuclein sono seminate in neuroni primari di interiorizzazione e propagazione di esogeno somministrato del microsomi nativo con alfa-synuclein aggregati isolati da topi transgenici malato dell'alfa-synuclein.
Abstract
Per anni, l'impossibilità di replicare la formazione di inclusioni insolubili dell'alfa-synuclein (αS) nelle colture cellulari è stata una grande limitazione nello studio dell'aggregazione di αS nella malattia di Parkinson (PD). Recentemente, lo sviluppo di nuovi modelli animali attraverso l'inoculazione esogeno di estratti di cervello di topi transgenici αS malate o pazienti del Palladio ha dato nuove speranze per la possibilità di creare modelli di cellulari più adeguate di aggregazione αS. Purtroppo, quando si tratta di cellule nelle colture, la somministrazione di estratti di cervello crudo non è provata come successo come topi e l'origine della scelta degli aggregati esogeni è ancora in vitro preformato fibrille αS.
Abbiamo sviluppato un metodo per indurre la formazione di inclusioni intracellulari αS in neuroni primari attraverso la somministrazione esogena di aggregati nativo αS microsomi-collegata, una specie αS altamente tossico isolata da zone malate di topi transgenici. Questa frazione di aggregati αS che è associata con le vescicole di microsomi, in modo efficiente è interiorizzato e induce la formazione di inclusioni intracellulari positive per aggregati e fosforilato αS. Rispetto a in vitro-fibrille preformate che sono fatti da αS ricombinante, il nostro metodo è più veloce e garantisce che la semina patogeni è realizzata con aggregati di autentica αS estratte dai modelli animali malati del PD, che imita più strettamente il tipo di inclusioni ottengono in vivo. Di conseguenza, la disponibilità dei tessuti ricchi di inclusioni di αS è obbligatoria.
Crediamo che questo metodo fornirà un modello basato su cellulare versatile per studiare gli aspetti microscopici di αS aggregazione e fisiopatologia cellulare correlati in vivo e sarà un punto di partenza per la creazione della cella più accurata e sofisticata paradigma del PD.
Introduzione
Accumulo di alfa-sinucleina (αS) inclusioni proteiche è una caratteristica prominente e importante di Parkinson malattia (PD) e alfa-synulceinopathies1. Purtroppo, mentre i modelli animali sono in grado di fornire un ambiente di cellulare e biochimico sufficiente per indurre i passaggi di aggregazione necessari per la formazione della proteina fibrille2, replicando la formazione del corpo di Lewy complessi (LB)-come aggregati nelle colture cellulari sono difficile e impegnativo.
Qui descriviamo un metodo per indurre la formazione di inclusioni di αS, simili a aggregati proteici ottenuti in modelli animali e pazienti del Palladio, in cellule coltivate, facendo uso dei neuroni primari di cervello isolato del mouse. Il nostro protocollo si basa sulla somministrazione esogena di microsomi-collegata αS aggregati isolati da αS sintomatico transgenici (Tg) topi ai neuroni hippocampal o corticale primario di topo. Questo metodo sfrutta la capacità di diffusione e propagazione di specie tossiche di αS che, una volta aggiunto al terreno di coltura, sono in grado di diventare interiorizzato e indurre la formazione di maturo αS-positivi aggregati3,4, 5,6,7,8.
Originariamente, i metodi standard per ottenere la formazione di fibrille αS nelle colture cellulari erano basati sulla sovraespressione del cDNA corrispondente αS attraverso i protocolli di transfezione regolari o un'infezione virale-mediata9. Mentre nel primo caso ottenendo αS LB-come aggregati erano fortuiti, ha mostrato scarsa efficienza e dipendeva il tipo di cella, il secondo protocollo ha portato alla formazione di fibrille insolubili, comprese le specie ad alto peso molecolare (HMW) in 24-48 h dall'infezione 10. in questi metodi, la formazione di aggregati era probabilmente a causa di un eccessivo e squilibrato in quantità di proteina αS che diventa insolubile piuttosto che una conversione patologica della conformazione αS che detta aggregazione. Invece, la tecnica che presentiamo qui non altera il livello di espressione di αS ma induce l'aggregazione proteica diffusa dovuto l'interiorizzazione delle fibrille esogeni. Inoltre, la formazione di aggregati αS attraverso la somministrazione di fibrille esogeni è un processo lungo che richiede giorni o settimane per diventare esaustiva che ci permette di studiare le fasi iniziali e intermedie di formazione di inclusioni di αS in modo time-lapse e correlare con i cambiamenti biochimici cellulari. Così, il nostro metodo è un'applicazione utile per creare modelli cellulari di aggregazione αS che sono utili per studiare la formazione di fibrille αS microscopicamente in relazione alla fisiopatologia cellulare.
Inoltre anche se amministrazione del cervello crudo estrae dal malato αS transgenici (Tg) topi11,12 o umano PD cervelli6,13 è in grado di indurre la deposizione di αS Tg o wild type (WT) animali, applicazione della stessa procedura alle colture cellulari non ha dimostrato di essere un successo, forse perché la bassa quantità di aggregati nei campioni utilizzati e la mancanza di una procedura standard per isolare αS nativo specie tossiche14. Per questo motivo, in vitro preformato fibrille (PFFs) di αS sono stati la fonte di aggregati di scelta fino ad oggi per l'induzione di inclusioni di αS nelle celle e modelli animali3,4,6,7 ,15,16. Con il nostro protocollo, tuttavia, dimostriamo che a specie aggregati isolate da topi Tg αS αS microsomi-collegato in modo efficiente possono indurre accumulo delle inclusioni intracellulari di αS LB-come in neuroni primari.
Nel nostro laboratorio, specie aggregate αS microsomi-collegati sono isolati dal tessuto del midollo spinale (SpC) dei topi Tg malati che esprimono il gene umano di αS A53T sotto il controllo del promotore del mouse del prion proteina (PrP) [Prp umano A53T αS Tg topi, linea G2-317]. Questi topi mostrano un fenotipo di età-dipendente neurodegenerative che include disfunzione del motore robusta e formazione di inclusioni nel sistema nervoso centrale fatto di fosforilato, ubiquitinate e αS insolubile, a partire dopo 9 mesi di età. Una volta che viene visualizzata la finestra di disfunzione del motore, il fenotipo si evolve rapidamente in paralisi, a partire dagli arti posteriori, che conduce alla morte in 2-3 settimane. Accumulo di aggregati αS parallels manifestazione di malattia. Topi sacrificati al momento della comparsa della disfunzione motore mostrano un grado robusto di aggregazione αS in SpC, tronco cerebrale e del cervelletto. Non c'è nessuna necessità di attendere fino a paralisi imposta a sacrificare il mouse. Presintomatici topi sono prese a 9 mesi di animali che non vengono visualizzati la disfunzione del motore.
Protocollo
L'uso di animali WT e Tg è stato approvato e rispettato integralmente dalle autorità nazionali e le leggi internazionali per il benessere degli animali di laboratorio e sperimentazione (CEE direttiva del Consiglio 86/609, 12 dicembre 1987 e direttiva 2010/63/UE, 22 settembre 2010). Tutti i protocolli descritti in questa carta seguono le linee guida di cura degli animali della nostra istituzione.
1. isolamento di aggregati αS microsomi-collegato da A53T malato αS Tg topi
- Preparare il tampone di omogeneizzazione che è composto di saccarosio di 250 mM, 20 mM HEPES, 10 mM KCl, 1.5 mM MgCl2, 2mm EDTA e 1 x fosfatasi/inibitori delle proteasi. Mantenere il buffer sul ghiaccio.
- Omogeneizzare il fresco o congelato del tessuto in un 01:10 volume (p/v) di buffer di omogeneizzazione ghiacciata utilizzando un Teflon pestello omogeneizzatore, con 10-15 colpi.
- Trasferire omogeneato iniziale (1-2 mL) in un tubo del microcentrifuge e centrifugare a 1.000 × g per 10 min a 4 ° C, utilizzando una centrifuga refrigerata al fine di rimuovere i nuclei e cellule ininterrotte nel pellet risultante (P1). Scartare il P1.
- Trasferire il surnatante (S1) ad un tubo del microcentrifuge pulito e centrifugare S1 a 10.000 × g per 20 min a 4 ° C, utilizzando una centrifuga refrigerata al fine di ottenere il secondo supernatante (S10) e il pellet (P10).
Nota: P10 è un pellet di greggio membrana che contiene i mitocondri e sinaptosomi. Scartare P10. - Trasferire il surnatante (S10) per una bottiglia di policarbonato (> 1 mL) e centrifugare S10 a 100.000 × g, per 1 h a 4 ° C, utilizzando un'ultracentrifuga e un rotore ad angolo fisso (90 Ti).
Nota: Il supernatante è la frazione di puro citosol mentre il pellet, P100, contiene aggregazioni αS microsomi-collegata. - Risospendere il pellet di P100 con 500 µ l di buffer di omogeneizzazione. Trasferimento P100 a un tubo del microcentrifuge pulito e centrifugare a 10.000 × g per 20 min a 4 ° C in una centrifuga refrigerata.
- Scartare il surnatante e risospendere P100 con 100 µ l di tampone di omogeneizzazione.
Nota: Questa frazione è gli aggregati αS microsomi-collegata. - Sottoporre ad ultrasuoni campioni per 2 s su ghiaccio [set potenza 1 watt (RMS)]. Conservare i campioni a-80 ° C.
- Il giorno dopo, determinare la quantità di proteina usando l'analisi di BCA.
2. Western Blot
Nota: Caratterizzazione biochimica degli aggregati αS microsomi-collegata viene valutata mediante Western Blot.
- Eseguire il cast di un gel di poliacrilammide del Tris-glicina gradiente 4-20% su un apparato elettroforesi verticale.
- Caricare 1 µ g di frazioni αS microsomi-collegata, disciolto nella sample buffer denaturante.
- In un ben diverso, caricare 5 µ l di marcatore standard della proteina.
- Esegua il gel a 100 V in un Tris/glicina/SDS tampone di corsa fino al marcatore di proteina raggiunge la fine del gel.
- Proteine di trasferimento ad una membrana di nitrocellulosa utilizzando un tampone di carbonato basico (10mm NaCO3, 3mm NaHCO3, 20% metanolo) O/N a 4 ° C, a 200 mA, costante.
- Bloccare la membrana con PBS-non ionico tensioattivo 0,05% (PBS-T) con 5% senza grassi del latte secco su agitatore orbitale per 30 minuti a TA.
- Risciacquare brevemente, la membrana con PBS-T.
- Incubare la membrana con Syn-1 (1:5, 000) o pSer129-αS anticorpo (1:5, 000) in latte in polvere senza grassi 2,5% in PBS-T, O/N a 4 ° C su agitatore orbitale.
- Lavare la membrana per 10 min a RT con PBS-T su agitatore orbitale.
- Incubare la membrana con anti-topo o anti-coniglio HRP-coniugato anticorpo secondario (1:3, 000) in 2,5% senza grassi del latte secco in PBS-T per 1 h a TA.
- Lavare la membrana per 10 min a RT con PBS-T su agitatore orbitale. Ripetere 3 volte.
- Ottenere il segnale attraverso il kit di chemiluminescenza regolari.
3. primarie colture neuronali
Nota: Colture neuronali primarie sono state preparate dal WT neonato (P0) del mouse ippocampo o corteccia (linea C57BL/6). L'intera procedura, meno le fasi di centrifugazione, avviene sotto una cappa di coltura delle cellule, in condizioni di sterilità.
- Trattare il coprioggetti (18 mm Ø) con soluzione di acido nitrico 65% per almeno 12 h a TA.
- Rimuovere l'acido nitrico. Sciacquare le lamelle due volte con PBS 10X e più volte con acqua distillata.
- Inserire i vetrini coprioggetti in 24 pozzetti piatti e trattarle con poli-D-lisina (0,1 mg/mL in acqua distillata sterile o PBS 1 x) per 1 h a 37 ° C.
- Poli-D-lisina di rimuovere e lavare i vetrini coprioggetti tre volte con acqua distillata. Conservarli a 4 ° C fino a quando necessario.
- I cuccioli del mouse di eutanasia per decapitazione e separate le teste dai corpi. Posizionate le testine sui piatti e sezionare delicatamente la pelle.
- Utilizzando le forbici bene, apre il cranio facendo un'incisione alla base del cervello. Separare le due metà dei teschi e rimuoverli con attenzione.
- Usando il forcipe, pizzico fuori il cervello dalle basi e isolare la corteccia e dell'ippocampo. Trasferirli in due piatti separati contenenti terreno di soluzione salina bilanciata (HBSS) di Hank contenente 1% di penicillina/streptomicina.
- Ripetere i passaggi da 3.6 e 3.7 per ciascun animale. Essere consapevoli del fatto che l'intero processo non dovrebbe richiedere più di 30-45 min.
- Tritare i tessuti raccolti e trasferirli in due provette coniche da 50 mL (uno per ippocampo) e uno per la corteccia con 10 mL di mezzo HBSS contenente tripsina 0,1%. Incubare a bagnomaria per 7 min a 37 ° C.
Nota: Nessuna agitazione è necessaria. - Aggiungere 1 mL di DMEM contenente 10% siero bovino fetale (FBS) e 10 µ g/mL dnasi per l'omogeneizzato per bloccare l'attività della tripsina.
- Centrifugare il tessuto risultante dissociato a 200 × g per 5 min a RT su una centrifuga e rimuovere il surnatante.
Nota: Il pellet rappresenta le celle dissecate dal tessuto. - Risospendere le cellule nel mezzo di placcatura, contenente il 2% B27, glutamina 2mm, glucosio 6 mg/mL, 10% FBS, 12,5 µM glutammato e gentamicina 10 µ g/mL.
- Piastra dissociato neuroni sulle lamelle di poli-D-lisina a 24 pozzetti secondo il rapporto: 1 corteccia/12 pozzi e ippocampo 1/6, con conseguente circa 150.000/200.000 cellule per pozzetto. Mantenere le cellule in incubatore a 37 ° C.
- Il giorno dopo (giorno in vitro, DIV 1), sostituire il mezzo di placcatura con il mezzo contenente il 2% B27, 10 µ g/mL Gentamicina e glutamina 2mm.
- Al DIV 2, rimuovere 1/3 della media e aggiungere 1/3 del mezzo fresco contenente 2,5 µM citosina arabinoside per 48 h per ridurre la contaminazione gliale.
- Mantenere i neuroni a 37 ° C e la metà del mezzo di sostituire ogni tre giorni.
4. i neuroni trattamento
Nota: Il trattamento è stato effettuato a 7 DIV. Tutte le fasi vengono svolte sotto una cappa di cultura delle cellule in condizioni sterili. Un esempio di densità di coltura neuronale corticale a DIV 7 è illustrato nella Figura 1.
- Aggregati di microsomi-collegata αS piscina ottenuti dal midollo spinale dei topi Tg diversi tre malati al fine di avere una soluzione di 1 µ g / µ l, utilizzando il buffer originale di omogeneizzazione per la diluizione.
- Togliere 1/3 del mezzo e sostituirlo delicatamente con il mezzo fresco contenente il 2% B27, 1x gentamicina e 2 mM glutammina.
- Aggiungere 1 µ g di aggregati pool αS microsomi-collegata al medium delle cellule. Restituire i neuroni nell'incubatore a 37 ° C.
- Ogni 3 giorni per 1 settimana, aggiungere 1/3 di terreno nuovo. Non sostituire il mezzo. Basta aggiungerlo.
- Dopo 1 settimana del trattamento, è necessario rimuovere 1/3 del mezzo e sostituirlo delicatamente con il mezzo fresco contenente il 2% B27, 10 µ g/mL Gentamicina e glutamina 2mm. Ripetere ogni 3 giorni.
- Difficoltà neuroni dopo 2 settimane di trattamento (DIV 21).
5. immunofluorescenza
- Difficoltà neuroni con paraformaldeide al 2% in PBS 1X e soluzione di saccarosio di 5% per 15 min a RT senza agitazione, sotto un prodotto chimico cappa aspirante.
- Rimuovere la soluzione di fissaggio. Brevemente, lavare con PBS 1 x, 3 volte.
Nota: Eseguire tutti i passaggi di lavaggio delicatamente perché neuroni primari non si attaccano saldamente alle lamelle di poli-lisina. - Permeabilize neuroni con 0,3% di tensioattivo non ionico in PBS 1 x per 5 minuti a TA.
- Brevemente, lavare con PBS 1 x, 3 volte.
- Incubare i neuroni con 3% FBS in PBS 1 x 30 min a RT, per bloccare i siti di legame aspecifici, su agitatore orbitale.
- Incubare i neuroni con l'anticorpo primario appropriato disciolto in 3% FBS in PBS 1 x, O/N a 4 ° C su agitatore orbitale.
Nota: syn303 (1:1, 000), mouse αS (1: 200), pser129-αS (1:1, 000) e Tau (01:10, 000) sono stati utilizzati anticorpi. - Rimuovere la soluzione di anticorpo e lavarlo, brevemente, con PBS 1 x, 3 volte.
- Incubare i neuroni con anticorpo secondario fluorescente appropriato dissolto nel 3% FBS in PBS, per 1h a RT in the dark su agitatore orbitale.
- Rimuovere la soluzione di anticorpo e lavarlo, brevemente, con PBS 1 x, 3 volte.
- Macchiare i neuroni con soluzione DAPI (0,1 µ g/mL in PBS 1 x) per 15 min a RT al buio su agitatore orbitale.
- Rimuovere la soluzione di anticorpo e lavarlo, brevemente, con PBS 1 x, 3 volte.
- Montare le lamelle su una diapositiva utilizzando il mezzo di montaggio antifade.
Risultati
Seguendo il protocollo descritto in precedenza e riassunti nella Figura 2, abbiamo purificato aggregati αS microsomi-collegata dai topi di tre malati A53T αS Tg (Figura 3). Microsomi sono frazioni di pellet di greggio della membrana che contengono il reticolo endoplasmatico, Golgi e piccole vescicole sinaptiche. Il grado di purezza del pellet microsomiale rispetto alle altre frazioni è stata precedentemente valutato usando organello specifici marcatori18.
Una volta isolato, caratterizzazione biochimica di aggregati αS viene valutata attraverso denaturante SDS-Page, seguita da incubazione con Syn-1 o αS fosforilato in serina 129 (pSer129-αS) anticorpo. Rispetto ai pari età non-Tg (nTg) topi, microsomi isolati da topi malati co-precipitato con aggregati αS e presintomatica (PreS). Microsomi-collegata αS specie mostrano le tipiche caratteristiche di αS aggregati, come accumulo di specie resistenti al detergente HMW, fosforilazione in serina 12919 e C- e N-terminale troncato frammenti (per una completa caratterizzazione dei aggregati di microsomi-collegata αS Vedi riferimento18,20,21). Questi sono requisiti fondamentali poiché αS monomerico non ottenere interiorizzato in modo efficiente e non induce αS deposizione7,15,22. È importante non utilizzare qualsiasi detergente (ionici e non ionici) per risospendere il pellet P100 poiché esso può essere dannoso per le cellule. Inoltre, al fine di evitare la variabilità del campione, aggregati αS microsomi-collegato da tre diversi topi malati saranno essere riuniti per il trattamento di un neurone.
Amministrazione di 1 µ g di aggregati αS microsomi-collegata in pool da malato A53T topi al terreno di coltura dei neuroni corticali o hippocampal induce un dipendente dal tempo la formazione di inclusioni di αS, positive per gli anticorpi specifici aggregati αS come Syn303 (Figura 4, 5) o pser129-αS (Figura 5). Dopo due giorni (2d) di trattamento questi aggregati vengono visualizzati come piccola, sparsa puncta che diventerà più abbondante in momenti successivi. Dopo due settimane, inclusioni di αS assomigliano a lungo e maturo perline-come le strutture, fortemente diffuso in tutto le colture neuronali, seguendo un modello del neurite e parzialmente co-localizzazione con presinaptici e neurites marcatori (Figura 5). Occasionalmente, possono essere visto neonata αS inclusioni co-localizzano e macchiare il soma di cella o coprire l'intero processo, che assomiglia neurites necrotico.
Anche se αS microsomi-associati aggregati frazioni possono diffondersi in modo efficiente in colture neuronali, il loro importo deve essere finemente sintonizzato al numero di neuroni placcato (Figura 1). Infatti, superando il rapporto consigliato, µ g di microsomi-associati aggregati: numero di neuroni, indurrà la morte prematura delle cellule entro pochi giorni (Figura 6), mentre una quantità insufficiente di aggregati di microsomi-collegata αS porterà a un scarso e ridotto numero di inclusioni dopo due settimane di trattamento, simile a quello che è stato ottenuto in momenti precedenti (Figura 4A).
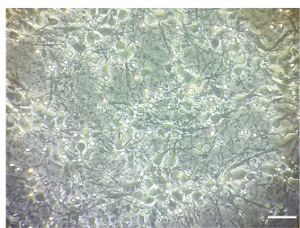
Figura 1 . Colture neuronali corticali. Immagine rappresentativa risultati densità alle 7 DIV di colture neuronali corticali. Immagini sono state scattate con un microscopio ottico invertito, obiettivo 10x. Barra della scala = 100 µm. Clicca qui per visualizzare una versione più grande di questa figura.
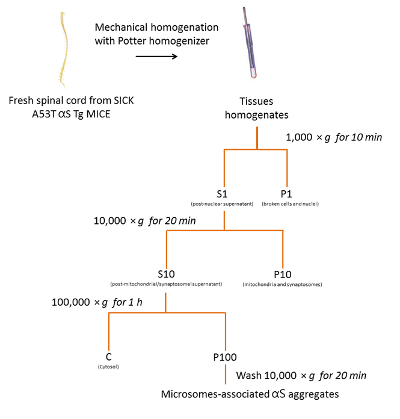
Figura 2 . Isolamento di microsomi-collegata αS aggrega da mouse SpC. Diagramma di flusso del protocollo di purificazione degli aggregati αS microsomi-collegato da SpC dei topi malati. Clicca qui per visualizzare una versione più grande di questa figura.
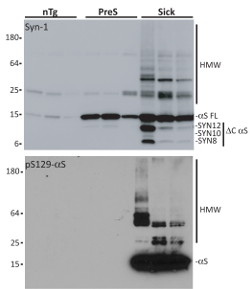
Figura 3 . Isolamento delle frazioni di microsomi da malate, presintomatici A53T αS Tg nTg topi e. Risultati di analisi di Western blot purificato aggregati di microsomi-collegata αS isolati di tre malato (Sick), presintomatici (PreS) e topi nTg invecchiato-abbinati. Topi malati sono A53T αS Tg topolini che mostrano la disfunzione motore e neurologica, tra cui l'accumulo di inclusioni di αS, mentre animali presintomatici sono sano A53T αS Tgs di 9 mesi di età che non mostrano ancora alcuna patologia αS relativo fenotipo. nTg topi sono littermates dei topi malati che non trasportano il transgene αS e pertanto non si sviluppano αS indotto da patologia. 1 µ g di ogni frazioni purificate sono stati eseguiti su una denaturante SDS-Page, trasferite su una membrana di nitrocellulosa e cancellati con anticorpo Syn-1 o pSer129-αS. Solo frazioni di microsomi isolati da topi malati contenuti aggregati di detersivo-resistente αS HMW fosforilati in serina 129 che mostrasse C- e N-terminale. Questa figura è stata adattata da Colla et al. 18. Clicca qui per visualizzare una versione più grande di questa figura.
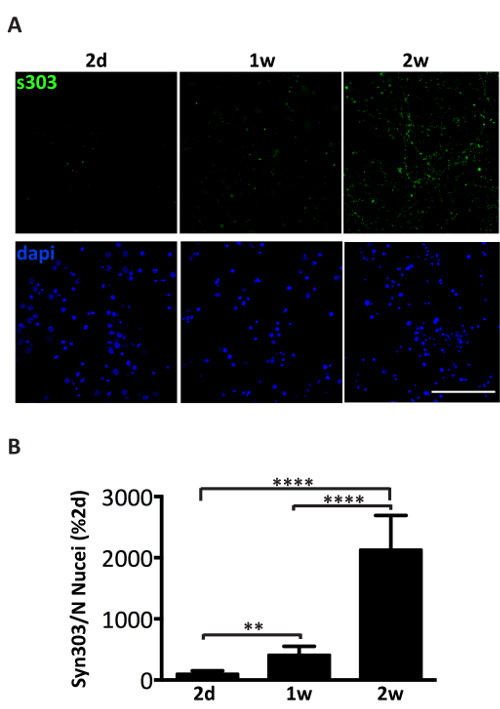
Figura 4 . Dipendente dal tempo di induzione di deposizione di αS dopo amministrazione di aggregati αS microsomi-collegata. (A) immunofluorescenza dei neuroni hippocampal primari trattati con 1 µ g di microsomi-collegata αS aggrega le frazioni riunite da tre diversi topi malati. I neuroni sono stati fissati ai 2 giorni (2d), 1 settimana (1w) o 2 settimane (2w) di trattamento e immunostained con syn303 (S303, 1: 1000), un anticorpo specifico per ossidato e aggregati αS. Le cellule erano controcolorate con DAPI. Immagini confocal sono state prese utilizzando un microscopio confocale, obiettivo X 63 di scansione laser. Barra della scala = 50 µm. (B) analisi quantitativa di totale fluorescenti, dopo la sottrazione del fondo, è stato fatto utilizzando il plugin di conteggio di particelle del software Image J. Valori sono stati normalizzati per il numero di nuclei per ogni campo (conteggio di DAPI) ed espresso come percentuale del segnale di fluorescenza S303 2D. I valori sono riportati come media ± DS (n = 5). * * p < 0,001, * * * p < 0,00001, One-way ANOVA, seguita da test post-hoc di LSD di Fisher. Clicca qui per visualizzare una versione più grande di questa figura.
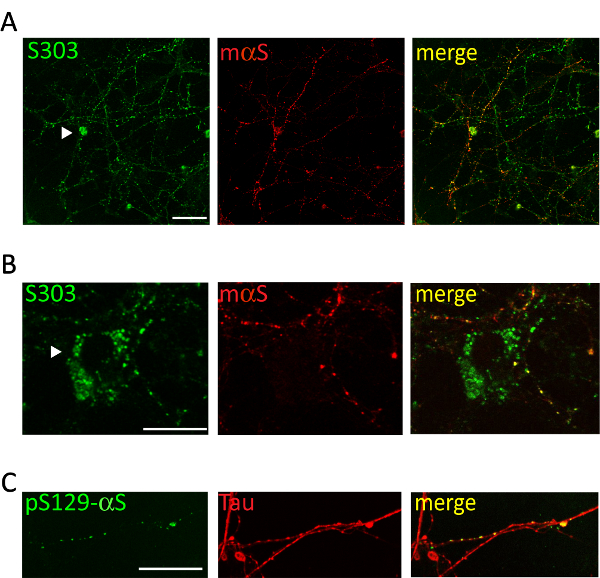
Figura 5 . Le inclusioni intracellulari αS colocalize con rete corticale neurites. Immagini confocal rappresentative dei neuroni corticali trattati con microsomi-collegata αS aggregati ottenuti da topi Tg malati. Dopo 2 settimane di neuroni di trattamento erano fissi e doppio macchiato con anticorpi specifici aggregati [S303 (A, B) o pser129-αS, 1:1,000 (C)] e marcatori del neurite [mouse αS, 1: 200 (A, B) o Tau, 1: 10.000 (C)]. Co-etichettatura dei segnali fluorescenti dimostrato parziale co-localizzazione della neonata αS tallone-come le strutture con la rete di neuriti. Occasionalmente le inclusioni αS si accumulano all'interno del soma neuronale (A, B, punte di freccia). Immagini impilate sono state acquisite con un microscopio confocale, obiettivo X 63 di scansione laser. Barra della scala = 50 µm. Questa figura è stata modificata da Colla et al. 20. Clicca qui per visualizzare una versione più grande di questa figura.
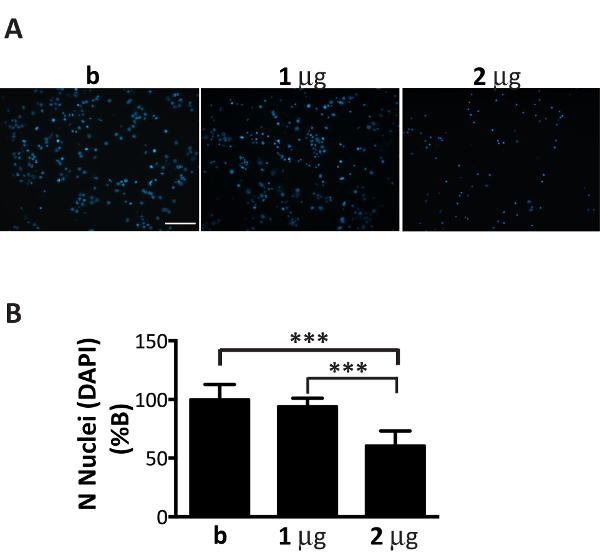
Figura 6 . Aggiunta di quantità non ottimale degli aggregati αS microsomi-collegata è tossico ai neuroni. DAPI macchiatura dei neuroni trattati con l'aumento della concentrazione di aggregati di microsomi-collegata αS conduce alla morte delle cellule. (A) i neuroni corticali sono stati trattati con 1, 2 µ g di aggregati di microsomi-collegata αS estratte da topi malati o buffer solo che non contiene aggregati (B) e colorato con DAPI. Immagini fluorescenti sono state acquisite con un microscopio a epifluorescenza utilizzando un obiettivo X 20. Barra della scala = 100 µm.(B) cellule DAPI-positive sono state contate utilizzando il software Image J. Il grafico mostra una riduzione del numero dei nuclei con l'aumento della concentrazione di aggregati di microsomi-collegata αS aggiunto ai mezzi di comunicazione neuronale. I valori sono espressi come % di b e sono indicati come la media ± SD (n = 5), * * * p < 0,0001, One-way ANOVA, seguita da test post-hoc di LSD di Fisher. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Abbiamo descritto un metodo per ottenere la formazione di inclusioni di αS in colture neuronali primarie cervello-derivato da topi WT, attraverso l'aggiunta di aggregati purificata microsomi-collegata αS isolato dai modelli animali di αS Tg.
Fasi critiche del presente protocollo sono i seguenti: il rapporto di µ g di microsomi-collegata αS aggregati/neuroni e l'origine degli aggregati αS. Come mostrato nella sessione di risultati, è fondamentale ottimizzare il rapporto di µ g di microsomi-collegata αS aggregati/numero di neuroni, poiché lavorano in condizioni non ottimali può condurre alla morte prematura delle cellule o troppo scarsi aggregati intracellulari (vedere la Sezione di risultati rappresentativi). Per questo motivo, è molto importante valutare la densità di coltura neuronale al DIV 7 (illustrato nella Figura 1) prima di iniziare il trattamento. Inoltre, aggregati αS devono essere purificati da topi Tg αS malato, vale a dire. dai modelli animali che si accumulano LB-come le inclusioni caratterizzata da fosforilati e detergente insolubile αS fibrille HMW.
Eventuali modifiche al presente protocollo riguardano il tessuto, surgelato o fresco, da quali microsomi possono essere isolate e l'importo di partenza. Mentre abbiamo usato i topi SpC di Tg a causa l'elevato contenuto di aggregati insolubili αS, il protocollo è adatto per isolare i microsomi-associati aggregati da eventuali tessuti, condizione che la zona ha un alto contenuto in aggregati αS. I campioni congelati possono essere utilizzati anche dal congelamento non pregiudica la procedura di purificazione degli aggregati microsomi-collegata o gli aggregati di per sé. Mentre il peso di partenza consigliato per tessuti è circa 100-150 mg, questo protocollo è adatto per l'ottenimento di microsomi da basso quanto 50 mg di materiale grezzo (nessun limite di peso massimo). Nel caso la quantità inferiore a 100 mg, tuttavia, il rapporto di omogeneizzazione appropriato sarà 01:20 (w/v) al fine di avere almeno 1 mL di surnatante S10 per caricare sulla bottiglia in policarbonato per la precipitazione dell'ultracentrifuga. Infatti, volumi inferiori a 1 mL di carico può provocare il collasso della perdita tubo e campione. Aumentando il volume di omogeneizzazione porterà ad un supernatante più diluita, ma la concentrazione del pellet microsomiale resteranno immutata.
Una limitazione di questo protocollo riguarda la croce-semina inefficiente nella formazione di inclusioni di αS che sono stati recentemente segnalati nell'amministrazione caso di αS PFFs di origine umana per colture neuronali murini al contrario del mouse αS PFFs24. Poiché aumentando la quantità di fibrille αS esogeno dato alle culture murine può aggirare questo problema, si consiglia di regolare la quantità di microsomi-associati aggregati in caso di somministrazione di fibrille ottenuti da altre varianti αS o da diversi specie di colture neuronali del mouse rispetto a ciò che abbiamo descritto.
Aggregati αS esogeno aggiunti al terreno di coltura possono essere da fonti diverse. In vitro αS PFFs precedentemente sono stati usati come modello di semina di aggregati intracellulari αS in colture cellulari, neuroni primari e modelli animali3,7,8,15. Rispetto al nostro metodo dove aggregati αS microsomi-collegato possono essere isolati in poche ore, la formazione di PFFs è lunga e laboriosa, che richiede più passaggi di purificazioni, seguite da ulteriori analisi per controllare αS aggrega confomations25 . Inoltre, PFFs viene ottenuto dall'umano batterico-espresso o del mouse αS, cioè manca modifiche di posttranslational tipiche degli eucarioti, può presentare diverse conformazioni, con semina selettiva e proprietà di patogeni, secondo i protocolli di nucleazione seguita (cioè nastri vs fibrille)5,8 che porta a conclusioni e risultati diversi. Invece, singola somministrazione di in vivo purificato αS aggregati garantisce la trasmissione dei modelli patogeni più autentiche, che imita molto attentamente il processo di formazione di inclusioni di αS in modelli animali e pazienti del Palladio.
Come una futura applicazione di questa tecnica, crediamo che questo protocollo può essere usato con successo per isolare il semi patogeni αS dal cervello di pazienti del Palladio o altri modelli animali αS Tg, purché la zona malata da cui sono isolati microsomi sono ricchi di αS inclusioni.
A nostra conoscenza, questo è il primo metodo che permette la purificazione di specie autoctone tossiche di αS da in vivo modelli PD per essere utilizzato come modello per ottenere la formazione di inclusioni di αS in neuroni primari di semina.
Noi crediamo che questo metodo è estremamente versatile e in grado di fornire un modello basato su cellulare eccezionale per studiare i diversi aspetti di aggregazione αS e la sua influenza sulla fisiopatologia delle cellule. Poiché la formazione di inclusioni di αS rappresentano un processo complesso che è stato difficile da replicare in cellule coltivate, siamo fiduciosi che questo modello fornirà grandi intuizioni in meccanismi patogenetici acuti, difficili da identificare in cronica e più elaborati i sistemi sono come modelli animali.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal Ministero dell'Università e ricerca (MIUR) attraverso il regime di sovvenzione carriera reinserimento (RLM programma per giovane ricercatore) e dalla Scuola Normale Superiore. Ringraziamo Prof Michael Lee, Università del Minnesota, USA, per fornire il αS Prp umano A53T topi Tg, da cui gli aggregati sono isolati.
Materiali
| Name | Company | Catalog Number | Comments |
| Sucrose | Sigma-Aldrich | 84097-1KG | |
| Hepes | Sigma-Aldrich | H0887-100ML | 1M pH=7-7.6 |
| EDTA | Sigma-Aldrich | 0390-100ml | pH=8 0.5M |
| MgCl2 | Sigma-Aldrich | M8266-100G | |
| NaCO3 | Sigma-Aldrich | S7795-500G | |
| NAHCO3 | Sigma-Aldrich | S5761-500G | |
| Methanol | Sigma-Aldrich | 322415-6X1L | |
| KCl | Sigma-Aldrich | P9541-500G | |
| cOmplete Mini | Roche | 11836170001 | protease inhibitor |
| PhosStop | Roche | 4906837001 | phosphatase inhibitor |
| BCA Protein Assay Kit | Euroclone | EMPO14500 | |
| Criterion TGX 4-20% Stain Free, 18 wells | Biorad | 5678094 | |
| Supported Nitrocellulose membrane | Biorad | 1620097 | 0.2 μm |
| Blotting-Grade Blocker | Biorad | 1706404 | Non-fat dry milk |
| SuperSignal West Pico Chemiluminescent Substrate | Termo Fisher Scientific | 34077 | |
| Nitric acid | Sigma-Aldrich | 1004411000 | 65% |
| Glass Coverslips | Termo Fisher Scientific | 1014355118NR1 | 18 mm x |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | |
| Hank's Balanced Salt Solution | Termo Fisher Scientific | 14170-500 mL | |
| Penicillin/Streptomycin | Termo Fisher Scientific | 15140122 | 10,000 U/mL, 100 mL |
| Dulbecco’s Modified Eagle’s Medium | Termo Fisher Scientific | D5796-500 mL | |
| Trypsin-EDTA | Termo Fisher Scientific | 15400054 | 0.50% |
| B27 Supplement | Termo Fisher Scientific | 17504044 | 50X |
| Glutamax | Termo Fisher Scientific | 35050-038 | 100x |
| DNAse | Sigma-Aldrich | D5025 | |
| Fetal bovine serum | Euroclone | EC50182L | |
| Glutamate | Sigma-Aldrich | 1446600-1G | |
| Gentamicin | Termo Fisher Scientific | 15710 | 10 mg/ml |
| Neurobasal Medium | Termo Fisher Scientific | 10888-022 | |
| Cytosine arabinoside (AraC) | Sigma-Aldrich | C3350000 | |
| VECTASHIELD antifade mounting medium | Vector Laboratories | H-1000 | |
| DAPI | Termo Fisher Scientific | 62247 | |
| 90 Ti rotor | Beckman | N/A | Ultracentrifuge rotor |
| Optima L-90K Ultracentrifuge | Beckman | N/A | |
| Syn-1 antibody, clone 42 | BD Biosciences | 610786 | anti-mouse WB: 1:5000 |
| Syn303 antibody | BioLegend | 824301 | anti-mouse IF: 1:1000 |
| Tau antibody | Synaptic Systems | 314 002 | anti-rabbit IF: 1:10,000 |
| pser129-αS antibody | A gift from Fujiwara et al, reference 19 | anti-rabbit WB: 1:5000 | |
| pser129-αS antibody | Abcam | ab51253 | anti-rabbit IF: 1:1000 |
| Mouse αS (D37A6) XP | Cell Signaling | 4179 | anti-rabbit IF 1:200 |
| Alexa fluor 555-conjugated anti-rabbit antibody | Termo Fisher Scientific | A27039 | |
| Alexa fluor 488-conjugated anti-mouse antibody | Termo Fisher Scientific | A-11029 | |
| Microson XL-2000 | Misonix | Sonicator | |
| Ultra Bottles (Oakridge Bottles), PCB, 16x76mm, Assembly, Noryl Cap, Beckman-type | Science Service EU | S4484 | Ultracentrifuge tubes |
| AXIO Observer Inverted Light Microscope | Zeiss | N/A | |
| TCS SP2 laser scanning confocal microscope | Leica | N/A | |
| Inverted epi-fluorescence microscope | Nikon | N/A | |
| Triton x-100 | Sigma-Aldrich | X100-500ML | Nonionic surfactant |
Riferimenti
- Goedert, M., Spillantini, M. G., Del Tredici, K., Braak, H. 100 years of Lewy pathology. Nat. Rev. Neurol. 9, 13-24 (2012).
- Visanji, N. P., et al. α-Synuclein-Based Animal Models of Parkinson's Disease: Challenges and Opportunities in a New Era. Trends Neurosci. 39, 750-762 (2016).
- Luk, K. C., et al. Pathological α-Synuclein Transmission Initiates Parkinson-like Neurodegeneration in Nontransgenic Mice. Science. 338, 949-953 (2012).
- Rey, N. L., Petit, G. H., Bousset, L., Melki, R., Brundin, P. Transfer of human α-synuclein from the olfactory bulb to interconnected brain regions in mice. Acta Neuropathol. (Berl). 126, 555-573 (2013).
- Guo, J. L., et al. Distinct α-Synuclein Strains Differentially Promote Tau Inclusions in Neurons. Cell. 154, 103-117 (2013).
- Masuda-Suzukake, M., et al. Prion-like spreading of pathological α-synuclein in brain. Brain. 136, 1128-1138 (2013).
- Volpicelli-Daley, L. A., et al. Exogenous α-Synuclein Fibrils Induce Lewy Body Pathology Leading to Synaptic Dysfunction and Neuron Death. Neuron. 72, 57-71 (2011).
- Peelaerts, W., et al. α-Synuclein strains cause distinct synucleinopathies after local and systemic administration. Nature. 522, 340-344 (2015).
- Lázaro, D. F., Pavlou, M. A. S., Outeiro, T. F. Cellular models as tools for the study of the role of alpha-synuclein in Parkinson's disease. Exp. Neurol. 298, 162-171 (2017).
- Lee, H. -. J., Patel, S., Lee, S. -. J. Intravesicular localization and exocytosis of alpha-synuclein and its aggregates. J. Neurosci. Off. J. Soc. Neurosci. 25, 6016-6024 (2005).
- Luk, K. C., et al. Intracerebral inoculation of pathological α-synuclein initiates a rapidly progressive neurodegenerative α-synucleinopathy in mice. J. Exp. Med. 209, 975-986 (2012).
- Mougenot, A. -. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol. Aging. 33, 2225-2228 (2012).
- Recasens, A., et al. Lewy body extracts from Parkinson disease brains trigger α-synuclein pathology and neurodegeneration in mice and monkeys: LB-Induced Pathology. Ann. Neurol. 75, 351-362 (2014).
- Woerman, A. L., et al. Propagation of prions causing synucleinopathies in cultured cells. Proc. Natl. Acad. Sci. 112, 4949-4958 (2015).
- Luk, K. C., et al. Exogenous alpha-synuclein fibrils seed the formation of Lewy body-like intracellular inclusions in cultured cells. Proc. Natl. Acad. Sci. U. S. A. 106, 20051-20056 (2009).
- Sacino, A. N., et al. Intramuscular injection of α-synuclein induces CNS α-synuclein pathology and a rapid-onset motor phenotype in transgenic mice. Proc. Natl. Acad. Sci. U. S. A. 111, 10732-10737 (2014).
- Lee, M. K., et al. Human alpha-synuclein-harboring familial Parkinson's disease-linked Ala-53 --> Thr mutation causes neurodegenerative disease with alpha-synuclein aggregation in transgenic mice. Proc. Natl. Acad. Sci. U. S. A. 99, 8968-8973 (2002).
- Colla, E., et al. Endoplasmic Reticulum Stress Is Important for the Manifestations of -Synucleinopathy In Vivo. J. Neurosci. 32, 3306-3320 (2012).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nat. Cell Biol. 4, 160-164 (2002).
- Colla, E., et al. Toxic properties of microsome-associated alpha-synuclein species in mouse primary neurons. Neurobiol. Dis. 111, 36-47 (2018).
- Colla, E., et al. Accumulation of Toxic -Synuclein Oligomer within Endoplasmic Reticulum Occurs in -Synucleinopathy In Vivo. J. Neurosci. 32, 3301-3305 (2012).
- Volpicelli-Daley, L. A., Luk, K. C., Lee, V. M. -. Y. Addition of exogenous α-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous α-synuclein to Lewy body and Lewy neurite-like aggregates. Nat. Protoc. 9, 2135-2146 (2014).
- Li, W., et al. Aggregation promoting C-terminal truncation of alpha-synuclein is a normal cellular process and is enhanced by the familial Parkinson's disease-linked mutations. Proc. Natl. Acad. Sci. U. S. A. 102, 2162-2167 (2005).
- Luk, K. C., et al. Molecular and Biological Compatibility with Host Alpha-Synuclein Influences Fibril Pathogenicity. Cell Rep. 16, 3373-3387 (2016).
- Volpicelli-Daley, L. A., Kirik, D., Stoyka, L. E., Standaert, D. G., Harms, A. S. How can rAAV-α-synuclein and the fibril α-synuclein models advance our understanding of Parkinson's disease. J. Neurochem. 139, 131-155 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon