Method Article
소 대형의 강력한 셀 모델로 기본 신경 하 Microsomes 관련 알파 synuclein 집계의 외 인 관리
요약
이 프로토콜의 목표는 vivo에서집계 하는 알파 synuclein의 형성을 복제 하는 셀 기반 시스템을 제공 하는입니다. 세포내 알파 synuclein 포함은 국제화에 의해 주 뉴런에 시드는 고 세의 전파 관리 네이티브 microsomes 관련 알파 synuclein 집계 병 알파 synuclein 유전자 변형 쥐에서 분리.
초록
년, 셀 문화 흠도 불용 성 알파 synuclein (αS)의 형성을 복제의 무 능력 αS 집계에서 파 킨 슨 병 (PD)의 연구에 큰 제한 되었습니다. 최근, 질병 αS 유전자 변형 쥐 또는 PD 환자에서 뇌 추출의 외 인 접종을 통해 새로운 동물 모델의 개발 αS 집계의 더 적절 한 셀 모델의 가능성을 새로운 희망을 부여 하고있다. 불행히도, 셀 문화에 관해서, 원시 뇌 추출의 쥐에서 성공적으로 입증 되지 않은 그리고 exogenous 집계의 선택의 소스는 아직 생체 외에서 preformed αS 소.
매우 독성 αS 종 유전자 변형 생쥐의 병에 걸리는 지역에서 고립의 네이티브 microsomes 관련 된 αS, 외 인 관리를 통해 기본 신경 세포에서 세포내 αS 포함의 형성을 유도 하는 방법을 개발 했습니다. Microsomes 소포와 연결 되는 αS의이 분수 효율적으로 내 면화 하 고 세포내 포함 집계 및 phosphorylated αS에 대 한 긍정적인의 형성을 유도 한다. 생체 외에서에 비해-재조합 αS, 우리의 방법에서에서 만든 미리 형성한 소 빠릅니다 및 정통 αS 집계로 만든 병원 성 시드 보장 더를 흉내 낸 PD의 질병 동물 모델에서 추출의 종류 밀접 하 게 포함에 비보를 얻을. 그 결과, 조직 αS 포함 풍부한의 가용성은 필수입니다.
우리 믿고이 방법은 αS 집계 및 비보에 관련된 세포 이상의 미세한 측면을 연구 하는 다양 한 셀 기반 모델을 제공 합니다 더 정확 하 고 정교한 세포의 창조를 위한 출발점이 될 것입니다. PD의 패러다임입니다.
서문
알파 synuclein (αS) 배치할 포함의 축적은 Parkinson의 질병 (PD)와 알파-synulceinopathies1의 유명 하 고 중요 한 기능입니다. 불행히도, 동물 모델 유도 집계 단계 단백질 소2의 형성에 필요한 충분 한 셀룰러 및 생 화 확 적인 환경을 제공할 수 있습니다, 하는 동안 복제 복잡 한 Lewy 몸 (파운드)의 형성-같은 집계 세포 배양에서 어렵고 도전 이다입니다.
여기는 αS 포함, 유사한 동물 모델 및 PD 환자, 경작된 한 세포에 고립 된 두뇌 마우스 기본 뉴런을 사용 하 여 얻은 단백질 집계의 형성을 유도 하는 방법에 설명 합니다. 우리의 프로토콜 αS 증상 유전자 변형 (Tg) 마우스에서 마우스 hippocampal 또는 대뇌 피 질의 기본 신경 격리 microsomes 관련 된 αS의 외 인 관리를 기반으로 합니다. 이 메서드는 αS 독성 종, 문화 매체에 추가 내 면 되 고 성숙 αS-긍정적인 집계3,4,의 형성을 유발 수 있습니다 확산 및 전파 능력의 활용 5,6,,78.
원래, 셀 문화에서 αS 소의 형성을 얻기 위해 표준 방법 일반 transfection 프로토콜 또는 중재 바이러스 감염9통해 해당 αS cDNA의 overexpression에 근거 했다. 두 번째 프로토콜 감염 에서에서 24-48 h에 고 분자량 (HMW) 종류를 포함 하 여 불용 성 소의 형성에 주도 동안 파운드 같은 αS를 얻는 첫 번째 경우 집계 뜻밖, 낮은 효율, 그리고 셀 형식에 의존 10. 이러한 방법의 형성 아마는 과도 한 때문 이었고 αS 단백질 금액 집계를 지시 하는 αS 나 란의 병 적인 변환 보다 불용 성 되는 불균형. 대신, 우리는 여기에서 제시 하는 기술은 αS 식 수준을 변경 하지 않습니다 하지만 세 소의 국제화로 인해 광범위 한 단백질 집계를 유도. 또한, 외 인 소의 관리를 통해 αS의 형성 하는 과정 일 또는 주 되 철저 한 공부 시간 경과 패션에 αS 포함 형성의 초기 및 중간 단계를 필요로 하 고 에 세포 생화학 변화 상관. 따라서, 우리의 방법은 현미경으로 세포 이상에 관하여 αS fibril 형성 연구에 도움이 되는 αS 집계의 휴대 전화 모델을 만드는 유용한 응용 프로그램입니다.
또한 원시 뇌의 병 αS (Tg) Transgenic 쥐11,에서 추출 하는 있지만12 또는 인간의 PD 두뇌6,13 은 Tg 또는 야생-타입 (WT) 동물, 응용 프로그램에서 αS 증 착을 유도 할 수 세포 배양에 동일한 절차의 가능성이 낮은 양의 집계에서 사용 하는 샘플 및 네이티브 αS 독성 종14분리 표준 절차의 부족 때문에 성공적으로 수 입증 되지 않았습니다. 이 때문에, 생체 외에서 미리 형성 된 소 (PFFs) αS의 지금까지 셀에 αS 포함의 유도 대 한 선택의 집계 소스 그리고 동물 모델3,4,6,7 ,,1516. 그러나 우리의 프로토콜,, 우리 αS microsomes 관련 집계 종 αS Tg 마우스에서 분리 세포내 파운드 같은 αS 포함 주 뉴런에서의 축적을 일으킬 수 있는 효율적으로 보여준다.
우리 실험실에서 αS microsomes 관련 집계 종 [Prp 인간 A53T αS Tg 마우스, g 2-317] 마우스 프리온 단백질 (PrP) 발기인의 통제 인간 A53T αS 유전자 표현 질병 안내 쥐의 척수 (SpC) 조직 으로부터 격리 됩니다. 이러한 마우스 표시 중앙 신경 시스템에 강력한 모터 역 기능 및 포함의 형성을 포함 하는 연령에 따라 신경 표현 형의 만든 phosphorylated, ubiquitinated, 및 나이의 9 달 후에 시작 하는 불용 성 αS. 모터 부전 나타나면, phenotype 마비, 후부 사지에서 시작 2-3 주에 죽음에 이르게 하는으로 급속 하 게 진화. ΑS의 축적 질환 징후를 평행 시킨다. 마우스 모터 장애의 발병에 희생 SpC, 뇌 줄기 및 소 뇌에 αS 집계의 강력한 학위를 보여줍니다. 마비 마우스를 희생 하는 설정 할 때까지 기다릴 필요가 없습니다입니다. Presymptomatic 마우스 모터 역 기능을 표시 하지 않는 9 개월 된 동물에서 가져옵니다.
프로토콜
WT 및 Tg 동물의 사용 승인 되었고 전체 국가 의해에 실험 동물 복지 및 실험 (EEC 위원회 지시 86/609, 1987 년 12 월 월 12 일 및 지침 2010/63/EU, 22 9 월 2010)에 대 한 국제 법률 준수. 이 문서에 설명 된 모든 프로토콜의 우리의 기관 동물 관리 지침을 따르십시오.
1. 격리 병 A53T αS Tg 마우스에서 Microsomes 관련 된 αS의
- 250 m m 자당, 20 mM HEPES, 10mm KCl, 1.5 m m MgCl2, 2 mM EDTA, 그리고 1 x 인산 가수분해 효소/효소-억제제의 구성 되는 균질 버퍼를 준비 합니다. 얼음에 버퍼를 유지 합니다.
- 균질 신선한 또는 테 플 론을 사용 하 여 차가운 균질 버퍼 (w/v) 양의 유 봉 균질 화기, 10 15의 치기와는 1시 10분에서 조직을 냉동.
- Microcentrifuge 튜브 및 냉장된 원심 분리기를 사용 하 여 결과 펠 릿 (P1)에 핵 및 손상 되지 않은 세포를 제거 하는 4 ° C에서 10 분 1000 × g에서 원심 분리기를 초기 homogenate (1-2 mL)를 전송 합니다. P1 삭제 합니다.
- 깨끗 한 microcentrifuge 튜브를 상쾌한 (S1)를 전송 및 S1 냉장된 원심 분리기를 사용 하 여 두 번째 상쾌한 (S10)과 펠 릿 (P10) 4 ° C에서 20 분 동안 10000 × g에서 원심.
참고: P10 원유 막 펠 릿 미토 콘 드리 아 및 synaptosomes를 포함 하는. P10 삭제 합니다. - 폴 리 탄산염 병에 상쾌한 (S10)를 전송 (> 1 mL) 및 S10는 ultracentrifuge와 고정된 각도 터를 사용 하 여 4 ° C에서 1 시간에 대 한 100000 × g에서 원심 (90 Ti).
참고:는 상쾌한 순수 cytosol 분수는 펠 릿, P100, αS microsomes 관련 된 집계를 포함 하는 동안. - 균질 버퍼의 500 µ L로 P100 펠 릿 resuspend 깨끗 한 microcentrifuge 튜브 및 냉장된 원심 분리기에 4 ° C에서 20 분 동안 10000 × g에서 원심 분리기 P100 전송.
- 삭제는 상쾌한 고 P100 균질 버퍼의 100 µ L 함께 resuspend.
참고:이 분수는 αS microsomes 관련 된 집계. - 2에 대 한 샘플을 sonicate 얼음 [설정된 출력 전력 1 와트 (RMS)]에 대 한 s. -80 ° c.에 샘플 저장
- 다음날, BCA 분석을 사용 하 여 단백질 양을 확인 합니다.
2. 서쪽 오 점
참고: αS microsomes 관련 된 집계의 생 화 확 적인 특성은 서쪽 오 점 하 여 평가 됩니다.
- 수직 전기 기구에 그라데이션 4-20% 트리 스-글리신 polyacrylamide 젤을 캐스팅.
- Microsomes 관련 αS 분수, 변성 샘플 버퍼에 녹아의 1 µ g를 로드 합니다.
- 다른 우물에서 5 µ L의 단백질 표준 마커를 로드 합니다.
- 100 V는 트리 스/글리신/SDS 단백질 마커 젤의 끝에 도달할 때까지 버퍼를 실행에 젤을 실행 합니다.
- 기본적인 탄산 버퍼를 사용 하 여 니트로 막 단백질을 전송 (10 m m NaCO3, 3 m m NaHCO3, 20% 메탄올) O/N 4 ° C에서, 200 mA, 상수.
- 차단 막 PBS 비와 실시간에서 30 분 동안 궤도 통에 5% 비 지방 건조 우유와 계면 활성 제 0.05% (PBS-T)
- 간단히, PBS-t.로 막 씻어
- Syn-1 (1:5, 000) 또는 pSer129 αS 항 체 (1:5, 000) PBS-T, O/N 궤도 통에 4 ° C에서에 2.5% 비 지방 건조 우유에 막 품 어.
- 10 분 막 궤도 셰이 커에 PBS-T와 RT에 씻는 다.
- 반대로 마우스 또는 반대로 토끼 HRP 활용 된 이차 항 체 (1:3, 000) 2.5% 비 지방 건조 우유 PBS-T에서 1 h 실시간에 대 한에 막 품 어
- 10 분 막 궤도 셰이 커에 PBS-T와 RT에 씻는 다. 3 배를 반복 합니다.
- 일반 화학 키트를 통해 신호를 얻을.
3. 기본 신경 문화
참고: 기본 신경 문화 WT 신생아 (P0) 마우스 해 마 나 피 (C57BL/6 호선)에서 준비 되었다. 원심 분리 단계 마이너스 전체 절차 후드를 셀 문화, 메 마른 조건에서 수행 됩니다.
- 실시간에서 적어도 12 h 65% 질 산 솔루션으로 coverslips (18 밀리미터 Ø) 치료
- 질소 산을 제거 합니다. Coverslips 두 번 PBS 10 배와 함께 여러 번 증류수 린스.
- 24 잘 요리에 coverslips를 삽입 하 고 폴 리-D-리와 코트 (멸 균 증류수 또는 PBS 1 0.1 mg/mL x) 37 ° c.에 1 시간에 대 한
- 폴 리-D-라이 신을 제거 하 고 증류수로 세 번 coverslips 세척. 필요할 때까지 4 ° C에서 그들을 저장 합니다.
- 잘린 여 마우스 강아지를 안락사 하 고 시체에서 머리를 분리. 요리에 머리를 놓고 부드럽게 피부를 해 부 합니다.
- 좋은 위를 사용 하 여 두뇌의 기지에서 절 개 하 여 두개골을 엽니다. 두개골의 두 반쪽을 분리 하 고 신중 하 게 그들을 제거 합니다.
- 집게를 사용 하 여 기초에서 두뇌를 꼬집어 하 고 피 질과 해 마를 분리 합니다. 1% 페니실린/스를 포함 하는 행 크의 균형 소금 솔루션 (HBSS) 매체를 포함 하는 두 개의 별도 요리에 그들을 전송.
- 각 동물에 대 한 3.6-3.7 단계를 반복 합니다. 전체 과정은 30-45 분 이상 걸리지 않을 다는 것을 유의 하십시오.
- 수집 된 조직 말하다 고 HBSS 매체 포함 된 트립 신 0.1%의 10 mL와 함께 두 50 mL 원뿔 튜브 (해 마)와 피 질에 대 한 하나에 그들을 전송. 37 ° c.에 7 분 물 목욕에서 품 어
참고: 아무 동요는 필요 합니다. - 차단 trypsin 활동 10% 태아 둔감 한 혈 청 (FBS)과 10 µ g/mL DNase는 homogenate에 포함 된 DMEM의 1 mL를 추가 합니다.
- 원심 분리기에 RT에 5 분 동안 200 × g에서 결과 천연된 조직 하 고는 상쾌한을 제거 합니다.
참고: 펠 릿 조직에서 해 부 셀을 나타냅니다. - 2 %B27, 2mm 글루타민, 포도 당 6 mg/mL, 10%를 포함 하는 도금 매체에 셀 resuspend FBS, 12.5 µ M 조미료 및 10 µ g/mL gentamicin.
- 플레이트 해리 폴 리-D-리 신 coverslips 비율에 따라 24 잘 접시에서에 뉴런: 1 피/12 우물과 1 해 마/6 웰 스, 잘 당 약 150000/200, 000 셀에 결과. 37 ° c.에 인큐베이터에서 세포를 유지
- 하루 후 (하루에서 생체 외에서DIV 1), 2 %B27, 10 µ g/mL gentamicin 2mm 글루타민을 포함 하는 매체 도금 매체를 바꿉니다.
- DIV 2에서 매체의 1/3를 제거 하 고 48 h glial 오염 감소를 위한 2.5 µ M 시 토 신 arabinoside 포함 된 신선한 매체의 1/3를 추가 합니다.
- 37 ° C에서 신경 세포를 유지 하 고 매체의 절반 3 일 마다 교체.
4. 신경 치료
참고: 치료 DIV 7에서 수행 되었습니다. 모든 단계는 무 균 조건에서 세포 문화 후드 아래 수행 됩니다. DIV 7에서 대뇌 피 질의 신경 문화 밀도의 예는 그림 1에서 그림입니다.
- ΑS microsomes 관련 집계 희석에 대 한 원래 균질 버퍼를 사용 하 여 1 µ g / µ L 솔루션을 위해 3 다른 질병 안내 쥐의 척수에서 얻은 풀.
- 매체의 1/3를 제거 하 고 2 %B27, gentamicin와 2 mM 글루타민 x 1 포함 된 신선한 매체 부드럽게 바꿉니다.
- 셀 중간에 풀링된 microsomes 관련 된 αS의 1 µ g을 추가 합니다. 37 ° c.에 인큐베이터에서 뉴런을 반환
- 1 주, 3 일 마다 신선한 매체의 1/3를 추가 합니다. 매체를 대체 하지 않습니다. 그냥 추가.
- 1 주일 후 치료, 매체의 1/3를 제거 하 고 2 %B27, 10 µ g/mL gentamicin 2mm 글루타민을 포함 된 신선한 매체 부드럽게 바꿉니다. 3 일 마다 반복 합니다.
- 신경 치료 (DIV 21)의 2 주 후 수정.
5입니다. 면역 형광 검사
- PBS에서 2 %paraformaldehyde 뉴런을 수정 1 x와 5% 자당 해결책 없이 떨고, RT에 15 분 동안 화학 물질에서 증기 후드.
- 담합 솔루션을 제거 합니다. 간단히, x, 3 회 PBS 1 씻어.
참고: 기본 신경 스틱을 하지 않는 확실히을 폴 리 리 신 coverslips 때문에 부드럽게 세척의 모든 단계를 수행 합니다. - PBS 1 비 계면의 0.3% 신경 세포를 permeabilize 실시간 5 분에 대 한 x
- 간단히, x, 3 회 PBS 1 씻어.
- 3%와 뉴런을 품 어 PBS 1에서에서 FBS x RT, 궤도 통에 불특정 바인딩 사이트 차단에서 30 분.
- 3%에 용 해 하는 적절 한 기본 항 체와 신경 세포를 품 어 PBS 1에서에서 FBS x, O/N 궤도 통에 4 ° C에서.
참고: syn303 (1:1, 000), 마우스 αS (1: 200), pser129-αS (1:1, 000)와 타우 (1:10, 000) 항 체 사용 되었다. - X, 3 회 PBS 1 가진 항 체 솔루션 및 세척, 짧게, 제거 합니다.
- 3%에 녹아 적절 한 형광 이차 항 체와 신경 세포를 품 어 FBS 궤도 셰이 커에 어둠 속에서 RT에 1 시간에 대 한 PBS에.
- X, 3 회 PBS 1 가진 항 체 솔루션 및 세척, 짧게, 제거 합니다.
- DAPI 솔루션 뉴런을 얼룩 (0.1 µ g/mL PBS 1에에서 x) 궤도 셰이 커에 어둠 속에서 RT에서 15 분.
- X, 3 회 PBS 1 가진 항 체 솔루션 및 세척, 짧게, 제거 합니다.
- Antifade 설치 매체를 사용 하 여 슬라이드에 coverslips를 탑재 합니다.
결과
프로토콜에 따라 위에서 설명한 그림 2에 요약, 우리 3 병 A53T αS Tg 쥐 (그림 3)에서 αS microsomes 관련 집계를 정화. Microsomes는 조 막 펠 릿 분수 바인딩과 그물, 골, 작은 시 냅 스 소포를 포함 하는. 다른 부분에 비해 microsomal 펠 릿의 순수성의 정도 특정 세포 기관이 마커18를 사용 하 여 평가 이전 되었습니다.
절연, 일단 αS의 생 화 확 적인 특성은 변성 SDS-페이지, Syn-1 또는 떠들고 129 (pSer129-αS) 항 체에 phosphorylated αS 부 화 뒤를 통해 평가 됩니다. Presymptomatic (PreS)와 일치 하는 나이 비-Tg (nTg) 쥐, microsomes αS 집계 아픈 마우스 공동 침전에서 격리에 비해. Microsomes 관련 된 αS 종 αS 집계 HMW 세제 저항 종, 떠들고 12919 와 C 인 산화의 축적 등의 일반적인 기능을 표시-N 맨끝 파편 (의 전체 특성에 대 한 잘립니다 및 αS microsomes 관련 집계 기준18,,2021참조). 이들은 기본 사항 단위체 αS 않습니다 하지 얻을 효율적으로 내 면 이후 αS 증 착7,,1522를 유도 하지 않습니다. 그것은 P100 펠 릿 세포에 유해한 수 있기 때문에 resuspend를 이온 (비 이온) 어떤 세제를 사용 하지 해야 합니다. 또한, 샘플 변화를 방지 하기 위해 세 가지 다른 병에 걸린 쥐에서 αS microsomes 관련 집계 풀링됩니다 신경 치료에 대 한.
관리의 풀링된 microsomes 관련 αS 병 A53T 쥐에서 피 질 또는 hippocampal 신경 세포의 배양에 1 µ g의 αS 포함와 같은 집계 관련 αS 항 체에 대 한 긍정적인의 시간에 따른 형성 유도 Syn303 (그림 4, 5) 또는 pser129-αS (그림 5). 2 일 후 (2d) 치료 이러한 집계 나중 시간 지점에서 더 풍부한 될 것입니다 작은, 뿌려 진 puncta로 나타납니다. 2 주 후, αS 포함 긴 닮 고 구슬 모양의 구조를 무 겁 게 성숙 neurite 패턴 부분적으로 공동 연 접과 지역화는 신경 문화에 걸쳐 확산 neurites 마커 (그림 5). 때때로, 새로 형성된 된 αS 포함 공동 지역화 및 셀 소마 얼룩 또는 전체 프로세스를 닮은 괴 neurites 커버를 볼 수 있습니다.
ΑS microsomes 관련 집계 분수 신경 문화에서 효율적으로 확산 될 수 있습니다, 그들의 양을 세밀 하 게 신경 도금 (그림 1)의 수를 조정 해야 있다. 사실, 권장된 비율, microsomes 관련 집계의 µ g을 초과: 뉴런의 숫자 microsomes 관련 된 αS의 부족 한 금액으로 이어질 것입니다 하는 동안 며칠 내에 (그림 6), 조 세포 죽음을 유도 것 이다는 무슨 유사한 치료 2 주 후 포함의 부족 및 감소 된 수는 이전 시간 포인트(그림 4)에서 얻은 했다.
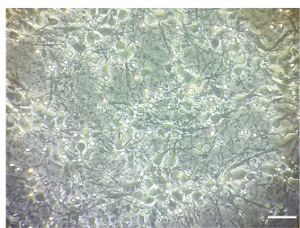
그림 1 . 대뇌 피 질의 신경 문화입니다. 대뇌 피 질의 신경 문화 사업부 7에서 밀도 표시 하는 대표 이미지. 이미지는 거꾸로 가벼운 현미경, 10 X 목표와 함께 찍은. 눈금 막대 = 100 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
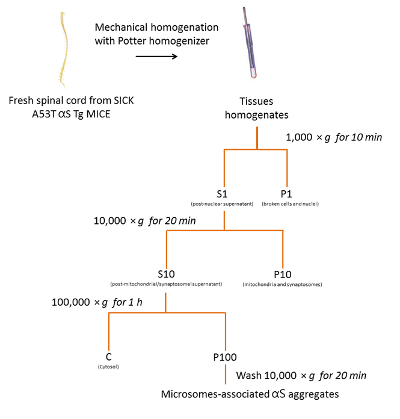
그림 2 . Microsomes 관련 된 αS의 절연 마우스 SpC에서에서 집계. Microsomes 관련 된 αS의 정화 프로토콜의 순서도 병에 걸린 쥐의 SpC에서 집계합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
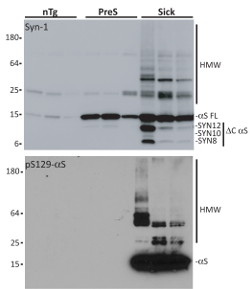
그림 3 . 질병, presymptomatic A53T αS 안내 및 nTg 쥐에서 microsomes 분수의 절연. 서쪽 오 점 분석 보여주는 정화 αS microsomes 관련 된 집계에서 3 병 (병), 절연 presymptomatic (PreS)와 일치 하는 세 nTg 쥐. 병에 걸린 생쥐는 presymptomatic 동물 건강 한 A53T는 αS 포함의 축적을 포함 하 여 모터 및 신경 장애를 나타내는 A53T αS Tg 마우스 αS 표시 되지 않는 나이 아직 어떤 αS 병리학의 9 개월의 Tgs 관련 표현 형. nTg 마우스 αS transgene를 수행 하지 않는 및 따라서 αS를 개발 하지 않는 병에 걸린 쥐의 littermates 유발 병 리는. 각 정제 분수의 1 µ g 변성 SDS 페이지에서 실행, 니트로 멤브레인에 전송 되었고 Syn-1 또는 pSer129 αS 항 체와 얼룩이. Microsomes 분수 격리 아픈 쥐에서 포함 된 HMW 세제 저항 αS 집계 했다 떠들고 129에 phosphorylated 고 C만-및 N 맨끝 잘림. 이 그림에서 콜라 외 적응 되었습니다. 18. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
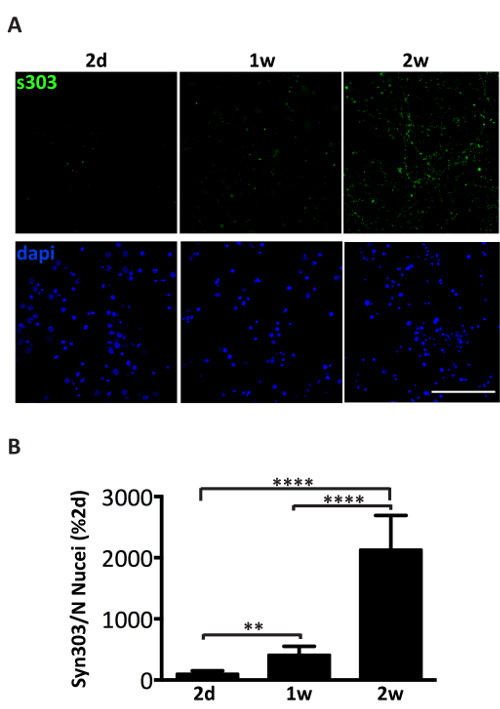
그림 4 . 시간에 따라 microsomes 관련 된 αS의 관리 후 αS 증 착의 감 응 작용. (A) 기본 hippocampal 신경 세포의 면역 형광 검사 치료 1 µ g의 microsomes 관련 αS 분수 3 다른 병에 걸린 쥐에서 풀링된 집계. 뉴런 일 2 고정 했다 (제 2), 1 주 (1w) 또는 처리와 syn303와 immunostained의 2 주 (2w) (S303, 1:1000), 항 체에 대 한 특정 산화 및 αS를 집계. 셀은 DAPI와 counterstained 했다. 공초점 이미지 공초점 현미경, 63 X 목표 스캐닝 레이저를 사용 하 여 찍은 사진. 눈금 막대 배경 빼기 후 50 µ m (B) 정량 분석 총 fluorescence, =, 이루어졌다 이미지 J 소프트웨어의 입자 수 플러그인을 사용 하 여. 값 필드 (DAPI 카운트) 핵의 수에 대 한 표준화 되었고 2D에서 S303 형광 신호에 대 한 비율로 표시. 값은 평균 ± SD로 부여 됩니다 (n = 5). * * p < 0.001, * * * p < 0.00001, 단방향 ANOVA, 피셔의 LSD 게시물-특별 시험 다음. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
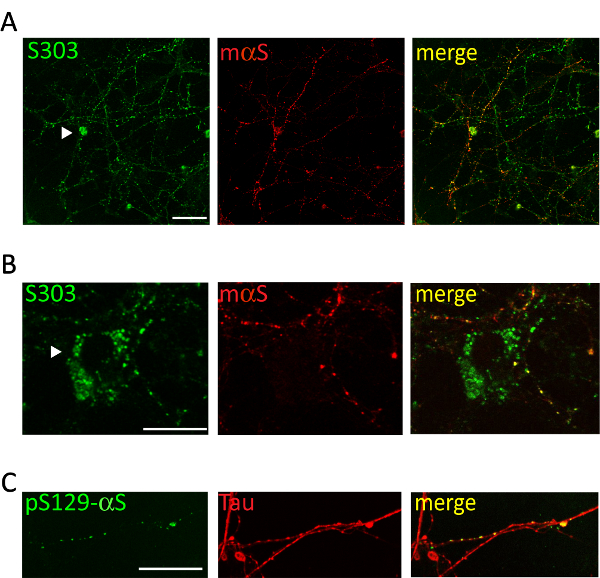
그림 5 . 대뇌 피 질의 neurites 네트워크와 세포내 αS 포함 colocalize. 대뇌 피 질의 뉴런의 대표적인 confocal 이미지 치료 질병 안내 생쥐에서 얻은 αS microsomes 관련 된 집계. 후 2 주 치료 뉴런의 고정 되었고 이중 집계 특정 항 체 [S303 (A, B) 또는 pser129-αS, 1:1,000 (C)]와 [마우스 αS, 1: 200 (A, B) 또는 타우, 1:10,000 (C)] neurite 마커 스테인드. 공동의 형광 신호 라벨 부분 공동 지역화 neurites 네트워크와 새로 형성된 된 αS 구슬 모양의 구조 설명. 때때로 αS 포함 (A, B, 화살촉) 신경 소마 내 축적. 스택된 이미지 confocal 현미경, 63 X 목표 스캐닝 레이저와 함께 인수 했다. 눈금 막대 = 50 µ m. 이 그림에서 콜라 외 수정 되었습니다. 20. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
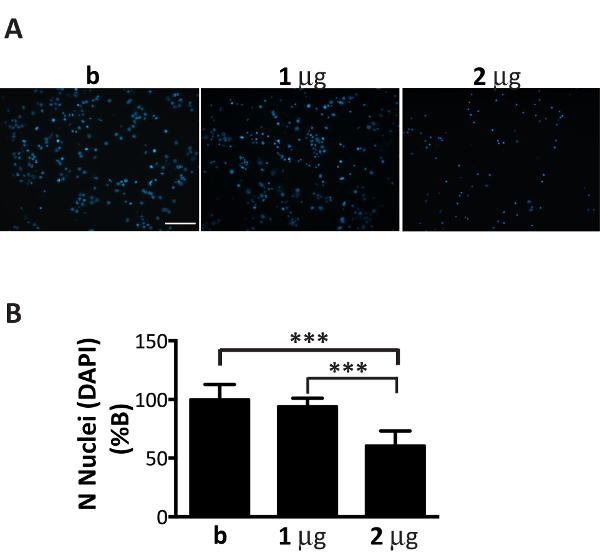
그림 6 . Microsomes 관련 된 αS의 차선 금액의 추가 신경에 독성 이다. 셀 죽음에 이르게 DAPI microsomes 관련 된 αS의 농도 증가 함께 치료 하는 뉴런의 얼룩. (A) 대뇌 피 질의 신경 치료 1, 2 µ g microsomes 관련 된 αS의 병에 걸린 쥐에서 추출 또는 포함 하지 않는 유일한 버퍼 (B)를 집계 하 고 DAPI 스테인드. 형광 이미지는 20 X 목표를 사용 하 여 피 형광 현미경으로 인수 했다. 눈금 막대 = 100 µ m.(B) DAPI 긍정적인 세포 이미지 J 소프트웨어를 사용 하 여 계산 했다. 그래프는 신경 미디어에 추가 된 microsomes 관련 된 αS의 농도 증가 함께 핵의 수에 있는 감소를 보여 줍니다. 값 b의 %로 표현 되 고 평균 ± SD로 받는다 (n = 5), * * * p < 0.0001, 단방향 ANOVA, 피셔의 LSD 게시물-특별 시험 다음. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
우리를 αS Tg 동물 모델에서 격리 순화 microsomes 관련 된 αS의 추가 통해 WT 쥐에서 신경 주 문화 두뇌 파생 된 αS 포함의 형성을 받는 방법을 설명 합니다.
이 프로토콜의 중요 한 단계는 다음: αS microsomes 관련 된 집계/뉴런의 µ g과 αS의 소스 비율. 그것은 이후 조 세포 죽음 또는 너무 부족 한 세포내 집계 이어질 수 있는 최적이 조건에서 작업 αS microsomes 관련 된 집계/신경의 수의 µ g의 비율을 최적화 하는 중요 한 결과 세션 같이 (참조는 대표적인 결과 섹션)입니다. 이 때문에, 그것은 매우 치료를 시작 하기 전에 신경 문화 사업부 7 ( 그림 1참조)에서 밀도 평가 하는 것이 중요. 또한, αS 집계 병 αS 안내 쥐, 즉에서 정화 해야 합니다. 누적 된 동물 모델에서 파운드 같은 포함 특징 phosphorylated 세제 불용 성 αS HMW 소.
이 프로토콜에 대 한 가능한 수정에 대해 조직, 냉동 또는 신선한, 어떤 microsomes 격리 될 수 있습니다 및 시작에서. 우리 αS 불 용해성의 높은 내용 때문에 SpC의 안내 마우스를 사용, 지역 αS 집계에 있는 높은 콘텐츠를 프로토콜을 어떤 조직에서 microsomes 관련 집계를 분리 하 적당 하다. 동결의 microsomes 관련 된 집계를 집계 라기보다정화 단계를 영향을 주지 않으므로 냉동된 샘플도 사용할 수 있습니다. 이 프로토콜은 microsomes에서 얻기를 위해 적합 한 조직에 대 한 권장된 시작 무게는 약 100-150 mg, 원료 (최대 중량 제한 없음)의 50 밀리 그램으로 낮은. 그러나 100 mg 보다 낮은 금액의 경우, 적합 한 균질 비율 있을 것입니다 1:20 (w/v) 적어도 1 mL의 표면에 뜨는 S10 ultracentrifuge 강 수에 대 한 폴 리 탄산염 병에 로드 하는 순서. 사실, 1 mL 보다 작은 볼륨을 로드 튜브 및 샘플 손실의 붕괴 될 수 있습니다. 더 희석된 상쾌한 이어질 것입니다 균질 볼륨 증가 하지만 microsomal 펠 릿의 농도 영향을 받지 유지 됩니다.
이 프로토콜의 한계는 비효율적인 크로스-시드 αS 포함 최근 보고 된 인간 근원의 αS PFFs의 사례 관리에 마우스 αS PFFs24반대 murine 신경 문화 형성에 염려 한다. 다른 αS 변종 또는 다른에서 소의 관리의 경우 microsomes 관련 집계의 양을 정밀 하 게 조정 하는 것이 좋습니다 murine 문화에 주어진 세 αS 소의 양을 늘리면이 문제를 무시할 수 있습니다, 이후 우리가 설명 보다 마우스 신경 문화 종.
문화 미디어에 추가 하는 외 인 αS 집계는 서로 다른 소스에서 수 있습니다. ΑS PFFs 체 외에서 세포 배양, 기본 신경 세포 및 동물 모델3,7,,815에 세포내 αS의 시드 템플릿으로 이전 사용 되었습니다. 어디 αS microsomes 관련 집계는 몇 시간에서 고립 될 수 있다 우리의 방법에 비해 PFFs의 형성은 길고 힘 드는, purifications, αS confomations25 집계 확인 하기 추가 분석 실험에 의해 다음의 여러 단계를 요구 . 또한, PFFs 박테리아 표현 인간 또는 마우스 αS에서 취득 되 고, 즉 부족 posttranslational 수정, 진핵생물의 전형적인 수 다른 conformations와 현재 선택적 시드 병원 성 속성에 따라 nucleation 프로토콜 (예: 리본 vs 소)5,8 다른 결과 및 결론에 따 랐 다. 대신, αS 집계에 vivo에서 정화의 단일 관리 동물 모델 및 PD 환자에서 αS 포함의 형성 과정을 밀접 하 게 흉내 낸 더 본격적인 병원 서식 파일의 전송을 보장 합니다.
이 기술의 미래 응용 프로그램,으로 우리 믿는 것이 프로토콜 사용할 수 있습니다 성공적으로 PD 환자의 뇌 또는 다른 αS Tg 동물 모델에서 αS 병원 성 종자를 격리 하 병에 걸리는 지역에서 microsomes 격리 된 풍부한 αS에 제공 흠입니다.
우리의 지식, vivo에서 PD 모델 시드 αS 포함 주 뉴런에서의 형성을 얻기 위해 서식 파일으로 사용할 수에서 αS의 기본 독성의 정화를 허용 하는 첫 번째 방법입니다.
우리는이 방법은 매우 다목적 이며 αS 집계 및 셀 이상에 미치는 영향의 다양 한 측면을 연구 하는 뛰어난 셀 기반 모델을 제공할 수 있습니다 믿습니다. ΑS 포함 형성 대표 배양된 세포에서 복제 하기 어려운 복잡 한 과정, 때문에 우리는이 모델 급성 병원 성 기계 장치, 만성 및 더 정교한 식별 하드에 큰 통찰력을 제공할 것입니다 희망 시스템은과 같은 동물 모델은.
공개
저자는 공개 없다.
감사의 말
이 작품 경력 재통합 부여 제도 (젊은 연구원을 위한 RLM 프로그램)를 통해 대학과 연구 (MIUR)의 이탈리아 정부에 의해 지원 되었습니다 학교 어쩔 레에서. 미네소타의 대학, 미국에서 교수 마이클 리는 Prp 인간 A53T αS Tg 마우스는 집계는 격리를 제공 하는 감사 합니다.
자료
| Name | Company | Catalog Number | Comments |
| Sucrose | Sigma-Aldrich | 84097-1KG | |
| Hepes | Sigma-Aldrich | H0887-100ML | 1M pH=7-7.6 |
| EDTA | Sigma-Aldrich | 0390-100ml | pH=8 0.5M |
| MgCl2 | Sigma-Aldrich | M8266-100G | |
| NaCO3 | Sigma-Aldrich | S7795-500G | |
| NAHCO3 | Sigma-Aldrich | S5761-500G | |
| Methanol | Sigma-Aldrich | 322415-6X1L | |
| KCl | Sigma-Aldrich | P9541-500G | |
| cOmplete Mini | Roche | 11836170001 | protease inhibitor |
| PhosStop | Roche | 4906837001 | phosphatase inhibitor |
| BCA Protein Assay Kit | Euroclone | EMPO14500 | |
| Criterion TGX 4-20% Stain Free, 18 wells | Biorad | 5678094 | |
| Supported Nitrocellulose membrane | Biorad | 1620097 | 0.2 μm |
| Blotting-Grade Blocker | Biorad | 1706404 | Non-fat dry milk |
| SuperSignal West Pico Chemiluminescent Substrate | Termo Fisher Scientific | 34077 | |
| Nitric acid | Sigma-Aldrich | 1004411000 | 65% |
| Glass Coverslips | Termo Fisher Scientific | 1014355118NR1 | 18 mm x |
| Poly-D-Lysine | Sigma-Aldrich | P7280 | |
| Hank's Balanced Salt Solution | Termo Fisher Scientific | 14170-500 mL | |
| Penicillin/Streptomycin | Termo Fisher Scientific | 15140122 | 10,000 U/mL, 100 mL |
| Dulbecco’s Modified Eagle’s Medium | Termo Fisher Scientific | D5796-500 mL | |
| Trypsin-EDTA | Termo Fisher Scientific | 15400054 | 0.50% |
| B27 Supplement | Termo Fisher Scientific | 17504044 | 50X |
| Glutamax | Termo Fisher Scientific | 35050-038 | 100x |
| DNAse | Sigma-Aldrich | D5025 | |
| Fetal bovine serum | Euroclone | EC50182L | |
| Glutamate | Sigma-Aldrich | 1446600-1G | |
| Gentamicin | Termo Fisher Scientific | 15710 | 10 mg/ml |
| Neurobasal Medium | Termo Fisher Scientific | 10888-022 | |
| Cytosine arabinoside (AraC) | Sigma-Aldrich | C3350000 | |
| VECTASHIELD antifade mounting medium | Vector Laboratories | H-1000 | |
| DAPI | Termo Fisher Scientific | 62247 | |
| 90 Ti rotor | Beckman | N/A | Ultracentrifuge rotor |
| Optima L-90K Ultracentrifuge | Beckman | N/A | |
| Syn-1 antibody, clone 42 | BD Biosciences | 610786 | anti-mouse WB: 1:5000 |
| Syn303 antibody | BioLegend | 824301 | anti-mouse IF: 1:1000 |
| Tau antibody | Synaptic Systems | 314 002 | anti-rabbit IF: 1:10,000 |
| pser129-αS antibody | A gift from Fujiwara et al, reference 19 | anti-rabbit WB: 1:5000 | |
| pser129-αS antibody | Abcam | ab51253 | anti-rabbit IF: 1:1000 |
| Mouse αS (D37A6) XP | Cell Signaling | 4179 | anti-rabbit IF 1:200 |
| Alexa fluor 555-conjugated anti-rabbit antibody | Termo Fisher Scientific | A27039 | |
| Alexa fluor 488-conjugated anti-mouse antibody | Termo Fisher Scientific | A-11029 | |
| Microson XL-2000 | Misonix | Sonicator | |
| Ultra Bottles (Oakridge Bottles), PCB, 16x76mm, Assembly, Noryl Cap, Beckman-type | Science Service EU | S4484 | Ultracentrifuge tubes |
| AXIO Observer Inverted Light Microscope | Zeiss | N/A | |
| TCS SP2 laser scanning confocal microscope | Leica | N/A | |
| Inverted epi-fluorescence microscope | Nikon | N/A | |
| Triton x-100 | Sigma-Aldrich | X100-500ML | Nonionic surfactant |
참고문헌
- Goedert, M., Spillantini, M. G., Del Tredici, K., Braak, H. 100 years of Lewy pathology. Nat. Rev. Neurol. 9, 13-24 (2012).
- Visanji, N. P., et al. α-Synuclein-Based Animal Models of Parkinson's Disease: Challenges and Opportunities in a New Era. Trends Neurosci. 39, 750-762 (2016).
- Luk, K. C., et al. Pathological α-Synuclein Transmission Initiates Parkinson-like Neurodegeneration in Nontransgenic Mice. Science. 338, 949-953 (2012).
- Rey, N. L., Petit, G. H., Bousset, L., Melki, R., Brundin, P. Transfer of human α-synuclein from the olfactory bulb to interconnected brain regions in mice. Acta Neuropathol. (Berl). 126, 555-573 (2013).
- Guo, J. L., et al. Distinct α-Synuclein Strains Differentially Promote Tau Inclusions in Neurons. Cell. 154, 103-117 (2013).
- Masuda-Suzukake, M., et al. Prion-like spreading of pathological α-synuclein in brain. Brain. 136, 1128-1138 (2013).
- Volpicelli-Daley, L. A., et al. Exogenous α-Synuclein Fibrils Induce Lewy Body Pathology Leading to Synaptic Dysfunction and Neuron Death. Neuron. 72, 57-71 (2011).
- Peelaerts, W., et al. α-Synuclein strains cause distinct synucleinopathies after local and systemic administration. Nature. 522, 340-344 (2015).
- Lázaro, D. F., Pavlou, M. A. S., Outeiro, T. F. Cellular models as tools for the study of the role of alpha-synuclein in Parkinson's disease. Exp. Neurol. 298, 162-171 (2017).
- Lee, H. -. J., Patel, S., Lee, S. -. J. Intravesicular localization and exocytosis of alpha-synuclein and its aggregates. J. Neurosci. Off. J. Soc. Neurosci. 25, 6016-6024 (2005).
- Luk, K. C., et al. Intracerebral inoculation of pathological α-synuclein initiates a rapidly progressive neurodegenerative α-synucleinopathy in mice. J. Exp. Med. 209, 975-986 (2012).
- Mougenot, A. -. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol. Aging. 33, 2225-2228 (2012).
- Recasens, A., et al. Lewy body extracts from Parkinson disease brains trigger α-synuclein pathology and neurodegeneration in mice and monkeys: LB-Induced Pathology. Ann. Neurol. 75, 351-362 (2014).
- Woerman, A. L., et al. Propagation of prions causing synucleinopathies in cultured cells. Proc. Natl. Acad. Sci. 112, 4949-4958 (2015).
- Luk, K. C., et al. Exogenous alpha-synuclein fibrils seed the formation of Lewy body-like intracellular inclusions in cultured cells. Proc. Natl. Acad. Sci. U. S. A. 106, 20051-20056 (2009).
- Sacino, A. N., et al. Intramuscular injection of α-synuclein induces CNS α-synuclein pathology and a rapid-onset motor phenotype in transgenic mice. Proc. Natl. Acad. Sci. U. S. A. 111, 10732-10737 (2014).
- Lee, M. K., et al. Human alpha-synuclein-harboring familial Parkinson's disease-linked Ala-53 --> Thr mutation causes neurodegenerative disease with alpha-synuclein aggregation in transgenic mice. Proc. Natl. Acad. Sci. U. S. A. 99, 8968-8973 (2002).
- Colla, E., et al. Endoplasmic Reticulum Stress Is Important for the Manifestations of -Synucleinopathy In Vivo. J. Neurosci. 32, 3306-3320 (2012).
- Fujiwara, H., et al. alpha-Synuclein is phosphorylated in synucleinopathy lesions. Nat. Cell Biol. 4, 160-164 (2002).
- Colla, E., et al. Toxic properties of microsome-associated alpha-synuclein species in mouse primary neurons. Neurobiol. Dis. 111, 36-47 (2018).
- Colla, E., et al. Accumulation of Toxic -Synuclein Oligomer within Endoplasmic Reticulum Occurs in -Synucleinopathy In Vivo. J. Neurosci. 32, 3301-3305 (2012).
- Volpicelli-Daley, L. A., Luk, K. C., Lee, V. M. -. Y. Addition of exogenous α-synuclein preformed fibrils to primary neuronal cultures to seed recruitment of endogenous α-synuclein to Lewy body and Lewy neurite-like aggregates. Nat. Protoc. 9, 2135-2146 (2014).
- Li, W., et al. Aggregation promoting C-terminal truncation of alpha-synuclein is a normal cellular process and is enhanced by the familial Parkinson's disease-linked mutations. Proc. Natl. Acad. Sci. U. S. A. 102, 2162-2167 (2005).
- Luk, K. C., et al. Molecular and Biological Compatibility with Host Alpha-Synuclein Influences Fibril Pathogenicity. Cell Rep. 16, 3373-3387 (2016).
- Volpicelli-Daley, L. A., Kirik, D., Stoyka, L. E., Standaert, D. G., Harms, A. S. How can rAAV-α-synuclein and the fibril α-synuclein models advance our understanding of Parkinson's disease. J. Neurochem. 139, 131-155 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유