Method Article
"Hígado-en-un-Chip" cultivos de hepatocitos primarios y células de Kupffer para infección del Virus de la Hepatitis B
En este artículo
Resumen
El objetivo de este protocolo es proporcionar una guía paso a paso para realizar experimentos 3D "hígado-en-un-chip" infección con el virus de la hepatitis B.
Resumen
A pesar de la excepcional infectividad de lo virus de la hepatitis B (VHB) en vivo, donde sólo tres genomas virales pueden resultar en una cronicidad de chimpancés infectados experimentalmente, más modelos in vitro requieren varios cientos de miles de genomas virales por la célula en orden para iniciar una infección transitoria. Además, culturas estáticas 2D de hepatocitos humanos primarios (PHH) permitan solamente a corto plazo estudios debido a su rápida diferenciación. Aquí, describimos a culturas de hígado-en-un-chip 3D de HPH, en monocultivos o en cocultures con otras células de hígado-residente de nonparenchymal. Estos ofrecen una mejora significativa al estudio de la infección por el VHB a largo plazo con respuestas de host fisiológica celular. Además de facilitar los estudios de eficacia de medicamentos, análisis toxicológico e investigaciones en patogenesia, estos sistemas de microfluidos cultura permiten la evaluación de terapias curativas para la infección de HBV, destinados a eliminar covalentemente cerrado, circular (ccc) ADN. Presenta método describe la instalación de monocultivos PHH y co-cultivos de células de Kupffer/PHH, la infección con el VHB purificado y el análisis de las respuestas del host. Este método es especialmente aplicable a la evaluación de los efectos a largo plazo de infección de HBV, combinaciones de tratamiento y patogénesis.
Introducción
El estudio de HBV ha sido complicado por la pobre sensibilidad de los sistemas de cultivo, que requiere varios cientos o miles de copias de genoma HBV por la célula para iniciar la infección1. Además, hepatocitos humanos primarios generalmente son extraordinariamente frágiles y rápidamente dedifferentiate en cultivos convencionales2. Esto es debido principalmente al hecho de que las superficies de plástico planas y duras no mímico natural ambiente extracelular en el hígado y la falta de oxigenación de los cultivos en la ausencia de circulación de microfluidos. Cultivos de hepatocitos estático convencional en las placas revestidas de colágeno rápidamente dedifferentiate y perder su susceptibilidad a la infección de VHB3. Aquí, describimos la configuración y la infección de HPH en 3D culturas del hígado-en-un-chip, que son enormemente ventajosas sobre culturas PHH estáticas 2D convencionales en placas recubiertas de colágeno debido a su prolongada competencia metabólica y funcional, facilitando cultivos a largo plazo de al menos 40 días4. En este sistema, HPH se siembran sobre andamios recubiertos de colágeno, que continuamente son perfundidos con medio de cultivo para suministrar oxígeno y nutrientes a las células. A pesar de que los sistemas de cultivo alternativos para PHH basan en complejo cocultures de crecimiento 3D en esferoides o fibroblastos murinos han sido validados y son susceptibles a la infección de HBV con multiplicidades de infección de los equivalentes de genoma 500 (GE) de HBV por célula, 3D hígado-en-un-chip culturas siguen siendo el sistema de único modelo in vitro susceptible a 0.05 GE de HBV por celular4. Esto está además avalado por la necesidad de utilizar altas concentraciones de sulfóxido de dimetilo (DMSO) y polietilenglicol (PEG) para establecer la infección de HBV en estas culturas, que es prescindible para la infección de los sistemas de cultivo de hígado-en-un-chip 3D 4. entre las principales características distintivas del HBV infección es la piscina de cccDNA, que actúa como plantilla transcripcional para todos de novo–producen viriones5,6. A pesar de cccDNA puede ser detectada en cultivos de hepatocitos convencional7,8, sigue siendo confuso en cuanto a si la regulación de cccDNA y los enfoques terapéuticos destinados a su eliminación son recapitulados en parcialmente o hepatocitos completamente dedifferentiated. Hemos demostrado que cccDNA funcionalmente se forma en las culturas de hígado-en-un-chip 3D, responde a los estímulos fisiológicos y puede orientarse al interferir con la accesibilidad de la maquinaria transcripcional del genoma cccDNA del4.
Respuestas de anfitrión a la infección por HBV en 3D imitador de hígado-en-un-chip aquellos observados en pacientes infectados por el VHB, lo que permite la identificación de biomarcadores de la infección, así como éxito terapéutico. Entre las características únicas de las culturas del hígado-en-un-chip es la capacidad de evaluar las respuestas a largo plazo de host entre PHH y otras nonparenchymal las células dentro del hígado, incluyendo Kupffer células4células radiadas9y sinusoidal del hígado las células endoteliales10,11. Esto ofrece una oportunidad única para evaluar las interacciones célula/en un microambiente 3D complejo.
Además, el período extendido de la cultura de esta plataforma facilita la evaluación de los tratamientos farmacológicos secuencial y su impacto en la persistencia del VHB, que no son posibles con los sistemas de cultivo convencionales del hepatocito.
Este protocolo describe cómo 3D hígado-en-un-chip se generan culturas, monocultivos de HPH o cocultures de HPH con células de Kupffer. Además, se describe la producción de HBV purificada para los estudios de los baja multiplicidad de infección, así como el posterior análisis de host y respuestas virales.
Protocolo
1. montaje y equilibrado de las placas de
- Asegúrese de que el compresor y la bomba de vacío asociada a la plataforma LiverChip se encienden. Realizar el montaje y equilibrado de las placas en una clase II de gabinete.
- Asépticamente, montar las placas de microfluidos colocando una membrana estéril entre la base de la placa y agregar la placa superior bien que contiene (Figura 1a).
- Asegúrese de que la membrana estéril suavemente descansa sobre los dos pernos de la placa base, desde compromisos de colocación membrana irregular la circulación de microfluidos.
- Añadir una tapa estéril de la placa y apriete los tornillos en la base de la placa con un par de precisión automatizada 33 lbs usando una espiral secuencia de apriete. Asegúrese de que estén apretados todos los tornillos a 35 lb con un apriete manual. Durante este paso, asegúrese que los tornillos estén apretados simétricamente (Figura 1a).
- Precaliente el hepatocito siembra medio con Williams Y medio, hepatocitos primarios descongelar y suplementos 5% suero bovino fetal (FBS) y la dexametasona μm 1 a 37 ° C antes de cebado de la galjanoplastia.
- Prime la placa completamente ensamblada colocando dentro de la base de la lavadora y añadir 400 μL de hepatocitos siembra media hacia el lado del depósito de cada pozo. Asegúrese de que la placa encaje en el muelle de lavado completamente.
- Iniciar el flujo en la dirección ascendente para 3,5 min a 1 μl/s. La exitosa función de la circulación de microfluidos puede determinarse a través de los indicadores rojo en el lado de la placa (Figura 1a).
- Una vez que el medio se bombea a la parte de crecimiento celular de la placa, asegurando el correcto ensamblaje del canal del flujo, agregar un adicional de 1,2 mL de hepatocitos siembra medio.
- Cuidadosamente la placa de transferencia en la estación de acoplamiento dentro de un incubador humedecido a 37 ° C y 5% CO2 e iniciar flujo hacia arriba a una velocidad de flujo de 1 μl/s para la h 16 (figura 1C).
- Transferir la placa a la estación de lavado y eliminar burbujas en el pozo transfiriendo suavemente hacia arriba y hacia abajo.
- Agregar una estéril, redonda de papel de filtro, seguido por un andamio de accesorio de celular y un anillo de retención, a cada pocillo utilizando pinzas estériles. Pulse en cada pozo con un émbolo estéril para Trabe los anillos de retención y andamios en su lugar (Figura 1b).
- Aspirar todo medio y añadir 400 μL de medio siembra hepatocito precalentado suavemente sobre el andamio e iniciar el flujo en dirección descendente para 3,5 min a 1 μl/s.
- Aspirar todo medio bombeado por el lado del depósito de la placa. Este paso es necesario para reemplazar el medio contenido en el canal de flujo.
- Añadir 1,4 mL de hepatocitos siembra medio a cada pocillo antes de devolver la placa hasta el muelle para completar el volumen total por pozo. El volumen por pozo es ahora 1,6 mL (1,4 mL en el pozo y 0,2 mL en el canal de flujo).
2. descongelado y siembra de hepatocitos para monocultivos
- Precaliente el hepatocito deshielo medio y medio siembra hepatocito a 37 ° C antes de descongelar un vial de PHH según las instrucciones de los proveedores. Utilizar una centrífuga a temperatura ambiente durante este paso para evitar cambios bruscos de temperatura. Realizar la descongelación y la siembra de los hepatocitos en una clase de gabinete II.
- Resuspender las células en 1 mL de medio de siembra de hepatocito y contar las células con azul tripán. Asegúrese de que la viabilidad de las células es superior al 90%.
- Mantener las células en hielo hasta que se añaden a los pocillos.
- Transferir la placa completamente montada y equilibrada hasta el muelle de lavar y aspirar todos los medio de los pozos.
- Añadir 600.000 hepatocitos a cada bien en volumen 500 μl de medio siembra de hepatocitos.
- Iniciar el flujo en dirección descendente con un caudal de 1 μl/s y el volumen total en el pozo a 1,6 mL agregar 900 μl de hepatocitos siembra medio.
- Transferir la placa a la estación de acoplamiento dentro de un incubador humedecido a 37 ° C y con 5% CO2.
- Iniciar el flujo en dirección descendente con un caudal de 1 μl/s por 8 h, seguido de una revocación del flujo hacia arriba a una velocidad de flujo de 1 μl/s 8 h.
- Transferir la placa a la base de la lavadora y aspirar todos los medio de los pozos.
- Añadir 400 μL de medio de mantenimiento de hepatocitos (Williams Y suplementado con suplementos de mantenimiento del hepatocito y 100 nM dexametasona) para cada bien e iniciar el flujo en dirección descendente con un caudal de 1 μl/s 3,5 min.
- Aspire todo medio del embalse y agregar 1,4 mL de medio de mantenimiento de hepatocitos (figura 1 d).
- Reemplazar el medio con medio de mantenimiento de hepatocitos cada 48 h. Para asegurar que se sustituye todo medio en el pozo, realizar un paso de lavado antes de la adición de medio de mantenimiento fresco de hepatocitos.
- Para el paso de lavado, transferir la placa a la base de lavado, aspirar todo medio de los pozos y añadir 400 μL de medio de mantenimiento.
- Iniciar el flujo en dirección descendente a 1 μl/s 3,5 min aspirar todos medio que aparece en el lado del depósito de los pozos.
- Agregar 1,4 mL de medio de mantenimiento de hepatocitos y, dentro de un incubador humedecido a 37 ° C y con 5% CO2, transferir la placa a la estación de acoplamiento e iniciar el flujo hacia arriba a una velocidad de flujo de 1 μl/s durante 48 h (figura 1f).
Nota: Para monocultivos de hepatocitos utilizados como controles para cocultures, con el fin de asegurar condiciones controladas, se utiliza un segundo tipo de medio de mantenimiento, que es específico para el uso en las cocultures con las células de Kupffer humanas primarias. 48 h después de reemplazar el hepatocito siembra medio con medio de mantenimiento de hepatocitos (día 3 post siembra), se reemplazará el medio de mantenimiento regulares del hepatocito con medio de mantenimiento de cocultivo II, especialmente en monocultivos de PHH al comparar a cocultures de PHH y Kupffer células, como los componentes medianas difieren ligeramente.
3. descongelar y siembra de células de Kupffer y de los hepatocitos de co-cultivos
- Para garantizar una comparación exacta de los resultados, compare cocultures PHH/Kupffer célula a monocultivos PHH
- Cocultures de células PHH y Kupffer, descongelar un vial de células de Kupffer en avanzada de Dulbecco modificado medio del águila (AdDMEM) sin dexametasona pero complementado con hepatocitos primarios descongelación y galjanoplastia de suplementos (siembra medio de cocultivo) según las instrucciones de los proveedores. Realizar la descongelación y la siembra de las células de Kupffer y hepatocitos en una clase de gabinete II.
- Resuspender las células en 1 mL de siembra medio de cocultivo y contar las células con azul tripán. Asegúrese de que la viabilidad de las células es superior al 90%.
- Mantener las células en hielo antes de agregar a los pozos para evitar la adherencia de la célula.
- Siga las instrucciones en pasos 2.1 – 2.3 para descongelar de hepatocitos humanos primarios.
- Transferir la placa completamente montada y equilibrada hasta el muelle de lavar y aspirar todos los medio de los pozos.
- Añadir 60.000 células de Kupffer o 600.000 hepatocitos a cada bien en un volumen total de 250 μl de siembra medio de cocultivo.
- Iniciar flujo en dirección descendente con un caudal de 1 μl/s y agregar 900 μl de cocultivo siembra medio a cada pocillo.
- Transferir la placa a la estación de acoplamiento dentro de un incubador humedecido a 37 ° C y con 5% CO2.
- Iniciar el flujo en dirección descendente con un caudal de 1 μl/s por 8 horas, seguido por revocación del flujo en la dirección hacia arriba con un caudal de 1 μl/s 8 h.
- Transferir la placa a la base de la lavadora y aspirar todos los medio de los pozos.
- Añadir 400 μL de medio de mantenimiento de cocultivo I (AdDMEM sin dexametasona pero complementada con suplementos de mantenimiento hepatocito) para cada bien e iniciar el flujo en dirección descendente con un caudal de 1 μl/s 3,5 min.
- Aspirar todo medio desde el lado del depósito y agregar 1,4 mL de medio de mantenimiento de cocultivo I a cada pocillo.
- Transferir la placa a la estación de acoplamiento dentro de un incubador humedecido a 37 ° C y con 5% CO2 e iniciar el flujo hacia arriba a una velocidad de flujo de 1 μl/s durante 48 h.
- Transferir la placa a la base de la lavadora y aspirar todos los medio de los pozos. Añadir 400 μL de medio de mantenimiento de cocultivo II (medio Williams Y sin dexametasona pero suplementado con 100 nM hidrocortisona y hepatocito mantenimiento suplementos) e iniciar el flujo en la dirección hacia abajo a 1 μl/s durante 3,5 minutos.
- Aspire todo medio que aparece en el lado del depósito de los pozos.
- Agregar 1,4 mL de medio de mantenimiento de cocultivo II y transferir la placa a la estación de acoplamiento dentro de un incubador humedecido a 37 ° C y con 5% CO2.
- Iniciar el flujo hacia arriba a una velocidad de flujo de 1 μl/s durante 48 h (Figura 1e).
- Reemplace el medio cada 48 h por medio de cocultivo mantenimiento II. Para asegurar que se sustituye todo medio en el pozo, realizar un paso de lavado antes de la adición de medio fresco.
- Para lavar, transferir la placa a la base de lavado, aspirar todo medio de los pozos y añadir 400 μL de medio de mantenimiento de cocultivo II.
- Iniciar el flujo en dirección descendente a 1 μl/s 3,5 min aspirar todos medio que aparece en el lado del depósito de los pozos.
- Agregar 1,4 mL de medio de mantenimiento de cocultivo II transferir la placa a la estación de acoplamiento dentro de un incubador humedecido a 37 ° C y con 5% CO2e Iniciar flujo hacia arriba a una velocidad de flujo de 1 μl/s durante 48 h (figura 1f).
4. producción de un Virus infecciosa Hepatitis B infección estudios
- Realizar esta sección del protocolo en un nivel de contención laboratorio III. Hacer la siembra, cambios medio, colección medio y concentración del virus en una clase de gabinete II.
- La cultura de células productoras de HBV (p. ej., HepDE19, HepAD38) en frascos de 5 capas de T1000 recubiertas de colágeno en 120 mL de DMEM/F12 completa (10% FBS, penicilina/steptomycin, aminoácidos no esenciales, 500 μg/mL G418 y tetraciclina de 1 μg/mL) hasta alcanzar el 90% de confluencia.
- Cambiar el medio al medio de inducción (DMEM completo sin tetraciclina) para inducir la producción de HBV.
- Recoger el volumen medio completo cada 48 h para el retiro tras 12 días de tetraciclina y almacenar a 4 ° C.
- Filtrar el medio recogido a través de un filtro 0.45 μm botella.
- Agregar 8000 PEG estéril en solución salina tamponada con fosfato (PBS) al medio de recogida a una concentración final de 4% w/w, mezclar por inversión del tubo 8 x x-10 e incubar a 4 ° C por 16 h. Centrifugar a 10.000 x g durante 1 h a 4 ° C para recoger el virus PEG-precipitado y resuspender el precipitado en PBS con 10% FBS.
- Combinar el virus precipitado PEG desde todos los puntos de tiempo cosecha y capa encima de un colchón de sacarosa 20%. Centrifugue a 140.000 x g durante 16 h a 4 ° C utilizando un rotor SW28.
- Aspirar el sobrenadante y resuspender el precipitado en PBS suplementado con 10% FBS y alícuota y almacenar a-80 ° C.
- Determinar el número de copia de DNA de VHB presente en el sobrenadante por HBV DNA qPCR (paso 6).
5. infección de culturas 3D con el VHB
- Realizar infecciones en una clase II de gabinete dentro de un nivel de contención laboratorio III.
- 3 días después de la siembra del monocultivo o cocultures, descongelar el número requerido de alícuotas que contiene VHB a temperatura ambiente y diluir la dosis necesaria de virus en 1,8 mL de medio de mantenimiento de hepatocitos o cocultivo mantenimiento medio II por pozo, respectivamente.
- Este virus diluido de 1,8 mL es suficiente para el paso de lavado (400 μL) y la sustitución del medio en el pozo (1,4 mL). Sin embargo, la necesaria multiplicidad de infección necesita ser ajustado para tener en cuenta el volumen de cultivo final de 1.6 mL.
- Transferir la placa a la base de la lavadora y aspirar todos los medio de los pozos. Añadir 400 μL de medio conteniendo VHB e iniciar el flujo en la dirección hacia abajo a 1 μl/s 3,5 min aspirar todos medio que aparece en el lado del depósito de los pozos.
- Añadir 1,4 mL de HBV que contiene medio/cocultivo mantenimiento II medio por bien y transferir la placa a la estación de acoplamiento dentro de un incubador humedecido a 37 ° C y con 5% CO2. Iniciar el flujo en dirección descendente con un caudal de 1 μl/s por 8 horas, seguido de una inversión a la dirección hacia arriba a una velocidad de flujo de 1 μl/s.
- 24 h después de la adición del HBV, transferir la placa a la estación de lavado y aspirar todos los medio de los pozos.
- Lave cada bien en la placa de 3 x con el medio correspondiente, según el tipo de cultura como se indica en pasos de 2.12, 2.14, para eliminar el virus restante desde el pozo. En contraste con pasos 2.12, 2.14, añadir 1,6 mL de medio en cada pozo para tener en cuenta el volumen adicional que se quiera muestrear para excluir contaminación inóculo (figura 1 g).
- Siguiendo estos pasos de lavado, recoge 200 μL del medio de cada pozo para confirmar la eliminación completa del inóculo de HBV por cuantificación de HBV DNA extracelular.
- Transferir la placa a la estación de acoplamiento dentro de un incubador humedecido a 37 ° C y con 5% CO2e iniciar el flujo hacia arriba a una velocidad de flujo de 1 μl/s durante 48 h.
- 48 h después, recoger el volumen bien completo para análisis de aguas abajo, seguido de tres lavados con medio de mantenimiento de hepatocitos como se indica en pasos 2.12-2.14. Reemplazar el medio y lavar cada pozo 3 x cada 48 h hasta terminación experimental.
6. cuantificación de DNA de HBV extracelular
- Aislar el ADN total de los sobrenadantes de cultivo según las instrucciones del fabricante con la adición de 1 μg de portador de RNA en un nivel de contención III lab para asegurar la inactivación de virus en las muestras antes de mudarse a un área diferente.
- Preparar una mezcla maestra que contiene cuantitativo PCR master mix, primer avance de 600 nM, cartilla inversa de 600 nM y 300 nM de sonda.
- Añadir 7 μl de la mezcla principal en cada pocillo de una placa de 384 pozos.
- Añadir 5 μl de las muestras de ADN en duplicado, un control no es de plantilla y duplicados de diluidos en serie VHB que contiene el genoma basado en el plásmido estándar (por ejemplo, pCMV-VHB) que van desde 109 copias por reacción a 102 copias por reacción a cada pocillo de la placa de qPCR.
- Coloque una cubierta de adhesivo sobre la placa y asegurarse de que cada uno y es sellado correctamente.
- Centrifugar la placa durante 1 min a 300 x g.
- Iniciar la qPCR ejecutar según las instrucciones del fabricante. Las condiciones del ciclo de PCR en tiempo real son 95 ° C durante 10 min, seguido de 40 ciclos de 95 ° C por 15 s y 60 ° C durante 1 minuto.
- Cuantificar el número de copias de DNA de VHB en las muestras desconocidas según la curva estándar.
7. cuantificación de HBV intracelular Pregenomic (pg) RNA
- Aislar el ARN total de las matrices de soporte según las instrucciones del fabricante. Fin de lisis celular completa, vortex cada andamio 3 x durante 30 s seguida por centrifugación a 300 x g durante 1 min entre cada vórtex. Realizar la lisis de la célula en el nivel de contención III lab para asegurar la inactivación de virus en las muestras antes de mudarse a un área diferente.
- Transcribir ADNc a partir del RNA aislado según las instrucciones del fabricante.
- Las condiciones del ciclo de la retrotranscripción son 25 ° C durante 10 min, 37 º C durante 120 min y 85 ° C durante 5 minutos.
- Mantener las muestras de cDNA a 4 ° C para a corto plazo o a-20 ° C para almacenamiento a largo plazo.
- Preparar mezclas principales para pgRNA y RPS11 mezcla de maestro PCR cuantitativa que contiene y cartillas de adelante y atrás para pgRNA y RPS11 (utilizado como gen housekeeping) a una concentración final de 0.2 μm.
- Agregar 7.5 μl de la mezcla principal y 2,5 μl de cDNA por pozo en una placa de 384 pozos. Medir RPS11 y pgRNA de cada muestra por duplicado e incluyen un control de plantilla no bien para ambos genes.
- Coloque una cubierta de adhesivo sobre la placa y asegurar que cada bien se sella completamente.
- Centrifugar la placa durante 1 min a 300 x g.
- Inserte la placa en el cycler de qPCR y empezar la qPCR ejecutar utilizando el protocolo estándar de PCR cuantitativo según las instrucciones del fabricante. Las condiciones del ciclo para PCR en tiempo real son 50 ° C por 2 min, 95 ° C por 2 min, seguido de 40 ciclos de 95 ° C por 15 s y 60 ° C durante 1 minuto.
- Calcular la expresión de pgRNA en relación con RPS11.
8. inmunofluorescencia, tinción del antígeno Viral
- Retire el anillo de retención del pozo y retirar el andamio con fórceps en una clase de gabinete II en el laboratorio III nivel de contención.
- Fijar los andamios que contiene células con paraformaldehído al 4% en 1 mL de PBS durante 30 min a temperatura ambiente en el nivel de contención laboratorio III. Los siguientes pasos pueden realizarse en un área diferente.
- Lavar los andamios 3 x con 1 mL de PBS.
- Permeabilizar las células utilizando 0,1% Triton-X 100 en 1 mL de PBS durante 1 h a temperatura ambiente.
- Lavar los andamios 3 x con 1 mL de PBS.
- Fijación no específica de bloque por la incubación de los andamios con 1% de BSA en 1 mL de PBS durante 16 horas a 4 ° C.
- Lavar los andamios 3 x con 1 mL de PBS.
- Realizar tinción de anticuerpo primario con antígeno del core de conejo contra la hepatitis B virus, a una dilución de 1: 200 en 1% de BSA en 1 mL de PBS durante 16 horas a 4 ° C.
- Lavar los andamios 1 x 0,1% Tween en 1 mL de PBS (PBS-Tween) y 3 x con 1 mL de PBS.
- Realizar tinción de anticuerpo secundario con cabra anti-conejo IgG (H+L) adsorbido Cruz Alexa Fluor 594 secundaria anticuerpo conjugado a la dilución de 1:2,000 en 1% de BSA en 1 mL de PBS durante 16 horas a 4 ° C.
- Lavar los andamios 1 x con 1 mL de 0.1% PBS-Tween y 3 x con 1 mL de PBS.
- Contratinción los andamios con DAPI en 1 mL de PBS en una concentración de 2 μg/mL durante 10 minutos a temperatura ambiente.
- Lavar los andamios 1 x con 1 mL de 0.1% PBS-Tween y 3 x con 1 mL de PBS.
- Transferir los andamios a un portaobjetos y montar imagen.
- Imagen de andamios utilizando un microscopio de fluorescencia.
9. humana albúmina ELISA
- Realizar esta sección del protocolo en una clase II gabinete asignada en el nivel de contención laboratorio III si trabaja con material infeccioso.
- Para evaluar la viabilidad y funcionalidad metabólica de HPH, evaluar la producción de albúmina humana por ELISA.
- Placas de capa 96 pocillos con 50 μL por pocillo de anticuerpo antihumano de cabra diluyen 1: 800 en tampón de recubrimiento (bicarbonato/carbonato de 100 mM, pH 9,6). Cubrir las placas e incubar por 2 h a 37 ° C o durante la noche a 4 ° C.
- Aspire el anticuerpo de recubrimiento de la placa y lavar 4 x con 200 μL de 0.05% PBS-Tween.
- Añadir 200 μL de solución amortiguadora de bloqueo (1% de BSA en PBS), placas, incubar durante 1 h a 37 ° C y almacenarlos a 4 ° C durante 3 meses. Para el almacenamiento a largo plazo, agregar 0.05% de azida sódica al buffer de bloqueo.
- Aspirar la solución amortiguadora de bloqueo y 1 x con 200 μL de 0.05% de lavado PBS-Tween.
- Añadir 50 μl de muestras diluidas previamente por pozo (1: 100). El diluyente de muestra contiene 1% BSA, 0.05% PBS-Tween. Incubar durante 1 h a 37 ° C o durante la noche a 4 ° C.
Nota: Incubar las normas al mismo tiempo que las muestras. Un rango de concentración de 500-0.488 recomienda ng/mL (diluciones seriadas de 1:2). Realizar diluciones seriadas todos de albúmina humana en diluyente de muestra. - Aspirar las muestras de la placa y lavar 4 x con 200 μL de 0.05% PBS-Tween.
- Añadir 50 μl de anticuerpo de albúmina humana de cabra conjugado-HRP diluido previamente 1: 10,000 en diluyente de muestra. Incubar 2 h a 37 ° C o durante la noche a 4 ° C.
- Aspire el anticuerpo de la placa y lavarla 6 x con 200 μL de 0.05% PBS-Tween.
- Añada 100 μl de reactivo TMB y, tan pronto como los más altos estándares se desarrollan completamente, agregar 100 μL 1 M H2hasta4 para detener la reacción colorimétrica.
- Leer la absorbancia a 450 nm en un lector de placa de 96 pocillos para el análisis.
10. Interleukin (IL) 6 y factor de Necrosis Tumoral (TNF) la producción de α en co-cultivos 3D
- Realizar esta sección del protocolo en una clase II gabinete asignada en el nivel de contención laboratorio III si trabaja con material infeccioso.
- Cuantificar la producción de IL6 y TNFα para evaluar la funcionalidad y viabilidad de las células de Kupffer primarias. Para inducir la producción de estas citoquinas por las células de Kupffer, tratar cocultures con 1 μg/mL el lipopolysaccharide (LPS) 9 d la siembra en el medio de mantenimiento de cocultivo II de 48 h.
- En día 11 post siembra, la cosecha media de cada pozo y almacenar a-80 ° C.
- Medir la concentración de IL6 y TNFα en el medio de cultivo por un análisis apropiado y de acuerdo a las instrucciones del fabricante.
Resultados
Describimos una plataforma simple y versátil para la cultura a largo plazo de las células de Kupffer humanas primarias o hepatocitos y su infección con el VHB. Las células humanas primarias se siembran sobre andamios de poliestireno recubiertas de colágeno dentro de un conjunto de placa microfluídica, que perfuses continuamente las células con medio de cultivo (Figura 1a).
HPH, que generalmente sólo son estables para una cantidad limitada de tiempo en sistemas de cultivo convencionales, funcionalmente se puede mantener durante largos períodos de tiempo. Albúmina humana, que es secretada por los hepatocitos funcionales y es considerada el mejor marcador para la evaluación del metabolismo hepático, es estable y altamente expresada por culturas 3D hasta el día 40 posterior siembra (figura 2). Para cocultures, viabilidad y funcionalidad de células de Kupffer pueden evaluarse por la secreción de citocinas específicas (por ejemplo, IL6 y TNFα). Para medir la producción de citoquinas, se recomienda el uso de medios de detección captura sobre el estímulo de LPS de cocultures (figura 3).
Las células forman microtissues hepática, generalmente dentro de 3 días de la siembra de HPH, demostración de canalículos biliares funcionales y polarización celular completa (figura 2). Además de mantener su metabolismo celular fisiológico, estas culturas se convierten en extraordinariamente susceptibles a la infección de HBV. ADN de VHB y otros marcadores virales, en contraste con otros sistemas de cultivo, se convierten en fácilmente detectables de post-infección día 2 (figura 4). Además secretados marcadores de infección viral, que contiene hepatocitos andamios pueden ser obtenidos de las culturas y utilizados para la detección de inmunofluorescencia de antígenos virales (p. ej., HBsAg, nucleocápsida) (figura 4). En cultivos de hepatocitos convencionales requieren inoculación con al menos 500 GE de HBV por celular y la adición de DMSO 2% y 4% PEG, tan sólo 0,05 HBV GE son capaces de iniciar la infección en 3-d culturas sin el requisito de DMSO o PEG (figura 4).
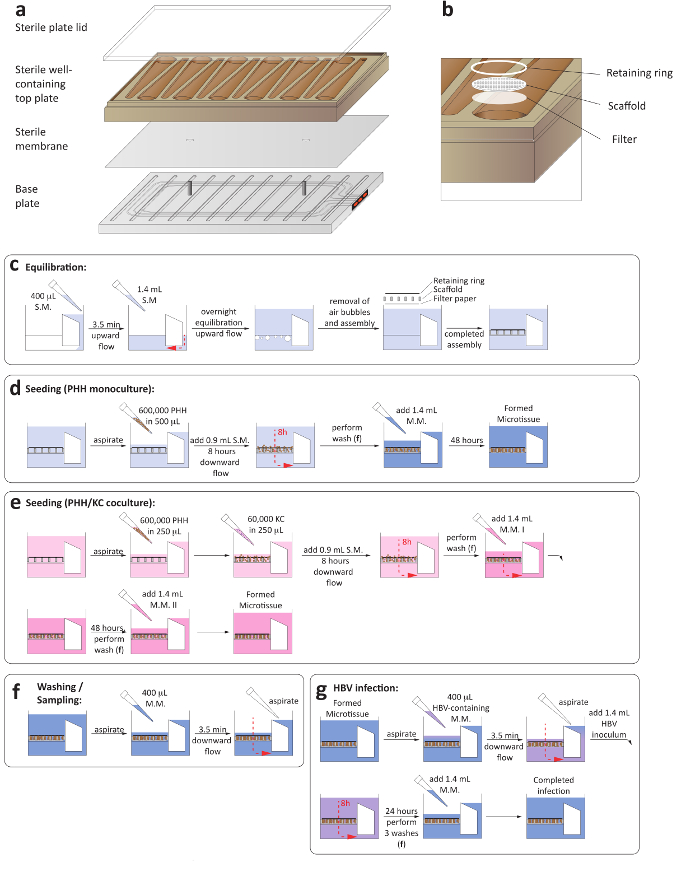
Figura 1: configuración de las culturas de hígado-en-un-chip 3D. (a) se trata de un diseño esquemático para el montaje de la placa de cultivo con el fin de asegurar el establecimiento de la circulación de microfluidos. (b) este panel muestra una vista cercana de los pozos de la cultura, incluyendo el papel de filtro, el andamio y el anillo de retención. (c) este panel muestra el proceso de equilibrio de la placa antes de la siembra de los cultivos. Los siguientes dos paneles muestran el proceso de la siembra de monocultivos de hepatocitos (d) y (e) hepatocito/Kupffer célula cocultures. (f) este panel muestra los pasos de lavado en medio cambios. (g) este panel muestra la configuración de la infección de HBV, incluida la eliminación de inóculo. S.M. = medio de siembra, M.M. = medio de mantenimiento. Haga clic aquí para ver una versión más grande de esta figura.
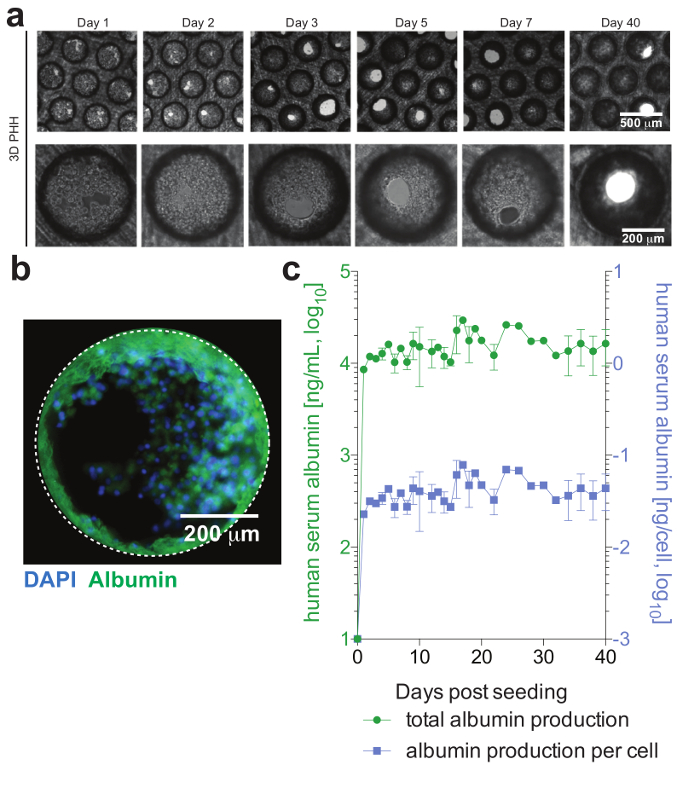
Figura 2: viabilidad formación y hepatocito hepática microtissue. (a) este panel muestra imágenes de brightfield longitudinal del monocultivo del hepatocito 3D demostrando la formación de microtissue después de siembra. (b) este panel muestra imágenes de inmunofluorescencia de las culturas de los núcleos (azul) y albúmina humana (verde). (c) este panel muestra albúmina total longitudinal, así como por la célula ajusta producción de albúmina, durante 40 días de los monocultivos de hepatocitos, determinados por ELISA. Los datos son medias ± SD Esta figura se ha adaptado de Ortega Prieto et al4. Haga clic aquí para ver una versión más grande de esta figura.
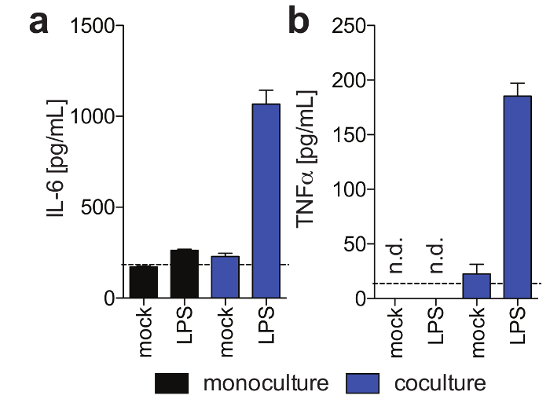
Figura 3: funcionalidad de células de Kupffer en 3-d cocultures. Estos paneles muestran la secreción de (un) IL6 y (b) TNFα en monocultivos de hepatocitos y células de Kupffer/hepatocitos cocultures 11 días post siembra en respuesta a LPS exógeno agregados en día 9 post siembra, como determinó humano magnético Ensayo de Luminex. Esta figura se ha adaptado de Ortega Prieto et al4. Haga clic aquí para ver una versión más grande de esta figura.
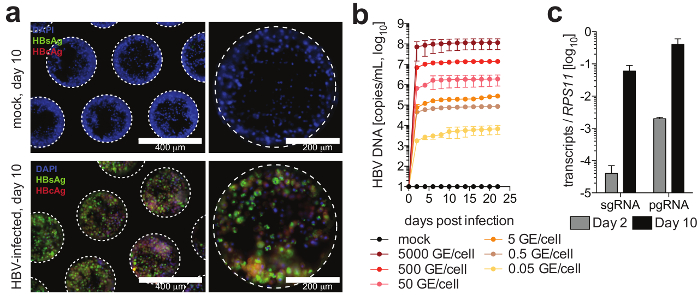
Figura 4: la infección por VHB en las culturas del hígado-en-un-chip. (a) este panel muestra la detección de la microscopia de inmunofluorescencia de la nucleocápsida (rojo), HBsAg (verde) y los núcleos (azul) 10 días después de la infección de las culturas con el VHB. (b) este panel muestra la susceptibilidad de los cultivos a la infección de HBV utilizando diferentes multiplicidades de infección, según lo determinado por una cuantificación de la DNA de HBV en los sobrenadantes de cultivo. (c) este panel muestra la cuantificación de la acumulación longitudinal de VHB pgRNA en relación con el gen housekeeping RPS11. Los datos son medias ± SD Esta figura se ha adaptado de Ortega Prieto et al4. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los desafíos en el mantenimiento de cultivos a largo plazo de PHH han impulsado el desarrollo de varios modelos de la cultura con mayor funcionalidad y longevidad, cada uno exhibiendo desventajas y ventajas diferenciales. Ahora es ampliamente reconocido que culturas estáticas 2D de HPH están imitando ciertos aspectos de la biología del hepatocito para una cantidad muy limitada de tiempo. Así, micropatterned cocultures12,13, esferoide culturas14,15, y16,de culturas de hígado-en-un-chip 3D17 rápidamente están reemplazando a estos sistemas más básicos. Especialmente al estudiar las enfermedades infecciosas, que han coevolucionado con su host utilizar microambientes específicos, el requisito de proporcionar ambientes fisiológicos se basa en la naturaleza a menudo difícil de cultivo de humanos-trópico enfermedades infecciosas, incluyendo el virus de la hepatitis C, el VHB y la malaria.
El paso más crítico en la realización de cultivos de hígado en un chip 3D es la calidad de los tipos de célula primaria inicialmente origen. Estas células deben ser probadas para su capacidad de adherencia y sólo lotes PHH plateable deben utilizarse para garantizar la formación de tejido de éxito y generación de cultura. Aunque PHH recién aislado se puede utilizar, su criopreservación es generalmente complicada y requiere congeladores controlados por tasa especiales.
En contraste con las culturas 2D estáticas convencionales, el fondo genético de host es despreciable con respecto a la susceptibilidad a la infección de HBV, y todos los donantes de hepatocitos probado así lejos son capaces de establecer HBV infección4.
Aunque HBV derivados del paciente establece infecciones de culturas 3D, es imperativo utilizar PEG-precipitado y sacarosa amortiguador purificado VHB cuando utilizando inducible HBV productor célula líneas para la generación de inóculo viral. Sobrenadantes de cultivo celular directamente aplicados a cultivos de hígado-en-un-chip 3D, ya sea a través de la presencia de factores inhibitorios o debido a una incompatibilidad de factores de crecimiento presentes con hepatocitos, no fácilmente causar infecciones. Además, al seleccionar el inóculo viral derivados del paciente, sólo suero debe usarse, ya que plasma inevitablemente se coagula y obstruye la circulación de microfluídica de la plataforma de cultura.
Independientemente del inóculo viral usado, asegurando la viabilidad celular y la diferenciación, así como garantizar la completa eliminación del inóculo inicial de HBV, es clave para el éxito a largo plazo estudios de infección. La manera más conveniente de hacer esto es muestreo de culturas tras la eliminación del inóculo viral, así como la medición de los niveles de albúmina sérica humana durante todo el período de la cultura. De la nota, del mismo modo a todas las demás plataformas descritas, la infección de HBV, una vez establecida, no fácilmente se extiende a las células no infectadas. El mecanismo subyacente para esto sigue siendo evasivo ya que vivo en la infección de HBV infecta fácilmente a la mayoría de los hepatocitos en el hígado.
Con respecto a cocultures de HPH con células de Kupffer, es recomendable realizar pruebas de muchas de las células de Kupffer para evaluar la secreción de IL6 y TNFα en respuesta al estímulo de los LPS, ya que no todos donantes de células de Kupffer comercialmente disponibles tienen una sensibilidad igual.
Lo importante, para todos los tratamientos con fármacos o infección inicial de las culturas con el VHB, el volumen total del pozo (1,4 mL), así como el canal de microfluidos (0,2 mL), debe tenerse en cuenta para el cálculo de las concentraciones de droga o inóculo. Para asegurar una dosificación exacta, se realiza un paso de lavado con medio que contiene VHB o drogas para cebar el canal microfluídico.
La plataforma utilizada utiliza PHH 600.000 por bien, que asegura hepatocitos varias capas dentro de los andamios. Aunque se puede variar el número de células, la concentración celular elegido garantiza resultados óptimos. El formato de la placa tiene un total de 12 andamios, que puede actualizarse a 36 andamios. Sin embargo, debido a requisitos de microfluidos, escalado a números más altos bien no es posible hasta la fecha.
Con estos enfoques, culturas pueden ser mantenidas con un rendimiento óptimo de la célula durante al menos 40 días, que, hasta el momento, ofrece oportunidades sin precedentes para evaluar a nuevos fármacos candidatos, así como estudiar la compleja interacción entre diferentes células hepáticas poblaciones durante la infección de HBV.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por una subvención de arranque del Consejo Europeo de investigación (637304), un premio de investigador confianza de Wellcome (104771/Z/14/Z) y CN Bio Innovations.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| William's E Medium, no phenol red | GIBCO | A12176-01 | |
| Hepatocyte Thaw Medium | GIBCO | CM7500 | |
| Primary Hepatocyte Thawing and Plating Supplements | GIBCO | CM3000 | |
| Primary Hepatocyte Maintenance Supplements | GIBCO | CM4000 | |
| DMEM/F-12 | GIBCO | 11320-033 | |
| Advanced DMEM | GIBCO | 12491023 | |
| DPBS, no calcium, no magnesium | GIBCO | 14190-144 | |
| MEM Non-Essential Amino Acids (NEAA) 100x | GIBCO | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | GIBCO | 15140-122 | |
| Fetal Bovine Serum, USA origin, Heat Inactivated, sterile-filtered, suitable for cell culture | SIGMA | 12106C | |
| Hydrocortisone | SIGMA | H0888 | |
| Trypan blue | Merck | T8154 | |
| Collagen from calf skin | Merck | C9791 | |
| G418 | SIGMA | G418-RO | |
| Tetracycline | SIGMA | T3258 | |
| Polyethylene glycol 8000 | SIGMA | P2139 | |
| Sucrose | SIGMA | SO389 | |
| Sodium carbonate anhydrous | SIGMA | 451614-25G | |
| Sodium bicarbonate | SIGMA | S5761 | |
| Sodium azide | SIGMA | S2002-5G | |
| Sulfuric acid, 99.999% | SIGMA | 339741 | |
| 4% Paraformaldehyde | SIGMA | 252549 | |
| Triton-X 100 | SIGMA | X100 | |
| Tween 20 | SIGMA | P1379 | |
| DAPI | SIGMA | D9564 | |
| Albumin (human) | SIGMA | A9731 | |
| Fisher BioReagent Bovine Serum Albumin, Fraction V, Heat Shock Treated | Fisher Scientific | BP9701-100 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| TaqMan Universal Master Mix II, no UNG | Applied Biosystems | 4440040 | |
| SYBR Select Master Mix | Applied Biosystems | 4472903 | |
| Lipopolysaccharide from Escherichia coli K12 | InvivoGen | tlrl-eklps | |
| Name | Company | Catalog Number | Comments |
| Kits/Consumables | |||
| Sterile membrane | CN Bio innovations | LC-SC | |
| LiverChip Perfusion cell culture plate | CN Bio innovations | LC12 | |
| LiverChip culture plate lid | CN Bio innovations | LC-SC | |
| Sterile round filter paper | CN Bio innovations | LC-SC | |
| Cell attachment scaffold | CN Bio innovations | LC-SC | |
| Retaining ring | CN Bio innovations | LC-SC | |
| Sterile plunger | CN Bio innovations | LC-ST | |
| Dneasy blood & tissue kit | Qiagen | 69506 | |
| Rneasy mini kit | Qiagen | 74106 | |
| Human Magnetic Luminex assay | R&D Systems | ||
| 1-Step Ultra TMB-ELISA Substrate Solution | ThermoFisher Scientific | 34028 | |
| High Capacity cDNA Reverse Transcription Kit | ThermoFisher Scientific | 4368814 | |
| QIAamp Viral RNA Mini Accessory Set | Qiagen | 1048147 | Containing RNA carrier |
| Millicell HY 5-layer cell culture flask, T-1000, sterile | Millipore (Merck) | PFHYS1008 | |
| MicroAmp Optical 384-Well Reaction Plate with Barcode | Life technologies | 4309849 | |
| MicroAmp Optical Adhesive Film | Life technologies | 4311971 | |
| Clear Flat-Bottom Immuno Nonsterile 96-Well Plates | ThermoFisher Scientific | 442404 | |
| Sealing Tape for 96-Well Plates | ThermoFisher Scientific | 15036 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters with PES Membrane | ThermoFisher Scientific | 295-3345 | |
| Fisherbrand Microscopic Slides with Ground Edges, Twin Frost | Fisher Scientific | FB58628 | |
| Tube, Thinwall, Ultra-Clear, 38.5 mL, 25 x 89 mm | Beckman Coulter | 344058 | |
| Name | Company | Catalog Number | Comments |
| Primary cells / Cell lines | |||
| Human Plateable Hepatocytes, Transporter Qualified | Thermo Fisher Scientific | HMCPTS | |
| Cryopreserved Human Kupffer Cells | Thermo Fisher Scientific | HUKCCS | |
| HepDE19 cell line | Haitao Guo (Indiana University, IN, USA) | ||
| Name | Company | Catalog Number | Comments |
| Primers/Probes/Standards | |||
| HBV DNA forward primer | Invitrogen | 5'-GTGTCTGCGGCGTTTTATCA-3' | |
| HBV DNA reverse primer | Invitrogen | 5'-GACAAACGGGCAACATACCTT-3' | |
| HBV DNA probe | Invitrogen | 5'FAM-CCTCTKCATCCTGCTGCTATGCCTCATC-3'TAMRA | |
| pgRNA forward primer | Invitrogen | 5'-GAGTGTGGATTCGCACTCC-3' | |
| pgRNA reverse primer | Invitrogen | 5'-GAGGCGAGGGAGTTCTTCT-3' | |
| RPS11 forward primer | Invitrogen | 5'-GCCGAGACTATCTGCACTAC-3' | |
| RPS11 reverse primer | Invitrogen | 5'-ATGTCCAGCCTCAGAACTTC-3' | |
| pCMV-HBV | Professor Christoph Seeger (Fox Chase Cancer Centre, PA, USA) | ||
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Anti-Hepatitis B virus core antigen IgG fraction (polyclonal) | DAKO | discontinued | Lot 10102505 |
| Human Albumin Antibody, A80-129A | Bethyl Laboratories. inc | A80-129A | |
| Human Albumin cross-adsorbed Antibody, A80-229P | Bethyl Laboratories. inc | A80-229P | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher Scientific | # A-11072 | Lot 1431810 |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| LiverChip Vacuum pump | CN Bio innovations | LC-PN | |
| LiverChip Pneumatic Hookup | CN Bio innovations | LC-PN | |
| LiverChip platform | CN Bio innovations | LC-PN | |
| LiverChip plate washing dock | CN Bio innovations | ||
| Autoclavable metal forceps | VWR | 232-0106 | |
| Vortex Genie 2 | Scientific industries | SKU: SI-0236 | |
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A95765 | |
| Heraeus Multifuge X3R Centrifuge | Thermo Scientific | 75004500 | |
| SAM-12 Medical Suction High Vacuum High Flow | MGE worldwide | SAM12/01010101 | |
| NUAIRE 5800 SERIES incubator | NUAIRE | NU-5841 | |
| Automated precision torgue | CN Bio innovations | ||
| Manual torque | CN Bio innovations | ||
| LiverChip compressor | CN Bio innovations | ||
| Luminex LX-200 Instrument with xPONENT 3.1 | Luminex | ||
| Millipore Hand-Held Magnetic Separator Block | ThermoFisher Scientific | Millipore™ 40-285 | |
| FluoStar Optima Plate Reader | BMG Labtech | ||
| KOLVER Precision electric screwdrivers | VTECH ltd | FAB10RE/FR | |
| KOLVER Power supply | VTECH ltd | EDU1FR | |
| BAMBI VTS75D | Air Equipment | Discontinued | |
| Integra Vacuboy | INTEGRA | ||
| ViiA 7 Real-Time PCR System with 384-Well Block | ThermoFisher Scientific | 4453536 |
Referencias
- Verrier, E. R., Colpitts, C. C., Schuster, C., Zeisel, M. B., Baumert, T. F. Cell Culture Models for the Investigation of Hepatitis B and D Virus Infection. Viruses. 8 (9), (2016).
- Elaut, G., et al. Molecular mechanisms underlying the dedifferentiation process of isolated hepatocytes and their cultures. Current Drug Metabolism. 7 (6), 629-660 (2006).
- Konig, A., et al. Kinetics of the bile acid transporter and hepatitis B virus receptor Na+/taurocholate cotransporting polypeptide (NTCP) in hepatocytes. Journal of Hepatology. 61 (4), 867-875 (2014).
- Ortega-Prieto, A. M., et al. 3D microfluidic liver cultures as a physiological preclinical tool for hepatitis B virus infection. Nature Communications. 9 (1), 682 (2018).
- Allweiss, L., Dandri, M. The Role of cccDNA in HBV Maintenance. Viruses. 9 (6), (2017).
- Guo, J. T., Guo, H. Metabolism and function of hepatitis B virus cccDNA: Implications for the development of cccDNA-targeting antiviral therapeutics. Antiviral Research. 122, 91-100 (2015).
- Lucifora, J., et al. Direct antiviral properties of TLR ligands against HBV replication in immune-competent hepatocytes. Scientific Reports. 8 (1), 5390 (2018).
- Hosel, M., et al. Hepatitis B Virus Activates Signal Transducer and Activator of Transcription 3 Supporting Hepatocyte Survival and Virus Replication. Cellular and Molecular Gastroenterology and Hepatology. 4 (3), 339-363 (2017).
- Mazza, G., et al. Rapid production of human liver scaffolds for functional tissue engineering by high shear stress oscillation-decellularization. Scientific Reports. 7 (1), 5534 (2017).
- Hang, T. C., Lauffenburger, D. A., Griffith, L. G., Stolz, D. B. Lipids promote survival, proliferation, and maintenance of differentiation of rat liver sinusoidal endothelial cells in vitro. American Journal of Physiology-Gastrointestinal and Liver Physiology. 302 (3), G375-G388 (2012).
- Hwa, A. J., et al. Rat liver sinusoidal endothelial cells survive without exogenous VEGF in 3D perfused co-cultures with hepatocytes. The FASEB Journal. 21 (10), 2564-2579 (2007).
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- March, S., et al. Micropatterned coculture of primary human hepatocytes and supportive cells for the study of hepatotropic pathogens. Nature Protocols. 10 (12), 2027-2053 (2015).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Griffith, L. G., Wells, A., Stolz, D. B. Engineering liver. Hepatology. 60 (4), 1426-1434 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados