Method Article
"Fígado-on-a-Chip" culturas de hepatócitos primários e células de Kupffer para infecção pelo vírus da hepatite B
Neste Artigo
Resumo
O objetivo do presente protocolo é fornecer um guia passo a passo para realizar experiências em 3-d "fígado-on-a-chip" infecção com o vírus da hepatite B.
Resumo
Apesar da excepcional infectividade do vírus da hepatite B (VHB) em in vivo, onde apenas três genomas virais podem resultar em uma cronicidade de chimpanzés experimentalmente infectados, mais modelos in vitro requerem várias centenas de milhares de genomas virais por célula em ordem para iniciar uma infecção transitória. Além disso, o estáticas 2D culturas de hepatócitos humanos primários (PHH) permitem apenas estudos de curto prazo devido a sua rápida quê. Aqui, descrevemos 3D culturas fígado-em-um-microplaqueta de poeira, monoculturas ou em cocultures com outras células do fígado-residente de parênquimas. Estes oferecem uma melhoria significativa ao estudo a longo prazo infecções HBV com respostas de célula fisiológico do hospedeiro. Além de facilitar estudos de eficácia de drogas, análise toxicológica e investigações sobre patogênese, estes sistemas de cultura microfluidic permitem a avaliação de terapias curativas para infecção pelo VHB, tendentes a eliminar covalentemente fechado, circular (ccc) DNA. Este apresentado método descreve o set-up de monoculturas PHH e culturas co de células de Kupffer/PHH, a infecção com o VHB purificado e a análise das respostas do hospedeiro. Este método é particularmente aplicável à avaliação dos efeitos a longo prazo da infecção pelo VHB, combinações de tratamento e patogênese.
Introdução
O estudo do HBV foi complicado pela pobre susceptibilidade dos sistemas de cultura, que requerem várias centenas de milhares de cópias do genoma HBV por célula para iniciar a infecção1. Além disso, os hepatócitos humanos primários geralmente são excepcionalmente frágil e dedifferentiate rapidamente durante as culturas convencionais2. Isto é principalmente devido ao fato de que as superfícies de plástico lisas e dura não imitar os ambientes naturais extracelulares encontrados dentro do fígado e a falta de oxigenação das culturas na ausência de circulação microfluidic geral. Culturas de hepatócitos estáticos convencionais em placas com revestimento em colágeno rapidamente dedifferentiate e perdem a sua susceptibilidade à infecção de VHB3. Aqui, descrevemos o set-up e infecção de poeira crescida em culturas de fígado-em-um-microplaqueta 3D, que são imensamente vantajosas sobre convencional 2D estáticas culturas PHH em placas com revestimento em colagénio devido a sua competência estendida de metabólica e funcional, facilitando culturas a longo prazo pelo menos 40 dias4. Neste sistema, PHH são semeados em andaimes colágeno-revestido, que continuamente são pintadas com meio de cultura para fornecer oxigênio e nutrientes para as células. Apesar dos sistemas de cultura alternativa para PHH baseados no complexos cocultures de fibroblastos murino ou crescimento 3D em esferoides foram validados e são suscetíveis à infecção pelo VHB usando multiplicidades de infecção de 500 equivalentes do genoma (GE) do HBV por célula, 3D fígado-em-um-microplaqueta culturas permanecem suscetíveis a 0,05 sistema único modelo in vitro GE de HBV por célula4. Isto adicionalmente é sustentado pela necessidade do uso de altas concentrações de Dimetilsulfóxido (DMSO) e polietileno glicol (PEG) para estabelecer a infecção pelo VHB nessas culturas, que é dispensável para a infecção dos sistemas de cultura de fígado-em-um-microplaqueta 3D 4. entre as principais marcas do HBV infecção é a piscina de cccDNA, que atua como o modelo transcriptional para todos de novo–produzido virions5,6. Mesmo que o cccDNA pode ser detectado em culturas de hepatócitos convencional7,8, permanece incerto sobre se o Regulamento da cccDNA e quaisquer abordagens terapêuticas vistas a sua eliminação são recapituladas em parcialmente ou completamente os hepatócitos. Demonstrámos que cccDNA funcionalmente é formada em culturas de fígado-em-um-microplaqueta 3D, responde a estímulos fisiológicos e pode ser direcionado, interferindo com a acessibilidade da maquinaria transcricional do genoma de cccDNA4.
Respostas de anfitrião para infecção pelo VHB em 3D fígado-em-um-microplaqueta imitam aqueles observaram em pacientes infectados pelo VHB, permitindo a identificação de biomarcadores para infecção, bem como sucesso terapêutico. Entre as características únicas do fígado-em-um-microplaqueta culturas é a capacidade de avaliar as respostas de acolhimento a longo prazo entre a poeira e outras células parênquimas dentro do fígado, incluindo células4Kupffer, células estreladas9e fígado sinusoidal células endoteliais10,11. Isto oferece uma oportunidade única para avaliar interações célula/célula em um microambiente 3D complexa.
Além disso, o período prolongado de cultura desta plataforma facilita a avaliação dos tratamentos medicamentosos sequencial e seu impacto sobre a persistência do VHB, que não são possíveis usando sistemas de cultura hepatócito convencional.
Este protocolo descreve como 3D fígado-em-um-microplaqueta culturas são geradas, monoculturas de poeira ou para cocultures de poeira com células de Kupffer. Além disso, descrevemos a produção do HBV purificado para estudos de baixo-multiplicidade de infecção, bem como a análise posterior de host e respostas virais.
Protocolo
1. montagem e equilíbrio de placas
- Certifique-se de que tanto o compressor e a bomba de vácuo, associado com a plataforma LiverChip estão ativadas. Realizar a montagem e o equilíbrio das placas em uma classe II do armário.
- Assepticamente, monte as placas microfluidic colocando uma membrana estéril entre a base da placa e adicionando bem contendo placa superior (Figura 1a).
- Assegurem a membrana estéril suavemente os dois pinos da placa de base, desde compromissos de colocação de membrana desigual a circulação microfluidic.
- Adicione uma tampa da placa estéril e aperte os parafusos na base da placa usando um torque de precisão automatizado para 33 lb usando uma espiral sequência de aperto. Certifique-se de que todos os parafusos estão apertados a 35 lb usando um torque manual. Durante esta etapa, certifique-se os parafusos estão apertados simetricamente (Figura 1a).
- Escaldar hepatócito semeadura médio contendo Williams E médio, hepatócito primário, congelamentos e descongelamentos chapeamento suplementos, 5% de soro fetal bovino (FBS) e 1 µM dexametasona, a 37 ° C antes de aprontar.
- Prime a placa completamente montada por colocá-lo dentro da doca de lavagem e adicionar 400 µ l de hepatócito semeadura médio ao lado de cada poço de reservatório. Certifique-se de que placa de encaixa no dock lavar completamente.
- Iniciem o fluxo na direção ascendente para 3,5 min a 1 µ l/s. A função de sucesso da circulação microfluidic pode ser verificada através de indicadores de vermelho ao lado da placa (Figura 1a).
- Uma vez que o meio é bombeado ao lado da placa de crescimento celular, garantindo a correcta montagem do canal de fluxo, adicione um adicional 1,2 mL de hepatócito semeadura médio.
- Cuidadosamente, transferir a placa na estação de ancoragem dentro de uma incubadora umidificada a 37 ° C e 5% de CO2 e iniciar o fluxo na direção ascendente com um caudal de 1 µ l/s durante 16 h (Figura 1C).
- A placa de transferência para a doca de lavagem e eliminar bolhas no poço suavemente pipetando acima e para baixo.
- Adicione um estéril, por papel de filtro, seguido de um andaime de acessório de celular e um anel de retenção, a cada poço usando Pinças esterilizadas. Pressione cada bem com um desentupidor esterilizado para travar os anéis de retenção e andaimes no lugar (Figura 1b).
- Aspirar todos médio e adicionar 400 µ l de meio de propagação de hepatócito escaldadas suavemente sobre o andaime e iniciar o fluxo no sentido descendente para 3,5 min a 1 µ l/s.
- Aspirado de todos meio bombeado fora do lado do reservatório da placa. Essa etapa é necessária para substituir o meio contido no canal de fluxo.
- Adicione 1,4 mL de hepatócito semeadura médio para cada poço antes de retornar a placa para a doca para completar o volume total por bem. O volume por bem agora é 1,6 mL (1,4 mL no poço e 0,2 mL no canal de fluxo).
2. descongelar e propagação dos hepatócitos para monoculturas
- Escaldar hepatócito descongelar médio e médio semeadura de hepatócito a 37 ° C antes de descongelar um frasco de poeira, de acordo com as instruções dos fornecedores. Use uma centrífuga à temperatura ambiente durante esta etapa para evitar mudanças bruscas de temperatura. Execute o descongelamento e propagação dos hepatócitos em uma classe de gabinete II.
- Ressuspender as células em 1 mL de meio de propagação de hepatócitos e contar as células usando trypan azul. Certifique-se de que a viabilidade das células é acima de 90%.
- Manter as células no gelo até que eles são adicionados aos poços.
- Transferir a placa totalmente montada e equilibrada para a doca de lavar e aspirar todas as médias dos poços.
- Adicione 600.000 hepatócitos a cada poço em um volume de 500 µ l de meio de propagação de hepatócitos.
- Iniciar o fluxo no sentido descendente com um caudal de 1 µ l/s e traga o volume total do poço para 1,6 mL adicionando 900 µ l do hepatócito semeadura médio.
- Transferi a placa para a estação de ancoragem dentro de uma incubadora umidificada a 37 ° C e com 5% de CO2.
- Iniciem o fluxo no sentido descendente com um caudal de 1 µ l/s de 8 h, seguido de uma inversão do fluxo para a direção para cima com um caudal de 1 µ l/s de 8 h.
- Transferir a placa para a doca de lavar e aspirar todas as médias dos poços.
- Adicione 400 µ l de meio de manutenção do hepatócito (Williams E suplementado com suplementos de manutenção do hepatócito e 100 nM de dexametasona) para cada bem e iniciar o fluxo no sentido descendente com um caudal de 1 µ l/s por 3,5 min.
- Aspire todos meio do reservatório e adicione 1,4 mL de meio de manutenção do hepatócito (Figura 1D).
- Substitua o meio meio de manutenção do hepatócito cada 48 h. Para garantir que todas as médias no poço é substituído, execute uma etapa de lavagem antes da adição do meio de manutenção do hepatócito fresco.
- Para a etapa de lavagem, a placa de transferência para a doca de lavar, aspirar todos médio dos poços e adicionar 400 µ l de meio de manutenção.
- Iniciem o fluxo no sentido descendente a 1 µ l/s de 3,5 min. aspirado médio todos aparecendo do lado do reservatório dos poços.
- Adicionar 1,4 mL de meio de manutenção do hepatócito e, dentro de uma incubadora umidificada a 37 ° C e com 5% de CO2, transferir a placa na estação de ancoragem e iniciar o fluxo na direção ascendente com um caudal de 1 µ l/s durante 48 h (Figura 1f).
Nota: Por monoculturas de hepatócito utilizadas como controles para cocultures, a fim de assegurar condições controladas, é utilizado um segundo tipo de meio de manutenção, que é específico para uso nas cocultures com células de Kupffer humanas primárias. 48 h após substituir o hepatócito semeadura médio com meio de manutenção do hepatócito (3º dia pós-semeadura), o meio de manutenção regular do hepatócito será substituído por meio de manutenção coculture II, especialmente em monoculturas de poeira quando comparando a cocultures de células tanto PHH e Kupffer, como os componentes médias diferem ligeiramente.
3. descongelar e propagação de células de Kupffer e hepatócitos para culturas co
- A fim de garantir uma comparação exata dos resultados, sempre compare cocultures de célula de Kupffer/PHH para monoculturas de poeira
- Para cocultures de células PHH e Kupffer, descongelar um frasco de células de Kupffer no avançado de Dulbecco modificado médio da águia (AdDMEM) sem dexametasona mas suplementado com hepatócito primário descongelar e chapeamento suplementos (coculture semeadura médio) de acordo instruções dos fornecedores. Execute o descongelamento e propagação das células de Kupffer e hepatócitos em uma classe de gabinete II.
- Ressuspender as células em 1 mL de coculture semeadura médio e contar as células usando trypan azul. Certifique-se de que a viabilidade das células é acima de 90%.
- Manter as células no gelo antes de adicioná-los aos poços para evitar aderência de célula.
- Siga as instruções em passos 2.1-2.3 para o descongelamento de hepatócitos humanos primários.
- Transferir a placa totalmente montada e equilibrada para a doca de lavar e aspirar todas as médias dos poços.
- Adicione 60.000 células de Kupffer e/ou 600.000 hepatócitos a cada poço em um volume total de 250 μL de cada de coculture semeadura médio.
- Iniciar o fluxo no sentido descendente com um caudal de 1 µ l/s e adicionar 900 µ l de coculture semeadura médio para cada poço.
- Transferi a placa na estação de ancoragem dentro de uma incubadora umidificada a 37 ° C e com 5% de CO2.
- Iniciem o fluxo no sentido descendente com um caudal de 1 µ l/s de 8 h, seguido de reversão de fluxo para a direção para cima com um caudal de 1 µ l/s de 8 h.
- Transferir a placa para a doca de lavar e aspirar todas as médias dos poços.
- Adicione 400 µ l de meio de manutenção coculture I (AdDMEM sem dexametasona mas complementado com suplementos de manutenção do hepatócito) para cada bem e iniciar o fluxo no sentido descendente com um caudal de 1 µ l/s por 3,5 min.
- Aspire médio todos do lado do reservatório e adicione 1,4 mL de meio de manutenção coculture eu a cada poço.
- Transferir a placa na estação de ancoragem dentro de uma incubadora umidificada a 37 ° C e com 5% de CO2 e iniciar o fluxo na direção ascendente com um caudal de 1 µ l/s por 48 h.
- Transferir a placa para a doca de lavar e aspirar todas as médias dos poços. Adicione 400 µ l de meio de manutenção coculture II (médio E Williams sem dexametasona mas complementado com 100 nM hidrocortisona e hepatócito manutenção suplementos) e iniciar o fluxo no sentido descendente a 1 µ l/s por 3,5 min.
- Aspire médio todos aparecendo do lado do reservatório dos poços.
- Adicionar 1,4 mL de meio de manutenção coculture II e transferir a placa na estação de ancoragem dentro de uma incubadora umidificada a 37 ° C e com 5% de CO2.
- Iniciem o fluxo na direção ascendente com um caudal de 1 µ l/s durante 48 h (Figura 1e).
- Substitua o cada 48 h médio com meio de manutenção coculture II. Para garantir que todas as médias no poço é substituído, execute uma etapa de lavagem antes da adição de meio fresco.
- Para lavar, transferir a placa para a doca de lavar, aspirar todas as médias dos poços e adicione 400 µ l de meio de manutenção coculture II.
- Iniciem o fluxo no sentido descendente a 1 µ l/s de 3,5 min. aspirado médio todos aparecendo do lado do reservatório dos poços.
- Adicionar 1,4 mL de meio de manutenção coculture II e transferir a placa na estação de ancoragem dentro de uma incubadora umidificada a 37 ° C e com 5% de CO2e iniciar o fluxo na direção ascendente com um caudal de 1 µ l/s durante 48 h (Figura 1f).
4. produção de um vírus de Hepatite infecciosa B para estudos de infecção
- Execute esta seção do protocolo em um nível de confinamento laboratório III. Fazer a semeadura, mudanças de médio, média coleção e concentração de vírus em uma classe de gabinete II.
- Cultura de células produtoras de VHB (por exemplo, HepDE19, HepAD38) em frascos de 5 camadas de T1000 colágeno-revestido em 120 mL de DMEM/F12 completa (10% FBS, penicilina/steptomycin, aminoácidos não essenciais, 500 μg/mL G418 e tetraciclina 1 μg/mL) até atingirem a confluência de 90%.
- Altere o meio para indução médio (DMEM completa sem tetraciclina) para induzir a produção de HBV.
- Coletar o volume médio completo cada 48h pós retirada de 12 dias de tetraciclina e armazená-lo em 4 ° C.
- Filtre o meio coletado através de um filtro superior de garrafa de 0,45 µm.
- Adicionar estéril PEG 8000 em tampão fosfato salino (PBS) para o médio coletado para uma concentração final de 4% w/w, misture por inversão 8 x x-10 e incubar a 4 ° C, durante 16 h. centrifugar a 10.000 x g durante 1 h a 4 ° C, para coletar o vírus precipitou a PEG e ressuspender a pelota em PBS contendo 10% FBS.
- Combine o vírus precipitou a PEG de todos os pontos de tempo de colheita e mergulhá-la em cima de uma almofada de sacarose 20%. Centrifugar a 140.000 x g durante 16 h a 4 ° C, utilizando um rotor SW28.
- Aspirar o sobrenadante e ressuspender o precipitado em PBS, suplementado com 10% FBS e alíquota e armazená-lo a-80 ° C.
- Determine o número de cópia de HBV DNA presente no sobrenadante por qPCR HBV DNA (etapa 6).
5. infecção das culturas 3D com HBV
- Realize infecções em uma classe II gabinete dentro de um nível de confinamento laboratório III.
- 3 dias após a semeadura, as monoculturas ou cocultures, descongelar o número necessário de HBV-contendo alíquotas à temperatura ambiente e diluir a dose necessária de vírus em 1,8 mL de meio de manutenção do hepatócito ou meio de manutenção coculture II por alvéolo, respectivamente.
- Este vírus diluído 1,8 mL são suficiente para a etapa de lavagem (400 µ l) e a substituição do meio no poço (1,4 mL). No entanto, a multiplicidade exigida de infecção precisa ser ajustada para dar conta do volume de cultura final de 1,6 mL.
- Transferir a placa para a doca de lavar e aspirar todas as médias dos poços. Adicione 400 µ l de meio contendo HBV e iniciem o fluxo no sentido descendente a 1 µ l/s de 3,5 min. aspirado todos médio aparecendo do lado do reservatório dos poços.
- Adicione 1,4 mL de HBV-contendo médio/coculture manutenção II médio por bem e transferir a placa na estação de ancoragem dentro de uma incubadora umidificada a 37 ° C e com 5% de CO2. Iniciem o fluxo no sentido descendente com um caudal de 1 µ l/s de 8 h, seguido por uma reversão para a direção para cima com um caudal de 1 µ l/s.
- 24 h após a adição do HBV, transferir a placa para a doca de lavar e aspirar todas as médias dos poços.
- Cada um lavar bem na placa 3x com o correspondente médio, de acordo com o tipo de cultura conforme descrito em etapas 2.12 – 2.14, para eliminar o vírus sobra do poço. Em contraste com passos 2.12 – 2.14, adicione 1,6 mL do meio em cada poço a conta para o volume extra a amostra, para excluir o reporte de inóculo (Figura 1G).
- Depois destas etapas de lavagem, recolha 200 µ l do meio de cada poço para confirmar a remoção completa do inóculo VHB pela quantificação de DNA de HBV extracelular.
- A placa de transferência para a estação de ancoragem dentro de uma incubadora umidificada a 37 ° C e com 5% de CO2e iniciar o fluxo na direção ascendente com um caudal de 1 µ l/s por 48 h.
- 48 h depois, recolher o volume bem completo para análise a jusante, seguido de três lavagens com meio de manutenção do hepatócito, conforme descrito nas etapas 2.12 – 2.14. Substituir o medium e lavar cada bem 3x cada 48 h até rescisão experimental.
6. quantificação de DNA HBV extracelular
- Isole o DNA total dos sobrenadantes de cultura, de acordo com as instruções do fabricante com a adição de 1 µ g de transportadora RNA em um nível de confinamento laboratório III para garantir a inactivação de vírus nas amostras antes de movê-los para uma área diferente.
- Preparar uma mistura de mestre contendo mistura de mestre PCR quantitativa, primeira demão para a frente de 600 nM, primeira demão reversa de 600 nM e 300 nM de sonda.
- Adicione 7 µ l da mistura em cada poço de uma placa de 384 mestre.
- Adicionar 5 µ l de amostras de DNA em duplicado, um controle de não-modelo e duplicatas de serialmente diluída HBV genoma contendo baseados no plasmídeo padrão (por exemplo, pCMV-HBV) variando de 10 cópias de9 por reação de 10 cópias de2 por reação a cada poço do placa de qPCR.
- Coloque uma tampa adesiva sobre a placa e certifique-se de que cada um é selado bem corretamente.
- Centrifugue a placa por 1 min a 300 x g.
- Inicie o qPCR executar de acordo com as instruções do fabricante. As condições de ciclo de PCR em tempo real são 95 ° C por 10 min, seguido de 40 ciclos de 95 ° C por 15 s e 60 ° C por 1 min.
- Quantificar o número de cópias de DNA HBV dentro as amostras desconhecidas de acordo com a curva padrão.
7. quantificação de HBV intracelular Pregenomic (pg) do RNA
- Isole o RNA total dos andaimes de acordo com as instruções do fabricante. Para assegurar a lise celular completa, vórtice cada andaime 3 x 30 s seguido de centrifugação a 300 x g por 1 min entre cada utilização do vortex. Execute o lysis da pilha do nível de contenção laboratório III para garantir a inactivação de vírus nas amostras antes de movê-los para uma área diferente.
- Transcreva o cDNA de RNA isolado de acordo com as instruções do fabricante.
- As condições de ciclo para o retrotranscription são de 25 ° C por 10 min, a 37 ° C durante 120 min e 85 ° C por 5 min.
- Mantenha as amostras de cDNA a 4 ° C para curto prazo ou a-20 ° C para armazenamento a longo prazo.
- Prepare misturas mestre pgRNA e mistura mestre do quantitativa PCR RPS11 contendo e primers para diante e reversos para pgRNA e RPS11 (usado como gene das tarefas domésticas) em uma concentração final de 0,2 µM.
- Adicione 7,5 µ l do mix mestre e 2,5 µ l de cDNA por bem sobre uma placa de 384. Medir RPS11 e pgRNA de cada amostra em duplicado e incluir um controle de não-modelo bem para ambos os genes.
- Coloque uma tampa adesiva sobre a placa e certifique-se de que cada um bem está completamente selado.
- Centrifugue a placa por 1 min a 300 x g.
- Insira a placa para o reciclador de qPCR e começar o qPCR executar usando o protocolo padrão de PCR quantitativo de acordo com as instruções do fabricante. Se as condições de ciclo da PCR em tempo real 50 ° C por 2 min, 95 ° C por 2 min, seguido de 40 ciclos de 95 ° C por 15 s e 60 ° C por 1 min.
- Calcule a expressão do pgRNA em relação RPS11.
8. imunofluorescência coloração de antígeno Viral
- Remover o anel de retenção do poço e retirar o andaime com pinças em uma classe de gabinete II no laboratório III nível de contenção.
- Corrigi os andaimes que contêm células com paraformaldeído 4% em 1 mL de PBS durante 30 min à temperatura ambiente no nível de contenção laboratório III. As seguintes etapas podem ser executadas em uma área diferente.
- Lave os andaimes 3 x com 1 mL de PBS.
- Permeabilize as células usando 0.1% Triton X 100 em 1 mL de PBS por 1h à temperatura ambiente.
- Lave os andaimes 3 x com 1 mL de PBS.
- Bloco inespecificas de incubação dos andaimes com 1% de BSA em 1 mL de PBS para 16 h a 4 ° C.
- Lave os andaimes 3 x com 1 mL de PBS.
- Executar a mancha do anticorpo primário usando antígeno núcleo de coelho anti-hepatite B vírus a uma diluição de 1: 200 em BSA 1% em 1 mL de PBS para 16 h a 4 ° C.
- Lave os andaimes 1 x com 0.1% Tween em 1 mL de PBS (PBS-Tween) e 3 x 1 ml de PBS.
- Executar a mancha do anticorpo secundário usando cabra anti-coelho IgG (H + L) Cruz-adsorvido Alexa Fluor 594-conjugado anticorpo secundário a uma diluição de 1:2,000 em BSA 1% em 1 mL de PBS para 16 h a 4 ° C.
- Lave os andaimes de 1 x 1 ml de 0.1% PBS-Tween e 3 x 1 ml de PBS.
- Counterstain os andaimes usando DAPI em 1 mL de PBS em uma concentração de 2 µ g/mL por 10 min à temperatura ambiente.
- Lave os andaimes de 1 x 1 ml de 0.1% PBS-Tween e 3 x 1 ml de PBS.
- Transferir os andaimes para uma lâmina de microscópio e montá-lo para a imagem latente.
- Imagem os andaimes usando um microscópio de fluorescência.
9. humana albumina ELISA
- Execute esta seção do protocolo em uma classe II gabinete alocada no nível de contenção laboratório III se trabalhando com material infeccioso.
- Para avaliar a viabilidade e a funcionalidade metabólica de poeira, avalie a produção de albumina humana por ELISA.
- Placas de revestimento 96 poços com 50 μL por poço de anticorpo anti-humano de cabra diluem 1:800 no buffer de revestimento (bicarbonato/carbonato de 100 mM, pH 9,6). Cobrir as placas e incubar durante 2 h a 37 ° C ou durante a noite a 4 ° C.
- Aspire o anticorpo do revestimento da placa e lavá-lo 4x com 200 µ l de 0.05% Tween-PBS.
- Adicionar 200 µ l de tampão de bloqueio (1% de BSA em PBS), cobrir as placas e incube-os durante 1 h a 37 ° C ou armazená-los em 4 ° C por 3 meses. Para armazenamento a longo prazo, adicione 0,05% de azida de sódio para o tampão de bloqueio.
- Aspire o tampão de bloqueio e lavar 1x com 200 µ l de 0.05% Tween-PBS.
- Adicione 50 µ l de amostras previamente diluídas por alvéolo (1: 100). O diluente de amostra contém 1% de BSA em 0,05% Tween-PBS. Incubar durante 1 h a 37 ° C ou durante a noite a 4 ° C.
Nota: Incube os padrões ao mesmo tempo como as amostras. Um intervalo de concentração de 500 – 0.488 ng/mL (1:2 diluições em série) é recomendado. Execute todas as diluições de série de albumina humana no diluente de amostra. - Aspire as amostras da placa e lavá-lo 4x com 200 µ l de 0.05% Tween-PBS.
- Adicione 50 µ l de anticorpo anti-humano albumina de caprinos conjugados a HRP diluída previamente 1:10,000 no diluente de amostra. Incubar durante 2 h a 37 ° C ou durante a noite a 4 ° C.
- Aspire o anticorpo da placa e lavá-lo 6x com 200 µ l de 0.05% Tween-PBS.
- Adicione 100 µ l de reagente TMB e, assim que os mais altos padrões estão totalmente desenvolvidos, adicionar 100 µ l 1 M H2então4 para parar a reação colorimétrica.
- Ler a absorvância a 450 nm em um leitor de placa de 96 poços para análise.
10. interleucina (IL) 6 e factores de necrose tumoral (TNF) α produção em culturas co 3D
- Execute esta seção do protocolo em uma classe II gabinete alocada no nível de contenção laboratório III se trabalhando com material infeccioso.
- Quantificar a produção de IL6 e TNFa para avaliar a funcionalidade e a viabilidade das células de Kupffer primárias. Para induzir a produção dessas citocinas pelas células de Kupffer, trate cocultures com 1 lipopolissacarídeo de µ g/mL (LPS) 9 d pós-semeadura em meio de manutenção da coculture II por 48 h.
- No dia 11 pós-semeadura, colheita o meio de cada poço e armazená-lo a-80 ° C.
- Medir a concentração de IL6 e TNFa em meio de cultura por um ensaio apropriado e de acordo com as instruções do fabricante.
Resultados
Nós descrevemos uma plataforma simples e versátil para a cultura a longo prazo das células de Kupffer humanas primárias e/ou hepatócitos e sua infecção com o VHB. Células humanas primárias são semeadas em andaimes de poliestireno revestido de colágeno dentro de um assembly de placa microfluídicos, que continuamente perfuses as células com o meio de crescimento (Figura 1a).
PHH, que geralmente são apenas estável para uma quantidade limitada de tempo nos sistemas de cultura convencional, pode ser funcionalmente mantida por longos períodos de tempo. Albumina humana, que é secretada pelos hepatócitos funcionais e é considerada o melhor marcador para a avaliação do metabolismo hepático, é estável e altamente expressa por culturas 3D até dia 40 pós-semeadura (Figura 2). Para cocultures, a viabilidade e a funcionalidade de células de Kupffer podem ser avaliadas pela secreção de citocinas específicas (por exemplo, IL6 e TNFa). Para medir a produção de citocinas, a utilização de meios de detecção baseada em captura sobre LPS-estimulação de cocultures é recomendada (Figura 3).
Células formam microtissues hepática, geralmente dentro de 3 dias da semeação de poeira, demonstrando canalículos biliares funcional e polarização de célula completa (Figura 2). Além de manter seu metabolismo celular fisiológico, essas culturas tornam-se excepcionalmente suscetíveis à infecção pelo VHB. DNA do HBV e outros marcadores virais, em contraste com outros sistemas de cultura, tornam-se prontamente detectáveis de pós-infecção do dia 2 (Figura 4). Além secretados marcadores de infecção viral, contendo hepatócito andaimes podem ser obtidas de culturas e usados para detecção de antígenos virais imunofluorescência (por exemplo, HBsAg, HBcAg) (Figura 4). Onde culturas de hepatócitos convencionais exigem inoculação pelo menos 500 GE HBV por célula e a adição de DMSO de 2% e 4% PEG, sómente 0,05 HBV GE são capazes de iniciar a infecção em culturas em 3D sem a necessidade de DMSO ou PEG (Figura 4).
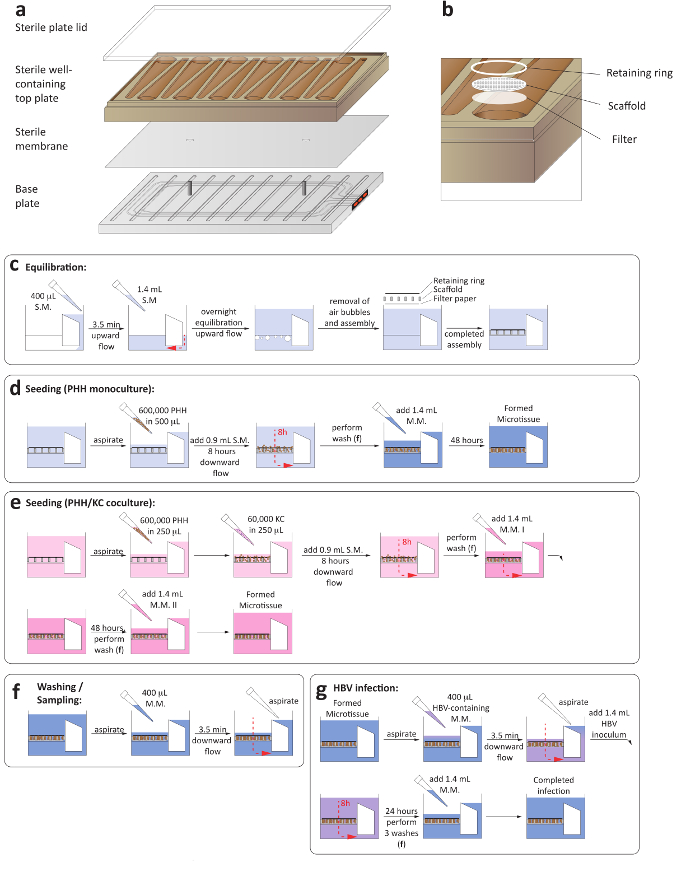
Figura 1: configuração das culturas de fígado-em-um-microplaqueta 3-d. (um) este é um layout esquemático para a montagem da placa de cultura para garantir o estabelecimento de circulação microfluidic. (b) este painel mostra uma visão mais apurada dos poços de cultura, incluindo o papel de filtro, andaime e anel de retenção. (c) este painel mostra o processo de equilíbrio de placa antes da semeadura das culturas. Os próximos dois painéis mostram o processo de propagação para monoculturas de hepatócitos (d) e (e) células de Kupffer/hepatócito cocultures. (f) este painel mostra as etapas de lavagem envolvidos em alterações médias. (g) este painel mostra a afinação de infecção pelo VHB, incluindo a remoção de um inóculo. S.M. = meio de semeadura, M.M = meio de manutenção. Clique aqui para ver uma versão maior desta figura.
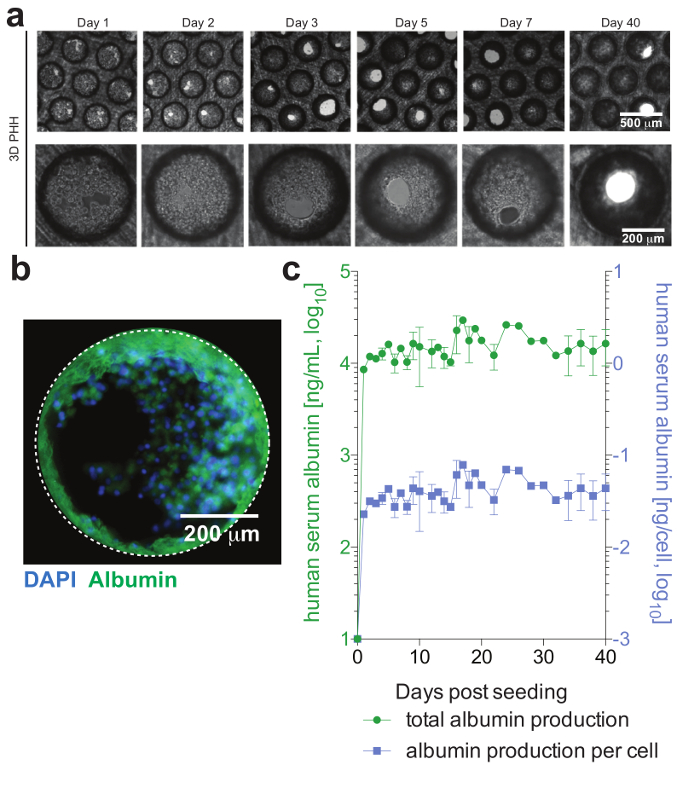
Figura 2: viabilidade de formação e hepatócito hepática microtissue. (um) este painel mostra imagens brightfield longitudinal de monoculturas hepatócito 3D demonstrando a formação de microtissue após semeadura. (b) este painel mostra imagens de imunofluorescência de culturas para núcleos (azul) e a albumina humana (verde). (c) este painel mostra longitudinal albumina total, bem como por célula ajustado produção de albumina, durante 40 dias de monoculturas de hepatócitos, conforme determinado pelo ELISA. Os dados mostrados são média ± SD Esta figura é adaptada de Ortega-Prieto et al.4. Clique aqui para ver uma versão maior desta figura.
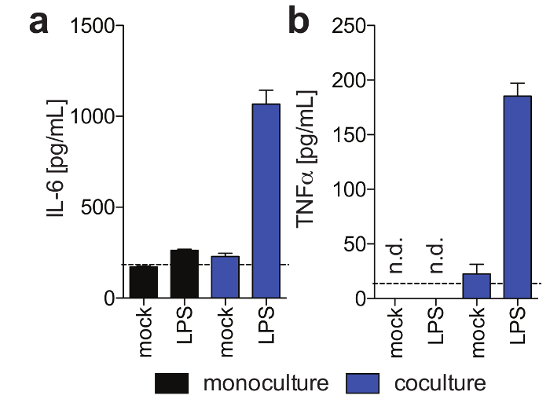
Figura 3: funcionalidade de células de Kupffer em 3-d cocultures. Estes painéis mostram a secreção de (um) IL6 e (b) TNFa em monoculturas de hepatócitos e células de Kupffer/hepatócito cocultures 11 dias pós-semeadura em resposta a LPS exogenamente adicionados no dia 9 post de semeadura, conforme determinado usando humana magnético Ensaio de Luminex. Esta figura é adaptada de Ortega-Prieto et al.4. Clique aqui para ver uma versão maior desta figura.
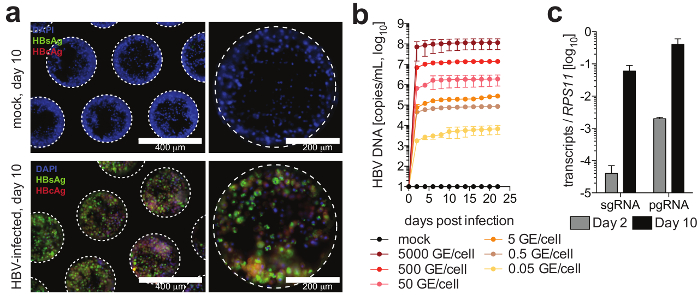
Figura 4: infecção pelo VHB em culturas de fígado-em-um-microplaqueta. (um) este painel mostra a detecção de microscopia de imunofluorescência de HBcAg (vermelho), HBsAg (verde) e núcleos (azul) 10 dias após a infecção das culturas com o VHB. (b) este painel mostra a susceptibilidade das culturas à infecção pelo VHB, usando diferentes multiplicidades de infecção, conforme determinado por uma quantificação do ADN do HBV nos sobrenadantes de cultura. (c) este painel mostra a quantificação da acumulação longitudinal de HBV pgRNA relativo para o gene de limpeza RPS11. Os dados mostrados são média ± SD Esta figura é adaptada de Ortega-Prieto et al.4. Clique aqui para ver uma versão maior desta figura.
Discussão
Os desafios em manter culturas a longo prazo de poeira têm impulsionado o desenvolvimento de diversos modelos de cultura com maior funcionalidade e longevidade, cada um exibindo diferenciais vantagens e desvantagens. Agora é amplamente reconhecido que culturas 2D estáticas de poeira estão imitando certos aspectos da biologia do hepatócito para quantidades muito limitadas de tempo. Assim, micropatterned cocultures12,13, esferoide culturas14,15, e culturas de fígado-em-um-microplaqueta 3D16,17 estão rapidamente substituindo estes sistemas mais básicos. Especialmente quando estudar doenças infecciosas, que evoluíram com seu anfitrião para utilizar específico microambiente, o requisito de fornecer ambientes fisiológicas é sustentado pela natureza muitas vezes desafiador de cultivo humano-tropic doenças infecciosas, incluindo o vírus da hepatite C, HBV e malária.
O passo mais crítico no desempenho 3D fígado-em-um-microplaqueta de culturas é a qualidade dos tipos inicialmente origem célula primária. Estas células devem ser testadas pela sua capacidade de aderência e apenas montes de poeira plateable devem ser usados para assegurar a formação de tecido de sucesso e geração de cultura. Mesmo que PHH recentemente isolado pode ser usado, sua criopreservação é geralmente complicada e requer especiais congeladores taxa-controlada.
Em contraste com culturas convencionais de 2D estáticas, o fundo genético de anfitrião é insignificante em relação à susceptibilidade à infecção pelo VHB, e todos os doadores do hepatócito testado até agora são capazes de estabelecer de infecção pelo VHB4.
Mesmo que o paciente-derivado HBV estabelece infecções das culturas 3D, é imperativo utilizar PEG-precipitado e sacarose coxim-purificado HBV sempre usando célula de produtor HBV inducible linhas para a geração de inóculos virais. Sobrenadantes de cultura celular aplicados diretamente às culturas de fígado-em-um-microplaqueta 3D, quer através da presença de fatores inibitórios ou devido a uma incompatibilidade de fatores de crescimento presentes com hepatócitos, prontamente não resultar em infecção. Além disso, ao selecionar paciente-derivado de inóculos virais, só soro deve ser usado, desde que o plasma, inevitavelmente, coagula e obstrui a circulação microfluidic da plataforma de cultura.
Independentemente do inóculo viral utilizado, assegurando a viabilidade celular e diferenciação, bem como assegurar a remoção completa do inóculo inicial HBV, é chave para o sucesso a longo prazo estudos de infecção. A maneira mais conveniente de fazer isto é amostragem culturas após a remoção do inóculo viral, bem como medir os níveis de albumina de soro humano durante todo o período de cultura. Da nota, da mesma forma para todas as outras plataformas descritas, infecção pelo VHB, uma vez estabelecida, não prontamente espalha para células não infectadas. O mecanismo subjacente para isto continua elusivo, já que a infecção pelo VHB em vivo prontamente infecta a maioria dos hepatócitos no fígado.
No que se refere cocultures de poeira, células de Kupffer, é aconselhável realizar testes de monte de células de Kupffer para avaliar a secreção IL6 e TNFa em resposta à estimulação de LPS, uma vez que nem todos os dadores de células de Kupffer comercialmente disponíveis têm uma capacidade de resposta igual.
Importante, para todos os tratamentos com drogas ou infecção inicial das culturas com HBV, o volume total do poço (1,4 mL), bem como a partir do canal microfluidic (0,2 mL), devem ser tomadas em consideração para o cálculo das concentrações de droga ou de inóculo. Para garantir a dosagem exata, uma etapa de lavagem com meio contendo HBV ou drogas é executada para prime o canal microfluidic.
A plataforma usada utiliza PHH 600.000 por bem, o que garante várias camados hepatócitos dentro os andaimes. Mesmo que o número de células pode ser variado, a concentração de células escolhido garante resultados óptimos. O formato da placa possui um total de 12 andaimes, que pode ser actualizada para 36 andaimes. No entanto, devido às exigências de microfluidic, intensificação para números bem mais altos não é possível até à data.
Usando essas abordagens, as culturas podem ser mantidas com desempenho de célula ideal pelo menos 40 dias, que, até então, oferece oportunidades sem precedentes para avaliar candidatos a novos fármacos, bem como estudar a complexa interação entre diferentes células hepáticas populações durante a infecção pelo VHB.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado por uma concessão do acionador de partida do Conselho Europeu de investigação (637304), um Wellcome Trust Investigator Award (104771/Z/14/Z) e pelas inovações de Bio CN.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| William's E Medium, no phenol red | GIBCO | A12176-01 | |
| Hepatocyte Thaw Medium | GIBCO | CM7500 | |
| Primary Hepatocyte Thawing and Plating Supplements | GIBCO | CM3000 | |
| Primary Hepatocyte Maintenance Supplements | GIBCO | CM4000 | |
| DMEM/F-12 | GIBCO | 11320-033 | |
| Advanced DMEM | GIBCO | 12491023 | |
| DPBS, no calcium, no magnesium | GIBCO | 14190-144 | |
| MEM Non-Essential Amino Acids (NEAA) 100x | GIBCO | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | GIBCO | 15140-122 | |
| Fetal Bovine Serum, USA origin, Heat Inactivated, sterile-filtered, suitable for cell culture | SIGMA | 12106C | |
| Hydrocortisone | SIGMA | H0888 | |
| Trypan blue | Merck | T8154 | |
| Collagen from calf skin | Merck | C9791 | |
| G418 | SIGMA | G418-RO | |
| Tetracycline | SIGMA | T3258 | |
| Polyethylene glycol 8000 | SIGMA | P2139 | |
| Sucrose | SIGMA | SO389 | |
| Sodium carbonate anhydrous | SIGMA | 451614-25G | |
| Sodium bicarbonate | SIGMA | S5761 | |
| Sodium azide | SIGMA | S2002-5G | |
| Sulfuric acid, 99.999% | SIGMA | 339741 | |
| 4% Paraformaldehyde | SIGMA | 252549 | |
| Triton-X 100 | SIGMA | X100 | |
| Tween 20 | SIGMA | P1379 | |
| DAPI | SIGMA | D9564 | |
| Albumin (human) | SIGMA | A9731 | |
| Fisher BioReagent Bovine Serum Albumin, Fraction V, Heat Shock Treated | Fisher Scientific | BP9701-100 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| TaqMan Universal Master Mix II, no UNG | Applied Biosystems | 4440040 | |
| SYBR Select Master Mix | Applied Biosystems | 4472903 | |
| Lipopolysaccharide from Escherichia coli K12 | InvivoGen | tlrl-eklps | |
| Name | Company | Catalog Number | Comments |
| Kits/Consumables | |||
| Sterile membrane | CN Bio innovations | LC-SC | |
| LiverChip Perfusion cell culture plate | CN Bio innovations | LC12 | |
| LiverChip culture plate lid | CN Bio innovations | LC-SC | |
| Sterile round filter paper | CN Bio innovations | LC-SC | |
| Cell attachment scaffold | CN Bio innovations | LC-SC | |
| Retaining ring | CN Bio innovations | LC-SC | |
| Sterile plunger | CN Bio innovations | LC-ST | |
| Dneasy blood & tissue kit | Qiagen | 69506 | |
| Rneasy mini kit | Qiagen | 74106 | |
| Human Magnetic Luminex assay | R&D Systems | ||
| 1-Step Ultra TMB-ELISA Substrate Solution | ThermoFisher Scientific | 34028 | |
| High Capacity cDNA Reverse Transcription Kit | ThermoFisher Scientific | 4368814 | |
| QIAamp Viral RNA Mini Accessory Set | Qiagen | 1048147 | Containing RNA carrier |
| Millicell HY 5-layer cell culture flask, T-1000, sterile | Millipore (Merck) | PFHYS1008 | |
| MicroAmp Optical 384-Well Reaction Plate with Barcode | Life technologies | 4309849 | |
| MicroAmp Optical Adhesive Film | Life technologies | 4311971 | |
| Clear Flat-Bottom Immuno Nonsterile 96-Well Plates | ThermoFisher Scientific | 442404 | |
| Sealing Tape for 96-Well Plates | ThermoFisher Scientific | 15036 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters with PES Membrane | ThermoFisher Scientific | 295-3345 | |
| Fisherbrand Microscopic Slides with Ground Edges, Twin Frost | Fisher Scientific | FB58628 | |
| Tube, Thinwall, Ultra-Clear, 38.5 mL, 25 x 89 mm | Beckman Coulter | 344058 | |
| Name | Company | Catalog Number | Comments |
| Primary cells / Cell lines | |||
| Human Plateable Hepatocytes, Transporter Qualified | Thermo Fisher Scientific | HMCPTS | |
| Cryopreserved Human Kupffer Cells | Thermo Fisher Scientific | HUKCCS | |
| HepDE19 cell line | Haitao Guo (Indiana University, IN, USA) | ||
| Name | Company | Catalog Number | Comments |
| Primers/Probes/Standards | |||
| HBV DNA forward primer | Invitrogen | 5'-GTGTCTGCGGCGTTTTATCA-3' | |
| HBV DNA reverse primer | Invitrogen | 5'-GACAAACGGGCAACATACCTT-3' | |
| HBV DNA probe | Invitrogen | 5'FAM-CCTCTKCATCCTGCTGCTATGCCTCATC-3'TAMRA | |
| pgRNA forward primer | Invitrogen | 5'-GAGTGTGGATTCGCACTCC-3' | |
| pgRNA reverse primer | Invitrogen | 5'-GAGGCGAGGGAGTTCTTCT-3' | |
| RPS11 forward primer | Invitrogen | 5'-GCCGAGACTATCTGCACTAC-3' | |
| RPS11 reverse primer | Invitrogen | 5'-ATGTCCAGCCTCAGAACTTC-3' | |
| pCMV-HBV | Professor Christoph Seeger (Fox Chase Cancer Centre, PA, USA) | ||
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Anti-Hepatitis B virus core antigen IgG fraction (polyclonal) | DAKO | discontinued | Lot 10102505 |
| Human Albumin Antibody, A80-129A | Bethyl Laboratories. inc | A80-129A | |
| Human Albumin cross-adsorbed Antibody, A80-229P | Bethyl Laboratories. inc | A80-229P | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher Scientific | # A-11072 | Lot 1431810 |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| LiverChip Vacuum pump | CN Bio innovations | LC-PN | |
| LiverChip Pneumatic Hookup | CN Bio innovations | LC-PN | |
| LiverChip platform | CN Bio innovations | LC-PN | |
| LiverChip plate washing dock | CN Bio innovations | ||
| Autoclavable metal forceps | VWR | 232-0106 | |
| Vortex Genie 2 | Scientific industries | SKU: SI-0236 | |
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A95765 | |
| Heraeus Multifuge X3R Centrifuge | Thermo Scientific | 75004500 | |
| SAM-12 Medical Suction High Vacuum High Flow | MGE worldwide | SAM12/01010101 | |
| NUAIRE 5800 SERIES incubator | NUAIRE | NU-5841 | |
| Automated precision torgue | CN Bio innovations | ||
| Manual torque | CN Bio innovations | ||
| LiverChip compressor | CN Bio innovations | ||
| Luminex LX-200 Instrument with xPONENT 3.1 | Luminex | ||
| Millipore Hand-Held Magnetic Separator Block | ThermoFisher Scientific | Millipore™ 40-285 | |
| FluoStar Optima Plate Reader | BMG Labtech | ||
| KOLVER Precision electric screwdrivers | VTECH ltd | FAB10RE/FR | |
| KOLVER Power supply | VTECH ltd | EDU1FR | |
| BAMBI VTS75D | Air Equipment | Discontinued | |
| Integra Vacuboy | INTEGRA | ||
| ViiA 7 Real-Time PCR System with 384-Well Block | ThermoFisher Scientific | 4453536 |
Referências
- Verrier, E. R., Colpitts, C. C., Schuster, C., Zeisel, M. B., Baumert, T. F. Cell Culture Models for the Investigation of Hepatitis B and D Virus Infection. Viruses. 8 (9), (2016).
- Elaut, G., et al. Molecular mechanisms underlying the dedifferentiation process of isolated hepatocytes and their cultures. Current Drug Metabolism. 7 (6), 629-660 (2006).
- Konig, A., et al. Kinetics of the bile acid transporter and hepatitis B virus receptor Na+/taurocholate cotransporting polypeptide (NTCP) in hepatocytes. Journal of Hepatology. 61 (4), 867-875 (2014).
- Ortega-Prieto, A. M., et al. 3D microfluidic liver cultures as a physiological preclinical tool for hepatitis B virus infection. Nature Communications. 9 (1), 682 (2018).
- Allweiss, L., Dandri, M. The Role of cccDNA in HBV Maintenance. Viruses. 9 (6), (2017).
- Guo, J. T., Guo, H. Metabolism and function of hepatitis B virus cccDNA: Implications for the development of cccDNA-targeting antiviral therapeutics. Antiviral Research. 122, 91-100 (2015).
- Lucifora, J., et al. Direct antiviral properties of TLR ligands against HBV replication in immune-competent hepatocytes. Scientific Reports. 8 (1), 5390 (2018).
- Hosel, M., et al. Hepatitis B Virus Activates Signal Transducer and Activator of Transcription 3 Supporting Hepatocyte Survival and Virus Replication. Cellular and Molecular Gastroenterology and Hepatology. 4 (3), 339-363 (2017).
- Mazza, G., et al. Rapid production of human liver scaffolds for functional tissue engineering by high shear stress oscillation-decellularization. Scientific Reports. 7 (1), 5534 (2017).
- Hang, T. C., Lauffenburger, D. A., Griffith, L. G., Stolz, D. B. Lipids promote survival, proliferation, and maintenance of differentiation of rat liver sinusoidal endothelial cells in vitro. American Journal of Physiology-Gastrointestinal and Liver Physiology. 302 (3), G375-G388 (2012).
- Hwa, A. J., et al. Rat liver sinusoidal endothelial cells survive without exogenous VEGF in 3D perfused co-cultures with hepatocytes. The FASEB Journal. 21 (10), 2564-2579 (2007).
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- March, S., et al. Micropatterned coculture of primary human hepatocytes and supportive cells for the study of hepatotropic pathogens. Nature Protocols. 10 (12), 2027-2053 (2015).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Griffith, L. G., Wells, A., Stolz, D. B. Engineering liver. Hepatology. 60 (4), 1426-1434 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados