Method Article
«Печени на чипе» культур первичных гепатоцитов и клеток Купфера для инфицирования вирусом гепатита B
В этой статье
Резюме
Цель настоящего Протокола заключается в предоставляют пошаговое руководство для 3-D «печени на чипе» инфекции эксперименты с вирусом гепатита в.
Аннотация
Несмотря на исключительные инфективности вируса гепатита в (HBV) в естественных условиях, где только три вирусных геномов может привести к хронизации экспериментально зараженных шимпанзе, наиболее в пробирке модели требуют нескольких сотен до тысяч вирусных геномов в ячейке чтобы инициировать переходных инфекции. Кроме того статические 2D культур первичных человеческих гепатоцитов (ПГГ) позволяют только краткосрочные исследования вследствие их быстрого дифференцировке. Здесь мы описываем 3D печени на чипе культур ПГГ, монокультур или в cocultures с другими клетками печени житель nonparenchymal. Они предлагают значительное улучшение для изучения долгосрочных HBV инфекции с физиологической принимающей ячейки ответы. Помимо содействия исследования эффективности препарата, токсикологического анализа и расследований в патогенезе, эти microfluidic культуры системы включить оценку лечебные терапии для инфекции ВГВ, направленных на ликвидацию ковалентно закрыт, циркуляр (КХЦ) ДНК. Представлен метод описывает структуры ПГГ монокультур и Сопредседатель культур клеток ПГГ/Купфера, их инфекции с очищенной ГВ и анализа принимающей ответов. Этот метод особенно применима для оценки долгосрочных последствий HBV инфекции, лечения комбинаций и патогенеза.
Введение
Исследование ГВ осложняется плохой восприимчивость систем культуры, требующие нескольких сотен до тысяч копий генома ГВ в ячейку, чтобы начать инфекции1. Кроме того основной человека гепатоцитов, как правило, исключительно хрупким и быстро дедифференцироваться во время обычных культур2. Это главным образом тем фактом, что плоские и жестких пластиковых поверхностей не имитировать естественный внеклеточных средах, в печени и общее отсутствие оксигенации культур в отсутствие microfluidic циркуляции. Обычные статические гепатоцитов культур на коллаген, покрытыми быстро дедифференцироваться и теряют их восприимчивость к инфекции HBV3. Здесь мы описываем set-up и инфекции ПГГ, выращенных в 3D печени на чипе культур, которые выгодны значительно на обычных 2D статического ПГГ культур на коллаген покрытием пластин из-за их расширенной метаболических и функциональной компетентности, содействие долгосрочные культуры по меньшей мере 40 дней4. В этой системе ПГГ являются семенами на коллаген покрытием лесов, которые постоянно увлажненную с среднего роста на поставку кислорода и питательных веществ к клеткам. Даже несмотря на то, что на основе систем альтернативной культуры для ПГГ комплекс cocultures мышиных фибробластов или 3D рост сфероидов были проверены и восприимчивы к инфекции ВГВ, используя кратности инфекции эквивалента 500 генома (GE) ГВ в клетку, 3D печень на чипе культур остаются единственным экстракорпоральное моделью системы подвержены 0,05 GE ГВ в ячейки4. Это дополнительно подкрепляется необходимость использования высоких концентраций диметилсульфоксида (ДМСО) и полиэтилен гликоль (PEG) установить ВГВ в этих культурах, который является необязательным для заражения систем 3D печени на чипе культуры 4. среди основных признаков HBV инфекции является бассейн cccDNA, который действует как транскрипционный анализ шаблон для всех de novo–производства вирионы5,6. Даже несмотря на то, что cccDNA могут быть обнаружены в обычных гепатоцитов культур7,8, остается неясным ли регулирование cccDNA и любые терапевтические подходы, направленные на его ликвидацию изъятый в частично или полностью Дедифференцированная гепатоцитов. Мы показали, что cccDNA функционально формируется в 3D печени на чипе культур, реагирует на физиологические стимулы и может быть объектом вмешательства с доступностью механизма транскрипционный анализ генома cccDNA4.
Размещать ответы на инфекции ВГВ в 3D мнемосхемы печени на чипе, те наблюдается у пациентов, инфицированных ВГВ, позволяя идентификация biomarkers для инфекции, а также терапевтического успеха. Среди уникальных особенностей печени на чипе культур является способность оценить долгосрочные принимающей ответов между ПГГ и другие nonparenchymal клетки в печени, включая4клетки Купфера, севрюга клетки9и печени синусоидального эндотелиальные клетки10,11. Это дает уникальную возможность для оценки взаимодействия клеток/клеток в сложных 3D микроокружения.
Кроме того расширенный культуры периода этой платформы облегчает оценки последовательных лекарств и их влияние на ГВ сохраняемости, которые не возможно с использованием обычных гепатоцитов культуры систем.
Этот протокол описывает как 3D печени на чипе культуры создаются для монокультур ПГГ либо cocultures ПГГ с клеток Купфера. Кроме того мы описываем производства очищенного ВГВ для исследования низкой кратности инфекции, а также последующего анализа хоста и вирусных ответов.
протокол
1. Ассамблея и уравновешивания пластин
- Убедитесь, что компрессор и вакуумный насос, связанные с платформой LiverChip включены. Выполните сборку и уравновешивания пластин в классе II кабинета.
- Асептически Соберите microfluidic пластины, поместив стерильные мембрану между основанию пластины и добавив хорошо содержащие верхней пластины (рис. 1a).
- Убедитесь, что стерильные мембраны плавно лежит на двух штифтах основание, с неравномерным мембраны размещения компромиссов microfluidic циркуляции.
- Добавьте стерильные пластина крышки и затяните винты на базе пластину с помощью автоматизированных точность крутящего момента на 33 фунтов с помощью спирали ужесточения последовательности. Убедитесь, что все винты затянуты до 35 фунтов с помощью ручной крутящий момент. Во время этого шага, обеспечения винты затянуты симметрично (рис. 1a).
- Prewarm гепатоцитов посева средних содержащие Уильямс E средний, первичный гепатоцитов оттаивания и покрытие добавки, 5% плода бычьим сывороточным (ФБС) и 1 мкм дексаметазон до 37 ° C до грунтовки.
- Премьер пластину полностью собран, поместив его в док стиральные и добавив 400 мкл гепатоцитов, посев средней водохранилища стороне каждой скважины. Убедитесь, что пластины встанет в док Стиральная полностью.
- Инициировать процесс в сторону для 3,5 мин в 1 мкл/сек. Функцию успешно microfluidic обращения может быть установлено через красные индикаторы на стороне пластины (рис. 1a).
- После того, как носитель перекачивается в сторону роста клеток пластины, обеспечивая правильную сборку канала потока, добавьте дополнительные 1,2 мл гепатоцитов, посев среднего.
- Тщательно передачи пластину в док-станцию в увлажненные инкубатора при 37 ° C и 5% CO2 и инициировать процесс в сторону со скоростью потока 1 мкл/сек для 16 h (рис. 1С).
- Передача пластину для стирки док и ликвидировать пузыри в колодец, нежно закупорить вверх и вниз.
- Добавьте один стерильные, раунд фильтровальная бумага, следуют леску вложение клеток и кольцо, для каждой скважины с использованием стерильный пинцет. Нажмите каждой скважины с стерильных поршень, чтобы зафиксировать стопорные кольца и подмости (рис. 1b).
- Аспирационная всех средних и мкл 400 подогретую гепатоцитов посева среднего мягко на эшафот и инициировать потока в направлении вниз 3,5 мин в 1 мкл/сек.
- Аспирационная всех средних перекачивается из водохранилища стороне пластины. Этот шаг необходим для замены среднего, содержащихся в канале потока.
- Добавьте 1.4 мл гепатоцитов, посев среднего для каждой скважины до возвращения пластину в dock, чтобы завершить общий объем за хорошо. Объем в хорошо теперь составляет 1,6 мл (1,4 в колодец и 0,2 мл в канале потока).
2. оттаивания и посев гепатоцитов для монокультуры
- Prewarm гепатоцитов оттаивания среднего и гепатоцитов посева среднего до 37 ° C до таяния один флакон ПГГ согласно инструкции поставщиков. Используйте центрифуги при комнатной температуре во время этого шага, чтобы избежать резких температурных изменений. Выполните оттаивания и заполнения гепатоцитов в классе II кабинета.
- Ресуспензируйте клеток в 1 мл гепатоцитов посева среды и подсчитать количество ячеек с помощью Трипановый синий. Убедитесь, что жизнеспособность клеток выше 90%.
- Держите клетки на льду, до тех пор, пока они добавляются к скважинам.
- Передать Стиральная док пластину уравновешенной и полностью собран и аспирационная всех средних из скважин.
- Добавьте 600.000 гепатоцитов в каждой скважины в объеме 500 мкл гепатоцитов инициализации среды.
- Инициировать потока в направлении вниз со скоростью потока 1 мкл/s и довести общий объем в скважине до 1,6 мл, добавив 900 мкл гепатоцитов, посев среднего.
- Передача пластину в док-станцию в увлажненные инкубатора при 37 ° C и с 5% CO2.
- Инициировать потока в направлении вниз со скоростью потока 1 мкл/сек за 8 ч, следуют потока разворот в сторону со скоростью потока 1 мкл/сек за 8 ч.
- Передача пластину для стирки док и аспирационная всех средних из скважин.
- Мкл 400 гепатоцитов обслуживания среды (Уильямс E средний дополнена гепатоцитов обслуживания добавки и 100 Нм дексаметазон) в каждой хорошо и инициировать поток в направлении вниз со скоростью потока 1 мкл/сек для 3,5 мин.
- Аспирационная всех средних из водохранилища и добавьте 1.4 мл гепатоцитов обслуживания среды (рис. 1 d).
- Замените носитель гепатоцитов обслуживания среднего каждые 48 ч. Чтобы заменить все среды в колодец, выполните шаг стирки перед добавлением свежей гепатоцитов обслуживания среды.
- Для стирки шага передавать пластину для стирки док, аспирационная всех средних из скважин и 400 мкл обслуживания среды.
- Инициировать потока в направлении вниз в 1 мкл/сек для 3,5 мин аспирата всех средних, появляясь на стороне водохранилище скважин.
- Добавить 1.4 мл гепатоцитов обслуживания среды и, в пределах увлажненные инкубатора при 37 ° C и с 5% CO2, передача пластину в док-станцию и инициировать потока в направлении вверх со скоростью потока 1 мкл/сек за 48 ч (Рисунок 1f).
Примечание: Для гепатоцитов монокультур, используемых как элементы управления для cocultures, с тем чтобы обеспечить контролируемых условиях второй тип обслуживания среды используется, который специфичен для использования в cocultures с первичных человеческих клеток Купфера. 48 ч после замены гепатоцитов, посев средней с среднего обслуживания гепатоцитов (3-й день после посева), средство поддержания регулярных гепатоцитов будут заменены coculture обслуживания среднего II, особенно монокультур ПГГ при сравнении cocultures ПГГ и Купфера клеток, как компонентов среды отличаются.
3. оттаивания и заполнение клеток Купфера и гепатоцитов для совместного культур
- Чтобы обеспечить точное сравнение результатов, всегда Сравните ПГГ/Купфера клеток cocultures для ПГГ монокультур
- Для cocultures клеток ПГГ и Купфера, размораживать один флакон клеток Купфера в передовых Дульбекко изменены орла среднего (AdDMEM) без дексаметазон, но с первичной гепатоцитов оттаивания и покрытия добавки (coculture посев средней) согласно для поставщиков инструкции. Выполните оттаивания и заполнение клеток Купфера и гепатоцитов в классе II кабинета.
- Ресуспензируйте клеток в 1 мл coculture посева среднего и подсчитать количество ячеек с помощью Трипановый синий. Убедитесь, что жизнеспособность клеток выше 90%.
- Держите клетки на льду перед добавлением их к скважинам избежать клеточной адгезии.
- Следуйте инструкциям шагов 2.1 – 2.3 для оттаивания первичных человеческих гепатоцитов.
- Передать Стиральная док пластину уравновешенной и полностью собран и аспирационная всех средних из скважин.
- Добавьте 60000 Купфера и/или 600.000 гепатоцитов к каждой скважины в общем объеме 250 мкл coculture посева среднего.
- Инициировать потока в направлении вниз со скоростью потока 1 мкл/с и 900 мкл coculture посева среднего для каждой скважины.
- Перенесите пластину в док-станцию в увлажненные инкубатора при 37 ° C и с 5% CO2.
- Инициировать потока в направлении вниз со скоростью потока 1 мкл/сек за 8 ч, следуют потока разворот в сторону со скоростью потока 1 мкл/сек за 8 ч.
- Передача пластину для стирки док и аспирационная всех средних из скважин.
- 400 мкл coculture обслуживания среды I (AdDMEM без дексаметазона но с гепатоцитов обслуживания добавки) к каждой хорошо и инициировать потока в направлении вниз со скоростью потока 1 мкл/сек для 3,5 мин.
- Аспирационная всех средних со стороны водохранилища и добавить 1.4 мл coculture обслуживания среды I к каждой скважины.
- Передача пластину в док-станцию в увлажненные инкубатора при 37 ° C и с 5% CO2 и инициировать процесс в сторону со скоростью потока 1 мкл/сек за 48 ч.
- Передача пластину для стирки док и аспирационная всех средних из скважин. 400 мкл coculture обслуживания среды II (Уильямс E средний без дексаметазона но с 100 Нм гидрокортизон и гепатоцитов содержание добавок) и инициировать потока в направлении вниз в 1 мкл/сек для 3,5 мин.
- Аспирационная всех средних, появляясь на стороне водохранилище скважин.
- Добавьте 1.4 мл coculture обслуживания среды II и передачи пластину в док-станцию в увлажненные инкубатора при 37 ° C и с 5% CO2.
- Инициировать процесс в сторону со скоростью потока 1 мкл/сек за 48 ч (Рисунок 1e).
- Замените coculture обслуживания среднего II Средний каждые 48 ч. Чтобы заменить все среды в колодец, выполните шаг стирки перед добавлением свежей среды.
- Мыть, передача, закрепить пластину для стирки, аспирационная всех средних из скважин и 400 мкл coculture обслуживания среды II.
- Инициировать потока в направлении вниз в 1 мкл/сек для 3,5 мин аспирата всех средних, появляясь на стороне водохранилище скважин.
- Добавьте 1.4 мл coculture обслуживания среды II передаче пластину в док-станцию в увлажненные инкубатора при 37 ° C и с 5% CO2и инициировать процесс в сторону со скоростью потока 1 мкл/сек за 48 ч (Рисунок 1f).
4. производство вируса инфекционного гепатита B инфекции исследований
- Выполните этот раздел протокола сдерживания уровня III лаборатории. Сделайте посев, среднего изменения, средний сбор и концентрацию вируса в классе II кабинета.
- Культура HBV-продуцирующие клетки (например, HepDE19, HepAD38) в коллагена покрытием колбы 5-слойный T1000 в 120 мл полной DMEM/F12 (10% FBS, пенициллин/steptomycin, заменимые аминокислоты, 500 мкг/мл G418 и тетрациклинов 1 мкг/мл) до тех пор, пока они достигают 90% confluency.
- Измените среднего индукции среднего (полного DMEM без тетрациклина) чтобы побудить производство ВГВ.
- Полный средний объем каждые 48 ч 12 дней после вывода тетрациклин собирать и хранить при 4 ° C.
- Фильтр собранные среднего через фильтр Топ бутылку 0,45 мкм.
- Добавьте стерильные PEG 8000 в фосфат амортизированное saline (PBS) собранных среднего до конечной концентрации 4% w/w, смешивать, инвертирование 8 x-10 x и Инкубируйте на 4 ° C для 16 h. центрифуги на 10000 x g за 1 ч при 4 ° C для сбора PEG-осаждают вирус и Ресуспензируйте гранулы в PBS, содержащие 10% FBS.
- Объединить PEG-осаждают вируса от всех лесозаготовительных пунктов времени и слой поверх подушки 20% сахарозы. Центрифуга на 140 000 x g для 16 ч при 4 ° C, с помощью SW28 ротора.
- Аспирационная супернатант и Ресуспензируйте гранулы в PBS, дополненная 10% FBS и Алиготе и храните его при температуре-80 ° C.
- Определите номер копии HBV ДНК в надосадке ПЦР HBV ДНК (шаг 6).
5. инфекции 3D культур с ГВ
- Выполняют инфекции в классе II кабинета в рамках сдерживания уровня III лаборатории.
- 3 дней после посева монокультур или cocultures, оттепель требуемое количество HBV-содержащих аликвоты при комнатной температуре и разбавленных необходимые вирус дозы в 1,8 мл гепатоцитов обслуживания среднего или среднего обслуживания coculture II в колодец, соответственно.
- Этот 1,8 мл разбавленной вирус является достаточным для стирки шаг (400 мкл) и замена среднего в скважине (1.4 мл). Однако требуется кратность инфекции необходимо быть скорректирована с учетом окончательного культуры объем 1,6 мл.
- Передача пластину для стирки док и аспирационная всех средних из скважин. 400 мкл HBV-содержащих среды и инициировать потока в направлении вниз в 1 мкл/сек для 3,5 мин аспирата всех средних появляясь на стороне водохранилище скважин.
- Добавьте 1.4 мл HBV-содержащих уход средне/coculture обслуживание, средний II за хорошо и передачи пластину в док-станцию в увлажненные инкубатора при 37 ° C и с 5% CO2. Инициировать потока в направлении вниз со скоростью потока 1 мкл/сек за 8 ч, следуют разворот в сторону со скоростью потока 1 мкл/сек.
- 24 часа после добавления ГВ, передача пластину Стиральная док и аспирационная всех средних из скважин.
- Мыть каждый хорошо в пластине 3 x с соответствующий средний, в зависимости от типа культуры изложенные в шаги 2.12 – 2.14, для ликвидации оставшихся вирус из колодца. В отличие от шаги 2.12 – 2.14 добавьте 1,6 мл среды в каждой скважине для учета дополнительных тома, чтобы отведать исключить посевным материалом уноса (рис. 1 g).
- После этих шагов Стиральная Соберите 200 мкл среды от каждой скважины для подтверждения полного удаления HBV посевным материалом по количественной оценке внеклеточной ДНК HBV.
- Передача пластину в док-станцию в увлажненные инкубатора при 37 ° C и с 5% CO2и инициировать процесс в сторону со скоростью потока 1 мкл/сек за 48 ч.
- 48 часов позже, собирать полный объем хорошо течению анализа, следуют три автомойки с среднего обслуживания гепатоцитов, изложенные в шагах 2.12 – 2.14. Замените носитель и мыть каждый хорошо 3 x каждые 48 ч до экспериментальных прекращения.
6. Количественная оценка внеклеточного HBV ДНК
- Изолируйте всего ДНК от supernatants культуры согласно инструкциям производителя с добавлением 1 мкг перевозчика РНК в сдерживания уровня III лаборатории обеспечить инактивацию вируса в образцах до их перемещения в другую область.
- Подготовка мастер смесь содержащие количественного PCR Мастер микс, 600 Нм вперед грунт, 600 Нм обратный грунт и 300 Нм зонда.
- 7 мкл мастер смесь в каждой скважине 384-ну плиты.
- 5 мкл образцов ДНК в дубликат и без шаблон управления, дубликаты серийно разреженных HBV геном содержащих плазмида-стандарт на основе (например, pCMV ВГВ) начиная от 109 копий на реакции на 102 копий за реакцией на каждом колодец ПЦР пластины.
- Место клей крышка над пластину и убедитесь, что каждый хорошо запечатан правильно.
- Центрифуга пластину за 1 мин на 300 x g.
- Запустите ПЦР, выполняться в соответствии с инструкциями производителя. Условия цикла для ПЦР в реальном времени являются 95 ° C в течение 10 мин, после чего 40 циклов 95 ° c 15 s и 60 ° C в течение 1 мин.
- Подсчитать количество копий ДНК HBV в неизвестных образцов по калибровочной кривой.
7. Количественная оценка внутриклеточных HBV Pregenomic (pg) РНК
- Изолируйте всего РНК из леса согласно инструкциям производителя. С тем чтобы обеспечить полное клеток лизиса, вихревой каждый эшафот 3 x 30 s после центрифугирования в 300 x g 1 мин между каждой vortexing. Выполните lysis клетки сдерживания уровня III лаборатории обеспечить инактивацию вируса в образцах до их перемещения в другую область.
- Транскрибируйте cDNA от изолированных РНК согласно инструкциям производителя.
- Условия цикла для retrotranscription, 25 ° C в течение 10 мин, 37 ° C в течение 120 минут и 85 ° C за 5 мин.
- Храните образцы cDNA на 4 ° C для краткосрочных или при-20 ° C для длительного хранения.
- Подготовка мастер смеси для pgRNA и RPS11 содержащий количественного PCR мастер смеси и прямого и обратного Праймеры для pgRNA и RPS11 (используется как уборка гена) в конечной концентрации 0,2 мкм.
- Добавьте 7,5 мкл мастер смеси и 2,5 мкл cDNA в колодец на тарелку, 384-хорошо. Измерения RPS11 и pgRNA каждого образца в двух экземплярах и включать без шаблон управления хорошо для обоих генов.
- Место клей крышка над пластину и убедитесь, что каждый хорошо запечатан полностью.
- Центрифуга пластину за 1 мин на 300 x g.
- Вставьте пластину в циклователь ПЦР и начать работать с использованием стандартных количественной ПЦР протокола согласно инструкциям производителя ПЦР. Условия цикла для ПЦР в реальном времени – 50 ° C за 2 мин., 95 ° C в течение 2 мин, после чего 40 циклов 95 ° c 15 s и 60 ° C в течение 1 мин.
- Вычислите выражение pgRNA по отношению к RPS11.
8. иммунофлюоресценции пятнать вирусного антигена
- Удалите стопорное кольцо из колодца и леска с щипцами в классе II кабинет в сдерживания уровня III лаборатории.
- Исправьте ячейки содержащих подмости с параформальдегида 4% в 1 мл PBS на 30 минут при комнатной температуре в сдерживания уровня III лаборатории. В другой области, можно выполнить следующие действия.
- Вымойте Подмости 3 x с 1 мл раствора PBS.
- Разрушения клеток с использованием 0,1% тритон-X 100 в 1 мл PBS в течение 1 ч при комнатной температуре.
- Вымойте Подмости 3 x с 1 мл раствора PBS.
- Блок-неспецифический привязки по инкубации подмости с 1% BSA в 1 мл PBS для 16 h при 4 ° C.
- Вымойте Подмости 3 x с 1 мл раствора PBS.
- Выполнять основное антитело пятная с помощью кролика против гепатита B вирус основных антигена в разведении 1: 200 в 1% BSA в 1 мл PBS для 16 h при 4 ° C.
- Вымойте подмости 1 x с 0.1% анимации в 1 мл PBS (PBS-анимации) и 3 x с 1 мл раствора PBS.
- Выполнять, вторичное антитело пятная с помощью коза анти кролик IgG (H + L) кросс адсорбированные Alexa Fluor 594-конъюгированных вторичное антитело при разбавлении стоматологов в 1% BSA в 1 мл PBS для 16 h при 4 ° C.
- Вымойте подмости 1 x 1 мл 0,1% PBS-анимации и 3 x с 1 мл раствора PBS.
- Counterstain леса, используя DAPI в 1 мл PBS в концентрации 2 мкг/мл по 10 мин при комнатной температуре.
- Вымойте подмости 1 x 1 мл 0,1% PBS-анимации и 3 x с 1 мл раствора PBS.
- Передача подмости для микроскопа и смонтировать его для обработки изображений.
- Изображения подмости с помощью микроскопа флуоресценции.
9. человеческого альбумина ELISA
- Выполните этот раздел протокола в классе II кабинета выделены сдерживания уровня III лаборатории, если работать с инфекционным материалом.
- Для оценки жизнеспособности и метаболические функции ПГГ, оценки производства человеческого альбумина, ELISA.
- Пальто-96-луночных пластины с 50 мкл на хорошо антитела анти человека коза разбавленный терапевтами в буфер покрытия (бикарбонат/карбонат 100 мм, pH 9.6). Накладки и проинкубируйте 2 ч при 37 ° C или на ночь при 4 ° C.
- Аспирационная покрытие антитела от плиты и мыть его 4 x с 200 мкл 0,05% PBS-анимации.
- Добавить 200 мкл блокировки буфера (1% BSA в PBS), накладки и инкубировать их за 1 ч при 37 ° C или хранить их при температуре 4 ° C на 3 месяца. Для длительного хранения добавьте азид натрия 0.05% блокирующий буфер.
- Аспирационная блокирующий буфер и вымыть 1 x с 200 мкл 0,05% PBS-анимации.
- Добавьте 50 мкл ранее Разводненная выборок на хорошо (1: 100). Разбавителя образец содержит 1% BSA в 0,05% PBS-анимации. Инкубировать 1 час при 37 ° C или на ночь при 4 ° C.
Примечание: Инкубируйте стандартов в то же время как образцы. Диапазон концентраций 500 – 0.488 нг/мл (1:2 серийных разведений) рекомендуется. Выполнение всех серийных разведений человеческого альбумина в образце разбавителя. - Аспирационная образцы от плиты и мыть его 4 x с 200 мкл 0,05% PBS-анимации.
- Добавьте 50 мкл HRP-конъюгированных коза античеловеческие альбумина антитела предварительно разводят мэм в образце разбавителя. Проинкубируйте 2 ч при 37 ° C или на ночь при 4 ° C.
- Аспирационная антитела от плиты и мыть его 6 x с 200 мкл 0,05% PBS-анимации.
- 100 мкл Реагента ТМБ и, как только полностью развиты высокие стандарты, добавить 100 мкл 1 М H2так4 остановить колориметрические реакции.
- Читайте поглощения в 450 Нм на 96-луночных пластины reader для анализа.
10. интерлейкина-(IL) 6 и фактор некроза опухоли (ФНО) α производства в 3D Сопредседатель культур
- Выполните этот раздел протокола в классе II кабинета выделены сдерживания уровня III лаборатории, если работать с инфекционным материалом.
- Количественную оценку производства IL6 и TNFα, с тем чтобы оценить функциональность и жизнеспособность первичных клеток Купфера. Чтобы побудить производство этих цитокинов клетками Купфера, лечить cocultures с 1 мкг/мл липополисахарида (LPS) 9 d после посева в средстве обслуживания coculture II в течение 48 часов.
- В день 11 после посева, урожай средний от каждой скважины и храните его при температуре-80 ° C.
- Измерьте IL6 и TNFα концентрации в среде культуры путем соответствующего анализа и в соответствии с инструкциями производителя.
Результаты
Мы опишем простой и универсальный платформы для долгосрочного культуры первичных человеческих клеток Купфера или гепатоцитов и их инфекции HBV. Первичных клеток человека посеян на коллаген покрытием из полистирола леса в сборке microfluidic пластины, которая постоянно perfuses клетки с среднего роста (Рисунок 1a).
ПГГ, который обычно стабильны только за ограниченное количество времени в системах обычных культуры, могут поддерживаться функционально для длительных периодов времени. Человеческого альбумина, который секретируется функциональных гепатоцитов и считается лучшим маркера для оценки печеночный метаболизм, стабильно и высоко выражается 3D культур до день 40 после заполнения (рис. 2). Для cocultures клеток Купфера функциональность и жизнеспособности могут быть оценены секрецию определенных цитокинов (например, IL6 и TNFα). Чтобы измерить производство цитокинов, (рис. 3) рекомендуется использовать средства на основе захвата обнаружения на LPS-стимуляция cocultures.
Клетки образуют печёночной microtissues, обычно в течение 3 дней после посева ПГГ, демонстрируя функциональных желчных канальцев и полная ячейка поляризации (рис. 2). Помимо сохранения их физиологических клеточный метаболизм, эти культуры становятся исключительно восприимчивыми к инфекции HBV. HBV ДНК и других вирусных маркеров, в отличие от других систем культуры, становятся легко обнаружить с 2 день после инфекции (рис. 4). Помимо секретируемые маркеров вирусной инфекции, гепатоцито содержащих подмостей могут быть извлечены из культур и используется для обнаружения вирусных антигенов иммунофлюоресценции (например, HBsAg, HBcAg) (Рисунок 4). Где обычных гепатоцитов культур требуют прививки с по крайней мере 500 HBV GE в клетки и добавлением 2% ДМСО и 4% PEG, как 0,05 HBV GE возможность инициировать инфекции в 3-D культур без требования ДМСО или ПЭГ (рис. 4).
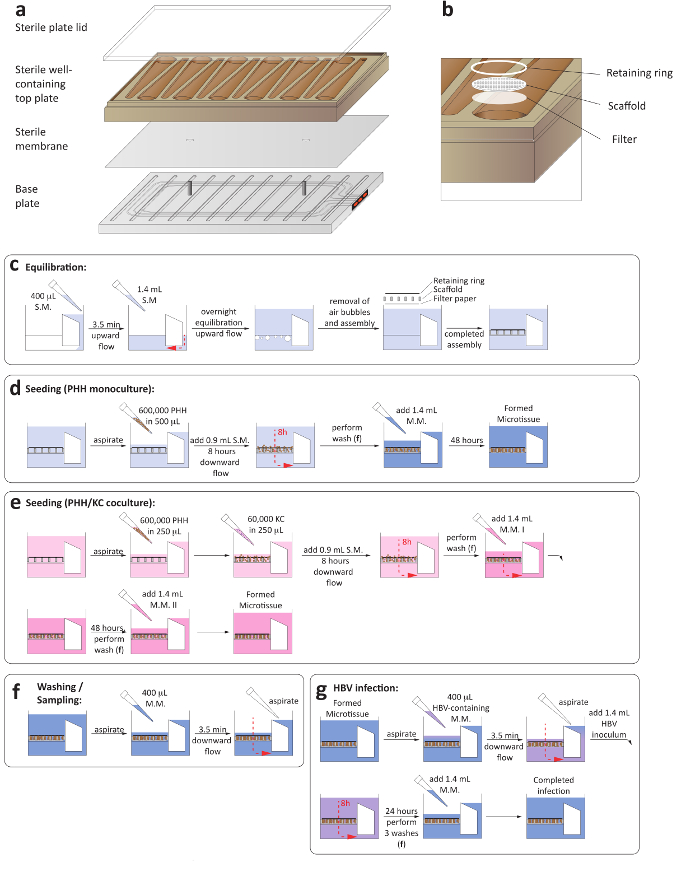
Рисунок 1: установка 3-D печени на чипе культур. () это принципиальная схема для Ассамблеи пластину культуры с целью обеспечить создание microfluidic циркуляции. (b) этой панели отображается в увеличенном культуры скважин, включая фильтр бумага, лески и стопорное кольцо. (c) Эта группа показывает процесс уравновешивания пластины до посева культур. Следующие две панели показывают процесс заполнения для монокультур гепатоцитов (d) и (e) гепатоцитов/Купфера ячейки cocultures. (f) Эта группа показывает Стиральная шаги в средних изменений. (g) Эта группа показывает HBV инфекции настройки, включая устранение посевным материалом. С.м. = посева средний, м.м. = Средний обслуживания. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
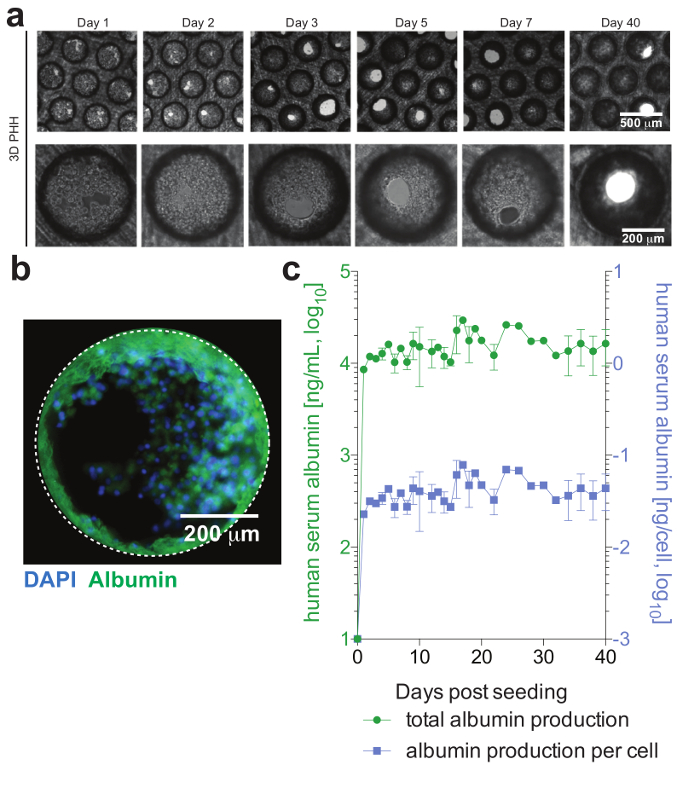
Рисунок 2: печеночная microtissue формирования и гепатоцитов жизнеспособность. () Эта группа показывает продольной brightfield изображения 3D гепатоцитов монокультур, демонстрируя microtissue формирования после посева. (b) Эта группа показывает изображения иммунофлюоресценции культур для ядер (синий) и человеческого альбумина (зеленый). (c) Эта группа показывает продольной всего альбумина, а также в клетку скорректирована производства альбумина, в течение 40 дней гепатоцитов монокультур, как определяется ELISA. Данные являются среднее ± SD. Эта цифра заимствован из Ортега-Прието et al.4. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
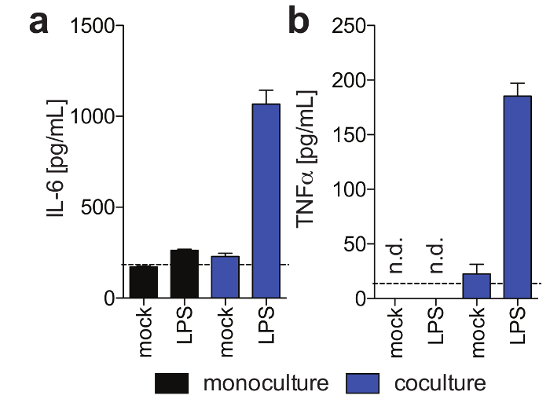
Рисунок 3: функции клеток Купфера в 3-D cocultures. Эти панели показывают секрецию () IL6 и (b) TNFα в гепатоцитов монокультур и гепатоцитов/Купфера клеток cocultures 11 дней после посева в ответ экзогенно добавлен LPS на 9 день пост посева, как определено с помощью человека магнитные Luminex assay. Эта цифра заимствован из Ортега-Прието et al.4. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
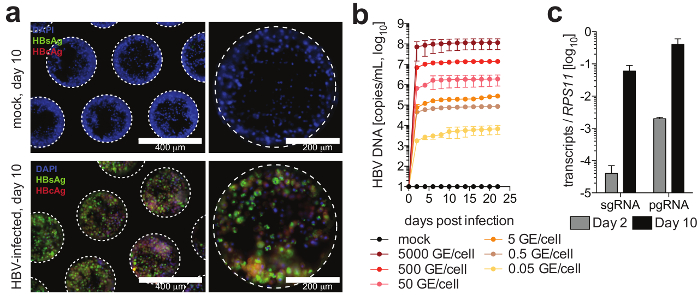
Рисунок 4: ВГВ в печени на чипе культурах. () Эта группа показывает обнаружения микроскопия иммунофлуоресценции HBcAg (красный), HBsAg (зеленый) и ядра (синий) через 10 дней после инфицирования культур с ГВ. (b) Эта группа показывает подверженность инфекции ВГВ, с использованием различных кратности инфекции, как определяется количественную оценку HBV ДНК в supernatants культуры культур. (c) этой панели отображается количественная оценка продольных накопления HBV pgRNA относительно уборки гена RPS11. Данные являются среднее ± SD. Эта цифра заимствован из Ортега-Прието et al.4. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Трудности в поддержании долгосрочной культур ПГГ инициативе разработки нескольких моделей культуры с расширенной функциональностью и долголетия, каждой выставке дифференциального преимущества и недостатки. Сейчас широко признается, что статические 2D культур ПГГ подражая определенные аспекты биологии гепатоцитов для весьма ограниченного количества времени. Таким образом micropatterned cocultures12,13, сфероиде культур14,15, и 3D печени на чипе культур16,17 быстро заменить эти более основных систем. Особенно при изучении инфекционных заболеваний, которые эволюционировали с их принимающих стран для использования конкретной микросреды, требование для обеспечения физиологической среды подкрепляется часто сложным характером культивирования человека Тропик инфекционные заболевания, включая вирус гепатита С, ГВ и малярия.
Наиболее важным шагом в выполнении 3D печени на чипе культур является качество типов первоначально источников первичной клеток. Эти клетки должны испытываться на их возможности присоединения и только plateable ПГГ много должны использоваться для обеспечения успешного ткани формирования и создания культуры. Хотя может использоваться свежевыделенных ПГГ, их криоконсервирования обычно сложна и требует специальных под контролем курс морозильники.
В отличие от обычных 2D статического культур принимающей генетический фон является незначительным в отношении подверженности инфекции ВГВ, и все таким образом далеко протестированных гепатоцитов доноры имеют возможность установить HBV инфекции4.
Даже несмотря на то, что пациент производные HBV устанавливает инфекции 3D культур, крайне важно использовать химически осажденный PEG и сахароза подушки очищенный HBV всякий раз, когда с помощью индуцибельной HBV продюсер клеток линии для генерации вирусного инокуляты. Supernatants культуры клеток, непосредственно применяться к 3D печени на чипе культур, либо через присутствии ингибирующих факторов или вследствие несовместимости нынешних факторов роста с гепатоцитов, не легко привести к инфекции. Кроме того при выборе пациента производные вирусного инокуляты, только сыворотки должны использоваться, поскольку плазма неизбежно свертывается и забивает циркуляции microfluidic платформа культуры.
Независимо от вирусных посевные используется обеспечении клеточной жизнеспособности и дифференциации, а также обеспечение полного удаления первоначального HBV посевным материалом, является ключом к успешной долгосрочные исследования инфекции. Наиболее удобным способом для этого является выборка культур после удаления вируса посевным материалом, а также измерения уровня человеческого сывороточного альбумина на протяжении всего периода культуры. Следует отметить, аналогично для всех других описанных платформ, инфекции ВГВ, после того, как установлено, не легко распространилась на неинфицированных клеток. Базовый механизм для этого остается труднодостижимой, поскольку ВГВ в естественных условиях легко заражает большинство гепатоцитов в печени.
Что касается cocultures клеток ПГГ и Купфера желательно выполнить много испытаний для оценки IL6 и TNFα секреции в ответ на стимуляцию ПЛАСТИНОК, так как не все коммерчески доступных доноров клеток Купфера имеют равные реакции клеток Купфера.
Важно отметить, что для всех лекарств или первичной инфекции культур с ГВ, общий объем хорошо (1.4 мл), а также по состоянию на microfluidic канал (0,2 мл), должны приниматься во внимание для расчета концентраций препарата или посевным материалом. Для того чтобы обеспечить точное дозирование, один шаг Стиральная с средой, содержащей HBV или наркотиков производится для премьер microfluidic канала.
Платформа используется использует 600.000 ПГГ в колодец, который обеспечивает многослойных гепатоцитов в пределах леса. Даже несмотря на то, что можно варьировать число клеток, концентрации выбранной ячейки обеспечивает оптимальные результаты. Формат пластин имеет в общей сложности 12 леса, которые можно обновить до 36 подмостей. Однако благодаря microfluidic требования, масштабирования для более высоких хорошо чисел невозможно на сегодняшний день.
С помощью этих подходов, культур может поддерживаться с производительность оптимальное ячейки для по крайней мере 40 дней, который до сих пор, открывает беспрецедентные возможности для оценки кандидатов роман наркотиков, а так же изучение сложного взаимодействия между различными печеночных клеток население во время инфекции ВГВ.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа финансировалась стартера грант от Европейского совета научных исследований (637304), Добро пожаловать доверять следователь премию (104771/Z/14/Z) и CN био инновации.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| William's E Medium, no phenol red | GIBCO | A12176-01 | |
| Hepatocyte Thaw Medium | GIBCO | CM7500 | |
| Primary Hepatocyte Thawing and Plating Supplements | GIBCO | CM3000 | |
| Primary Hepatocyte Maintenance Supplements | GIBCO | CM4000 | |
| DMEM/F-12 | GIBCO | 11320-033 | |
| Advanced DMEM | GIBCO | 12491023 | |
| DPBS, no calcium, no magnesium | GIBCO | 14190-144 | |
| MEM Non-Essential Amino Acids (NEAA) 100x | GIBCO | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | GIBCO | 15140-122 | |
| Fetal Bovine Serum, USA origin, Heat Inactivated, sterile-filtered, suitable for cell culture | SIGMA | 12106C | |
| Hydrocortisone | SIGMA | H0888 | |
| Trypan blue | Merck | T8154 | |
| Collagen from calf skin | Merck | C9791 | |
| G418 | SIGMA | G418-RO | |
| Tetracycline | SIGMA | T3258 | |
| Polyethylene glycol 8000 | SIGMA | P2139 | |
| Sucrose | SIGMA | SO389 | |
| Sodium carbonate anhydrous | SIGMA | 451614-25G | |
| Sodium bicarbonate | SIGMA | S5761 | |
| Sodium azide | SIGMA | S2002-5G | |
| Sulfuric acid, 99.999% | SIGMA | 339741 | |
| 4% Paraformaldehyde | SIGMA | 252549 | |
| Triton-X 100 | SIGMA | X100 | |
| Tween 20 | SIGMA | P1379 | |
| DAPI | SIGMA | D9564 | |
| Albumin (human) | SIGMA | A9731 | |
| Fisher BioReagent Bovine Serum Albumin, Fraction V, Heat Shock Treated | Fisher Scientific | BP9701-100 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| TaqMan Universal Master Mix II, no UNG | Applied Biosystems | 4440040 | |
| SYBR Select Master Mix | Applied Biosystems | 4472903 | |
| Lipopolysaccharide from Escherichia coli K12 | InvivoGen | tlrl-eklps | |
| Name | Company | Catalog Number | Comments |
| Kits/Consumables | |||
| Sterile membrane | CN Bio innovations | LC-SC | |
| LiverChip Perfusion cell culture plate | CN Bio innovations | LC12 | |
| LiverChip culture plate lid | CN Bio innovations | LC-SC | |
| Sterile round filter paper | CN Bio innovations | LC-SC | |
| Cell attachment scaffold | CN Bio innovations | LC-SC | |
| Retaining ring | CN Bio innovations | LC-SC | |
| Sterile plunger | CN Bio innovations | LC-ST | |
| Dneasy blood & tissue kit | Qiagen | 69506 | |
| Rneasy mini kit | Qiagen | 74106 | |
| Human Magnetic Luminex assay | R&D Systems | ||
| 1-Step Ultra TMB-ELISA Substrate Solution | ThermoFisher Scientific | 34028 | |
| High Capacity cDNA Reverse Transcription Kit | ThermoFisher Scientific | 4368814 | |
| QIAamp Viral RNA Mini Accessory Set | Qiagen | 1048147 | Containing RNA carrier |
| Millicell HY 5-layer cell culture flask, T-1000, sterile | Millipore (Merck) | PFHYS1008 | |
| MicroAmp Optical 384-Well Reaction Plate with Barcode | Life technologies | 4309849 | |
| MicroAmp Optical Adhesive Film | Life technologies | 4311971 | |
| Clear Flat-Bottom Immuno Nonsterile 96-Well Plates | ThermoFisher Scientific | 442404 | |
| Sealing Tape for 96-Well Plates | ThermoFisher Scientific | 15036 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters with PES Membrane | ThermoFisher Scientific | 295-3345 | |
| Fisherbrand Microscopic Slides with Ground Edges, Twin Frost | Fisher Scientific | FB58628 | |
| Tube, Thinwall, Ultra-Clear, 38.5 mL, 25 x 89 mm | Beckman Coulter | 344058 | |
| Name | Company | Catalog Number | Comments |
| Primary cells / Cell lines | |||
| Human Plateable Hepatocytes, Transporter Qualified | Thermo Fisher Scientific | HMCPTS | |
| Cryopreserved Human Kupffer Cells | Thermo Fisher Scientific | HUKCCS | |
| HepDE19 cell line | Haitao Guo (Indiana University, IN, USA) | ||
| Name | Company | Catalog Number | Comments |
| Primers/Probes/Standards | |||
| HBV DNA forward primer | Invitrogen | 5'-GTGTCTGCGGCGTTTTATCA-3' | |
| HBV DNA reverse primer | Invitrogen | 5'-GACAAACGGGCAACATACCTT-3' | |
| HBV DNA probe | Invitrogen | 5'FAM-CCTCTKCATCCTGCTGCTATGCCTCATC-3'TAMRA | |
| pgRNA forward primer | Invitrogen | 5'-GAGTGTGGATTCGCACTCC-3' | |
| pgRNA reverse primer | Invitrogen | 5'-GAGGCGAGGGAGTTCTTCT-3' | |
| RPS11 forward primer | Invitrogen | 5'-GCCGAGACTATCTGCACTAC-3' | |
| RPS11 reverse primer | Invitrogen | 5'-ATGTCCAGCCTCAGAACTTC-3' | |
| pCMV-HBV | Professor Christoph Seeger (Fox Chase Cancer Centre, PA, USA) | ||
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Anti-Hepatitis B virus core antigen IgG fraction (polyclonal) | DAKO | discontinued | Lot 10102505 |
| Human Albumin Antibody, A80-129A | Bethyl Laboratories. inc | A80-129A | |
| Human Albumin cross-adsorbed Antibody, A80-229P | Bethyl Laboratories. inc | A80-229P | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher Scientific | # A-11072 | Lot 1431810 |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| LiverChip Vacuum pump | CN Bio innovations | LC-PN | |
| LiverChip Pneumatic Hookup | CN Bio innovations | LC-PN | |
| LiverChip platform | CN Bio innovations | LC-PN | |
| LiverChip plate washing dock | CN Bio innovations | ||
| Autoclavable metal forceps | VWR | 232-0106 | |
| Vortex Genie 2 | Scientific industries | SKU: SI-0236 | |
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A95765 | |
| Heraeus Multifuge X3R Centrifuge | Thermo Scientific | 75004500 | |
| SAM-12 Medical Suction High Vacuum High Flow | MGE worldwide | SAM12/01010101 | |
| NUAIRE 5800 SERIES incubator | NUAIRE | NU-5841 | |
| Automated precision torgue | CN Bio innovations | ||
| Manual torque | CN Bio innovations | ||
| LiverChip compressor | CN Bio innovations | ||
| Luminex LX-200 Instrument with xPONENT 3.1 | Luminex | ||
| Millipore Hand-Held Magnetic Separator Block | ThermoFisher Scientific | Millipore™ 40-285 | |
| FluoStar Optima Plate Reader | BMG Labtech | ||
| KOLVER Precision electric screwdrivers | VTECH ltd | FAB10RE/FR | |
| KOLVER Power supply | VTECH ltd | EDU1FR | |
| BAMBI VTS75D | Air Equipment | Discontinued | |
| Integra Vacuboy | INTEGRA | ||
| ViiA 7 Real-Time PCR System with 384-Well Block | ThermoFisher Scientific | 4453536 |
Ссылки
- Verrier, E. R., Colpitts, C. C., Schuster, C., Zeisel, M. B., Baumert, T. F. Cell Culture Models for the Investigation of Hepatitis B and D Virus Infection. Viruses. 8 (9), (2016).
- Elaut, G., et al. Molecular mechanisms underlying the dedifferentiation process of isolated hepatocytes and their cultures. Current Drug Metabolism. 7 (6), 629-660 (2006).
- Konig, A., et al. Kinetics of the bile acid transporter and hepatitis B virus receptor Na+/taurocholate cotransporting polypeptide (NTCP) in hepatocytes. Journal of Hepatology. 61 (4), 867-875 (2014).
- Ortega-Prieto, A. M., et al. 3D microfluidic liver cultures as a physiological preclinical tool for hepatitis B virus infection. Nature Communications. 9 (1), 682 (2018).
- Allweiss, L., Dandri, M. The Role of cccDNA in HBV Maintenance. Viruses. 9 (6), (2017).
- Guo, J. T., Guo, H. Metabolism and function of hepatitis B virus cccDNA: Implications for the development of cccDNA-targeting antiviral therapeutics. Antiviral Research. 122, 91-100 (2015).
- Lucifora, J., et al. Direct antiviral properties of TLR ligands against HBV replication in immune-competent hepatocytes. Scientific Reports. 8 (1), 5390 (2018).
- Hosel, M., et al. Hepatitis B Virus Activates Signal Transducer and Activator of Transcription 3 Supporting Hepatocyte Survival and Virus Replication. Cellular and Molecular Gastroenterology and Hepatology. 4 (3), 339-363 (2017).
- Mazza, G., et al. Rapid production of human liver scaffolds for functional tissue engineering by high shear stress oscillation-decellularization. Scientific Reports. 7 (1), 5534 (2017).
- Hang, T. C., Lauffenburger, D. A., Griffith, L. G., Stolz, D. B. Lipids promote survival, proliferation, and maintenance of differentiation of rat liver sinusoidal endothelial cells in vitro. American Journal of Physiology-Gastrointestinal and Liver Physiology. 302 (3), G375-G388 (2012).
- Hwa, A. J., et al. Rat liver sinusoidal endothelial cells survive without exogenous VEGF in 3D perfused co-cultures with hepatocytes. The FASEB Journal. 21 (10), 2564-2579 (2007).
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- March, S., et al. Micropatterned coculture of primary human hepatocytes and supportive cells for the study of hepatotropic pathogens. Nature Protocols. 10 (12), 2027-2053 (2015).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Griffith, L. G., Wells, A., Stolz, D. B. Engineering liver. Hepatology. 60 (4), 1426-1434 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены