Method Article
« Foie-on-a-Chip » Cultures d’hépatocytes primaires et des cellules de Kupffer pour Infection de Virus de l’hépatite B
Dans cet article
Résumé
Le but du présent protocole est de fournir un guide étape par étape pour réaliser des expériences 3D « foie-on-a-chip » infection par le virus de l’hépatite B.
Résumé
Malgré l’infectivité exceptionnelle du virus de l’hépatite B (VHB) in vivo, où seulement trois génomes viraux peuvent entraîner une chronicité des chimpanzés infectés expérimentalement, plus les modèles in vitro nécessitent plusieurs centaines de milliers de génomes viraux par cellule chez afin d’initier une infection transitoire. En outre, les cultures d’hépatocytes humains primaires (PHH) 2D statiques permettent uniquement les études à court terme en raison de leur rapide dédifférenciation. Nous décrivons ici 3D cultures de foie-on-a-chip de PHH, soit en monocultures cocultures avec d’autres cellules de foie-résident parenchymateuses. Ceux-ci offrent une amélioration significative à l’étude des infections à HBV à long terme avec les réponses des cellules hôtes physiologiques. En plus de faciliter les études de l’efficacité des médicaments, analyses toxicologiques et enquêtes sur la pathogenèse, ces systèmes microfluidiques permettent l’évaluation des thérapies curatives visant à éliminer par covalence fermé, infection par le VHB circulaire (ccc) ADN. Ceci présente méthode décrit la mise en place de PHH monocultures et les cultures de cellules co PHH/Kupffer, leur infection par le VHB purifiée et l’analyse des réponses de l’hôte. Cette méthode s’applique à l’évaluation des effets à long terme de l’infection à VHB, combinaisons de traitements et pathogenèse.
Introduction
L’étude du VHB a été compliquée par la mauvaise sensibilité des systèmes de culture, obligeant plusieurs centaines de milliers de copies de génome du VHB par cellule pour lancer l' infection1. En outre, des hépatocytes humains primaires sont généralement extrêmement fragiles et dédifférencient rapidement au cours des cultures classiques2. Ceci est principalement dû au fait que les surfaces en plastique plats et durs ne pas imiter les milieux extracellulaires naturels que se trouves dans le foie de l’absence générale d’oxygénation des cultures en l’absence de circulation de la microfluidique. Rapidement, des cultures d’hépatocytes statiques classiques sur des plaques recouvertes de collagène dédifférencient et perdent leur susceptibilité à l' infection de HBV3. Nous décrivons ici la mise en place et l’infection de PHH en cultures de foie-on-a-chip 3D, qui sont très avantageuses sur les cultures PHH statiques 2D classiques sur des plaques recouvertes de collagène en raison de leur compétence étendue de métabolique et fonctionnel, facilitant cultures à long terme d’au moins 40 jours4. Dans ce système, PHH sont ensemencées sur des échafauds enduit de collagène, qui sont continuellement perfusés avec milieu de culture pour fournir l’oxygène et des nutriments vers les cellules. Même si les systèmes de culture alternative pour PHH basée sur cocultures complexes de fibroblastes murins ou croissance 3D en sphéroïdes ont été validées et sont sensibles à l’infection par le VHB à l’aide des multiplicités d’infection de 500 génomes (GE) du VHB par cellule, 3D foie-on-a-chip cultures restent le système unique modèle in vitro sensible à 0,05 GE du VHB par cellule4. C’est en outre étayé par la nécessité d’utiliser des concentrations élevées de diméthylsulfoxyde (DMSO) et le polyéthylène glycol (PEG) pour établir l’infection par le VHB dans ces cultures, qui est dispensable pour l’infection des systèmes de culture de foie-on-a-chip 3D 4. parmi les principales caractéristiques du VHB, l’infection est la piscine cccDNA, constituant ainsi le modèle transcriptional pour tous de novo–produit des virions,5,6. Même si cccDNA peut être détectée dans les hépatocytes classiques cultures7,8, on ne sait pas quant à savoir si la réglementation de cccDNA et toute approche thérapeutique visant à éliminer est récapitulées dans partiellement ou hépatocytes complètement dédifférenciées. Nous avons montré que cccDNA est formé sur le plan fonctionnel dans les cultures de foie-on-a-chip 3D, répond à des stimuli physiologiques et peut être ciblé en interférant avec l’accessibilité de la machinerie transcriptionnelle au génome cccDNA4.
Réactions de l’hôte à l’infection par le VHB dans 3D imitateur de foie-on-a-chip ceux observés chez les patients infectés par le VHB, permettant l’identification de biomarqueurs de l’infection, mais aussi le succès thérapeutique. Parmi les caractéristiques uniques du foie-on-a-chip cultures est la possibilité d’évaluer à long terme h6te entre PHH et autres cellules parenchymateuses dans le foie, y compris les cellules4Kupffer, cellules étoilées9et foie sinusoïdal les cellules endothéliales10,11. Cela offre l’occasion unique pour évaluer les interactions cellule/cellule dans un micro-environnement 3D complexe.
En outre, la période de culture prolongée de cette plate-forme facilite l’évaluation des traitements médicamenteux séquentiel et leur impact sur la persistance du VHB, qui ne sont pas possibles à l’aide de systèmes de culture conventionnels hépatocyte.
Ce protocole décrit comment 3D foie-on-a-chip cultures sont générés, soit pour les monocultures de PHH cocultures de PHH avec des cellules de Kupffer. En outre, nous décrivons la production du VHB purifié pour les études de la basse-multiplicité de l’infection, ainsi que l’analyse subséquente de l’hôte et réponses virales.
Protocole
1. montage et équilibrage des plaques
- Vérifiez que le compresseur et la pompe à vide associé à la plate-forme de LiverChip sont sous tension. Effectuer le montage et l’équilibrage des plaques dans une classe II du cabinet.
- Aseptiquement assembler les plaques microfluidique en plaçant une membrane stérile entre la plaque de base et en ajoutant la plaque contenant bien supérieure (Figure 1 a).
- Veiller à ce que la membrane stérile sans à-coup repose sur les deux broches de la plaque de base, depuis le compromis de placement membrane inégale la circulation de la microfluidique.
- Ajouter un couvercle de plaque stérile et serrer les vis à la base de la plaque à l’aide d’un couple de précision automatisé à 33 lb à l’aide d’une spirale séquence de serrage. Veiller à ce que toutes les vis sont serrées à 35lbs couple manuel. Au cours de cette étape, s’assurer que les vis sont serrées de façon symétrique (Figure 1 a).
- Réchauffer au préalable les hépatocytes semis moyenne contenant Williams E moyenne, primaires d’hépatocytes dégel et placage de suppléments, 5 % sérum fœtal (SVF) et 1 µM dexaméthasone à 37 ° C avant l’amorçage.
- Amorcer la plaque entièrement Assemblée en le plaçant dans la station de lavage et ajout de 400 µL d’hépatocytes ensemencement moyen sur le côté du réservoir de chaque puits. Assurez-vous que la plaque s’enclenche dans le dock de laver complètement.
- Ouvrir le flux vers le haut pour 3,5 min 1 µL/s. La fonction réussie de la microfluidique de circulation peut être déterminée grâce à des indicateurs rouges sur le côté de la plaque (Figure 1 a).
- Une fois que le milieu est pompé vers le côté de la croissance cellulaire de la plaque, assurer un montage correct du chenal d’écoulement, ajouter 1,2 mL d’hépatocytes ensemencement moyen supplémentaire.
- Soigneusement la plaque de transfert dans la station d’accueil au sein d’un incubateur humidifié à 37 ° C et 5 % de CO2 et ouvrir le flux vers le haut à un débit de 1 µL/s pendant 16 h (Figure 1C).
- La plaque de transfert à la station de lavage et d’éliminer les bulles dans le puits de pipetage doucement verticalement.
- Add-on de stériles, round papier-filtre, suivi d’un échafaudage d’attachement cellulaire et un circlips, dans chaque puits à l’aide d’une pince stérile. Appuyer chaque puits avec un piston stérile pour bloquer les anneaux de retenue et les échafaudages en place (Figure 1 b).
- Aspirer tous les moyen et ajouter 400 µL de milieu semis hépatocyte préchauffée doucement sur l’échafaud et initier le flux dans la direction vers le bas pour 3,5 min 1 µL/s.
- Aspirer toutes les moyennes pompée hors du côté du réservoir de la plaque. Cette étape est nécessaire pour remplacer le milieu contenu dans le canal d’écoulement.
- Ajouter 1,4 mL d’hépatocytes ensemencement moyen dans chaque puits avant de regagner le quai pour compléter le volume total par puits de la plaque. Le volume de chaque puits est maintenant 1,6 mL (1,4 mL dans le puits et 0,2 mL dans le chenal d’écoulement).
2. dégel et l’ensemencement des hépatocytes de Monocultures
- Réchauffer au préalable les hépatocytes dégel moyenne et moyenne semis hépatocytes à 37 ° C avant le dégel d’un flacon de PHH conformément aux instructions du fournisseur. Utiliser une centrifugeuse à température ambiante pendant cette étape afin d’éviter les changements brusques de température. Effectuer la fonte et l’ensemencement des hépatocytes dans une classe du cabinet II.
- Remettre en suspension les cellules dans 1 mL de milieu de semis hépatocyte et compter les cellules à l’aide de bleu trypan. Veiller à ce que la viabilité des cellules est supérieur à 90 %.
- Garder les cellules sur la glace jusqu'à ce qu’ils sont ajoutés dans les puits.
- Transférer la plaque équilibrée et entièrement Assemblée à la station de lavage et aspirer toutes les moyennes des puits.
- Ajouter 600 000 hépatocytes dans chaque puits dans un volume de 500 µL de milieu semis hépatocytaire.
- Ouvrir le flux dans la direction vers le bas à un débit de 1 µL/s et porter le volume total dans le puits à 1,6 mL en ajoutant 900 µL d’hépatocytes ensemencement moyen.
- La plaque de transfert à la station d’accueil au sein d’un incubateur humidifié à 37 ° C et avec 5 % de CO2.
- Ouvrir le flux dans la direction vers le bas à un débit de 1 µL/s pendant 8 h, suivie d’une inversion de flux vers le vers le haut à un débit de 1 µL/s pendant 8 h.
- La plaque de transfert vers le quai de laver et aspirer toutes les moyennes des puits.
- Ajouter 400 µL de milieu de maintenance de hépatocytaire (Williams E milieu additionné de suppléments entretien hépatocyte et 100 nM dexaméthasone) pour chaque flux de bien et initier la vers le bas à un débit de 1 µL/s pendant 3,5 minutes.
- Aspirer toutes les moyennes du réservoir et ajouter 1,4 mL du milieu de maintenance hépatocytaire (Figure 1D).
- Remplacez le support par moyen de maintenance hépatocyte toutes les 48 h. Afin d’assurer que tous les moyens dans le puits est remplacé, effectuer une étape de lavage avant l’ajout du support de maintenance hépatocyte fraîches.
- Pour le lavage, la plaque de transfert à la station de lavage, aspirer toutes les moyennes des puits et ajouter 400 µL de milieu de l’entretien.
- Initier flux dans la direction vers le bas à 1 µL/s pour 3,5 min. aspirer tous les médium qui apparaissent sur le côté du réservoir des puits.
- Ajouter 1,4 mL de support de maintenance hépatocyte et, au sein d’un incubateur humidifié à 37 ° C et avec 5 % de CO2, la plaque de transfert dans la station d’accueil et initier le flux vers le haut à un débit de 1 µL/s pendant 48 h (Figure 1f).
Remarque : Pour les monocultures d’hépatocytes utilisés comme témoins pour cocultures, afin d’assurer des conditions contrôlées, un deuxième type de support de maintenance est utilisé, qui est spécifique pour une utilisation dans les cocultures avec des cellules de Kupffer humaines primaires. 48 h après avoir remplacé l’hépatocyte ensemencement moyenne avec support de maintenance hépatocytaire (jour 3 après semis), le support de maintenance régulière hépatocyte sera remplacé par le moyen de maintenance de coculture II, surtout dans les monocultures de PHH lorsque l'on compare au cocultures des cellules PHH et Kupffer, comme les composantes moyennes diffèrent légèrement.
3. dégel et ensemencement des cellules de Kupffer et les hépatocytes des co-cultures
- Afin d’assurer une comparaison précise des résultats, toujours comparer les cocultures cellule PHH/Kupffer aux monocultures PHH
- Pour décongeler les cocultures des cellules de Kupffer et de PHH, un flacon de cellules de Kupffer dans avancé de Dulbecco aigle modifié (AdDMEM) sans dexaméthasone mais additionné de dégel primaires d’hépatocytes et placage complète (co-culture ensemencement moyen) selon aux instructions du fournisseur. Effectuer la fonte et l’ensemencement des cellules de Kupffer et hépatocytes dans une classe du cabinet II.
- Remettre en suspension les cellules dans 1 mL de coculture ensemencement moyen et compter les cellules à l’aide de bleu trypan. Veiller à ce que la viabilité des cellules est supérieur à 90 %.
- Garder les cellules sur la glace avant en les ajoutant dans les puits pour éviter l’adhérence cellulaire.
- Suivez les instructions par étapes 2.1 – 2.3 pour le dégivrage des hépatocytes humains primaires.
- Transférer la plaque équilibrée et entièrement Assemblée à la station de lavage et aspirer toutes les moyennes des puits.
- Ajouter des cellules de Kupffer 60 000 ou 600 000 hépatocytes dans chaque puits dans un volume total de 250 µL de chaque de coculture ensemencement moyen.
- Ouvrir le flux dans la direction vers le bas à un débit de 1 µL/s et ajouter 900 µL de coculture ensemencement moyen dans chaque puits.
- Transvaser la plaque dans la station d’accueil au sein d’un incubateur humidifié à 37 ° C et avec 5 % de CO2.
- Ouvrir le flux dans la direction vers le bas à un débit de 1 µL/s pendant 8 h, suivie d’inversion de flux vers le vers le haut à un débit de 1 µL/s pendant 8 h.
- La plaque de transfert vers le quai de laver et aspirer toutes les moyennes des puits.
- Ajouter 400 µL de milieu de coculture entretien j’ai (AdDMEM sans dexaméthasone mais additionné de suppléments de maintenance des hépatocytes) pour chaque flux de bien et initier la vers le bas à un débit de 1 µL/s pendant 3,5 minutes.
- Aspirer toutes les moyennes sur le côté du réservoir et ajouter 1,4 mL de coculture entretien milieu j’ai dans chaque puits.
- La plaque de transfert dans la station d’accueil au sein d’un incubateur humidifié à 37 ° C et avec 5 % de CO2 et ouvrir le flux vers le haut à un débit de 1 µL/s pendant 48 h.
- La plaque de transfert vers le quai de laver et aspirer toutes les moyennes des puits. Ajouter 400 µL de milieu de coculture entretien II (moyennement Williams E sans dexaméthasone mais additionné de 100 nM hydrocortisone et hépatocytes entretien des suppléments) et lancer le flux dans la direction vers le bas à 1 µL/s pendant 3,5 minutes.
- Aspirer toutes les moyennes qui apparaissent sur le côté du réservoir des puits.
- Ajouter 1,4 mL de coculture entretien milieu II et transférer la plaque dans la station d’accueil au sein d’un incubateur humidifié à 37 ° C et avec 5 % de CO2.
- Ouvrir le flux vers le haut à un débit de 1 µL/s pendant 48 h (Figure 1e).
- Remplacer le support de toutes les 48 h avec support de maintenance de coculture II. Afin d’assurer que tous les moyens dans le puits est remplacé, effectuer une étape de lavage avant l’ajout du milieu frais.
- À laver, la plaque de transfert à la station de lavage, aspirer toutes les moyennes des puits et ajouter 400 µL de milieu de coculture entretien II.
- Initier flux dans la direction vers le bas à 1 µL/s pour 3,5 min. aspirer tous les médium qui apparaissent sur le côté du réservoir des puits.
- Ajouter 1,4 mL de coculture entretien milieu II et transférer la plaque dans la station d’accueil au sein d’un incubateur humidifié à 37 ° C et avec 5 % de CO2et initier le flux vers le haut à un débit de 1 µL/s pendant 48 h (Figure 1f).
4. production d’un Virus de l’hépatite infectieuse B pour les études d’Infection
- Effectuez cette section du protocole dans un niveau de confinement laboratoire III. Les semis, modifications moyennes, collection medium et concentration du virus dans une classe du cabinet II.
- La culture de cellules productrices de VHB (par exemple, HepDE19, HepAD38) dans des flacons de 5 couches de T1000 enduit de collagène dans 120 mL de complet DMEM/F12 (10 % FBS, pénicilline/streptomycine, les acides aminés non essentiels, 500 μg/mL G418 et tétracycline 1 μg/mL) jusqu'à ce qu’ils atteignent 90 % confluence.
- Changer le support au milieu de l’induction (DMEM complet sans la tétracycline) pour induire la production de VHB.
- Recueillir le volume moyen complet toutes les 48 h retrait après 12 jours de la tétracycline et conserver à 4 ° C.
- Filtrer le milieu recueilli sur un filtre supérieur de bouteille de 0,45 µm.
- Ajouter stérile PEG 8000 dans une solution saline tamponnée au phosphate (PBS) au milieu de prélevés à une concentration finale de 4 % w/w, mélanger en retournant le 8 x x-10 et incuber à 4 ° C pendant 16 h. centrifuger à 10 000 x g pendant 1 h à 4 ° C, pour recueillir le virus PEG-précipité et remettre en suspension le culot dans du PBS contenant 10 % FBS.
- Combiner le virus PEG-précipité de tous les points de temps récolte et il couche sur un coussin de saccharose de 20 %. Centrifuger à 140 000 x g pendant 16 h à 4 ° C à l’aide d’un rotor SW28.
- Aspirer le surnageant et resuspendre le culot dans du PBS additionné de 10 % FBS et partie aliquote et conserver à-80 ° C.
- Déterminer le nombre de copies de l’ADN du VHB présent dans le surnageant par ADN-VHB qPCR (étape 6).
5. infection des Cultures 3D par le VHB
- Effectuer des infections dans une classe II du cabinet au sein d’un niveau de confinement laboratoire III.
- 3 jours après l’ensemencement les monocultures ou cocultures, décongeler le nombre requis d’aliquotes contenant HBV à température ambiante et diluer la dose requise de virus dans 1,8 mL d’hépatocytes entretien moyen ou support de maintenance de coculture II / puits, respectivement.
- Ce virus dilué de 1,8 mL est suffisant pour l’étape de lavage (400 µL) et le remplacement du support, le puits (1,4 mL). Toutefois, la nécessaire multiplicité d’infection doit être rajusté pour tenir compte du volume de culture finale de 1,6 mL.
- La plaque de transfert vers le quai de laver et aspirer toutes les moyennes des puits. Ajouter 400 µL de milieu contenant du VHB et initier le flux dans la direction vers le bas à 1 µL/s pour 3,5 min. aspirer toutes les moyennes apparaissant sur le côté du réservoir des puits.
- Ajouter 1,4 mL de contenant du VHB moyen/coculture entretien moyen II par bien et la plaque de transfert dans la station d’accueil au sein d’un incubateur humidifié à 37 ° C et avec 5 % de CO2. Ouvrir le flux dans la direction vers le bas à un débit de 1 µL/s pendant 8 h, suivie d’un retournement à vers le haut à un débit de 1 µL/s.
- 24h après l’ajout du VHB, la plaque de transfert vers le quai de laver et aspirer toutes les moyennes des puits.
- Laver chaque bien dans la plaque 3 x avec le milieu correspondant, selon le type de culture comme indiqué dans les étapes 2.12 – 2.14, afin d’éliminer les virus restes du puits. Contrairement aux étapes 2.12 – 2.14, ajouter 1,6 mL de milieu dans chaque cupule pour tenir compte du volume supplémentaire à échantillonner pour exclure le report de l’inoculum (Figure 1 g).
- Suite à ces étapes de lavage, recueillir 200 µL de milieu de chaque puits à confirmer la suppression complète de l’inoculum du VHB par quantification de l’ADN du VHB extracellulaire.
- La plaque de transfert à la station d’accueil au sein d’un incubateur humidifié à 37 ° C et avec 5 % de CO2et de lancer des flux vers le haut à un débit de 1 µL/s pendant 48 h.
- 48 h plus tard, recueillir le volume bien complet pour l’analyse en aval, suivi par trois lavages avec support maintenance hépatocyte décrites aux étapes 2.12 – 2.14. Remplacer le support et laver chaque puits 3 x toutes les 48 h jusqu'à fin expérimentale.
6. quantification de l’ADN du VHB extracellulaire
- Isoler l’ADN total des surnageants de culture selon les instructions du fabricant avec l’ajout de 1 µg de transporteur RNA dans un niveau de confinement laboratoire III à assurer l’inactivation du virus dans les échantillons avant en les déplaçant vers une autre zone.
- Préparer un mélange maître contenant mélange maître de quantitative PCR, apprêt avant de 600 nM, apprêt inverse de 600 nM et 300 nM de sonde.
- Ajouter 7 µL du mélange maître dans chaque puits d’une plaque 384 puits.
- Ajouter 5 µL d’échantillons d’ADN en deux exemplaires, un contrôle de non-modèle et duplicata des dilués en série HBV contenant du génome plasmidique norme basée sur (par exemple, le VHB cmvp) allant de 109 copies par réaction à 102 copies par réaction dans chaque loge de la plaque de qPCR.
- Placer une couverture de l’adhésive sur la plaque et faire en sorte que chacun est bien scellé correctement.
- Centrifuger la plaque pendant 1 min à 300 x g.
- Démarrer le qPCR exécuter selon les instructions du fabricant. Les conditions de cycle de PCR en temps réel sont de 95 ° C pendant 10 min, suivie de 40 cycles de 95 ° C pour 15 s et 60 ° C pendant 1 min.
- Quantifier le nombre de copies d’ADN du VHB dans les échantillons inconnus selon la courbe d’étalonnage.
7. quantification des intracellulaire VHB Prégénomique (pg) RNA
- Isoler l’ARN total des échafaudages conformément aux instructions du fabricant. Afin d’assurer la lyse cellulaire complet, vortex chaque échafaudage 3 x pour 30 s, suivi par centrifugation à 300 g pendant 1 min entre chaque vortex. Effectuer la lyse cellulaire dans le niveau de confinement laboratoire III à assurer l’inactivation du virus dans les échantillons avant en les déplaçant vers une autre zone.
- Transcrire le cDNA de l’ARN isolé selon les instructions du fabricant.
- Les conditions de cycle pour le fut sont de 25 ° C pendant 10 min, 37 ° C pendant 120 min et 85 ° C pendant 5 min.
- Conserver les échantillons d’ADNc à 4 ° C pendant à court terme ou à-20 ° C pour le stockage à long terme.
- Préparer des mélanges maîtres Pan-RPGAA et mélange maître contenant du quantitative PCR de RPS11 et amorces et inverses pour Pan-RPGAA et RPS11 (utilisé comme gène de ménage) à une concentration finale de 0,2 µM.
- Ajouter 7,5 µL du mélange maître et 2,5 µL du cDNA / puits sur une plaque 384 puits. Mesurer RPS11 et Pan-RPGAA de chaque échantillon en double exemplaire et inclure un contrôle non-modèle bien pour les deux gènes.
- Placer une couverture de l’adhésive sur la plaque et faire en sorte que chaque bien est parfaitement étanches.
- Centrifuger la plaque pendant 1 min à 300 x g.
- Insérer la plaque dans le cycleur qPCR et commencer le qPCR en utilisant le protocole standard de PCR quantitatif selon les instructions du fabricant. Les conditions de cycle de PCR en temps réel sont de 50 ° C pour 2 min, 95 ° C pendant 2 min, suivie de 40 cycles de 95 ° C pour 15 s et 60 ° C pendant 1 min.
- Calculer l’expression de Pan-RPGAA par rapport à RPS11.
8. immunofluorescence souillant d’antigène Viral
- Retirez la bague de retenue du puits et retirez l’échafaud avec une pince dans une classe du cabinet II dans le laboratoire III niveau de confinement.
- Fixer les cellule contenant les échafaudages avec 4 % de paraformaldéhyde dans 1 mL de PBS pendant 30 min à température ambiante dans le niveau de confinement laboratoire III. Les étapes suivantes peuvent être effectuées dans un domaine différent.
- Laver les échafaudages 3 x 1 ml de PBS.
- Permeabilize des cellules à l’aide de 0,1 % Triton X 100 dans 1 mL de PBS pendant 1 h à température ambiante.
- Laver les échafaudages 3 x 1 ml de PBS.
- Bloc non-spécifiques en incubant les échafaudages avec 1 % de BSA dans 1 mL de PBS pendant 16 h à 4 ° C.
- Laver les échafaudages 3 x 1 ml de PBS.
- Effectuer l’anticorps primaire de coloration à l’aide de l’antigène de noyau virus lapin contre l’hépatite B à une dilution de 1 : 200 à 1 % de BSA dans 1 mL de PBS pendant 16 h à 4 ° C.
- Laver les échafaudages 1 x 0,1 % Tween dans 1 mL de PBS (PBS-Tween) et 3 x 1 ml de PBS.
- Effectuer l’anticorps secondaire de coloration à l’aide de chèvre anti-lapin IgG (H + L) croix-adsorbé Alexa Fluor 594 secondaires anticorps conjugué à une dilution de 1:2,000 1 % BSA dans 1 mL de PBS pendant 16 h à 4 ° C.
- Laver les échafaudages 1 x 1 ml de 0.1 % PBS-Tween et 3 x 1 ml de PBS.
- Contre-coloration les échafaudages à l’aide de DAPI dans 1 mL de PBS à une concentration de 2 µg/mL pendant 10 min à température ambiante.
- Laver les échafaudages 1 x 1 ml de 0.1 % PBS-Tween et 3 x 1 ml de PBS.
- Transférer les échafaudages sur une lame de microscope et montez-le pour l’imagerie.
- Les échafaudages à l’aide d’un microscope à fluorescence de l’image.
9. humain albumine ELISA
- Effectuer cette section du protocole dans une classe II armoire consacrés dans le niveau de confinement laboratoire III si vous travaillez avec des matières infectieuses.
- Pour évaluer la viabilité et la fonctionnalité métabolique de PHH, évaluer la production de l’albumine humaine par ELISA.
- Plaques de couche 96 puits avec 50 µL / puits des anticorps de chèvre anti-humain dilué 1:800 dans un tampon enduit (carbonate/bicarbonate de 100 mM, pH 9,6). Recouvrir les plaques et incuber pendant 2 h à 37 ° C ou toute une nuit à 4 ° C.
- Aspirer l’anticorps de revêtement de la plaque et lavez-le 4 x avec 200 µL de 0.05 % PBS-Tween.
- Ajouter 200 µL de tampon de blocage (1 % de BSA dans du PBS), recouvrir les plaques et les incuber pendant 1 heure à 37 ° C ou les stocker à 4 ° C pendant 3 mois. Pour le stockage à long terme, ajouter 0,05 % d’azide de sodium au tampon de blocage.
- Aspirer le tampon de blocage et laver 1 fois avec 200 µL de 0.05 % PBS-Tween.
- Ajouter 50 µL de sérums préalablement dilués par puits (au 1/100). Le diluant pour échantillons contient 1 % de BSA à 0.05 % PBS-Tween. Incuber pendant 1 h à 37 ° C ou une nuit à 4 ° C.
NOTE : Incuber les normes en même temps que les échantillons. Une gamme de concentrations de 500 – 0.488 ng/mL (1 / 2 dilutions successives) est recommandé. Effectuer toutes les dilutions en série d’albumine humaine en diluant de l’échantillon. - Aspirer les échantillons de la plaque et lavez-le 4 x avec 200 µL de 0.05 % PBS-Tween.
- Ajouter 50 µL d’anticorps de chèvre conjugué HRP anti-humain albumine préalablement dilué 1/10 000 en diluant de l’échantillon. Incuber pendant 2 h à 37 ° C ou une nuit à 4 ° C.
- Aspirer les anticorps de la plaque et le laver 6 x avec 200 µL de 0,05 % PBS-Tween.
- Ajouter 100 µL de réactif de TMB et, dès que les normes les plus élevées sont entièrement développées, ajouter 100 µL 1 M H2SO4 pour arrêter la réaction colorimétrique.
- Lire l’absorbance à 450 nm sur un lecteur de plaque à 96 puits pour analyse.
10. interleukine (IL) 6 et facteurs de nécrose tumorale (TNF) α la Production en 3D co-cultures
- Effectuer cette section du protocole dans une classe II armoire consacrés dans le niveau de confinement laboratoire III si vous travaillez avec des matières infectieuses.
- Quantifier la production IL6 et TNFα afin d’évaluer la fonctionnalité et la viabilité des cellules de Kupffer primaires. Pour induire la production de ces cytokines par les cellules de Kupffer, traiter les cocultures avec 1 lipopolysaccharide de µg/mL (LPS) 9d après ensemencement dans le milieu de maintenance de coculture II pendant 48 h.
- Au jour 11 après semis, récolte le milieu de chaque puits et conserver à-80 ° C.
- Mesurer la concentration d’IL6 et TNFα dans le milieu de culture par un test approprié et selon les instructions du fabricant.
Résultats
Nous décrivons une plateforme simple et versatile pour la culture à long terme de leur infection par le VHB et/ou les hépatocytes et les cellules de Kupffer humaines primaires. Des cellules humaines primaires sont ensemencées sur des échafaudages en polystyrène enduit de collagène au sein d’un assemblage de plaque de microfluidique, qui alimente en continu les cellules avec le milieu de croissance (Figure 1 a).
PHH, qui sont habituellement seulement stable pour un temps limité dans les systèmes de culture conventionnels, peut être maintenue sur le plan fonctionnel pendant de longues périodes de temps. L’albumine humaine, qui est sécrétée par les hépatocytes fonctionnels et est considéré comme le meilleur marqueur pour l’évaluation du métabolisme hépatique, est stable et hautement exprimé par cultures 3D jusqu’au jour 40 après ensemencement (Figure 2). Pour les cocultures, viabilité et fonctionnalités de cellules de Kupffer peuvent être évaluées par la sécrétion de cytokines spécifiques (p. ex., IL6 et TNFα). Pour mesurer la production de cytokines, l’utilisation de moyens de détection basée sur les captures par LPS-stimulation des cocultures est recommandée (Figure 3).
Les cellules forment microtissues hépatique, habituellement dans les 3 jours des semis de PHH, démontrant les canalicules biliaires fonctionnels et polarisation cellulaire complet (Figure 2). En plus de retenir leur métabolisme cellulaire physiologique, ces cultures deviennent exceptionnellement sensibles à l’infection par le VHB. L’ADN du VHB et autres marqueurs viraux, contrairement aux autres systèmes de culture deviennent facilement détectables post-d’infection jour 2 (Figure 4). En plus sécrétées marqueurs d’infection virale, hépatocytes contenant les échafaudages peuvent être provient de cultures et utilisés pour la détection par immunofluorescence des antigènes viraux (par exemple, AgHBs, AgHBc) (Figure 4). Où les cultures d’hépatocytes conventionnels exigent l’inoculation avec au moins 500 GE de VHB par cellule et par l’ajout de 2 % DMSO et 4 % PEG, aussi peu que 0,05 VHB GE sont capables de déclencher l’infection dans les cultures 3D sans avoir besoin de DMSO ou PEG (Figure 4).
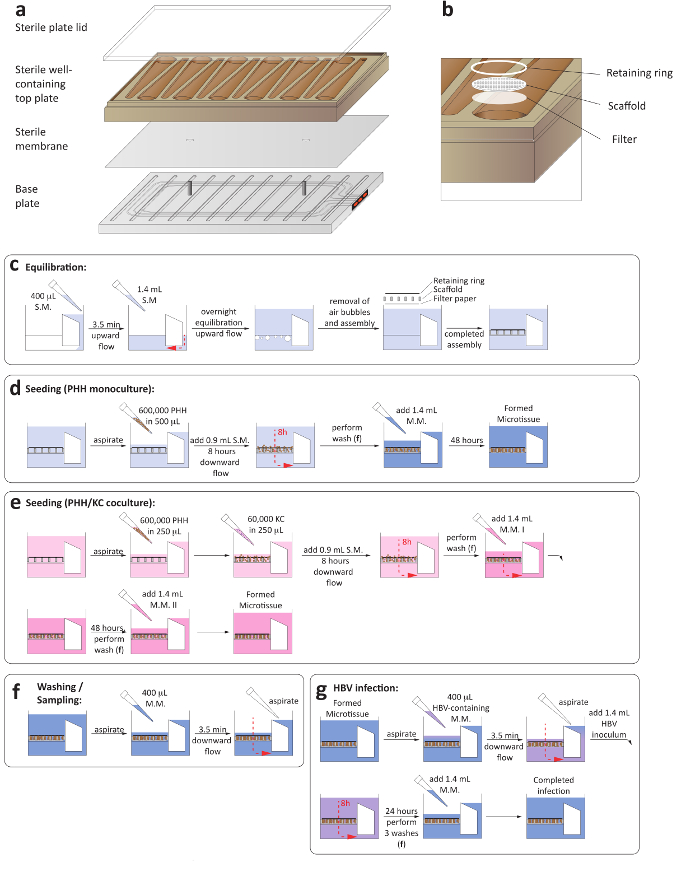
Figure 1 : mise en place de cultures de foie-on-a-chip 3-d. (un) c’est une présentation schématique pour le montage de la plaque de culture afin d’assurer la mise en place de la circulation de la microfluidique. (b) ce panneau montre une vue rapprochée des puits de culture, y compris le papier filtre, échafaudage et bague de retenue. (c) ce panneau montre le processus d’équilibration de la plaque avant le semis des cultures. Les deux panneaux montrent le processus d’ensemencement des monocultures d’hépatocytes (d) et (e) hépatocytes/Kupffer cell cocultures. (f) ce panneau montre les étapes de lavage moyen changements apportés. (g) ce panneau montre le montage infection VHB, y compris la suppression de l’inoculum. S.M. = moyen de semis, M.M. = entretien moyen. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
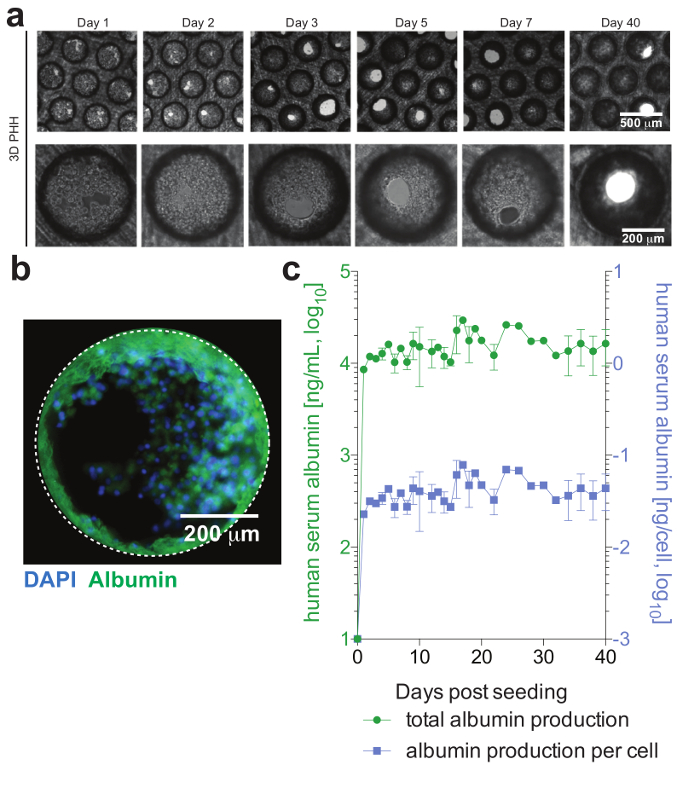
Figure 2 : viabilité de formation et des hépatocytes hépatique micro-culture. (un) ce panneau montre des images de fond clair longitudinale de monocultures d’hépatocytes 3D démontrant micro-culture formation après l’ensemencement. (b) ce panneau montre l’imagerie immunofluorescence des cultures pour les noyaux (bleu) et l’albumine humaine (vert). (c) ce panneau montre albumine total longitudinale, ainsi que par cellule ajusté production d’albumine, pendant 40 jours de monocultures d’hépatocytes, tel que déterminé par ELISA. Les données présentées sont moyenne ± SD Ce chiffre est une adaptation d’Ortega-Prieto et al.,4. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
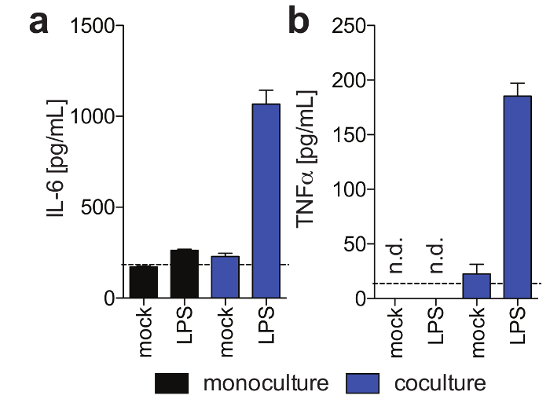
Figure 3 : fonctionnalités de cellules de Kupffer dans cocultures 3-d. Ces panneaux montrent la sécrétion de (un) IL6 et (b) TNFα dans les monocultures d’hépatocytes et cellules hépatocytes/Kupffer cocultures 11 jours après l’ensemencement en réponse au LPS exogène au jour 9 post semis, tel que déterminé à l’aide humaine magnétique Luminex dosage. Ce chiffre est une adaptation d’Ortega-Prieto et al.,4. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
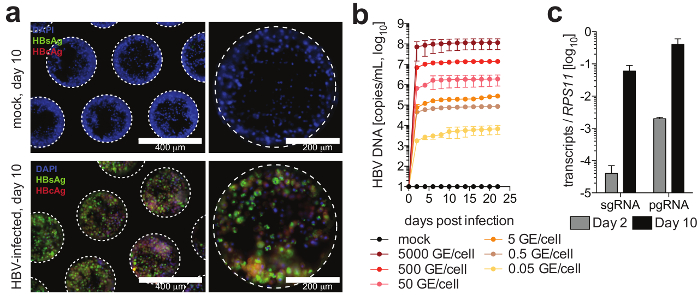
Figure 4 : infection par le VHB dans les cultures de foie-on-a-chip. (a) ce panneau montre la détection de microscopie d’immunofluorescence AgHBc (rouge), Ag HBs (vert) et noyaux (bleu) 10 jours après l’infection des cultures par le VHB. (b) ce panneau montre la sensibilité des cultures à l’infection par le VHB à l’aide des multiplicités différentes d’infection, tel que déterminé par une quantification de l’ADN du VHB dans les surnageants de culture. (c) ce panneau montre la quantification de l’accumulation longitudinale de Pan-RPGAA VHB par rapport à la gène de ménage RPS11. Les données présentées sont moyenne ± SD Ce chiffre est une adaptation d’Ortega-Prieto et al.,4. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Les défis dans le maintien des cultures à long terme de PHH ont conduit à l’élaboration de plusieurs modèles de culture avec une fonctionnalité accrue et de la longévité, chacun présentant des inconvénients et des avantages différentiels. Il est maintenant largement reconnu que les cultures 2D statiques de PHH sont imitant certains aspects de la biologie des hépatocytes pour une quantité très limitée de temps. Ainsi, micromotifs cocultures12,13, sphéroïde cultures14,15, et16,de cultures de foie-on-a-chip 3D17 sont rapidement remplacer ces systèmes plus basiques. Surtout quand l’étude des maladies infectieuses, qui ont coévolué avec leur hôte à utiliser des micro-environnements spécifiques, l’obligation de remettre des environnements physiologiques repose sur la nature souvent difficile de culture homme-tropic maladies infectieuses, y compris les virus de l’hépatite C, le VHB et le paludisme.
L’étape la plus critique dans le cadre de cultures de foie-on-a-chip 3D est la qualité des types cellulaires initialement d’origine. Ces cellules doivent être testés pour leur capacité d’adhérence et uniquement des lots PHH plateable doivent être utilisés afin d’assurer la formation de tissu réussie et génération de culture. Même si PHH fraîchement isolée peut être utilisé, leur cryoconservation est généralement compliquée et exige spéciaux congélateurs vitesse contrôlée.
Par contraste avec les cultures conventionnelles de 2D statiques, le bagage génétique de l’hôte est négligeable en ce qui concerne la susceptibilité à l’infection par le VHB, et tous les donateurs de l’hépatocyte testés jusqu'à présent sont capables d’établir d’infection à VHB4.
Même si le patient dérivé VHB établit des infections des cultures 3D, il est impératif d’utiliser PEG-précipité et saccharose coussin purifié VHB quand utilisant inductible VHB producteur cellule lignes pour la production d’inoculum viral. Les surnageants de culture cellulaire directement appliquées aux cultures de foie-on-a-chip 3D, soit par le biais de la présence de facteurs inhibiteurs ou en raison d’une incompatibilité de facteurs de croissance présents avec les hépatocytes, ne résultent pas facilement dans l’infection. En outre, lorsque vous sélectionnez inoculum viral dérivé de patient, seulement le sérum doit être utilisé, car inévitablement, plasma coagule et obstrue la circulation de microfluidique de la plate-forme de la culture.
Indépendamment de l’inoculum viral utilisé, assurant la viabilité cellulaire et la différenciation, en plus d’assurer le retrait complet de l’inoculum initial de VHB, est la clé pour des études à long terme de l’infection. La façon la plus pratique de le faire est d’échantillonnage cultures après le retrait de l’inoculum viral, mais aussi de mesurer les niveaux de l’albumine sérique humaine tout au long de la période de culture. De note, de même pour toutes les autres plates-formes décrits, infection par le VHB, une fois établie, ne pas facilement se propage aux cellules non infectées. Le mécanisme sous-jacent pour que cela demeure difficile, étant donné que l’infection à VHB in vivo infecte facilement la plupart des hépatocytes dans le foie.
En ce qui concerne les cocultures des cellules de Kupffer et de PHH, il est conseillé d’effectuer des essais de beaucoup de cellules de Kupffer afin d’évaluer la sécrétion en réponse à la stimulation de la LPS, IL6 et TNFα puisque pas tous les donneurs de cellules de Kupffer disponibles dans le commerce ont une réactivité égale.
Ce qui est important, pour tous les traitements médicamenteux ou infection initiale des cultures par le VHB, le volume total du puits (1,4 mL), aussi bien à partir de la chaîne microfluidiques (0,2 mL), doit prendre en compte pour le calcul des concentrations de médicament ou d’un inoculum. Afin d’assurer un dosage précis, une étape de lavage avec le milieu contenant du VHB ou médicaments est effectuée pour amorcer le canal microfluidique.
La plate-forme utilisée utilise 600 000 PHH / puits, qui assure des hépatocytes multicouches dans les échafaudages. Même si le nombre de cellule peut être modifié, la concentration cellulaire choisi assure un résultat optimal. Le format de plaque détient un total de 12 échafaudages, qui peut être amélioré à 36 échafaudages. Toutefois, en raison des exigences de microfluidique, mise à l’échelle vers le haut à un nombre bien plus élevé n’est pas possible à ce jour.
Utilisant ces approches, les cultures peuvent être maintenus avec les performances de la cellule optimale pendant au moins 40 jours, qui, jusqu’ici, offre des possibilités sans précédent pour évaluer les nouveaux médicaments candidats, ainsi que l’étude de l’interaction complexe entre les différentes cellules hépatiques populations au cours de l’infection par le VHB.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été financé par une subvention de démarrage de l’European Research Council (637304), un Wellcome Trust Investigator Award (104771/Z/14/Z) et par CN Bio Innovations.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| William's E Medium, no phenol red | GIBCO | A12176-01 | |
| Hepatocyte Thaw Medium | GIBCO | CM7500 | |
| Primary Hepatocyte Thawing and Plating Supplements | GIBCO | CM3000 | |
| Primary Hepatocyte Maintenance Supplements | GIBCO | CM4000 | |
| DMEM/F-12 | GIBCO | 11320-033 | |
| Advanced DMEM | GIBCO | 12491023 | |
| DPBS, no calcium, no magnesium | GIBCO | 14190-144 | |
| MEM Non-Essential Amino Acids (NEAA) 100x | GIBCO | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | GIBCO | 15140-122 | |
| Fetal Bovine Serum, USA origin, Heat Inactivated, sterile-filtered, suitable for cell culture | SIGMA | 12106C | |
| Hydrocortisone | SIGMA | H0888 | |
| Trypan blue | Merck | T8154 | |
| Collagen from calf skin | Merck | C9791 | |
| G418 | SIGMA | G418-RO | |
| Tetracycline | SIGMA | T3258 | |
| Polyethylene glycol 8000 | SIGMA | P2139 | |
| Sucrose | SIGMA | SO389 | |
| Sodium carbonate anhydrous | SIGMA | 451614-25G | |
| Sodium bicarbonate | SIGMA | S5761 | |
| Sodium azide | SIGMA | S2002-5G | |
| Sulfuric acid, 99.999% | SIGMA | 339741 | |
| 4% Paraformaldehyde | SIGMA | 252549 | |
| Triton-X 100 | SIGMA | X100 | |
| Tween 20 | SIGMA | P1379 | |
| DAPI | SIGMA | D9564 | |
| Albumin (human) | SIGMA | A9731 | |
| Fisher BioReagent Bovine Serum Albumin, Fraction V, Heat Shock Treated | Fisher Scientific | BP9701-100 | |
| ProLong Gold Antifade Mountant | Invitrogen | P36930 | |
| TaqMan Universal Master Mix II, no UNG | Applied Biosystems | 4440040 | |
| SYBR Select Master Mix | Applied Biosystems | 4472903 | |
| Lipopolysaccharide from Escherichia coli K12 | InvivoGen | tlrl-eklps | |
| Name | Company | Catalog Number | Comments |
| Kits/Consumables | |||
| Sterile membrane | CN Bio innovations | LC-SC | |
| LiverChip Perfusion cell culture plate | CN Bio innovations | LC12 | |
| LiverChip culture plate lid | CN Bio innovations | LC-SC | |
| Sterile round filter paper | CN Bio innovations | LC-SC | |
| Cell attachment scaffold | CN Bio innovations | LC-SC | |
| Retaining ring | CN Bio innovations | LC-SC | |
| Sterile plunger | CN Bio innovations | LC-ST | |
| Dneasy blood & tissue kit | Qiagen | 69506 | |
| Rneasy mini kit | Qiagen | 74106 | |
| Human Magnetic Luminex assay | R&D Systems | ||
| 1-Step Ultra TMB-ELISA Substrate Solution | ThermoFisher Scientific | 34028 | |
| High Capacity cDNA Reverse Transcription Kit | ThermoFisher Scientific | 4368814 | |
| QIAamp Viral RNA Mini Accessory Set | Qiagen | 1048147 | Containing RNA carrier |
| Millicell HY 5-layer cell culture flask, T-1000, sterile | Millipore (Merck) | PFHYS1008 | |
| MicroAmp Optical 384-Well Reaction Plate with Barcode | Life technologies | 4309849 | |
| MicroAmp Optical Adhesive Film | Life technologies | 4311971 | |
| Clear Flat-Bottom Immuno Nonsterile 96-Well Plates | ThermoFisher Scientific | 442404 | |
| Sealing Tape for 96-Well Plates | ThermoFisher Scientific | 15036 | |
| Nalgene Rapid-Flow Sterile Disposable Bottle Top Filters with PES Membrane | ThermoFisher Scientific | 295-3345 | |
| Fisherbrand Microscopic Slides with Ground Edges, Twin Frost | Fisher Scientific | FB58628 | |
| Tube, Thinwall, Ultra-Clear, 38.5 mL, 25 x 89 mm | Beckman Coulter | 344058 | |
| Name | Company | Catalog Number | Comments |
| Primary cells / Cell lines | |||
| Human Plateable Hepatocytes, Transporter Qualified | Thermo Fisher Scientific | HMCPTS | |
| Cryopreserved Human Kupffer Cells | Thermo Fisher Scientific | HUKCCS | |
| HepDE19 cell line | Haitao Guo (Indiana University, IN, USA) | ||
| Name | Company | Catalog Number | Comments |
| Primers/Probes/Standards | |||
| HBV DNA forward primer | Invitrogen | 5'-GTGTCTGCGGCGTTTTATCA-3' | |
| HBV DNA reverse primer | Invitrogen | 5'-GACAAACGGGCAACATACCTT-3' | |
| HBV DNA probe | Invitrogen | 5'FAM-CCTCTKCATCCTGCTGCTATGCCTCATC-3'TAMRA | |
| pgRNA forward primer | Invitrogen | 5'-GAGTGTGGATTCGCACTCC-3' | |
| pgRNA reverse primer | Invitrogen | 5'-GAGGCGAGGGAGTTCTTCT-3' | |
| RPS11 forward primer | Invitrogen | 5'-GCCGAGACTATCTGCACTAC-3' | |
| RPS11 reverse primer | Invitrogen | 5'-ATGTCCAGCCTCAGAACTTC-3' | |
| pCMV-HBV | Professor Christoph Seeger (Fox Chase Cancer Centre, PA, USA) | ||
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Anti-Hepatitis B virus core antigen IgG fraction (polyclonal) | DAKO | discontinued | Lot 10102505 |
| Human Albumin Antibody, A80-129A | Bethyl Laboratories. inc | A80-129A | |
| Human Albumin cross-adsorbed Antibody, A80-229P | Bethyl Laboratories. inc | A80-229P | |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher Scientific | # A-11072 | Lot 1431810 |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| LiverChip Vacuum pump | CN Bio innovations | LC-PN | |
| LiverChip Pneumatic Hookup | CN Bio innovations | LC-PN | |
| LiverChip platform | CN Bio innovations | LC-PN | |
| LiverChip plate washing dock | CN Bio innovations | ||
| Autoclavable metal forceps | VWR | 232-0106 | |
| Vortex Genie 2 | Scientific industries | SKU: SI-0236 | |
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A95765 | |
| Heraeus Multifuge X3R Centrifuge | Thermo Scientific | 75004500 | |
| SAM-12 Medical Suction High Vacuum High Flow | MGE worldwide | SAM12/01010101 | |
| NUAIRE 5800 SERIES incubator | NUAIRE | NU-5841 | |
| Automated precision torgue | CN Bio innovations | ||
| Manual torque | CN Bio innovations | ||
| LiverChip compressor | CN Bio innovations | ||
| Luminex LX-200 Instrument with xPONENT 3.1 | Luminex | ||
| Millipore Hand-Held Magnetic Separator Block | ThermoFisher Scientific | Millipore™ 40-285 | |
| FluoStar Optima Plate Reader | BMG Labtech | ||
| KOLVER Precision electric screwdrivers | VTECH ltd | FAB10RE/FR | |
| KOLVER Power supply | VTECH ltd | EDU1FR | |
| BAMBI VTS75D | Air Equipment | Discontinued | |
| Integra Vacuboy | INTEGRA | ||
| ViiA 7 Real-Time PCR System with 384-Well Block | ThermoFisher Scientific | 4453536 |
Références
- Verrier, E. R., Colpitts, C. C., Schuster, C., Zeisel, M. B., Baumert, T. F. Cell Culture Models for the Investigation of Hepatitis B and D Virus Infection. Viruses. 8 (9), (2016).
- Elaut, G., et al. Molecular mechanisms underlying the dedifferentiation process of isolated hepatocytes and their cultures. Current Drug Metabolism. 7 (6), 629-660 (2006).
- Konig, A., et al. Kinetics of the bile acid transporter and hepatitis B virus receptor Na+/taurocholate cotransporting polypeptide (NTCP) in hepatocytes. Journal of Hepatology. 61 (4), 867-875 (2014).
- Ortega-Prieto, A. M., et al. 3D microfluidic liver cultures as a physiological preclinical tool for hepatitis B virus infection. Nature Communications. 9 (1), 682 (2018).
- Allweiss, L., Dandri, M. The Role of cccDNA in HBV Maintenance. Viruses. 9 (6), (2017).
- Guo, J. T., Guo, H. Metabolism and function of hepatitis B virus cccDNA: Implications for the development of cccDNA-targeting antiviral therapeutics. Antiviral Research. 122, 91-100 (2015).
- Lucifora, J., et al. Direct antiviral properties of TLR ligands against HBV replication in immune-competent hepatocytes. Scientific Reports. 8 (1), 5390 (2018).
- Hosel, M., et al. Hepatitis B Virus Activates Signal Transducer and Activator of Transcription 3 Supporting Hepatocyte Survival and Virus Replication. Cellular and Molecular Gastroenterology and Hepatology. 4 (3), 339-363 (2017).
- Mazza, G., et al. Rapid production of human liver scaffolds for functional tissue engineering by high shear stress oscillation-decellularization. Scientific Reports. 7 (1), 5534 (2017).
- Hang, T. C., Lauffenburger, D. A., Griffith, L. G., Stolz, D. B. Lipids promote survival, proliferation, and maintenance of differentiation of rat liver sinusoidal endothelial cells in vitro. American Journal of Physiology-Gastrointestinal and Liver Physiology. 302 (3), G375-G388 (2012).
- Hwa, A. J., et al. Rat liver sinusoidal endothelial cells survive without exogenous VEGF in 3D perfused co-cultures with hepatocytes. The FASEB Journal. 21 (10), 2564-2579 (2007).
- Khetani, S. R., Bhatia, S. N. Microscale culture of human liver cells for drug development. Nature Biotechnology. 26 (1), 120-126 (2008).
- March, S., et al. Micropatterned coculture of primary human hepatocytes and supportive cells for the study of hepatotropic pathogens. Nature Protocols. 10 (12), 2027-2053 (2015).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Tong, W. H., et al. Constrained spheroids for prolonged hepatocyte culture. Biomaterials. 80, 106-120 (2016).
- Griffith, L. G., Wells, A., Stolz, D. B. Engineering liver. Hepatology. 60 (4), 1426-1434 (2014).
- Domansky, K., et al. Perfused multiwell plate for 3D liver tissue engineering. Lab Chip. 10 (1), 51-58 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon