Method Article
Cosecha de las células endoteliales de las puntas del globo de catéteres de Swan-Ganz después de cateterismo cardíaco derecho
En este artículo
Resumen
Este protocolo describe la extracción y purificación de células endoteliales de arteria pulmonar (PAECs) que se adhieren a las puntas del globo de catéteres de Swan-Ganz, mientras se acuñan en la arteria pulmonar durante el cateterismo cardíaco derecho y permanecer adherente a la globo desinflado después del retiro del cuerpo del paciente.
Resumen
Una variedad de patologías conducen a hipertensión pulmonar (PH), que se define como una presión de arteria pulmonar media superior a 25 mmHg en reposo. Para diagnosticar y controlar el PH, los pacientes experimentan cateterizaciones repetidas de corazón derecho (RHC) en donde se avanza un catéter de Swan-Ganz en una rama de la arteria pulmonar y se infla un globo para la punta del catéter de la cuña. Este artículo ilustra un protocolo por el que las células endoteliales de arteria pulmonar (PAECs) pueden ser cosechadas de las puntas del globo de catéteres de Swan-Ganz después de RHC y purificadas con una técnica de columna anti-CD146 afinidad para purificar putativas PAECs. Estas células podrían utilizarse para proporcionar una instantánea in situ del estado biológico del endotelio de la vasculatura pulmonar para complementar las mediciones hemodinámicas obtenidas durante RHC. Cosecha y PAECs purificados se pueden utilizar para cualquier cultivo de células o para posteriores ensayos analíticos como flujo cytometery.
Introducción
Las guías estadounidenses y europeas actuales requieren cateterismo cardíaco derecho para el diagnóstico de hipertensión pulmonar1. Los médicos y los científicos tratando de entender esta enfermedad desean de muestras biológicas de la vasculatura pulmonar para complementar los datos hemodinámicos que se reunieron en RHC. Desafortunadamente, el riesgo asociado con biopsia vascular pulmonar es muy alto, y por lo tanto las muestras biológicas de la vasculatura pulmonar son raramente si siempre Obtenido de pacientes vivos sometidos a RHC. Mientras que ha ganado mucho conocimiento de tejido vascular pulmonar obtenida de cadáver o pulmón explantado, estas muestras es incapaces de reflejar la biología el PH del proceso de enfermedad como se desenvuelve en un paciente vivo. En 2013, primero divulgado que las células endoteliales de arteria pulmonar (PAECs) son despojadas de las ramas de la arteria pulmonar por contacto físico con la punta del globo del catéter de Swan-Ganz durante RHC y pueden ser recuperadas en una pequeña cantidad de las puntas de catéter después el procedimiento2.
Este artículo ilustra nuestra técnica para la extracción y purificación de las células endoteliales de arteria pulmonar (PAECs) de las extremidades del globo de catéteres de Swan-Ganz tras cateterismo cardíaco derecho. Hasta ahora, la metodología para la realización de esta técnica de cosecha se ha descrito en detalle suficiente en la literatura para garantizar resultados homogéneos entre laboratorios realizar la técnica. Este artículo está pensado para superar esta deficiencia, que ofrece visualizar demostración de la técnica, de noche colección de puntas de catéter hasta el producto final de purificada CD146 + las células endoteliales. Esta técnica debe ayudar en el avance de la investigación en la Patobiología de diversas etiologías del PH y posiblemente resultar en el desarrollo de nuevos ensayos de diagnóstico para complementar datos hemodinámicos durante RHC.
La importancia de esta técnica en el campo de la investigación y medicina vascular pulmonar es que proporciona acceso a una instantánea de la biología del endotelio pulmonar en situ y en contraste con estudios anteriores en el pulmón explantado o cadavérico, no representa un punto final para el pulmón del sujeto. Recientemente, hemos demostrado que un biomarcador de anti-apoptosis en estas células puede tener utilidad en fenotipaje más precisamente relacionadas con variedades de hipertensión pulmonar3. El rendimiento de las células obtenidas es relativamente pequeño, ~ 5, 000-25.000 PAECs por muestra y estas células son difíciles (pero no imposible) a la cultura. Creemos que los investigadores y los clínicos inteligentes encontrará sinergias entre estas técnicas de compañero para avanzar en el pronóstico, diagnóstico y la investigación vascular pulmonar.
Protocolo
Todos los estudios descritos en este artículo fueron aprobados por la Junta de revisión institucional de la red de salud de Allegheny. Siempre el consentimiento informado antes de la administración de agentes sedantes y se identificaron por ser asignado a un número de estudio todos los pacientes.
1. cabecera colección
Nota: Todo en este protocolo debe realizarse en hielo, mediante soluciones previamente enfriadas. Es importante inducir estasis frío en las células para conservar su fenotipo biológico in situ. Este protocolo implica el manejo de sangre y las células obtenidas de seres humanos y por lo tanto se deben observar las precauciones universales.
- Después de retirar el catéter de la vaina, inmediatamente sumerja el catéter en un tubo de centrífuga de 50 mL que contiene 40 mL de solución salina estéril fría. Agitar el catéter para eliminar sangre y lavar la línea si es necesario para eliminar la sangre retenida dentro de la línea.
- Cortar los 5 cm distal de la punta del cateterismo y déjelo caer en el tubo de centrífuga de 50 mL que contiene solución salina enfriada. Inmediatamente retire la punta de cateterismo con pinzas y transferirlo a un tubo de centrífuga de 15 mL que contiene 15 mL de medio de cultivo de células endoteliales (CE).
- Sellar el tubo, coloque en hielo y traslado al laboratorio para preparar para procesamiento o envío. Es esencial que el balón permanece inmerso en el medio, así que asegúrese de que hay un mínimo espacio de aire en el tubo de 15 mL llenándolo totalmente con medio de cultivo EC.
- Proceso de la muestra inmediatamente procediendo a paso 2.1 o sello y enviar la muestra en hielo húmedo durante la noche para el procesamiento en un laboratorio especializado en este protocolo. Si las células en última instancia va a ser utilizado para el cultivo celular, es recomienda que la punta de cateterismo inmediatamente se tramitarán en el mismo sitio en que se recogió.
2 células
Nota: Todo en este protocolo debe realizarse en hielo, mediante soluciones previamente enfriadas. Las células están en estasis frío, y es importante evitar despertarlos hasta que estén listos para ser corregido o cultivadas. Este conjunto del protocolo debe realizarse en una campana de flujo laminar, utilizando instrumentos estériles, si la intención final de cultura de las PAECs cosechadas. Si la cultura no está prevista (por ejemplo, análisis de citometría de flujo), no es necesario observar precauciones estériles.
- Añadir 5 mL de solución de la separación de células a un tubo de centrífuga de 15 mL; Coloque en hielo.
- Extraer 1 mL de EC media de eso queda en el tubo de la colección de noche en la jeringa de 1 mL.
- Rápidamente realice los pasos 2.3 a 2.5. Agarre el extremo cortado de la punta del catéter con pinzas hemostáticas.
- Introduzca cuidadosamente la aguja de la jeringa de 1 mL en el agujero "blanco" frente a la guía ("agujero negro"). Tener mucho cuidado para evitar lesiones con la aguja.
- Transferencia de la punta de cateterismo en el tubo de centrífuga de 15 mL que contiene la solución de la separación de la célula.
- Inflar el globo, teniendo cuidado de no reventar inflar el globo con aproximadamente 200 μL de los medios de comunicación funciona bien.
- Permita que el catéter para sentarse en la solución de separación celular en hielo por 5 min con el globo inflado. Si el globo se desinfla en sus el propios durante la incubación de 5 minutos, esto es aceptable.
- Verter el contenido del tubo de centrífuga de 15 mL en el plato de 100 mm. Coloque el globo en la solución de la separación de la célula "charco".
- Raspar el globo inflado con un raspador celular. El raspador de célula puede establecerse alrededor del balón en un movimiento circular o un movimiento de cepillado. Se centran en los "polos" del globo, donde se encuentra con el catéter. Asegúrese de que el raspador celular contacto toda la superficie del globo con al menos dos veces. Enjuagar periódicamente la rasqueta de la célula en la solución de la separación de la célula "charco".
- Desinflar el balón y raspar con un movimiento de cepillado. Enjuague el raspador de la célula en la solución de la separación de la célula "charco".
- Deseche el raspador de punta, aguja y célula de cateterismo en el contenedor de residuos adecuado.
- Vierta la solución de separación de células que contiene la cosecha de células en un tubo de centrífuga de 50 mL. Agitar el tubo y vierta los restantes medios de comunicación desde el tubo de la colección de la muestra recogida así.
- Centrifugar la muestra a 650 x g a 4 ° C durante 10 minutos. Es importante tener en cuenta que muchas veces un pellet no se verá. Puede ser útil marcar el lugar donde se vería una pelotilla, si es visible, para evitar aspirar el sedimento en caso de que es demasiado pequeño para ser visto.
Nota: Normalmente, un diábolo sólo se ve cuando la muestra ha sido contaminada por la sangre. Contaminación de la sangre es inmaterial para el producto final de la cosecha porque la sangre no se unen los granos CD146 y lava a través de la columna. Pruebas extensas han demostrado que la marca específica de tubos de microcentrífuga de 1.5 mL que se hace referencia en la Tabla de materiales reduce al mínimo pérdida de células en comparación con otros tubos utilizados durante la optimización del protocolo. - Cuidadosamente aspirar los medios de comunicación y evitar perturbar o aspirar el sedimento.
3. célula purificación
Nota: Todo en este protocolo debe realizarse en hielo, mediante soluciones previamente enfriadas. Las células están en estasis frío, y es importante evitar despertarlos hasta que estén listos para ser corregido o cultivadas.
- Resuspender el precipitado en 1 mL de solución de lisis de glóbulos rojos refrigerados y transferir a un tubo de microcentrífuga de 1.5 mL; suavemente rock durante 10 min a 4 ° C.
- Centrifugar durante 5 minutos a 500 x g a 4 ° C. Aspire la solución de lisis RBC.
- Resuspender el precipitado en 60 μL de PBS, 20 μL de FcR bloqueador y 20 μL de anti-humana CD146 microbeads. Incubar por 15 min a 4 ° C.
- Añadir 1 mL de PBS frío. Centrifugar durante 5 minutos a 500 x g a 4 ° C. Aspirar el sobrenadante y resuspender el precipitado en 1 mL de PBS frío.
- Coloque una columna magnética de LS en un magnético (véase Tabla de materiales específicas identidades comerciales de estos artículos) a temperatura ambiente. Primera columna, añadir 1 mL de PBS y permitir que el volumen entero fluya a través. Deseche el flujo a través.
- Colocar la muestra en la columna magnética. Deseche el flujo a través.
- Lavar la columna con 3 mL de PBS frío tres veces. Deseche el flujo a través de cada colada.
- Añadir 3 mL de PBS enfriado a un tubo de centrífuga de 15 mL. Quitar la columna magnética de imán, verter los 3 mL de PBS desde el tubo de centrífuga de 15 mL en la columna y rápidamente Coloque la columna en el tubo de la centrífuga para atrapar el flujo a través. Inmediatamente se sumergen con el émbolo provisto de columna. La muestra está ahora purificado, preparado para la fijación, tinción o cultivo.
Resultados
Este protocolo resulta en la purificación de las células, de puntas de catéter de Swan-Ganz después de la cateterización del corazón derecho, que se unen a una columna de selección CD146 y tienen perfiles de dispersión hacia delante o lateral que son indistinguibles de culto humano primario pulmonar células endoteliales de la arteria (figura 1). Dado que el balón del catéter está en contacto físico con sólo la vaina introductora (un material sin células), la pared de la arteria pulmonar, y la sangre, los datos se proporciona aquí para demostrar que estas células no proceden de la sangre (figura 2) , y por lo tanto se supone que de hecho se derivan de la pared del vaso de la arteria pulmonar. El lector debe tener en cuenta que las bolas magnéticas anti-CD146 que sirven para purificar las células siguen siendo adherente a la superficie de la célula después del procedimiento y así es subóptima para intentar analizar las cosechas celulares para CD146 como marcador de células endoteliales. CD31 u otros marcadores endoteliales probablemente estaría disponibles para el etiquetado y podrían considerarse como alternativas.
Elementos clave de este protocolo han sido identificados que pueden afectar los resultados. En primer lugar, es importante enjuagar la punta del catéter en la cabecera para quitar la sangre. La figura 3 muestra dispersión lateral (SSC), perfiles de Forward scatter (FSC) de flujo a través de la columna de anti-CD146 para una muestra fue debidamente aclarado y uno que no era. La columna parece excluir las células derivadas de sangre de las cosechas (figura 2), pero el paso de enjuague garantizará un mínimo posible contaminación de células endoteliales circulantes (que están normalmente presentes en < 50 células/mL de sangre4). Hemos observado eluido de la CD146 columna es totalmente clara, incluso en el caso de las muestras de punta de catéter muy sangrienta. Esto sugiere que la columna es capaz de manejar grandes cantidades de sangre sin obstrucción o retención no-CD146 + células de la sangre.
En segundo lugar, es importante inflar el globo de sugerencias por lo menos una vez durante el paso de raspador celular separación solución celular. Dado que el supuesto PAECs en la punta del globo siendo adherente a pesar de la aclaración salina paso, parece que pueden ser parcialmente atrapados por pliegues en el globo de vinilo como se desinfla en preparación para el retiro del paciente. Probablemente, el paso de la inflación libera el PAECs, lo que les permite raspar suavemente lejos. No es inmediatamente claro uno podría probar esta hipótesis, pero se han observado un menor rendimiento de las células cuando el balón no está inflados (datos no mostrados).
Finalmente, es importante tener en cuenta que los rendimientos de PAECs derivados de este método pueden variar considerablemente. Presumiblemente, paciente-enfermedad específicas del estado y del médico factores contribuyen a esta variabilidad, como el Protocolo no contiene medidas que se espera que resulte en pérdida importante del material de fuente. La tabla 1 muestra a representante que cd146 + rendimientos de una variedad de cosechas PAEC utilizando puntas de catéter de una variedad de pacientes con Estados de enfermedad diferentes de la hipertensión pulmonar y una variedad de operadores de médico.
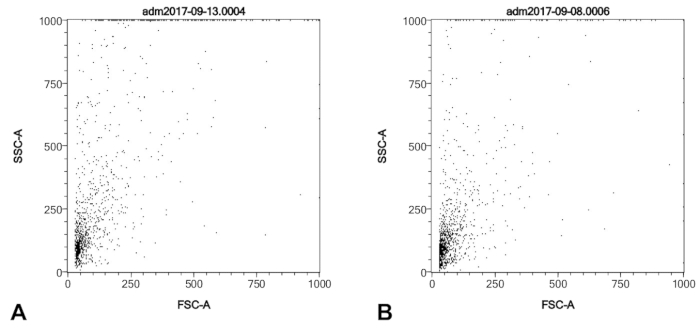
Figura 1 : Perfiles SSC/FSC de una cosecha de punta de globo sonda típica de un paciente de hipertensión pulmonar (A) y un número similar de células de un humano PAEC primario adquirido comercialmente de la cultura (B). Ambas muestras fueron purificados con el anti-CD146 columna fija y permeablized como se describe en el protocolo, antes del análisis FACS. Haga clic aquí para ver una versión más grande de esta figura.
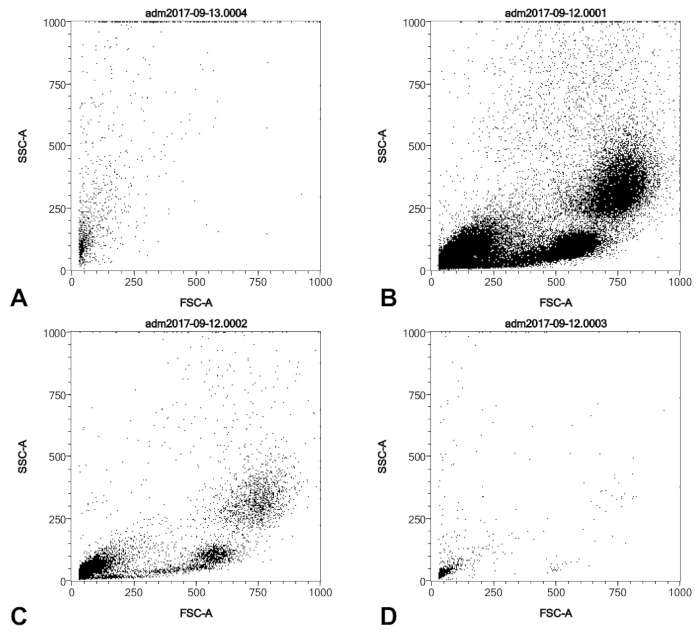
Figura 2 : Perfiles SSC/FSC de un globo sonda típica punta de cosecha de una hipertensión pulmonar paciente (A) y serie 1:10 dilución de Ficoll gradiente purificada humana de la capa anteada (B, C, D). (A) se purificó con la columna anti-CD146 mientras que (B-D) no. Todas las muestras de células se fija y permeablized como se describe en el protocolo, antes del análisis FACS. Haga clic aquí para ver una versión más grande de esta figura.
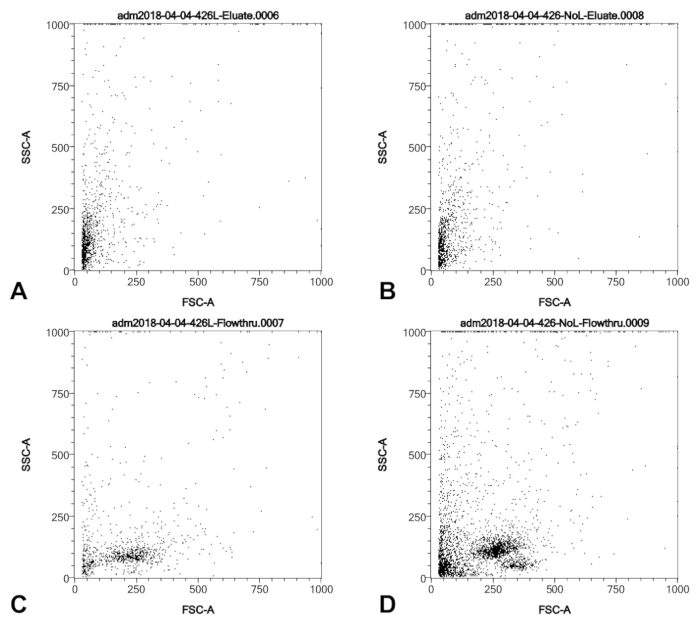
Figura 3 : Perfiles SSC/FSC de una cosecha de punta de catéter balón de un paciente de hipertensión pulmonar en que la sangre era visible en la punta del catéter antes de procesar. Antes de paso 3.1 del Protocolo, se dividió la muestra y tampón de lisis se añade a una alícuota y retenido de la otra. (A) y (C) mostrar los perfiles SSC/FSC de las muestras sometidas a lisis, tanto las células retenidas por la columna (A) y el flujo a través de la columna. (B) y (D) mostrar los perfiles SSC/FSC de la muestra unlysed, tanto las células retenidas por la columna (B) y el flujo a través de la columna (D). Concluimos que lisis elimina algunos pero no todos los leucocitos pero eso leucocitos no son retenidas por la columna y por lo tanto quedan excluidos de la cosecha final, independientemente de la lisis. Haga clic aquí para ver una versión más grande de esta figura.
| Muestra | Fecha | Rendimiento de la célula | Diagnóstico |
| 433 | 17/04/2018 | 7364 | Enfermedad pulmonar intersticial PH |
| 279 | 17/04/2018 | 7130 | PH-esclerodermia |
| 432 | 13/04/2018 | 3976 | PH-Multifactorial |
| 431 | 13/04/2018 | 3634 | HFrEF |
| 390 | 13/04/2018 | 5666 | PAH |
| 423 | 23/03/2018 | 9024 | HFrEF |
| 272 | 23/03/2018 | 7098 | HFrEF |
| 408 | 27/02/2018 | 4784 | HFrEF |
| 403 | 14/02/2018 | 10376 | PH-CIA + insuficiencia mitral |
| 396 | 26/01/2018 | 4890 | ICFEP IPCPH |
| 397 | 26/01/2018 | 7672 | Hemodinámica normal |
| 318 | 04/01/2018 | 7002 | Davi HFrEF presente |
Tabla 1: CD146 + rendimientos de una variedad de cosechas PAEC. Representante CD146 + rendimientos de una variedad de cosechas PAEC utilizando puntas de catéter de una variedad de pacientes con Estados de enfermedad diferentes de la hipertensión pulmonar y una variedad de operadores de médico.
Discusión
La técnica descrita en este artículo se aprecia mejor en el contexto de los anteriores paradigmas experimentales para estudiar el endotelio vascular pulmonar. Los intentos anteriores para obtener PAECs de los seres humanos se han limitado a los pulmones explantados cadavérico5 y una tentativa de breve duración para desarrollar un catéter de arteria pulmonar biopsia6. Como se señaló en un reciente informe7, la presente técnica se distingue de la cosecha de tejido pulmonar por su capacidad para obtener PAECs de una vida humana y hacerlo en varios puntos de tiempo en la progresión de la enfermedad o terapia. Sin embargo, debe señalarse que una técnica de compañero se ha divulgado recientemente por el inducido por células madre pluripotentes (IPSCs) puede ser transdifferentiated en PAECs4,5. Esta técnica produce abundantes cultivos de PAECs específico para cada paciente y permite el estudio de los efectos de fondo genético específico para cada paciente en biología PAEC. A pesar de estas ventajas, estas PAECs derivados de IPSC no pueden ofrecer cualquier información sobre la interacción entre el microentorno local y fondo genético específico para cada paciente. Nuestro grupo ha presentado la opinión de que la "punta del cateterismo" y técnicas IPSC están probables que en avanzar en el campo8.
Dentro de este contexto histórico y actual, cabe señalar las limitaciones de esta técnica. En primer lugar, es importante tener en cuenta que los rendimientos de PAECs derivados de este método pueden variar considerablemente. Presumiblemente, paciente-enfermedad específicas del estado y del médico factores contribuyen a esta variabilidad, como el Protocolo no contiene medidas que se espera que resulte en pérdida importante del material de fuente. La tabla 1 muestra a representante que cd146 + rendimientos de una variedad de cosechas PAEC utilizando puntas de catéter de una variedad de pacientes con Estados de enfermedad diferentes de la hipertensión pulmonar y una variedad de operadores de médico. En segundo lugar, los rendimientos de la célula son general baja, y su viabilidad para el cultivo ha demostrado para ser más bajo todavía en nuestras manos. Mientras que previamente hemos crecido culturas de PAECs utilizando este método1, asumen esos resultados representan rescate de un subconjunto de células madre tras la muerte de la mayoría de la muestra y sólo intermitentemente éxito en nuestras manos. Por ejemplo, no es infrecuente encontrar solamente algunos docena adherente PAECs en cultura por la mañana después de una cosecha ha sido plateada. A menudo estas micro-culturas no sobreviven a la expansión. Es necesario seguir trabajando para optimizar este protocolo de manera que la viabilidad de PAECs y sus condiciones en la cultura para lograr el objetivo deseado de propagación de las cosechas PAEC específico para cada paciente. Por último, la selección positiva CD146 que hemos adaptado no puede excluir la contaminación con otras CD146 + células, tales como circulación de4de las células endoteliales, pericitos, células musculares lisas y rara CD146 + T células9,10. Sin embargo, estas células se presume que son muy pocos en número en las muestras recogidas de esta manera, y CD146 es considerablemente más específico de este protocolo que otros marcadores de la célula de las células endoteliales como el CD31 (que también está presente en una variedad de transmisión sanguínea células como las plaquetas11). Las mejoras futuras encaminadas a mejorar la especificidad deben sopesarse frente a su efecto potencialmente negativo sobre el rendimiento.
Divulgaciones
MJP y RLB son inventores patentes alegando las porciones de los métodos descritos.
Agradecimientos
Los autores desean agradecer a los médicos y personal del servicio de insuficiencia cardíaca avanzada y la hipertensión pulmonar del Hospital General Allegheny de apoyo para la prestación de cientos de muestras de catéter durante varios años que han facilitado la optimización de esta metodología.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 mm culture dish | Fisher | NC9385690 | |
| 15 mL Centrifuge Tubes | Midsci | C15R | |
| 16% Formaldehyde | Fisher | PI28908 | |
| 50 mL centrifuge tubes | Midsci | C50R | |
| Accutase | Thermo | A1110501 | cell detachment solution |
| Cell Scraper | Fisher | 08-100-241 | |
| Endothelial Cell Growth media | Cell Applications | 211-500 | |
| Forceps | any | ||
| Hemostat | any | ||
| LoBind microfuge tube | Fisher | 13-698-794 | |
| Miltenyi CD146 beads | Miltenyi | 130-093-596 | |
| Miltenyi FCR blocker | Miltenyi | 130-059-901 | |
| Miltenyi LS columns | Miltenyi | 130-042-401 | |
| Miltenyi magnet | Miltenyi | MidiMACS | |
| Miltenyi RBC lysis buffer | Miltenyi | 130-094-183 | |
| PBS | Fisher | BP2438-4 | |
| Scissors | any | ||
| Syringes | BD | 309597 |
Referencias
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Respiratory Journal. 46 (4), 903-975 (2015).
- Pollett, J. B., Benza, R. L., Murali, S., Shields, K. J., Passineau, M. J. Harvest of pulmonary artery endothelial cells from patients undergoing right heart catheterization. Journal of Heart Lung Transplantation. 32 (7), 746-749 (2013).
- Benza, R. L., et al. In situ expression of Bcl-2 in pulmonary artery endothelial cells associates with pulmonary arterial hypertension relative to heart failure with preserved ejection fraction. Pulmonary Circulation. 6 (4), 551-556 (2016).
- Bull, T. M., et al. Circulating endothelial cells in pulmonary hypertension. Thrombosis and Haemostasis. 90 (4), 698-703 (2003).
- Kaneko, F. T., et al. Biochemical reaction products of nitric oxide as quantitative markers of primary pulmonary hypertension. American Journal of Respiratory and Critical Care Medicine. 158 (3), 917-923 (1998).
- Rothman, A., et al. Transvenous procurement of pulmonary artery smooth muscle and endothelial cells using a novel endoarterial biopsy catheter in a canine model. Journal of the American College of Cardiology. 27 (1), 218-224 (1996).
- Savale, L., Guignabert, C., Weatherald, J., Humbert, M. Precision medicine and personalising therapy in pulmonary hypertension: seeing the light from the dawn of a new era. European Respiratory Reviews. 27 (148), (2018).
- Kanwar, M., Raina, A., Passineau, M., Benza, R. Idiopathic Pulmonary Arterial Hypertension: Evolving Therapeutic Strategies. Seminars in Respiratory and Critical Care Medicine. 38 (5), 606-618 (2017).
- Elshal, M. F., Khan, S. S., Takahashi, Y., Solomon, M. A., McCoy, J. P. CD146 (Mel-CAM), an adhesion marker of endothelial cells, is a novel marker of lymphocyte subset activation in normal peripheral blood. Blood. 106 (8), 2923-2924 (2005).
- Elshal, M. F., et al. A unique population of effector memory lymphocytes identified by CD146 having a distinct immunophenotypic and genomic profile. BMC Immunolology. 8, 29 (2007).
- Newman, P. J., et al. PECAM-1 (CD31) cloning and relation to adhesion molecules of the immunoglobulin gene superfamily. Science. 247 (4947), 1219-1222 (1990).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados