Method Article
Ernte von Endothelzellen von Sprechblasentipps Swan-Ganz Katheter nach rechts Herzkatheter
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Beseitigung und Reinigung der Lungenarterie endothelialen Zellen (PAECs), die sich zu den Ballon-Tipps von Swan-Ganz Katheter halten, während sie während rechts Herzkatheter in der Lungenarterie eingeklemmt sind und bleiben an der Luftballon nach Entnahme aus dem Körper des Patienten.
Zusammenfassung
Eine Vielzahl von Krankheiten führen, pulmonale Hypertonie (PH), definiert als eine mittlere Lungenarterie Druck von mehr als 25 MmHg in Ruhe. Zur weiteren diagnose und PH zu verwalten, werden Patienten wiederholt Rechte Herz Katheterwechsel (RHC) wobei ein Swan-Ganz-Katheter ist in eine Filiale der Lungenarterie fortgeschritten und ein Ballon aufgeblasen wird, um die Katheterspitze Keil unterzogen. Dieser Artikel beschreibt ein Protokoll, wobei Lungenarterie endothelialen Zellen (PAECs) von Sprechblasentipps Swan-Ganz Katheter nach RHC geerntet und mit einer Anti-CD146 Affinität Spalte Technik, vermeintliche PAECs zu reinigen gereinigt werden können. Diese Zellen können verwendet werden, um eine in-situ Momentaufnahme der biologische Zustand der pulmonalen Gefäßsystems Endothel, hämodynamische Messungen während RHC zu ergänzen. Geerntet und gereinigten PAECs verwendet werden, für die entweder Zellkultur oder für nachfolgende analytische Tests wie Fluss Cytometery.
Einleitung
Aktuelle US-amerikanischen und europäischen Richtlinien erfordern richtige Herzkatheter zur Diagnostik der pulmonalen Hypertonie1. Ärzte und Wissenschaftler, die versuchen, diese Krankheit zu verstehen den Wunsch biologischer Proben aus der pulmonalen Gefäßsystem der hämodynamischen Daten ergänzen, die während der RHC erfasst werden. Leider das Risiko bei pulmonalen vaskulären Biopsie ist sehr hoch, und biologische Proben des pulmonalen Gefäßsystems sind daher nur selten wenn überhaupt von lebenden Patienten RHC erhalten. Während viel von Erkenntnis pulmonalen Gefäßgewebe von cadaveric oder explantiert Lungen, diese Beispiele sind nicht in der Lage, die Biologie des Krankheitsprozesses PH zu reflektieren, wie es bei einem lebenden Patienten abspielt. Im Jahr 2013 berichteten wir erstmals, dass Lungenarterie endothelialen Zellen (PAECs) von den Ästen der Lungenarterie durch physischen Kontakt mit der QuickInfo-Sprechblase des Swan-Ganz-Katheters während RHC entblößt sind und in kleinen Stückzahlen aus dem Katheterspitzen zurückgewonnen werden nach dem Verfahren2.
Dieser Artikel veranschaulicht unsere Technik für die Beseitigung und Reinigung der Lungenarterie endothelialen Zellen (PAECs) von Sprechblasentipps Swan-Ganz Katheter nach rechts Herzkatheter. Bisher, wurde die Methodik für die Durchführung dieser Ernte-Technik nicht ausreichend detailliert in der Literatur um einheitliche Ergebnisse zwischen Laboratorien, die Durchführung der Technik gewährleisten beschrieben. Dieser Artikel soll diesen Mangel mit visualisierten Demonstration der Technik, von am Krankenbett Sammlung von Katheterspitzen bis zum fertigen Produkt von gereinigten CD146 + Endothelzellen zu überwinden. Diese Technik sollte Hilfe bei der Förderung der Forschung in der Pathobiologie der verschiedenen Ätiologien von PH und möglicherweise führen zur Entwicklung von neuen diagnostischen Assays hämodynamische während RHC gesammelten Daten ergänzen.
Die Bedeutung dieser Technik auf dem Gebiet der pulmonalen vaskulären Medizin und Forschung ist, dass es ermöglicht den Zugriff auf eine Momentaufnahme der Biologie der pulmonalen Endothel in Situ und im Gegensatz zu früheren Studien auf explantiert oder cadaveric Lungen, stellt keine einen Endpunkt für das Thema Lunge. Vor kurzem haben wir gezeigt, dass eine Anti-apoptotische Biomarker in diesen Zellen Nützlichkeit in genauer Phänotypisierung kann im Zusammenhang mit Sorten von pulmonaler Hypertonie3. Die Ausbeute an Zellen gewonnen ist relativ klein, ~ 5, 000-25.000 PAECs pro Probe, und diese Zellen sind schwierig (aber nicht unmöglich), Kultur. Wir glauben, dass clevere Kliniker und Forscher Synergien zwischen diesen Begleiter Techniken finden um pulmonalen vaskulären Forschung, Diagnostik und Vorzeichen zu fördern.
Protokoll
Alle Studien, die in diesem Artikel beschriebenen stimmten der Institutional Review Board des Allegheny Health Network. Alle Patienten zur Verfügung gestellt Einwilligung vor der Verabreichung von beruhigenden Wirkstoffen und wurden durch eine Studie Nummer zugewiesen wird de-identifiziert.
(1) am Krankenbett Sammlung
Hinweis: Alles in diesem Protokoll sollte auf Eis, mit vorgekühlt Lösungen erfolgen. Es ist wichtig, induzieren Kälte Stase in den Zellen, die in-situ biologische Phänotyp zu erhalten. Dieses Protokoll beinhaltet den Umgang mit Blut und Zellen aus Mensch und daher sollten Vorsichtsmaßnahmen beachtet werden.
- Tauchen Sie nach Abzug des Katheters aus der Scheide sofort den Katheter in eine 50 mL Zentrifugenröhrchen mit 40 mL gekühlten sterile Kochsalzlösung. Schwenken Sie den Katheter mehrmals Blut entfernen und Spülen der Linie, wenn notwendig, entfernen von Blut innerhalb der Linie beibehalten.
- Die distalen 5 cm der Cath Spitze geschnitten Sie ab und lassen Sie es in der 50 mL Zentrifugenröhrchen mit gekühlten Kochsalzlösung fallen. Sofort die Cath-Spitze mit der Pinzette entfernen und überträgt es auf eine 15 mL Zentrifugenröhrchen mit 15 mL Wachstumsmedium Endothelzellen (EG).
- Versiegeln Sie das Rohr, auf Eis legen und transfer ins Labor zur Verarbeitung oder Versand vorbereiten. Es ist wichtig, dass der Ballon mitten im Medium bleibt, so stellen Sie sicher, dass gibt es minimale Gasraum in der 15 mL Tube von EG Wachstumsmedium komplett einfüllen.
- Prozess der Probe sofort von Verfahren zum Schritt 2.1 oder Siegel und Schiff die Probe auf nassem Eis über Nacht zur Verarbeitung an ein Labor geschickt in diesem Protokoll. Wenn Zellen letztlich für die Zellkultur verwendet werden sollen, ist es dringend empfohlen, dass die Cath Spitze verarbeitet werden sofort am selben Ort, an dem sie gesammelt wurden.
2. Zellernte
Hinweis: Alles in diesem Protokoll sollte auf Eis, mit vorgekühlt Lösungen erfolgen. Die Zellen sind in kalten Stase, und es ist wichtig, zu vermeiden, Erwachen sie, bis sie bereit sind, behoben oder kultiviert werden. Das gesamte Protokoll sollte in einer Laminar-Flow-Kapuze, mit sterilen Instrumenten, wenn die ultimative Absicht Kultur der geernteten PAECs durchgeführt werden. Wenn Kultur nicht vorgesehen ist (z. B. flow Cytometry Analysis), es ist nicht notwendig, sterile Vorsichtsmaßnahmen zu beachten.
- Eine 15 mL Zentrifugenröhrchen 5 mL der Zelle Ablösung Lösung hinzufügen; auf Eis legen.
- Ziehen Sie 1 mL der EG-Medien aus, dass noch auf dem Nachttisch Sammelrohr in 1 mL Spritze.
- Schnell Schritte 2,3 bis 2,5. Fassen Sie das abgeschnittene Ende der Katheterspitze mit Arterienklemmen.
- 1 mL Spritze Nadel vorsichtig in die "weiße" Loch gegenüber den Führungsdraht ("Schwarzes Loch"). Zur Vermeidung von Verletzungen mit der Nadel zu achten.
- Übertragen Sie Cath-Tipp in der 15 mL Zentrifugenröhrchen, enthält die Zelle Ablösung Lösung.
- Pumpen Sie den Ballon, darauf achten, nicht zu es platzen; Aufblasen des Ballons mit ca. 200 µL Medien funktioniert gut.
- Lassen Sie den Katheter in Zelle Ablösung Lösung für 5 min auf Eis mit dem Ballon aufgeblasen zu sitzen. Wenn der Ballon während der 5 min Inkubation auf eigene entlüftet, ist das akzeptabel.
- Gießen Sie den Inhalt der 15 mL Zentrifugenröhrchen in 100 mm Schale. Legen Sie den Ballon in die Zelle Ablösung Lösung "Pfütze".
- Kratzen Sie den aufgeblasenen Ballon mit einer Zelle-Spachtel. Die Zelle-Spachtel kann um den Ballon in einer kreisförmigen Bewegung oder ein Bürsten Bewegung gezeichnet werden. Konzentrieren Sie sich auf die "Pole" des Ballons, trifft es den Katheter. Stellen Sie sicher, dass die Zelle Spachtel die gesamte Oberfläche des Ballons mindestens zweimal berührt. Spülen Sie die Zelle Spachtel in die Zelle Ablösung Lösung "Pfütze" in regelmäßigen Abständen.
- Luft aus dem Ballon und reiben Sie es mit einer Bürsten Bewegung. Spülen Sie die Zelle Spachtel in die Zelle Ablösung Lösung "Pfütze".
- Entsorgen Sie die Cath Spitze, Nadel und Zelle Spachtel in die entsprechenden Abfallbehälter.
- Füllen Sie die Zelle Ablösung Lösung mit der Zellernte in ein 50 mL Zentrifugenröhrchen. Schütteln Sie das Sammelröhrchen und gießen Sie die restlichen Medien aus dem Sammelrohr in den gesammelten Probe sowie.
- Zentrifugieren Sie die Probe bei 650 X g bei 4 ° C für 10 min. Es ist wichtig zu beachten, dass oft ein Pellet nicht gesehen werden. Es kann hilfreich sein, markieren Sie die Stelle, wo ein Pellet gesehen werden würde, wenn sichtbar, um zu vermeiden das Pellet Absaugen, falls es zu klein, um zu sehen ist.
Hinweis: Normalerweise wird ein Pellet nur angezeigt, wenn die Probe durch Blut verschmutzt worden ist. Blut ist für das ultimative Ernte Produkt unerheblich, weil Blut schlägt fehl, die CD146 Perlen zu binden und durch die Säule wäscht. Umfangreiche Tests hat gezeigt, dass die spezifische Marke von 1,5 mL Mikrozentrifugenröhrchen verwiesen in der Tabelle der Materialien Zellverlust im Vergleich zu anderen Röhren verwendet während der Protokoll-Optimierung minimiert. - Vorsichtig aspirieren Sie Medien, und vermeiden Sie störende oder Absaugen der Pellets.
3. Zelle Reinigung
Hinweis: Alles in diesem Protokoll sollte auf Eis, mit vorgekühlt Lösungen erfolgen. Die Zellen sind in kalten Stase, und es ist wichtig, zu vermeiden, Erwachen sie, bis sie bereit sind, behoben oder kultiviert werden.
- Das Pellet in 1 mL gekühlten Erythrozyten Lyse Lösung Aufschwemmen und überträgt es auf ein 1,5 mL Microfuge Rohr; sanft Rock für 10 min bei 4 ° C.
- Zentrifuge für 5 min bei 500 x g und 4 ° C. Aspirieren Sie die RBC-Lyse-Lösung.
- Das Pellet in 60 μl PBS, 20 μL der FcR-Blocker und 20 μL des Anti-Human CD146 Microbeads aufzuwirbeln. 15 min bei 4 ° c inkubieren
- Fügen Sie 1 mL gekühlten PBS. Zentrifuge für 5 min bei 500 x g und 4 ° C. Aspirieren Sie überstand und aufzuwirbeln Sie das Pellet in 1 mL gekühlten PBS.
- Legen Sie eine magnetische LS-Spalte auf einem magnetischen Gitter (siehe Tabelle der Materialien für bestimmte kommerzielle Identitäten dieser Elemente) bei Raumtemperatur. Prime Spalte durch Zugabe von 1 mL PBS und das gesamte Volumen durchströmen lassen. Entsorgen Sie den Durchfluss.
- Legen Sie die Probe im magnetischen Feld. Entsorgen Sie den Durchfluss.
- Waschen Sie Spalte mit 3 mL gekühlten PBS dreimal. Entsorgen Sie den Durchfluss von jedem Waschgang.
- Eine 15 mL Zentrifugenröhrchen 3 mL gekühlten PBS hinzufügen. Entfernen Sie die magnetischen Spalte vom Magnet, Gießen Sie die 3 mL PBS aus den 15 mL Zentrifugenröhrchen in der Spalte und setzen Sie schnell die Säule in die Zentrifugenröhrchen, den Durchfluss zu fangen. Sofort stürzen Sie mit den Kolben mit Spalte geliefert. Die Probe ist nun gereinigt, bereit für Fixierung/beflecken oder Kultur.
Ergebnisse
Dieses Protokoll ergibt sich bei der Reinigung der Zellen von Swan-Ganz Katheterspitzen nach rechts Herzkatheter, die an eine CD146 Auswahl Spalte binden und vorwärts/Side Scatter-Profile, die von kultivierten primären menschlichen pulmonalen nisht zu unterscheidend sind Arterie Endothelzellen (Abbildung 1). Bedenkt, dass der Katheter Ballon in Körperkontakt mit nur der Einführhilfe Scheide (eine zellfreie Material), der Lungenarterie Gefäßwand, und das Blut, Daten ist hier zur Verfügung gestellten nachweisen können, dass diese Zellen aus dem Blut (Abbildung 2) nicht gewonnen werden , und es wird daher angenommen, dass sie tatsächlich aus der Lungenarterie Gefäßwand. Die Leser sollten beachten, dass die Anti-CD146 magnetische Beads, die verwendet werden, um die Zellen zu reinigen bleiben Anhänger an die Zelloberfläche nach dem Verfahren, und somit es ist suboptimal zu versuchen, die Zelle ernten für CD146 als Marker der endothelial Zellen zu analysieren. CD31 oder andere endotheliale Marker wäre vermutlich für die Kennzeichnung und als Alternativen in Erwägung gezogen werden.
Wesentliche Elemente dieses Protokolls wurden Ergebnisse beeinflussen können. Erstens ist es wichtig, die Katheterspitze am Krankenbett zu spülen, um Blut zu entfernen. Abbildung 3 zeigt Side Scatter (SSC) / Forward Scatter (FSC) Profile von durchströmten aus der Spalte "Anti-CD146" für eine Probe, die war richtig gespült und war nicht. Die Spalte scheint Blut gewonnenen Zellen aus der Ernte (Abbildung 2) ausschließen, aber die Spülung Schritt sorgt für minimale mögliche Kontamination von zirkulierenden endotheliale Zellen (das sind normalerweise anwesend < 50 Zellen/mL Blut4). Wir haben das Eluat aus der CD146 beobachtet, die Spalte völlig klar, sogar bei sehr blutigen Katheter Tipp Proben ist. Dies deutet darauf hin, dass die Spalte in der Lage, erhebliche Mengen an Blut zu behandeln, ohne Verstopfung oder Aufrechterhaltung von nicht-CD146 + Bloodborne-Zellen.
Zweitens ist es wichtig, die QuickInfo-Sprechblase mindestens einmal während der Zelle Ablösung Lösung/Zelle Schaber Schritt aufzublasen. Angesichts der Tatsache, dass die vermeintliche PAECs auf die QuickInfo-Sprechblase Anhänger trotz der Kochsalzlösung spülen Schritt bleiben, es scheint wahrscheinlich können sie teilweise durch Falten in der Vinyl-Ballon gefangen sein, wie es in der Vorbereitung für die Entfernung aus der Patient entleert ist. Vermutlich, befreit die Inflation Schritt PAECs, so dass sie sanft weg gekratzt werden. Es ist nicht sofort klar, man könnte diese Hypothese testen, aber niedrigere Erträge von Zellen eingehalten worden, wenn der Ballon nicht aufgeblasen (Daten nicht gezeigt) ist.
Zu guter Letzt ist es wichtig zu beachten, dass die Erträge der PAECs abgeleitet von dieser Methode erheblich variieren können. Vermutlich tragen Patienten-Arzt-bundeslandspezifischen Krankheitsfaktoren zu dieser Variabilität, wie das Protokoll keine Schritte enthält, die zu großen Verlust des Quellmaterials führen zu erwarten wäre. Tabelle 1 zeigt Vertreter, die CD146 + ergibt sich aus einer Vielzahl von PAEC ernten Nutzung Katheterspitzen, gewonnen aus einer Vielzahl von Patienten mit verschiedenen Krankheitszuständen der pulmonalen Hypertonie und eine Vielzahl von Arzt-Betreiber.
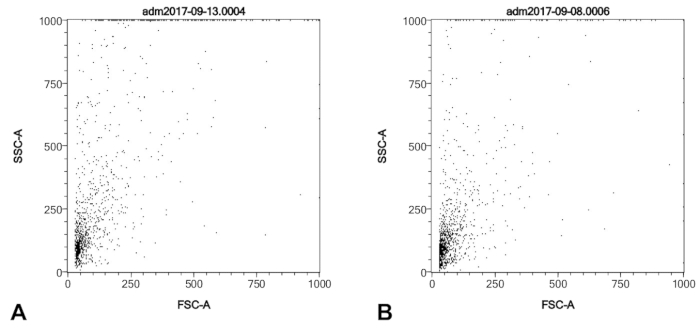
Abbildung 1 : SSC/FSC Profile einer typischen Katheter Ballon Tipp Ernte von pulmonaler Hypertonie Patienten (A) und eine ähnliche Anzahl von Zellen aus einem kommerziell erworbenen primären menschlichen PAEC Kultur (B). Beide Proben wurden gereinigt mit der Anti-CD146-Spalte fixiert und permeablized wie im Protokoll vor der FACS Analyse beschrieben. Bitte klicken Sie hier für eine größere Version dieser Figur.
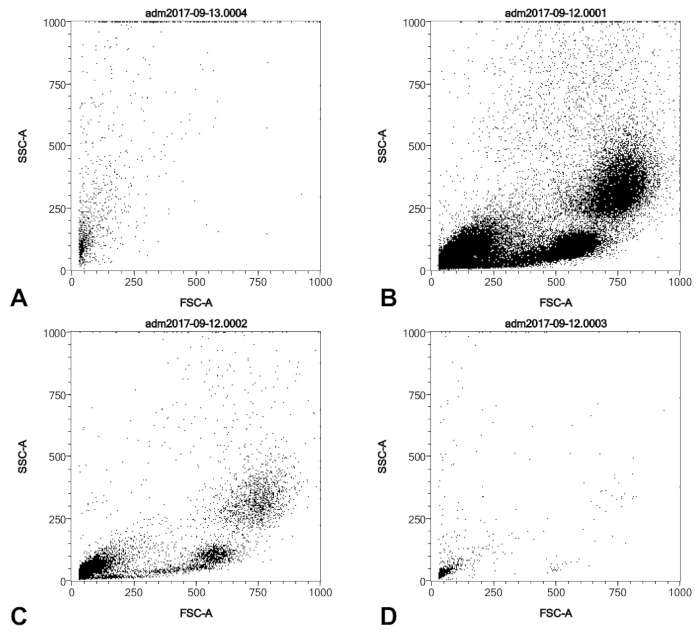
Abbildung 2 : SSC/FSC Profile eines typischen Katheter Ballon Tipp Ernte von pulmonaler Hypertonie Patienten (A) und serielle 01:10 Verdünnung Ficoll Farbverlauf-gereinigte menschlichen buffy Coat (B, C, D). (A) mit der Anti-CD146-Säule gereinigt wurde, während (B-D) waren nicht. Alle Zellproben wurden behoben und permeablized wie im Protokoll vor der FACS Analyse beschrieben. Bitte klicken Sie hier für eine größere Version dieser Figur.
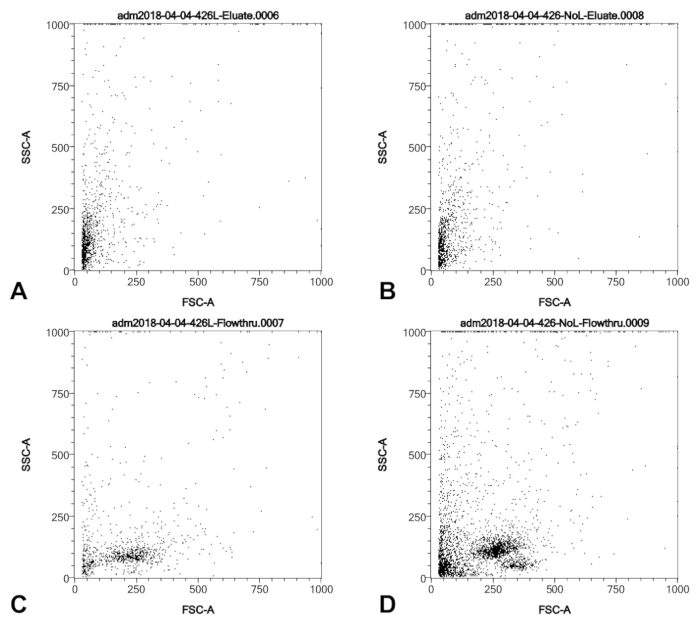
Abbildung 3 : SSC/FSC Profile einer Katheter Ballon Tipp Ernte von pulmonaler Hypertonie Patienten in das Blut wurde auf die Katheterspitze vor der Verarbeitung sichtbar. Vor Schritt 3.1 des Protokolls die Probe wurde aufgeteilt und Lyse Puffer wurde hinzugefügt, um einen aliquoten und den anderen nicht vorenthalten. (A) und (C) die SSC/FSC-Profile der lysierten Probe beide Zellen erhalten durch die Spalte (A) und die Durchströmung aus der Spalte zu zeigen. (B) und (D) die SSC/FSC-Profile der unlysed Probe beide Zellen erhalten durch die Spalte (B) und die Durchströmung aus der Spalte (D) zeigen. Wir schlussfolgern, dass Lyse einige entfernt aber nicht alle der Leukozyten aber die Leukozyten werden nicht durch die Spalte beibehalten und sind daher aus der letzten Ernte, unabhängig von Lyse ausgeschlossen. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Probe | Datum | Zellausbeute | Diagnose |
| 433 | 17.04.2018 | 7364 | PH-interstitielle Lungenerkrankung |
| 279 | 17.04.2018 | 7130 | PH-Sklerodermie |
| 432 | 13.04.2018 | 3976 | PH-multifaktoriell |
| 431 | 13.04.2018 | 3634 | HFrEF |
| 390 | 13.04.2018 | 5666 | PAH |
| 423 | 23.03.2018 | 9024 | HFrEF |
| 272 | 23.03.2018 | 7098 | HFrEF |
| 408 | 27.02.2018 | 4784 | HFrEF |
| 403 | 14.02.2018 | 10376 | PH-Ass + Mitral-Krankheit |
| 396 | 26.01.2018 | 4890 | HFpEF-IPCPH |
| 397 | 26.01.2018 | 7672 | Normale Hämodynamik |
| 318 | 04.01.2018 | 7002 | HFrEF-LVAD vorhanden |
Tabelle 1: CD146 + ergibt sich aus einer Vielzahl von PAEC ernten. Vertreter CD146 + ergibt sich aus einer Vielzahl von PAEC ernten Nutzung Katheterspitzen, gewonnen aus einer Vielzahl von Patienten mit verschiedenen Krankheitszuständen der pulmonalen Hypertonie und eine Vielzahl von Arzt-Betreiber.
Diskussion
In diesem Artikel beschriebene Verfahren wird am besten im Rahmen der bisherigen experimentellen Paradigmen für das Studium der pulmonalen Gefäßendothels geschätzt. Frühere Versuche, PAECs von Menschen zu erhalten wurden beschränkt explantiert/cadaveric Lunge5 und einem kurzlebigen Versuch, einen Katheter in der Lage, Lungenarterie Biopsie6zu entwickeln. Wie in den letzten Beitrag7erwähnt, ist die gegenwärtige Technik durch seine Fähigkeit PAECs von menschliche Leben zu erhalten, und zwar an mehreren Zeitpunkten in der Progression der Krankheit und/oder Therapie von Lungenkrebs Gewebe Ernte auszeichnet. Allerdings ist darauf hinzuweisen, dass eine Begleiter-Technik vor kurzem berichtet hat wobei induzierte pluripotente Stammzellen (IPSCs) Transdifferentiated in PAECs4,5sein kann. Diese Technik produziert reichliche Kulturen der Patienten-spezifischen PAECs und ermöglicht die Studie über die Auswirkungen des Patienten-spezifischen genetischen Hintergrund auf PAEC Biologie. Trotz dieser Vorteile können nicht diese IPSC abgeleitet PAECs keine Informationen über die Interaktion zwischen lokalen Mikroumgebung und Patienten-spezifischen genetischen Hintergrund bieten. Unsere Fraktion hat die Ansicht dargestellt, dass "Cath Tip" und IPSC-Techniken bei der Förderung der Feld8synergistische sein dürften.
In dieser gegenwärtigen und historischen Kontext die Grenzen dieser Technik hingewiesen. Erstens ist es wichtig zu beachten, dass die Erträge der PAECs abgeleitet von dieser Methode erheblich variieren können. Vermutlich tragen Patienten-Arzt-bundeslandspezifischen Krankheitsfaktoren zu dieser Variabilität, wie das Protokoll keine Schritte enthält, die zu großen Verlust des Quellmaterials führen zu erwarten wäre. Tabelle 1 zeigt Vertreter, die CD146 + ergibt sich aus einer Vielzahl von PAEC ernten Nutzung Katheterspitzen, gewonnen aus einer Vielzahl von Patienten mit verschiedenen Krankheitszuständen der pulmonalen Hypertonie und eine Vielzahl von Arzt-Betreiber. Zweitens Zelle Erträge sind insgesamt gering und ihre Lebensfähigkeit für Kultur erweist sich noch tiefer in unseren Händen. Während wir früher Kulturen der PAECs mit dieser Methode1gewachsen sind, wir übernehmen diese Ergebnisse stellen Rettung einer Teilmenge von Progenitorzellen nach Absterben der meisten der Probe und ist nur zeitweise erfolgreich in unseren Händen. Beispielsweise ist es nicht ungewöhnlich, am Morgen nach eine Ernte vergoldet wurden nur ein paar Dutzend Anhänger PAECs in Kultur zu finden. Diese Mikro-Kulturen überleben oft nicht auf Expansion. Zur Optimierung dieses Protokolls in einer Weise, die die Lebensfähigkeit der PAECs aufrechterhalten wird und ihre Bedingungen in der Kultur, das angestrebten Ziel der Vermehrung der patientenspezifischen PAEC Ernten zu erreichen, sind weitere Arbeiten erforderlich. Zu guter Letzt kann der CD146 positive Selektion, die, den wir angepasst haben, Verunreinigungen mit anderen CD146 + Zellen, wie z. B. die zirkulierenden endothelialen Zellen4, Perizyten, glatten Muskelzellen und seltene CD146 + T Zellen9,10nicht ausschließen. Dennoch, diese Zellen gelten als sehr gering an Zahl in auf diese Weise gesammelten Proben und CD146 ist für dieses Protokoll wesentlich genauer als andere Zelle Marker der Endothelzellen wie CD31 (die auch auf eine Vielzahl von Blut übertragbare vorhanden ist Zellen, einschließlich der Thrombozyten-11). Alle zukünftigen Verbesserungen zur Verbesserung der Spezifität sollten gegen ihre potenziell negativen Einfluss auf Ertrag ausgeglichen werden.
Offenlegungen
MJP und RLB sind Erfinder auf Patente behaupten Teile der beschriebenen Methoden.
Danksagungen
Die Autoren möchten danken die Ärzten und support-Mitarbeiter von der fortgeschrittenen Herzinsuffizienz und pulmonale Hypertonie Service des Allegheny General Hospital für die Bereitstellung von Hunderten von Katheter Proben über mehrere Jahre, das erleichtert die Optimierung dieser Methodik.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 mm culture dish | Fisher | NC9385690 | |
| 15 mL Centrifuge Tubes | Midsci | C15R | |
| 16% Formaldehyde | Fisher | PI28908 | |
| 50 mL centrifuge tubes | Midsci | C50R | |
| Accutase | Thermo | A1110501 | cell detachment solution |
| Cell Scraper | Fisher | 08-100-241 | |
| Endothelial Cell Growth media | Cell Applications | 211-500 | |
| Forceps | any | ||
| Hemostat | any | ||
| LoBind microfuge tube | Fisher | 13-698-794 | |
| Miltenyi CD146 beads | Miltenyi | 130-093-596 | |
| Miltenyi FCR blocker | Miltenyi | 130-059-901 | |
| Miltenyi LS columns | Miltenyi | 130-042-401 | |
| Miltenyi magnet | Miltenyi | MidiMACS | |
| Miltenyi RBC lysis buffer | Miltenyi | 130-094-183 | |
| PBS | Fisher | BP2438-4 | |
| Scissors | any | ||
| Syringes | BD | 309597 |
Referenzen
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Respiratory Journal. 46 (4), 903-975 (2015).
- Pollett, J. B., Benza, R. L., Murali, S., Shields, K. J., Passineau, M. J. Harvest of pulmonary artery endothelial cells from patients undergoing right heart catheterization. Journal of Heart Lung Transplantation. 32 (7), 746-749 (2013).
- Benza, R. L., et al. In situ expression of Bcl-2 in pulmonary artery endothelial cells associates with pulmonary arterial hypertension relative to heart failure with preserved ejection fraction. Pulmonary Circulation. 6 (4), 551-556 (2016).
- Bull, T. M., et al. Circulating endothelial cells in pulmonary hypertension. Thrombosis and Haemostasis. 90 (4), 698-703 (2003).
- Kaneko, F. T., et al. Biochemical reaction products of nitric oxide as quantitative markers of primary pulmonary hypertension. American Journal of Respiratory and Critical Care Medicine. 158 (3), 917-923 (1998).
- Rothman, A., et al. Transvenous procurement of pulmonary artery smooth muscle and endothelial cells using a novel endoarterial biopsy catheter in a canine model. Journal of the American College of Cardiology. 27 (1), 218-224 (1996).
- Savale, L., Guignabert, C., Weatherald, J., Humbert, M. Precision medicine and personalising therapy in pulmonary hypertension: seeing the light from the dawn of a new era. European Respiratory Reviews. 27 (148), (2018).
- Kanwar, M., Raina, A., Passineau, M., Benza, R. Idiopathic Pulmonary Arterial Hypertension: Evolving Therapeutic Strategies. Seminars in Respiratory and Critical Care Medicine. 38 (5), 606-618 (2017).
- Elshal, M. F., Khan, S. S., Takahashi, Y., Solomon, M. A., McCoy, J. P. CD146 (Mel-CAM), an adhesion marker of endothelial cells, is a novel marker of lymphocyte subset activation in normal peripheral blood. Blood. 106 (8), 2923-2924 (2005).
- Elshal, M. F., et al. A unique population of effector memory lymphocytes identified by CD146 having a distinct immunophenotypic and genomic profile. BMC Immunolology. 8, 29 (2007).
- Newman, P. J., et al. PECAM-1 (CD31) cloning and relation to adhesion molecules of the immunoglobulin gene superfamily. Science. 247 (4947), 1219-1222 (1990).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten