Method Article
Récolte des cellules endothéliales de l’info-bulles des cathéters Swan-Ganz après cathétérisme cardiaque droit
Dans cet article
Résumé
Ce protocole décrit la dépose et la purification des cellules endothéliales de l’artère pulmonaire (PAECs) qui respectent les info-bulles des cathéters Swan-Ganz tandis qu’ils sont coincés dans l’artère pulmonaire au cours du cathétérisme cardiaque droit et restent adhérentes à la ballonnet dégonflé après le retrait du corps du patient.
Résumé
Une variété de pathologies conduire à l’hypertension pulmonaire (PH), qui est définie comme une pression de l’artère pulmonaire moyenne supérieure à 25 mmHg au repos. Pour diagnostiquer et gérer le PH, les patients subissent cathétérismes répétées de bon coeur (RHC) dans laquelle un cathéter de Swan-Ganz est avancé dans une branche de l’artère pulmonaire et un ballonnet est gonflé pour coincer l’extrémité du cathéter. Cet article illustre un protocole par lequel les cellules endothéliales de l’artère pulmonaire (PAECs) peuvent être récoltées dans les info-bulles des cathéters Swan-Ganz après RHC et purifiées avec une technique de colonne anti-CD146 affinité pour purifier PAECs putatifs. Ces cellules pourraient servir à donner un aperçu in situ de l’état biologique de l’endothélium vasculaire pulmonaire en complément des mesures hémodynamiques obtenus au cours de la RHC. Récoltées et PAECs purifiés peuvent être utilisés pour une culture de cellules ou pour des tests analytiques suivantes comme flux cytometery.
Introduction
Les lignes directrices américaines et européennes actuelles exigent cathétérisme cardiaque droit pour le diagnostic d’hypertension artérielle pulmonaire1. Les médecins et les scientifiques qui cherchent à comprendre cette maladie le désir des échantillons biologiques de la vascularisation pulmonaire pour compléter les données hémodynamiques qui sont recueillies au cours de la RHC. Malheureusement, le risque lié à la biopsie vasculaire pulmonaire est très élevé, et donc des échantillons biologiques de la vascularisation pulmonaire sont rarement sinon jamais obtenus de patients vivants subissant RHC. Tandis que beaucoup insight a été acquis de tissu vasculaire pulmonaire provenant de cadavres ou poumons explantés, ces échantillons ne peuvent refléter la biologie le PH du processus de maladie car il se déroule chez un patient vivant. En 2013, nous avons pour la première fois que les cellules endothéliales de l’artère pulmonaire (PAECs) sont dénudées des branches de l’artère pulmonaire par un contact physique avec l’info-bulle du cathéter Swan-Ganz pendant RHC et peuvent être récupérés en petits nombres depuis le bout du cathéter après la procédure2.
Cet article illustre notre technique pour la dépose et la purification des cellules endothéliales de l’artère pulmonaire (PAECs) des info-bulles des cathéters de Swan-Ganz après cathétérisme cardiaque droit. Jusqu’ici, la méthodologie utilisée pour effectuer cette technique de récolte a été décrit en détail insuffisant dans la littérature pour garantir des résultats uniformes entre les laboratoires effectuant la technique. Cet article est destiné à surmonter cette lacune, en offrant visualisée démonstration de la technique, de chevet collection d’astuces de cathéter jusqu’au produit final des cellules endothéliales purifiées CD146 +. Cette technique devrait aider à faire avancer la recherche dans la pathobiologie de différentes étiologies de PH et risquerait d’aboutir à l’élaboration de nouveaux tests de diagnostics pour compléter les données hémodynamiques recueillies au cours de la RHC.
L’importance de cette technique dans le domaine de la médecine vasculaire pulmonaire et de la recherche est qu’il donne accès à un instantané de la biologie de l’endothélium pulmonaire in situ et contrairement aux études antérieures sur les poumons explantés ou cadavériques, ne représente pas un point de terminaison pour poumon du sujet. Récemment, nous avons montré qu’un biomarqueur anti-apoptotique dans ces cellules peut-être avoir utilité dans plus précisément de phénotypage des variétés de l’hypertension pulmonaire3. Le rendement des cellules obtenues est relativement petit, ~ 5, 000-25 000 PAECs par échantillon et ces cellules sont difficile (mais pas impossible) à la culture. Nous croyons que chercheurs et cliniciens intelligents vont trouver des synergies entre ces techniques compagnon afin de faire progresser la recherche vasculaire pulmonaire, le diagnostic et pronostic.
Protocole
Toutes les études décrites dans cet article ont été approuvées par l’Institutional Review Board de l’Allegheny Health Network. Tous les patients a donné son consentement éclairé avant l’administration d’agents sédatifs et ont été rendus anonymes par étant affecté à un numéro d’étude.
1. chevet Collection
Remarque : Tout dans ce protocole devrait être fait sur la glace, à l’aide de solutions préalablement réfrigérées. Il est important induire une stase froide dans les cellules pour préserver leur phénotype biologique in situ. Ce protocole implique la manipulation de sang et de cellules humains et donc universal precautions doivent etre prises.
- Après retrait du cathéter de la gaine, immédiatement plonger le cathéter dans un tube à centrifuger 50 mL contenant 40 mL de sérum physiologique stérile réfrigéré. Agiter le cathéter plusieurs fois pour enlever le sang et rincer la ligne si nécessaire pour enlever le sang conservé au sein de la ligne.
- Couper les distale 5 cm de la pointe de cath et laisser tomber dans le tube de centrifuger de 50 mL contenant une solution saline réfrigérée. Immédiatement, retirer l’embout de cath avec une pince et transférez-le dans un tube à centrifuger 15 mL contenant 15 mL de milieu de culture de cellules endothéliales (EC).
- Sceller le tube, placez-le sur la glace et transfert au laboratoire de préparer pour le traitement ou d’expédition. Il est essentiel que le ballon reste immergé dans le milieu, alors assurez-vous d’il y a un espace libre minimal en la remplissant complètement avec le milieu de croissance de EC dans le tube de 15 mL.
- Processus de l’échantillon immédiatement en procédant au point 2.1 ou sceau et navire l’échantillon sur la glace humide durant la nuit à la transformation dans un laboratoire qualifié dans le présent protocole. Si les cellules sont en fin de compte va être utilisé pour la culture cellulaire, il est fortement recommander que la pointe de cath immédiatement traitées sur le même site au cours de laquelle ils ont été recueillis.
2. cellule récolte
Remarque : Tout dans ce protocole devrait être fait sur la glace, à l’aide de solutions préalablement réfrigérées. Les cellules sont en stase froid, et il est important d’éviter leur éveil jusqu'à ce qu’ils sont prêts à être fixés ou cultivées. Cet ensemble du protocole doit être effectué dans une hotte à flux laminaire, à l’aide d’instruments stériles, si le but ultime est la culture des PAECs récoltés. Si la culture n’est pas prévue (p. ex., analyse de cytometry d’écoulement), il n’est pas nécessaire d’observer les précautions stériles.
- Ajouter 5 mL de solution de détachement de cellules dans un tube à centrifuger 15 mL ; placer sur la glace.
- 1 mL de médias EC tirer de ce restant dans le tube de prélèvement de chevet dans la seringue de 1 mL.
- Rapidement toutes les étapes 2.3 à 2.5. Saisir l’extrémité coupée de l’extrémité du cathéter avec une pince hémostatique.
- Introduire doucement l’aiguille de la seringue de 1 mL dans le trou « blanc » en face de la fil-guide (« black hole »). Prenez grand soin d’éviter de vous blesser avec l’aiguille.
- Transférer l’astuce cath dans le tube à centrifuger 15 mL contenant la solution de détachement cellulaire.
- Gonfler le ballonnet, en veillant à ne pas faire éclater gonfler le ballonnet avec environ 200 µL des médias fonctionne bien.
- Permettre le cathéter siéger dans une solution de détachement cellulaire sur la glace pendant 5 min avec le ballon gonflé. Si le ballon se dégonfle sur ses propres au cours de l’incubation de 5 min, c’est acceptable.
- Versez le contenu du tube à centrifuger 15 mL dans le plat de 100 mm. Placer le ballon dans la solution de détachement cellulaire « flaque ».
- Gratter le ballon gonflé avec un grattoir de cellules. Le grattoir de cellules peut être dessiné autour du ballon dans un mouvement circulaire ou un mouvement de brossage. Mettre l’accent sur les « pôles » du ballon, où il rencontre le cathéter. Veiller à ce que le grattoir de cellules en contact avec la totalité de la surface du ballon au moins deux fois. Rincez le grattoir de cellules dans la solution de détachement cellulaire « flaque » périodiquement.
- Dégonfler le ballonnet et il gratter avec un mouvement de brossage. Rincez le grattoir de cellules dans la solution de détachement cellulaire « flaque ».
- Jeter le grattoir cath de pointe, des aiguilles et des cellules dans le conteneur à déchets approprié.
- Verser la solution de détachement de cellules contenant la récolte de cellules dans un tube à centrifuger 50 mL. Agiter le tube de prélèvement et versez les médias restants dans le tube de collecte dans l’échantillon prélevé aussi bien.
- Centrifuger l’échantillon à 650 x g à 4 ° C pendant 10 min. Il est important de noter que souvent une pastille ne sera pas vu. Il peut être utile marquer l’emplacement où un pellet serait vu, si elle est visible, pour éviter d’aspirer le culot dans le cas où il est trop petit pour être vu.
Remarque : Normalement, un projectile est vu que lorsque l’échantillon a été contaminé par le sang. Contamination du sang est sans rapport avec le produit ultime récolte parce que le sang ne peut pas lier les perles CD146 et lave par le biais de la colonne. Des tests approfondis a démontré que la marque spécifique de microtubes de 1,5 mL à référencée dans la Table des matières minimise la perte de cellules par rapport à d’autres tubes utilisés lors de l’optimisation de protocole. - Aspirer les médias avec précaution et éviter de déranger ou une aspiration du culot.
3. Purification de cellules
Remarque : Tout dans ce protocole devrait être fait sur la glace, à l’aide de solutions préalablement réfrigérées. Les cellules sont en stase froid, et il est important d’éviter leur éveil jusqu'à ce qu’ils sont prêts à être fixés ou cultivées.
- Resuspendre le culot dans 1 mL de solution de lyse réfrigérés de globules rouges et de le transférer dans un tube de microtubes de 1,5 mL ; doucement la roche pendant 10 min à 4 ° C.
- Centrifuger pendant 5 min à 500 x g et 4 ° C. Aspirer la solution de lyse de RBC.
- Resuspendre le culot dans 60 μl de PBS, 20 μL de bloqueur de FcR et 20 μL de microbilles CD146 anti-humain. Incuber pendant 15 min à 4 ° C.
- Ajouter 1 mL de PBS réfrigérés. Centrifuger pendant 5 min à 500 x g et 4 ° C. Aspirer le surnageant et resuspendre le culot dans 1 mL de PBS réfrigérés.
- Placer une colonne de LS magnétique sur un support magnétique (voir Table des matières pour les identités commerciales spécifiques de ces éléments) à température ambiante. Amorcer la colonne en ajoutant 1 mL de PBS et laisser la totalité du volume de couler à travers. Jeter le cheminement.
- Placer l’échantillon dans la colonne magnétique. Jeter le cheminement.
- Laver à colonne avec 3 mL de PBS réfrigérés trois fois. Jeter le cheminement de chaque lavage.
- Ajouter 3 mL de PBS réfrigérées dans un tube à centrifuger 15 mL. Supprimer la colonne magnétique de l’aimant, versez les 3 mL de PBS depuis le tube à centrifuger 15 mL dans la colonne et placer rapidement la colonne dans le tube à centrifuger pour attraper le cheminement. Plonger immédiatement avec le piston fourni avec colonne. L’échantillon est maintenant purifiée, prête pour fixation/coloration, ou la culture.
Résultats
Ce protocole se traduit par la purification de cellules, de conseils de cathéter de Swan-Ganz après cathétérisme du cœur droit, qui se lient à une colonne de sélection CD146 et ont des profils de diffusion vers l’avant/latérale qui sont impossibles à distinguer de la culture humaines primaire pulmonaire cellules endothéliales de l’artère (Figure 1). Étant donné que le ballonnet de la sonde est en contact physique avec seulement la gaine d’introduction (un matériel acellulaire), la paroi de l’artère pulmonaire, et le sang, données est fourni ici pour démontrer que ces cellules ne sont pas dérivés de sang (Figure 2) , et on présume donc qu’ils sont en effet issus de la paroi de l’artère pulmonaire. Le lecteur notera que les billes magnétiques anti-CD146 qui servent à purifier les cellules restent adhérentes à la surface de la cellule après la procédure et donc il n’est pas optimale pour tenter d’analyser les récoltes de cellule pour CD146 comme marqueur des cellules endothéliales. CD31 ou autres marqueurs endothéliales seraient probablement disponibles pour l’étiquetage et pouvaient être considérés comme des solutions de rechange.
Les éléments clés du présent protocole ont été identifiées qui peuvent affecter les résultats. Tout d’abord, il est important de rincer l’extrémité du cathéter au chevet du patient afin d’éliminer le sang. La figure 3 montre la diffusion latérale (SSC) / profils Forward scatter (FSC) des intermédiaires de la colonne anti-CD146 pour un goûter qui a été rincé correctement et un qui n’était pas. La colonne semble exclure les cellules d’origine sanguine des récoltes (Figure 2), mais l’étape de rinçage assurera une contamination possible minimale de cellules endothéliales circulantes (qui sont normalement présents à < 50 cellules/mL de sang4). Nous avons observé cet éluat de la CD146 colonne est complètement clair, même dans le cas d’échantillons de pointe de cathéter très sanglante. Ceci suggère que la colonne est en mesure de gérer des quantités importantes de sang sans colmatage ou conservant non-CD146 + transmissibles par le sang des cellules.
Deuxièmement, il est important de gonfler la bulle au moins une fois pendant l’étape de racleur de solution/cellule de détachement cellulaire. Étant donné que les PAECs putatifs sur l’info-bulle restent adhérente malgré l’étape du rinçage au sérum physiologique, il semble probable qu’ils peuvent être partiellement piégés par des plis dans la bulle de vinyle comme il est dégonflé en préparation pour l’enlèvement du patient. Vraisemblablement, l’étape de l’inflation libère les PAECs, leur permettant d’être raclée délicatement. Il n’est pas immédiatement clair on pourrait tester cette hypothèse, mais la baisse des rendements des cellules ont été observées lorsque le ballon n’est pas gonflées (données non présentées).
Enfin, il est important de noter que les rendements de PAECs dérivées de cette méthode peuvent varier considérablement. Vraisemblablement, patient-, maladie spécifique état et médecin facteurs contribuent à cette variabilité, car le protocole ne contient-elle pas de mesures qui devraient se traduire par des pertes de matière d’origine. Le tableau 1 montre représentant que cd146 + les rendements d’une variété de récoltes PAEC utilisant les conseils de cathéter provenant d’une variété de patients présentant des États différents de la maladie d’hypertension artérielle pulmonaire et une variété d’opérateurs de médecin.
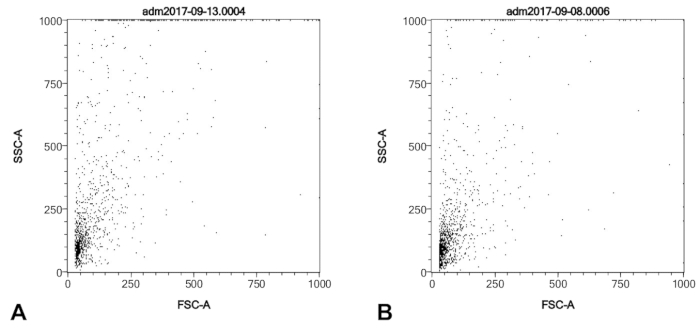
Figure 1 : Profils SSC/FSC d’une récolte de pointe de ballon cathéter typique d’un patient de l’hypertension artérielle pulmonaire (A) et un nombre similaire de cellules d’un PAEC humain primaire commercialement acquis la culture b. Les deux échantillons ont été épurés par la colonne anti-CD146, fixe et permeablized comme décrit dans le protocole, avant l’analyse de FACS. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
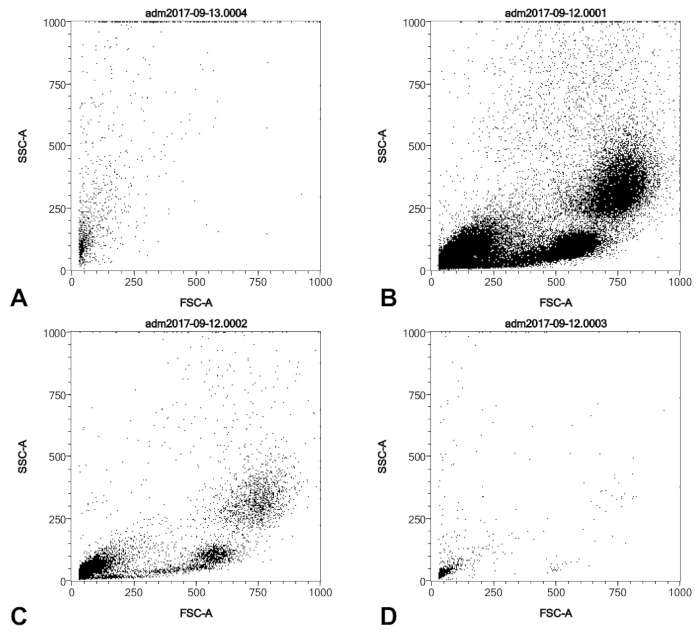
Figure 2 : Profils SSC/FSC d’un ballon sonde typique astuce récolte d’une hypertension pulmonaire patients (A) et série 01:10 dilution de Ficoll purifiés par gradient homme couche leuco-plaquettaire (B, C, D). (A) a été purifiée avec la colonne anti-CD146 alors que (B-D) n’étaient pas. Tous les échantillons de cellules ont été fixés et permeablized comme décrit dans le protocole, avant l’analyse de FACS. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
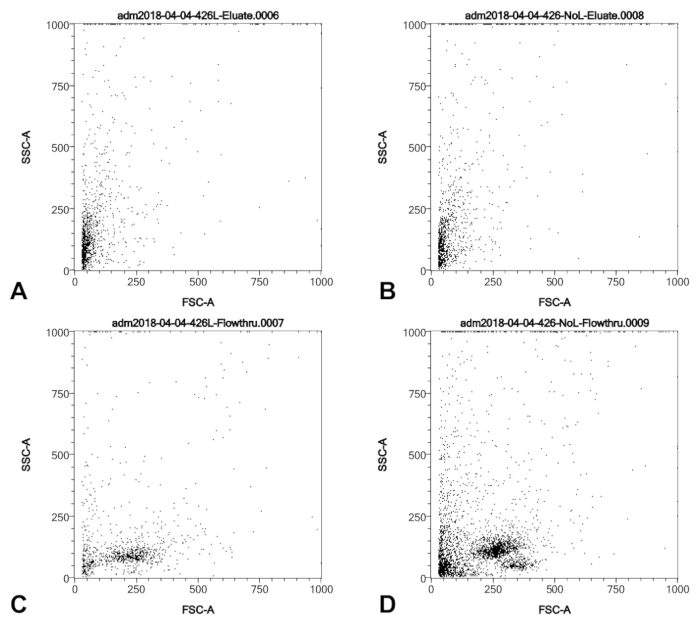
Figure 3 : Profils SSC/FSC d’une récolte de pointe cathéter ballon provenant d’un patient de l’hypertension pulmonaire dans lequel le sang était visible sur l’extrémité du cathéter avant la transformation. Avant l’étape 3.1 du protocole, l’échantillon a été divisé et tampon de lyse a été ajouté à une partie aliquote et retenu sur l’autre. (A) et (C) montrent les profils SSC/FSC de l’échantillon lysé, les deux cellules retenues par la colonne (A) et le cheminement de la colonne. (B) et (D) montrent les profils SSC/FSC de l’échantillon entassée, les deux cellules retenues par la colonne (B) et le cheminement de la colonne (D). Nous concluons que la lyse supprime certains mais pas tous les leucocytes, mais que les leucocytes ne sont pas conservées par la colonne et sont donc exclus de la récolte finale, indépendamment de la lyse. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Échantillon | Date | Rendement des cellules | Diagnostic |
| 433 | 17/04/2018 | 7364 | Pneumopathie interstitielle-PH |
| 279 | 17/04/2018 | 7130 | PH-sclérodermie |
| 432 | 13/04/2018 | 3976 | PH-multifactorielle |
| 431 | 13/04/2018 | 3634 | HFrEF |
| 390 | 13/04/2018 | 5666 | PAH |
| 423 | 23/03/2018 | 9024 | HFrEF |
| 272 | 23/03/2018 | 7098 | HFrEF |
| 408 | 27/02/2018 | 4784 | HFrEF |
| 403 | 14/02/2018 | 10376 | PH-ASD + maladie mitrale |
| 396 | 26/01/2018 | 4890 | HFpEF-IPCPH |
| 397 | 26/01/2018 | 7672 | Hémodynamique normale |
| 318 | 04/01/2018 | 7002 | HFrEF-DAVG présents |
Tableau 1 : CD146 + les rendements d’une variété de récoltes PAEC. Représentant CD146 + rendements d’une variété de récoltes PAEC utilisant les conseils de cathéter provenant d’une variété de patients présentant des États différents de la maladie d’hypertension artérielle pulmonaire et une variété d’opérateurs de médecin.
Discussion
La technique décrite dans cet article s’apprécie dans le cadre du précédents paradigmes expérimentaux pour l’étude de l’endothélium vasculaire pulmonaire. Les tentatives précédentes pour obtenir le PAECs de l’homme ont été limitées aux poumons explantées/cadavériques5 et une éphémère tentative de développer une sonde capable de biopsie de l’artère pulmonaire6. Comme indiqué dans un récent examen7, la technique actuelle se distingue des récolte de tissus pulmonaires par sa capacité à obtenir le PAECs d’une vie humaine et de le faire à plusieurs moments dans la progression de la maladie ou à un traitement. Toutefois, il est à noter qu’une technique de compagnon a récemment signalée auquel cas induit des cellules souches pluripotentes (CISP) peut être transdifférenciation dans PAECs4,5. Cette technique produit des cultures abondantes de PAECs spécifique au patient et permet l’étude des effets du bagage génétique spécifique au patient sur la biologie PAEC. Malgré ces avantages, ces PAECs IPSC dérivée ne peuvent offrir aucune information sur l’interaction entre le microenvironnement local et le bagage génétique spécifique au patient. Notre groupe a présenté l’idée que les « astuce cath » et les techniques de l’IPSC sont susceptibles d’agir en synergie pour faire progresser le champ8.
Dans ce contexte historique et actuel, les limites de cette technique est à noter. Tout d’abord, il est important de noter que les rendements de PAECs dérivées de cette méthode peuvent varier considérablement. Vraisemblablement, patient-, maladie spécifique état et médecin facteurs contribuent à cette variabilité, car le protocole ne contient-elle pas de mesures qui devraient se traduire par des pertes de matière d’origine. Le tableau 1 montre représentant que cd146 + les rendements d’une variété de récoltes PAEC utilisant les conseils de cathéter provenant d’une variété de patients présentant des États différents de la maladie d’hypertension artérielle pulmonaire et une variété d’opérateurs de médecin. Deuxièmement, rendements cellulaires sont globalement faible, et leur viabilité pour la culture s’est avéré plus faible encore dans nos mains. Alors que précédemment, nous avons grandi cultures du PAECs à l’aide de cette méthode1, nous assumer ces résultats représentent sauvetage d’un sous-ensemble de cellules progénitrices suite die-off de la majeure partie de l’échantillon et n’est par intermittence réussies entre nos mains. Par exemple, il n’est pas rare de trouver seulement quelques douzaine adherent PAECs en culture le matin après qu’une récolte a été plaquée. Souvent, ces micro-cultures ne survivent pas à l’expansion. Travaux supplémentaires sont nécessaires afin d’optimiser ce protocole d’une manière qui soutiendront la viabilité du PAECs et leurs conditions de culture pour atteindre l’objectif souhaité de la propagation des récoltes PAEC spécifique au patient. Enfin, la sélection positive CD146 que nous avons adapté ne peut exclure la contamination avec les autres cellules CD146 +, comme la circulation des cellules endothéliales4, les péricytes, les cellules musculaires lisses et les rares CD146 + T cellules9,10. Néanmoins, ces cellules sont censés être très peu nombreux dans les échantillons prélevés de cette manière, et CD146 est considérablement plus spécifique pour ce protocole que les autres marqueurs de cellules des cellules endothéliales par exemple CD31 (qui est également présent sur une variété de véhiculés par le sang cellules y compris plaquettes11). Les améliorations futures vise à améliorer la spécificité doivent être équilibrées contre leurs effets potentiellement négatifs sur le rendement.
Déclarations de divulgation
Le MJP et le RLB sont inventeurs sur brevets revendiquant des portions des méthodes décrites.
Remerciements
Les auteurs tiennent à remercier les médecins et le personnel du service avancé une insuffisance cardiaque et l’Hypertension pulmonaire de l’hôpital général d’Allegheny de soutien pour la fourniture de plusieurs centaines d’échantillons de cathéter sur plusieurs années qui ont facilité la optimisation de cette méthodologie.
matériels
| Name | Company | Catalog Number | Comments |
| 100 mm culture dish | Fisher | NC9385690 | |
| 15 mL Centrifuge Tubes | Midsci | C15R | |
| 16% Formaldehyde | Fisher | PI28908 | |
| 50 mL centrifuge tubes | Midsci | C50R | |
| Accutase | Thermo | A1110501 | cell detachment solution |
| Cell Scraper | Fisher | 08-100-241 | |
| Endothelial Cell Growth media | Cell Applications | 211-500 | |
| Forceps | any | ||
| Hemostat | any | ||
| LoBind microfuge tube | Fisher | 13-698-794 | |
| Miltenyi CD146 beads | Miltenyi | 130-093-596 | |
| Miltenyi FCR blocker | Miltenyi | 130-059-901 | |
| Miltenyi LS columns | Miltenyi | 130-042-401 | |
| Miltenyi magnet | Miltenyi | MidiMACS | |
| Miltenyi RBC lysis buffer | Miltenyi | 130-094-183 | |
| PBS | Fisher | BP2438-4 | |
| Scissors | any | ||
| Syringes | BD | 309597 |
Références
- Galie, N., et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). European Respiratory Journal. 46 (4), 903-975 (2015).
- Pollett, J. B., Benza, R. L., Murali, S., Shields, K. J., Passineau, M. J. Harvest of pulmonary artery endothelial cells from patients undergoing right heart catheterization. Journal of Heart Lung Transplantation. 32 (7), 746-749 (2013).
- Benza, R. L., et al. In situ expression of Bcl-2 in pulmonary artery endothelial cells associates with pulmonary arterial hypertension relative to heart failure with preserved ejection fraction. Pulmonary Circulation. 6 (4), 551-556 (2016).
- Bull, T. M., et al. Circulating endothelial cells in pulmonary hypertension. Thrombosis and Haemostasis. 90 (4), 698-703 (2003).
- Kaneko, F. T., et al. Biochemical reaction products of nitric oxide as quantitative markers of primary pulmonary hypertension. American Journal of Respiratory and Critical Care Medicine. 158 (3), 917-923 (1998).
- Rothman, A., et al. Transvenous procurement of pulmonary artery smooth muscle and endothelial cells using a novel endoarterial biopsy catheter in a canine model. Journal of the American College of Cardiology. 27 (1), 218-224 (1996).
- Savale, L., Guignabert, C., Weatherald, J., Humbert, M. Precision medicine and personalising therapy in pulmonary hypertension: seeing the light from the dawn of a new era. European Respiratory Reviews. 27 (148), (2018).
- Kanwar, M., Raina, A., Passineau, M., Benza, R. Idiopathic Pulmonary Arterial Hypertension: Evolving Therapeutic Strategies. Seminars in Respiratory and Critical Care Medicine. 38 (5), 606-618 (2017).
- Elshal, M. F., Khan, S. S., Takahashi, Y., Solomon, M. A., McCoy, J. P. CD146 (Mel-CAM), an adhesion marker of endothelial cells, is a novel marker of lymphocyte subset activation in normal peripheral blood. Blood. 106 (8), 2923-2924 (2005).
- Elshal, M. F., et al. A unique population of effector memory lymphocytes identified by CD146 having a distinct immunophenotypic and genomic profile. BMC Immunolology. 8, 29 (2007).
- Newman, P. J., et al. PECAM-1 (CD31) cloning and relation to adhesion molecules of the immunoglobulin gene superfamily. Science. 247 (4947), 1219-1222 (1990).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon