Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Simultánea estimulación eléctrica y mecánica para mejorar el potencial de las células cardiomiogenético
En este artículo
Resumen
Aquí presentamos un protocolo para la formación de una población celular mediante estímulos eléctricos y mecánicos, emulando la fisiología cardiaca. Esta estimulación electromecánica realza el potencial cardiomiogenético de las células tratadas y es una estrategia prometedora para la terapia celular más, modelado de la enfermedad y drogas.
Resumen
Las enfermedades cardiovasculares son la principal causa de muerte en los países desarrollados. En consecuencia, la demanda de terapias de la célula cardiaca eficaz ha motivado a los investigadores en los campos de la bioingeniería y la célula de vástago para desarrollar en vitro alta fidelidad humana miocardio para investigación básica y aplicaciones clínicas. Sin embargo, el fenotipo inmaduro de las células cardiacas es una limitación en la obtención de tejidos que imitan funcionalmente el miocardio adulto, que se caracteriza principalmente por señales mecánicas y eléctricas. Así, el propósito del presente Protocolo es preparar y madurar la población de células blanco a través de la estimulación electromecánica, recapitulando los parámetros fisiológicos. Ingeniería del tejido fino cardiaco está evolucionando hacia enfoques más biológicos y estrategias basadas en estímulos biofísicos, por lo tanto, están ganando impulso. El dispositivo desarrollado para este fin es único y permite individual o simultánea estimulación eléctrica y mecánica, cuidadosamente caracterizados y validado. Además, aunque la metodología ha sido optimizada para este estimulador y una población de células específicas, puede fácilmente ser adaptado a otros dispositivos y líneas celulares. Los resultados aquí ofrecen evidencia del compromiso cardiaco aumento de la población de la célula después de la estimulación electromecánica. Electromecánico estimulado las células muestran un aumento de la expresión de marcadores cardíacos principales, incluyendo genes tempranos, estructurales y regulación de calcio. Este condicionamiento de la célula podría ser útil para seguir la terapia celular regenerativa, enfermedad modelado y detección de drogas de alto rendimiento.
Introducción
La función cardíaca se basa en el acoplamiento de la excitación eléctrica y la contracción mecánica. Brevemente, uniones intercelulares cardiomiocitos permitan de propagación de la señal eléctrica para producir contracciones casi síncronas del corazón bombear sangre sistémica y a través del sistema pulmonar. Células cardíacas, por lo tanto, son sometidos a fuerzas eléctricas y mecánicas que regulan la función celular y expresión génica. Por consiguiente, muchos grupos han tratado de desarrollar plataformas de cultura que imitan el entorno fisiológico cardiaco para entender el papel de la estimulación mecánica y eléctrica en el desarrollo cardiaco, la función y maduración. In vitro los estímulos eléctricos y mecánicos individualmente se han aplicado extensamente en la ingeniería de tejido cardíaco para mejorar propiedades funcionales, aumentar la maduración de la célula o mejorar el acoplamiento de la célula y el calcio manejo1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. sin embargo, acondicionado electromecánico sincrónico sigue sin explotar por el desafío de desarrollar un estimulador y un protocolo y por la optimización obligatorio22.
Trabajo preliminar dirigida electromecánica estimulación como una combinación de estimulación eléctrica y perfusión de los medios de comunicación; sin embargo, el flujo no implica la deformación basada en la cepa típica de relleno ventricular23,24,25. Más tarde, enfoques fisiológicos más combinan estímulos eléctricos con deformación física o estiramiento para imitar la isovolumétrica contracción26,27,28,29,30 ,31. Feng et al describieron la primera demostración de estimulación electromecánica en 2005, informes mejorada cardiomiocitos propiedades contráctiles y el26. Wang et al. pretratada en células madre mesenquimales con 5-azacitidina y aplicadas simultánea acondicionado mecánico y eléctrico, mejorar la recelularización, viabilidad celular, diferenciación cardiaca y remodelación27de tejido. Desde las publicaciones, más grupos informaron sobre estimulación electromecánica de monocapas de células o ingeniería de tejidos (e.g., negro28Vunjak-Novakovic29,31y nuestro grupo30) con el primeras células acondicionadas probaron en vivo30. Brevemente, Morgan y negro probaron varias combinaciones de estímulos eléctricos y mecánicos, que el tiempo entre estímulos era crucial porque retrasada estimulación electromecánica combinada produjo mejores resultados28. A continuación, Furnémont Godier y colaboradores optimización un protocolo de estimulación electromecánicos para ingeniería corazón músculo constructores de células de corazón de rata neonatal y alcanzó, por primera vez, una relación positiva fuerza-frecuencia del29. Después, nuestro grupo reportó que células electromecánico previo aumentaron la expresión de marcadores cardiacos principales en vitro y amplio beneficiosa efectos in vivo, tales como mejora la función cardiaca o mayor densidad de vasos en el infarto frontera región30. La publicación más reciente demostró que los tejidos cardiacos de cardiomiocitos derivados de células madre sometida a acondicionado electromecánica alcanzada una maduración nivel más cercano al ser humano adulto cardiaco estructura y función de31. Además, plataformas alternativas de estímulo tridimensional conforman andamios electroactivos que proporcionan electricidad, mecánica, y señales topográficas a las células Unido32. Por otra parte, deformación mecánica (compresión y estiramiento de monocapa de células) también puede ser inducida con electrodos estirables imitando las condiciones fisiológicas normales, así como condiciones extremas33.
Por lo tanto, el fundamento es que en vitro estímulos electromecánicos basados en condiciones fisiológicas podrían aumentar el potencial cardiomiogenético de una célula. De hecho, esta estimulación podría beneficiarse más integraciones de células terapéuticas en el miocardio en un escenario clínico o aumentar la maduración de tejidos para aplicaciones de detección de drogas.
Además, hemos aislado y caracterizado una población de células progenitoras derivadas de tejido adiposo humano de Cardiaco de origen (ATDPCs cardiacas)34. Estas células se encuentran en la grasa epicárdica. Estas células mostrar efectos histopatológicos y funcionales beneficiosos en el tratamiento del infarto de miocardio y también mantienen cardíaca y endotelial diferenciación potencial. 30 , 35. la hipótesis de que estos beneficios aumentarían tras la estimulación Biofísica.
En consecuencia, hemos desarrollado un dispositivo y un régimen de estímulo para la población de la célula de interés e investigó los efectos. Este protocolo electromecánico es una nueva estrategia para inducir la celda activa que se extiende en forma estéril y no invasor en comparación a anteriores publicaciones36, en combinación con el estímulo del campo eléctrico. La técnica que se divulga aquí explica detalladamente el dispositivo y el método utilizado para la estimulación de células eléctrica, mecánica y electromecánica.
Este dispositivo puede proporcionar estimulación eléctrica y mecánica, independientemente o simultáneamente. La estimulación se realiza con un enfoque novedoso no invasivo y aséptico que incluye soporte para celular preesterilizado, electrodos colocados dentro de una placa de cultivo estándar y una plataforma que induce las fuerzas mecánicas y eléctricas (figura 1).
La plataforma puede sostener hasta cultura seis placas y consiste en una estructura sándwich de poly(methyl methacrylate) laser-corte y piezas de placa de circuito impreso. El prototipo de la plataforma se basa en una combinación de un monofásico programable controlado por ordenador estimulador eléctrico, una placa de circuito impreso para la sólida conexión de los electrodos y seis 10 mm x 10 mm x 5 mm niquelado fijo de neodimio imanes cerca de un lado de las placas de cultura. También hay un bar de aluminio con seis imanes de conducción (mismo modelo) situado frente al otro lado de las placas de cultivo y se movió con un servomotor lineal. El motor es accionado por un regulador del motor, funcionado a través de un puerto RS-232 software comercial (véase la Tabla de materiales). A través de la interfaz de usuario y estimulador programable, es posible programar la duración del pulso y frecuencia, la intensidad eléctrica, la frecuencia de estimulación mecánica, su ciclo de trabajo, el número de pulsos, la amplitud de pulso (excursión de imán), y la pendiente.
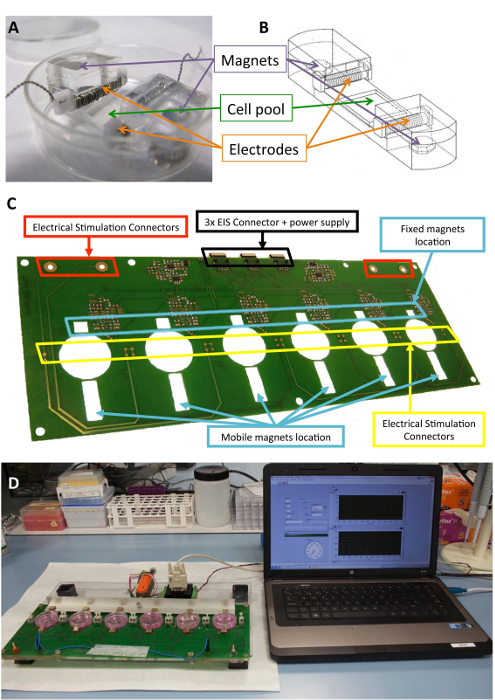
Figura 1 : Estimulador electromecánico. (A) PDMS construcción utilizada para el acondicionamiento de la célula. (B) dibujo de la construcción PDMS, incluyendo electrodos e imanes. (C) detalle del tablero del circuito impreso (plataforma) utilizado para realizar el acondicionamiento electromecánico. Este panel ha sido modificado de Llucià Valldeperas et al.30. (D) cuadro de la estimulación electromecánico plataforma e interfaz de usuario (ordenador). Haga clic aquí para ver una versión más grande de esta figura.
El estimulador y el método para acondicionamiento electromecánico se describen completamente en dos patentes internacionales, WO-2013185818-A137 y38de WO-2017125159-A1.
La silicona biocompatible diseñadas para proporcionar apoyo estructural a las células, electrodos e imanes de construcciones han sido descritos10,21. Brevemente, se componen de polidimetilsiloxano (PDMS), moldeado y curado a temperatura ambiente, con módulo de Young de 1,3 MPa, cerca de los niveles fisiológicos. La construcción contiene una piscina de la cultura de célula en una zona flexible (10 x 10 x 2 mm), dos ranuras transversales interiores para sujetar los electrodos y dos integrado 6 mm x 2 mm x 4 imanes de neodimio mm niquelado. Los electrodos se construyen con 0.2 mm platino alambre trenzado alrededor de un 2 x 3 mm x 12 politetrafluoroetileno mm (PTFE) de la base de la barra (21 cm por electrodo, aproximadamente 23 vueltas) y colocados en lados opuestos de la zona flexible para crear un campo eléctrico para inducir estimulación eléctrica. Estiramiento mecánico se logra a través de la atracción magnética entre imanes incrustados en el apoyo e imanes externos junto a la placa de cultivo y en el brazo de aluminio móviles. De esta manera, el apoyo de la célula puede ser extendido sin romper la barrera estéril. Este enfoque es adecuado para una monocapa de células pero podría adaptarse a construcciones tridimensionales, así.
Además, un patrón regular podría ser impreso donde se siembran las células, utilizando una rejilla de difracción gobernada (1.250 surcos/mm). La visualización directa de las células cultivadas en el constructo PDMS bajo brightfield y microscopios fluorescentes es posible debido a su transparencia y 0,5 mm de espesor. En el caso actual, la piscina de la cultura PDMS tiene un patrón superficial vertical, perpendicular a la fuerza que estira, alinear las células perpendicular al campo eléctrico, que minimiza el gradiente de campo eléctrico a través de la célula.
La figura 1 muestra una descripción detallada de la construcción y el dispositivo utilizado para la estimulación. Construir el PDMS y características optimizadas para el estiramiento (figura 1A, B) de la célula. El estimulador es desarrollado y validado para la aplicación efectiva de la deseada estimulación eléctrica y mecánica a las células a la construcción PDMS. Este proceso incluye asegurar buena conectividad y usuario operabilidad a través de la interfaz de software (figura 1, D).
El procedimiento para la estimulación de la célula utilizando este dispositivo a la medida se describe en la sección de protocolo.
Protocolo
Este estudio usa ATDPCs cardiacas humanas de las muestras del paciente. Su uso ha sido aprobado por el Comité de ética local, y todos los pacientes dieron consentimiento informado. El protocolo de estudio se ajusta a los principios esbozados en la declaración de Helsinki.
1. preparaciones
- Autoclave dos pinzas, 12 electrodos de platino PTFE para estimulación eléctrica y algunas toallas de papel, a 121 ° C por 20 min.
-
Esterilizar 12 construcciones por encargo de PDMS (figura 1A).
- Lave cada construcción con 5 mL de agua estéril, destilada con agitación magnética a temperatura ambiente durante 15 minutos.
- Lavar 1 x con 5 mL de etanol al 70% con agitación magnética a temperatura ambiente durante 5 minutos.
- Lavar 5 veces con 5 mL de agua estéril, destilada con agitación magnética a temperatura ambiente durante 10 min por lavado, para eliminar residuos de alcohol.
- Seco construcciones sobre toallas de papel estéril dentro de la noche gabinete de flujo.
- Almacenar en tubos de centrífuga de 50 mL estériles hasta su uso.
2. siembra (día -1) de la célula
- Antes de la siembra de la célula, transferir las construcciones PDMS limpiadas placas estériles y exponerlos a la luz ultravioleta durante 5 minutos garantizar la esterilización completa.
- Transferir cada constructo a una placa de cultivo celular de 35 mm o placa de 6 pozos, para la siembra inmediata de la célula.
-
Trypsinize un frasco de T75 confluente de ATDPCs cardiacas.
- Lavar el matraz con 5 mL de 1 x de tampón fosfato salino (PBS) de T75.
- Añada 1 mL de tripsina 0,05%-EDTA e incubar a 37 ° C por 5 min separar las células.
- Añadir 5 mL de medio completo para inactivar el tripsina-EDTA.
- Recoge todas las células en un tubo de 15 mL y lavar el matraz x 2 con 5 mL de PBS para recoger las células restantes.
- Centrifugue a 230 x g durante 5 minutos a 22 ° C, eliminar el sobrenadante y resuspender las células en 2 mL de medio completo para contar con la cámara del hemocitómetro.
- 200 μL de ATDPCs cardiacas (2.5 x 105 células/mL) de semillas en la piscina de la célula de las construcciones PDMS 12 (figura 1A, B) que el ~ 80% de la superficie sembrada por células el día después e incubar a 37 ° C y 5% CO2.
Nota: Después de 2 a 4 h, las células deben unirse. Célula el inóculo se preparó según el tamaño de la célula y el crecimiento. Para las células más pequeñas, se debe aumentar la densidad de siembra. - Cuidadosamente añadir 2 mL de medio completo precalentado (α-MEM suplementado con 10% fetal bovino suero 1% L-glutamina y 1% penicilina-estreptomicina) por placa.
- Incubar durante una noche las construcciones en condiciones de cultivo (generalmente 37 º C y 5% CO2).
3. configuración del estímulo electromecánico (día 0)
- Antes de iniciar el procedimiento, tome seis constructos para estimulación electromecánica y seis como controles nonstimulated. Con menos de seis platos por estimulación, uso de construcciones vacías con el mismo volumen de medio para estimulación de campo eléctrico adecuado.
- Limpie la unidad de estimulación con etanol al 70% y colóquelo en el flujo de gabinete.
- Traer los electrodos estériles y pinzas dentro del gabinete de flujo.
- Eliminar el 90% de los medios de comunicación desde la placa de cultivo para manipular fácilmente los electrodos y construcciones. En primer lugar, coloque las construcciones PDMS en la posición correcta para asegurar la atracción magnética (desplazamiento de PDMS en la placa de cultivo hacia el imán) entre los imanes fijos y móviles. A continuación, conecte el alambre de platino para los conectores de electrodo y la pieza PTFE en su espacio designado en el constructo PDMS.
- Añadir 2,5 mL de medio completo precalentado fresco a cada construcción.
Nota: Mantener la esterilidad durante el procedimiento y funciona en una construcción a la vez. Mantener el resto de las construcciones en la incubadora a 37 ° C y 5% de CO2 hasta su uso. - Una vez que todos los constructos PDMS se colocan y eléctricamente conectados a la plataforma, traer la plataforma nuevamente dentro de la incubadora a 37 ° C y 5% CO2.
- Conectar la fuente eléctrica y mecánica.
-
Configurar el programa de estimulación. Especificar regímenes de estimulación eléctrica y mecánica a través de las interfaces de usuario del estimulador eléctrico y la aplicación, que controla la estimulación mecánica. Establecidas en el sincronismo.
- Encender el estimulador eléctrico. Espere el menú principal aparezca en la pantalla.
- A continuación, seleccione opción 2: editar la secuencia + Enter.
- Editar la secuencia menú como sigue.
- Utilice la ficha de modo para seleccionar ya sea voltaje o corriente. Seleccione actual haciendo clic en + y presiona Enter.
- Para la ficha de amplitud , seleccione 1 (mA) con +- y presiona Enter.
- Para el Período (T), seleccione 1000 (ms) con +- y presiona Enter.
- Ajuste la duración del pulso (Tw) a 2 (ms) con +- y presiona Enter.
- Para la ficha de modo de disparo , seleccione externa por software y presiona Enter.
- En el menú principal, seleccione opción 4: generar secuencia y presiona Enter.
Nota: El estimulador eléctrico se basa en el modo de espera hasta recibir un comando de activación de la aplicación de estimulador mecánico a través del puerto serial.
- Realice los pasos siguientes en la sección de estimulación mecánica la aplicación del panel de control (figura 2C).
- Escribir 1.000 (ms) en el control de texto del Periodo del pulso .
- Escribir 500 (ms) en el control de texto de ON time (Tw) para establecer la duración del pulso mecánico.
- Escribir 2.000 (AU) en el control de texto de excursión para entregar un alargamiento del 10% de construcción. Este es el número de pasos del motor de control lineal.
Nota: El protocolo de estimulación aplicado aquí consiste en pulsos de onda cuadrada ms 2 corriente alterna monofásicos de 50 mV/cm a 1 Hz y 10% que se extiende por 7 días. Los tiempos de subida y la caída del pulso mecánico se fijan en 100 ms, más o menos imitar la forma del pulso de presión del hogar. Además, se establece el modo de repetición en continuo y hay un contador mostrando el número de pulsos.
- Encender el estimulador eléctrico. Espere el menú principal aparezca en la pantalla.
- Cambiar los medios de comunicación 2 x por semana (el lunes y el jueves por la tarde). En primer lugar, eliminar los viejos medios de comunicación; a continuación añadir los medios de comunicación cálida en los lados del soporte del PDMS, nunca directamente sobre la piscina de la célula.
Nota: Si las células tienen una alta tasa de crecimiento, los medios de comunicación deben ser cambiado 3 x una semana (por ejemplo, el lunes, el miércoles y el viernes). Es necesario desconectar y volver a conectar todos los cables, pero no hay que quitar las placas y electrodos de su lugar. - Recolectar las muestras después de realiza la experimentación.
4. la muestra recogida al final de la experimentación (día 7)
-
Para el análisis de RNA
- Lave la construcción 2 x con 3 mL de PBS 1 x durante 5 minutos a temperatura ambiente.
- Añadir 3 mL de tripsina 0,05%-EDTA a cada plato (suficiente para cubrir la construcción entera) y espere 5 minutos a 37 ° C.
- Después las células son separadas, agregar 2 mL de medio completo para inactivar el tripsina-EDTA.
- Recoge todas las células en un 15 mL tubo y lavar la construcción 2 x con 3 mL de PBS para recoger las células restantes.
- Centrifugar a 230 x g durante 5 minutos a 22 ° C.
- Quite el sobrenadante y resuspender el precipitado en 1 mL de PBS.
- Transferir la solución de células a un tubo de 1.5 mL y centrifugar a 230 x g durante 5 minutos.
- Quite el sobrenadante y almacenar el pellet a-80 ° C en 700 μl de reactivo de lisis para el aislamiento de RNA más.
- Aislar el RNA usando un kit comercial, siguiendo las instrucciones del fabricante.
- Inversa-transcribir el ARN aislado utilizando el kit y random hexamers, según protocolo del fabricante.
- Para concentraciones pequeñas de RNA, preamplificar y, luego, diluir 1:5 con agua libre de ARNasa antes de realizar la posterior transcripción reversa en tiempo real la reacción en cadena de polimerasa (RT-PCR). Continuar con el protocolo estándar de RT-PCR en tiempo real y comprobar los principales marcadores cardiacos.
Nota: Marcadores cardiacos típicos incluyen marcadores tempranos y tardío de diversas categorías, tales como factores de transcripción cardiaca (2A de factor potenciador específico de miocito [MEF2A], proteína de unión a GATA 4 [GATA-4]) y estructurales (troponina I [cTnI], cardíaca troponina T [reposo], α-actinina) y la regulación del calcio (Connexin43 [Cx43], sarco-/ retículo endoplásmico Ca2 +-ATPasa [SERCA2])30. Aislamiento de la proteína también se puede realizar si es necesario. Aislamiento de ARN y proteína simultánea puede realizarse con la misma muestra, utilizando reactivos comercialmente disponibles y kits (Tabla de materiales) si la cantidad de muestra es menor.
-
Para immunostainings
Nota: Esto se realiza directamente en las células a la piscina de la célula de la construcción PDMS. Por lo tanto, se recomienda colocar, cada vez, 1 cm x 1 cm de la película de parafina en la parte superior de la piscina de la célula, aparte de la placa de la tapa, para minimizar la evaporación de las soluciones de incubación.- Lave la construcción 2 x con 3 mL de PBS durante 5 minutos a temperatura ambiente.
- Fijar las células a la estructura con 2 mL de formalina al 10% durante 15 min a temperatura ambiente.
- Lavar las células 3 x con 3 mL de PBS durante 5 minutos a temperatura ambiente. Para el almacenamiento a largo plazo, dejar las muestras en PBS con azida de sodio 0,1% a 4 ° C.
- Permeabilizar las células con 3 mL de PBS + 0.5% de detergente (3 x, cada vez 5-10 min, a temperatura ambiente).
- Incubar las células con 100 μl de PBS + detergente 0,2% + 10% de suero de caballo, seroalbúmina bovina al 1% a temperatura ambiente durante 1 h, para bloquear la Unión de anticuerpos no específicos.
- Incubar las células con 100 μl de PBS + 10% de suero equino, seroalbúmina bovina al 1% + 0.2% detergente + anticuerpo primario a temperatura ambiente durante 1 h. Por ejemplo, anticuerpos primarios contra la Cx43 (1: 100), espectro α-actinina (1: 100), GATA-4 (1:50), MEF2 (1:25) y SERCA2 (1:50).
- Lavar 3 veces con 3 mL de PBS a temperatura ambiente durante 5 minutos.
- Incubar las células con 100 μl de PBS + anticuerpo secundario a temperatura ambiente en la oscuridad durante 1 hora.
Nota: Usaron un agente counterstaining y anticuerpos secundarios conjugados con diferentes fluoróforos. - Lavar 3 veces con 3 mL de PBS a temperatura ambiente en la oscuridad durante 5 minutos.
- Incubar las células con 100 μl (0,1 μg/mL) de tinción nuclear en PBS a temperatura ambiente en oscuridad durante 15 minutos.
- Lavar 3 veces con 3 mL de PBS a temperatura ambiente en la oscuridad durante 5 minutos.
- Almacenar las muestras en 3 mL de PBS con azida de sodio 0,1% a 4 ° C hasta la adquisición.
Nota: Adquisición de microscopio es posible en microscopios fluorescentes y confocales invertidos con objetivos de trabajo de larga distancia porque el grueso de la construcción es aproximadamente de 0,5 mm.
Resultados
Figura 2 representa el esquema general seguido para la estimulación de la célula. Brevemente, las células fueron sembradas en la construcción PDMS y sometidas a estimulación electromecánica, con un cambio de los medios de comunicación realizado dos veces a la semana. Las células nonstimulated se utilizaron como control para el acondicionamiento electromecánico. Además, hemos añadido un control extra para el experimento, y ATDPCs subcutáneos fueron...
Discusión
Estimulación electromecánica parece ser una alternativa segura para preparar las células para un hostil ambiente cardiaco y aumentar su compromiso cardiaco. Aquí, un protocolo descrito para las células cardiacas progenitoras aumentó la expresión de marcadores cardiacos principal y fue divulgado para ser beneficioso para su próxima implantación en aquejada de un infarto de miocardio murino30. En general, ATDPCs cardiacos electromecánico estimulados aumentaron la expresión de genes relaci...
Divulgaciones
Los autores no tienen nada que revelar, salvo que el dispositivo de estimulación y el protocolo fueron patentados previamente (WO-2013185818-A1, WO-2017125159-A1).
Agradecimientos
Los autores quieren agradecer a los miembros del programa de investigación ICREC (vocal, Badalona) y la electrónica y el grupo de instrumentación biomédica (UPC, Barcelona), especialmente el Prof. J. Rosell-Ferrer. Además, los autores reconocen células Translational Medicine journal y AlphaMed Press para permitir la adaptación de figuras previamente publicados (Llucià-Valldeperas, et al. 30). el desarrollo de este prototipo y el diseño del protocolo fueron apoyados por el Ministerio de Educación y Ciencia (SAF 2008-05144), Ministerio de Economía y Competitividad (SAF 2014-59892), la Comisión Europea (programa marco 7 RECATABI, NMP3-SL-2009-229239), Fundació La Marató de TV3 (080330 201516, 201502) y Fundación para la Innovación y la Prospectiva en Salud en España (FIPSE; 00001396-06-15).
Materiales
| Name | Company | Catalog Number | Comments |
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2x | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
Referencias
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium's electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology--Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados