需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
同时进行机电刺激增强细胞心肌成功能的潜能
摘要
在这里, 我们提出了一个协议, 训练细胞群使用电子和机械刺激模拟心脏生理。这种机电刺激增强了治疗细胞的心肌潜能, 是进一步进行细胞治疗、疾病建模和药物筛选的有希望的策略。
摘要
心血管疾病是发达国家的主要死因。因此, 对有效的心脏细胞疗法的需求促使干细胞和生物工程领域的研究人员在体外开发高保真的人心肌, 用于基础研究和临床应用。然而, 心脏细胞的未成熟表型是获得功能模仿成人心肌的组织的一个限制, 而成年心肌主要以机械和电信号为特征。因此, 该协议的目的是通过机电刺激、重述生理参数来制备和成熟靶细胞群。心脏组织工程正在向更多的生物方法发展, 因此, 基于生物物理刺激的策略正在获得动力。为此目的开发的设备是独特的, 允许单独或同时进行电气和机械刺激, 经过仔细的表征和验证。此外, 尽管该方法已针对这种刺激器和特定的细胞群进行了优化, 但它可以很容易地适应其他设备和细胞系。这里的结果提供了在机电刺激后细胞群心脏承诺增加的证据。运动刺激细胞表现出增加的主要心脏标记表达, 包括早期, 结构, 和钙调节基因。这种细胞调理可用于进一步再生细胞治疗、疾病建模和高通量药物筛选。
引言
心功能是基于电激励和机械收缩的耦合。简单地说, 心肌细胞间的连接允许电信号的传播产生几乎同步收缩的心脏, 泵血系统和通过肺系统。因此, 心脏细胞经历了调节基因表达和细胞功能的电和机械力。因此, 许多团体试图开发模仿心脏生理环境的培养平台, 以了解机械和电刺激对心脏发育、功能和成熟的作用。体外电和机械刺激在心脏组织工程中得到了广泛的应用, 以增强功能特性, 提高细胞成熟, 或改善细胞细胞耦合和钙处理1,2,3 个,4 个,5,6,7.,8,9,10,11,12,13,14,15,16,17,18,19,20,21. 然而, 由于开发刺激器和协议的挑战, 以及由于强制性优化 22, 同步机电调节仍未得到开发22。
初步工作将机电刺激作为电刺激和介质灌注的结合;然而, 流动不涉及应变为基础的变形典型的心室充盈 23,24,25。后来, 更多的生理方法结合电刺激与物理变形或拉伸, 以模仿等体积收缩 26,27,28,29,30 ,31。feng 等人介绍了2005年首次演示机电刺激, 报告心肌细胞大小和收缩特性增强26。wang 等人接受了 5-azacytidine 预处理的间充质干细胞, 并同时进行了电气和机械调理, 改善了再细胞化、细胞活力、心脏分化和组织重塑27。自这些出版物以来, 更多的团体报告了细胞单层或工程组织的机电刺激情况 (例如, black28、vunjak-novakovic29、31和我们的第30组)。第一个被适应的细胞在体内测试 30。简单地说, 摩根和布莱克测试了几种电气和机械刺激的组合, 报告说, 刺激之间的时间是至关重要的, 因为延迟联合机电刺激产生了最好的结果28。接下来, godier-fufurnémont 和合作者从新生大鼠心脏细胞中优化了工程心脏肌肉结构的机电刺激协议, 并首次实现了正力频率关系29。随后, 我们的研究小组报告说, 机电预处理细胞在体外增加了主要心脏标记物的表达, 并在体内产生了广泛的有益作用, 如心脏功能的改善或梗死血管密度的增加边境地区30。最近的出版物表明, 干细胞衍生心肌细胞的心脏组织在机电条件下达到了接近成人成人心脏结构和功能31的成熟水平.此外, 替代的三维刺激平台包括电活性支架, 为所附单元提供电气、机械和地形提示 32.此外, 机械变形 (细胞单层拉伸和压缩) 也可以通过模仿正常生理条件以及极端条件33的可拉伸电极引起。
因此, 其基本原理是, 基于生理条件的体外机电刺激可以增强细胞的心肌潜能。事实上, 这种刺激可以有利于进一步整合治疗细胞到心肌在临床情况下, 或增加组织成熟的药物筛选应用。
此外, 我们分离并鉴定了人类脂肪组织源性心脏祖细胞 (心脏 atdpc)34。这些细胞位于心外膜脂肪中。这些细胞在心肌梗死治疗中表现出有益的组织病理学和功能作用, 同时也保持心脏和内皮分化的潜力。30,35. 我们假设, 在生物物理刺激之后, 这些好处会增加。
因此, 我们为感兴趣的细胞群开发了一种装置和刺激机制, 并对其影响进行了调查。与以前的出版物36相比, 这种机电协议是以无菌和非侵入性的方式诱导主动细胞拉伸的新策略。这里报道的技术详细说明了用于细胞的电气、机械和机电刺激的装置和方法。
该装置可以独立或同时提供电和机械刺激。刺激是用一种非侵入性和无菌的新方法进行的, 该方法包括预灭菌的细胞支架、放置在标准培养板内的电极以及诱导机械和电力的平台 (图 1)。
该平台最多可容纳六个培养板, 由激光切割聚 (甲基丙烯酸甲酯) 和印刷电路板件组成。该平台原型依靠的组合单相可编程计算机控制的电刺激器, 印刷电路板的强大连接的电极, 和 6 10 毫米 x 10 毫米镍镀镍固定的磁铁放置附近的一面的培养板。也有一个铝棒与六个驱动磁铁 (同一模型) 放置在前面的另一侧的培养板, 并移动与线性伺服马达。电机由电机控制器驱动, 通过 rs-232 端口由商业软件操作 (见材料表)。通过用户界面和可编程刺激器, 可以对电强度、脉冲持续时间和频率、机械刺激频率、占空比、脉冲数、脉冲振幅 (磁体偏移) 进行编程,和斜坡。
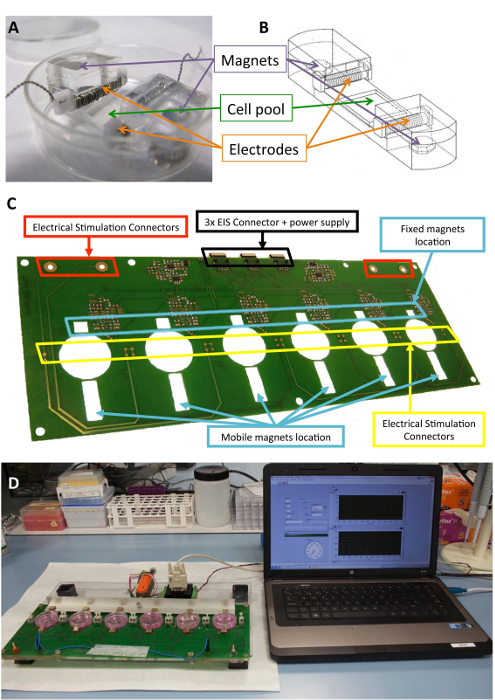
图 1: 机电刺激器.(a) 用于细胞调理的 pdms 构造。(b) 绘制 pdms 结构, 包括电极和磁铁。(c) 用于执行机电调理的印刷电路板 (平台) 的详细情况。该面板已从 llucia-valdeperas 等人30 人处进行了改装。(d) 机电刺激平台和用户界面 (计算机) 的图片。请点击这里查看此图的较大版本.
在两项国际专利中都充分介绍了刺激装置和机电调理方法, 即 wo-2013185818-a137和 wo-201725159-a138。
生物兼容型有机硅结构旨在为电池、电极和磁体提供结构支持, 此前已有 10、21 种。简单地说, 它们由聚二甲基硅氧烷 (pdms) 组成, 在室温下成型和固化, 杨氏模量为 1.3 mpa, 接近生理水平。该结构包含一个灵活区域 (10 毫米 x 10 毫米 x 2 毫米) 中的细胞培养池、两个固定电极的内部横向插槽和两个嵌入的6毫米 x2 毫米 x4 mm 镀镍的磁铁。电极是由0.2 毫米铂线扭曲周围的2毫米 x 3 毫米 x 12 毫米聚四氟乙烯 (ptfe) 核心酒吧 (21 厘米每个电极, 约23转), 并放置在对面的灵活区域, 以创建一个电场诱导电刺激。机械拉伸是通过在支撑中嵌入的磁体和放置在培养板旁边的外部磁体之间以及在移动的铝臂上的磁吸引来实现的。这样, 细胞支持可以在不打破无菌屏障的情况下扩展。这种方法适用于细胞单层, 但也可以适应三维结构。
此外, 使用规则衍射光栅 (1, 250 声), 可以在细胞播种的地方印上规则图案。由于其透明度和 0.5 mm 的厚度, 在明亮场和荧光显微镜下的 pdms 结构下培养的细胞是可能的直接可视化。在目前的情况下, pdms 培养池具有垂直的表面图案, 垂直于拉伸力, 以将细胞垂直地与电场对齐, 从而最大限度地减少整个细胞的电场梯度。
图 1显示了用于刺激的构造和设备的详细说明。pdms 结构和特性针对细胞拉伸进行了优化 (图 1a. b)。该刺激器的开发和验证是为了有效地应用所需的电和机械刺激的细胞连接到 pdms 结构。此过程包括通过软件界面确保良好的连接性和用户可操作性 (图 1C,D)。
协议部分介绍了使用此定制设备进行细胞刺激的过程。
研究方案
本研究使用患者样本中的人心脏 atdpc。它们的使用已得到当地道德委员会的批准, 所有患者都给予了知情同意。研究议定书符合《赫尔辛基宣言》概述的原则。
1. 准备工作
- 高压灭菌器两个推子, 12个用于电刺激的铂金 ptfe 电极, 以及一些纸巾, 在121°c 下20分钟。
-
消毒 12个 pdms 自定义构造 (图 1a)。
- 用5毫升的无菌蒸馏水在室温下用磁性搅拌清洗每件材料15分钟。
- 用5毫升的70% 乙醇在室温下用磁搅拌清洗 1x 5分钟。
- 用5毫升无菌蒸馏水在室温下搅拌10分钟每次清洗清洗 5倍, 以去除酒精残留物。
- 在流动柜内的无菌纸巾上擦干结构一夜。
- 将它们存放在无菌的50毫升离心管中, 直至使用。
2. 细胞播种 (第1天)
- 在细胞播种之前, 将清洁后的 pdms 结构转移到无菌板, 并将其暴露在紫外线下 5分钟, 以确保完全灭菌。
- 将每个构造转移到一个35毫米的细胞培养板, 或6孔板, 立即进行细胞播种。
-
胰蛋白酶--心脏 atdpc 的融合 t75 瓶。
- 用1毫升磷酸盐缓冲盐水 (pbs) 清洗 t75 烧瓶。
- 加入1毫升0.05% 的胰蛋白酶 edta, 在37°c 孵育 5分钟, 分离细胞。
- 添加5毫升的完整介质, 以灭活胰蛋白酶 edta。
- 收集15毫升管中的所有细胞, 用5毫升的 pbs 清洗烧瓶 2x, 收集任何剩余的细胞。
- 在22°c 下, 以 230 x g离心 5分钟, 取出上清液, 并将细胞重新悬浮在完整介质的2毫升中, 用血细胞仪室计数。
- 种子200μl 的心脏 atdpc (2.5 x10 5细胞/ml) 到细胞池的 12个 pdms 结构 (图 1a, b) 有 ~ 80% 的种子表面覆盖的细胞后一天, 并在37°c 和 5% co 2 孵育.
请注意:2-4小时后, 应连接细胞。细胞接种是根据细胞的大小和生长情况制备的。对于较小的细胞, 应增加播种密度。 - 每片轻轻加入2毫升的预热培养基 (α-mL, 补充10% 的胎牛血清、1% 的 l-谷氨酰胺和1% 的青霉素链霉素)。
- 在培养条件下 (通常为37°c 和 5% co2) 隔夜孵化结构。
3. 机电刺激设置 (第0天)
- 在开始这个过程之前, 采取六个结构的机电刺激和六个作为非受刺激的控制。每次刺激少于六个板块, 使用具有相同介质体积的空结构, 以确保适当的电场刺激。
- 用70% 乙醇清洗刺激装置, 并将其放置在流动柜中。
- 将无菌电极和推子放入流柜内。
- 从培养板中取出90% 的介质, 以轻松操作电极和结构。首先, 将 pdms 构造放置在正确的位置, 以确保固定磁体和移动磁体之间的磁吸引 (培养板内的 pdms 位移)。接下来, 将铂金丝连接到 pdms 结构中指定空间中的电极连接器和 ptfe 部件。
- 在每个结构中加入2.5 毫升新鲜预热的完整介质。
请注意:在整个过程中保持无菌状态, 并一次在一个构造上操作。将其余结构保存在孵化器中的37°c 和 5% co 2 中, 直至使用 。 - 一旦所有 pdms 结构都被放置并电连接到平台, 将平台带回37°c 和 5% co 2 的孵化器.
- 连接电气和机械源。
-
配置刺激程序。通过电刺激器的用户界面和控制机械刺激的应用程序, 指定电气和机械刺激机制。设置同步, 如下所示。
- 打开电刺激器。等待主菜单显示在显示屏中。
- 然后, 选择选项 2: 编辑序列 + 输入。
- 编辑序列菜单, 如下所示。
- 使用"模式" 选项卡选择电压或电流。通过单击"+"选择 "当前", 然后按enter.
- 对于 "振幅" 选项卡, 选择带+/的1 (ma) , 然后按enter。
- 对于"期间 (t)", 选择 " 1000 (ms) " + /- ", 然后按enter。
- 用+/将脉冲持续时间 (tw)设置为 2 (ms) , 然后按enter。
- 对于 "触发模式" 选项卡, 选择 "软件外部" , 然后按enter。
- 返回主菜单, 选择选项 4: 生成序列,然后按enter。
注: 电气刺激器处于待机状态, 直到通过串行端口从机械刺激器应用程序收到触发命令。
- 在控制应用程序面板的机械刺激部分执行以下步骤 (图 2c)。
- 在脉冲周期文本控件中写入 1, 000 (ms)。
- 在on time (tw)文本控件中写入 500 (ms), 以设置机械脉冲持续时间。
- 在"游览" 文本控件中写入 2, 000 (au), 以提供10% 的构造伸长率。这是直线控制电机中的步数。
注: 这里应用的刺激协议包括交流电流2毫秒单相方波脉冲 50 mvcm 在1赫兹和10% 拉伸7天。机械脉冲的上升和下降时间设置为100毫秒, 以大致模拟炉膛压力脉冲的形状。此外, 重复模式设置为"连续", 并有一个计数器显示脉冲数。
- 打开电刺激器。等待主菜单显示在显示屏中。
- 每周更换2倍媒体 (周一和周四下午)。首先, 删除旧媒体;接下来, 在 pdms 支持的两侧添加温暖的媒体, 绝不直接在单元格池上。
请注意:如果细胞的生长速度很高, 则媒体应每周更换 3倍 (例如, 星期一、星期三和星期五)。有必要断开并重新连接所有电缆, 但没有必要将培养板和电极从它们的位置移开。 - 在进行实验后收集样品。
4. 实验结束时的样本收集 (第7天)
-
用于 rna 分析
- 用 1x pbs 的3毫升清洗结构 2x 5分钟, 在室温下。
- 在每个板材中加入3毫升0.05% 的色氨酸 edta (足以覆盖整个结构), 在37°c 下等待5分钟。
- 分离细胞后, 添加2毫升的完整培养基, 以灭活胰蛋白酶 edta。
- 收集15毫升管中的所有细胞, 用3毫升的 pbs 清洗结构 2x, 以收集任何剩余的细胞。
- 在220°c 下, 以 230 x g离心5分钟。
- 取出上清液, 重新悬浮 pbs 1 毫升中的颗粒。
- 将电池溶液以 230 x g 的速度转移到 1.5 ml 管和离心机上5分钟。
- 取出上清液, 将颗粒储存在-80°c 的700μl 裂解试剂中, 以便进一步分离 rna。
- 按照制造商的说明, 使用商业试剂盒隔离 rna。
- 根据制造商的协议, 使用试剂盒和随机六分体反向转录分离的 rna。
- 对于小 rna 浓度, 在进行随后的实时逆转录聚合酶链反应 (rt-pcr) 之前, 用无 rnase 的水进行预扩, 然后用 1: 5 稀释。继续使用实时 rt-pcr 的标准协议, 并检查主要心脏标记。
注: 典型的心脏标记包括来自不同类别的早期和晚期标记, 如心脏转录因子 (亚粒特定增强因子 2 a [mef2a]、gat 结合蛋白 4 [gaca-4]) 和结构 (心肌肌钙蛋白 i [ctni], 心脏肌钙蛋白 t [ctnt]、α-放香素) 和钙调节 (Connexin43 [cx43], sarco/内质网 ca2 +-atpase [serca2])30。如有需要, 也可以进行蛋白质隔离。如果样品数量较少, 可以使用市售试剂和试剂盒 (材料表), 使用同一样品同时进行 rna 和蛋白质分离。
-
用于免疫染色
请注意:这直接在连接到 pdms 构造的单元格池的单元格上执行。因此, 我们建议每次将1厘米 x 1 厘米的石蜡膜放置在细胞池顶部, 除了板盖, 以最大限度地减少孵育溶液的蒸发。- 用3毫升的 pbs 清洗结构 2x 5分钟, 在室温下。
- 将连接在结构上的细胞与2毫升的10% 福尔拉林固定 15分钟, 在室温下。
- 用3毫升的 pbs 清洗细胞 3x 5分钟, 在室温下。对于长期储存, 请在4°c 下, 用0.1% 的氮化钠将样品留在 pbs 中。
- 用3毫升的 pbs + 0.5% 的洗涤剂对细胞进行渗透 (3倍, 每次 5–10分钟, 室温下)。
- 在室温下将100μl 的 pbs + 10% 马血清 + 0.2% 洗涤剂 + 1% 牛血清白蛋白培养 1小时, 阻断非特异性抗体结合。
- 在室温下用100μl 的 pbs + 10% 马血清 + 0.2% 洗涤剂 + 1% 的牛血清白蛋白 + 初级抗体对细胞进行1年的培养。例如, 针对 cx43 (1:100)、肉瘤α-放线素 (1:100)、gata-4 (1:100)、mef2 (1:100) 和 serca2 (1:100) 的主要抗体。
- 用3毫升的 pbs 在室温下清洗 3x 5分钟。
- 在室温下, 在黑暗中将细胞在 100μl pbs + 二级抗体中培养1小时。
请注意:采用不同荧光剂和对染剂结合的二级抗体。 - 在室温下在室温下清洗 3x 3 毫升的 pbs 5分钟。
- 在室温下在黑暗中将细胞在 pbs 中进行 100μl (0.1μg/ml) 的培养, 时间为15分钟。
- 在室温下在室温下清洗 3x 3 毫升的 pbs 5分钟。
- 将样品储存在3毫升的 pbs 中, 在4°c 下使用0.1% 的氮化钠, 直至采集。
请注意:由于结构厚度约为 0.5 mm, 因此可以在具有长工作距离目标的倒置荧光和共聚焦显微镜上进行显微镜采集。
结果
图 2表示单元刺激所遵循的一般架构。简单地说, 细胞播种在 pdms 结构上, 并接受机电刺激, 每周进行两次介质改变。非受激细胞被用作机电调理的控制。此外, 我们在实验中添加了额外的控制, 并使用皮下 atdpc 作为心脏 atdpc 的对照。皮下 atdpc 是通过皮下脂肪组织获得的, 经过与心脏 atdpc33相同的隔离和培养过程。连接到 pdms 结构的细...
讨论
机电刺激似乎是一个安全的选择, 准备细胞的敌对心脏环境, 并提高他们的心脏承诺。在这里, 描述的心脏祖细胞的协议增加了主要心脏标记的表达, 并被报道是有益的, 他们的下一个植入梗死小鼠心肌 30.一般来说, 机电刺激的心脏 atdpc 增加了与早期、结构和钙调节相关的基因表达, 而这在以前的电气或机械刺激中从未单独实现过。事实上, 机电刺激的心脏 atdpc 显示出一个更完整的...
披露声明
提交人没有什么可透露的, 只是刺激装置和协议以前获得了专利 (wo-201201185818-a1, wo-201711259-a1)。
致谢
作者要感谢 icrec 研究项目 (igtp, badalona) 和电子和生物医学仪器仪表组 (upc, 巴塞罗那) 的成员, 特别是 j. rocel-ferrer 教授。此外, 作者还承认 stem cels 转化医学杂志和 alphamed 出版社允许改编以前发表的数字 (llucia-valldeperas 等).30). 这一原型的开发和议定书的设计得到了欧洲联盟委员会第7个框架方案 (saf 2014-59892)、经济和竞争事务部 (saf----第7个框架方案) 的支持。Marató, nmp3-sl-2009-29239)、fundacióla maratóde tv3 (080330, 201516, 201516) 和 fundación para la Prospectiva y la prospectivión en salud en españa (fipse; 06-00001396-15)。
材料
| Name | Company | Catalog Number | Comments |
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2x | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
参考文献
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium's electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology--Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。