Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Stimulation électrique et mécanique simultanée pour promouvoir le potentiel de cellules Cardiomyogénique
Dans cet article
Résumé
Nous présentons ici un protocole pour la formation d’une population de cellules à l’aide de stimuli électriques et mécaniques, émulant la physiologie cardiaque. Cette stimulation électromécanique améliore le potentiel de cardiomyogénique des cellules traitées et est une stratégie prometteuse pour autre thérapie cellulaire, modélisation de la maladie et dépistage des drogues.
Résumé
Les maladies cardiovasculaires sont la principale cause de décès dans les pays développés. Par conséquent, la demande pour des thérapies efficaces cellule cardiaque a motivé des chercheurs dans les domaines de la bio-ingénierie et de cellules souches pour développer en vitro haute-fidélité humaine myocarde pour la recherche fondamentale et les applications cliniques. Cependant, le phénotype immature des cellules cardiaques est une limitation sur l’obtention de tissus qui imitent fonctionnellement le myocarde adult, qui se caractérise principalement par des signaux mécaniques et électriques. Ainsi, le but du présent protocole est de préparer et de maturité de la population de cellules cibles par le biais de la stimulation électromécanique, récapitulant les paramètres physiologiques. Génie tissulaire cardiaque évolue vers des approches plus biologiques, et des stratégies fondées sur des stimuli biophysiques, ainsi, sont accélèrent. Le dispositif mis au point à cet effet est unique et permet individuelle ou simultanée électrique et mécanique stimulation, soigneusement caractérisés et validées. En outre, bien que la méthodologie a été optimisée pour ce stimulateur et une population de cellules spécifiques, il peut être facilement adaptée à d’autres dispositifs et les lignées cellulaires. Les résultats présentés ici offrent la preuve de l’engagement cardiaque accrue de la population cellulaire après stimulation électromécanique. Cellules stimulées électro-mécaniquement montrent une augmentation de l’expression des principaux marqueurs cardiaques, y compris des gènes précoces, structurales et régulatrices du calcium. Ce conditionnement cellulaire pourrait être utile pour encore la thérapie régénératrice cellulaire, modélisation de la maladie et dépistage des drogues de haut débit.
Introduction
La fonction cardiaque est basée sur le couplage de l’excitation électrique et mécanique contraction. Brièvement, jonctions intercellulaires cardiomyocyte permettent de propagation du signal électrique pour produire des contractions presque synchrones du coeur qui pompe le sang systémique et à travers le système pulmonaire. Les cellules cardiaques, subissent ainsi, électriques et mécaniques des forces qui régissent la fonction cellulaire et de l’expression du gène. En conséquence, plusieurs groupes ont tenté de développer des plates-formes de culture qui imitent l’environnement physiologique cardiaque pour comprendre le rôle de stimulation mécanique et électrique sur le développement cardiaque, fonction et la maturation. In vitro les stimulations électriques et mécaniques individuellement ont été appliquées largement dans l’ingénierie du tissu cardiaque pour améliorer les propriétés fonctionnelles, augmenter la maturation cellulaire ou améliorer le couplage cellule-cellule et calcium manipulation1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. Néanmoins, climatisation electromecanique synchrone reste inexploitée en raison du défi de mettre au point un protocole et un stimulateur et l' optimisation obligatoire22.
Les travaux préliminaires adressées stimulation électromécanique comme une combinaison de la stimulation électrique et de la perfusion de médias ; Toutefois, le flux n’implique pas la déformation axée sur la souche typique du remplissage ventriculaire23,24,25. Plus tard, les approches physiologiques plus combinée des stimuli électriques avec déformation physique ou d’étirement pour imiter les isovolumétriques contraction26,27,28,29,30 ,,31. Feng Al décrit la première démonstration de stimulation électromécanique en 2005, rapports améliorés cardiomyocyte les propriétés size et contractiles26. Wang Al prétraitées avec des cellules souches mésenchymateuses avec la 5-azacytidine et appliqué simultanée climatisation électrique et mécanique, amélioration de la recellularization, la viabilité cellulaire, différenciation cardiaque et tissu transformant le27. Depuis ces publications, plusieurs groupes ont rapporté sur la stimulation électromécanique de monocouches de cellules ou ingénierie des tissus (p. ex., noir28, Vunjak-Novakovic29,31et notre groupe30) avec la premières cellules climatisées testé in vivo30. En bref, Morgan et noir testé plusieurs combinaisons de stimuli électriques et mécaniques, déclaration que le moment entre les stimulations était crucial car retardée combinée stimulation électromécanique ont donné les meilleurs résultats28. Ensuite, Godier-Furnémont et collaborateurs optimisé un protocole de stimulation électromécaniques pour constructions muscle cœur machiné de cellules cardiaques de rat néonatal et atteint, pour la première fois, une de relation positive force-fréquence29. Par la suite, notre groupe a indiqué qu’électro-mécaniquement préconditionnés cellules augmenté l’expression de marqueurs cardiaques principal in vitro et large bénéfique effets in vivo, tels qu’améliore la fonction cardiaque ou augmente la densité des navires dans l’infarctus frontière région30. La publication la plus récente a démontré que les tissus cardiaques de cardiomyocytes dérivés tige-cellule soumis à atteint une maturation niveau plus proche de l’humain adulte cardiaque structure et la fonction31aux électromécaniques. En outre, les plates-formes alternatives de stimulation en trois dimensions représentent électroactifs échafaudages qui fournissent l’électricité, mécanique et repères topographiques aux cellules attaché32. En outre, déformation mécanique (cellulaire monocouche qui s’étend et compression) peut également être induite avec électrodes extensibles imitant les conditions physiologiques normales, ainsi que des conditions extrêmes,33.
Par conséquent, le raisonnement est que des stimuli électromécaniques in vitro selon les conditions physiologiques pourraient renforcer le potentiel de cardiomyogénique d’une cellule. En effet, cette stimulation pourrait une prestation plus intégrations de cellules thérapeutiques dans le myocarde dans un scénario clinique ou la maturation des tissus pour des applications de dépistage des drogues.
En outre, nous avons isolé et caractérisé une population de cellules progénitrices de dérivées du tissu adipeux humain de cardiaque d’origine (ATDPCs cardiaques)34. Ces cellules sont situées dans la graisse épicardique. Ces cellules affichent des effets histopathologiques et fonctionnels bénéfiques dans le traitement de l’infarctus du myocarde et aussi maintient la différenciation cardiaque et endothéliale potentiel. 30 , 35. nous avons supposé que ces bénéfices augmenteraient après stimulation biophysique.
Par conséquent, nous avons mis au point un dispositif et un régime de stimulation pour la population de cellules d’intérêt et ont étudié les effets. Ce protocole électromécanique est une nouvelle stratégie pour induire la cellule active, qui s’étend de façon stérile et non invasive par rapport aux précédentes publications36, en combinaison avec une stimulation de champ électrique. La technique rapportée ici explique en détail l’appareil et la méthode utilisée pour la stimulation électrique, mécanique et électromécanique des cellules.
Cet appareil peut fournir la stimulation électrique et mécanique, indépendamment ou simultanément. La stimulation est effectuée avec une nouvelle approche non invasive et aseptique qui inclut le support de cellule pré-stérilisé, électrodes placées à l’intérieur d’une plaque de culture standard et une plate-forme qui induit les forces mécaniques et électriques (Figure 1).
La plate-forme peut contenir jusqu'à six culture plaques et se compose d’une structure "sandwich" de poly(methyl methacrylate) découpé au laser et des morceaux de carte de circuit imprimé. Le prototype de plate-forme repose sur une combinaison d’une monophasique programmable commandé par ordinateur stimulateur électrique, une carte de circuit imprimé pour la connexion robuste des électrodes et six 10 x 10 mm x 5 mm nickelé-correction de néodyme aimants placés près d’un côté des plaques de culture. Il y a également une barre en aluminium avec six aimants conduites (même modèle) placé en face de l’autre côté des plaques de culture et s’installe avec un servomoteur linéaire. Le moteur est entraîné par un contrôleur de moteur, opéré via un port RS-232 par des logiciels commerciaux (voir la Table des matières). Par le biais de l’interface utilisateur et stimulateur programmable, il est possible de programmer l’intensité électrique, la durée de l’impulsion et de fréquence, la fréquence de stimulation mécanique, son rapport cyclique, le nombre d’impulsions, l’amplitude de l’impulsion (excursion aimant), et la pente.
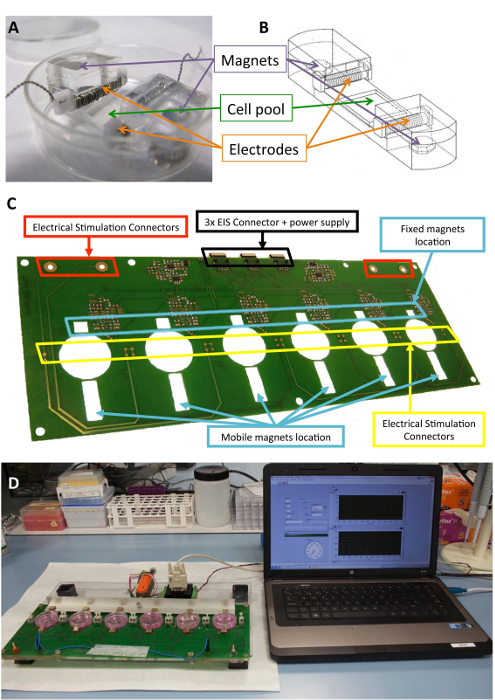
Figure 1 : Stimulateur électromécanique. (A), PDMS construction utilisée pour le conditionnement de la cellule. Dessin (B) de la construction PDMS, y compris les électrodes et les aimants. (C) détail de la platine (plate-forme) utilisée pour effectuer le conditionnement électromécanique. Ce panneau a été modifié par Llucià-Valldeperas Al30. (D) photo de la stimulation électromécaniques plate-forme et interface utilisateur (ordinateur). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Tant le stimulateur et le mode de conditionnement électromécanique sont décrites en détail dans deux brevets internationaux, WO-2013185818-A137 et38de la WO-2017125159-A1.
Le silicone biocompatible constructions conçues pour apporter un soutien structurel aux cellules, électrodes et aimants ont été décrits précédemment10,21. En bref, ils se composent de polydiméthylsiloxane (PDMS), moulé et durci à la température ambiante, avec un module d’Young de 1,3 MPa, proches des niveaux physiologiques. La construction contient un bassin de culture cellulaire dans une zone flexible (10 x 10 x 2 mm), deux fentes transversales intérieures pour tenir les électrodes et deux intégré 6 x 2 mm x 4 mm nickelé néodyme. Les électrodes sont construits avec 0,2 mm platine fil torsadé autour d’une 2 x 3 mm x 12 le polytétrafluoroéthylène (PTFE) de mm base bar (21 cm par électrode, environ 23 tours) et mis à part et d’autre de la zone flexible pour créer un champ électrique pour induire stimulation électrique. Étirement mécanique est obtenue par une attraction magnétique entre les aimants intégrés dans le support et aimants externes placés à côté de la plaque de culture et sur le bras en aluminium mobile. De cette façon, le soutien de la cellule peut être étendu sans casser la barrière stérile. Cette approche convient à une monocouche de cellules, mais pourrait être adaptée pour des constructions en trois dimensions, aussi bien.
En outre, un modèle régulier pourrait être imprimé où les cellules sont ensemencées, à l’aide d’un réseau de diffraction gouverné (1 250 rainures/mm). La visualisation directe des cellules cultivées sur la construction PDMS sous fond clair et microscopes fluorescents est possible en raison de sa transparence et son épaisseur 0,5 mm. En l’espèce, la piscine de la culture PDMS a un motif de surface vertical, perpendiculaire à la force d’étirement, d’aligner les cellules perpendiculairement au champ électrique, ce qui minimise le gradient de champ électrique dans l’ensemble de la cellule.
La figure 1 montre une description détaillée de la construction et le dispositif utilisé pour la stimulation. Construire les PDMS et caractéristiques sont optimisés pour une cellule qui s’étend (Figure 1 a, B). Le stimulateur est développé et validé pour l’application effective de la stimulation électrique et mécanique souhaitée aux cellules attaché à la construction PDMS. Ce processus vise à assurer le bon fonctionnement connectivité et utilisateur par le biais de l’interface du logiciel (Figure 1, D).
La procédure pour la stimulation des cellules à l’aide de ce dispositif sur mesure est décrite dans la section protocole.
Protocole
Cette étude utilise une ATDPCs cardiaque humaine d’échantillons de patients. Leur utilisation a été approuvée par le Comité d’éthique local et tous les patients ont donné un consentement éclairé. Le protocole de l’étude est conforme aux principes énoncés dans la déclaration d’Helsinki.
1. les préparatifs
- Autoclave deux pincettes, 12 électrodes de platine PTFE pour la stimulation électrique et quelques serviettes en papier, à 121 ° C pendant 20 min.
-
Stériliser des constructions sur mesure de PDMS 12 (Figure 1A).
- Lavez chaque construction avec 5 mL d’eau distillée stérile avec agitation magnétique à température ambiante pendant 15 min.
- Laver 1 fois avec 5 mL d’éthanol à 70 % avec agitation magnétique à température ambiante pendant 5 min.
- Laver 5 x 5 ml d’eau distillée stérile avec agitation magnétique à température ambiante pendant 10 min / cycle de lavage, pour éliminer les résidus alcooliques.
- Sécher les constructions sur des essuie-tout stérile à l’intérieur de la nuit armoire de flux.
- Rangez-les dans des tubes à centrifuger stérile de 50 mL jusqu'à l’utilisation.
2. cellule ensemencement (jour -1)
- Avant cellule ensemencement, transférer les constructions PDMS nettoyées à plaques stériles et les exposer aux rayons ultraviolets pendant 5 min afin d’assurer une stérilisation complète.
- Transférer chaque construction à une plaque de culture cellulaire 35 mm ou plaque 6 puits, pour l’ensemencement de la cellule immédiatement.
-
Trypsinize une fiole T75 confluente de ATDPCs cardiaques.
- Laver la fiole T75 avec 5 mL 1 x solution saline tamponnée au phosphate (PBS).
- Ajouter 1 mL de 0.05 % trypsine-EDTA et incuber à 37 ° C pendant 5 min détacher les cellules.
- Ajouter 5 mL de milieu complet pour inactiver la trypsine-EDTA.
- Recueillir toutes les cellules dans un tube de 15 mL et laver la fiole 2 x 5 ml de PBS pour recueillir les cellules restantes.
- Centrifuger à 230 x g pendant 5 min à 22 ° C, retirez le surnageant et remettre en suspension les cellules dans 2 mL de milieu complet pour les compter avec la chambre hémocytomètre.
- Semences 200 µL de ATDPCs cardiaques (2. 5 x 105 cellules/mL) dans le pool de cellules des constructions PDMS 12 (Figure 1A, B) d’avoir environ 80 % de la surface d’ensemencement couverte par des cellules le lendemain et incuber à 37 ° C et 5 % de CO2.
Remarque : Après 2 à 4 h, les cellules doivent être attachés. Cellule inoculum est préparé selon la taille des cellules et la croissance. Pour les plus petites cellules, la densité de semis doit être augmentée. - Doucement, ajouter 2 mL de milieu complet préchauffée (α-MEM additionné de 10 % fœtale bovine sérique, 1 % L-glutamine et 1 % la pénicilline-streptomycine) par plaque.
- Incuber les constructions à des conditions de culture (généralement 37 ° C et 5 % CO2) jusqu’au lendemain.
3. électromécaniques Stimulation Setup (jour 0)
- Avant de commencer la procédure, prendre six constructions électromécaniques stimulation et six en tant que contrôles non stimulées. Avec moins de six plaques par stimulation, utilisent des constructions vides avec le même volume moyen d’assurer une stimulation appropriée de champ électrique.
- Nettoyer l’appareil de stimulation avec l’éthanol à 70 % et le placer dans le flux du cabinet.
- Mettre les électrodes stériles et la pince à épiler à l’intérieur de l’armoire de flux.
- Retirez la plaque de culture pour manipuler facilement les électrodes et les constructions de 90 % des médias. Tout d’abord, placez les constructions PDMS dans la bonne position pour assurer une attraction magnétique (déplacement de PDMS dans la plaque de culture vers l’aimant) entre les aimants fixes et mobiles. Ensuite, connectez le fil de platine pour les connecteurs de l’électrode et la pièce PTFE dans son espace désigné dans la construction PDMS.
- Ajouter 2,5 mL de milieu complet préchauffée frais à chaque construction.
Remarque : Maintenir la stérilité tout au long de la procédure et d’exploiter sur une construction à la fois. Conserver le reste des constructions dans l’incubateur à 37 ° C et 5 % de CO2 jusqu'à utilisation. - Une fois que toutes les constructions PDMS sont placées et raccordées électriquement à la plate-forme, ramener la plate-forme dans l’incubateur à 37 ° C et 5 % de CO2.
- Connectez la source électrique et mécanique.
-
Configurer le programme de stimulation. Spécifier des régimes de stimulation électrique et mécanique via les interfaces utilisateur du stimulateur électrique et de l’application, qui contrôle la stimulation mécanique. Définissez le synchronisme comme suit.
- Allumez le stimulateur électrique. Attendez que le menu principal sur l’affichage.
- Puis, sélectionnez Option 2 : modifier la séquence + entrée.
- Modifier la séquence de Menu comme suit.
- Utilisez l’onglet Mode pour sélectionner la tension ou courant. Sélectionnez actuel en cliquant sur + et appuyez sur entrée.
- Pour l’Amplitude onglet, sélectionnez 1 (mA) avec +/- et appuyez sur entrée.
- Pour la Période (T), 1000 (ms) avec +/- , presser Enter.
- Réglez la durée de l’impulsion (Tw) sur 2 (ms) avec +/- et appuyez sur entrée.
- Pour l’onglet mode de déclenchement , sélectionnez externe par le logiciel et appuyez sur entrée.
- Retour dans le menu principal, sélectionnez Option 4 : générer la séquence et appuyez sur entrée.
Remarque : Le stimulateur électrique repose dans l’attente jusqu'à ce qu’il reçoit une commande de déclencheur de l’application de stimulateur mécanique via le port série.
- Effectuez les opérations suivantes dans la section de stimulation mécanique du panneau application (Figure 2C).
- Écrire 1 000 (ms) dans le contrôle de texte de Période d’impulsion .
- Écrire 500 (ms) dans le contrôle de texte ON time (Tw) pour définir la durée de l’impulsion mécanique.
- Écriture 2 000 (UA) dans le contrôle de texte Excursion pour livrer un allongement de la construction de 10 %. C’est le nombre d’étapes dans le moteur de commande linéaire.
Remarque : Le protocole de stimulation appliqué ici consistant en courant alternatif 2 ms monophasiques impulsions d’ondes carrées de 50 mV/cm à 1 Hz et 10 % qui s’étend sur 7 jours. Les temps de montée et la chute de l’impulsion mécanique sont fixés à 100 ms, d’imiter à peu près la forme de l’impulsion de pression du foyer. En outre, le mode de répétition est défini sur continue et il y a un compteur affichant le nombre d’impulsions.
- Allumez le stimulateur électrique. Attendez que le menu principal sur l’affichage.
- Modifier les médias 2 x par semaine (lundi et jeudi après-midi). Tout d’abord, enlever les anciens médias ; Ensuite, ajoutez les médias chauds sur les côtés du support PDMS, jamais directement sur la piscine de la cellule.
Remarque : Si les cellules ont un taux de croissance élevés, les médias doivent être changé 3 x par semaine (par exemple, lundi, mercredi et vendredi). Il est nécessaire de débrancher et rebrancher tous les câbles, mais il n’y a aucun besoin d’enlever les plaques de culture et les électrodes de leur place. - Recueillir les échantillons après que l’expérimentation ne soit effectuée.
4. PRELEVEMENT à la fin de l’expérimentation (jour 7)
-
Pour les analyses de RNA
- La construction de lavage 2 x avec 3 mL de PBS 1 x pendant 5 min à température ambiante.
- Ajouter 3 mL de 0.05 % trypsine-EDTA à chaque plat (assez pour couvrir tout l’assemblage) et attendre 5 min à 37 ° C.
- Après que les cellules sont individuelles, ajouter 2 mL de milieu complet pour inactiver la trypsine-EDTA.
- Recueillir toutes les cellules dans un 15 mL tube et laver la construction 2 x avec 3 mL de PBS pour recueillir les cellules restantes.
- Centrifuger à 230 x g pendant 5 min à 22 ° C.
- Retirez le surnageant et resuspendre le culot dans 1 mL de PBS.
- Transférer la solution de cellules dans un tube de 1,5 mL et centrifuger à 230 x g pendant 5 min.
- Retirez le surnageant et stocker le culot à-80 ° C à 700 µL de réactif de lyse d’autres ARN.
- Isoler l’ARN à l’aide d’une trousse commerciale, suivant les instructions du fabricant.
- Inverse-transcrire l’ARN isolé à l’aide de la trousse et hexamères aléatoire, selon le protocole du fabricant.
- Pour les faibles concentrations de RNA, preamplify et ensuite, diluer 1:5 avec de l’eau exempte de RNase avant transcription inverse en temps réel les PCR (RT-PCR) est effectuée. Continuer avec le protocole standard pour la RT-PCR en temps réel et vérifier les principaux marqueurs cardiaques.
NOTE : Les marqueurs cardiaques typiques comprennent des marqueurs précoces et tardives de différentes catégories, telles que les facteurs de transcription cardiaque (axée sur les myocytes enhancer facteur 2 a [MEF2A], protéine GATA-4 [GATA-4]) et structurels (troponine cardiaque je [TNIC], cardiaque troponine T [cTnT], α-actinine) et régulation du calcium (Connexin43 [Cx43], sarco-/ réticulum endoplasmique Ca2 +-ATPase [SERCA2])30. Isolement de protéine aussi peut être effectuée que si nécessaire. Simultanée isolement d’ARN et de protéine peut être effectuée avec le même échantillon, à l’aide de réactifs commercialement disponibles et nécessaires (Table des matières) si la quantité de l’échantillon est inférieure.
-
Pour immunostainings
Remarque : Ceci est réalisé directement sur les cellules attachés à la piscine de la cellule de la construction PDMS. Par conséquent, nous recommandons de placer, à chaque fois, couvercle de 1 cm x 1 cm de film de paraffine sur le dessus de la piscine de la cellule, en dehors de la plaque, pour minimiser l’évaporation des solutions d’incubation.- La construction de lavage 2 x avec 3 mL de PBS pendant 5 min à température ambiante.
- Fixer les cellules attachés à la construction avec 2 mL de formol 10 % pendant 15 min à température ambiante.
- Laver les cellules 3 x 3 ml de PBS pendant 5 min à température ambiante. Pour le stockage à long terme, laisser les échantillons dans du PBS avec 0,1 % d’azide de sodium à 4 ° C.
- Permeabilize les cellules avec 3 mL de PBS + 0,5 % de détergent (3 x, chaque fois 5 à 10 minutes, à température ambiante).
- Incuber les cellules avec 100 µL de PBS + 10 % de sérum de cheval, 1 % d’albumine sérique bovine à température ambiante pendant 1 h, + 0,2 % de détergent pour bloquer la liaison de l’anticorps non spécifiques.
- Incuber les cellules avec 100 µL de PBS + 10 % de sérum de cheval + 0,2 % de détergent + 1 % d’albumine sérique bovine, l’anticorps primaire à température ambiante pendant 1 h. Par exemple, les anticorps primaires contre Cx43 (au 1/100), du sarcomère α-actinine (au 1/100), GATA-4 (01:50), MEF2 (01:25) et SERCA2 (01:50).
- Laver 3 fois avec 3 mL de PBS à température ambiante pendant 5 min.
- Incuber les cellules avec 100 µL de PBS + anticorps secondaire dans l’obscurité pendant 1 h à température ambiante.
Remarque : Anticorps secondaires conjugués avec des fluorophores différents et un agent de counterstaining ont été utilisés. - Laver 3 x avec 3 mL de PBS dans l’obscurité pendant 5 min à température ambiante.
- Incuber les cellules avec 100 µL de nucléaire coloration (0,1 µg/mL) dans du PBS à température de la pièce dans l’obscurité pendant 15 min.
- Laver 3 x avec 3 mL de PBS dans l’obscurité pendant 5 min à température ambiante.
- Stocker les échantillons dans 3 mL de PBS avec 0,1 % d’azide de sodium à 4 ° C jusqu'à l’acquisition.
Remarque : Acquisition de microscope est possible sur des microscopes inversés fluorescents et confocale avec objectifs de distance de long-travail parce que l’épaisseur de la construction est d’environ 0,5 mm.
Résultats
La figure 2 représente le schéma général suivi pour la stimulation des cellules. Brièvement, les cellules ont été ensemencées sur la construction PDMS et soumis à une stimulation électromécanique, avec un changement de support effectué deux fois par semaine. Les cellules stimulées ont été utilisés comme un contrôle pour la climatisation electromecanique. En outre, nous avons ajouté un contrôle supplémentaire à l’expérience, et ATDPCs s...
Discussion
La stimulation électromécanique semble être une alternative sûre pour préparer des cellules pour un environnement hostile cardiaque et renforcer leur engagement cardiaque. Ici, un protocole décrit pour cellules souches cardiaques a augmenté l’expression de marqueurs cardiaques principales et a été rapporté pour être bénéfique pour leur prochaine implantation le myocarde murin infarci30. En général, électromécanique stimulées ATDPCs cardiaques a augmenté l’expression de gène...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer, sauf que l’appareil de stimulation et du protocole ont été déjà brevetés (WO-2013185818-A1, WO-2017125159-A1).
Remerciements
Les auteurs souhaitent remercier les membres du programme de recherche établissement (Mechanism, Badalona) et électroniques et de groupe d’Instrumentation biomédicale (UPC, Barcelone), particulièrement Prof. J. Rosell-Ferrer. En outre, les auteurs reconnaissent cellules souches Translational Medicine journal et presse AlphaMed pour permettre l’adaptation des chiffres précédemment publiés (Llucià-Valldeperas, et al. 30). le développement de ce prototype et la conception du protocole ont été pris en charge par Ministerio de Educación y Ciencia (SAF 2008-05144), Ministerio de Economía y Competitividad (SAF 2014-59892), la Commission européenne 7e Programme-cadre () RECATABI, NMP3-SL-2009-229239), fondation La Marató de TV3 (080330, 201516, 201502) et Fundación para la Salud Innovación y la Prospectiva fr España (FIPSE ; 00001396-06-15).
matériels
| Name | Company | Catalog Number | Comments |
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2x | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
Références
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium's electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology--Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon