Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Gleichzeitige elektrische und mechanische Stimulation, Cells Cardiomyogenic Potenzial zu steigern
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll für die Ausbildung einer Zellpopulation, die mit elektrischen und mechanischen Reizen emuliert kardiale Physiologie. Diese elektromechanische Stimulation erhöht das Cardiomyogenic Potenzial der behandelten Zellen und ist eine vielversprechende Strategie für weitere Zelltherapie, Krankheit Modellierung und Drogen-Screening.
Zusammenfassung
Kardiovaskuläre Erkrankungen sind die häufigste Todesursache in den entwickelten Ländern. Infolgedessen hat die Nachfrage nach effektiven Herzmuskelzellen Therapien motiviert, Forscher in der Stammzelle und Bioengineering Felder in Vitro High-Fidelity-menschlichen Myokard für Grundlagenforschung und klinische Anwendungen zu entwickeln. Die unreife Phänotyp der Herzmuskelzellen ist jedoch eine Beschränkung auf den Erhalt von Gewebe, die funktionell die adulten Myokard imitieren charakterisiert vor allem durch mechanische und elektrische Signale. Somit ist der Zweck dieses Protokolls zu bereiten und Reifen der Ziel-Zell-Population durch elektromechanische Stimulation Rekapitulation physiologische Parameter. Herzgewebe Engineering entwickelt sich in Richtung mehr biologische Ansätze und Strategien basierend auf biophysikalische Reize, so sind an Dynamik gewinnt. Für diesen Zweck entwickelte Gerät ist einzigartig und ermöglicht individuelle oder gleichzeitige elektrische und mechanische Stimulation, sorgfältig gekennzeichnet und validiert. Zusätzlich, obwohl die Methodik dieser Stimulator und einer bestimmten Zellpopulation optimiert wurde, kann es leicht auf andere Geräte und Zell-Linien angepasst werden. Die Ergebnisse hier bieten Beweis für das erhöhte kardiale Engagement der Zellpopulation nach elektromechanische Stimulation. Elektromechanisch stimulierte Zellen zeigen einen erhöhte Ausdruck der wichtigsten kardialen Marker, einschließlich der frühen, strukturellen und Calcium-regulierende Gene. Diese Zelle Klimaanlage könnte für weitere regenerative Zelltherapie, Krankheit Modellierung und Hochdurchsatz-Drogen-Screening nützlich sein.
Einleitung
Herz-Funktion basiert auf der Kopplung von elektrischen Erregung und mechanische Schrumpfung. Kurz, Cardiomyocyte interzelluläre Verbindungen ermöglichen elektrische Signalausbreitung fast synchronen Kontraktionen des Herzens, Blut zu Pumpen systemisch und durch Lungensystems produzieren. Herzzellen, unterziehen damit, elektrische und mechanische Kräfte, die Genfunktion Ausdruck und Mobilfunk zu regulieren. Dementsprechend haben viele Gruppen, Kultur-Plattformen entwickeln, die die kardiale physiologische Umgebung um zu verstehen, die Rolle der mechanischen und elektrischen Stimulation auf kardiale Entwicklung, Funktion und Reifung zu imitieren versucht. In-vitro- elektrische und mechanische Reize wurden individuell umfassend angewendet im Herzgewebe Engineering bis zur funktionelle Eigenschaften verbessern, die Zelle Reifung oder Verbesserung der Zell-Zell-Kupplung und Kalzium Umgang mit1 , 2 , 3 , 4 , 5 , 6 , 7 , 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. synchrone elektromechanische Klimaanlage bleibt jedoch ungenutzt, wegen der Herausforderung einen Stimulator und ein Protokoll zu entwickeln, und wegen der obligatorischen Optimierung22.
Vorarbeiten wurden elektromechanische Stimulation als eine Kombination von Elektrostimulation und Medien Perfusion, Allerdings beinhaltet die Strömung die Stamm-basierten Verformung typische ventrikuläre Füllung23,24,25. Später kombiniert weitere physiologische Ansätze elektrische Reize mit physischen Deformation oder Strecken, um die Isovolumetric Kontraktion26,27,28,29,30 imitieren ,31. Feng Et Al. beschrieben die erste Demonstration der elektromechanische Stimulation im Jahr 2005, Berichterstattung, Cardiomyocyte Größe und kontraktile Eigenschaften26verbessert. Wang Et Al. mesenchymalen Stammzellen mit 5-Azacytidine vorbehandelt und gleichzeitige elektrische und mechanische Klimaanlage, Verbesserung der Recellularization, Zellviabilität, kardialen Differenzierung und Gewebe Umbau27angewendet. Seit diese Veröffentlichungen mehr Gruppen berichteten über elektromechanische Stimulation der Zelle Monolagen oder Gewebe (z.B. Schwarz28, Vunjak-Novakovic29,31, und unsere Gruppe30) entwickelt, mit der erste klimatisierte Zellen getestet in-vivo30. Kurz, Morgan und schwarz getestet mehrere Kombinationen von elektrischen und mechanischen Reizen, berichtet, dass das Timing zwischen Stimulationen entscheidend war, weil verzögerte kombinierte elektromechanische Stimulation der besten Ergebnisse28ergab. Als nächstes Godier-Furnémont und Mitarbeiter eine elektromechanische Stimulation Protokoll für technische Herz Muskel Konstrukte von neonatalen Ratte Herzzellen optimiert und erreicht, zum ersten Mal eine positive Kraft-Frequenz Beziehung29. Danach berichtete unserer Gruppe, dass elektromechanisch vorkonditionierten Zellen den Ausdruck der wichtigsten kardialen Marker in Vitro erhöht und breit vorteilhaft in-vivo Effekte, wie z. B. verbesserte Herzfunktion oder erhöht Schiff Dichte in der Infarkt Border Region30. Die jüngste Publikation gezeigt, dass kardiale Gewebe aus Stamm-abgeleitete Herzmuskelzellen elektromechanische Klimaanlage erreicht eine Reifung Ebene näher an menschlichen Erwachsenen kardialen Struktur und Funktion31unterzogen. Darüber hinaus alternative dreidimensionale Stimulierung Plattformen umfassen elektroaktive Gerüste, die bieten elektrische, mechanische und topographische Hinweise, um die Zellen32befestigt. Darüber hinaus kann auch mechanische Verformung (Zelle Monolage stretching und Kompression) mit dehnbaren Elektroden imitiert normalen physiologischen Bedingungen als auch extreme Bedingungen33induziert werden.
Daher ist die Begründung, dass in-vitro-elektromechanische Reize basierend auf physiologischen Bedingungen das Cardiomyogenic Potential einer Zelle steigern könnte. In der Tat, könnte diese Stimulation profitieren weitere Integrationen von therapeutischen Zellen in das Myokard in einem Szenario mit klinischen oder Gewebe Reifung für Drogentest Anwendungen zu erhöhen.
Darüber hinaus wir isoliert und charakterisiert eine Bevölkerung von menschlichen Fettgewebe abgeleitet Vorläuferzellen der kardialen Ursprungs (kardiale ATDPCs)34. Diese Zellen befinden sich in das epicardial Fett. Diese Zellen anzeigen histopathologische und funktional wohltuend bei der Behandlung von Herzinfarkt und auch pflegen Herz- und endothelialen Differenzierung Potenzial. 30 , 35. wir vermutet, dass diese Vorteile nach biophysikalischen Stimulation erhöhen würde.
Infolgedessen entwickelt ein Gerät und eine Anregung für die Zell-Population von Interesse und untersuchte die Auswirkungen. Dieses elektromechanische Protokoll ist eine neue Strategie zur aktiven Zelle erstreckt sich auf sterile Weise zu induzieren und nicht-invasiv im Vergleich zu früheren Veröffentlichungen36, in Kombination mit elektrischen Feldes Stimulation. Die Technik hier berichtet beschreibt im Detail die Vorrichtung und Verfahren für die elektrische, mechanische und elektromechanische Stimulation der Zellen verwendet.
Dieses Gerät kann sowohl mechanische als auch elektrische Stimulation, unabhängig voneinander oder gleichzeitig bereitstellen. Die Stimulation erfolgt mit einem nicht-invasive und aseptische neuartiger Ansatz, die Elektroden im Inneren einer standard Kultur-Platte und eine Plattform, die die mechanische und elektrische Kräfte (Abbildung 1) induziert Elektrodenspitzen Zelle unterstützt.
Die Plattform fasst bis zu sechs Kultur Platten und besteht aus einer Sandwichstruktur von lasergeschnittenen Poly(methyl methacrylate) und Leiterplatte Stücke. Die Plattform Prototyp stützt sich auf eine Kombination von ein monophasisch programmierbare computergesteuerten elektrischen Stimulator eine Leiterplatte für die stabile Verbindung der Elektroden und sechs 10 mm x 10 mm x 5 mm vernickelter Neodym-feste Magneten platziert in der Nähe von einer Seite des Kultur-Platten. Außerdem gibt es eine Aluminium-Bar mit sechs treibenden Magnete (Gleiches Modell) vor der anderen Seite der Kultur Platten gelegt und zog mit einem linearen Servomotor. Der Motor wird von einer Motorsteuerung, betrieben durch einen RS-232-Port von kommerzieller Software angetrieben (siehe die Tabelle der Materialien). Durch die Benutzeroberfläche und programmierbarer Stimulator ist es möglich, programmieren Sie die elektrischen Intensität, die Pulsdauer und Frequenz, die Häufigkeit der mechanischen Stimulation, die Einschaltdauer, die Anzahl der Impulse, die Impuls-Amplitude (Magnet Ausflug), und die Steigung.
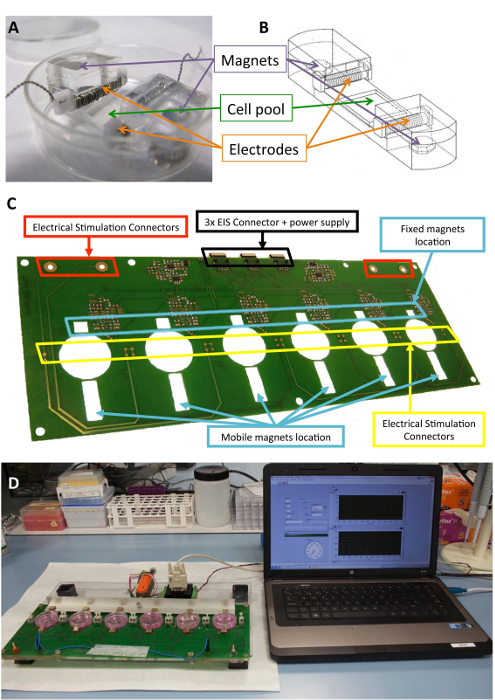
Abbildung 1 : Elektromechanischer Stimulator. (A) PDMS Konstrukt für die Konditionierung der Zelle verwendet. (B) Zeichnung des PDMS Konstrukts, einschließlich Elektroden und Magnete. (C) Detail der Leiterplatte (Plattform) verwendet, um die elektromechanische Konditionierung durchzuführen. Dieses Panel verändert wurde, vom Llucià-Valldeperas Et Al.30. (D) Bild von der elektromechanische Stimulation-Plattform und Benutzeroberfläche (Computer). Bitte klicken Sie hier für eine größere Version dieser Figur.
Der Stimulator und die Methode für die elektromechanische Konditionierung sind vollständig in zwei internationale Patente, WO-2013185818-A1-37 und WO-2017125159-A138beschrieben.
Das biokompatible Silikon Konstrukte entwickelt, um strukturelle Unterstützung Zellen, Elektroden und Magnete wurden beschriebenen zuvor10,21. Kurz, Sie bestehen aus Polydimethylsiloxan (PDMS), geformt und bei Raumtemperatur mit einem Elastizitätsmodul von 1,3 MPa, in der Nähe von physiologischen Ebenen geheilt. Das Konstrukt enthält einen Zelle Kultur Pool in einem flexiblen Bereich (10 x 10 x 2 mm), zwei innere quer-Steckplätze, die Elektroden zu halten, und zwei eingebettet 6 x 2 mm x 4 mm vernickelter Neodym-Magneten. Die Elektroden sind mit 0,2 mm Platin Draht verdreht um eine 2 x 3 mm x 12 mm Polytetrafluorethylen (PTFE) core-bar (21 cm pro Elektrode, ca. 23 Kurven) und platziert auf gegenüberliegenden Seiten des flexiblen Bereich erstelle ich ein elektrisches Feld zur Induktion gebaut elektrische Stimulation. Mechanische Dehnung wird durch magnetische Anziehungskraft zwischen Magneten, eingebettet in die Unterstützung und externen Magneten platziert neben der Kultur-Platte und auf dem beweglichen Arm Aluminium erreicht. Auf diese Weise kann die Zelle Unterstützung verlängert werden, ohne die sterile Barriere zu brechen. Dieser Ansatz eignet sich für eine Zelle Monolage aber könnte für dreidimensionale Konstrukte auch angepasst werden.
Darüber hinaus könnte ein regelmäßiges Muster eingeprägt, wo die Zellen ausgesät werden, werden mit einem linierten Beugungsgitter (1.250 Rillen/mm). Die direkte Visualisierung der Zellen kultiviert auf das PDMS-Konstrukt unter Hellfeld und Fluoreszenz Mikroskope ist wegen seiner Transparenz und 0,5 mm Dicke möglich. Im vorliegenden Fall hat der PDMS-Kultur-Pool eine vertikale Oberflächenmuster, senkrecht auf die Dehnung Kraft, um die Zellen senkrecht auf das elektrische Feld ausrichten, die das elektrische Feld Gefälle über die Zelle minimiert.
Abbildung 1 zeigt eine detaillierte Beschreibung des Konstrukts und Gerät zur Stimulation verwendet. Die PDMS zu konstruieren und Eigenschaften sind für die Zelle Dehnung (Abb. 1A, B) optimiert. Der Stimulator wird entwickelt und validiert für den effizienten Einsatz der gewünschten elektrischen und mechanischen Stimulation auf Zellen an der PDMS-Konstrukt befestigt. Dieser Prozess umfasst gute Konnektivität und Benutzer Bedienbarkeit durch die Software-Schnittstelle (Abbildung 1, D) zu gewährleisten.
Das Verfahren zur Zellstimulation mit diesem maßgeschneiderten Gerät wird im Abschnitt Protokoll beschrieben.
Protokoll
Diese Studie wird menschliche Herz ATDPCs von Patientenproben verwendet. Ihre Nutzung durch die lokale Ethikkommission genehmigt wurde, und alle Patienten gab informierte Zustimmung. Das Studienprotokoll passt sich an die Grundsätze, die in der Deklaration von Helsinki.
1. Vorbereitungen
- Autoklav zwei Pinzetten, 12 Platinelektroden PTFE für elektrische Stimulation und einige Papiertücher, bei 121 ° C für 20 Minuten.
-
Sterilisieren Sie 12 PDMS maßgeschneiderte Konstrukte (Abb. 1A).
- Waschen Sie jedes Konstrukt mit 5 mL sterilem, destilliertem Wasser mit magnetischen Agitation bei Raumtemperatur 15 Minuten.
- Waschen Sie 1 X mit 5 mL 70 % igem Ethanol mit magnetischen Agitation bei Raumtemperatur für 5 min.
- Waschen Sie 5 X mit 5 mL sterilem, destilliertem Wasser mit magnetischen Agitation bei Raumtemperatur für 10 min pro Waschgang, alkoholische Rückstände zu entfernen.
- Trocknen Sie die Konstrukte auf sterile Küchenpapier in den Fluss Kabinett über Nacht.
- Speichern sie in sterilen 50 mL Zentrifuge Rohre bis zur Verwendung.
(2) Cell Seeding (Tag-1)
- Übertragen Sie vor der Aussaat Zelle die gereinigte PDMS-Konstrukte zu sterilen Platten und setzen sie mit UV-Licht für 5 min um vollständige Sterilisation zu gewährleisten.
- Übertragen Sie jedes Konstrukt auf eine Zellplatte Kultur 35 mm oder 6-Well-Platte für die Aussaat sofortige Zelle.
-
Trypsinize eine konfluierende T75 Fläschchen der kardialen ATDPCs.
- Waschen Sie die T75 Fläschchen mit 5 mL 1 x Phosphat-gepufferte Kochsalzlösung (PBS).
- Fügen Sie 1 mL 0,05 % Trypsin-EDTA und Inkubation bei 37 ° C für 5 min um die Zellen zu lösen.
- Fügen Sie 5 mL des kompletten Medium, Trypsin-EDTA zu inaktivieren.
- Sammle alle Zellen in einem 15 mL-Tube und Waschen der Küvette 2 X mit 5 mL PBS, alle übrigen Zellen zu sammeln.
- Zentrifugieren bei 230 X g für 5 min bei 22 ° C, den Überstand zu entfernen und Aufschwemmen der Zellen in 2 mL komplette Medium, sie mit der Hemocytometer-Kammer zu zählen.
- Samen 200 µL der kardialen ATDPCs (2,5 x 105 Zellen/mL) in die Zelle-Pool von 12 PDMS-Konstrukte (Abbildung 1A, B) ~ 80 % der Aussaat Oberfläche bedeckt haben von Zellen am Folgetag und Inkubation bei 37 ° C und 5 % CO2.
Hinweis: Nach 2 – 4 h sollten die Zellen befestigt werden. Zelle Inokulum ist je nach Zellengröße und Wachstum vorbereitet. Für kleinere Zellen sollte die Aussaatdichte erhöht werden. - Fügen Sie sanft 2 mL vorgewärmte komplette Medium (α-MEM mit 10 % fetalen bovine Serum, 1 % L-Glutamin und 1 % Penicillin-Streptomycin ergänzt) pro Platte.
- Inkubieren Sie die Konstrukte Kulturbedingungen (in der Regel 37 ° C und 5 % CO2) über Nacht.
(3) elektromechanische Stimulation Setup (Tag 0)
- Nehmen Sie bevor Sie die Schritte ausführen sechs Konstrukte für elektromechanische Stimulation und sechs als nonstimulated Steuerelemente. Verwenden Sie mit weniger als sechs Platten pro Stimulation leere Konstrukte mit dem gleichen mittleren Volumen um ordnungsgemäße elektrische Feld Stimulation sicherzustellen.
- Reinigen Sie der Stimulationseinheit mit 70 % Ethanol und legen Sie sie in den Fluss Kabinett.
- Bringen Sie die sterilen Elektroden und Pinzette in die Fluss-Schrank.
- Entfernen Sie 90 % der Medien von der Kultur-Platte, die Elektroden und Konstrukte leicht zu manipulieren. Die PDMS-Konstrukte, Platz 1 in der richtigen Position um magnetische Anziehung (PDMS Verschiebung innerhalb der Kultur-Platte in Richtung der Magnet) zwischen festen und mobilen Magneten zu gewährleisten. Schließen Sie als nächstes, die Platin Draht die Elektrode-Anschlüsse und der PTFE-Teil in den dafür vorgesehenen Raum in der PDMS-Konstrukt.
- Jedes Konstrukt 2,5 mL frisch vorgewärmte komplette Medium hinzufügen.
Hinweis: Die Sterilität während des Verfahrens warten und betreiben auf einem Konstrukt zu einem Zeitpunkt. Behalten Sie den Rest der Konstrukte im Inkubator bei 37 ° C und 5 % CO2 bis zur Verwendung. - Sobald alle PDMS-Konstrukte sind platziert und elektrisch mit der Plattform verbunden, zurückbringen Sie die Plattform in den Brutschrank bei 37 ° C und 5 % CO2.
- Elektrischen und mechanischen Anschluss.
-
Konfigurieren Sie die Stimulation-Programm. Geben Sie elektrische und mechanische Stimulation Regime durch die Benutzeroberflächen von elektrischen Stimulator und die Anwendung, die die mechanische Stimulation kontrolliert. Legen Sie wie folgt die Synchronität.
- Schalten Sie den elektrischen Stimulator. Warten Sie, bis das Hauptmenü auf dem Display angezeigt werden.
- Wählen Sie Option 2: Bearbeiten der Sequenz + Enter.
- Bearbeiten Sie die Sequenz Menü wie folgt.
- Verwenden Sie die Registerkarte " Modus ", um entweder Spannung oder Strom auszuwählen. Wählen Sie aktuelle + , und drücken Sie die Eingabetaste.
- Wählen Sie 1 (mA) mit + /- für die Registerkarte " Amplitude " und drücken Sie die Eingabetaste.
- Wählen Sie 1000 (ms) mit + /- für die Zeit (T)und drücken Sie die Eingabetaste.
- Legen Sie die Impulsdauer (Tw) , 2 (ms) mit + /- und drücken Sie die Eingabetaste.
- Für die Registerkarte " Trigger-Modus " externe Software auswählen und Enterdrücken.
- Zurück im Hauptmenü, wählen Sie Option-4: Sequenz zu erzeugen und drücken Sie die Eingabetaste.
Hinweis: Der elektrischen Stimulator ruht in den Standby-Modus, bis sie einen Trigger-Befehl aus der mechanischen Stimulator-Anwendung über die serielle Schnittstelle erhält.
- Führen Sie die folgenden Schritte im Abschnitt mechanische Stimulation der Systemsteuerung Anwendung (Abbildung 2C).
- 1.000 (ms) in der Impulsperiode -Text-Steuerelement zu schreiben.
- Schreiben Sie 500 (ms) in die Einschaltzeit (Tw) -Text-Steuerelement die mechanische Pulsdauer festgelegt.
- Schreiben 2.000 (AU) in der Exkursion -Text-Steuerelement, eine Konstrukt 10 % Dehnung zu liefern. Dies ist die Anzahl der Schritte in der lineares Steuermotor.
Hinweis: Die Stimulation Protokoll hier angewendet besteht aus abwechselnd Strom 2 ms monophasische Rechteckimpulse von 50 mV/cm bei 1 Hz und 10 % Dehnung für 7 Tage. Der Aufstieg und Fall Zeiten des mechanischen Impulses sollen bei 100 ms, etwa die Form des Herd-Druckimpuls imitieren. Auch die Wiederholung eingestellt ist, kontinuierlich und befindet sich ein Zähler zeigt die Anzahl der Impulse.
- Schalten Sie den elektrischen Stimulator. Warten Sie, bis das Hauptmenü auf dem Display angezeigt werden.
- Wechseln Sie das Medium 2 x wöchentlich (Montag und Donnerstag Nachmittag). Entfernen Sie zunächst die alten Medien; Fügen Sie dann die warmen Medien auf den Seiten des PDMS-Unterstützung, nie direkt auf die Zelle-Pool.
Hinweis: Wenn die Zellen verfügen über eine hohe Wachstumsrate, sollte die Medien veränderten 3 x pro Woche (z. B. Montag, Mittwoch und Freitag). Es ist notwendig zu trennen, und schließen alle Kabel, aber es gibt keine Notwendigkeit, die Kultur-Platten und Elektroden von ihrem Platz entfernen. - Die Proben zu sammeln, nachdem die Experimente durchgeführt wird.
(4) Entnahme von Proben am Ende des Experiments (Tag 7)
-
Für RNA-Analysen
- Waschen Sie das Konstrukt 2 X mit 3 mL 1 X PBS für 5 min bei Raumtemperatur.
- Fügen Sie 3 mL 0,05 % Trypsin-EDTA auf jede Platte (genug, um das ganze Konstrukt) und warten Sie 5 min bei 37 ° C.
- Nachdem die Zellen getrennt sind, fügen Sie 2 mL des kompletten Medium, Trypsin-EDTA zu inaktivieren.
- Sammle alle Zellen in einem 15 mL tube und waschen Sie das Konstrukt 2 X mit 3 mL PBS, alle übrigen Zellen zu sammeln.
- Zentrifuge bei 230 X g für 5 min bei 22 ° C.
- Den Überstand zu entfernen und das Pellet in 1 mL PBS Aufschwemmen.
- Übertragen Sie die Zelle-Lösung auf eine 1,5 mL-Tube und Zentrifuge bei 230 X g für 5 min.
- Entfernen Sie den Überstand zu und speichern Sie das Pellet bei-80 ° C in 700 µL Lyse-Reagenz für weitere RNA Isolierung.
- Isolieren Sie RNA mithilfe eines kommerziellen Kits nach den Anweisungen des Herstellers.
- Reverse-transkribieren der isolierten RNS mit Kit und zufällige Hexamers laut Protokoll des Herstellers.
- Für kleine RNA-Konzentrationen Vorverstärkung und dann 1:5 mit RNase-freies Wasser zu verdünnen, bevor nachfolgende Echtzeit reversen Transkription Polymerase-Kettenreaktion (RT-PCR) durchgeführt wird. Fahren Sie mit dem Standardprotokoll für Real-Time RT-PCR und überprüfen Sie wichtigsten kardialen Marker zu.
Hinweis: Typische kardialen Marker umfassen frühe und späte Marker aus verschiedenen Kategorien, wie z. B. kardiale Transkriptionsfaktoren (Myozyten-spezifische Enhancer Faktor 2A [MEF2A], 4 [GATA-4]-GATA-bindendes Protein) und strukturellen (kardiale Troponin ich [cTnI], kardiale Troponin T [cTnT], α-Actinin) und Kalzium (Connexin43 [Cx43], Sarco-/ endoplasmatische Retikulum Ca2 +-ATPase [SERCA2])30. Protein-Isolierung kann auch erfolgen, wenn nötig. Gleichzeitige RNA und Protein Isolation kann durchgeführt werden, mit der gleichen Probe und mit handelsüblichen Reagenzien und Kits (Table of Materials), wenn die Probenmenge kleiner ist.
-
Für immunostainings
Hinweis: Dies erfolgt direkt in die Zellen an der Zelle-Pool des PDMS-Konstrukts befestigt. Daher empfehlen wir, jedes Mal 1 cm x 1 cm Paraffin-Film auf der Oberseite der Zelle Pool, abgesehen von der Platte Deckel, um die Verdunstung der Inkubation Lösungen zu minimieren.- Waschen Sie das Konstrukt 2 X mit 3 mL PBS für 5 min bei Raumtemperatur.
- Befestigen Sie die Zellen, das Konstrukt mit 2 mL 10 % Formalin für 15 min bei Raumtemperatur.
- Waschen Sie die Zellen 3 X mit 3 mL PBS für 5 min bei Raumtemperatur. Lassen Sie für die langfristige Lagerung die Proben mit PBS-Puffer mit 0,1 % Natriumazid bei 4 ° c
- Permeabilize der Zellen mit 3 mL PBS + 0,5 % Waschmittel (3 x, jeweils 5 – 10 min., bei Raumtemperatur).
- Inkubieren Sie die Zellen mit 100 µL PBS + 10 % Pferd Serum + 0,2 % Waschmittel + 1 % Rinderserumalbumin bei Raumtemperatur 1 Stunde, um unspezifische Antikörperbindung zu blockieren.
- Inkubation der Zellen mit 100 µL PBS + 10 % Pferd Serum + 0,2 % Waschmittel + 1 % Rinderserumalbumin Primärantikörper bei Raumtemperatur für 1 h. Z. B. primäre Antikörper gegen Cx43 (1: 100), zugeschrieben α-Actinin (1: 100), GATA-4 (01:50), MEF2 (01:25), und SERCA2 (01:50).
- Waschen Sie 3 X mit 3 mL PBS bei Raumtemperatur für 5 min.
- Inkubation der Zellen mit 100 µL PBS + Sekundärantikörper bei Raumtemperatur im Dunkeln für 1 h.
Hinweis: Sekundäre Antikörper konjugiert mit verschiedenen Fluorophore und ein Gegenfärbung Agent dienten. - Waschen Sie sie 3 X mit 3 mL PBS bei Raumtemperatur im Dunkeln für 5 Minuten.
- Inkubieren Sie die Zellen mit 100 µL der nuklearen Färbung (0,1 µg/mL) mit PBS-Puffer bei Raumtemperatur im Dunkeln für 15 min.
- Waschen Sie sie 3 X mit 3 mL PBS bei Raumtemperatur im Dunkeln für 5 Minuten.
- Speichern Sie die Proben in 3 mL PBS mit 0,1 % Natriumazid bei 4 ° C bis zum Erwerb.
Hinweis: Mikroskop Erwerb ist auf invertierten fluoreszierende und konfokale Mikroskope mit langen arbeitende Entfernung Zielen möglich, denn die Konstrukt-Dicke ca. 0,5 mm.
Ergebnisse
Abbildung 2 stellt das allgemeine Schema für die Zellstimulation gefolgt. Kurz, wurden Zellen ausgesät auf das PDMS-Konstrukt und elektromechanische Stimulation mit einem Medienwechsel zweimal pro Woche durchgeführt. Nonstimulated Zellen dienten als Kontrolle für die elektromechanische Konditionierung. Darüber hinaus wir das Experiment ein zusätzliches Steuerelement hinzugefügt, und subkutane ATDPCs dienten als Kontrolle für kardiale ATDPCs. Von subku...
Diskussion
Elektromechanische Stimulation scheint eine sichere Alternative für die Vorbereitung einer feindlichen Umgebung kardialen Zellen und Stärkung ihrer kardialen Engagements sein. Hier berichtet ein Protokoll beschrieben für kardiale Vorläuferzellen erhöht den Ausdruck der wichtigsten kardialen Marker und wurde für ihre nächste Implantation auf murinen Infarzierte Myokard30vorteilhaft. Im Allgemeinen erhöht elektromechanisch stimuliert kardiale ATDPCs die Expression von Genen im Zusammenhang m...
Offenlegungen
Die Autoren haben nichts offen zu legen, außer dass die Stimulationsvorrichtung und das Protokoll bereits patentiert wurden, (WO-2013185818-A1, WO-2017125159-A1).
Danksagungen
Die Autoren möchten den Mitgliedern des ICREC Research Program (IGTP, Badalona) und die elektronische und biomedizinische Messtechnik Gruppe (UPC, Barcelona), vor allem Prof. J. Rosell-Ferrer danken. Darüber hinaus bestätigen die Autoren Stammzellen Translational Medicine Journal und AlphaMed Presse erlaubt die Anpassung der zuvor veröffentlichten Zahlen (Llucià-Valldeperas, Et al. 30). die Entwicklung dieses Prototypen und das Design des Protokolls wurden vom Ministerio de Educación y Ciencia (SAF 2008-05144), Ministerio de Economía y Competitividad (SAF-2014-59892), die Europäische Kommission unterstützt 7. Rahmenprogramm () RECATABI, NMP3-SL-2009-229239), Fundació La Marató de TV3 (080330, 201516, 201502) und Fundación Para la Innovación y la Prospectiva de Salud de España (FIPSE; 15 / 00001396 / 06).
Materialien
| Name | Company | Catalog Number | Comments |
| Stimulator | |||
| nickel plated neodymium magnets | Supermagnete | Q-10-10-05-N | |
| nickel-plated neodymium magnets | Supermagnete | Q-06-04-02-HN | |
| polydimethylsiloxane (PDMS) SYLGAR 184 Silicone Elastomer Kit | Dow Corning Corp | 184 | |
| ruled diffraction grating (1250 grooves/mm) | Newport | 05RG150-1250-2 | |
| Motor controller | Faulhaber | MCLM-3006-S | |
| Labview | National Instruments | ||
| Cell culture | |||
| phosphate-buffered saline (PBS) | Gibco | 70013-065 | |
| 0.05% trypsin-EDTA | Gibco | 25300-120 | |
| 35 mm cell culture dish | BD Falcon | 45353001 | |
| fetal bovine serum (FBS) | Gibco | 10270-106 | |
| L-Glutamine 200 mM, 100x | Gibco | 25030-024 | |
| Penicilina/Streptomicine, 10.000 U/mL | Gibco | 15140-122 | |
| Minimum essential medium eagle (alfa-MEM) | Sigma | M4526-24x500ML | |
| Protein & RNA analyses | |||
| protease inhibitor cocktail | Sigma | P8340 | |
| QIAzol Lysis Reagent | Qiagen | 79306 | |
| AllPrep RNA/Protein Kit | Qiagen | 50980404 | |
| Rneasy mini kit | Qiagen | 74104 | |
| iTaq Universal Probes One-Step Kit | Bio-Rad Laboratories | 172-5140 | |
| Random hexamers | Qiagen | 79236 | |
| TaqMan PreAmp MasterMix 2x | Applied Biosystems | 4391128 | |
| TaqMan Universal PCR MasterMix | Applied Biosystems | 4324018 | |
| Immunostaining | |||
| 10% formalin | Sigma | HT-501128-4L | |
| horse serum | Sigma | H1138 | |
| Triton X-100 | Sigma | X100-500ML | |
| Bovine Serum Albumina (BSA) | Sigma | A7906-100G | |
| PARAFILM | Sigma | P6543 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Sigma | D9542 | |
| Phalloidin Alexa 568 | Invitrogen | A12380 | |
| sodium azide | Sigma | S8032-100g | |
| Hoechst 33342 | Sigma | 14533 | |
| Connexin-43 rabbit primary antibody | Sigma | C6219 lot#061M4823 | |
| sarcomeric α-actinin mouse primary antibody | Sigma | A7811 lot#080M4864 | |
| GATA-4 goat primary antibody | R&D | AF2606 VAZ0515101 | |
| MEF2 rabbit primary antibody | Santa Cruz | sc-313 lot#E0611 | |
| SERCA2 goat primary antibody | Santa Cruz | sc-8095 lot#D2709 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 711-165-152 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 715-165-151 | |
| Cy3 secondary antibody | Jackson ImmunoResearch | 712-165-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 715-225-150 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 711-225-152 | |
| Cy2 secondary antibody | Jackson ImmunoResearch | 705-225-147 |
Referenzen
- McDonough, P. M., Glembotski, C. C. Induction of atrial natriuretic factor and myosin light chain-2 gene expression in cultured ventricular myocytes by electrical stimulation of contraction. Journal of Biological Chemistry. 267, 11665-11668 (1992).
- Tandon, N., et al. Electrical stimulation systems for cardiac tissue engineering. Nature Protocols. 4, 155-173 (2009).
- Serena, E., et al. Electrical stimulation of human embryonic stem cells: cardiac differentiation and the generation of reactive oxygen species. Experimental Cell Research. 315, 3611-3619 (2009).
- Tandon, N., et al. Optimization of electrical stimulation parameters for cardiac tissue engineering. Journal of Tissue Engineering and Regenerative Medicine. 5, 115-125 (2011).
- Zhang, X., Wang, Q., Gablaski, B., Lucchesi, P., Zhao, Y. A microdevice for studying intercellular electromechanical transduction in adult cardiac myocytes. Lab on a Chip. 13, 3090-3097 (2013).
- Chan, Y. C., et al. Electrical stimulation promotes maturation of cardiomyocytes derived from human embryonic stem cells. Journal of Cardiovascular Translational Research. 6, 989-999 (2013).
- Pietronave, S., et al. Monophasic and biphasic electrical stimulation induces a precardiac differentiation in progenitor cells isolated from human heart. Stem Cells and Development. 23, 888-898 (2014).
- Pavesi, A., et al. Electrical conditioning of adipose-derived stem cells in a multi-chamber culture platform. Biotechnology and Bioengineering. 111, 1452-1463 (2014).
- Baumgartner, S., et al. Electrophysiological and morphological maturation of murine fetal cardiomyocytes during electrical stimulation in vitro. Journal of Cardiovascular Pharmacology and Therapeutics. 20, 104-112 (2015).
- Llucià-Valldeperas, A., et al. Electrical stimulation of cardiac adipose tissue-derived progenitor cells modulates cell phenotype and genetic machinery. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 76-83 (2015).
- Llucià-Valldeperas, A., et al. Physiological conditioning by electric field stimulation promotes cardiomyogenic gene expression in human cardiomyocyte progenitor cells. Stem Cell Research and Therapy. 5, 93 (2014).
- Radisic, M., et al. Functional assembly of engineered myocardium by electrical stimulation of cardiac myocytes cultured on scaffolds. Proceedings of the National Academy of Sciences of the United States of America. 101 (52), 18129-18134 (2004).
- Fink, C., et al. Chronic stretch of engineered heart tissue induces hypertrophy and functional improvement. FASEB Journal. 14, 669-679 (2000).
- Zimmermann, W. H., et al. Engineered heart tissue grafts improve systolic and diastolic function in infarcted rat hearts. Nature Medicine. 12 (4), 452-458 (2006).
- Birla, R. K., Huang, Y. C., Dennis, R. G. Development of a novel bioreactor for the mechanical loading of tissue-engineered heart muscle. Tissue Engineering. 13, 2239-2248 (2007).
- Salameh, A., et al. Cyclic mechanical stretch induces cardiomyocyte orientation and polarization of the gap junction protein connexin43. Circulation Research. 106, 1592-1602 (2010).
- Galie, P. A., Stegemann, J. P. Simultaneous application of interstitial flow and cyclic mechanical strain to a three-dimensional cell-seeded hydrogel. Tissue Engineering Part C: Methods. 17 (5), 527-536 (2011).
- Leychenko, A., Konorev, E., Jijiwa, M., Matter, M. L. Stretch-induced hypertrophy activates NFkB-mediated VEGF secretion in adult cardiomyocytes. PLoS One. 6, 29055 (2011).
- Tulloch, N. L., et al. Growth of engineered human myocardium with mechanical loading and vascular coculture. Circulation Research. 109, 47-59 (2011).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35, 2798-2808 (2014).
- Llucià-Valldeperas, A., et al. Unravelling the effects of mechanical physiological conditioning on cardiac adipose tissue-derived progenitor cells in vitro and in silico. Scientific Reports. 8, 499 (2018).
- Stoppel, W. L., Kaplan, D. L., Black, L. D. Electrical and mechanical stimulation of cardiac cells and tissue constructs. Advanced Drug Delivery Reviews. 96, 135-155 (2016).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nature Methods. 10, 781-787 (2013).
- Barash, Y., et al. Electric field stimulation integrated into perfusion bioreactor for cardiac tissue engineering. Tissue Engineering Part C: Methods. 16, 1417-1426 (2010).
- Maidhof, R., et al. Biomimetic perfusion and electrical stimulation applied in concert improved the assembly of engineered cardiac tissue. Journal of Tissue Engineering and Regenerative Medicine. 6, 12-23 (2012).
- Feng, Z., et al. An electro-tensile bioreactor for 3-D culturing of cardiomyocytes. A bioreactor system that simulates the myocardium's electrical and mechanical response in vivo. IEEE Engineering in Medicine and Biology Magazine. 24 (4), 73-79 (2005).
- Wang, B., et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 29 (35), 11109-11117 (2013).
- Morgan, K. Y., Black, L. D. Mimicking isovolumic contraction with combined electromechanical stimulation improves the development of engineered cardiac constructs. Tissue Engineering Part A. 20 (11-12), 1654-1667 (2014).
- Godier-Furnémont, A. F., et al. Physiologic force-frequency response in engineered heart muscle by electromechanical stimulation. Biomaterials. 60, 82-91 (2015).
- Llucià-Valldeperas, A., et al. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cell Translational Medicine. 6 (3), 970-981 (2017).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Gelmi, A., et al. Direct Mechanical Stimulation of Stem Cells: A Beating Electromechanically Active Scaffold for Cardiac Tissue Engineering. Advanced Healthcare Materials. 5 (12), 1471-1480 (2016).
- Poulin, A., et al. An ultra-fast mechanically active cell culture substrate. Scientific Reports. 8 (1), 9895 (2018).
- Bayes-Genis, A., et al. Human progenitor cells derived from cardiac adipose tissue ameliorate myocardial infarction in rodents. Journal of Molecular and Cellular Cardiology. 49 (5), 771-780 (2010).
- Bagó, J. R., et al. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. International Journal of Cardiology. 169, 288-295 (2013).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
- Rosell Ferrer, F. X., Sánchez Terrones, B., Bragós Bardia, R., Bayés Genís, A., Llucià Valldeperas, A. Methods and devices for mechanical and electrical stimulation of stem cell monolayer and 3d cultures for tissue engineering applications. Spanish patent. , (2013).
- Bayés Genís, A., Llucià Valldeperas, A., Soler Botija, C., Bragós Bardia, R., Rosell Ferrer, F. X. Method for Conditioning Stem Cells. Spanish patent. , (2017).
- Roura, S., Gálvez-Montón, C., Bayes-Genis, A. Myocardial healing using cardiac fat. Expert Review of Cardiovascular Therapy. 16 (4), 305-311 (2018).
- Zhang, Y. M., Hartzell, C., Narlow, M., Dudley, S. C. Stem cell-derived cardiomyocytes demonstrate arrhythmic potential. Circulation. 106 (10), 1294-1299 (2002).
- Liu, J., Fu, J. D., Siu, C. W., Li, R. A. Functional sarcoplasmic reticulum for calcium handling of human embryonic stem cell-derived cardiomyocytes: insights for driven maturation. Stem Cells. 25 (12), 3038-3044 (2007).
- Wipff, P. J., et al. The covalent attachment of adhesion molecules to silicone membranes for cell stretching applications. Biomaterials. 30 (9), 1781-1789 (2009).
- Kim, C. iPSC technology--Powerful hand for disease modeling and therapeutic screen. Biochemistry and Molecular Biology Reports. 48 (5), 256-265 (2015).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-Chip: A Fast Track for Engineered Human Tissues in Drug Development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Bruyneel, A. A., McKeithan, W. L., Feyen, D. A., Mercola, M. Will iPSC-cardiomyocytes revolutionize the discovery of drugs for heart disease. Current Opinion inPharmacology. 42, 55-61 (2018).
- Farley, A., Johnstone, C., Hendry, C., McLafferty, E. Nervous system: part 1. Nursing Standard. 28 (31), 46-51 (2014).
- Brotto, M., Bonewald, L. Bone and muscle: Interactions beyond mechanical. Bone. 80, 109-114 (2015).
- Park, S. J., et al. Neurogenesis Is Induced by Electrical Stimulation of Human Mesenchymal Stem Cells Co-Cultured With Mature Neuronal Cells. Macromolecular Bioscience. 15 (11), 1586-1594 (2015).
- Vianney, J. M., Miller, D. A., Spitsbergen, J. M. Effects of acetylcholine and electrical stimulation on glial cell line-derived neurotrophic factor production in skeletal muscle cells. Brain Research. 1588, 47-54 (2014).
- Shima, A., Morimoto, Y., Sweeney, H. L., Takeuchi, S. Three-dimensional contractile muscle tissue consisting of human skeletal myocyte cell line. Experimental Cell Research. 370 (1), 168-173 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten