Method Article
Nucleótido y extracciones de proteínas de Caenorhabditis elegans
En este artículo
Resumen
Aquí, presentamos un protocolo para el aislamiento de RNA, DNA y proteínas de la misma muestra, en un esfuerzo por reducir la variación y mejorar la reproducibilidad, facilitar interpretaciones.
Resumen
Una muestra biológica contiene una gran cantidad de información, y ahora es una práctica común para investigar simultáneamente varias macromoléculas para capturar una imagen completa de los múltiples niveles de procesamiento molecular y los cambios entre diferentes condiciones. Este protocolo presenta el método de aislamiento de DNA, RNA, y proteínas de la misma muestra del nematodo Caenorhabditis elegans para eliminar la variación cuando estas biomoléculas están aisladas de repeticiones del trataron similar pero al final diferentes muestras. Ácidos nucleicos y proteínas se extraen de los nematodos mediante el método de extracción del tiocianato-fenol-cloroformo de guanidinio ácido, con posterior precipitación, lavado y solubilización de cada uno. Mostramos el aislamiento exitoso de RNA, DNA y proteínas de una muestra de tres cepas de nematodos y de las células HeLa, con mejores resultados de aislamiento de la proteína en los animales adultos. Además, Guanidinio tiocianato-fenol-cloroformo-extrajo proteína de nematodos mejora la resolución de las proteínas más grandes, con mayor niveles detectables como observado por immunoblotting, en comparación con la tradicional extracción RIPA de proteína.
El método presentado aquí es útil la investigación de las muestras con un enfoque multiomic, específicamente para la exploración del transcriptoma y proteoma. Técnicas que evalúan simultáneamente multiomics son atractivas debido a fenómenos biológicos complejos subyacentes señalización moleculares se piensa para ocurrir en niveles complementarios; sin embargo, se ha vuelto cada vez más común ver que los cambios en los niveles de mRNA no siempre reflejan el mismo cambio en los niveles de proteína y que el momento de la recogida es relevante en el contexto de regulaciones circadianas. Este método elimina cualquier variación intersample cuando ensayando diferentes contenidos dentro de la misma muestra (intrasample).
Introducción
Multiomics, el enfoque analítico que utiliza una combinación de ómicas, como genoma, proteoma, transcriptoma, epigenoma, microbioma o lipidome, se ha vuelto cada vez más popular al procesar grandes conjuntos de datos para caracterización de la enfermedad1, 2. Creciente evidencia ha demostrado que limitar enfoques a un solo "ome" proporciona un análisis molecular incompleto (revisado por Ensoli y Reif Motsinger1). Grandes conjuntos de datos son generados, particularmente al realizar pantallas usando técnicas de alto rendimiento, pero para pintar una imagen completa o para identificar los objetivos más relevantes, multiomic enfoques son preferibles. Con el uso de los enfoques multiomics, sin embargo, es la observación frecuente de las discrepancias entre el mRNA y proteína niveles3,4,5,6. En particular, mRNA y proteína utilizada para transcriptómicos de side-by-side y los análisis proteómicos con secuencia de RNA (RNAseq) y líquido cromatografía-tandem espectrometría de masas (LC-MS/MS), respectivamente, se obtienen a menudo de las muestras tratadas del mismo modo de diferentes repeticiones, potencialmente presentar variación entre los mismos condiciones3,4,5,6. Harvald et al realizaron un elegante gusanos C. elegans hambre tiempo-curso de estudios que compararon el transcriptoma y proteoma del tipo salvaje (WT) al de hlh-30 gusanos mutantes que carecen de un factor de transcripción importante en la longevidad 7. de la nota, el RNA y la proteína fueron extraídas las misma repeticiones de condición, no asi de la misma muestra. Sus hallazgos muestran una baja correlación entre los niveles de ARNm y niveles de proteína en cada momento (r = 0.559 a 0.628). De hecho, su heatmap formaron cuatro clusters: Cluster tuve una gran disminución de mRNA niveles pero poca o ninguna disminución en los niveles de la proteína correspondiente, Cluster II tenía poco o ningún aumento en los niveles de mRNA pero un aumento en los niveles de proteína, Cluster III tenían un aumento en el mRNA niveles pero una disminución en los niveles de proteína y Cluster IV tenía un aumento en los niveles de mRNA sino sólo un cambio sutil en los niveles de proteína4. Además, esta variación intersample puede introducirse en casos donde no se recogen las muestras de la misma condición en el momento exacto de la misma. Por ejemplo, mRNA y proteínas reguladas por el ciclo circadiano fluctúan dependiendo de la hora del día8,9, o, más concretamente, la exposición de C. elegans a luz9; expresión de estas proteínas circadianas puede retrasarse hasta 8 h después de la inducción de expresión de genes10. Sin embargo, la prevalencia de esta observación no significa necesariamente que está mal; de hecho, esto puede resultar informativo. Proteína y mRNA están en un estado dinámico constante entre formación y degradación. Por otra parte, las proteínas se modifican a menudo posttranslationally para aumentar estabilidad o inducir su degradación11. Por ejemplo, su condición de ubiquitinación puede conducir a la activación o la focalización al proteasoma o lisosoma para degradación12. Además, RNAs noncoding juegan un papel importante en la regulación de expresión génica en las etapas transcripcional y postranscripcional13. Así, la pregunta es cómo limitar las variables para confirmar que las diferencias que observamos en estos estudios nematodos son reales.
Aquí proponemos un método que elimina la variable intersample al permitir análisis de macromoléculas diferentes de la misma muestra. El objetivo de este protocolo es ofrecer un método para sistemáticamente aislar DNA, RNA y proteína de una muestra única de C. elegans (también conocido como lombrices) en un esfuerzo por reducir la variación y mejorar la reproducibilidad y facilitar interpretaciones. Beneficios adicionales del uso de la misma muestra incluyen el ahorro de tiempo y recursos durante la recogida de muestras, facilitando el análisis transversal de muestras valiosas y limitadas, incluyendo cepas que son difíciles de cultivar y mantener y ganando penetraciones en la regulación diferencial de macromoléculas basado en intrasample variaciones en los niveles de mRNA y proteína.
Este método es adecuado para evaluar expresiones de genes y los niveles de proteína de una sola muestra de gusanos, lo que permite una evaluación más amplia de varios niveles de procesamiento molecular. Guanidinio tiocianato-fenol-cloroformo (GTCp) reactivo14, un producto químico comúnmente utilizado para aislar RNA, se utiliza para la extracción de ácidos nucleicos y proteínas de las lombrices, con la posterior precipitación, lavado y solubilización de cada uno. Este protocolo es una compilación de varios protocolos15,16 con pequeñas modificaciones, diseñado con un enfoque en C. elegans, pero también con éxito hemos aislado RNA, proteínas y ADN de un pellet de células HeLa después de la mismos pasos. Aunque no probado aquí, este protocolo es probable trabajar en tejidos así17,18.
Protocolo
Nota: Cada paso de la precipitación de la macromolécula se realiza secuencialmente, seguido de lavado hecho simultáneamente; sin embargo, se recomienda completar el aislamiento del RNA primero ya que es intrínsecamente inestable.
1. muestras
- Semilla de 1.000 huevos de gusano por placa de 10 cm con las condiciones de crecimiento apropiado19. Incubar a 20 ° C por 72 h.
Nota: Bleach adultos huevo fértil para la recolección de huevos como se describió anteriormente19. - Lave la placa con unos 5 mL de buffer M9 y recoger 1.000 lombrices adultas en un tubo.
Nota: M9 buffer se compone de 35 mM fosfato de sodio dibásico, 102 mM cloruro sódico, 22 mM potasio fosfato monobásico y sulfato de magnesio de 1 mM de agua estéril19. - Centrifugue los gusanos a 1.000 x g durante 1 min, descartar el sobrenadante y transferir los gusanos concentrados con 1 mL de buffer M9 a un tubo de microcentrífuga de 1,5 mL.
- Centrifugar nuevamente a 845 x g durante 1 min y descartar la mayor parte del sobrenadante. Almacenar los alimentos peletizados gusanos a-80 ° C durante un mínimo de 4 h.
Nota: Usando un pellet congelado produce un mayor rendimiento que un fresco de la pelotilla. Se recomienda una serie de ciclos de congelación/descongelación usando líquido nitrógeno o 95% etanol en hielo seco para romper la cutícula del gusano si con una toronda de fresca. Dejando una pequeña cantidad de M9 en la pelotilla ayudará a romper la cutícula al congelar.
2. nucleótido y el aislamiento de la proteína
- Quite cualquier sobrenadante pellets descongeladas y añadir 1 mL de reactivo de GTCp frío. Mezclar por pipeteo arriba y abajo. Coloque la muestra en hielo durante 10 minutos y mezclar ocasionalmente girándolo boca abajo.
PRECAUCIÓN: El fenol es corrosivo, neurotóxico y altamente tóxico y puede causar quemaduras químicas y ceguera.
Nota: Utilizamos hasta 5.000 lombrices adultas como material de partida con los volúmenes reportados; cada volumen se basa en el uso de 1 mL de reactivo de GTCp. Al utilizar una muestra más grande, puede ser necesario escalar. - A la solución de gusanos y GTCp, añadir 200 μL de cloroformo frío. Sujete el tubo entre los dedos y sacudirlo vigorosamente para licencia s. 15 a temperatura ambiente (RT) durante 3 minutos.
PRECAUCIÓN: Cloroformo es un tóxico irritante, puede causar úlceras de la piel y otros daños de órgano blanco y es un posible carcinógeno. - Centrifugar el tubo a 13.500 x g durante 15 min a 4 ° C.
Nota: Se forman tres capas después de este giro: la parte superior, fase acuosa clara, la parte inferior, rosa fase orgánica y la interfase pequeña, nublada que contiene lípidos y ADN. - Usando una micropipeta, mover la capa superior clara (fase acuosa) a un nuevo libre de RNasa 1,5 mL tubo de microcentrífuga (tubo) para aislar RNA vía precipitación de alcohol (como se describe en el paso 2.5) y mover la capa rosa (fase orgánica) pellets restantes a un nuevo (tubo tubo B) y coloque en hielo.
Nota: La fase orgánica rosada puede ser congelada a-80 ° C hasta el aislamiento de DNA y proteínas a partir de esta muestra. Muestras más grandes producen una gruesa capa blanca entre la fase acuosa y orgánica. Esta fracción contiene ADN. Si esta capa se puede quitar sin molestar a las otras fases, hacerlo y ponerlo en un separado tubo (B2). -
Aislar el RNA como sigue.
- De la fase acuosa clara en tubo, precipitar el ARN con 500 μl de isopropanol al 100%. Incubar por 10 min a TA. Luego, centrifugar el tubo a 13.500 x g por 10 min a 4 ° C.
Nota: Una pelotilla blanca pequeña de ARN debe ser visible en la parte inferior del tubo. - Decantar la mayor parte del sobrenadante. Retire el resto con una jeringa de 1 mL con una aguja y descarte el sobrenadante.
Nota: El tamaño de la aguja no es importante; sin embargo, una aguja de calibre más grande ofrece más control para no perturbar el sedimento. Una micropipeta se puede utilizar si las agujas no están disponibles. - Añadir 1 mL de etanol al 75% a tubo para lavar el pellet. Girar el tubo a 5.300 x g durante 5 min a 4 ° C.
- Quite el sobrenadante pellets por decantación y utilizando una jeringa de 1 mL con una aguja, como se describe en el paso 2.5.2 y deséchela.
- Que el sedimento seque al aire durante 5-10 min, pero no deje que se seque en exceso. Utilizar 50 μl de agua libre de ARNasa a reconstituir el pellet de RNA antes de que sea totalmente transparente.
Nota: Se trata de un volumen adecuado a partir de 1.000 – 3.000 lombrices, pero puede necesitar ser ajustado dependiendo de cuánto material de partida se utilizó. - Incubar la pelotilla a 55 – 60 ° C durante 10 minutos para disolverla.
- Medir la concentración y la pureza utilizando un espectrofotómetro. Registrar la absorbancia a 260 nm para la concentración de RNA y en 230 y 280 nm para determinar impurezas.
- Limpie el ARN para quitar cualquier contaminante, tales como residuos de fenol o DNA, con la purificación de la columna o con etanol posteriores lavados y el tratamiento de DNasa.
Nota: En este punto, el ARN está listo para ser enviado para análisis RNAseq o puede ser utilizado para hacer cDNA para RT-qPCR (ver sección 3.1 para más detalles). RNA se puede almacenar a-80 ° C hasta su uso posterior.
- De la fase acuosa clara en tubo, precipitar el ARN con 500 μl de isopropanol al 100%. Incubar por 10 min a TA. Luego, centrifugar el tubo a 13.500 x g por 10 min a 4 ° C.
-
Aislar ADN como sigue.
- De la fase orgánica rosa en el tubo B y la muestra en tubo de B2, si los hubiere, precipitar el ADN agregando 300 μL de etanol al 100% y mezclar por inversión. Dejar los tubos a temperatura ambiente para 2 a 3 minutos.
- Centrifugue los tubos B y B2 en 375 x g durante 5 min a 4 ° C a pellet de DNA.
- Pasar el sobrenadante de los tubos B y B2 vertiendo en un nuevo tubo de 2 mL (tubo C) y dejar en hielo para el aislamiento de proteína posterior. Lavar el precipitado de DNA en el tubo B o B2 con 1 mL de citrato de sodio de 0.1 M en etanol al 10% para tubos de centrífuga de 30 min B y B2 en 375 x g durante 5 min a 4 ° C.
Nota: Sodio se une a la espina dorsal de la DNA, haciendo ADN precipitado más fácilmente en citrato de sodio y etanol, permitiendo que las impurezas al eliminarse por centrifugación a baja velocidad. - Repetir el lavado como se describe en el paso 2.6.3. Resuspender el precipitado en 1,5 mL de etanol al 75% y dejarlo a temperatura ambiente por 20 min, con mezcla ocasional por alteraba.
- Centrífuga del tubo B y B2 en 375 x g durante 5 min a 4 ° C.
- Deseche el sobrenadante y deje que se seque por 5 a 10 min.
- Disolver la pastilla en 150 μL de hidróxido de sodio 8 mM. Ajustar al pH deseado con HEPES si es necesario. Girar la muestra a 375 x g durante 5 min a 4 ° C.
- Usando una micropipeta, mueva el sobrenadante (DNA) a un tubo nuevo. Medir la concentración y determine la pureza utilizando un espectrofotómetro. Registrar la absorbancia a 260 nm para la concentración de ADN y en 230 y 280 nm para determinar impurezas.
-
Aislar la proteína como sigue.
- Para precipitar la proteína, añada hasta 1,5 mL de isopropanol al 100% al rosa sobrenadante en tubo, mezclar por inversión varias veces e incubar a temperatura ambiente durante 10 minutos.
- Centrifugar el tubo a 13.500 x g por 10 min a 4 ° C.
- Deseche el sobrenadante y lavar el sedimento con 2 mL de clorhidrato de la guanidina de 0,3 M en etanol al 95% durante 20 minutos en el tubo de centrífuga de ruta C a 5.300 x g durante 5 min a 4 ° C.
- Repetir el lavado, como se describe en el paso 2.7.3 x 2.
- Mover el precipitado de proteína a un nuevo tubo de 1,5 mL (tubo C2) y agregar hasta 1,5 mL de etanol al 95%. Vórtice y permiten sentarse a temperatura ambiente durante 20 minutos.
- Centrifugar el tubo C2 a 5.300 x g durante 5 min a 4 ° C. Deseche el sobrenadante y dejar el sedimento seco durante 10 minutos a RT. disolver el pellet en 300 μL de SDS 5% a 50 ° C durante 60 min.
Nota: Puede requerirse un tiempo de incubación para disolver completamente el precipitado de proteína. En el pasado, la pelotilla ha sido incubada por hasta 6 horas sin sacrificar la calidad. - Centrifugar el tubo C2 a 13.500 x g por 10 min a 17 ° C. Pasar el sobrenadante a un tubo nuevo.
- Medir la concentración usando un análisis de cuantificación de proteína recomendado: compatible con detergente.
Nota: La proteína está lista para ser utilizado en SDS-PAGE y western blot. Puede ser almacenado a-20 ° C para su uso futuro. Para otras técnicas, como LC-MS/MS, el detergente necesitará se dializaron apagado.
3. evaluación de ARNm y niveles de la proteína
-
RT-qPCR
- Preparación de ADNc por transcripción reversa con 1 ng de ARN, utilizando el siguiente protocolo termociclador: cebado (5 min a 25 ° C), transcripción inversa (20 min a 46 ° C) y la inactivación de RT (1 minuto a 95 ° C).
- Hacer un plato común de cDNA mediante la adición de 100 μl de las diluciones 1: 100 de cada muestra de cDNA para los pocillos de una placa de 96 pocillos. Incluyen controles apropiados, tales como no pozos plantilla/agua solamente y las muestras diluidas en serie de 1:25 1: 400 (se originó con los cDNA de todas las muestras analizadas) para permitir una curva estándar establecer la eficacia de la cartilla para cada gen analizado.
Nota: Este formato puede utilizarse con el microdispenser de 96 pocillos, que permite la transferencia de todas las muestras en una placa a una placa de RT-qPCR y la mitigación de variaciones de pipeteo de pozo a pozo. La mezcla principal apropiada (por ejemplo, SYBR + cartillas) se puede Agregar a cada uno bien después de eso, con una pipeta multicanal. En general, este enfoque reduce errores cuando mano-pipetear cada muestra, reduciendo aún más la variabilidad. - Agregar 3 μl de cDNA de la placa de acción en los pocillos de la placa de RT-qPCR.
- Hacer una mezcla maestra para cada juego de iniciadores que incluye supermix de x 1 que contiene un tinte de Cianina intercalantes de ADN, 5 μm de adelante y reversa cartillas y agua hasta 7 μl por muestra. Añadir 7 μl a los pocillos adecuados de una placa de RT-qPCR y agitar suavemente para mezclar.
Nota: Incluyen muestras para medir los genes housekeeping para utilizar como referencia para normalizar los resultados20. - Ejecute la placa usando un protocolo de RT-qPCR que es conveniente para los iniciadores que se utilizan.
-
Mancha blanca /negra occidental
Nota: Para obtener información detallada acerca de las manchas blancas /negras occidentales, consulte Mahmood y Yang21.- Preparar muestras para SDS-PAGE al combinar 20 μg de proteína con un volumen igual de 2 x Laemmli Sample Buffer y ebullición a 95 ° C durante 10 minutos.
- Las muestras en un gel de Tris glicina 4% – 15% de la carga y correr a 150 V durante 1 hora o hasta que el frente del tinte llega a la parte inferior del gel.
- Transferencia de proteínas desde el gel a una membrana de nitrocelulosa a 25 V durante 30 minutos en un aparato de transferencia semiseca.
- Confirmar a la transferencia apropiada por la coloración de la membrana con colorante Ponceau S.
- Lave muy bien la mancha de la membrana con solución salina tamponada con Tris (TBS) con 0,01% polisorbato 20 (TBS-T).
- Bloquear la membrana con 5% de leche descremada en TBS-T por 1 h a TA.
- Incubar la membrana el anticuerpo primario en la dilución según las recomendaciones del proveedor. Deja en el eje de balancín a 4 ° C durante la noche.
- Lavar la membrana 3 x, 5 minutos cada uno, con TBS-T.
- Incubar la membrana en el anticuerpo secundario correspondiente a la dilución apropiada según las recomendaciones del proveedor. Deja en el eje de balancín de 1 h a TA.
- Lavar la membrana 3 x, 5 minutos cada uno, con TBS-T.
- Imagen y cuantificar el western blot utilizando métodos preferidos.
Resultados
Se analizaron las muestras de RNA, DNA y proteínas, y se presentan aquí resultados representativos con los aislados de proteína y RNA. Además, comparamos la muestra de proteína cosechada usando el método de GTCp al RIPA común lisis método22. Para nuestro experimento, se utilizaron cuatro repeticiones independientes de cada gusanos WT (N2) y dos gusanos mutantes duraderos, 2 comer y rsks-123,24.
Calidad y la cantidad de ARN y ADN
La concentración de ARN cuando se resuspendió en 50 μl de agua osciló entre 0.2 a 2 μg/μl, utilizando alrededor de 3.000 adultos gusanos como materia prima. Los valores de absorbancia, que indican la pureza, variaron de 2.0 a 2.2 para A260/A280 y 1.9 a 2.5 para A260/A230 (tabla 1), indicando la exitosa extracción de ARN sin contaminación con componentes de GTCp, como fenol o guanidina clorhidrato.
La extracción de ADN fue exitosa, pero la calidad fue variable. La concentración de ADN cuando se resuspendió en 150 μL de NaOH varió de 0.04 a 1.1 μg/μl. Las proporciones de absorbancia oscilaron entre 1.8 y 2.1 de A260/A280 y 0.9 a 1.6 para A260/A230 (tabla 1), que indica la extracción exitosa de ADN; sin embargo, algunas de las muestras estaban contaminadas con componentes de GTCp, como fenol o guanidina clorhidrato. Si el ADN es necesario, debe tenerse cuidado cuando se separa la capa media de la separación de la fase de GTCp, y más lavados pueden ser necesarios.
RT-qPCR de objetivos seleccionados
El aislamiento de RNA de cuatro muestras independientes de cada cepa de gusano era acertado y fue enviado para análisis RNAseq, con posterior RT-qPCR realizado usando un supermix que contiene un tinte de Cianina. Objetivos analizados por RT-qPCR fueron seleccionados de una gran base de datos RNAseq basada en los genes regulados diferencialmente más común en ambos mutantes en comparación con los gusanos de la WT. F07C4.1225, un homólogo a humano neuroligin 3, isoforma b, era el objetivo seleccionado alza compartido. También incluimos un gen regulado diferencialmente entre ambos mutantes, mrp-126, para el análisis adicional, que se alza en 2 comer gusanos pero regulada en gusanos rsks-1 . Cambios de expresión de mrp-1 fueron confirmados mediante RT-qPCR; sin embargo, el upregulation F07C4.12 en rsks-1 gusanos predicha por el análisis RNAseq no fue visto por RT-qPCR (figura 1).
Objetivos adicionales con anticuerpos para gusanos investigaron así. Éstos incluyeron varios marcadores de organelas en Hadwiger et al27. Un número de estos marcadores se expresaron diferencialmente en el nivel de mRNA en los gusanos mutantes. Como se ve en la figura 1, lmp-128 y dlg-129 fueron upregulated en gusanos de comer-2 ; HSP-4 30, hsp-7030y lmp-1 son upregulated en gusanos rsks-1 ; HSP-60 31 y 7 pas32 fueron reguladas en gusanos de comer-2 ; HSP-60 y 1 tac33 fueron reguladas en gusanos rsks-1 .
Preparación de proteína simultánea vs RIPA
Para afirmar la eficiencia y la calidad de la proteína con el método de GTCp como se describió anteriormente, se compararon a la proteína recopilada mediante el método más tradicional de RIPA lisis22. Utilizando la misma cantidad de material, es decir, solo para adultos (aproximadamente 10.000 gusanos) o una población mixta de adultos, larvas y huevos (unos 130.000 gusanos), a partir de la cantidad total recogida con GTCp fue menor cuando se resuspendió en volúmenes iguales final (tabla 1 ); sin embargo, la extracción de una población de sólo para adultos era más acertada que de una población mixta. Además, la calidad de las proteínas fue similar, aunque la proteína extraída de GTCp demostró una mejor resolución de proteínas mayor a igual carga de la proteína total, como se muestra por tinción de Coomassie en la figura 2. De hecho, metas evaluadas por western blot en la figura 3 mostraron niveles similares en la mayoría de los casos; sin embargo, las proteínas más de 75 kDa demostraron niveles más bajos de la proteína extraída de RIPA en comparación con la proteína extraída de GTCp (Figura 3A, carril de la derecha; Barra de la figura 3B, amarillo).
También se evaluó el método de extracción que se presentan en la línea de células de mamífero HeLa. Para referencia, la cantidad de proteína extraída con RIPA un pellet compacto de células HeLa 6 millones (un pellet de ~ 25 μl) fue comparable a la que se extrae de una población mixta 130.000 de gusanos (un pellet compacto ~ 75 μL), o cerca de la mitad de lo que se extrae de 10.000 gusanos adultos (una ~ 100 μl gravedad-colocado de la pelotilla), como se ve en la tabla 1. Demostramos que la eficiencia de extracción de proteínas (tabla 1) y la resolución de las proteínas más grandes (figura 2) disminuyó en GTCp comparado con proteína extraída de RIPA en células HeLa, lo que sugiere que esta técnica funciona mejor en una población adulta de gusanos. La solubilización incompleta de la pelotilla de la proteína de la proteína extraída de GTCp HeLa puede ser una limitación de este método en células de mamíferos.
Immunoblotting objetivos analizados por RT-qPCR
A continuación, hemos investigado los niveles de proteína de los productos del gen por RT-qPCR para determinar si los niveles de mRNA correlacionaron con los niveles de proteína. Como se ve en la figura 3, los cambios de medio de expresión de la proteína se correlacionan con las expresiones de mRNA promedio cambiadas para muchos objetivos; sin embargo, algunos niveles de proteína no reflejaba los cambios en los niveles de mRNA. A menudo, los niveles de mRNA en 2 comer gusanos eran superiores a los de las otras cepas, pero los niveles de proteína fueron igual o menor que las otras cepas del mismo objetivo. La observación más destacada fue el niveles muy altos de dlg-1 mRNA en 2 comer gusanos, que no se traducen a la proteína de más; de hecho, hubo menor dlg-1 niveles de proteína en comparación con las otras cepas (figura 3).
Finalmente, los niveles de la proteína extraída de GTCp y la proteína extraída de RIPA mostraron una notable diferencia. El ARN fue extraído de la misma manera para ambos; sin embargo, la muestra similar pero separada por RIPA lisis mostró marcado reducido niveles de la proteína, particularmente para los más de 75 kDa (Figura 3A, carril de la derecha; Barra de la figura 3B, amarillo).
Intrasample comparación de los niveles de mRNA y proteína
Uno de los objetivos de este protocolo fue determinar si la variación que vimos en el mRNA y proteína era real, o si pudiera ser un artefacto de la variación intersample. En la figura 4, se comparó con un subconjunto de objetivos dentro de las muestras individuales. Cada muestra individual se muestra como la misma sombra y color del punto, con la muestra 1 es la sombra más oscura y muestra 4 como la más ligera sombra de gris (WT), azul (comer-2), rojo (rsks-1). En la mayoría de las muestras, hubo una baja variabilidad de los niveles de mRNA, con una mayor variabilidad en el nivel de proteína, una falla potencial del análisis semicuantitativo de las manchas blancas /negras occidentales. Al mirar la posición de cada uno de los puntos de color entre los pares de mRNA y proteína, el orden de mayor a menor frecuencia no coincide con; por ejemplo, en peso, del orden de mRNA de hsp-60 fue muestra 4, 3, 2, 1, pero los niveles de proteína fueron 1, 2, 3, 4. Así, desde luego, existen diferencias entre los niveles de mRNA y proteína dentro de una muestra, pero el método presentado permite a los usuarios eliminar el tiempo de colección como una posible fuente de la diferencia observada.
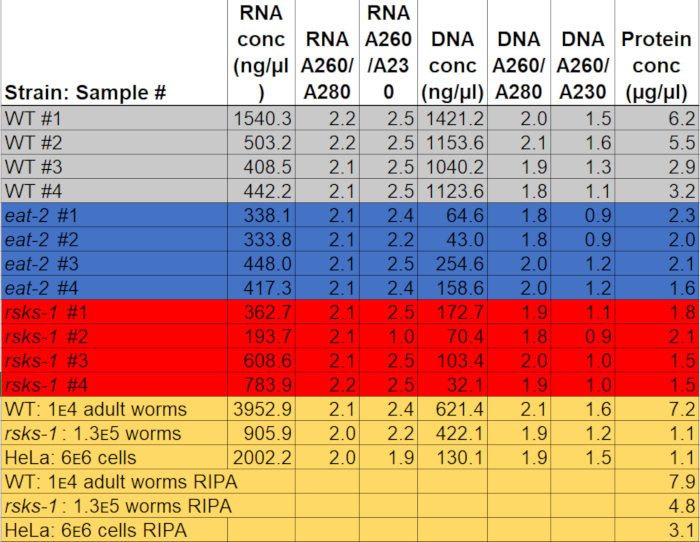
Tabla 1: concentraciones y proporciones de absorción. Las concentraciones de ARN y ADN y proporciones de pureza se midieron en un espectrofotómetro. Se determinaron las concentraciones de la proteína usando un análisis de cuantificación de proteína colorimétrica. El gris, azul y rojo destacan las muestras utilizadas para RT-qPCR y western blot. El amarillo indica que las muestras utilizadas para comparar GTCp extracción de proteínas RIPA o gusano de proteína a proteína de HeLa. Haga clic aquí para descargar este archivo.
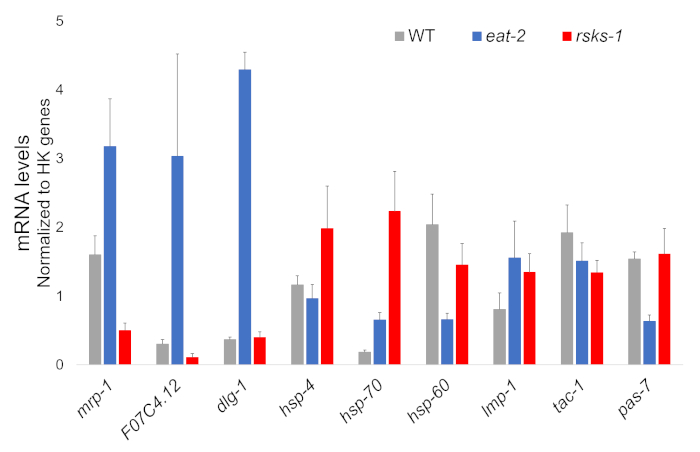
Figura 1: expresión génica por RT-qPCR. Análisis de RT-qPCR para el ARNm obtenida por este método, confirmando los objetivos identificados de RNAseq datos y de genes marcadores de organelas. Las barras de error representan la desviación estándar. n = 4. La concentración de mRNA se definió contra una curva estándar para cada juego de iniciadores. Todos los niveles de mRNA fueron normalizados a la media de un conjunto de seis genes housekeeping utilizado como genes de la referencia, act-1, cdc-42, ama-1, nhr-23, pmp 3y cyn-1. Haga clic aquí para ver una versión más grande de esta figura.
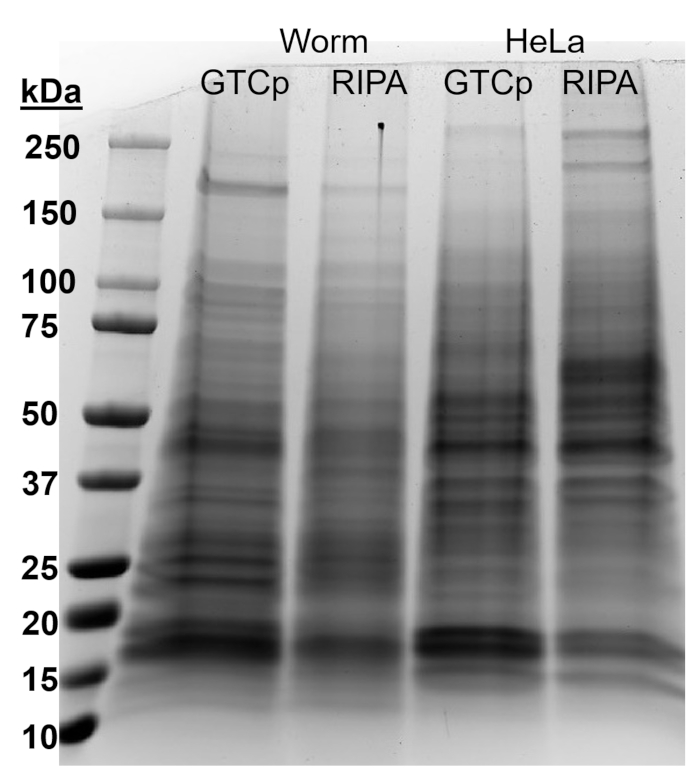
Figura 2: comparación de GTCp-versus proteína extraída de RIPA en gusanos y células HeLa. Proteína total de tipo salvaje (WT) gusanos o HeLa células cosechadas mediante el método de lisis GTCp o RIPA, separadas por SDS-PAGE y teñidas con azul de Coomassie. Cada compartimento contiene 25 μg de proteínas totales. Haga clic aquí para ver una versión más grande de esta figura.
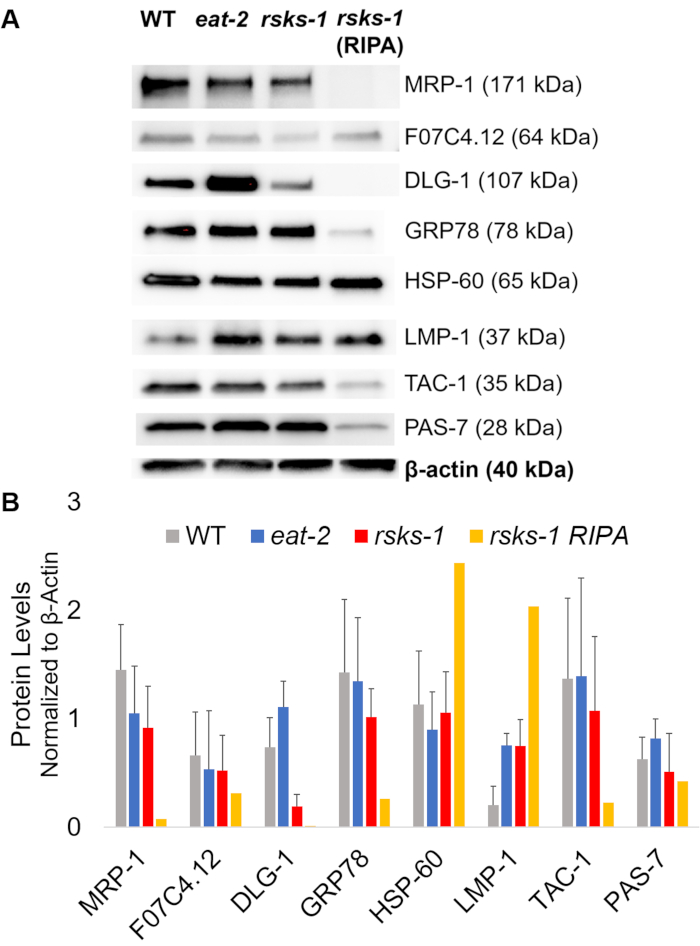
Figura 3: niveles de proteína en gusanos de. (A) Western blot de objetivos investigados por RT-qPCR y (B) análisis de densitometría de la intensidad de la señal. Cada compartimento contiene 20 μg de la proteína total extraído de GTCp de tipo salvaje (WT), 2 comero gusanos mutantes rsks-1 . La imagen es una representación de cuatro repeticiones independientes por cepa de gusano. Β-actina (abajo) se utilizó para el control de igual carga de cada destino; solamente un grupo representativo se muestra. Carril de la derecha contiene 20 μg de la proteína total extraído de RIPA de gusanos mutantes rsks-1 . (B) intensidades de la señal correspondiente se cuantificaron con ImageJ. Las barras de error representan la desviación estándar. n = 4. Haga clic aquí para ver una versión más grande de esta figura.
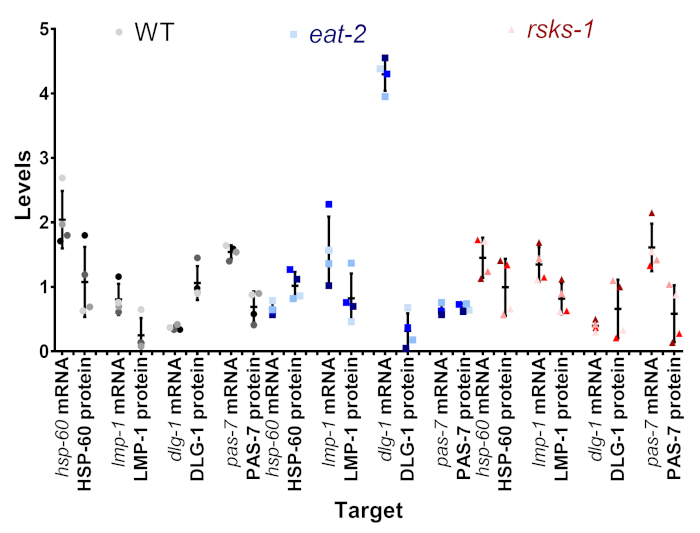
Figura 4: comparación de nivel Intrasample mRNA y proteína. Se alinean los niveles de mRNA y proteína de las muestras individuales de un subconjunto de objetivos para cada cepa. El color es el representante de la tabla 1. Gris/negro es WT, el azul es comer-2, y el rojo es rsks-1. mRNA y proteína de la misma meta son emparejados al lado del otro y separados por cepa nematodo. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Métodos para el aislamiento de biomoléculas, como ADN, ARN y proteínas, se optimizan a menudo sin superposición técnica o combinaciones. Esto es particularmente desfavorable cuando las muestras son difíciles de obtener, que podría conducir a la recolección de muestras en las mismas condiciones en diferentes momentos. Dependiendo de las vías celulares, repeticiones recogidas en diferentes momentos pueden generar variación. Este manuscrito ofrece un procedimiento para evadir este obstáculo permitiendo el concurrente aislamiento y purificación de cada biomolécula de la misma muestra de gusanos, reduciendo las variaciones introducidas por técnicas de aislamiento diferentes, el momento de la cosecha de la muestra, o recolección desigual. Controlar estas variables no sólo ahorra tiempo y recursos, pero también facilita la reproducibilidad. Aquí, demostramos una aproximación combinatoria que evita comprometer RNA y proteína calidad, aunque con resultados variables con el ADN. Preparaciones se pueden optimizar más lejos usando la DNA procedimientos de limpieza. Hemos demostrado el acercamiento usando material de las células del nematodo C. elegans y HeLa.
Anterior trabajo explorando el transcriptoma y el proteoma de N2 WT animales y comer 2 y rsks-1 mutantes han ofrecido una visión varias vías, incluyendo mecanismos que amplían la vida útil4,34,35 ,36. En un esfuerzo para investigar el mecanismo de restricción calórica en la extensión de vida útil, un isótopo estable de etiquetado por/con los aminoácidos en la célula (SILAC) la cultura análisis encontró que comer-2 gusanos tienen una desregulación total de síntesis de la proteína global 36. los datos presentados aquí están consistentes con este hallazgo, así como los niveles de mRNA de los objetivos de la misma se incrementaron. Otro grupo pretende identificar los determinantes de la longevidad S6K-mediada y, por lo tanto, realiza una pantalla de Proteómica de rsks-1 gusanos34. De los datos RNAseq con el presente estudio, se identificaron al menos tres genes que corroboran con proteínas identificadas desde esta pantalla; MRP-1 y homólogos de CPA y neuroligin (F07C4.12) fueron descubiertos como diferencialmente expresados en rsks-1 gusanos en comparación con N2 WT34.
Los datos generados mediante este método están consistentes con investigaciones anteriores del multiomic. Los niveles de mRNA de nueve objetivos fueron usados para predecir los niveles de proteína en cada muestra. De estos objetivos, muchos tenían niveles de proteína predecible basados en los niveles de mRNA. No obstante, hubo notables discrepancias entre los niveles de mRNA y proteína. Lo importante es el protocolo que presentamos permite a los científicos con confianza evaluar e interpretar estas diferencias mediante la eliminación de variabilidad intersample por la recogida de mRNA y proteína de la misma muestra. Además, se compararon los niveles de mRNA para los niveles de proteína obtenidos de la misma muestra o recogida de una muestra similar pero diferente con RIPA. Demostramos que para varios de los objetivos, hubo niveles mucho más bajos de proteína en la muestra extraída de RIPA. Sin controlar la variación intersample, sería imposible saber si esta diferencia era debido a la regulación diferencial de mRNA y proteína.
Es importante tener en cuenta que hay protocolos optimizados específicamente para estas macromoléculas diferentes, así que si un análisis transversal no es el objetivo final del experimento, sería pertinente emplear estos métodos en su lugar. Utilizando GTCp para aislar DNA y proteínas les hace ser menos solubles, que requiere la reconstitución de la DNA en una base débil, como el NaOH y solubilizar la proteína en un tampón con una alta concentración de detergente con la calefacción, a riesgo de incompleto solubilización. Además, GTCp contiene tiocianato de guanidinio y ácido fenol, que inactiva las enzimas como las proteasas, pero poco a poco degrada proteína con el tiempo a menos que los congelados. Será a la discreción del investigador para decidir si la acción de eludir estas limitaciones será que vale la pena.
Lo importante, al trabajar con ARN, una técnica estéril, manteniendo la muestra en hielo a menos que se indique lo contrario y el uso de descontaminación disponibles comercialmente reactivo recomienda que mantenga intacto el ARN. En particular, muestras más grandes necesitarán GTCp más, en el cual cada solvente de extracción también tendrá que ampliarse. Este protocolo no requiere cualquier manual de homogeneización de las muestras de gusano o de la célula cuando se utiliza la cantidad correcta de GTCp. En el contexto de aislamiento de ADN, el rendimiento es altamente dependiente de la habilidad para recuperar la capa orgánica (color rosa). Por último, para mejorar la solubilización de las proteínas durante el aislamiento, aumentando el volumen de tampón resolubilización o añadiendo otros detergentes además SDS puede ser necesario. De hecho, las proteínas de una población de sólo para adultos de gusanos en vez de una mezcla de adultos, larvas y huevos son más fáciles de resolubilize.
En general, mediante este protocolo proporciona un enfoque integrado para aislamientos de biomoléculas y facilita la interpretación de las correlaciones, o falta de ella, entre los niveles de mRNA y proteína que pueden surgir de recolección por separado de biomoléculas de diferente muestras. Este método puede ayudar a los científicos a identificar correctamente los casos en que la traducción del mRNA a la proteína no es correlativa y puede conducir a la investigación más profunda de los mecanismos de regulación postranscripcional y postraduccionales en diversas condiciones.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
L.R.L. fue financiado por subvenciones de NIH/NIA (R00 AG042494 y R01 AG051810), un Glenn Foundation para Premio de investigación médica para la investigación en los mecanismos biológicos del envejecimiento y una beca de la Facultad de Junior de la Federación Americana para la investigación del envejecimiento. Los autores desean agradecer a Anita Kumar y Shi Quan Wong por sus útiles comentarios en la redacción de este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 4–15% Mini-PROTEAN® TGX Stain-Free™ Protein Gels | BIORAD | 4568084 | |
| Antibodies: | |||
| CePAS7-s | DHSB- U of Iowa | ||
| CeTAC1-s | DHSB- U of Iowa | ||
| DLG1-s | DHSB- U of Iowa | ||
| GRP78 | Novus Bio. | NBp1-06274 | |
| HRP Goat Anti-Mouse | Li-Cor | 926-80010 | |
| HRP Goat Anti-Rabbit | Li-Cor | 92680011 | |
| HSP60-s | DHSB- U of Iowa | ||
| LMP1-s | DHSB- U of Iowa | ||
| MRP-1 | Abcam | ab24102 | |
| Neuroligin 3 | Abcam | ab172798 | |
| β-actin | Millipore | MAB1501R | |
| ChemiDoc MP Imaging System | BIORAD | ||
| Chloroform | Fisher | C298-500 | Health hazard, Irritant, Toxic |
| Coomassie Brilliant Blue | ThermoSci | 20279 | |
| DC Protein assay | BIORAD | 500-0116 | |
| Epoch 2 microplate reader | BioTek | ||
| Ethanol (200 proof) | Fisher | 04-355-223 | Flammable, health hazard |
| HeLa cells | ATCC | CCL-2 | BSL2 |
| iScript Reverse Transcription Supermix | BIORAD | 1708840 | |
| Hydra microdispenser: Matrix Hydra | Robbins/ThermoFisher | ||
| Isopropanol | Fisher | A516-4 | Flammable, health hazard |
| M9 buffer: 3 g KH2PO4 6 g Na2HPO4 5 g NaCl Add H2O to 1 liter. Sterilize by autoclaving. After solution cools down, add 1 mL sterile 1 M MgSO4 | |||
| Laemmli Sample Buffer (2x) | BIORAD | 161-0737 | |
| NanoDrop One | ThermoSci | ||
| PAGE apparatus | BIORAD | ||
| Ponceau S | Alfa Aesar | J60744 | |
| Primers | IDT | 25 nmole DNA Oligo with Standard Desalting | |
| dlg-1: F (5'-GGTCCTACCA GGCAGTTGAG-3') R (5'-CACGTCCGTT AACCTCTCCC-3') | |||
| hsp-4: F (5'-AGAGGGCTTT GTCAACCCAG-3') R (5'-TCGTCAGGGT TGATTCCACG-3') | |||
| hsp-70: F (5'-CGGCATGTGA ACGTGCTAAG-3') R (5'-GAGCAGTTGA GGTCCTTCCC-3') | |||
| hsp-60: F (5'-ATTGAGCAAT CGACGAGCGA-3') R (5'-CAACACCTCC TCCTGGAACG-3') | |||
| lmp-1: F (5'-ACAACAACAC CGGACTCACG-3') R (5'-ATCGAGCTCC CACTCTTTGG-3') | |||
| tac-1: F (5'-AGTGGCAGGC AAAGTTCCTC-3') R (5'-TGAGCACCTT GATCTCGTCG-3') | |||
| pas-7: F (5'-GTACGCTCAA AAGGCTGTCG-3') R (5'-CTGAATCGGC ATTGGCTCAC-3') | |||
| mrp-1: F (5'-TTTGCCTTGC GCTTGTTCTG-3') R (5'-AGTTCCAGTG CGGAGCATAC-3') | |||
| F07C4.12: F (5'-TGCTGAGCAT GAAGGACTGT-3') R (5'-TGGCAATAGC TCCTCCGTTG-3') | |||
| HK Actin: F (5'-CTACGAACTT CCTGACGGACAAG-3') R (5'-CCGGCGGACT CCATACC-3') | |||
| HK cyn-1: F (5'-GTGTCACCAT GGAGTTGTTC-3') R (5'-TCCGTAGATT GATTCACCAC-3') | |||
| HK nhr-23: F (5'-CAGAAACACT GAAGAACGCG-3') R (5'-CGATCTGCAG TGAATAGCTC-3') | |||
| HK ama-1: F (5'-TGGAACTCTG GAGTCACACC-3') R (5'-CATCCTCCTT CATTGAACGG-3') | |||
| HK cdc-42: F (5'-CTGCTGGACA GGAAGATTACG-3') R (5'-CTCGGACATT CTCGAATGAAG-3') | |||
| HK pmp-3: F (5'-GTTCCCGTGT TCATCACTCAT-3') R (5'-ACACCGTCGA GAAGCTGTAGA-3') | |||
| LightCycler 96 qPCR machine | Roche | ||
| RIPA buffer: 10 mM Tris-Cl (pH 8.0) 1 mM EDTA 1% Triton X-100 0.2% SDS 140 mM NaCl 1 tablet of Roche protease inhibitor per 20 mL | |||
| SsoAdvanced Universal SYBR Supermix | BIORAD | 1725274 | |
| SuperSignal West Femto Max Sens Substrate | ThermoSci | 34095 | |
| Trans-Blot Transfer apparatus | BIORAD | ||
| Trans-Blot Turbo Transfer Pack | BIORAD | 170-4159 | |
| TRIzol reagent | Invitrogen | 15596026 | Health hazard (skin, eyes) |
| Worm strains: | Caenorhabditis Genetics Center (CGC) | ||
| N2 (wild type) | Caenorhabditis Genetics Center (CGC) | ||
| eat-2 (MAH95) | Caenorhabditis Genetics Center (CGC) | ||
| rsks-1 (VB633) | Caenorhabditis Genetics Center (CGC) |
Referencias
- Rotroff, D. M., Motsinger-Reif, A. A. Embracing Integrative Multiomics Approaches. International Journal of Genomics. 2016, 1715985 (2016).
- Chen, R., Snyder, M. Promise of personalized omics to precision medicine. Wiley Interdisciplinary Reviews: System Biology and Medicine. 5 (1), 73-82 (2013).
- Anderson, L., Seilhamer, J. A comparison of selected mRNA and protein abundances in human liver. Electrophoresis. 18 (3-4), 533-537 (1997).
- Harvald, E. B., et al. Multi-omics Analyses of Starvation Responses Reveal a Central Role for Lipoprotein Metabolism in Acute Starvation Survival in C. elegans. Cell Systems. 5 (1), (2017).
- Griffin, T. J., et al. Complementary profiling of gene expression at the transcriptome and proteome levels in Saccharomyces cerevisiae. Molecular and Cell Proteomics. 1 (4), 323-333 (2002).
- Greenbaum, D., Colangelo, C., Williams, K., Gerstein, M. Comparing protein abundance and mRNA expression levels on a genomic scale. Genome Biology. 4 (9), 117 (2003).
- Lapierre, L. R., et al. The TFEB orthologue HLH-30 regulates autophagy and modulates longevity in Caenorhabditis elegans. Nature Communications. 4, 2267 (2013).
- Doherty, C. J., Kay, S. A. Circadian control of global gene expression patterns. Annual Reviews Genetics. 44, 419-444 (2010).
- Goya, M. E., Romanowski, A., Caldart, C. S., Benard, C. Y., Golombek, D. A. Circadian rhythms identified in Caenorhabditis elegans by in vivo long-term monitoring of a bioluminescent reporter. Proceedings of the National Academy of Sciences USA. 113 (48), E7837-E7845 (2016).
- Dalvin, L. A., Fautsch, M. P. Analysis of Circadian Rhythm Gene Expression With Reference to Diurnal Pattern of Intraocular Pressure in Mice. Investigative Ophthalmology and Visual Science. 56 (4), 2657-2663 (2015).
- Narayanan, A., Jacobson, M. P. Computational studies of protein regulation by post-translational phosphorylation. Current Opinion in Structural Biology. 19 (2), 156-163 (2009).
- Swatek, K. N., Komander, D. Ubiquitin modifications. Cell Research. 26 (4), 399-422 (2016).
- Cech, T. R., Steitz, J. A. The noncoding RNA revolution-trashing old rules to forge new ones. Cell. 157 (1), 77-94 (2014).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Triant, D. A., Whitehead, A. Simultaneous Extraction of High-Quality RNA and DNA from Small Tissue Samples. Journal of Heredity. 100 (2), 246-250 (2009).
- Liu, X., Harada, S. RNA Isolation from Mammalian Samples. Current Protocols in Molecular Biology. 103 (1), 11-14 (2013).
- Hummon, A. B., Lim, S. R., Difilippantonio, M. J., Ried, T. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage. Biotechniques. 42 (4), 467-470 (2007).
- Kopec, A. M., Rivera, P. D., Lacagnina, M. J., Hanamsagar, R., Bilbo, S. D. Optimized solubilization of TRIzol-precipitated protein permits Western blotting analysis to maximize data available from brain tissue. Journal of Neuroscience Methods. 280, 64-76 (2017).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Hoogewijs, D., Houthoofd, K., Matthijssens, F., Vandesompele, J., Vanfleteren, J. R. Selection and validation of a set of reliable reference genes for quantitative sod gene expression analysis in C. elegans. BMC Molecular Biology. 9 (1), 9 (2008).
- Mahmood, T., Yang, P. -. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Peach, M., Marsh, N., MacPhee, D. J., Kurien, B. T., Scofield, R. H. Protein solubilization: Attend to the choice of lysis buffer. Protein Electrophoresis: Methods and Protocols. , 37-47 (2012).
- Lakowski, B., Hekimi, S. The genetics of caloric restriction in Caenorhabditis elegans. Proceedings of the National Academy of Science USA. 95 (22), 13091-13096 (1998).
- Pan, K. Z., et al. Inhibition of mRNA translation extends lifespan in Caenorhabditis elegans. Aging Cell. 6 (1), 111-119 (2007).
- Gaudet, P., Livstone, M. S., Lewis, S. E., Thomas, P. D. Phylogenetic-based propagation of functional annotations within the Gene Ontology consortium. Briefings in Bioinformatics. 12 (5), 449-462 (2011).
- Broeks, A., Gerrard, B., Allikmets, R., Dean, M., Plasterk, R. H. Homologues of the human multidrug resistance genes MRP and MDR contribute to heavy metal resistance in the soil nematode Caenorhabditis elegans. The EMBO Journal. 15 (22), 6132-6143 (1996).
- Hadwiger, G., Dour, S., Arur, S., Fox, P., Nonet, M. L. A Monoclonal Antibody Toolkit for C. elegans. PLoS One. 5 (4), e10161 (2010).
- Kostich, M., Fire, A., Fambrough, D. M. Identification and molecular-genetic characterization of a LAMP/CD68-like protein from Caenorhabditis elegans. Journal of Cell Science. 113 (14), 2595 (2000).
- Firestein, B. L., Rongo, C. DLG-1 is a MAGUK similar to SAP97 and is required for adherens junction formation. Molecular Biology of the Cell. 12 (11), 3465-3475 (2001).
- Heschl, M. F., Baillie, D. L. Characterization of the hsp70 multigene family of Caenorhabditis elegans. DNA. 8 (4), 233-243 (1989).
- Yoneda, T., et al. Compartment-specific perturbation of protein handling activates genes encoding mitochondrial chaperones. Journal of Cell Science. 117 (18), 4055 (2004).
- Takahashi, M., Iwasaki, H., Inoue, H., Takahashi, K. Reverse Genetic Analysis of the Caenorhabditis elegans 26S Proteasome Subunits by RNA Interference. Biological Chemistry. 383, 1263 (2002).
- Le Bot, N., Tsai, M. C., Andrews, R. K., Ahringer, J. TAC-1, a regulator of microtubule length in the C. elegans embryo. Current Biology. 13 (17), 1499-1505 (2003).
- McQuary, P. R., et al. C. elegans S6K Mutants Require a Creatine-Kinase-like Effector for Lifespan Extension. Cell Reports. 14 (9), 2059-2067 (2016).
- Larance, M., et al. Global Proteomics Analysis of the Response to Starvation in C. elegans . Molecular and Cell Proteomics. 14 (7), 1989-2001 (2015).
- Yuan, Y., et al. Enhanced energy metabolism contributes to the extended life span of calorie-restricted Caenorhabditis elegans. Journal of Biological Chemistry. 287 (37), 31414-31426 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados