Method Article
Kombinierte Nukleotid- und Protein Extraktionen in Caenorhabditis elegans
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll für die Isolierung von RNA, DNA und Proteine aus der gleichen Probe in einer Bemühung zu reduzieren Variation, Verbesserung der Reproduzierbarkeit und Interpretationen zu erleichtern.
Zusammenfassung
Eine einzige biologische Probe hält eine Fülle von Informationen, und es ist jetzt üblich, gleichzeitig mehrere Makromoleküle um ein vollständiges Bild über die mehrere Ebenen von molekularen Verarbeitung und wechselt zwischen verschiedenen Bedingungen erfassen zu untersuchen. Dieses Protokoll stellt die Methode zur Isolierung von DNA, RNA, und Protein aus der gleichen Probe der Fadenwurm Caenorhabditis Elegans , entfernen die Variante eingeführt, wenn diese Biomoleküle von Wiederholungen von isoliert sind ähnlich aber letztlich behandelt verschiedene Proben. Nukleinsäuren und Proteinen sind die Nematoden mit der Säure Guanidinium-Thiocyanat-Phenol-Chloroform Extraktion-Methode, mit anschließenden Niederschlag, Wasch- und Solubilisierung der einzelnen entzogen. Wir zeigen die erfolgreichen Isolierung von RNA, DNA und Proteine aus einer einzigen Probe aus drei Stämme von Nematoden und HeLa-Zellen, mit besseren Ergebnissen der Protein-Isolierung bei erwachsenen Tieren. Darüber hinaus verbessert Guanidinium-Thiocyanat-Phenol-Chloroform extrahiert Protein von Nematoden die Auflösung der größere Proteine mit verstärkten nachweisbaren Konzentrationen wie Immunoblotting, im Vergleich zu den traditionellen RIPA Extraktion des Proteins beobachtet.
Die hier vorgestellte Methode ist nützlich bei der Untersuchung von Proben mit einem Multiomic Ansatz, speziell für die Erforschung des Proteoms und Transkriptom. Techniken, die gleichzeitig Multiomics zu bewerten sind attraktiv, weil molekulare Signalisierung zugrunde liegende komplexe biologische Phänomene wird gedacht, um auf ergänzenden Ebenen erfolgen; jedoch ist es geworden, immer häufiger zu sehen, dass Veränderungen der mRNA-Niveaus nicht immer die gleiche Änderung in Protein-Ebene widerspiegeln und die Sammlung im Zusammenhang mit der circadianen Vorschriften relevant ist. Diese Methode entfernt intersample Abweichungen, wenn unterschiedliche Inhalte innerhalb der gleichen Probe (intrasample.) prüfen
Einleitung
Multiomics, der analytische Ansatz, die verwendet eine Kombination von Omics wie Genom, Proteom, Transkriptom, Epigenom, Microbiome oder Lipidome, immer beliebter geworden, bei der Verarbeitung von großen Datenmengen für Krankheit Charakterisierung1, 2. Montage Beweise hat gezeigt, dass die Begrenzung der Ansätze zu einem einzigen "Ome" stellt eine unvollständige molekulare Analyse (rezensiert von Rotroff und Motsinger-Reif1). Großer Datenmengen entstehen, besonders bei Bildschirmen mit Hochdurchsatz-Techniken, sondern um ein vollständiges Bild zu malen oder zu die wichtigsten Zielen identifizieren, Multiomic Ansätze sind vorzuziehen. Mit dem Einsatz von Multiomics Ansätzen ist jedoch die häufige Beobachtung von Diskrepanzen zwischen mRNA und Protein Ebenen3,4,5,6. Vor allem, mRNA und Protein verwendet für Side-by-Side-transkriptomischen und Proteomic Analysen mit RNA Sequenzierung (RNAseq) und flüssige Chromatographie-Tandem-Massenspektrometrie (LC-MS/MS), bzw. oft in ähnlicher Weise behandelten Proben aus stammen von verschiedenen Wiederholungen, potenziell Einführung Variation zwischen denselben Bedingungen3,4,5,6. Harvald Et Al. durchgeführt ein elegantes Würmer C. Elegans Hunger Zeitverlauf Studie, die die Transkriptom und Proteom der Wildtyp (WT) verglichen mit der Hlh-30 mutierten Würmer, die einen wichtigen Transkriptionsfaktors in Langlebigkeit fehlt 7. Note, RNA und Proteine aus der gleichen Bedingung repliziert, also nicht aus der gleichen Probe geerntet wurden. Ihre Ergebnisse zeigen eine geringe Korrelation zwischen der mRNA-Niveaus und Proteingehalt zu jedem Zeitpunkt (R = 0.559, 0.628). In der Tat ihre Heatmap bildeten vier Cluster: Cluster, ich hatte einen starken Rückgang der mRNA Niveaus aber wenig oder gar keine Abnahme der entsprechenden Proteingehalte, Cluster II hatte wenig oder gar keine Erhöhung in mRNA-Niveaus aber ein Anstieg der Proteingehalte, Cluster III hatte eine Erhöhung in mRNA Ebenen, aber eine Abnahme der Proteingehalt und Cluster IV hatte eine Zunahme der mRNA-Niveaus aber nur eine subtile Veränderung im Protein Level4. Darüber hinaus kann diese intersample Variante in Fällen eingeführt werden, wo die Proben des gleichen Zustand nicht an der exakt gleichen Zeit gesammelt werden. Zum Beispiel schwanken mRNA und Proteine, die durch die circadiane Zyklus reguliert je nach zum Zeitpunkt der Tag8,9, oder genauer gesagt, die Exposition von C. Elegans , leichte9; Ausdruck dieser circadianen Proteine kann bis zu 8 h nach gen Ausdruck Induktion10verzögert werden. Dennoch bedeutet die Prävalenz dieser Beobachtung nicht notwendigerweise, dass es falsch ist; in der Tat, könnte dies informativ sein. Protein- und mRNA sind in einem ständigen dynamischen Zustand zwischen Bildung und Abbau. Proteine sind darüber hinaus häufig posttrans-zur Erhöhung der Stabilität oder induzieren ihre Abbau-11geändert. Zum Beispiel kann ihr Ubiquitination Status Aktivierung oder Ausrichtung auf das Proteasom oder Lysosomen für Abbau12führen. Forensisches RNAs spielen darüber hinaus eine wichtige Rolle bei der Regulierung der Genexpression an der transcriptional und posttranskritionelle Stufe13. So ist die Frage, wie zur Begrenzung der Variablen um zu bestätigen, dass die Unterschiede, die wir in diesen Nematoden Studien beobachten real sind.
Hier schlagen wir eine Methode, die intersample Variable ermöglicht Analysen verschiedener Makromoleküle aus derselben Probe entfernt. Das Ziel dieses Protokolls ist es, bieten eine Methode zur Isolierung konsequent DNA, RNA und Proteine aus einer einzigen Probe von C. Elegans (auch als Würmer bezeichnet) in einer Bemühung zu reduzieren Variation, Reproduzierbarkeit und Interpretationen zu erleichtern. Zusätzliche Vorteile der Verwendung der gleichen Probe sind die Einsparung von Zeit und Ressourcen während der Probenentnahme, Erleichterung der Querschnittsanalyse der wertvolle und begrenzte Proben, einschließlich der Stämme, die schwierig zu wachsen und zu pflegen, und gewinnt Einblicke in die differenzierte Regelung von Makromolekülen, die anhand von intrasample Varianten in mRNA und Protein Ebenen.
Diese Methode eignet sich für die Bewertung gen Ausdrücke und Proteingehalt aus einer einzigen Stichprobe von Würmern, so dass für eine umfassendere Bewertung von mehreren Ebenen der molekularen Verarbeitung. Guanidinium Thiocyanat-Phenol-Chloroform (GTCp) Reagenz14, eine häufig verwendete Chemikalie zu isolieren, RNA, ist für die Extraktion von Nukleinsäuren und Proteinen aus Worms, mit anschließenden Niederschlägen, waschen und Solubilisierung der einzelnen verwendet. Dieses Protokoll ist eine Zusammenstellung der verschiedenen Protokolle15,16 mit geringfügigen Änderungen, ausgelegt mit einem Fokus auf C. Elegans, aber wir haben auch erfolgreich isolierten DNA, RNA und Protein aus einem Pellet von HeLa-Zellen nach der dieselben Schritte. Obwohl hier nicht getestet, dürfte dieses Protokoll auf Gewebe sowie17,18arbeiten.
Protokoll
Hinweis: Jede Makromolekül Niederschlag Schritt erfolgt gegenüber dem Vorquartal, gefolgt von Waschungen gleichzeitig getan; Es wird jedoch empfohlen, die RNA-Isolierung abzuschließen zuerst, da es per se instabil ist.
1. die Probenahme
- Samen Sie 1.000 Wurm Eier pro 10 cm Platte mit entsprechenden Wachstum Bedingungen19. Inkubation bei 20 ° C für 72 h.
Hinweis: Bleichmittel Ei-Lager Erwachsene um Eier zu sammeln, wie zuvor beschrieben,19. - Waschen Sie die Platte mit etwa 5 mL M9 Puffer und sammeln Sie 1.000 Erwachsenen Würmer in ein Rohr.
Hinweis: M9 Puffer besteht aus 35 mM Natriumphosphat Diabas-, Natrium-Chlorid-102 mM, 22 mM Kalium Phosphat monobasic und 1 mM Magnesiumsulfat in sterilem Wasser19. - Die Würmer bei 1.000 X g für 1 min Zentrifugieren, überstand verwerfen und die gebeizte Würmer mit 1 mL der M9 Puffer auf einen 1,5 mL Microcentrifuge Schlauch übertragen.
- Wieder bei 845 X g für 1 min Zentrifugieren Sie und entsorgen Sie die meisten des Überstands. Speichern Sie die gebeizte Würmer bei-80 ° C bei einem Mindestaufenthalt von 4 h.
Hinweis: Mit einem gefrorenen Pellet erzeugt eine höhere Rendite als eine frische Pellets. Eine Reihe von Frost/Tau-Zyklen mit flüssigem Stickstoff bzw. 95 % Ethanol auf Trockeneis, um die Wurm-Nagelhaut zu knacken wird empfohlen, wenn eine frische Pellets verwenden. So dass eine kleine Menge der M9 auf das Pellet wird dazu beitragen, die Nagelhaut zu brechen, beim Einfrieren.
(2) Nucleotide und Protein isoliert
- Entfernen Sie überstand aus dem aufgetauten Pellet und fügen Sie 1 mL kalte GTCp Reagenz. Mischen Sie gut durch Pipettieren rauf und runter. Legen Sie die Probe für 10 min auf Eis und mischen Sie es gelegentlich durch auf den Kopf drehen.
Vorsicht: Phenol ist ätzend, neurotoxische und hochgiftig und Verätzungen und Blindheit verursachen kann.
Hinweis: Wir haben bis zu 5.000 Erwachsenen Würmer als das Ausgangsmaterial mit den gemeldeten Mengen; Jeder Band basiert auf der Verwendung von 1 mL GTCp Reagenz. Wenn Sie eine größere Stichprobe verwenden, kann es scale-up erforderlich. - Die Lösung von Würmern und GTCp fügen Sie 200 µL des kalten Chloroform hinzu. Halten Sie das Röhrchen zwischen den Fingern und kräftig schütteln für 15 S. lassen es bei Raumtemperatur (RT) für 3 min.
Vorsicht: Chloroform ist ein giftiges reizend, Hautwunden und andere Organ gezielt Schaden verursachen kann, und ist ein mögliches Karzinogen. - Zentrifugieren Sie das Rohr auf 13.500 X g für 15 min bei 4 ° C.
Hinweis: Drei Schichten bilden sich nach diesem Spin: oben, klaren wässrigen Phase unten, rosa organische Phase und die kleine, trübe Interphase, die Lipide und DNA enthält. - Bewegen Sie die klare Deckschicht (wässrige Phase) zu einem neuen RNase-freie 1,5 mL Microcentrifuge Schlauch (Schlauch A) zu isolieren RNA über Alkohol Niederschlag (wie in Schritt 2.5) und verschieben die rosa Schicht (organische Phase) aus die restlichen Pellets in ein neues Rohr (mit einer Mikropipette Rohr B) und legen Sie es auf dem Eis.
Hinweis: Die rosa organische Phase kann bis die Isolation von DNA und Proteinen aus diesem Beispiel bei-80 ° C eingefroren werden. Größere Proben werden eine dicke weiße Schicht zwischen der wässrige und organische Phase produzieren. Dieser Teil enthält DNA. Wenn diese Schicht entfernt werden kann, ohne zu stören die anderen Phasen, und legen Sie sie in einem separaten Rohr (Rohr B2). -
RNA ist wie folgt zu isolieren.
- Überstürzen Sie aus der klaren wässrigen Phase im Rohr A sich die RNA mit 500 µL 100 % Isopropanol. 10 min bei RT inkubieren Dann, Zentrifuge Rohr A bei 13.500 X g für 10 min bei 4 ° C.
Hinweis: Ein kleinen weißen Pellet RNA sollten an der Unterseite des Rohres sichtbar. - Den Großteil der Überstand abgießen. Den Rest mit einer 1 mL Spritze mit einer Nadel entfernen und entsorgen des Überstands.
Hinweis: Die Größe der Nadel ist nicht wichtig; einen größeren Nadelstärke bieten jedoch mehr Kontrolle um nicht zu stören das Pellet. Eine Mikropipette kann verwendet werden, wenn die Nadeln nicht verfügbar sind. - Schlauch A Pellet waschen fügen Sie 1 mL 75 % Ethanol hinzu. Drehen Sie das Rohr auf 5.300 X g für 5 min bei 4 ° C.
- Entfernen Sie den Überstand von Pellet durch Dekantieren und mit eine 1 mL Spritze mit einer Nadel zu, wie in Schritt 2.5.2 beschrieben, und entsorgen.
- Lassen Sie die Tablette für 5 – 10 Minuten an der Luft trocknen, aber nicht übertrocknen lassen. Verwenden Sie 50 µL RNase-freies Wasser, das Pellet RNA wiederherzustellen, bevor es völlig durchsichtig wird.
Hinweis: Dies ist eine angemessene Ausgangspunkt Volumen für 1.000 – 3.000 Würmer, aber es müssen eventuell angepasst werden, je nachdem, wieviel Ausgangsmaterial verwendet wurde. - Inkubieren Sie die Pellets bei 55 – 60 ° C für 10 min, es aufzulösen.
- Messen Sie die Konzentration und die Reinheit mit einem Spektralphotometer. Aufzeichnen der Absorptionswerte bei 260 nm für RNA-Konzentration und bei 230 bis 280 nm um eventuelle Verunreinigungen zu identifizieren.
- Reinigen Sie die RNA um Verunreinigungen, wie Phenol Rückstände oder DNA, mit anschließenden Ethanol Waschungen und DNase-Behandlung oder mit Spalte Reinigung zu entfernen.
Hinweis: An dieser Stelle die RNA ist bereit zur RNAseq Untersuchung geschickt werden oder kann zur cDNA besteht für RT-qPCR (siehe Abschnitt 3.1) zu verwenden. RNA kann bei-80 ° C bis zur weiteren Verwendung gespeichert werden.
- Überstürzen Sie aus der klaren wässrigen Phase im Rohr A sich die RNA mit 500 µL 100 % Isopropanol. 10 min bei RT inkubieren Dann, Zentrifuge Rohr A bei 13.500 X g für 10 min bei 4 ° C.
-
DNA ist wie folgt zu isolieren.
- Aus der rosa organischen Phase im Rohr B und der Probe im Rohr B2 wenn überhaupt, überstürzen Sie sich die DNA durch Zugabe von 300 µL aus 100 % Ethanol und Mix durch Umkehrung. RT belassen Sie die Tube(n) für 2 – 3 min..
- Zentrifugieren Sie Röhren B und B2 bei 375 X g für 5 min bei 4 ° C, pellet-DNA.
- Verschieben Sie des Überstands von Röhren B und B2 durch Gießen in eine neue 2 mL Tube (Röhre C) und lassen Sie ihn auf Eis für nachfolgende Protein isoliert. Waschen Sie das DNA-Pellet in Rohr B oder B2 mit 1 mL 0,1 M Natriumcitrat in 10 % Ethanol für 30 min. Zentrifuge Röhren B und B2 bei 375 X g für 5 min bei 4 ° C.
Hinweis: Natrium bindet an die DNA Rückgrat, bei DNA Niederschlag leichter Natriumcitrat und Ethanol, so dass Verunreinigungen durch langsame Zentrifugation entfernt werden. - Wiederholen Sie die Waschschritt, wie in Schritt 2.6.3 beschrieben. Aufschwemmen Sie das Pellet in 1,5 mL 75 % Ethanol und lassen Sie es bei RT für 20 min, mit gelegentlichen mischen durch abstoßen.
- Zentrifuge Rohr B und B2 bei 375 X g für 5 min bei 4 ° C.
- Den Überstand verwerfen und für 5 – 10 min trocknen lassen.
- Das Pellet in 150 µL 8 mM Natronlauge auflösen. Um den gewünschten pH-Wert mit HEPES ggf. nachstellen. Drehen Sie die Probe bei 375 X g für 5 min bei 4 ° C.
- Verschieben Sie mithilfe einer Mikropipette überstand (DNA) zu einem neuen Schlauch. Messen Sie die Konzentration und bestimmen Sie die Reinheit mit einem Spektralphotometer zu. Aufzeichnen der Absorptionswerte bei 260 nm für DNA-Konzentration und bei 230 bis 280 nm um eventuelle Verunreinigungen zu identifizieren.
-
Protein ist wie folgt zu isolieren.
- Um das Eiweiß Niederschlag, der rosa Überstand in Rohr C, Mix von invertierenden mehrmals, bis zu 1,5 mL Isopropanol 100 % hinzu und 10 min bei RT inkubieren.
- Zentrifugieren Sie Rohr C bei 13.500 X g für 10 min bei 4 ° C.
- Den Überstand verwerfen und das Pellet mit 2 mL 0,3 M Guanidin-Hydrochlorid in 95 % igem Ethanol für 20 min bei RT. Zentrifugenröhrchen C bei 5.300 X g für 5 min bei 4 ° c waschen
- Der Waschschritt zu wiederholen, wie unter Schritt 2.7.3 2 X.
- Verschieben Sie das Protein Pellet in eine neue 1,5 mL Tube (Röhre C2) und fügen Sie bis zu 1,5 mL 95 % Ethanol. Wirbel und lassen es für 20 min bei RT sitzen.
- Zentrifugieren Sie Rohr C2 bei 5.300 X g für 5 min bei 4 ° C. Den Überstand verwerfen und das Pellet für 10 min bei RT auflösen das Pellet in 300 µL 5 % SDS bei 50 ° C für 60 min. trocknen lassen.
Hinweis: Eine längere Inkubationszeit möglicherweise müssen das Protein Pellet vollständig zu lösen. In der Vergangenheit hat das Pellet für bis zu 6 h inkubiert worden, ohne Abstriche an der Qualität. - Zentrifugieren Sie Rohr C2 bei 13.500 X g für 10 min bei 17 ° C. Bewegen Sie den Überstand zu einem neuen Schlauch.
- Messen der Konzentration über einen bevorzugten Protein Quantifizierung Assay, der kompatibel mit Waschmittel ist.
Hinweis: Das Protein ist gebrauchsfertig in SDS-PAGE und westliche Beflecken. Es kann bei-20 ° C für eine spätere Verwendung gespeichert werden. Für andere Techniken wie LC-MS/MS musst das Waschmittel aus dialysiert werden.
(3) Bewertung von mRNA und Protein-Ebene
-
RT-qPCR
- Bereiten Sie cDNA durch reverse Transkription mit 1 ng RNA, unter Verwendung des folgenden Thermocycler-Protokolls: Grundierung (5 min bei 25 ° C), reverse Transkription (20 min bei 46 ° C) und RT Inaktivierung (1 min bei 95 ° C).
- Eine Lager Platte cDNA durch Zugabe von 100 µL 1: 100 Verdünnung der Samples cDNA in einzelnen Vertiefungen einer 96-Well-Platte zu machen. Sind entsprechende Steuerelemente, z. B. keine Vorlage/nur mit Wasser Brunnen und seriell verdünnten Proben von 01:25 bis 1: 400 (mit gepoolten cDNA aller analysierten Proben entstanden) ermöglicht eine Standardkurve, Grundierung Effizienz für jedes Gen analysiert zu etablieren.
Hinweis: Dieses Format kann mit 96-Well-Microdispenser, verwendet werden, die für die Überführung aller Proben in einer Platte in eine RT-qPCR-Platte und für die Minderung von Brunnen zu Brunnen Pipettieren Variationen ermöglicht. Die entsprechenden master-Mix (z. B. SYBR + Primer) kann zu jedem gut danach mit einer Mehrkanal-Pipette hinzugefügt werden. Dieser Ansatz reduziert insgesamt Fehler eingeführt, wenn jedes Muster, wodurch weitere Variabilität Hand-pipettieren. - Die Brunnen der RT-qPCR Platte 3 µL cDNA aus der Lager Platte hinzufügen.
- Machen Sie einen master-Mix für jeden Satz von Grundierungen, die 1 X Supermix mit ein DNA-verschuppen Cyanin-Farbstoff, 5 µM von enthält weiterleiten und reverse Primer und Wasser bis zu 7 µL pro Probe. Die entsprechenden Vertiefungen eines RT-qPCR-Platte 7 µL hinzu und rühren Sie leicht um zu mischen.
Hinweis: Zählen Sie Proben zur Messung der Housekeeping-Gene als Referenz zu verwenden, um die Ergebnisse20zu normalisieren. - Führen Sie die Platte mit einer RT-qPCR-Protokoll, die für die verwendeten Primer eignet.
-
Western-blot
Hinweis: Für detaillierte Informationen über westliche Flecken siehe Mahmood und Yang21.- Bereiten Sie Proben für SDS-PAGE, durch die Kombination von 20 µg Protein mit einem gleichen Volumen 2 x Laemmli Probenpuffer und bei 95 ° C für 10 min kochen.
- Laden Sie die Proben auf einem 4 – 15 %-Tris-Glycin-Gel und führen sie bei 150 V für 1 h, oder bis die Farbstoff-Front das Ende des Gels erreicht.
- Übertragen Sie Proteine aus dem Gel auf eine Nitrozellulose-Membran bei 25 V für 30 min in einem halbtrocken Transfer Apparat.
- Bestätigen Sie die korrekte Übertragung durch Färbung der Membran mit Ponceau S Fleck.
- Waschen Sie den Fleck aus der Membran mit Tris-gepufferte Kochsalzlösung (TBS) mit 0,01 % Polysorbat 20 (TBS-T).
- Block der Membran mit 5 % Magermilch in TBS-T für 1 h bei RT
- Inkubieren Sie die Membran in den primären Antikörper bei der entsprechenden Verdünnung entsprechend den Empfehlungen des Lieferanten. Lassen Sie es über Nacht auf die Wippe bei 4 ° C.
- Waschen Sie die Membran 3 X für jeweils 5 min mit TBS-T.
- Inkubieren Sie die Membran in die entsprechenden Sekundärantikörper an die entsprechende Verdünnung entsprechend den Empfehlungen des Lieferanten. Lassen Sie es auf die Wippe für 1 h bei RT
- Waschen Sie die Membran 3 X für jeweils 5 min mit TBS-T.
- Bild und Quantifizierung der western-Blot, bevorzugte Methoden verwenden.
Ergebnisse
Die RNA, DNA und Protein Proben wurden analysiert und repräsentative Ergebnisse mit Hilfe der RNA und Protein Isolate werden hier vorgestellt. Darüber hinaus vergleichen wir die Protein-Probe mit der GTCp-Methode, um die gemeinsamen RIPA Lyse Methode22geerntet. Für unser Experiment verwendeten wir vier unabhängige Wiederholungen von einzelnen WT (N2) Würmern und zwei langlebige mutierten Würmer, Essen-2 und Rsks-123,24.
RNA und DNA-Menge und Qualität
Die Konzentration der RNA als Nukleinsäuretablette in 50 µL Wasser reichten von 0,2 bis 2 µg/µL, mit rund 3.000 Erwachsene Würmer als Ausgangsmaterial. Die Extinktion-Verhältnisse, die Reinheit angeben, reichten von 2,0 bis 2,2 für A260/A280 und 1,9 bis 2,5 für A260/A230 (Tabelle 1), zeigt die erfolgreiche Gewinnung von RNA ohne Kontamination mit GTCp Komponenten, wie Phenol oder Guanidin-Hydrochlorid.
Die DNA-Extraktion war erfolgreich, aber die Qualität war variabel. Die DNA-Konzentration bei Nukleinsäuretablette in 150 µL NaOH reichte von 0,04 bis 1,1 µg/µL. Die Extinktion Verhältnisse reichte von 1,8 bis 2,1 für A260/A280 und 0,9 bis 1,6 für A260/A230 (Tabelle 1), zeigt die erfolgreiche Extraktion von DNA; jedoch wurden einige der Proben mit GTCp Komponenten, wie Phenol oder Guanidin-Hydrochlorid kontaminiert. Wenn DNA-Isolierung notwendig ist, Vorsicht ist bei die mittlere Schicht aus der GTCp Phasentrennung Trennung und mehr Wäschen können erforderlich sein.
RT-qPCR der ausgewählten Ziele
Die RNA Isolierung von vier unabhängigen Proben von jedem Stamm der Wurm war erfolgreich und wurde zur RNAseq Analyse, mit anschließenden RT-qPCR durchgeführt mit einem Supermix mit einem Cyanin-Farbstoff geschickt. Ziele von RT-qPCR analysiert wurden aus einem großen RNAseq Dataset basierend auf die meisten differentiell regulierten Gene häufig in beiden Mutanten im Vergleich zu den WT-Würmern ausgewählt. F07C4.1225, ein Homolog zu menschlichen Neuroligin 3, Isoform b, wurde die ausgewählte freigegebene hochreguliert. Wir enthalten auch ein differentiell regulierte gen zwischen beiden Mutanten, Mrp-126, für die weitere Analyse, die hochreguliert in Essen-2 Würmer aber herunterreguliert Rsks-1 Worms war. Veränderungen der Mrp - 1 wurden per RT-qPCR bestätigt; F07C4.12 Hochregulation Rsks-1 Worms vorhergesagt durch die RNAseq-Analyse wurde jedoch nicht von RT-qPCR (Abbildung 1) gesehen.
Zusätzliche Ziele mit Antikörpern für Würmer validiert wurden ebenfalls untersucht. Dazu gehörten mehrere Organellen Markierungen gekennzeichnet Hadwiger Et Al.27. Eine Reihe dieser Marker wurden auf der mRNA-Ebene in den mutierten Würmern differenziell ausgedrückt. Wie aus Abbildung 1ersichtlich, wurden Lmp-128 und Dlg-129 hochreguliert in Essen-2 Würmer; HSP-4 30, Hsp-7030und Lmp-1 wurden hochreguliert Rsks-1 Worms; HSP-60 31 und Pas-732 wurden herunterreguliert in Essen-2 Würmer; HSP-60 und tac-133 wurden herunterreguliert Rsks-1 Worms.
Gleichzeitige vs. RIPA Protein Vorbereitung
Um die Effizienz und die Qualität des Proteins mit der GTCp Methode wie oben beschrieben bestätigen, verglichen wir es an Protein gesammelt, nach der traditionellen Methode der RIPA Lyse22. Unter Verwendung der gleichen Menge des Ausgangsmaterials, nämlich entweder nur für Erwachsene (ca. 10.000 Würmer) oder eine gemischte Bevölkerung von Erwachsenen, Larven und Eier (ca. 130.000 Würmer), war die Gesamtmenge mit GTCp gesammelten weniger wenn gleich Ende Bände (Tabelle 1 Nukleinsäuretablette ); jedoch war die Gewinnung aus einer nur für Erwachsene Bevölkerung erfolgreicher als aus einer gemischten Population. Darüber hinaus war die Qualität der Proteine ähnlich, wenn auch das Protein GTCp extrahiert eine bessere Auflösung der größere Proteine bei gleicher Belastung des Gesamt-Protein, zeigte, wie Coomassie Fleck in Abbildung 2gezeigt. In der Tat zeigte Ziele bewertet von western-Blot in Abbildung 3 ähnliche Niveaus in den meisten Fällen; jedoch zeigte die Proteine größer als 75 kDa untere Ebenen im RIPA extrahiert Protein im Vergleich zu den GTCp extrahiert Protein (Abbildung 3A, Rechte Spur; Abbildung 3 b, gelbe Balken).
Die hier vorgestellte Extraktionsmethode wurde auch in der Säugetier-Zelle Zeile HeLa evaluiert. Als Referenz die Menge an Protein ein kompakter Pellet 6 Millionen HeLa-Zellen (ein ~ 25 µL Pellet) mit RIPA entzogen war vergleichbar mit dem einer 130.000 Mischpopulation von Worms (eine kompakte Pellet ~ 75 µL) entnommen, oder etwa die Hälfte von dem, was aus 10.000 gewonnen Erwachsene Würmer (ein ~ 100 µL Schwerkraft zu erfüllenden Pellet), wie in Tabelle 1zu sehen. Wir zeigen, dass die Effizienz der Proteingewinnung (Tabelle 1) und die Auflösung der größere Proteine (Abbildung 2), in GTCp im Vergleich zu RIPA extrahiert Protein in HeLa-Zellen abgenommen wurde, was darauf hindeutet, dass diese Technik funktioniert besser in einem erwachsenen Bevölkerung Würmer. Die unvollständige Solubilisierung des Pellet-Protein aus GTCp extrahiert HeLa Protein möglicherweise eine Einschränkung dieser Methode in Säugetierzellen.
Immunoblotting Ziele von RT-qPCR analysiert
Als nächstes haben wir die Proteingehalte der Genprodukte von RT-qPCR um festzustellen, ob die mRNA-Niveaus mit der Protein-Ebene korreliert getestet. Wie aus Abbildung 3ersichtlich, korreliert die durchschnittliche Ausdruck Änderungen des Proteins mit der durchschnittlichen mRNA Ausdrücke für viele Ziele geändert; jedoch einige Protein-Ebene nicht die Änderungen in mRNA-Niveaus. Oft die mRNA-Niveaus in Essen-2 Würmer waren höher als die der anderen Stämme, aber die Proteingehalte waren entweder gleich oder niedriger als die anderen Stämme des gleichen Ziels. Die herausragendste Beobachtung war das sehr hohe Niveau der Dlg-1 mRNA in Essen-2 Würmer, die nicht, mehr Protein übersetzen; in der Tat gab es geringere Dlg-1 -Protein-Ebene im Vergleich zu den anderen Stämmen (Abbildung 3).
Schließlich zeigten die Ebenen in der GTCp extrahiert und die RIPA extrahiert Protein einen auffallenden Unterschied. Die RNA wurde auf die gleiche Weise für beide gewonnen; Allerdings reduziert die ähnliche, aber separate Probe von RIPA Lyse zeigte deutlich Proteingehalte, insbesondere für diejenigen, die größer als 75 kDa (Abb. 3A, Rechte Spur; Abbildung 3 b, gelbe Balken).
Intrasample Vergleich der mRNA und protein
Eines der Ziele dieses Protokolls war, ob die Variante sahen wir auf der mRNA und Protein-Ebene war real, oder wenn es ein Artefakt der intersample Variante sein könnte. In Abbildung 4wurde eine Teilmenge von Zielen innerhalb der einzelnen Proben verglichen. Jeder einzelnen Probe erscheint als die gleiche Farbton und Farbe des Punktes, mit Beispiel 1 wird der dunkelste Schatten und Probe 4 als der hellsten Farbe grau (WT), blau (Essen-2) oder rot (Rsks-1). In den meisten Proben gab es eine geringe Variabilität der die mRNA-Niveaus mit größere Variabilität auf Proteinebene, eine potenzielle Schwachstelle der semiquantitative Analyse des western Blots. Bei der Betrachtung der Position jedes die farbigen Punkte zwischen den Paaren mRNA und Protein die Reihenfolge der höchsten zur niedrigsten oft nicht überein; z. B. in WT, die Hsp-60 mRNA Bestellung war Probe 4, 3, 2, 1, aber die Proteingehalte wurden 1, 2, 3, 4. So, sicherlich gibt es Unterschiede zwischen mRNA und Protein Ebenen innerhalb einer Probe, sondern die vorgestellte Methode ermöglicht es Benutzern, die Zeit der Sammlung als eine mögliche Ursache für die beobachtete Differenz zu entfernen.
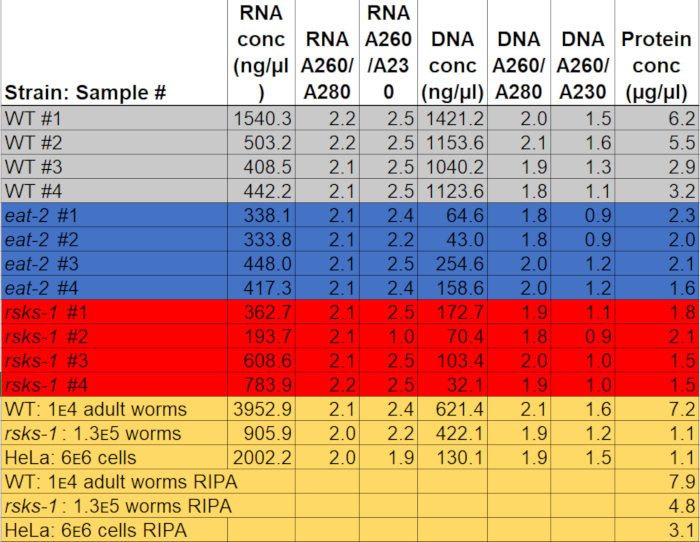
Tabelle 1: Konzentrationen und Absorption Verhältnisse. RNA und DNA-Konzentration und Reinheit-Verhältnisse wurden auf einem Spektralphotometer gemessen. Proteinkonzentrationen wurden anhand eines kolorimetrischen Protein Quantifizierung Assays ermittelt. Die grau, blau und rot markieren die Proben für die RT-qPCR und western-Blot. Der gelbe zeigt Proben verwendet, um GTCp RIPA Proteingewinnung oder Wurm HeLa Protein-Protein zu vergleichen. Bitte klicken Sie hier, um diese Datei herunterladen.
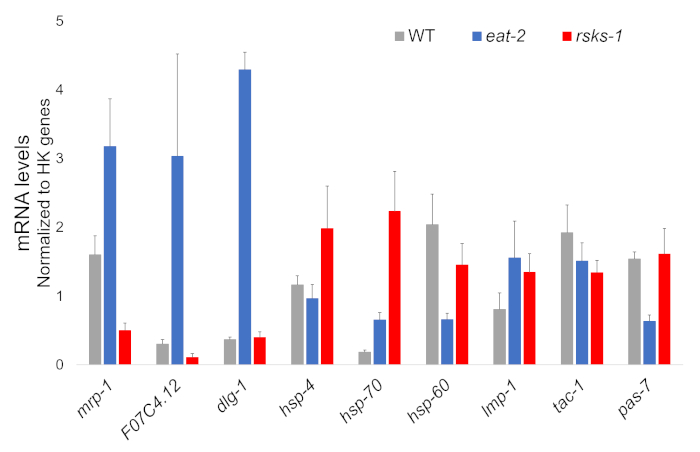
Abbildung 1: Genexpression durch RT-qPCR. RT-qPCR-Analyse für die mRNA durch diese Methode erhalten Ziele identifiziert von RNAseq Daten und Organelle Markergene zu bestätigen. Die Fehlerbalken darzustellen Standardabweichung; n = 4. Die Konzentration der mRNA wurde gegen eine Standardkurve für jeden Satz von Primern definiert. Alle mRNA-Niveaus wurden normiert auf dem Durchschnitt einer Reihe von sechs Housekeeping-Gene als Referenz Gene, darunter 1. Akt, cdc-42, Ama-1, Nhr-23, Pmp-3und Cyn-1verwendet. Bitte klicken Sie hier für eine größere Version dieser Figur.
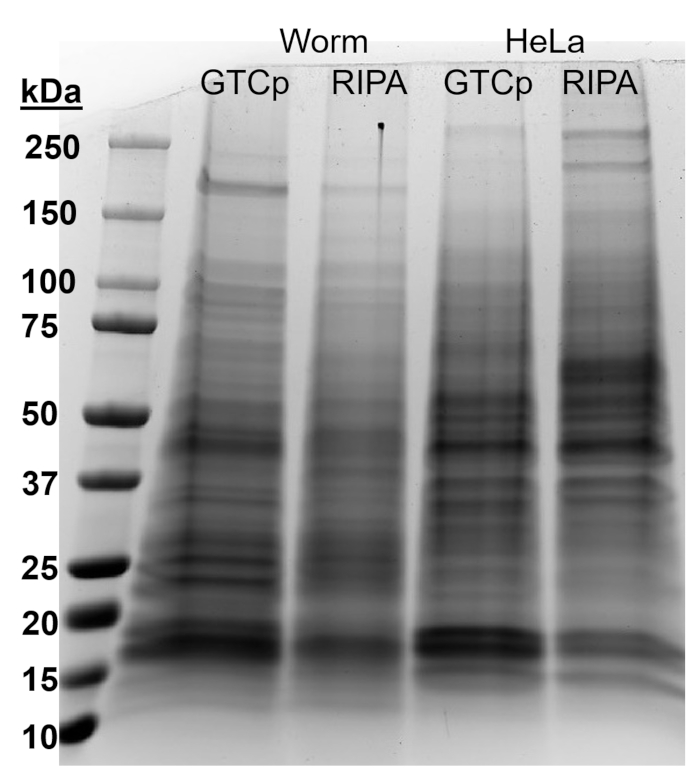
Abbildung 2: Vergleich der GTCp-versus RIPA extrahiert Protein in Worms und HeLa-Zellen. Gesamt-Protein aus Wildtyp (WT) Würmer oder HeLa-Zellen geerntet über GTCp oder RIPA Lyse Methode, getrennt durch SDS-PAGE, und mit Coomassie Blau gefärbt. Jede Spur enthält 25 µg Gesamt-Protein. Bitte klicken Sie hier für eine größere Version dieser Figur.
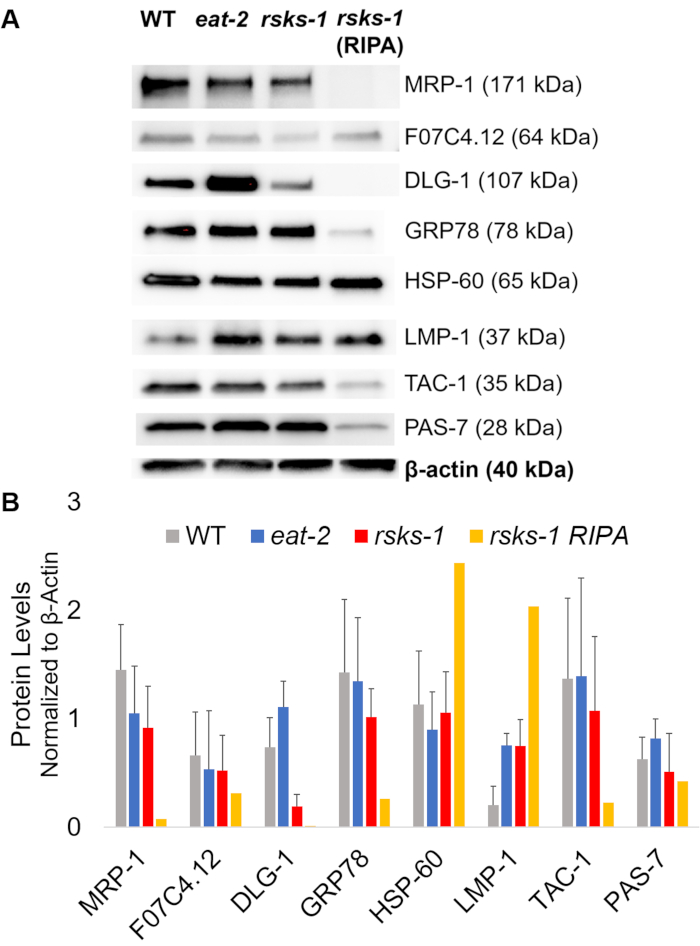
Abbildung 3: Proteingehalte in Worms. (A) Western-Blot Ziele von RT-qPCR und (B) Densitometrie Analyse der Signalintensität untersucht. Jede Spur enthält 20 µg GTCp extrahiert Gesamtprotein vom Wildtyp (WT), Essen-2oder Rsks-1 mutierten Würmer. Das gezeigte Bild ist eine Darstellung von vier unabhängigen Wiederholungen pro Wurm Stamm. Β-Aktin (unten) diente gleich Laden für jedes Ziel zu kontrollieren; nur eine repräsentative Menge wird angezeigt. Die Rechte Spur enthält 20 µg RIPA extrahiert Gesamtprotein von mutierten Würmer Rsks-1 . (B) entsprechende Signalintensitäten wurden quantifiziert mit ImageJ. Die Fehlerbalken darzustellen Standardabweichung; n = 4. Bitte klicken Sie hier für eine größere Version dieser Figur.
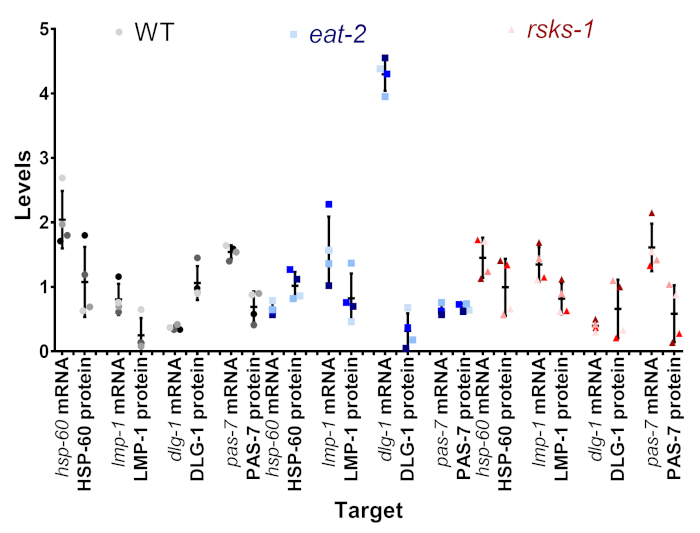
Abbildung 4: Intrasample mRNA und Protein level Vergleich. Die mRNA und Protein Ebenen von einzelnen Proben aus einer Teilmenge von Zielen für jede Belastung ausgerichtet sind. Die Farbe ist der Repräsentant der Tabelle 1. Grau/schwarz ist WT, das Blau ist Essen-2, und die rote Rsks-1. mRNA und Protein des gleichen Ziels nebeneinander gekoppelt und durch Nematoden Stamm getrennt. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Methoden für das Biomolekül Isolationen, wie DNA, RNA und Proteine, sind oft ohne technische überlappen oder Kombinationen optimiert. Dies ist besonders nachteilig beim Proben schwer sind zu bekommen, was zur Ernte Proben unter den gleichen Bedingungen zu unterschiedlichen Zeiten führen könnte. Abhängig von der zelluläre Signalwege können Wiederholungen zu verschiedenen Zeiten gesammelt Variation generiert. Diese Handschrift bietet ein Verfahren um diese Hürde zu umgehen, indem es ermöglicht die gleichzeitige Isolierung und Reinigung der einzelnen Biomolekül aus derselben Probe von Würmern, Verringerung der Variationen von unterschiedlichen Isolierungstechniken eingeführt das Timing der Probe Ernte, oder ungleiche Ernte. Diese Variablen zu kontrollieren nicht nur spart Zeit und Ressourcen, sondern erleichtert auch die Reproduzierbarkeit. Hier zeigen wir einen kombinatorischen Ansatz, der vermeidet kompromittierende RNA und Protein-Qualität, wenn auch mit unterschiedlichen Ergebnissen mit DNA. Vorbereitungen können mit der DNA Reinigung Verfahren weiter optimiert werden. Wir zeigten den Ansatz mit Material aus den Nematoden C. Elegans und HeLa-Zellen.
Vorarbeiten, die Erkundung der Transkriptom und Proteom von N2 WT Tiere und Essen-2 und Rsks-1 Mutanten haben Einblick in die verschiedenen Wege, einschließlich der Mechanismen, die Verlängerung der Lebensdauer4,34,35 angeboten ,36. In dem Bemühen, den Mechanismus der kalorische Restriktion verlängern Lebensdauer zu untersuchen haben ein stabiles Isotop Kennzeichnung von/mit Aminosäuren in Zelle Kulturanalyse (SILAC) fand, dass Essen 2 Würmer eine allgemeine Herabregulation der globalen Proteinsynthese 36. die hier vorgestellten Daten steht im Einklang mit dieser Befund, auch wenn die mRNA-Niveaus der gleichen Ziele stark erhöht werden. Eine andere Gruppe zielte darauf ab, Effektoren der S6K-vermittelten Langlebigkeit zu identifizieren und somit, durchgeführt einen Proteomic Bildschirm Rsks-1 Würmer34. Aus den RNAseq-Daten mit der aktuellen Studie gefunden identifizierten wir mindestens drei Gene, die Proteine identifiziert auf diesem Bildschirm bestätigen; MRP-1 und homologe des CPA und Neuroligin (F07C4.12) wurden entdeckt, als differentiell Rsks-1 Worms im Vergleich zu WT N234zum Ausdruck gebracht werden.
Mit dieser Methode gewonnenen Daten steht im Einklang mit früheren Multiomic Untersuchungen. Die mRNA-Niveaus von neun Ziele wurden verwendet, um die Proteingehalte in jeder Probe vorherzusagen. Dieser Ziele hatten viele vorhersehbar Proteingehalte basierend auf die mRNA-Niveaus. Dennoch gab es bemerkenswerte Unterschiede zwischen der mRNA und Protein. Wichtig ist, die hier vorgestellten Protokoll ermöglicht es Wissenschaftlern, selbstbewusst zu bewerten und zu interpretieren diese Unterschiede durch Entfernen intersample Variabilität durch das Sammeln von mRNA und Protein aus der gleichen Probe. Darüber hinaus haben wir verglichen die mRNA-Niveaus, die Proteingehalte aus derselben Probe gesammelt oder von einer ähnlichen aber unterschiedlichen Probe geerntet mit RIPA erfasst. Wir zeigten, dass für eine Reihe von Zielen, gab es viel niedrigeren Niveaus des Proteins in der Probe RIPA extrahiert. Ohne Steuerung für die intersample Variante, wäre es unmöglich zu wissen, ob dieser Unterschied durch die differenzierte Regelung der mRNA und Protein.
Es ist wichtig, denken daran, dass es Protokolle, die speziell für diese verschiedenen Makromolekülen, optimiert so wenn eine Querschnittsanalyse nicht das endgültige Ziel des Experiments ist, dann es relevant, stattdessen die Methoden anzuwenden wäre. Mit GTCp DNA und Proteine isolieren bewirkt, dass sie weniger löslich, das Protein in einem Puffer mit einer hohen Konzentration des Reinigungsmittels mit Heizung, auf die Gefahr hin unvollständig Gefäss- und erfordern die Rekonstitution der DNA in einer schwachen Base, wie NaOH, werden Solubilisierung. Zusätzlich GTCp enthält Guanidinium-Thiocyanat und sauren Phenol, die Enzyme wie Proteasen inaktiviert, sondern wird langsam Protein im Laufe der Zeit abgebaut, es sei denn, eingefroren. Es werden im Ermessen des Forschers zu entscheiden, ob die Umgehung dieser Einschränkungen lohnen wird.
Wichtig ist, beim Arbeiten mit RNA, eine sterile Technik die Probe auf dem Eis zu halten, sofern nicht anders angegeben und die Verwendung von handelsüblichen dekontaminierende Reagenz empfiehlt sich die RNA intakt zu halten. Vor allem benötigen größere Proben mehr GTCp, mit zu beginnen, müssen jede Extraktion Lösungsmittel auch hochskaliert werden. Dieses Protokoll erfordert manuelle Homogenisierung der Wurm oder Zelle Proben, wenn die richtige Menge an GTCp verwendet wird. Im Rahmen der DNA-Isolierung ergibt sich eine stark abhängig von der Kompetenz der organische Schicht (rosa) wiederherstellen. Zu guter Letzt kann um die Solubilisierung von Proteinen während der Isolierung zu verbessern, Erhöhung des Volumens der Resolubilization Puffer oder andere Reinigungsmittel neben SDS hinzufügen erforderlich sein. Proteine aus einer nur für Erwachsene Bevölkerung von Würmern statt einer Mischung von Erwachsenen, Larven und Eier sind in der Tat viel einfacher zu resolubilize.
Alles in allem unter Verwendung dieses Protokolls bietet einen integrierten Ansatz für Biomolekül Isolationen und erleichtert die Interpretation der Korrelationen oder fehlen, zwischen mRNA und Protein Ebenen, die auftreten können, von der Ernte separat Biomoleküle aus verschiedenen Proben. Mit dieser Methode kann helfen Wissenschaftlern Fälle korrekt zu ermitteln, wo die Übersetzung von mRNA zu Protein ist nicht korrelative und kann auf die tiefere Untersuchung von posttranskritionelle und posttranslationale Regulationsmechanismen unter verschiedenen Bedingungen führen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
L.R.L. wurde finanziert durch Zuschüsse aus dem NIH/NIA (R00 AG042494 und R01 AG051810), ein Glenn Foundation für Medical Research Award for Research in biologischen Mechanismen des Alterns und ein Junior Faculty Grant von der American Federation für Alternsforschung. Die Autoren möchten Anita Kumar und Shi Quan Wong für ihre nützliches Feedback beim Schreiben dieses Manuskriptes danken.
Materialien
| Name | Company | Catalog Number | Comments |
| 4–15% Mini-PROTEAN® TGX Stain-Free™ Protein Gels | BIORAD | 4568084 | |
| Antibodies: | |||
| CePAS7-s | DHSB- U of Iowa | ||
| CeTAC1-s | DHSB- U of Iowa | ||
| DLG1-s | DHSB- U of Iowa | ||
| GRP78 | Novus Bio. | NBp1-06274 | |
| HRP Goat Anti-Mouse | Li-Cor | 926-80010 | |
| HRP Goat Anti-Rabbit | Li-Cor | 92680011 | |
| HSP60-s | DHSB- U of Iowa | ||
| LMP1-s | DHSB- U of Iowa | ||
| MRP-1 | Abcam | ab24102 | |
| Neuroligin 3 | Abcam | ab172798 | |
| β-actin | Millipore | MAB1501R | |
| ChemiDoc MP Imaging System | BIORAD | ||
| Chloroform | Fisher | C298-500 | Health hazard, Irritant, Toxic |
| Coomassie Brilliant Blue | ThermoSci | 20279 | |
| DC Protein assay | BIORAD | 500-0116 | |
| Epoch 2 microplate reader | BioTek | ||
| Ethanol (200 proof) | Fisher | 04-355-223 | Flammable, health hazard |
| HeLa cells | ATCC | CCL-2 | BSL2 |
| iScript Reverse Transcription Supermix | BIORAD | 1708840 | |
| Hydra microdispenser: Matrix Hydra | Robbins/ThermoFisher | ||
| Isopropanol | Fisher | A516-4 | Flammable, health hazard |
| M9 buffer: 3 g KH2PO4 6 g Na2HPO4 5 g NaCl Add H2O to 1 liter. Sterilize by autoclaving. After solution cools down, add 1 mL sterile 1 M MgSO4 | |||
| Laemmli Sample Buffer (2x) | BIORAD | 161-0737 | |
| NanoDrop One | ThermoSci | ||
| PAGE apparatus | BIORAD | ||
| Ponceau S | Alfa Aesar | J60744 | |
| Primers | IDT | 25 nmole DNA Oligo with Standard Desalting | |
| dlg-1: F (5'-GGTCCTACCA GGCAGTTGAG-3') R (5'-CACGTCCGTT AACCTCTCCC-3') | |||
| hsp-4: F (5'-AGAGGGCTTT GTCAACCCAG-3') R (5'-TCGTCAGGGT TGATTCCACG-3') | |||
| hsp-70: F (5'-CGGCATGTGA ACGTGCTAAG-3') R (5'-GAGCAGTTGA GGTCCTTCCC-3') | |||
| hsp-60: F (5'-ATTGAGCAAT CGACGAGCGA-3') R (5'-CAACACCTCC TCCTGGAACG-3') | |||
| lmp-1: F (5'-ACAACAACAC CGGACTCACG-3') R (5'-ATCGAGCTCC CACTCTTTGG-3') | |||
| tac-1: F (5'-AGTGGCAGGC AAAGTTCCTC-3') R (5'-TGAGCACCTT GATCTCGTCG-3') | |||
| pas-7: F (5'-GTACGCTCAA AAGGCTGTCG-3') R (5'-CTGAATCGGC ATTGGCTCAC-3') | |||
| mrp-1: F (5'-TTTGCCTTGC GCTTGTTCTG-3') R (5'-AGTTCCAGTG CGGAGCATAC-3') | |||
| F07C4.12: F (5'-TGCTGAGCAT GAAGGACTGT-3') R (5'-TGGCAATAGC TCCTCCGTTG-3') | |||
| HK Actin: F (5'-CTACGAACTT CCTGACGGACAAG-3') R (5'-CCGGCGGACT CCATACC-3') | |||
| HK cyn-1: F (5'-GTGTCACCAT GGAGTTGTTC-3') R (5'-TCCGTAGATT GATTCACCAC-3') | |||
| HK nhr-23: F (5'-CAGAAACACT GAAGAACGCG-3') R (5'-CGATCTGCAG TGAATAGCTC-3') | |||
| HK ama-1: F (5'-TGGAACTCTG GAGTCACACC-3') R (5'-CATCCTCCTT CATTGAACGG-3') | |||
| HK cdc-42: F (5'-CTGCTGGACA GGAAGATTACG-3') R (5'-CTCGGACATT CTCGAATGAAG-3') | |||
| HK pmp-3: F (5'-GTTCCCGTGT TCATCACTCAT-3') R (5'-ACACCGTCGA GAAGCTGTAGA-3') | |||
| LightCycler 96 qPCR machine | Roche | ||
| RIPA buffer: 10 mM Tris-Cl (pH 8.0) 1 mM EDTA 1% Triton X-100 0.2% SDS 140 mM NaCl 1 tablet of Roche protease inhibitor per 20 mL | |||
| SsoAdvanced Universal SYBR Supermix | BIORAD | 1725274 | |
| SuperSignal West Femto Max Sens Substrate | ThermoSci | 34095 | |
| Trans-Blot Transfer apparatus | BIORAD | ||
| Trans-Blot Turbo Transfer Pack | BIORAD | 170-4159 | |
| TRIzol reagent | Invitrogen | 15596026 | Health hazard (skin, eyes) |
| Worm strains: | Caenorhabditis Genetics Center (CGC) | ||
| N2 (wild type) | Caenorhabditis Genetics Center (CGC) | ||
| eat-2 (MAH95) | Caenorhabditis Genetics Center (CGC) | ||
| rsks-1 (VB633) | Caenorhabditis Genetics Center (CGC) |
Referenzen
- Rotroff, D. M., Motsinger-Reif, A. A. Embracing Integrative Multiomics Approaches. International Journal of Genomics. 2016, 1715985 (2016).
- Chen, R., Snyder, M. Promise of personalized omics to precision medicine. Wiley Interdisciplinary Reviews: System Biology and Medicine. 5 (1), 73-82 (2013).
- Anderson, L., Seilhamer, J. A comparison of selected mRNA and protein abundances in human liver. Electrophoresis. 18 (3-4), 533-537 (1997).
- Harvald, E. B., et al. Multi-omics Analyses of Starvation Responses Reveal a Central Role for Lipoprotein Metabolism in Acute Starvation Survival in C. elegans. Cell Systems. 5 (1), (2017).
- Griffin, T. J., et al. Complementary profiling of gene expression at the transcriptome and proteome levels in Saccharomyces cerevisiae. Molecular and Cell Proteomics. 1 (4), 323-333 (2002).
- Greenbaum, D., Colangelo, C., Williams, K., Gerstein, M. Comparing protein abundance and mRNA expression levels on a genomic scale. Genome Biology. 4 (9), 117 (2003).
- Lapierre, L. R., et al. The TFEB orthologue HLH-30 regulates autophagy and modulates longevity in Caenorhabditis elegans. Nature Communications. 4, 2267 (2013).
- Doherty, C. J., Kay, S. A. Circadian control of global gene expression patterns. Annual Reviews Genetics. 44, 419-444 (2010).
- Goya, M. E., Romanowski, A., Caldart, C. S., Benard, C. Y., Golombek, D. A. Circadian rhythms identified in Caenorhabditis elegans by in vivo long-term monitoring of a bioluminescent reporter. Proceedings of the National Academy of Sciences USA. 113 (48), E7837-E7845 (2016).
- Dalvin, L. A., Fautsch, M. P. Analysis of Circadian Rhythm Gene Expression With Reference to Diurnal Pattern of Intraocular Pressure in Mice. Investigative Ophthalmology and Visual Science. 56 (4), 2657-2663 (2015).
- Narayanan, A., Jacobson, M. P. Computational studies of protein regulation by post-translational phosphorylation. Current Opinion in Structural Biology. 19 (2), 156-163 (2009).
- Swatek, K. N., Komander, D. Ubiquitin modifications. Cell Research. 26 (4), 399-422 (2016).
- Cech, T. R., Steitz, J. A. The noncoding RNA revolution-trashing old rules to forge new ones. Cell. 157 (1), 77-94 (2014).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Triant, D. A., Whitehead, A. Simultaneous Extraction of High-Quality RNA and DNA from Small Tissue Samples. Journal of Heredity. 100 (2), 246-250 (2009).
- Liu, X., Harada, S. RNA Isolation from Mammalian Samples. Current Protocols in Molecular Biology. 103 (1), 11-14 (2013).
- Hummon, A. B., Lim, S. R., Difilippantonio, M. J., Ried, T. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage. Biotechniques. 42 (4), 467-470 (2007).
- Kopec, A. M., Rivera, P. D., Lacagnina, M. J., Hanamsagar, R., Bilbo, S. D. Optimized solubilization of TRIzol-precipitated protein permits Western blotting analysis to maximize data available from brain tissue. Journal of Neuroscience Methods. 280, 64-76 (2017).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Hoogewijs, D., Houthoofd, K., Matthijssens, F., Vandesompele, J., Vanfleteren, J. R. Selection and validation of a set of reliable reference genes for quantitative sod gene expression analysis in C. elegans. BMC Molecular Biology. 9 (1), 9 (2008).
- Mahmood, T., Yang, P. -. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Peach, M., Marsh, N., MacPhee, D. J., Kurien, B. T., Scofield, R. H. Protein solubilization: Attend to the choice of lysis buffer. Protein Electrophoresis: Methods and Protocols. , 37-47 (2012).
- Lakowski, B., Hekimi, S. The genetics of caloric restriction in Caenorhabditis elegans. Proceedings of the National Academy of Science USA. 95 (22), 13091-13096 (1998).
- Pan, K. Z., et al. Inhibition of mRNA translation extends lifespan in Caenorhabditis elegans. Aging Cell. 6 (1), 111-119 (2007).
- Gaudet, P., Livstone, M. S., Lewis, S. E., Thomas, P. D. Phylogenetic-based propagation of functional annotations within the Gene Ontology consortium. Briefings in Bioinformatics. 12 (5), 449-462 (2011).
- Broeks, A., Gerrard, B., Allikmets, R., Dean, M., Plasterk, R. H. Homologues of the human multidrug resistance genes MRP and MDR contribute to heavy metal resistance in the soil nematode Caenorhabditis elegans. The EMBO Journal. 15 (22), 6132-6143 (1996).
- Hadwiger, G., Dour, S., Arur, S., Fox, P., Nonet, M. L. A Monoclonal Antibody Toolkit for C. elegans. PLoS One. 5 (4), e10161 (2010).
- Kostich, M., Fire, A., Fambrough, D. M. Identification and molecular-genetic characterization of a LAMP/CD68-like protein from Caenorhabditis elegans. Journal of Cell Science. 113 (14), 2595 (2000).
- Firestein, B. L., Rongo, C. DLG-1 is a MAGUK similar to SAP97 and is required for adherens junction formation. Molecular Biology of the Cell. 12 (11), 3465-3475 (2001).
- Heschl, M. F., Baillie, D. L. Characterization of the hsp70 multigene family of Caenorhabditis elegans. DNA. 8 (4), 233-243 (1989).
- Yoneda, T., et al. Compartment-specific perturbation of protein handling activates genes encoding mitochondrial chaperones. Journal of Cell Science. 117 (18), 4055 (2004).
- Takahashi, M., Iwasaki, H., Inoue, H., Takahashi, K. Reverse Genetic Analysis of the Caenorhabditis elegans 26S Proteasome Subunits by RNA Interference. Biological Chemistry. 383, 1263 (2002).
- Le Bot, N., Tsai, M. C., Andrews, R. K., Ahringer, J. TAC-1, a regulator of microtubule length in the C. elegans embryo. Current Biology. 13 (17), 1499-1505 (2003).
- McQuary, P. R., et al. C. elegans S6K Mutants Require a Creatine-Kinase-like Effector for Lifespan Extension. Cell Reports. 14 (9), 2059-2067 (2016).
- Larance, M., et al. Global Proteomics Analysis of the Response to Starvation in C. elegans . Molecular and Cell Proteomics. 14 (7), 1989-2001 (2015).
- Yuan, Y., et al. Enhanced energy metabolism contributes to the extended life span of calorie-restricted Caenorhabditis elegans. Journal of Biological Chemistry. 287 (37), 31414-31426 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten