Method Article
משולב נוקלאוטיד שיחולץ חלבון ב Caenorhabditis elegans
In This Article
Summary
כאן, אנו מציגים עבור בידודו של RNA DNA, חלבונים מדגם זהה, פרוטוקול, במאמץ להפחית את הווריאציה לשפר הפארמצבטית, להקל על פרשנויות.
Abstract
דגימה ביולוגית יחיד מכיל שפע של מידע, עכשיו זה מקובל לחקור בו זמנית מספר מקרומולקולות כדי ללכוד תמונה מלאה של רמות מרובות של עיבוד מולקולרית של שינויים בין מצבים שונים. פרוטוקול זה מציג את השיטה של בידוד ה-DNA, RNA, וטיפל חלבון מדגם זהה של תולעים נימיות Caenorhabditis elegans כדי להסיר את הווריאציה הציג כאשר מולקולות אלה הם בודדו אותנו מהמתרחש/בית דומה אבל בסופו של דבר דוגמאות שונות. חומצות גרעין וחלבונים המחולצים של תולעים נימיות שימוש בשיטת thiocyanate-פנול-כלורופורם מיצוי חומצה guanidinium, עם משקעים עוקבות, כביסה, solubilization של כל אחד. אנו מראים את הבידוד מוצלח של RNA DNA, חלבונים מן דוגמה אחת מתוך שלושה זנים של תולעים נימיות ותאים הלה, עם תוצאות טובות יותר בידוד חלבון בבעלי חיים למבוגרים. בנוסף, guanidinium thiocyanate-פנול-כלורופורם-חילוץ חלבון של נמטודות משפר את הרזולוציה של חלבונים גדולים יותר, עם רמות לגילוי משופרת כפי שנצפה על ידי immunoblotting, בהשוואה החילוץ ריפה המסורתי של חלבון.
השיטה המוצגת כאן היא שימושית כאשר חוקרים דוגמאות שימוש בגישה multiomic, במיוחד עבור חקר פרוטאום ואת transcriptome. טכניקות בו-זמנית להעריך multiomics פונים בגלל מולקולרית איתות המשמש כבסיס ביולוגי תופעות מורכבות, נחשב להתרחש ברמות המשלים; עם זאת, זה הפך נפוץ יותר ויותר לראות כי שינויים ברמות ה-mRNA אינן משקפות תמיד את השינוי אותו ברמות החלבון ואת הזמן של אוסף רלוונטי בהקשר של תקנות היממה. שיטה זו מסירה כל וריאציה intersample כאשר assaying תוכן שונים בתוך המדגם אותו (intrasample).
Introduction
Multiomics, הגישה האנליטית העושה שילוב של טכנולוגיות, כגון הגנום, פרוטאום, transcriptome, epigenome, microbiome או lipidome, הפך יותר ויותר פופולרי בעת עיבוד ערכות נתונים גדולות עבור מחלת אפיון1, 2. הרכבה הראיות הוכיחו כי הגבלת גישות יחיד "הביתה" מספקת ניתוח מולקולרית לא שלם (נבדקה על ידי Rotroff ו- Motsinger-רייף1). ערכות נתונים גדולות נוצרים, במיוחד בעת ביצוע המסכים באמצעות טכניקות תפוקה גבוהה, אבל כדי לצייר תמונה מלאה או כדי לזהות את המטרות הרלוונטי ביותר, גישות multiomic עדיפים. עם השימוש של גישות multiomics, עם זאת, יש התבוננות תכופים אי-התאמות בין mRNA וחלבון רמות3,4,5,6. ראוי לציין, ה-mRNA, חלבון המשמש transcriptomic side-by-side וניתוחים פרוטיאומיה מבנית עם רצפי RNA (RNAseq), נוזלי כרומטוגרפיה-טנדם ספקטרומטר מסה (LC-MS/MS), בהתאמה, לעתים קרובות מתקבלים מן דגימות שטופלו באופן דומה משכפל שונים, פוטנציאל מציגה וריאציה בין אותו תנאי3,-4,-5,-6. Harvald et al. ביצע אלגנטי C. elegans רעב זמן-קורס לימוד כי בהשוואה את transcriptome ואת פרוטאום של פראי-סוג (WT) תולעים לזה של hlh-30 תולעים מוטנטים חסרי גורם שעתוק חשובים אריכות ימים 7. ראוי לציין, ה-RNA וחלבון נבצרו מ אותו מצב משכפל, אז לא מן באותה דגימת זרע. הממצאים מראים מתאם נמוך בין רמות ה-mRNA רמות החלבון בכל נקודה בזמן (r = 0.559 כדי 0.628). למעשה, heatmap שלהם יצרו ארבעה אשכולות: אשכול הייתה לי ירידה גדולה mRNA רמות אבל מעט או ללא ירידה ברמות החלבון המתאים, האשכול השני היה מעט או ללא עלייה ברמות ה-mRNA אבל עלייה ברמות החלבון, האשכול השלישי הייתה עלייה ב- mRNA רמות אבל ירידה רמות החלבון, האשכול הרביעי היה עלייה ברמות ה-mRNA אבל רק שינוי עדין רמות חלבון4. בנוסף, זו וריאציה intersample עשוי להיות מוצג במקרים היכן הדגימות באותו המצב אינם נאספים באותו הזמן המדויק. לדוגמה, ה-mRNA, חלבונים מוסדר על ידי מחזור היממה משתנים בהתאם הזמן של יום8,9, או, ליתר דיוק, את החשיפה של C. elegans אור9; ביטוי של חלבונים היממה אלה עשויות להתעכב עד 8 שעות לאחר אינדוקציה של ביטוי גנים10. למרות זאת, השכיחות של התבוננות זו אינה אומרת בהכרח שזה שגוי; למעשה, זו עשויה להיות אינפורמטיבי. חלבון ה-mRNA הם במצב דינמי מתמיד בין היווצרות והשפלה. יתר על כן, חלבונים הם לעתים קרובות posttranslationally ששינה כדי להגביר את היציבות או לזירוז שלהם השפלה11. למשל, את מעמדם ubiquitination יכול להוביל ההפעלה או פילוח פרוטאוזום או ליזוזום השפלה12. בנוסף, noncoding RNAs לשחק תפקיד חשוב בוויסות ביטוי גנים-שלבים גנים ברמת השעתוק והתרגום posttranscriptional13. לכן, השאלה היא כיצד להגביל את המשתנים כדי לאשר הסתירות שלנו להתבונן במחקרים אלה נמטודות אמיתיים.
כאן, אנו מציעים שיטה מסיר המשתנה intersample על-ידי מתן ניתוחים של מקרומולקולות שונים מדגם זהה. המטרה של פרוטוקול זה היא להציע שיטה לבודד בעקביות DNA, RNA וחלבון מתוך מדגם יחיד של C. elegans (המכונה גם תולעים), במאמץ להפחית את הווריאציה, לשפר הפארמצבטית, וכדי להקל על פרשנויות. יתרונות נוספים של שימוש באותה דגימת זרע כוללים החיסכון של זמן ומשאבים במהלך אוסף דגימה, הקלת ניתוח חתך הרוחב של דגימות יקר ומוגבל, כולל זנים קשים לגדול ולשמור, וצובר תובנות ברגולציה דיפרנציאלית של מקרומולקולות מבוסס על וריאציות intrasample mRNA וחלבון רמות.
שיטה זו מתאימה לשם הערכת ביטויים ג'ין ואת רמות החלבון מן דוגמה אחת של תולעים, המאפשר הערכה מקיפה יותר של רמות מרובות של עיבוד מולקולרית. Guanidinium thiocyanate-פנול-כלורופורם (GTCp) מגיב14, חומר כימי נפוץ כדי לבודד RNA, משמש להפקת חומצות גרעין וחלבונים מן התולעים, עם המשקעים עוקבות, כביסה, solubilization של כל אחד. פרוטוקול זה היא אוסף של שונים15,פרוטוקולים16 עם שינויים מזעריים, תוכנן עם דגש על C. elegans, אבל לנו יש גם בהצלחה מבודד RNA, חלבון ו- DNA גלולה של תאים הלה בעקבות אותם שלבים. אף לא נבדק כאן, פרוטוקול זה סביר לעבוד על רקמות גם17,18.
Protocol
הערה: כל שלב משקעים מקרומולקולה מתבצע באופן רציף, ואחריו שוטף נעשה במקביל; עם זאת, מומלץ להשלים את הבידוד RNA קודם כפי שהוא מהותי לא יציב.
1. דוגמה אוסף
- זרע ביצי התולעת 1,000 לכל צלחת 10 ס מ עם תנאי הגידול המתאימים19. דגירה ב 20 מעלות צלזיוס במשך 72 h.
הערה: מבוגרים ביצה מניבי אקונומיקה כדי לאסוף את הביצים כאמור תיאר19. - לשטוף את הצלחת עם בסביבות 5 מ של מאגר M9 ולאסוף תולעים בוגרות 1,000 לתוך צינור.
הערה: M9 המאגר מורכב של 35 מ מ סודיום פוספט dibasic, 102 מ נתרן כלורי, 22 מ"מ אשלגן פוספט monobasic 1 מ מ מגנזיום גופרתי במים סטריליים19. - Centrifuge התולעים ב x 1000 g עבור 1 דקות, למחוק את תגובת שיקוע, ולהעביר את התולעים pelleted עם 1 מ"ל M9 מאגר לרכבת התחתית microcentrifuge 1.5 mL.
- רוב תגובת שיקוע צנטריפוגה שוב ב x 845 g עבור 1 דקות וזורקים. אחסן את התולעים pelleted ב-80 מעלות צלזיוס למשך 4 שעות לפחות.
הערה: באמצעות גלולה קפוא מייצרת תשואה גבוהה יותר מאשר גלולה טריים. סדרה של מחזורים ההקפאה/ההפשרה באמצעות נוזל חנקן או 95% אתנול על קרח יבש כדי לפצח את הקוטיקולה תולעת מומלץ אם באמצעות גלולה טריים. להשאיר כמות קטנה של M9 על בגדר תסייע לשבור את הקוטיקולה כאשר קופאים.
2. נוקלאוטיד ובידוד חלבונים
- הסר כל תגובת שיקוע בגדר המופשרים ולהוסיף 1 מ"ל של ריאגנט GTCp קר. מערבבים היטב על ידי pipetting למעלה ולמטה. למקם את הדגימה על קרח למשך 10 דקות ומערבבים מדי פעם על-ידי זה מתהפך.
התראה: פנול קורוזיבי, העצבים, רעיל מאוד, עלול לגרום כוויות כימיות ועיוורון.
הערה: השתמשנו עד 5,000 תולעים בוגרות בתור חומר המוצא עם אמצעי האחסון שדווחה; כל אמצעי אחסון מבוסס על השימוש של 1 מ"ל של ריאגנט GTCp. בעת שימוש מדגם גדול יותר, ייתכן צורך לשנות את קנה המידה. - הפיתרון של תולעים, GTCp, הוסף 200 µL של כלורופורם קר. הצינור בין האצבעות ומנערים רשות ס' 15 זה בטמפרטורת החדר (RT) במשך 3 דקות.
התראה: כלורופורם הוא רעיל מגרה, עלול לגרום נזק, ממוקדות איברים אחרים ופצעים בעור, הוא קרצינוגן אפשרי. - Centrifuge את הצינור ב x 13,500 g למשך 15 דקות ב 4 º C.
הערה: שלוש שכבות נוצרות לאחר המהדורה הזו: העליון פאזה מימית ברור, התחתון, שלב אורגני ורוד, קטן, מעונן לאטמוספרה המכילה שומנים של ה-DNA. - שימוש של micropipette, לעבור ללא RNase 1.5 mL microcentrifuge צינור (שפופרת A) כדי לבודד את ה-RNA באמצעות אלכוהול משקעים (כמפורט בשלב 2.5), להעביר את השכבה ורוד (שלב אורגני) בגדר הנותרים (צינור חדש השכבה העליונה ברור (פאזה מימית) הרכבת התחתית B) ומניחים אותו על קרח.
הערה: השלב אורגני ורוד שיכול להיות קפוא ב-80 מעלות צלזיוס עד בידודו של ה-DNA וחלבון מן הדוגמא הזאת. דוגמאות גדול יותר יהיה לייצר שכבה לבנה עבה בין השלב מימית ואורגניים. שבר זה מכיל דנ א. אם ניתן להסיר רובד זה מבלי להפריע השלבים האחרים, כך ושם אותו בתוך צינור נפרד (הצינור B2). -
לבודד RNA כדלקמן.
- משלב ברור מימית בצינור A, לזרז את הרנ א עם 500 µL של 100% אלכוהול איזופרופיל. תקופת דגירה של 10 דקות ב- RT. לאחר מכן, צנטריפוגה שפופרת A ב x 13,500 g 10 דקות ב 4 º C.
הערה: גלולה לבנה קטנה של רנ א צריך להיות גלוי בחלק התחתון של הצינור. - Decant הרוב תגובת שיקוע. הסר את השאר עם מזרק 1 מ"ל עם מחט וזורקים את תגובת שיקוע.
הערה: הגודל של המחט אינו חשוב; עם זאת, לאמוד מחט גדולה תציע שליטה רבה יותר כדי לא להפריע בגדר. ניתן להשתמש micropipette אם מחטים אינן זמינות. - להוסיף 1 מ"ל של 75% אתנול צינור כדי לשטוף את גלולה. לסובב את הצינור ב x 5,300 g למשך 5 דקות ב 4 º C.
- להסיר את תגובת שיקוע בגדר על ידי decanting באמצעות מזרק 1 מ"ל עם מחט, כפי שמתואר בשלב 2.5.2, ולמחוק אותו.
- תן בגדר מילה נהדרת למשך 5 – 10 דקות, אבל לא לתת לזה overdry. להשתמש µL 50 של מים נטולי RNase כדי לשקם את צניפה של RNA לפני שהוא הופך שקוף לחלוטין.
הערה: זה אמצעי התחלה נאותה של 1,000-3,000 תולעים, אבל זה אולי צריכים להיות מותאמים בהתאם כמה חומר המוצא ששימשה. - דגירה בגדר ב 55 – 60 מעלות צלזיוס למשך 10 דקות לפזר אותו.
- למדוד את הריכוז ואת טוהר באמצעות ספקטרופוטומטרים. להקליט absorbances ב-260 nm ריכוז ה-RNA ו- 230 ו 280 ננומטר כדי לזהות כל הטומאות.
- לנקות את הרנ א כדי להסיר כל מזהמים, כמו שאריות של פנול או ה-DNA, עם עמודות טיהור או עם אתנול עוקבות שוטף וטיפול DNase.
הערה: בשלב זה, הרנ א מוכן להישלח לניתוח RNAseq או יכול לשמש כדי להפוך cDNA לשימוש עבור RT-qPCR (ראו סעיף 3.1 לפרטים). RNA ניתן לאחסן ב- 80 ° C עד שימוש נוסף.
- משלב ברור מימית בצינור A, לזרז את הרנ א עם 500 µL של 100% אלכוהול איזופרופיל. תקופת דגירה של 10 דקות ב- RT. לאחר מכן, צנטריפוגה שפופרת A ב x 13,500 g 10 דקות ב 4 º C.
-
לבודד דנ א כדלקמן.
- מן השלב אורגני ורוד בצינור B המדגם בצינור B2, אם בכלל, לזרז את ה-DNA על-ידי הוספת µL 300 של 100% אתנול וביו -מיקס על ידי היפוך. להשאיר את צינור RT למשך 2-3 דקות.
- צנטריפוגה צינורות B ו- B2 ב x 375 גרם במשך 5 דקות ב 4 ° C כדי הצניפה הדנ א.
- להעביר את תגובת שיקוע משפופרות B ו- B2 על-ידי למזוג לתוך צינור 2 מ"ל (הצינור C) ולהשאיר את זה על הקרח בידוד חלבון עוקבות. לשטוף בגדר DNA בצינור B או B2 עם 1 מ"ל של 0.1 M ציטראט נתרן 10% אתנול במשך 30 דקות צנטריפוגה צינורות B ו- B2 ב x 375 גרם במשך 5 דקות ב 4 º C.
הערה: נתרן המאגד עמוד השדרה של DNA, יצירת DNA precipitate בקלות רבה יותר סודיום ציטרט, אתנול, ומאפשר זיהומים שיוסרו על-ידי צנטריפוגה במהירות נמוכה. - חזור על השלב שטיפת כפי שמתואר בשלב 2.6.3. Resuspend בגדר ב- 1.5 מ של 75% אתנול ולהשאיר אותה RT כעשרים דקות, עם ערבוב מדי פעם על-ידי upending.
- צנטריפוגה צינור B ו- B2 ב x 375 גרם במשך 5 דקות ב 4 º C.
- למחוק את תגובת שיקוע ולאפשר לו להתייבש למשך 5 – 10 דקות.
- להמיס בגדר ב 150 µL של 8 מ"מ נתרן הידרוקסידי. התאם את רמת ה-pH הרצוי עם HEPES במידת הצורך. ספין המדגם ב x 375 גרם במשך 5 דקות ב 4 º C.
- שימוש של micropipette, להעביר את תגובת שיקוע (DNA) צינור חדש. למדוד את הריכוז ולקבוע את הטוהר באמצעות ספקטרופוטומטרים. להקליט absorbances ב-260 nm ריכוז ה-DNA ו- 230 ו 280 ננומטר כדי לזהות כל הטומאות.
-
לבודד חלבון כדלקמן.
- כדי לזרז את החלבון, להוסיף תגובת שיקוע ורוד בצינור C, מיקס על ידי היפוך מספר פעמים, עד 1.5 מ ל 100% אלכוהול איזופרופיל, דגירה-RT למשך 10 דקות.
- צנטריפוגה צינור C ב x 13,500 g 10 דקות ב 4 º C.
- למחוק את תגובת שיקוע ולשטוף את גלולה עם 2 מ של 0.3 M guanidine הידרוכלוריד אתנול 95% במשך 20 דקות בשפופרת צנטריפוגה RT. C-x 5,300 g עבור 5 דקות ב 4 º C.
- חזור על השלב שטיפת כפי שמתואר בשלב 2.7.3 2 x.
- לעבור בגדר חלבון צינור 1.5 mL (הצינור C2) ולהוסיף עד 1.5 מ ל 95% אתנול. מערבולת ולתת זה לשבת ב RT במשך 20 דקות.
- צנטריפוגה צינור C2-5,300 x g עבור 5 דקות ב 4 º C. למחוק את תגובת שיקוע ותנו בגדר יבש למשך 10 דקות ב RT. התמוססות בגדר ב- 300 µL של 5% מרחביות ב 50 מעלות צלזיוס למשך 60 דקות.
הערה: זמן דגירה ארוך עשוי להידרש להתפרק לחלוטין בגדר חלבון. בעבר, בגדר יש כבר מתפשט עבור עד 6 שעות מבלי להתפשר על איכות. - צנטריפוגה צינור C2 ב 13,500 x g 10 דקות ב-17 מעלות צלסיוס להעביר את תגובת שיקוע צינור חדש.
- למדוד את הריכוז שימוש assay כימות של החלבון המועדפת התואמת דטרגנט.
הערה: החלבון הוא מוכן לשמש מרחביות-דף סופג המערבי. ניתן לאחסן ב-20 ° C לשימוש עתידי. שיטות אחרות, כגון LC-MS/MS, הנוזל צריך להיות דיאליזה חופש.
3. הערכת mRNA ורמות החלבון
-
RT-qPCR
- הכן cDNA על ידי שעתוק במהופך עם 1 ng של RNA, באמצעות פרוטוקול thermocycler הבאים: הטרמה (5 דקות 25 ° c), שעתוק במהופך (20 דקות ב 46 ° C), ו- RT איון (1 דקות ב 95 ° C).
- להכין צלחת מניות של cDNA על-ידי הוספת µL 100 של דילולים בטחונות של כל מדגם cDNA בארות בודדים של צלחת 96-ובכן. לכלול פקדים המתאים, כגון אין בארות תבנית/מים-בלבד ודגימות באופן סדרתי מדולל 1:25 1:400 (מקורו עם cDNA במאגר מכל הדגימות ניתח) כדי לאפשר עיקול רגיל להקים פריימר יעילות עבור כל הגן ניתח.
הערה: תבנית זו יכולה לשמש עם microdispenser 96-ובכן, אשר מאפשר את העברת כל הדגימות לתוך צלחת צלחת RT-qPCR ועבור ההקלה ובכן-את pipetting וריאציות. המיקס הבסיס המתאים (למשל, SYBR + תחל) ניתן להוסיף לכל טוב לאחר מכן, עם פיפטה רב-ערוצי. באופן כללי, גישה זו מפחיתה טעויות שנעשות כאשר היד-pipetting כל דגימה, ובכך להקטין עוד יותר את השתנות. - להוסיף 3 µL של cDNA מהצלחת מניות הבארות של צלחת RT-qPCR.
- להפוך את תערובת הבסיס עבור כל ערכה של צבעי יסוד הכולל supermix x 1 המכיל צבע cyanine DNA-intercalating, 5 מיקרומטר כל של קדימה הפוכה תחל ואת המים µL עד 7 עבור כל דגימה. להוסיף 7 µL הבארות המתאים של צלחת RT-qPCR, להתסיס בקלילות לערבב.
הערה: כולל דוגמאות כדי למדוד את משק הבית גנים להשתמש כהפניה לנרמל את התוצאות20. - הפעל את הצלחת באמצעות פרוטוקול RT-qPCR מתאים צבעי יסוד בשימוש.
-
תספיג חלבון
הערה: לקבלת מידע מפורט אודות שהכלים המערבי, עיין ורד פנחסוב ויאנג21.- להכין דגימות מרחביות-דף על ידי שילוב 20 µg של חלבון עם אמצעי אחסון שווה של 2 x Laemmli מדגם מאגר ומרתיחים ב 95 מעלות צלזיוס למשך 10 דקות.
- לטעון את הדוגמאות על גבי ג'ל 4% – 15% טריס-גליצין ולהפעיל אותם ב-150 V עבור 1 h, או עד לחזית צבע מגיע לתחתית של הג'ל.
- להעביר חלבונים בג'ל קרום ניטרוצלולוזה בגיל 25 V למשך 30 דקות במנגנון העברה semidry.
- לאשר את העברה נכונה על ידי מכתימה את הקרום עם כתם צבע מאכל פונסו S.
- לשטוף ביסודיות את הכתם של הקרום בתמיסת באגירה טריס (TBS) עם polysorbate 0.01% 20 (TBS-T).
- לחסום את הקרום עם חלב דל שומן 5% ב- TBS-T עבור h 1-RT.
- דגירה הקרום ב נוגדן ראשוני-דילול המתאים על פי ההמלצות של הספק. . תשאיר את זה על הנדנדה ב 4 מעלות צלזיוס למשך הלילה
- לשטוף את הקרום 3 x, למשך 5 דקות כל אחד, עם TBS-טי
- דגירה הקרום של הנוגדן המשני המתאים-דילול המתאים על פי ההמלצות של הספק. תשאיר את זה על הנדנדה עבור h 1-RT.
- לשטוף את הקרום 3 x, למשך 5 דקות כל אחד, עם TBS-טי
- תמונה ולכמת את תספיג חלבון, תוך שימוש בשיטות המועדפת.
תוצאות
הדגימות RNA DNA, חלבונים נותחו, נציג תוצאות באמצעות מבודד את ה-RNA וחלבון מוצגים כאן. בנוסף, אנו משווים המדגם חלבון שנקטפו באמצעות השיטה GTCp נפוצות ריפה פירוק שיטת22. עבור הניסוי שלנו, השתמשנו ארבעה משכפל עצמאית של כל WT (N2) תולעים, תולעים מוטציה שני מאריכים, לאכול-2 ו- rsks-123,24.
RNA ו- DNA בכמות ובאיכות
הריכוז של RNA כאשר resuspended ב 50 µL המים נע בין 0.2-2 µg/µL, משתמש בסביבות 3,000 בוגרים תולעים חומר כמו המוצא. ספיגת יחס, אשר מצביעים על טוהר, נע בין 2.0 ל 2.2 עבור A260/A280 ו- 1.9-2.5 עבור A260/A230 (טבלה 1), המציין את החילוץ מוצלחת של RNA ללא זיהום, עם רכיבים GTCp, כגון הידרוכלוריד פנול או guanidine.
הפקת דנ א היה מוצלח, אבל האיכות משתנה. ריכוז ה-DNA בעת resuspended ב µL 150 של NaOH נע מ 0.04 אל µg 1.1/µL. היחס ספיגת נע בין 1.8 אל 2.1 עבור A260/A280 ו- 0.9 ל 1.6 עבור A260/A230 (טבלה 1), המציין את החילוץ מוצלחת של ה-DNA; עם זאת, חלק מן הדגימות היו מזוהמים עם רכיבים GTCp, כמו פנול או guanidine הידרוכלוריד. אם בידוד ה-DNA הוא הכרחי, יש לנקוט בעת הפרדת השכבה האמצעית מן ההפרדה שלב GTCp, שוטף יותר עשוי להיות נחוץ.
RT-qPCR של יעדים נבחרים
הבידוד RNA מתוך הארבעה עצמאית של כל זן התולעת היה מוצלח, נשלחה לניתוח RNAseq, עם עוקבות RT-qPCR מבוצעים על-ידי supermix המכיל צבע cyanine. מטרות נותחו על ידי RT-qPCR נבחרו מתוך מערכת נתונים RNAseq גדולה המבוססת על הגנים מוסדר באופן שונה הכי נפוץ אצל שתי מוטציות לעומת התולעים WT. F07C4.1225, homolog כדי neuroligin האנושי 3, isoform b, הייתה המטרה שנבחרה upregulated משותפת. אנחנו כללה גם גן מוסדר באופן שונה בין שתי מוטציות, mrp-126, לניתוח נוסף, אשר היה upregulated ב 2 לאכול תולעים אבל downregulated בעיר וורמס rsks-1 . שינויים בביטוי של mrp-1 אומתו באמצעות RT-qPCR; עם זאת, קולטנים F07C4.12 upregulation ב rsks-1 תולעים חזה על ידי ניתוח RNAseq לא נראתה על ידי RT-qPCR (איור 1).
מטרות נוספות עם נוגדנים לאמת לתולעים נחקרו גם כן. אלה כללו מספר סמנים אברון מאופיין Hadwiger et al.27... מספר סמנים אלה באו לידי ביטוי באופן שונה ברמת mRNA של התולעים מוטציה. כפי שניתן לראות באיור1, lmp-128 ותיבות דו-שיח-129 היו upregulated בעיר וורמס לאכול-2 ; hsp-4 30, hsp-7030 lmp-1 היו upregulated בעיר וורמס rsks-1 ; hsp-60 31 ו- pas-732 היו downregulated בעיר וורמס לאכול-2 ; hsp-60 וטק-133 היו downregulated בעיר וורמס rsks-1 .
הכנה חלבון סימולטני מול ריפה
כדי לאשר את יעילות ואיכות החלבון באמצעות שיטת GTCp כמתואר לעיל, אנחנו לעומת זה חלבון נאסף באמצעות השיטה המסורתית של פירוק ריפה22. באמצעות כמות זהה של החומר, כלומר גם למבוגרים בלבד (כ-10,000 תולעים) או אוכלוסייה מעורבת של מבוגרים, רימות וביצים (כ-130,000 תולעים), החל הכמות הכוללת הנאספים יחד עם GTCp היה פחות כאשר resuspended השווה קצה כרכים (טבלה 1 ); עם זאת, החילוץ אוכלוסייה למבוגרים בלבד היה מוצלח יותר של אוכלוסייה מעורבת. בנוסף, האיכות של החלבונים היה דומה, אם כי החלבון GTCp, חילוץ הראה רזולוציה טובה יותר של חלבונים גדולים יותר על טעינת שווה של חלבון הכולל, כפי שהראה Coomassie הכתם באיור2. אכן, מטרות הערכה על ידי תספיג באיור 3 הראו רמות דומות ברוב המקרים; עם זאת, החלבונים הגדולים מ- 75 kDa הראו רמות נמוכות יותר החלבון ריפה, חילוץ בהשוואה החלבון GTCp, חילוץ (איור 3 א, בנתיב הימני; איור 3B, צהוב בר).
שיטת החילוץ המובאת כאן הוערך גם בקו בתרבית של תאים הלה. לעיון, כמות חלבון המופק עם ריפה גלולה קומפקטי של שישה מיליון תאים הלה (גלולה µL ~ 25) היה לזו מופק אוכלוסייה מעורבת 130,000 של תולעים (גלולה קומפקטי µL ~ 75), או בערך חצי ממה מופק מ-10,000 תולעים בוגרות (µL ~ 100 התיישבו הכבידה גלולה), כפי שנראה בטבלה1. אנחנו מראים כי היעילות של חלבון החילוץ (טבלה 1) ואת הרזולוציה של חלבונים גדולים יותר (איור 2) ירדו ב GTCp בהשוואה ריפה-לחלץ את החלבון בתאים הלה, מציעה שטכניקה זו פועלת טוב יותר אוכלוסיית הבוגרים של תולעים. Solubilization לא שלם של בגדר חלבון מחלבון הלה, חילוץ GTCp עשוי להיות מגבלה של שיטה זו של תאי יונקים.
מטרות Immunoblotting נותחו על ידי RT-qPCR
בשלב הבא, חקרנו את רמות החלבון של ג'ין מוצרים שנבדקו על-ידי RT-qPCR כדי לקבוע אם רמות ה-mRNA בקורלציה עם רמות חלבון. כפי שניתן לראות באיור3, השינויים ביטוי הממוצע של חלבון בקורלציה עם הביטויים mRNA הממוצע לשנות עבור מטרות רבות; עם זאת, כמה רמות חלבון לא שיקפה את השינויים ברמות ה-mRNA. לעתים קרובות, רמות ה-mRNA לאכול-2 תולעים היו גבוהים יותר מאשר אלו זנים אחרים, אבל רמות החלבון היו גם זהים או נמוכות יותר זנים אחרים לאותו היעד. התצפית הבולטים היה רמות גבוהות מאוד של תיבות דו-שיח-1 mRNA בעיר וורמס לאכול-2 , אשר לא לתרגם יותר חלבון; למעשה, היו רמות חלבון נמוכות יותר תיבות דו-שיח-1 לעומת זנים אחרים (איור 3).
בסופו של דבר, רמות החלבון GTCp, חילוץ, החלבון ריפה, חילוץ הראו הבדל בולט. ה-RNA שהופק באופן זהה עבור שניהם; עם זאת, המדגם דומים אך שונים שנאספו על ידי פירוק ריפה הראה בצורה ניכרת מופחתת רמות החלבון, במיוחד עבור אלה גדול יותר kDa 75 (איור 3A, בנתיב הימני; איור 3B, צהוב בר).
השוואה intrasample של רמות ה-mRNA, חלבון
אחת המטרות של פרוטוקול זה היה כדי לקבוע אם הווריאציה ראינו ה-mRNA, רמת חלבון היה אמיתי, או שזה יכול להיות חפץ של וריאציה intersample. איור 4, תת-קבוצה של מטרות נמשל בתוך הדגימות יחיד. כל מדגם בודדים מוצג את אותו הגוון והצבע של הנקודה, עם דגימת 1 להיות הגוון הכהה ולדגום 4 הגוון הבהיר של אפור (WT), כחול (לאכול-2), או אדום (rsks-1). בתוך רוב דגימות, הייתה השתנות נמוכה של רמות ה-mRNA, עם השתנות גדולה ברמת חלבון, ליקוי פוטנציאלי של ניתוח semiquantitative של שהכלים המערבי. כאשר מסתכלים על המיקום של כל אחד הנקודות הצבעוניות בין זוגות mRNA, חלבון, הסדר של הגבוה-כדי-הנמוך לעיתים קרובות לא תאמה; לדוגמה, ב WT, סדר mRNA hsp-60 היה לטעום 4, 3, 2, 1, אבל את רמות החלבון היו 1, 2, 3, 4. לפיכך, ההבדלים בין רמות ה-mRNA, חלבון בתוך מדגם בהחלט קיימים, אבל השיטה הציג מאפשר למשתמשים להסיר את הזמן של אוסף כמקור אפשרי של ההבדל שנצפו.
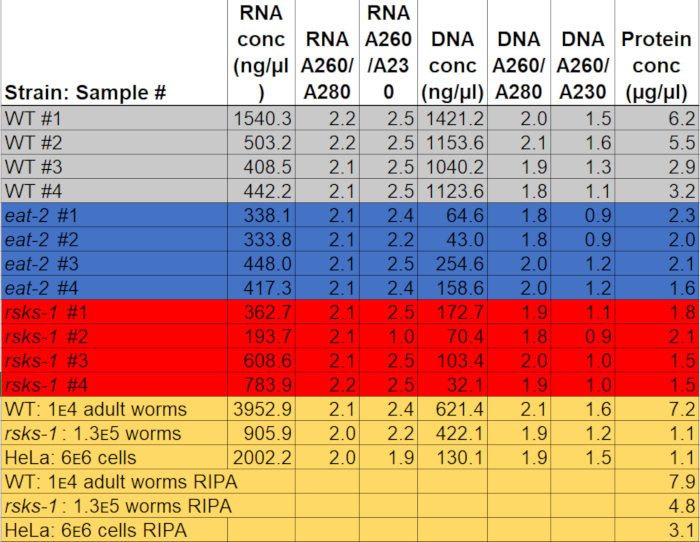
טבלה 1: ריכוזי, הקליטה יחסי. על ספקטרופוטומטרים נמדדו ריכוזים RNA ו- DNA ואת טוהר יחסי. ריכוז החלבון היו נחושים שימוש assay כימות של חלבון ערכי צבע מוחלטים. אפור, כחול, ואדום להדגיש את הדגימות שימשו RT-qPCR ותספיג חלבון. הצהוב מצביע על דגימות המשמשות להשוואה GTCp ריפה חלבון חילוץ או תולעת חלבון הלה לחלבון. אנא לחץ כאן כדי להוריד את הקובץ.
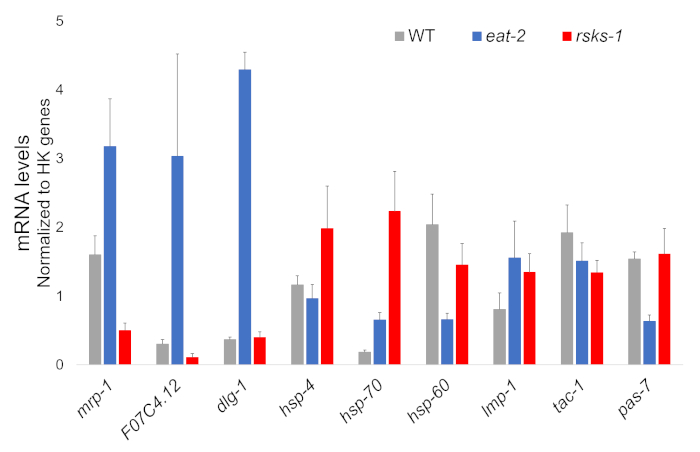
איור 1: ביטוי גנים מאת RT-qPCR. RT-qPCR ניתוח של mRNA המתקבלות בשיטה זו, המאשרת את המטרות זוהו מנתונים RNAseq, של אברון סמן גנים. קווי השגיאה לייצג סטיית תקן; n = 4. הריכוז של ה-mRNA הוגדרה מפני עיקול רגיל עבור כל ערכה של צבעי יסוד. כל רמות ה-mRNA היו מנורמל לממוצע של קבוצת בשישה גנים משק הבית משמש גנים התייחסות, הכוללים מעשה-1, ה-cdc-42, ama-1, nhr-23, pmp-3 וסין-1. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
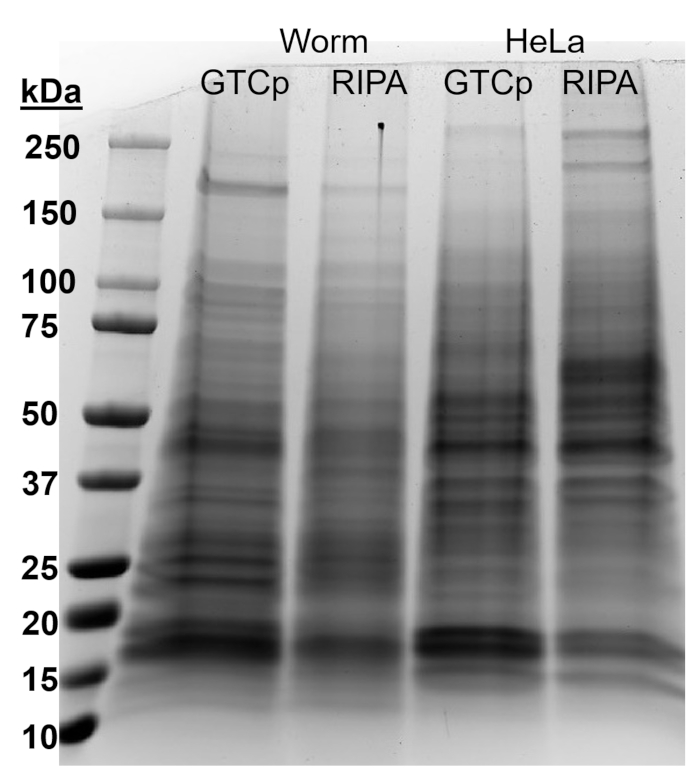
איור 2: השוואה של GTCp-לעומת חלבון ריפה, חילוץ תולעים ותאים הלה. חלבון הכולל פראי-סוג התולעים (WT) או תאים הלה קצרו דרך GTCp או ריפה פירוק בשיטה, מופרדים על-ידי מרחביות-דף, מוכתם כחול Coomassie. כל ליין מכיל 25 µg של חלבון הכולל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
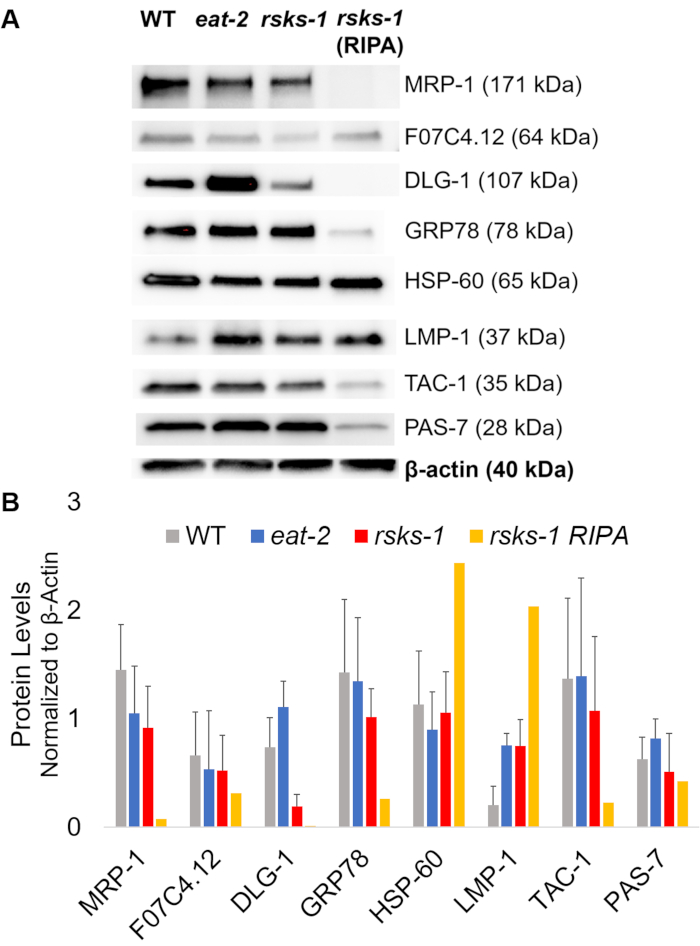
איור 3: רמות החלבון תולעים. (א) תספיג של מטרות נחקרים על ידי RT-qPCR וניתוח densitometry (B) של עוצמת האות. כל ליין מכיל 20 µg סה כ GTCp-לחלץ את החלבון פראי-סוג (WT), לאכול-2או תולעים מוטציה rsks-1 . התמונה המוצגת היא ייצוג של משכפל עצמאית ארבעה לכל זן תולעת. Β-אקטין (למטה) נעשה שימוש כדי לשלוט להעלאה שווה עבור כל מטרה; סט נציג אחד מוצג. לנתיב הימני מכיל 20 µg של חלבון ריפה, חילוץ הכולל של תולעים מוטציה rsks-1 . (B) עוצמות האות המתאימה היו לכמת באמצעות ImageJ. קווי השגיאה לייצג סטיית תקן; n = 4. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
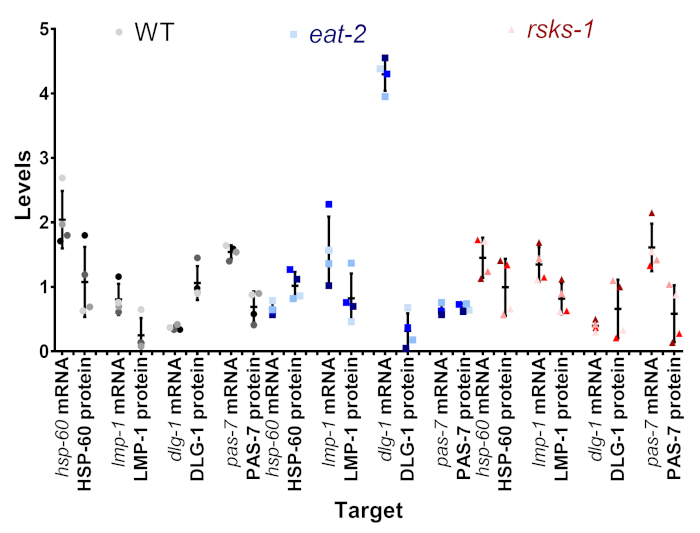
איור 4: Intrasample mRNA וחלבון ברמה השוואה. רמות ה-mRNA וחלבון בודדים דגימות תת-קבוצה של מטרות עבור כל זן מיושרים. הצבע הוא הנציג של טבלה 1. האפור/השחור WT, הכחול הוא לאכול-2, האדום הוא rsks-1. ה-mRNA, חלבון של אותו יעד לזווג אחד ליד השני, מופרדים על-ידי נמטודות זן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
שיטות ומשום biomolecule, כגון ה-DNA, RNA, חלבונים, לעיתים קרובות אופטימיזציה ללא חפיפה טכני או שילובים. זה חסרון במיוחד כאשר הם דוגמאות קשה להשיג, אשר יכול להוביל קציר דגימות תחת באותם התנאים בזמנים שונים. בהתאם המסלולים הסלולר, משכפל נאסף במועדים שונים עשויה ליצור וריאציה. כתב יד זה מציע הליך כדי לעקוף את המכשול הזה על-ידי הפיכת בידוד בו-זמניות של טיהור של כל biomolecule מדגם זהה של תולעים, הפחתת וריאציות שהוצגו על ידי טכניקות שונות בידוד, העיתוי של מדגם הקציר, או קציר שוויוני. שליטה משתנים אלה לא רק חוסך זמן ומשאבים, אלא גם מסייע הפארמצבטית. . הנה, נדגים בגישה קומבינטורית הנמנעת RNA להתפשר על ואיכות חלבון, אמנם עם התוצאות משתנה עם ה-DNA. ההכנות ניתן בהמשך למטב באמצעות DNA ניקוי הליכים. להדגים את הגישה באמצעות חומר מתאי C. elegans , הלה נמטודות.
העבודות הקודמות לחקור את transcriptome ואת פרוטאום של N2 WT ובעלי מוטציות לאכול-2 ו- rsks-1 להציע תובנה מסלולים שונים, לרבות מנגנונים להאריך את תוחלת החיים4,34,35 ,36. במטרה לחקור את המנגנון של הגבלה קלורית, הארכת תוחלת החיים, תיוג איזוטופ יציב עם/על-ידי חומצות אמינו בתא ניתוח התרבות (SILAC) מצא כי תאכל-2 תולעים יש של downregulation הכוללת של סינתזה של חלבון העולמי 36. הנתונים המובאים כאן הם עקביים עם ממצא זה, גם רמות ה-mRNA של המטרות אותן הם גדל באופן משמעותי. קבוצה נוספת שמטרתה לזהות effectors לאריכות ימים בתיווך S6K והופיע, לפיכך, מסך פרוטיאומיה מבנית של rsks-1 תולעים34. מן הנתונים RNAseq נמצאו עם המחקר הנוכחי, זיהינו לפחות שלושה גנים המאששים עם חלבונים מזוהה מסך זה; MRP-1 ו- homologs של רו ח, neuroligin (F07C4.12) התגלו כ באות לידי ביטוי באופן שונה ב- worms rsks-1 לעומת WT N234.
הנתונים שנוצר בשיטה זו הם עקביים עם חקירות multiomic הקודם. רמות ה-mRNA של יעדים תשע שימשו כדי לחזות את רמות החלבון כל דגימה. מטרות אלה, רבים היו רמות חלבון צפוי המבוסס על רמות ה-mRNA. למרות זאת, היו סתירות הבולטים בין רמות ה-mRNA וחלבון. חשוב, פרוטוקול המובאת כאן מאפשרת למדענים בביטחון להעריך ולפרש הבדלים אלה על-ידי הסרת השתנות intersample על ידי איסוף mRNA וחלבון מדגם זהה. יתר על כן, השווינו את רמות ה-mRNA את רמות החלבון שנאסף באותה דגימת זרע או שנאסף מדגם דומה אבל שונה שנקטפו עם ריפה. הראינו כי עבור מספר המטרות, שהיו הרבה רמות נמוכות של חלבון במדגם ריפה, חילוץ. ללא שליטה על וריאציית intersample, זה יהיה בלתי אפשרי לדעת אם ההבדל הזה נבע ברגולציה דיפרנציאלית של mRNA וחלבון.
חשוב לזכור כי ישנם פרוטוקולים מותאם במיוחד עבור אלה מקרומולקולות שונה, אז אם ניתוח חתך הרוחב אינה המטרה הסופית של הניסוי, ואז זה יהיה רלוונטי להעסיק בשיטות אלה במקום זאת. שימוש GTCp כדי לבודד דנ א, חלבון גורמת להם להיות פחות מסיסים, המחייב את בנייתו מחדש של ה-DNA ב בסיס חלש, כגון NaOH, ו solubilizing החלבון של מאגר עם ריכוז גבוה של סבון עם חימום, תוך סיכון לא שלם solubilization. בנוסף, GTCp מכיל guanidinium thiocyanate ופנול חומצי, אשר חלבונית אנזימים כגון פרוטאזות, אבל לאט לאט תגרע חלבון לאורך זמן אלא אם קפוא. זה יהיה שיקול הדעת של החוקר להחליט אם circumvention של מגבלות אלה יהיו למשתלם.
חשוב בעת עבודה עם RNA טכניקה סטרילי, שמירה על המדגם על קרח, אלא אם צוין אחרת, השימוש מטהר זמינים מסחרית ריאגנט מומלץ לשמור את הרנ א ללא פגע. ראוי לציין, דגימות גדולה יותר יהיה צורך GTCp יותר כדי להתחיל עם, שבו כל הממס החילוץ גם צריך להיות להיות יורה. פרוטוקול זה אינו דורש כל המגון ידנית של הדגימות תולעת או תא כאשר הכמות המדוייקת של GTCp. בהקשר של בידוד ה-DNA, התשואה תלויה מאוד מיומנות כדי לשחזר את השכבה (ורוד) אורגני. לבסוף, כדי לשפר את solubilization של חלבונים במהלך בידוד, הגדלת הנפח של מאגר resolubilization או הוספת דטרגנטים אחרים מלבד מרחביות ייתכן שיהיה צורך. ואכן, חלבונים מאוכלוסיה למבוגרים בלבד של תולעים במקום תערובת של מבוגרים, רימות וביצים הם הרבה יותר קל resolubilize.
בסך הכל, באמצעות פרוטוקול זה מספק גישה אינטגרטיבית כדי biomolecule ומשום ואסטמה ומקילה על הפרשנות של מתאמים, או היעדרה, בין רמות ה-mRNA, חלבון זה יכול לנבוע בנפרד קציר מולקולות מ שונה דוגמאות. בשיטה זו יכול לעזור מדענים לזהות כראוי במקרים שבהם התרגום של mRNA לחלבון אינה correlative והוא יכול להוביל חקירה עמוקה יותר של מנגנוני רגולציה posttranscriptional ו- posttranslational בתנאים שונים.
Disclosures
המחברים אין לחשוף.
Acknowledgements
L.r.l. ב מומן על ידי מעניקה מ NIH/NIA (R00 AG042494 ו- R01 AG051810), בסיס גלן מחקר רפואי, פרס המחקר הביולוגי מנגנונים של הזדקנות, מענק סגל ג'וניור של הפדרציה האמריקנית לחקר הזדקנות. המחברים רוצה להודות וונג קוואן שי של אניטה קומר למשוב שימושי שלהם בכתביו של כתב היד הזה.
Materials
| Name | Company | Catalog Number | Comments |
| 4–15% Mini-PROTEAN® TGX Stain-Free™ Protein Gels | BIORAD | 4568084 | |
| Antibodies: | |||
| CePAS7-s | DHSB- U of Iowa | ||
| CeTAC1-s | DHSB- U of Iowa | ||
| DLG1-s | DHSB- U of Iowa | ||
| GRP78 | Novus Bio. | NBp1-06274 | |
| HRP Goat Anti-Mouse | Li-Cor | 926-80010 | |
| HRP Goat Anti-Rabbit | Li-Cor | 92680011 | |
| HSP60-s | DHSB- U of Iowa | ||
| LMP1-s | DHSB- U of Iowa | ||
| MRP-1 | Abcam | ab24102 | |
| Neuroligin 3 | Abcam | ab172798 | |
| β-actin | Millipore | MAB1501R | |
| ChemiDoc MP Imaging System | BIORAD | ||
| Chloroform | Fisher | C298-500 | Health hazard, Irritant, Toxic |
| Coomassie Brilliant Blue | ThermoSci | 20279 | |
| DC Protein assay | BIORAD | 500-0116 | |
| Epoch 2 microplate reader | BioTek | ||
| Ethanol (200 proof) | Fisher | 04-355-223 | Flammable, health hazard |
| HeLa cells | ATCC | CCL-2 | BSL2 |
| iScript Reverse Transcription Supermix | BIORAD | 1708840 | |
| Hydra microdispenser: Matrix Hydra | Robbins/ThermoFisher | ||
| Isopropanol | Fisher | A516-4 | Flammable, health hazard |
| M9 buffer: 3 g KH2PO4 6 g Na2HPO4 5 g NaCl Add H2O to 1 liter. Sterilize by autoclaving. After solution cools down, add 1 mL sterile 1 M MgSO4 | |||
| Laemmli Sample Buffer (2x) | BIORAD | 161-0737 | |
| NanoDrop One | ThermoSci | ||
| PAGE apparatus | BIORAD | ||
| Ponceau S | Alfa Aesar | J60744 | |
| Primers | IDT | 25 nmole DNA Oligo with Standard Desalting | |
| dlg-1: F (5'-GGTCCTACCA GGCAGTTGAG-3') R (5'-CACGTCCGTT AACCTCTCCC-3') | |||
| hsp-4: F (5'-AGAGGGCTTT GTCAACCCAG-3') R (5'-TCGTCAGGGT TGATTCCACG-3') | |||
| hsp-70: F (5'-CGGCATGTGA ACGTGCTAAG-3') R (5'-GAGCAGTTGA GGTCCTTCCC-3') | |||
| hsp-60: F (5'-ATTGAGCAAT CGACGAGCGA-3') R (5'-CAACACCTCC TCCTGGAACG-3') | |||
| lmp-1: F (5'-ACAACAACAC CGGACTCACG-3') R (5'-ATCGAGCTCC CACTCTTTGG-3') | |||
| tac-1: F (5'-AGTGGCAGGC AAAGTTCCTC-3') R (5'-TGAGCACCTT GATCTCGTCG-3') | |||
| pas-7: F (5'-GTACGCTCAA AAGGCTGTCG-3') R (5'-CTGAATCGGC ATTGGCTCAC-3') | |||
| mrp-1: F (5'-TTTGCCTTGC GCTTGTTCTG-3') R (5'-AGTTCCAGTG CGGAGCATAC-3') | |||
| F07C4.12: F (5'-TGCTGAGCAT GAAGGACTGT-3') R (5'-TGGCAATAGC TCCTCCGTTG-3') | |||
| HK Actin: F (5'-CTACGAACTT CCTGACGGACAAG-3') R (5'-CCGGCGGACT CCATACC-3') | |||
| HK cyn-1: F (5'-GTGTCACCAT GGAGTTGTTC-3') R (5'-TCCGTAGATT GATTCACCAC-3') | |||
| HK nhr-23: F (5'-CAGAAACACT GAAGAACGCG-3') R (5'-CGATCTGCAG TGAATAGCTC-3') | |||
| HK ama-1: F (5'-TGGAACTCTG GAGTCACACC-3') R (5'-CATCCTCCTT CATTGAACGG-3') | |||
| HK cdc-42: F (5'-CTGCTGGACA GGAAGATTACG-3') R (5'-CTCGGACATT CTCGAATGAAG-3') | |||
| HK pmp-3: F (5'-GTTCCCGTGT TCATCACTCAT-3') R (5'-ACACCGTCGA GAAGCTGTAGA-3') | |||
| LightCycler 96 qPCR machine | Roche | ||
| RIPA buffer: 10 mM Tris-Cl (pH 8.0) 1 mM EDTA 1% Triton X-100 0.2% SDS 140 mM NaCl 1 tablet of Roche protease inhibitor per 20 mL | |||
| SsoAdvanced Universal SYBR Supermix | BIORAD | 1725274 | |
| SuperSignal West Femto Max Sens Substrate | ThermoSci | 34095 | |
| Trans-Blot Transfer apparatus | BIORAD | ||
| Trans-Blot Turbo Transfer Pack | BIORAD | 170-4159 | |
| TRIzol reagent | Invitrogen | 15596026 | Health hazard (skin, eyes) |
| Worm strains: | Caenorhabditis Genetics Center (CGC) | ||
| N2 (wild type) | Caenorhabditis Genetics Center (CGC) | ||
| eat-2 (MAH95) | Caenorhabditis Genetics Center (CGC) | ||
| rsks-1 (VB633) | Caenorhabditis Genetics Center (CGC) |
References
- Rotroff, D. M., Motsinger-Reif, A. A. Embracing Integrative Multiomics Approaches. International Journal of Genomics. 2016, 1715985 (2016).
- Chen, R., Snyder, M. Promise of personalized omics to precision medicine. Wiley Interdisciplinary Reviews: System Biology and Medicine. 5 (1), 73-82 (2013).
- Anderson, L., Seilhamer, J. A comparison of selected mRNA and protein abundances in human liver. Electrophoresis. 18 (3-4), 533-537 (1997).
- Harvald, E. B., et al. Multi-omics Analyses of Starvation Responses Reveal a Central Role for Lipoprotein Metabolism in Acute Starvation Survival in C. elegans. Cell Systems. 5 (1), (2017).
- Griffin, T. J., et al. Complementary profiling of gene expression at the transcriptome and proteome levels in Saccharomyces cerevisiae. Molecular and Cell Proteomics. 1 (4), 323-333 (2002).
- Greenbaum, D., Colangelo, C., Williams, K., Gerstein, M. Comparing protein abundance and mRNA expression levels on a genomic scale. Genome Biology. 4 (9), 117 (2003).
- Lapierre, L. R., et al. The TFEB orthologue HLH-30 regulates autophagy and modulates longevity in Caenorhabditis elegans. Nature Communications. 4, 2267 (2013).
- Doherty, C. J., Kay, S. A. Circadian control of global gene expression patterns. Annual Reviews Genetics. 44, 419-444 (2010).
- Goya, M. E., Romanowski, A., Caldart, C. S., Benard, C. Y., Golombek, D. A. Circadian rhythms identified in Caenorhabditis elegans by in vivo long-term monitoring of a bioluminescent reporter. Proceedings of the National Academy of Sciences USA. 113 (48), E7837-E7845 (2016).
- Dalvin, L. A., Fautsch, M. P. Analysis of Circadian Rhythm Gene Expression With Reference to Diurnal Pattern of Intraocular Pressure in Mice. Investigative Ophthalmology and Visual Science. 56 (4), 2657-2663 (2015).
- Narayanan, A., Jacobson, M. P. Computational studies of protein regulation by post-translational phosphorylation. Current Opinion in Structural Biology. 19 (2), 156-163 (2009).
- Swatek, K. N., Komander, D. Ubiquitin modifications. Cell Research. 26 (4), 399-422 (2016).
- Cech, T. R., Steitz, J. A. The noncoding RNA revolution-trashing old rules to forge new ones. Cell. 157 (1), 77-94 (2014).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical Biochemistry. 162 (1), 156-159 (1987).
- Triant, D. A., Whitehead, A. Simultaneous Extraction of High-Quality RNA and DNA from Small Tissue Samples. Journal of Heredity. 100 (2), 246-250 (2009).
- Liu, X., Harada, S. RNA Isolation from Mammalian Samples. Current Protocols in Molecular Biology. 103 (1), 11-14 (2013).
- Hummon, A. B., Lim, S. R., Difilippantonio, M. J., Ried, T. Isolation and solubilization of proteins after TRIzol extraction of RNA and DNA from patient material following prolonged storage. Biotechniques. 42 (4), 467-470 (2007).
- Kopec, A. M., Rivera, P. D., Lacagnina, M. J., Hanamsagar, R., Bilbo, S. D. Optimized solubilization of TRIzol-precipitated protein permits Western blotting analysis to maximize data available from brain tissue. Journal of Neuroscience Methods. 280, 64-76 (2017).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Hoogewijs, D., Houthoofd, K., Matthijssens, F., Vandesompele, J., Vanfleteren, J. R. Selection and validation of a set of reliable reference genes for quantitative sod gene expression analysis in C. elegans. BMC Molecular Biology. 9 (1), 9 (2008).
- Mahmood, T., Yang, P. -. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Peach, M., Marsh, N., MacPhee, D. J., Kurien, B. T., Scofield, R. H. Protein solubilization: Attend to the choice of lysis buffer. Protein Electrophoresis: Methods and Protocols. , 37-47 (2012).
- Lakowski, B., Hekimi, S. The genetics of caloric restriction in Caenorhabditis elegans. Proceedings of the National Academy of Science USA. 95 (22), 13091-13096 (1998).
- Pan, K. Z., et al. Inhibition of mRNA translation extends lifespan in Caenorhabditis elegans. Aging Cell. 6 (1), 111-119 (2007).
- Gaudet, P., Livstone, M. S., Lewis, S. E., Thomas, P. D. Phylogenetic-based propagation of functional annotations within the Gene Ontology consortium. Briefings in Bioinformatics. 12 (5), 449-462 (2011).
- Broeks, A., Gerrard, B., Allikmets, R., Dean, M., Plasterk, R. H. Homologues of the human multidrug resistance genes MRP and MDR contribute to heavy metal resistance in the soil nematode Caenorhabditis elegans. The EMBO Journal. 15 (22), 6132-6143 (1996).
- Hadwiger, G., Dour, S., Arur, S., Fox, P., Nonet, M. L. A Monoclonal Antibody Toolkit for C. elegans. PLoS One. 5 (4), e10161 (2010).
- Kostich, M., Fire, A., Fambrough, D. M. Identification and molecular-genetic characterization of a LAMP/CD68-like protein from Caenorhabditis elegans. Journal of Cell Science. 113 (14), 2595 (2000).
- Firestein, B. L., Rongo, C. DLG-1 is a MAGUK similar to SAP97 and is required for adherens junction formation. Molecular Biology of the Cell. 12 (11), 3465-3475 (2001).
- Heschl, M. F., Baillie, D. L. Characterization of the hsp70 multigene family of Caenorhabditis elegans. DNA. 8 (4), 233-243 (1989).
- Yoneda, T., et al. Compartment-specific perturbation of protein handling activates genes encoding mitochondrial chaperones. Journal of Cell Science. 117 (18), 4055 (2004).
- Takahashi, M., Iwasaki, H., Inoue, H., Takahashi, K. Reverse Genetic Analysis of the Caenorhabditis elegans 26S Proteasome Subunits by RNA Interference. Biological Chemistry. 383, 1263 (2002).
- Le Bot, N., Tsai, M. C., Andrews, R. K., Ahringer, J. TAC-1, a regulator of microtubule length in the C. elegans embryo. Current Biology. 13 (17), 1499-1505 (2003).
- McQuary, P. R., et al. C. elegans S6K Mutants Require a Creatine-Kinase-like Effector for Lifespan Extension. Cell Reports. 14 (9), 2059-2067 (2016).
- Larance, M., et al. Global Proteomics Analysis of the Response to Starvation in C. elegans . Molecular and Cell Proteomics. 14 (7), 1989-2001 (2015).
- Yuan, Y., et al. Enhanced energy metabolism contributes to the extended life span of calorie-restricted Caenorhabditis elegans. Journal of Biological Chemistry. 287 (37), 31414-31426 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved