Method Article
Cuantificación de la aterosclerosis en ratones
En este artículo
Resumen
Los modelos murinos de aterosclerosis son herramientas útiles para investigar vías patógenas a nivel molecular, pero requieren una cuantificación estandarizada del desarrollo de lesiones. Este protocolo describe un método optimizado para determinar el tamaño de la lesión en los vasos arteriales principales, incluyendo la raíz aórtica, el arco aórtico y la arteria braquiocéfala.
Resumen
Las enfermedades cardiovasculares son la principal causa de muerte en el mundo. La causa subyacente en la mayoría de los casos es la aterosclerosis, que es en parte una enfermedad inflamatoria crónica. Estudios experimentales de aterosclerosis han aclarado el papel del colesterol y la inflamación en el proceso de la enfermedad. Esto ha llevado a ensayos clínicos exitosos con agentes farmacéuticos que reducen las manifestaciones clínicas de la aterosclerosis. Los experimentos cuidadosos y bien controlados en modelos de ratón de la enfermedad podrían dilucidar aún más la patogénesis de la enfermedad, que no se entiende completamente. El análisis estandarizado de lesiones es importante para reducir la variabilidad experimental y aumentar la reproducibilidad. Determinar el tamaño de la lesión en la raíz aórtica, el arco aórtico y la arteria braquiocéfala son puntos finales comunes en la aterosclerosis experimental. Este protocolo proporciona una descripción técnica para la evaluación de la aterosclerosis en todos estos sitios con un solo ratón. El protocolo es particularmente útil cuando el material es limitado, como es frecuentemente el caso cuando se caracterizan animales modificados genéticamente.
Introducción
Las enfermedades cardiovasculares son la principal causa de muerte en el mundo con cardiopatía isquémica y accidente cerebrovascular que representan una de cada cuatro muertes1. La mayoría de los casos son causados por la aterosclerosis, una enfermedad caracterizada por una acumulación lenta de placas llenas de lípidos con signos de inflamación crónica en arterias grandes y medianas2. La enfermedad generalmente pasa desapercibida durante varias décadas hasta que una ruptura o erosión de la placa provoca una trombosis arterial que conduce a daño del tejido isquémico.
Una arteria normal consiste en una capa de intima con células endoteliales y células musculares lisas escasamente distribuidas, una capa mediacon células musculares lisas y lamelas elásticas, y una capa adventitativa circundante con tejido conectivo suelto 3. Una retención intimal de LDL compensa el desarrollo de aterosclerosis4. La acumulación y modificación de lipoproteínas conducen a la agregación y atrapamiento dentro de la intima arterial5. Una respuesta inflamatoria es evocada por las lipoproteínas atrapadas y modificadas6. Las células endoteliales comienzan a expresar moléculas de adhesión, como El VCAM-1 en sitios en elárbol arterial con flujo sanguíneo turbulento, lo que conduce al reclutamiento de monocitos circulantes y otros leucocitos 7. Los monocitos infiltrados se diferencian en macrófagos que envuelven lípidos con la transformación subsiguiente a las células de espuma de macrófagos8.
La aterosclerosis se ha estudiado en modelos de ratón con frecuencia creciente desde mediados de la década de 1980. C57BL/6 es la cepa de ratón endogámica más utilizada para estos estudios, y se utiliza como antecedentes genéticos para la mayoría de las cepas modificadas genéticamente9. Esta cepa fue establecida en la década de 192010,y su genoma fue publicado en 200211. Los experimentos en modelos de ratón tienen varios beneficios: las colonias se reproducen rápidamente, la vivienda es eficiente en el espacio y la endogamia reduce la variabilidad experimental. El modelo también permite manipulaciones genéticas, como deleciones genéticas dirigidas e inserción de transgenes. Esto ha llevado a una nueva comprensión fisiológica de la enfermedad y nuevas metas de terapia12.
Los ratones C57BL/6 de tipo salvaje son naturalmente resistentes a la aterosclerosis. Tienen la mayor parte del colesterol circulante en HDL, y lesiones ateroscleróticas complejas no se forman incluso cuando se alimentan de una dieta alta en grasas y colesterol13. Por lo tanto, los ratones hipercolesterolémicos, como Apoe-/- en el fondo C57BL/6, se utilizan como modelos experimentales de aterosclerosis14,15. La falta de ApoE afecta la absorción hepática de lipoproteínas remanentes y perturba gravemente el metabolismo de los lípidos. En los ratones Apoe-/-, el colesterol circulante es predominantemente en partículas vLDL, y los ratones desarrollan placas ateroscleróticas complejas en una dieta regular para la dieta.
Ldlr-/- ratones imitan el desarrollo de aterosclerosis visto en humanos con hipercolesterolemia familiar16. Los ratones Ldlr-/- necesitan una dieta de tipo occidental para desarrollar aterosclerosis17. La dieta occidental imita la ingesta de alimentos humanos y generalmente contiene 0.15% colesterol. El receptor LDL reconoce ApoB100 y ApoE y media la aceptación de partículas LDL a través de la endoocitosis. Los receptores LDL son fundamentales para el aclaramiento hepático de LDL de la circulación, mientras que la expresión del receptor LDL en las células hematopoyéticas no influye en este proceso. Esto abre la posibilidad de trasplante de médula ósea de células Ldlr+/+ en receptores hipercolesterolémicos de Ldlr-/- y evaluación del desarrollo de aterosclerosis. Las quimeras de médula ósea se han utilizado comúnmente para estudiar la participación de células hematopoyéticas en la aterosclerosis experimental. Sin embargo, el trasplante de médula ósea podría influir en el tamaño y la composición de las placas ateroscleróticas, haciendo que la interpretación de los resultados sea ambigua.
Se han desarrollado diferentes variantes de ratones Apoe-/- y Ldlr-/- con alteraciones genéticas adicionales para estudiar procesos específicos de la enfermedad18. Un ejemplo son los ratones humanos APOB100-Ldlr transgénico -/- (HuBL) que llevan el gen APOB100 humano de longitud completa19,20. Estos ratones desarrollan hipercolesterolemia y aterosclerosis en una dieta regular para hacer comidas. Sin embargo, el desarrollo de placas ateroscleróticas complejas toma al menos seis meses y protocolos experimentales más cortos suelen utilizar la dieta occidental21. Una gran fracción del colesterol plasmático está circulando en partículas LDL, lo que da a los ratones HuBL un perfil de lipoproteína disfidemiadilo más humana en comparación con apoe-/- y Ldlr-/- ratones. Los ratones HuBL también permiten estudios de apoB humano como un autoantígeno22.
Los modelos de ratón de aterosclerosis desarrollan placas ateroscleróticas complejas con características compartidas de la enfermedad humana. Sin embargo, las placas son bastante resistentes a la ruptura con el infarto de miocardio subsiguiente. La aterocrobosis sólo se detecta esporádicamente y se desafia experimentalmente para evaluar23,24,25. Se han desarrollado modelos especiales de ruptura de placas, pero el campo experimental carece de un modelo fiable y reproducible para la evaluación de los agentes estabilizadores de placas.
Cuantificación de la aterosclerosis se ha divulgado de muchas maneras en la literatura. Los esfuerzos recientes han tratado de estandarizar el diseño experimental, la ejecución y la presentación de informes de estudios en animales26. Los investigadores tienen diferentes preferencias y técnicas adaptadas a sus laboratorios. La mayoría de los proyectos de investigación también son únicos de una manera que requieren algunas modificaciones de protocolo. Debido a la naturaleza multifactorial de la enfermedad, los controles óptimos varían entre los proyectos. Las condiciones locales y la falta de estandarización pueden causar diferencias observadas en el desarrollo de la enfermedad, lo que dificulta los avances en el campo de la investigación. Las diferencias en la variabilidad experimental también significan que los cálculos estadísticos de potencia deben basarse en estudios piloto en condiciones locales.
La cuantificación de la aterosclerosis se recomienda en varios lugares del árbol vascular. Este protocolo describe cómo obtener resultados de la raíz aórtica, el arco aórtico y la arteria braquiocéfala en un solo ratón, además de dejar el resto de la aorta toracoabdominal para otros análisis. Las preparaciones faciales permiten una cuantificación rápida de las placas cargados de lípidos en el arco aórtico. La carga de enfermedad en la arteria braquiocéfala también se puede cuantificar si los especímenes se muestran cuidadosamente. El corte transversal más lento de la raíz aórtica deja varias secciones disponibles para la evaluación detallada de la composición de la placa.
Protocolo
Todos los experimentos con animales requieren la aprobación de las autoridades éticas.
1. Sacrificio del ratón y microdisección de Aorta
- Sacrificar el ratón por asfixia CO2 y peso récord.
- Rocíe el ratón con 70% de etanol para evitar la contaminación del pelaje de las muestras. Coloque el ratón en posición supina. A partir de la muesca yugular, haz una incisión de línea media usando tijeras Mayo extendiéndola casi hasta el hueso púbico.
PRECAUCION: El etanol de alto porcentaje es altamente inflamable y podría causar irritación ocular grave. Tome medidas de precaución. - Utilice una aguja de 23 G para exsanguinar el ratón por punción cardíaca a través de la pared del tórax. Este procedimiento generalmente produce 750 ml de sangre de un ratón de 20 semanas de edad. Por lo general, recoger la mitad del volumen en un tubo recubierto de EDTA tri-potasio y la otra mitad en un tubo recubierto de heparina de suero o litio. Gire suavemente los tubos y manténgalos a temperatura ambiente hasta su posterior procesamiento.
- Usa las tijeras Mayo para cortar el peritoneo parietal en la línea media para abrir la cavidad abdominal. Sostenga el proceso de xifoide con fórceps tisulares y corte el peritoneo lateralmente en ambos lados y continúe abrendo el diafragma.
- Usa las tijeras Mayo para abrir la cavidad torácica cortando la caja torácica lo más lateralmente posible. Esto permitirá ángulos amplios para los instrumentos mientras microdisecting la aorta más adelante.
- Haga una incisión en la aurícula derecha para el drenaje del fluido de perfusión. Inserte una aguja de 27 G a través del ápice del corazón en dirección craneal. Mantenga la aguja fija en el ventrículo izquierdo mientras perfunde lentamente el ratón con una solución salina tamponada de fosfato helado de 10 ml (PBS) durante un mínimo de 2 minutos.
NOTA: Algunos protocolos utilizan perfusión de paraformaldehído, pero esto interfiere con varias aplicaciones posteriores, como el análisis inmunohistoquímico de linfocitos. Por lo tanto, no se realiza ninguna fijación de perfusión con paraformaldehído en este protocolo. - Diseccionar órganos de interés (por ejemplo, ganglios linfáticos, bazo, hígado, intestino, almohadillas de grasa inguinal, riñones, etc.) utilizando fórceps anatómicos y tijeras diseccionantes.
- Corte la tráquea y el esófago en el lado derecho del corazón sin dañar el arco aórtico. Corta el diafragma y las estructuras que unen las vísceras al retroperitoneo, dejando el corazón, la aorta y los riñones in situ. Doblar los pulmones y vísceras caudalmente y cubrirlos con una servilleta para comenzar la microdisección retroperitoneal de los ganglios linfáticos paraaórticos y la aorta abdominal.
- Inicie la microdisección bajo un estereomicroscopio con un aumento de 6x. Comience a diseccionar la bifurcación aórtica levantando el tejido circundante con fórceps Dumont y cortando bajo tensión con tijeras Vannas.
- Continúe la disección de la aorta abdominal cranealmente. Corta las ramas abdominales de la aorta y libera la aorta proximalmente a través del hiato aórtico en el diafragma.
NOTA: La microdisección requiere una coordinación precisa mano-ojo a través del estereomicroscopio, que requiere cierta práctica para dominar.
- Continúe la disección de la aorta abdominal cranealmente. Corta las ramas abdominales de la aorta y libera la aorta proximalmente a través del hiato aórtico en el diafragma.
- Retire el tejido adiposo que cubre la aorta torácica. Disecciona cuidadosamente dorsalmente del timo para liberar el arco aórtico con ramas. Continúe diseciendo las arterias carótidas de la forma más dismeal posible en la cavidad torácica. En casos especiales, la disección del cuello podría realizarse para incluir la bifurcación carótida.
- Limpie los instrumentos mediante enjuagues consecutivos en agua desionizada, solución de descontaminación RNase, 70% etanol y PBS antes de cortar realmente la aorta. Levante el corazón por el ápice con los fórceps. Corta la aorta cerca del corazón y coloca todo el corazón en un tubo con PBS. El corazón podría almacenarse en hielo durante un par de horas antes de continuar procesando y criomontando la raíz aórtica.
- Cortar el arco aórtico de acuerdo con la Figura 1A. Colocar el arco aórtico en un tubo que contenga 1 ml de 4% de formaldehído durante la noche a 4oC. El espécimen podría ser almacenado de esta manera durante varios años antes de fijar y análisis.
PRECAUCION: El formaldehído puede causar cáncer, reacciones alérgicas en la piel y es dañino si se ingiere. Utilice equipo de protección personal según sea necesario. - Diseccionar la aorta descendente restante y ponerla en una solución de estabilización de ARN o congelarla con presión para su posterior análisis de ARN u otra aplicación. Optimizar el flujo de trabajo para minimizar el tiempo de disección es crucial para evitar la degradación excesiva del ARN.
- Coloque los tubos de recolección de sangre (recogidos en el paso 1.3) en una centrífuga. Gire los tubos de plasma y suero separados a 1.500 x g durante 15 minutos a temperatura ambiente. Transfiera cuidadosamente el plasma y el suero a tubos de microcentrífuga y guárdelo a -80 oC. La recolección de EDTA y plasma heparinizado o suero deja posibilidades para múltiples aplicaciones aguas abajo.
- Coloque el corazón sobre una cama de corcho con el lado ventral hacia arriba. Fije el corazón al corcho con una aguja a través del ápice. Sostenga la base del corazón con fórceps anatómicos.
- Utilice un bisturí para cortar el apical 2/3 del corazón con la dirección del corte como una línea entre las dos aurículas con el bisturí en ángulo de 20o caudalmente en el plano sagital y 20o cranealmente en el plano transversal (Figura1B).
- Incrustar la raíz aórtica en el compuesto de temperatura de corte óptima (OCT), que rodea, pero no se infiltren en el tejido. Sumerja la base del corazón en el compuesto OCT. Apriete suavemente el corazón con los fórceps para llenar la raíz aórtica con OCT y eliminar cualquier burbuja de aire.
- Transfiera el espécimen a la parte inferior de un criomold lleno de PTU. La raíz aórtica ahora debe ser perpendicular a la superficie inferior. Ponga el corazón montado en hielo seco para congelarlo. Almacene los especímenes en bolsas de cierre de cremallera en -80 oC hasta que persiga la criosección de acuerdo con la sección 3 de este protocolo.

Figura 1: Corazón y arco aórtico in situ. (A) Los pulmones, la tráquea, el esófago y el timo se extraen para mostrar el arco aórtico in situ en un ratón hembra de 20 semanas de edad -/- en dieta regular de café en un micrográfico, Barra de escala de 2 mm. Las líneas punteadas indican dónde cortar el arco aórtico y sus ramas. (B) Una representación esquemática del corazón y la aorta. La línea punteada en rojo indica dónde cortar el corazón antes de criomontar la raíz aórtica. Haga clic aquí para ver una versión más grande de esta figura.
2. Es Análisis facial del arco aórtico y la arteria braquiocéfala
- Preparar camas fijadas para el análisis facial de arcos aórticos. Doble un segmento de película de cera de parafina ocho veces para hacer una superficie plana de 25 mm x 25 mm. Envuélvelo con cinta aislante eléctrica negra para hacer un fondo oscuro para la aorta. Coloque una etiqueta en la parte posterior de la cama anclada y utilice un lápiz de plomo para escribir el número de identificación del ratón (la tinta normal de la pluma desaparecerá en el proceso de tinción).
- Transfiera el arco aórtico a la cama fija y coloque una gota de PBS encima de ella. Comience a limpiar la aorta del tejido adiposo periadyial restante bajo un estereomicroscopio.
- Usa las tijeras Vannas y los fórceps Dumont para despegar suavemente todo el tejido adiposo circundante sin manipular o dañar la aorta. El Sudán IV manchará el tejido adiposo brillantemente y es crucial eliminar todo ese tejido en este momento.
NOTA: Mantenga la aorta húmeda en todo momento aplicando PBS adicional cuando sea necesario.
- Usa las tijeras Vannas y los fórceps Dumont para despegar suavemente todo el tejido adiposo circundante sin manipular o dañar la aorta. El Sudán IV manchará el tejido adiposo brillantemente y es crucial eliminar todo ese tejido en este momento.
- Abra la aorta en el plano coronal introduciendo las tijeras Vannas en el lumen aórtico para exponer la superficie intimal. Comience a cortar la curvatura exterior del arco ascendente en dirección distal y continúe cortando las ramas incluyendo la arteria braquiocéfala. Ahórrese la parte dorsal de la región torácica descendente.
- Cortar abrir la curvatura menor y doblar la aorta para mostrar la superficie intimal.
NOTA: Este paso requiere habilidades motoras finas y necesita un poco de práctica para dominar.
- Cortar abrir la curvatura menor y doblar la aorta para mostrar la superficie intimal.
- Ancle el arco abierto a la cama fija usando el extremo romo de los alfileres de insectos minucias. Utilice un soporte de aguja micro Castroviejo para colocar los pasadores en su lugar. Doble suavemente los pasadores lejos de la muestra cuando esté en su lugar. Anclar la aorta plana en la cama sin estirar la muestra. Almacene el arco anclado mirando hacia abajo en un plato de Petri lleno de PBS a 4oC.
NOTA: El protocolo se puede pausar aquí. - Preparar una solución de trabajo de Sudán IV. Mezclar 1 g de polvo de Sudán IV, 100 ml de 70% de etanol y 100 ml de acetona en una botella oscura y remover suavemente durante 10 min. No hay necesidad de filtrar la solución y se puede utilizar durante un par de meses si se mantiene oscuro a temperatura ambiente. Si el color de tinción no es satisfactorio, se puede hacer una nueva solución y los especímenes se tiñen de nuevo.
PRECAUCION: La acetona es un líquido inflamable que podría causar irritación ocular grave. Conservar en un lugar bien ventilado y tomar medidas de precaución al manipular. - Organizar cinco platos de Petri en el banco de laboratorio: uno lleno de 70% de etanol, uno lleno de solución de trabajo De Sudán IV, dos llenos de 80% de etanol y uno lleno de PBS.
- Comience con el enjuadecimiento de la muestra en 70% de etanol durante 5 min colocando la cama fija en la primera placa Petri con el arco mirando hacia abajo. Transfiera el espécimen a la solución de trabajo de Sudán IV y déjelo manchar el arco durante 7 minutos.
- A continuación, enjuague en 80% de etanol durante 3 minutos dos veces para desestainlar la superficie intimal normal. El tiempo de desconexión se puede ajustar para optimizar los resultados. Por último, enjuague en PBS antes de volver a colocar la muestra en la placa Petri original.
- Adquiera micrografías utilizando un estereomicroscopio con una ampliación 10 veces conectada a una cámara digital. Tome fotografías del arco anclado sumergido en PBS utilizando pequeños pesos metálicos (20 mm x 10 mm x 5 mm) para sujetar la cama anclada hasta la parte inferior de una placa Petri. Coloque una regla junto a la aorta para la calibración de la imagen.
- Utilice un software de análisis de imágenes (por ejemplo, ImageJ) para determinar el área de la lesión y la superficie intimal total. A falta de puntos de referencia anatómicos para definir el arco aórtico, la medición se realiza generalmente desde el inicio de la aorta ascendente hasta la primera rama intercostal (Figura2A). Utilice la función de cuantificación de área en el software para rodear manualmente el área de arco íntimo total.
NOTA: La cuantificación de la lesión debe hacerse de manera cegadora y es aconsejable que un segundo investigador confirme los resultados.- En ImageJ, seleccione la herramienta de selección de polígonos y circule el área total del arco con clics repetitivos. A continuación, seleccione medir en el menú Analizar para mostrar el área de arco total en la ventana de resultados.
- A continuación, rodea todas las placas teñidas de Sudán IV en el arco. Sudán IV es un tinte de diazo de lisocromo que tiñe lípidos, triglicéridos y lipoproteínas con un color rojo anaranjado. En ImageJ, seleccione la herramienta de selección a mano alzada y circule todas las placas mientras presiona la tecla Alt. Haga clic en Medir en el menú Analizar para mostrar el área del arco libre de lesiones en la ventana de resultados.
- Calcule el área de lesión relativa restando el área libre de lesiones del área total del arco y luego dividiendo el resultado con el área total del arco.
- Fije cuidadosamente las arterias subclavias y carótidas para permitir la cuantificación de lesiones en la arteria braquiocéfala (Figura 2A). La cuantificación de lesiones en las arterias subclatienses y las arterias carótidas comunes suele ser muy difícil y no significativa, respectivamente.
- En ImageJ, circule ambas piezas de la arteria braciocéfala utilizando la herramienta de selección de polígonos mientras presiona la tecla Mayús. Haga clic en Medir en el menú Analizar para mostrar el área total de la arteria braquiocéfala en la ventana de resultados.
- A continuación, seleccione la herramienta de selección a mano alzada y rodee todas las placas en la arteria braquiocéfala mientras presiona la tecla Alt. Haga clic en Medir en el menú analizar para mostrar el área de la arteria braquiocéfala libre de lesiones en la ventana de resultados.
- Calcule el área de lesión relativa restando el área libre de lesiones del área arterial braquiocéfala total y luego dividiendo el resultado con el área arterial braquiocéfala total.

Figura 2: Cuantificación de lesiones ateroscleróticas. (A) Arco aórtico de un ratón aórtico de 20 semanas de edad humana APOB100-ldlr transgénico -/- (HuBL) alimentado la dieta occidental durante diez semanas anclado abierto y manchado para placas ricas en lípidos con Sudán IV. El área de superficie del arco aórtico total se delinea con la línea punteada en blanco en el micrográfico, Barra de escala de 2 mm. Las líneas punteadas en amarillo delinean la superficie total de la arteria braquiocéfala. (B) Sección transversal de la raíz aórtica a 400 m del seno aórtico en un Ldlr macho de 20 semanas de edad -/- dieta occidental alimentada con ratón durante ocho semanas visualizada en un micrográfico, Scale Bar a 500 m. Las líneas punteadas en negro delinean el área total del vaso y las lesiones ateroscleróticas manchadas con Aceite Rojo O localizado en la intima arterial. Haga clic aquí para ver una versión más grande de esta figura.
3. Criosección de la raíz aórtica
- Ajuste la temperatura del criostato a -20 oC y el espesor de la sección a 10 m. Monte el bloque OCT que contiene la raíz aórtica en el soporte de la muestra con el tejido ventricular mirando hacia afuera. Al comenzar a cortar, ajuste con precisión la alineación de la superficie de sección para que sea paralela al soporte de la muestra.
- Elimine los OCT circundantes excesivos para facilitar la recogida de secciones sin pliegues. La raíz aórtica ahora debe colocarse perpendicular a la cuchilla del cuchillo, dado que la base del corazón se colocó correctamente en el molde.
- Recoger secciones de control iniciales en diapositivas de microscopio ordinarias, que se descartarán. Las primeras secciones solo deben contener tejido muscular cardíaco. Progresa la sección en 200 m en ese momento. Recoja una sección y compruebe el progreso con un microscopio de luz.
- Cuando se acerque al tracto de salida del ventrículo izquierdo, compruebe cada 100 m bajo el microscopio. Cuando se observan las indicaciones iniciales de una pared del recipiente, reduzca el ritmo a 50 m.
NOTA: Cuando aparezca la primera cúspide aórtica, este será el punto cero para recopilar secciones. Puede ser difícil ver cuando las cúspides aparecen exactamente, pero una localización exacta es crucial para realizar comparaciones de lesiones en la misma región. -
Incline la muestra hacia la cúspide del punto cero para alinear el plano de sección con las otras dos cúspides. Esto es crucial para obtener verdaderas secciones transversales de la aorta. Haz un dibujo de la raíz aórtica, indicando las cúspides a medida que aparecen, y cuenta cada sección de 10 m que se cortan desde el punto cero en adelante.
- Cuando aparezca una segunda cúspide, incline ligeramente la muestra de nuevo lejos de la cúspide para alinear la muestra con la tercera cúspide. La diferencia de nivel entre las cúspides no debe exceder los 50 m. Empezar a recoger secciones en diapositivas a partir del nivel 90 m y posteriores.
- Recopile secciones según la planificación de diapositivas en la Figura3. La colección de secciones puede iniciarse a partir de 190 m si la raíz aórtica está más de 50 m inclinada, para permitir que más espacio alinee la raíz en una posición recta. Continúe seccionando hasta alcanzar el nivel 800 m desde el punto cero. Si todavía hay placas visibles en este nivel, la colección podría ampliarse a 1.000 m.
NOTA: Una organización de diapositivas simplificada se presenta en la Figura Suplementaria1, que podría aumentar la velocidad de seccionamiento. La planificación óptima de diapositivas debe decidirse en función del plan del proyecto.
-
Corrija las secciones después de la colección.
- Fijar las secciones recogidas para la tinción de aceite rojo O y la tinción roja Picrosirius de colágeno en 4% formaldehído durante 10 min. Enjuagar en agua desionizada, secar y almacenar a temperatura ambiente hasta perseguir con la sección 4 en este protocolo. Si los portaobjetos deben estar manchados con aceite rojo O de inmediato y todavía están húmedos, colóquelos en 60% isopropanol durante 1 min para acelerar el proceso de secado.
PRECAUCION: El isopropanol es un líquido inflamable que puede causar irritación ocular grave y puede causar somnolencia o mareos. Conservar en un lugar bien ventilado y tomar medidas de precaución al manipular. - Fijar las secciones recogidas para inmunohistoquímica o inmunofluorescencia en acetona pura helada durante 10 min. Seco en temperatura ambiente durante 30 min. Almacene secciones en -20 oC.
- Fijar las secciones recogidas para la tinción de aceite rojo O y la tinción roja Picrosirius de colágeno en 4% formaldehído durante 10 min. Enjuagar en agua desionizada, secar y almacenar a temperatura ambiente hasta perseguir con la sección 4 en este protocolo. Si los portaobjetos deben estar manchados con aceite rojo O de inmediato y todavía están húmedos, colóquelos en 60% isopropanol durante 1 min para acelerar el proceso de secado.
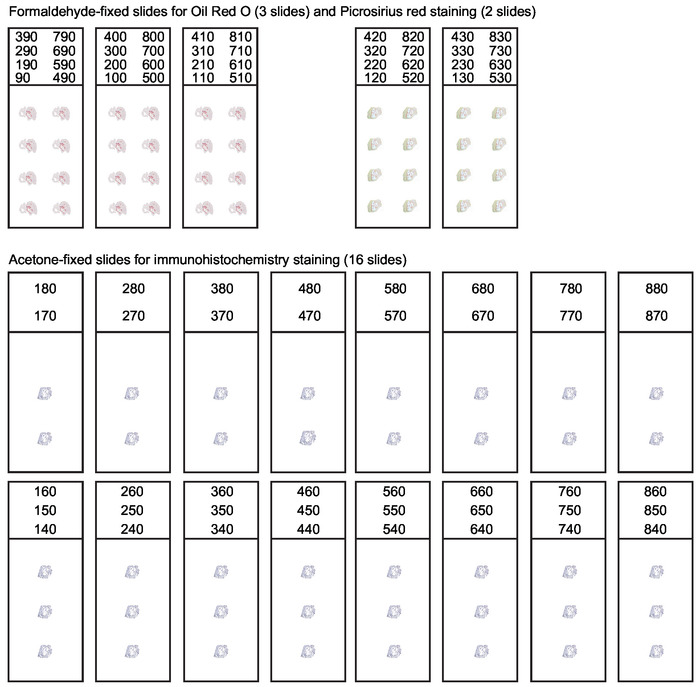
Figura 3: Organización de diapositivas para secciones seriales de la raíz aórtica. Durante la criosección de la raíz aórtica cada sección de 10 m de espesor que abarca los primeros 800 m de la aorta ascendente debe recogerse. Se necesita una organización sistemática de diapositivas para obtener secciones adecuadas para diversas aplicaciones. El análisis de la composición de la lesión generalmente incluye la tinción de aceite rojo O para lípidos y la tinción roja de Picrosirius para colágeno. Las secciones restantes se recogen y se fijan la acetona para la inmunohistoquímica y la tinción de inmunofluorescencia. Esta cifra ha sido modificada de Gister y al30. Haga clic aquí para ver una versión más grande de esta figura.
4. Aceite Rojo O Tinción y Cuantificación de la Aterosclerosis en Raíces Aórticas
- Preparar una solución saturada de aceite rojo O mediante la disolución de 1 g de aceite rojo O en 100 ml de isopropanol. Revuelva la solución en una botella oscura durante 1 hora a temperatura ambiente. La solución saturada se puede mantener durante varios meses.
NOTA: Es aconsejable tener equipos de laboratorio designados para la tinción de aceite rojo O ya que es difícil limpiar equipos que han estado en contacto con la solución. - Preparar una solución de trabajo mezclando 75 ml de la solución saturada de aceite rojo O con 50 ml de agua desionizada. Deje reposar a temperatura ambiente durante 10 minutos. Filtrar a través de un papel de filtro cualitativo.
- Coloque los portaobjetos en la solución de trabajo Oil Red O durante 20 min. Enjuague en agua del grifo durante 5 min.
- Para ayudar a la visualización del tejido, mancha con la hematoxilina de Mayer durante 1 min. Enjuague en agua tibia del grifo durante 5 min. Todos los núcleos ahora deben estar teñidos en color azul, ajustar el tiempo de tinción para optimizar el resultado.
- Monte los portaobjetos en un medio de montaje acuoso (por ejemplo, gelatina de glicerol de Kaiser). Caliente la gelatina de glicerol de Kaiser a 40 oC para que sea fluida antes de su uso. No es necesario secar los portaobjetos ya que el medio de montaje es a base de agua. Tenga cuidado de evitar la formación de burbujas de aire al añadir el vidrio de la cubierta.
PRECAUCION: La gelatina de glicerol de Kaiser contiene fenol, que se sospecha que causa defectos genéticos. Utilice equipo de protección personal según sea necesario. - Adquiera micrografías digitales utilizando una cámara conectada a un microscopio de luz. Por lo general, la pared completa del vaso y los límites de la lesión podrían visualizarse claramente mediante un aumento de 50 veces. Guarde imágenes de alta resolución, preferiblemente en formato de archivo de imagen etiquetado (TIFF).
- Realice análisis del tamaño de la lesión utilizando un sistema de software de análisis de imágenes asistido por ordenador. El aceite Rojo O es un tinte de diazo de lysocromo que tiñe los lípidos neutros y visualiza placas ateroscleróticas con un color rojo intenso, que ayuda a la cuantificación de lesiones.
NOTA: La cuantificación de la lesión debe hacerse de manera cegadora y es aconsejable que un segundo investigador confirme los resultados obtenidos.- Utilice la función de cuantificación de área en el software de análisis de imágenes para definir el área total del recipiente rodeando la lámina elástica externa de la pared del recipiente aórtico (Figura2B). En ImageJ, seleccione la herramienta de selección de polígonos y circule el área con clics repetitivos. A continuación, seleccione la medida en el menú de análisis. El área total del recipiente se muestra en la ventana de resultados.
- Continuar cuantificando las lesiones ateroscleróticas en la capa intimal del vaso, definida por la lámina elástica interna y el límite luminal. Por lo general, las lesiones en las cúspides de las válvulas se excluyen de la medida27. En ImageJ, seleccione la herramienta de selección a mano alzada y circule todas las placas mientras presiona la tecla Alt. Seleccione la medida en el menú de análisis para mostrar el área del recipiente libre de lesiones en la ventana de resultados.
- Calcule el área de lesión relativa restando el área libre de lesiones del área total del recipiente y luego dividiendo el resultado con el área total del recipiente.
NOTA: Calibrar los resultados en el software de análisis de imágenes de acuerdo con el aumento utilizado para obtener el área de lesión absoluta en el micrómetro cuadrado.
- Defina el área teñida de o rojo de aceite en las lesiones utilizando una función de umbral de color en el software de análisis de imágenes para calcular el porcentaje de área positiva de Oil Red O del área total de la lesión.
- En ImageJ, circule todo el área de la lesión utilizando la herramienta de selección a mano alzada mientras presiona la tecla Mayús. Seleccione la medida en el menú analizar para mostrar el área de lesión total en la ventana de resultados.
- Seleccione Borrar fuera en el menú de edición. Cambie el tipo de imagen a 8 bits en el menú de la imagen.
- Establezca un umbral rojo para el área negativa Rojo aceite seleccionando umbral en el submenú de ajuste del menú de imagen. Haga clic en Aplicar. Haga que la imagen sea binaria seleccionando esta opción en el submenú binario del menú de proceso.
NOTA: Por lo general, la tinción de aceite rojo O varía entre lotes. Por lo tanto, el umbral de color solo se recomienda dentro del mismo lote de tinción. El resultado debe presentarse junto con una descripción de cómo se determinó y estandarizó el umbral. - Analice la imagen seleccionando Analizar partículas en el menú Analizar y haga clic en Aceptar. El área de lesión negativa Total Oil Red O ahora se muestra en la ventana de resumen. Calcule el área relativa de aceite rojo O positivo restando el área negativa de aceite rojo O del área de lesión total y luego dividiendo con el área total de la lesión.
Resultados
En los modelos de ratón de aterosclerosis las lesiones más prominentes tienden a desarrollarse en la raíz aórtica y el arco aórtico. Este protocolo describe la cuantificación de la aterosclerosis en la raíz aórtica, el arco aórtico y la arteria braquiocéfala en un solo ratón. Las lesiones mentoráticas en la aorta descendente torácica y la aorta abdominal solo están presentes en animales con enfermedad avanzada. En este protocolo, estas partes no se analizan para la carga aterosclerótica, sino que se guardan para el análisis posterior de los niveles de ARNm u otros análisis. Las secciones seriales de lesiones ateroscleróticas en la raíz aórtica generalmente se muestran en un gráfico con el tamaño de la lesión en el eje yy la distancia al seno aórtico en el eje x28. Las secciones transversales verdaderas son cruciales para la cuantificación del tamaño de la lesión. Las secciones oblicuas pueden sobreestimar el tamaño de las lesiones y una inclinación de sólo 20o podría sobreestimar la superficie absoluta de la lesión en un 15%29. Sin embargo, el cálculo de la fracción de lesión del área total del vaso hace que el resultado sea menos sensible a las posibles diferencias de ángulo durante el seccionamiento (Figura4A). Un método estadístico adecuado para detectar diferencias entre grupos suele ser un análisis regular de 2 vías de la varianza (ANOVA). A continuación, se llevan a cabo las pruebas posteriores de Bonferroni para detectar diferencias a ciertos niveles. La diferencia menos significativa de Fisher también podría utilizarse como prueba de seguimiento para ANOVA. Reduce la probabilidad de errores estadísticos de tipo II, pero no tiene en cuenta las comparaciones múltiples. Además, podría ser ilustrativo calcular el área debajo de la curva o el tamaño medio de la lesión por ratón y presentar los datos en una gráfica de puntos para visualizar aún más la variación individual dentro de los grupos (Figura4B).
El aceite Rojo O es un tinte de diazo rojo brillante soluble en grasa, que tiñe los lípidos neutros. Los lípidos polares en las membranas celulares no están manchados. La tinción de aceite Rojo O se puede realizar en muestras frescas, congeladas o fijadas en formalina, pero no en muestras incrustadas en parafina debido a la eliminación de lípidos en el proceso de desfinación requerido. Una cuantificación de la acumulación de lípidos lesionales podría realizarse umbral de color en el área positiva de aceite rojo O del área total de la lesión (Figura4C). La hematoxilina produce una tinción azul de los núcleos celulares, que es útil para visualizar la morfología de la placa. Las arterias coronarias derecha e izquierda generalmente difieren de la aorta alrededor de 250 m del seno aórtico27,que a menudo coinciden con los tamaños de lesión más prominentes. Las secciones transversales de esta región se muestran a menudo como resultados representativos (Figura4D).

Figura 4: Lesiones ateroscleróticas en la raíz aórtica. (A) Veintiocho semanas de edad, se evaluaron las quimeras de médula ósea masculina alimentadas con dieta occidental durante ocho semanas para determinar el efecto de las células T deficientes de Smad7en el desarrollo de la aterosclerosis. Las quimeras experimentales Ldlr-/- recibieron la médula ósea Cd4-Cre+Smad7fl/fl y los controles recibieron la médula ósea Cd4-Cre+Smad7fl/+. El gráfico muestra la cuantificación del área de la lesión aterosclerótica a partir de ocho secciones consecutivas, 100 - 800 m del seno aórtico que se muestra como fracción de lesión de la superficie total del vaso (Cd4-Cre+Smad7fl/+/Ldlr-/- n-6, Cd4-Cre+Smad7fl/fl/Ldlr-/- n a 9, ANOVA de 2 vías con la prueba posterior de Bonferroni, el gráfico muestra la media de LASE, los aparatos ortopédicos indican el nivel de significancia para la comparación de deformación unitaria). (B) La gráfica de puntos combinada y el gráfico de barras muestran el área media de la lesión aterosclerótica a partir de las secciones de la raíz aórtica (Cd4-Cre+Smad7fl/+/Ldlr-/- n-6, Cd4-Cre+Smad7fl/fl/ Ldlr-/- n n 9, Prueba del estudiante) (C) Fracción de la zona teñida de aceite rojo o en las lesiones (Cd4-Cre+Smad7fl/+/Ldlr-/- n 4, Cd4-Cre+Smad7fl/fl /Ldlr-/- n 6, Prueba t-test del estudiante, ns-no significativo) (B-C) Los puntos representan ratones y barras individuales muestran la media de la SEM. (D) Micrografías representativas que muestran la tinción de aceite rojo O (en rojo color) de los lípidos neutros en la raíz aórtica 300 m a partir del seno aórtico (aumento de 50x), barra de escala a 500 m. *p a 0,05, ***p a 0,001. Esta cifra ha sido modificada de Gister y al.31. Haga clic aquí para ver una versión más grande de esta figura.
El aceite Rojo O podría utilizarse para la tinción de aortas preparadas en la cara, pero este protocolo utiliza Sudán IV, otro conveniente tinte de diazo soluble en grasa. Sudán IV visualiza claramente las placas ateroscleróticas en un color rojo anaranjado mediante la tinción de lípidos, triglicéridos y lipoproteínas. La eliminación del fondo oscuro en imágenes representativas de los arcos aórticos en la cara podría mejorar la visualización visual (Figura5A). Por lo general, el tamaño de la lesión se distribuye normalmente dentro de los grupos, lo que permite realizar pruebas estadísticas con la prueba tdel estudiante entre grupos. Una gráfica de puntos que muestra tanto ratones individuales como la media, que se compara entre grupos, es una forma informativa de mostrar los resultados (Figura 5B-C). Dado que la variación dentro de los grupos suele ser diferente entre ubicaciones en el árbol vascular, normalmente se necesitan cálculos de potencia separados. La variación innecesaria puede evitarse mediante la competencia del método y la estandarización del protocolo. La obtención de resultados estadísticamente significativos es importante, pero la relevancia biológica para una diferencia observada siempre debe ser considerada también.
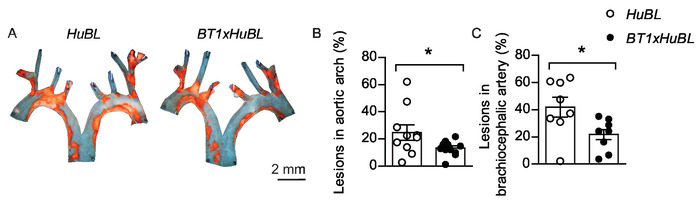
Figura 5: Lesiones ateroscleróticas en arco aórtico y arteria braquiocéfala. (A) Representante en cara a micrografías de arcos aórticos con placas cargados de lípidos manchadas con Sudán IV (en color naranja) de 20 semanas de edad ratones alimentados con dieta occidental durante diez semanas, visualizados juntos. Barra de escala de 2 mm. Se utilizaron ratones APOB100-Ldlr transgénicos -/- (HuBL) como controles y el grupo experimental consistió en ratones transgénicos TCR con células T reactivas LDL (BT1) cruzadas a ratones HuBL. (B) Lesiones ateroscleróticas en el arco aórtico (HuBL n a 10, BT1xHuBL n á 12; Prueba del estudiante). (C) Lesiones ateroscleróticas en la arteria braquiocéfala (HuBL n .8, BT1xHuBL n 9, Prueba t-test del estudiante). (B-C) Los puntos representan ratones individuales, las barras muestran la media de la seM. *p a 0,05. Esta cifra ha sido modificada de Gister y al.32. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Organización alternativa de diapositivas para secciones seriales de la raíz aórtica. Una organización de diapositivas sistemática simplificada para la recopilación de secciones de la raíz aórtica. La colección permite la tinción de aceite rojo O para lípidos e inmunohistoquímica o tinción de inmunofluorescencia. Se omiten las diapositivas dedicadas para la tinción roja de colágeno de Picrosirius. Haga clic aquí para descargar este archivo.
Discusión
Las enfermedades cardiovasculares son la principal causa de mortalidad en el mundo y se necesitan nuevas mediciones preventivas2. Los modelos de ratón de la enfermedad proporcionan una plataforma integral para la investigación de la fisiopatología y los tratamientos experimentales13. La cuantificación fiable del tamaño de la lesión es esencial para este enfoque. Sin embargo, los métodos de cuantificación difieren entre laboratorios. La estandarización y optimización han sido un proceso continuo desde losaños 13,27,33,34. Raíces aórticas han surgido como el sitio más popular para cuantificar la aterosclerosis experimental. Las secciones transversales de las placas permiten comparar el volumen de placa entre grupos. Los preparados faciales en son favorecidos para la cuantificación de lesiones en segmentos más grandes de la aorta. El método en face visualiza la cantidad de placa y permite cuantificar la cobertura del área de placa, pero no tiene en cuenta el grosor de la placa. La relevancia biológica para las diferencias observadas está corroborada por resultados coherentes en diferentes lugares del árbol vascular. La evaluación del desarrollo de aterosclerosis en diferentes ubicaciones aborda los posibles efectos específicos del sitio. El efecto de las células hematopoyéticas trasplantadas en el desarrollo de la aterosclerosis se puede evaluar en quimeras hipercolesterolémicas de Ldlr-/- . Sin embargo, la irradiación de todo el cuerpo afecta el proceso de aterosclerosis con efectos específicos del sitio. Las lesiones ateroscleróticas más prominentes se desarrollan en la raíz aórtica, mientras que el desarrollo reducido de lesiones se observa en arcos aórticos35.
Es importante destacar que no sólo el tamaño de la lesión debe abordarse en estudios de aterosclerosis experimental. La composición de la lesión también es un parámetro clave. Varias características de la placa se han asociado con manifestaciones de la enfermedad en los seres humanos36. El seccionamiento en serie de la raíz aórtica deja varias secciones disponibles para un análisis cuidadoso de la composición de la placa. La ruptura de la placa en los seres humanos se caracteriza por una fina tapa fibrosa con pocas células musculares lisas, contenido de colágeno disperso y signos de inflamación en las placas36. Aunque la ruptura de la placa es un evento raro en los modelos de ratón de aterosclerosis, los marcadores para la estabilidad de la placa son informativos de evaluar. Los enfoques traslacionales podrían confirmar los hallazgos mecanicistas de los modelos de ratón y descubrir características importantes de la enfermedad humana31. El estado inflamatorio de las placas ateroscleróticas podría determinarse mediante la tinción inmunohistoquímica de VCAM-1, MHC clase II, macrófagos y linfocitos30. Algunos protocolos utilizan secciones longitudinales en el plano coronal del arco aórtico o la arteria braquiocéfala para medir el tamaño de la lesión aterosclerótica y la composición37. Sin embargo, este método alternativo deja sólo algunas secciones a analizar, lo que limita sus aplicaciones.
Un paso crítico inicial en este protocolo es la capacidad de cosechar aortas de manera eficiente. La coordinación mano-ojo bajo el microscopio requiere práctica y es crucial tanto para la microdisección como para la posterior fijación del arco aórtico. El siguiente paso crítico en este protocolo es la colección de secciones seriales de la raíz aórtica. Ochenta secciones consecutivas deben ser recogidas para cada ratón, lo que requiere tanto enfoque como paciencia. La competencia metodológica podría acelerar considerablemente los procesos descritos. Sin embargo, la cuantificación de lesiones ateroscleróticas sigue siendo una tarea que requiere mucho tiempo. La nueva tecnología, el manejo automatizado y las imágenes de animales pequeños podrían facilitar la cuantificación de la aterosclerosis experimental en el futuro. La progresión de la aterosclerosis es lenta y la mayoría de los protocolos experimentales en los modelos de ratón tardan más de cuatro meses en completar13. Por lo tanto, las aortas deben recopilarse de forma optimizada en los puntos finales de estudio. Este protocolo proporciona una guía completa para cosechar aortas de manera eficiente y el procesamiento propuesto prepara aortas para uso multiusos, incluida la cuantificación de lesiones en la raíz aórtica, el arco aórtico y la arteria braquiocéfala. Esperemos que el protocolo pueda reducir la variabilidad experimental, mejorar la fiabilidad de los resultados y dar lugar a hallazgos que allanarán el camino para nuevos tratamientos contra la aterosclerosis.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a todos los miembros anteriores de la unidad de investigación cardiovascular experimental de Géran K Hansson que ayudó a desarrollar este protocolo en el último cuarto de siglo. Agradecemos especialmente las contribuciones de Antonino Nicoletti, Xinghua Zhou, Anna-Karin Robertson e Inger Bodin. Este trabajo fue apoyado por la concesión del proyecto 06816 y linneo apoyaron 349-2007-8703 del Consejo Sueco de Investigación, y por subvenciones de la Fundación Sueca Heart-Lung, el Consejo del Condado de Estocolmo, la Fundación Profesora Nanna Svartz, Loo y Hans Osterman Fundación para la Investigación Médica, Fundación de Investigación de Karolinska Institutet y Fundación para Enfermedades Geriátricas en Karolinska Institutet.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | 20066.296 | For fixation of sections for immunohistochemistry. |
| Black electrical insulation tape (50 mm wide) | Any specialized retailer | - | To create pinning beds for aortic arches. |
| Centrifuge | Eppendorf | 5417C | Benchtop microcentrifuge. |
| Cork board | Any specialized retailer | - | For cutting hearts in the preparation to cryomount aortic roots. |
| Cryostat | Thermo Scientific | Microm HM 560 | For serial cryosectioning of aortic roots. |
| Deionized water | - | - | For rinsing and preparation of solutions. |
| Digital camera | Leica Microsystems | DC480 | 5.1 megapixel CCD for high-resolution images of aortic arches and aortic root sections. |
| Dissecting scissors (10 cm, straight) | World Precision Instruments | 14393 | For general dissection of organs. |
| Dumont forceps #5 (11 cm, straight) | World Precision Instruments | 500341 | For microdissection of aorta. |
| Ethanol 70% (v/v) | VWR Chemicals | 83801.290 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Ethanol absolute ≥99.8% | VWR Chemicals | 20821.310 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Formaldehyde 4% stabilised, buffered (pH 7.0) | VWR Chemicals | 9713.1000 | Harmful by inhalation, in contact with skin and if swallowed. |
| ImageJ | NIH | - | Image analysis software. |
| Iris forceps (10 cm, curved, serrated) | World Precision Instruments | 15915-G | Used as anatomical forceps. |
| Isopropanol | Merck | 1096341011 | Flammable liquid, causes serious eye irritation, and may cause drowsiness or dizziness. |
| Kaiser's glycerol gelatine | Merck | 1092420100 | Aqueous mounting medium containing phenol. Suspected of causing genetic defects. |
| Light microscope | Leica Microsystems | DM LB2 | For analysis during sectioning and documentation of Oil Red O stained micrographs. |
| Mayer's hematoxylin | Histolab | 1820 | Non-toxic staining solution without chloral hydrate, but causes serious eye irritation. |
| Mayo scissors (17 cm, straight) | World Precision Instruments | 501751-G | For general dissection. |
| Micro Castroviejo needle holder (9 cm, straight) | World Precision Instruments | 503376 | For pinning of aortic arches. |
| Microcentrifuge tubes | Corning | MCT-175-C | Polypropylene microtubes with snaplock cap. |
| Microlance 3 needles, 23 gauge | BD | 300800 | For blood collection. |
| Microlance 3 needles, 27 gauge | BD | 302200 | For perfusion of mice. |
| Microvette 500 µL, K3 EDTA | Sarstedt | 20.1341.100 | For blood collection. |
| Microvette 500 µL, Lithium Heparin | Sarstedt | 20.1345.100 | For blood collection. |
| Minutien insect pins, 0.10 mm | Fine Science Tools | 26002-10 | For pinning of aortic arches. |
| Oil Red O | Sigma-Aldrich | O0625 | Not classified as a hazardous substance or mixture. |
| Optimum cutting temperature (OCT) cryomount | Histolab | 45830 | For embedding tissue. |
| Parafilm M | Bemis | PM992 | Paraffin wax film used to create pinning beds for aortic arches. |
| Petri dishes (100 mm x 20 mm) | Any cell culture supplier | - | Proposed as a storage container for pinned aortas. |
| Phosphate buffered saline (PBS) | - | - | Sterile and RNase-free solution is required for perfusion of mice. |
| Qualitative filter paper (grade 1001) | Munktell | 120006 | For filtering Oil Red O working solution (typical retention 2-3 µm). |
| RNAlater RNA stabilization reagent | Qiagen | 76106 | For stabilization of RNA in tissue samples |
| RNaseZap RNase Decontamination Solution | Invitrogen | AM9780 | A surface decontamination solution that destroys RNases on contact. |
| Scalpel handle #3 (13 cm) | World Precision Instruments | 500236 | For cutting hearts in the preparation to cryomount aortic roots. |
| Standard scalpel blade #10 | World Precision Instruments | 500239 | For cutting hearts in the preparation to cryomount aortic roots. |
| Stereomicroscope | Leica Microsystems | MZ6 | For dissection and en face documentation |
| Sudan IV | Sigma-Aldrich | S4261 | Not classified as a hazardous substance or mixture. |
| Superfrost Plus microscope slides | Thermo Scientific | J1800AMNZ | To collect aortic root sections. |
| Tissue forceps (15 cm) | World Precision Instruments | 501741-G | For general dissection. |
| Tissue-Tek cryomolds (10 mm x 10 mm x 5 mm) | Sakura | 4565 | For embedding aortic roots in OCT. |
| Vannas scissors (8 cm, straight) | World Precision Instruments | 503378 | For microdissection of aorta. |
Referencias
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859), 2095-2128 (2012).
- Gistera, A., Hansson, G. K. The immunology of atherosclerosis. Nature Reviews Nephrology. 13 (6), 368-380 (2017).
- Hansson, G. K. Inflammation, atherosclerosis, and coronary artery disease. New England Journal of Medicine. 352 (16), 1685-1695 (2005).
- Williams, K. J., Tabas, I. The response-to-retention hypothesis of early atherogenesis. Arteriosclerosis, Thrombosis, and Vascular Biology. 15 (5), 551-561 (1995).
- Pentikainen, M. O., Oorni, K., Ala-Korpela, M., Kovanen, P. T. Modified LDL - trigger of atherosclerosis and inflammation in the arterial intima. Journal of Internal Medicine. 247 (3), 359-370 (2000).
- Ruuth, M., et al. Susceptibility of low-density lipoprotein particles to aggregate depends on particle lipidome, is modifiable, and associates with future cardiovascular deaths. European Heart Journal. 39 (27), 2562-2573 (2018).
- Nakashima, Y., Raines, E. W., Plump, A. S., Breslow, J. L., Ross, R. Upregulation of VCAM-1 and ICAM-1 at atherosclerosis-prone sites on the endothelium in the ApoE-deficient mouse. Arteriosclerosis, Thrombosis, and Vascular Biology. 18 (5), 842-851 (1998).
- Goldstein, J. L., Ho, Y. K., Basu, S. K., Brown, M. S. Binding site on macrophages that mediates uptake and degradation of acetylated low density lipoprotein, producing massive cholesterol deposition. Proceedings of the National Academy of Sciences of the United States of America. 76 (1), 333-337 (1979).
- Paigen, B., Morrow, A., Brandon, C., Mitchell, D., Holmes, P. Variation in susceptibility to atherosclerosis among inbred strains of mice. Atherosclerosis. 57 (1), 65-73 (1985).
- Russell, E. S. Origins and history of mouse inbred strains: contributions of Clarence Cook Little. Origins of Inbred Mice, Morse, HC, eds. (Academic Press, NY). , 33-43 (1978).
- Waterston, R. H., et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Gistera, A., Ketelhuth, D. F. J. Lipid-driven immunometabolic responses in atherosclerosis. Current Opinion in Lipidology. 29 (5), 375-380 (2018).
- Maganto-Garcia, E., Tarrio, M., Lichtman, A. H. Mouse models of atherosclerosis. Current Protocols in Immunology. Chapter 15, (2012).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Zhang, S. H., Reddick, R. L., Piedrahita, J. A., Maeda, N. Spontaneous hypercholesterolemia and arterial lesions in mice lacking apolipoprotein E. Science. 258 (5081), 468-471 (1992).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. Journal of Clinical Investigation. 92 (2), 883-893 (1993).
- Ishibashi, S., Goldstein, J. L., Brown, M. S., Herz, J., Burns, D. K. Massive xanthomatosis and atherosclerosis in cholesterol-fed low density lipoprotein receptor-negative mice. Journal of Clinical Investigation. 93 (5), 1885-1893 (1994).
- Ketelhuth, D. F., Gistera, A., Johansson, D. K., Hansson, G. K. T cell-based therapies for atherosclerosis. Current Pharmaceutical Design. 19 (33), 5850-5858 (2013).
- Skalen, K., et al. Subendothelial retention of atherogenic lipoproteins in early atherosclerosis. Nature. 417 (6890), 750-754 (2002).
- Boren, J., et al. Identification of the low density lipoprotein receptor-binding site in apolipoprotein B100 and the modulation of its binding activity by the carboxyl terminus in familial defective apo-B100. Journal of Clinical Investigation. 101 (5), 1084-1093 (1998).
- Sanan, D. A., et al. Low density lipoprotein receptor-negative mice expressing human apolipoprotein B-100 develop complex atherosclerotic lesions on a chow diet: no accentuation by apolipoprotein(a). Proceedings of the National Academy of Sciences of the United States of America. 95 (8), 4544-4549 (1998).
- Gistera, A., et al. Vaccination against T-cell epitopes of native ApoB100 reduces vascular inflammation and disease in a humanized mouse model of atherosclerosis. Journal of Internal Medicine. , (2017).
- Johnson, J. L., Jackson, C. L. Atherosclerotic plaque rupture in the apolipoprotein E knockout mouse. Atherosclerosis. 154 (2), 399-406 (2001).
- Calara, F., et al. Spontaneous plaque rupture and secondary thrombosis in apolipoprotein E-deficient and LDL receptor-deficient mice. The Journal of Pathology. 195 (2), 257-263 (2001).
- Caligiuri, G., Levy, B., Pernow, J., Thoren, P., Hansson, G. K. Myocardial infarction mediated by endothelin receptor signaling in hypercholesterolemic mice. Proceedings of the National Academy of Sciences of the United States of America. 96 (12), 6920-6924 (1999).
- Daugherty, A., et al. Recommendation on Design, Execution, and Reporting of Animal Atherosclerosis Studies: A Scientific Statement From the American Heart Association. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (9), (2017).
- Paigen, B., Morrow, A., Holmes, P. A., Mitchell, D., Williams, R. A. Quantitative assessment of atherosclerotic lesions in mice. Atherosclerosis. 68 (3), 231-240 (1987).
- Purcell-Huynh, D. A., et al. Transgenic mice expressing high levels of human apolipoprotein B develop severe atherosclerotic lesions in response to a high-fat diet. Journal of Clinical Investigation. 95 (5), 2246-2257 (1995).
- Nicoletti, A., Kaveri, S., Caligiuri, G., Bariety, J., Hansson, G. K. Immunoglobulin treatment reduces atherosclerosis in apo E knockout mice. Journal of Clinical Investigation. 102 (5), 910-918 (1998).
- Gistera, A., Ketelhuth, D. F. Immunostaining of Lymphocytes in Mouse Atherosclerotic Plaque. Methods in Molecular Biology. 1339, 149-159 (2015).
- Gistera, A., et al. Transforming growth factor-beta signaling in T cells promotes stabilization of atherosclerotic plaques through an interleukin-17-dependent pathway. Science Translational Medicine. 5 (196), (2013).
- Gistera, A., et al. Low-Density Lipoprotein-Reactive T Cells Regulate Plasma Cholesterol Levels and Development of Atherosclerosis in Humanized Hypercholesterolemic Mice. Circulation. 138 (22), 2513-2526 (2018).
- Daugherty, A., Whitman, S. C. Quantification of atherosclerosis in mice. Methods in Molecular Biology. 209, 293-309 (2003).
- Baglione, J., Smith, J. D. Quantitative assay for mouse atherosclerosis in the aortic root. Methods in Molecular Biology. 129, 83-95 (2006).
- Schiller, N. K., Kubo, N., Boisvert, W. A., Curtiss, L. K. Effect of gamma-irradiation and bone marrow transplantation on atherosclerosis in LDL receptor-deficient mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 21 (10), 1674-1680 (2001).
- Naghavi, M., et al. From vulnerable plaque to vulnerable patient: a call for new definitions and risk assessment strategies: Part I. Circulation. 108 (14), 1664-1672 (2003).
- Seijkens, T. T. P., et al. Targeting CD40-Induced TRAF6 Signaling in Macrophages Reduces Atherosclerosis. Journal of the American College of Cardiology. 71 (5), 527-542 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados