Method Article
Quantification de l'athérosclérose chez les souris
Dans cet article
Résumé
Les modèles murines de l'athérosclérose sont des outils utiles pour étudier les voies pathogènes au niveau moléculaire, mais exigent une quantification normalisée du développement des lésions. Ce protocole décrit une méthode optimisée pour déterminer la taille de lésion dans les vaisseaux artériels principaux comprenant la racine aortique, l'arc aortique, et l'artère brachiocéphalique.
Résumé
Les maladies cardiovasculaires sont la principale cause de décès dans le monde. La cause sous-jacente dans la plupart des cas est l'athérosclérose, qui est en partie une maladie inflammatoire chronique. Des études expérimentales sur l'athérosclérose ont élucidé le rôle du cholestérol et de l'inflammation dans le processus de la maladie. Ceci a mené aux essais cliniques réussis avec des agents pharmaceutiques qui réduisent des manifestations cliniques de l'athérosclérose. Des expériences minutieuses et bien contrôlées dans des modèles murins de la maladie pourraient encore élucider la pathogénie de la maladie, qui n'est pas entièrement comprise. L'analyse normalisée des lésions est importante pour réduire la variabilité expérimentale et augmenter la reproductibilité. La taille de lésion de détermination dans la racine aortique, l'arc aortique, et l'artère brachiocéphalique sont des points de terminaison communs dans l'athérosclérose expérimentale. Ce protocole fournit une description technique pour l'évaluation de l'athérosclérose à tous ces emplacements dans une seule souris. Le protocole est particulièrement utile lorsque le matériel est limité, comme c'est souvent le cas lorsque des animaux génétiquement modifiés sont caractérisés.
Introduction
Les maladies cardiovasculaires sont la principale cause de décès dans le monde, les cardiopathies ischémiques et les accidents vasculaires cérébraux représentant un décès sur quatre1. La plupart des cas sont provoqués par l'athérosclérose, une maladie caractérisée par une accumulation lente de plaques chargées de lipides avec des signes d'inflammation chronique dans les artères de grande et moyenne taille2. La maladie reste habituellement inaperçue pendant plusieurs décennies jusqu'à ce qu'une rupture ou une érosion de la plaque provoque une thrombose artérielle qui mène aux dommages ischémiques de tissu.
Une artère normale se compose d'une couche d'intima avec des cellules endothéliales et des cellules musculaires lisses peu distribuées, une couche média avec des cellules musculaires lisses et des lamelles élastiques, et une couche adventitielle environnante avec le tissu conjonctif lâche3. Une rétention intimale de LDL compense le développement de l'athérosclérose4. L'accumulation et la modification des lipoprotéines conduisent à l'agrégation et au piégeage dans l'intima artérielle5. Une réponse inflammatoire est évoquée par les lipoprotéines piégées et modifiées6. Les cellules endothéliales commencent à exprimer des molécules d'adhérence, telles que VCAM-1 aux emplacements dans l'arbre artériel avec le flux sanguin turbulent, menant au recrutement des monocytes circulants et d'autres leucocytes7. Les monocytes infiltrants se différencient en macrophages qui engloutissent les lipides avec la transformation qui s'ensuit en cellules de mousse de macrophage8.
L'athérosclérose a été étudiée dans des modèles de souris avec une fréquence croissante depuis le milieu des années 1980. C57BL/6 est la souche de souris consanguine la plus couramment utilisée pour ces études, et elle est utilisée comme fond génétique pour la majorité des souches génétiquement modifiées9. Cette souche a été établie dans les années 192010, et son génome a été publié en 200211. Les expériences sur les modèles murins présentent plusieurs avantages : les colonies se reproduisent rapidement, le logement est économe en espace et la consanguinité réduit la variabilité expérimentale. Le modèle permet également des manipulations génétiques, telles que des suppressions de gènes ciblées et l'insertion de transgènes. Cela a conduit à une nouvelle compréhension pathophysiologique de la maladie et de nouvelles cibles de thérapie12.
Les souris de type sauvage C57BL/6 sont naturellement résistantes à l'athérosclérose. Ils ont la plupart du cholestérol circulant dans HDL, et les lésions athérosclérotiques complexes ne sont pas formées même lorsqu'elles sont alimentées un régime riche en graisses et en cholestérol13. Les souris hypercholestérolémiques, comme Apoe-/- sur le c57BL/6-arrière-plan, sont donc utilisées comme modèles expérimentaux de l'athérosclérose14,15. L'absence d'ApoE altère l'upprise hépatique des lipoprotéines restantes et perturbe sévèrement le métabolisme des lipides. Dans Apoe-/- souris, le cholestérol circulant est principalement dans les particules de VLDL, et les souris développent des plaques athérosclérotiques complexes sur un régime régulier de chow.
Ldlr-/- les souris imitent le développement de l'athérosclérose vue chez l'homme avec l'hypercholestérolémie familiale16. Les souris Ldlr-/- ont besoin d'un régime occidental de type pour développer l'athérosclérose17. Le régime occidental imite l'apport alimentaire humain et contient habituellement 0,15% de cholestérol. Le récepteur LDL reconnaît apoB100 et ApoE et médiatise l'apport de particules de LDL par endocytose. Les récepteurs de LDL sont fondamentaux pour le dégagement de foie du LDL de la circulation, alors que l'expression de récepteur de LDL dans les cellules hématopoietic n'influence pas ce processus. Ceci ouvre la possibilité pour la transplantation de moelle de Ldlr- / cellules dans l'hypercholestérolémie Ldlr-/- destinataires et évaluation du développement d'athérosclérose. Les chimères de moelle ont été couramment employées pour étudier la participation des cellules hématopoïétiques dans l'athérosclérose expérimentale. Cependant, la transplantation de moelle pourrait influencer la taille et la composition des plaques athérosclérotiques, rendant l'interprétation des résultats ambigu.
Différentes variantes d'Apoe-/et de Ldlr-/- des souris présentant d'autres altérations génétiques ont été développées pour étudier des processus spécifiques de la maladie18. Un exemple est l'homme APOB100-transgénique Ldlr-/- (HuBL) souris qui portent la pleine longueur humaine APOB100 gène19,20. Ces souris développent l'hypercholestérolémie et l'athérosclérose sur un régime régulier de chow. Cependant, le développement de plaques athérosclérotiques complexes prend au moins six mois et les protocoles expérimentaux plus courts utilisent habituellement le régime occidental21. Une grande fraction du cholestérol plasmatique circule dans les particules de LDL, ce qui donne aux souris HuBL un profil de lipoprotéines dyslipidémiques plus humains que les souris Apoe-/- et Ldlr-/- Les souris HuBL permettent également des études de l'apoB humain comme autoantigène22.
Les modèles de souris de l'athérosclérose développent des plaques athérosclérotiques complexes avec des dispositifs partagés de la maladie humaine. Cependant, les plaques sont assez résistantes à la rupture avec l'infarctus du myocarde qui s'ensuit. L'athérothromose n'est détectée que sporadiquement et expérimentalement difficile à évaluer23,24,25. Des modèles spéciaux de rupture de plaque ont été développés, mais le champ expérimental n'a pas de modèle fiable et reproductible pour l'évaluation des agents stabilisateurs de plaque.
Quantification de l'athérosclérose a été rapportée de nombreuses manières dans la littérature. Des efforts récents ont tenté de normaliser la conception expérimentale, l'exécution et la production de rapports sur les études sur les animaux26. Les chercheurs ont des préférences et des techniques différentes adaptées à leurs laboratoires. La plupart des projets de recherche sont également uniques d'une manière qu'ils nécessitent des modifications au protocole. En raison de la nature multifactorielle de la maladie, les contrôles optimaux varient d'un projet à l'autre. Les conditions locales et l'absence de normalisation peuvent entraîner des différences observées dans le développement de la maladie, ce qui entrave les progrès du domaine de la recherche. Les différences dans la variabilité expérimentale signifient également que les calculs statistiques de la puissance doivent être basés sur des études pilotes dans des conditions locales.
La quantification de l'athérosclérose est recommandée à plusieurs endroits dans l'arbre vasculaire. Ce protocole décrit comment obtenir des résultats de la racine aortique, de l'arc aortique, et de l'artère brachiocéphalique dans une souris simple, en plus de laisser le reste de l'aorte thoracoabdominale pour d'autres analyses. En préparations face permettent une quantification rapide des plaques chargées de lipides dans l'arc aortique. La charge de morbidité dans l'artère brachiocéphalique peut également être quantifiée si les spécimens sont soigneusement montrés. Le découpement plus long de la racine aortique laisse plusieurs sections disponibles pour l'évaluation détaillée de la composition de la plaque.
Protocole
Toutes les expériences sur les animaux doivent être approuvées par les autorités éthiques.
1. Sacrifice de souris et microdissection d'Aorta
- Sacrifiez la souris par asphyxie co2 et enregistrez le poids.
- Vaporiser la souris avec 70% d'éthanol pour éviter la contamination de la fourrure des échantillons. Placez la souris en position de supine. De l'encoche jugulaire, faire une incision de ligne médiane à l'aide de ciseaux Mayo l'étendant presque jusqu'à l'os pubien.
MISE EN GARDE: L'éthanol à pourcentage élevé est très inflammable et pourrait causer une irritation oculaire grave. Prenez des mesures de précaution. - Utilisez une aiguille de 23 G pour exsanguiner la souris par ponction cardiaque à travers la paroi du thorax. Cette procédure donne habituellement 750 l de sang d'une souris de 20 semaines. En règle générale, recueillir la moitié du volume dans un tube enduit EDTA tri-potassium et l'autre moitié dans un sérum ou un tube recouvert d'héparine de lithium. Tourner délicatement les tubes et les garder à température ambiante jusqu'à ce que le traitement se repousse.
- Utilisez des ciseaux Mayo pour couper le péritoine pariétal dans la ligne médiane pour ouvrir la cavité abdominale. Maintenez le processus de xiphoïde avec des forceps de tissu et coupez le péritoine latéralement des deux côtés et continuez à ouvrir le diaphragme.
- Utilisez les ciseaux Mayo pour ouvrir la cavité thoracique en coupant à travers la cage thoracique aussi latéralement que possible. Cela permettra de grands angles pour les instruments tout en microdisséquant l'aorte plus tard.
- Faire une incision dans l'oreillette droite pour le drainage du liquide de perfusion. Insérer une aiguille de 27 G à travers le sommet du cœur dans la direction crânienne. Gardez l'aiguille fixe dans le ventricule gauche tout en perfusant lentement la souris avec 10 ml de saline tamponnée par le phosphate glacé (PBS) pendant un minimum de 2 minutes. Observez le foie changeant de couleur et deplus en plus pâle.
REMARQUE: Certains protocoles utilisent la perfusion de paraformaldéhyde, mais cela interfère avec plusieurs applications en aval, telles que l'analyse immunohistochimie des lymphocytes. Par conséquent, aucune fixation de perfusion avec le paraformaldehyde n'est exécutée dans ce protocole. - Disséquer les organes d'intérêt (p. ex. ganglions lymphatiques, rate, foie, intestin, coussinets de graisse inguinal, reins, etc.) à l'aide de forceps anatomiques et de ciseaux disséquants.
- Couper la trachée et l'œsophage sur le côté droit du cœur sans endommager l'arc aortique. Couper le diaphragme et les structures attachant les viscères au rétroperitoneum, laissant le cœur, l'aorte et les reins in situ. Pliez les poumons et les viscères caudally et couvrez-les avec une serviette pour commencer la microdissection rétropéritonéale des ganglions lymphatiques para-aortiques et de l'aorte abdominale.
- Démarrer la microdissection sous un stéréomicroscope à 6x grossissement. Commencez à disséquer la bifurcation aortique en soulevant les tissus environnants avec des forceps Dumont et en coupant sous tension avec des ciseaux Vannas.
- Continuer la dissection de l'aorte abdominale cranially. Couper les branches abdominales de l'aorte et libérer l'aorte proximally par le hiatus aortique dans le diaphragme.
REMARQUE: La microdissection nécessite une coordination œil-main précise par le stéréomicroscope, ce qui prend une certaine pratique à maîtriser.
- Continuer la dissection de l'aorte abdominale cranially. Couper les branches abdominales de l'aorte et libérer l'aorte proximally par le hiatus aortique dans le diaphragme.
- Enlever le tissu adipeux recouvrant l'aorte thoracique. Disséquez soigneusement dorséquement du thymus pour libérer l'arc aortique avec des branches. Continuer à disséquer les artères carotides aussi distally que possible dans la cavité thoracique. Dans des cas spéciaux, la dissection de cou pourrait être exécutée pour inclure la bifurcation carotide.
- Nettoyez les instruments par des rinçants consécutifs dans de l'eau déionisée, une solution de décontamination RNase, 70 % d'éthanol et du PBS avant de couper l'aorte. Soulevez le cœur par le sommet avec les forceps. Couper l'aorte près du cœur et placer tout le cœur dans un tube avec PBS. Le cœur pouvait être stocké sur la glace pendant quelques heures avant de poursuivre le traitement et le cryomontage de la racine aortique.
- Couper l'arc aortique selon la figure 1A. Mettre l'arc aortique dans un tube contenant 1 ml de 4 % de formaldéhyde pendant la nuit à 4 oC. Le spécimen pourrait être stocké de cette manière pendant plusieurs années avant l'épinglage et l'analyse.
MISE EN GARDE: Le formaldéhyde peut causer le cancer, les réactions allergiques de la peau, et est nocif s'il est avalé. Utilisez de l'équipement de protection individuelle au besoin. - Disséquez l'aorte descendante restante et mettez-la dans une solution de stabilisation d'ARN ou congelez-la pour l'analyse suivante d'ARN ou toute autre application. Optimiser le flux de travail pour minimiser le temps de dissection est crucial pour éviter la dégradation excessive de l'ARN.
- Mettre les tubes de collecte de sang (recueillis à l'étape 1.3) dans une centrifugeuse. Faites tourner les tubes de plasma et de sérum séparés à 1 500 x g pendant 15 min à température ambiante. Transférer soigneusement le plasma et le sérum dans les tubes de microcentrifuge et les stocker à -80 oC. La collecte de l'EDTA et du plasma ou du sérum héparinisé laisse des possibilités pour de multiples applications en aval.
- Placer le cœur sur un lit de liège avec le côté ventral vers le haut. Fixer le cœur au bouchon avec une aiguille à travers l'apex. Tenez la base du cœur avec des forceps anatomiques.
- Utilisez un scalpel pour couper l'apical 2/3 du cœur avec la direction de la coupe étant comme une ligne entre les deux auriculaires avec le scalpel incliné 20 degrés caudally dans le plan sagittal et 20 'cranially dans le plan transversal (Figure 1B).
- Intégrez la racine aortique dans un composé optimal de température de coupe (OCT), qui entoure, mais ne s'infiltrent pas dans le tissu. Immerger la base du cœur dans le composé OCT. Pressez doucement le cœur avec les forceps pour remplir la racine aortique d'OCT et enlevez les bulles d'air.
- Transférer le spécimen au fond d'un cryomold rempli d'OCT. La racine aortique doit maintenant être perpendiculaire à la surface inférieure. Mettre le cœur monté sur de la glace sèche pour geler. Conservez les spécimens dans des sacs à fermeture éclair dans des -80 oC jusqu'à ce qu'ils poursuivent la cryosection selon la section 3 de ce protocole.

Figure 1 : Arche cardiaque et aortique in situ. (A) Les poumons, la trachée, l'œsophage et le thymus sont enlevés pour afficher l'arc aortique in situ dans un Apoe femelle de 20 semaines -/- souris sur le régime régulier de chow dans un micrographe, barre d'échelle ' 2 mm. Les lignes pointillées indiquent où couper l'arc aortique et ses branches. (B) Une représentation schématique du cœur et de l'aorte. La ligne pointillée en rouge indique où couper le cœur avant de cryomonter la racine aortique. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
2. En Face Analysis of Aortic Arch and Brachiocephalic Artery (en)
- Préparer des lits d'épinglage pour l'analyse du visage des arcs aortiques. Pliez un segment de film de cire de paraffine huit fois pour faire une surface plate de 25 mm x 25 mm. Enveloppez-le de ruban isolant électrique noir pour faire un fond sombre pour l'aorte. Placez une étiquette à l'arrière du lit d'épinglage et utilisez un crayon de plomb pour écrire le numéro d'identification de la souris (l'encre de stylet normale disparaîtra dans le processus de coloration).
- Transférer l'arc aortique sur le lit d'épinglage et placer une goutte de PBS sur le dessus de celui-ci. Commencez à nettoyer l'aorte du tissu adipeux périadventitial restant sous un stéréomicroscope.
- Utilisez des ciseaux Vannas et des forceps Dumont pour éplucher délicatement tout le tissu adipeux environnant sans manipuler ou endommager l'aorte. Le Soudan IV tachera le tissu adipeux brillamment et il est crucial d'enlever tous ces tissus à ce stade.
REMARQUE: Gardez l'aorte humide en tout temps en appliquant PBS supplémentaire en cas de besoin.
- Utilisez des ciseaux Vannas et des forceps Dumont pour éplucher délicatement tout le tissu adipeux environnant sans manipuler ou endommager l'aorte. Le Soudan IV tachera le tissu adipeux brillamment et il est crucial d'enlever tous ces tissus à ce stade.
- Coupez l'aorte dans le plan coronal en introduisant les ciseaux Vannas dans le lumen aortique pour exposer la surface intimale. Commencez à couper la courbure externe de l'arc ascendant dans la direction distale et continuez à couper les branches, y compris l'artère brachiocéphalique. Épargnez la partie dorsale de la région thoracique descendante.
- Coupez la moindre courbure et pliez l'aorte pour afficher la surface intimale.
REMARQUE: Cette étape nécessite une motricité fine et a besoin d'une certaine pratique à maîtriser.
- Coupez la moindre courbure et pliez l'aorte pour afficher la surface intimale.
- Épingler l'arc ouvert sur le fond à l'aide de l'extrémité émoussée des broches d'insectes. Utilisez un porte-aiguille micro Castroviejo pour mettre les broches en place. Pliez délicatement les broches loin du spécimen lorsqu'elles sont en place. Épingler l'aorte à plat sur le lit sans étirer le spécimen. Entreposer l'arc épinglé vers le bas dans un plat Petri rempli de PBS à 4 oC.
REMARQUE: Le protocole peut être mis en pause ici. - Préparer une solution de travail de Soudan IV. Mélanger 1 g de poudre IV au Soudan, 100 ml d'éthanol à 70 % et 100 ml d'acétone dans une bouteille foncée et remuer doucement pendant 10 min. Il n'est pas nécessaire de filtrer la solution et elle peut être utilisée pendant quelques mois si elle est maintenue sombre à température ambiante. Si la couleur de coloration n'est pas satisfaisante, une nouvelle solution peut être faite et les spécimens tachés à nouveau.
MISE EN GARDE: L'acétone est un liquide inflammable qui pourrait causer une irritation oculaire grave. Conserver dans un endroit bien aéré et prendre des mesures de précaution lors de la manipulation. - Disposez cinq plats Petri sur le banc du laboratoire : un rempli de 70 % d'éthanol, un rempli de solution de travail Soudan IV, deux remplis d'éthanol à 80 % et un rempli de PBS.
- Commencez par rincer le spécimen à 70 % d'éthanol pendant 5 min en plaçant le lit d'épinglage dans le premier plat Petri avec l'arc vers le bas. Transférer le spécimen à la solution de travail Soudan IV et laisser tacher l'arc pendant 7 min.
- Ensuite, rincez à 80 % d'éthanol pendant 3 min deux fois pour demarrer la surface intimale normale. Le temps de détention pourrait être ajusté pour optimiser les résultats. Enfin, rincer au PBS avant de remettre le spécimen dans le plat Petri original.
- Acquérir des micrographes à l'aide d'un stéréomicroscope à 10 fois grossissement connecté à un appareil photo numérique. Prenez des photos de l'arc épinglé immergé dans PBS à l'aide de petits poids métalliques (20 mm x 10 mm x 5 mm) pour tenir le lit d'épinglage au fond d'un plat Petri. Placez une règle à côté de l'aorte pour l'étalonnage de l'image.
- Utilisez un logiciel d'analyse d'images (p. ex. ImageJ) pour déterminer la zone de lésion et la surface intimale totale. En l'absence de repères anatomiques pour définir l'arc aortique, la mesure est généralement effectuée à partir du début de l'aorte ascendante jusqu'à la première branche intercostale (Figure 2A). Utilisez la fonction de quantification de la zone dans le logiciel pour encercler manuellement la zone intimale totale de l'arc.
REMARQUE : La quantification de lésions doit être faite d'une manière aveuglée et il est conseillé qu'un deuxième investigateur confirme les résultats.- Dans ImageJ, sélectionnez l'outil de sélection de polygones et encerclez la zone totale de l'arc par des clics répétitifs. Sélectionnez ensuite la mesure dans le menu d'analyse pour afficher la zone totale de l'arc dans la fenêtre de résultat.
- Ensuite, encerclez toutes les plaques tachées du Soudan IV dans l'arc. Soudan IV est un colorant diazo lysochrome qui tache les lipides, les triglycérides et les lipoprotéines avec une couleur orange-rouge. Dans ImageJ, sélectionnez l'outil de sélection à main levée et encerclez toutes les plaques tout en appuyant sur la touche Alt. Cliquez sur mesure dans le menu d'analyse pour afficher la zone d'arc sans lésion dans la fenêtre de résultat.
- Calculer la surface relative de lésion en soustrayant la zone exempte de lésion de la zone totale de l'arc, puis en divisant le résultat avec la zone totale de l'arc.
- Épinglez soigneusement les artères sous-clavière souillées et carotides pour permettre la quantification des lésions dans l'artère brachiocéphalique (figure 2A). La quantification des lésions dans les artères sous-cllavens et les artères carotides communes est habituellement très provocante et peu significative, respectivement.
- Dans ImageJ, encerclez les deux morceaux de l'artère braciocéphalique à l'aide de l'outil de sélection du polygone tout en appuyant sur la touche de décalage. Cliquez sur la mesure dans le menu d'analyse pour afficher la zone totale de l'artère brachiocéphale dans la fenêtre de résultat.
- Ensuite, sélectionnez l'outil de sélection à main levée et encerclez toutes les plaques dans l'artère brachiocéphalique tout en appuyant sur la touche Alt. Cliquez sur mesure dans le menu d'analyse pour afficher la zone de l'artère brachiocéphalique sans lésion dans la fenêtre de résultat.
- Calculer la zone relative de lésion en soustrayant la zone sans lésion de la zone totale de l'artère brachiocéphale, puis en divisant le résultat avec la zone totale de l'artère brachiocéphale.

Figure 2 : Quantification des lésions arosclérotiques. (A) Arche aortique d'un homme de 20 semaines APOB100-transgénique Ldlr-/- (HuBL) souris nourrie régime occidental pendant dix semaines épinglé ouvert et taché pour les plaques riches en lipides avec le Soudan IV. La surface totale de l'arc aortique est décrite avec la ligne pointillée en blanc dans le micrographe, barre d'échelle de 2 mm. Les lignes pointillées en jaune décrivent la surface totale de l'artère brachiocéphalique. (B) Section transversale de racine aortique à 400 m du sinus aortique dans un Ldlr mâle de 20 semaines -/- la souris a alimenté le régime occidental pendant huit semaines visualisé dans un micrographe, barre d'échelle 500 m. Les lignes pointillées en noir décrivent la surface totale du navire et les lésions athérosclérotiques tachées d'huile rouge O localisées dans l'intima artérielle. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
3. Cryosectioning de la racine aortique
- Fixer la température du cryostat à -20 oC et l'épaisseur de la section à 10 m. Montz le bloc OCT contenant la racine aortique sur le porte-échantillon avec le tissu ventriculaire orienté vers l'extérieur. Tout en commençant à couper, ajuster l'alignement de la surface de section pour être parallèle au porte-échantillon.
- Enlever l'OCT environnant excessif pour faciliter la collecte des sections sans plis. La racine aortique doit maintenant être positionnée perpendiculairement à la lame du couteau étant donné que la base du cœur a été placée correctement dans le moule.
- Recueillir les sections de commande initiales sur les lames de microscope ordinaires, qui seront jetées. Les premières sections ne doivent contenir que du tissu musculaire cardiaque. Progrès de la section de 200 m à l'époque. Recueillir une section et vérifier les progrès avec un microscope léger.
- Lorsque vous vous rapprochez de la zone d'écoulement ventriculaire gauche, vérifiez tous les 100 m sous le microscope. Lorsque des indications initiales d'un mur de navire sont observées, ralentissez le rythme jusqu'à 50 m.
REMARQUE: Lorsque la première cuspide aortique apparaît, ce sera le point zéro pour la collecte des sections. Il peut être difficile de voir quand les cuspes apparaissent exactement, mais une localisation exacte est cruciale pour effectuer des comparaisons des lésions dans la même région. -
Inclinez le spécimen vers le point zéro cuspide pour aligner le plan de section avec les deux autres cuspides. Ceci est crucial pour l'obtention de véritables sections transversales de l'aorte. Faire un dessin de la racine aortique, en indiquant les cusps comme ils apparaissent, et compter toutes les sections de 10 m qui sont coupés à partir du point zéro.
- Lorsqu'une deuxième cuspide apparaît, inclinez légèrement le spécimen à nouveau loin de la cuspide pour aligner le spécimen avec la troisième cuspide. La différence de niveau entre les cusps ne doit pas dépasser 50 m. Commencer à recueillir des sections sur les toboggans à partir du niveau 90 et à partir.
- Recueillir les sections selon la planification de diapositives de la figure 3. La collecte des sections peut être commencée à partir de 190 m si la racine aortique est inclinée à plus de 50 m, afin de permettre à plus d'espace d'aligner la racine en position droite. Continuer la section jusqu'à ce qu'elle atteigne le niveau 800 m à partir du point zéro. S'il y a encore des plaques visibles à ce niveau, la collection pourrait être étendue à 1 000 m.
REMARQUE: Une organisation simplifiée de diapositives est présentée dans la figure 1supplémentaire, ce qui pourrait augmenter la vitesse de sectionnement. La planification optimale des diapositives doit être décidée en fonction du plan de projet.
-
Fixer les sections après la collecte.
- Fixer les sections recueillies pour la coloration huile rouge O et la coloration rouge Picrosirius de collagène dans 4 % de formaldéhyde pendant 10 min. Rincer à l'eau déionisée, sécher et conserver à température ambiante jusqu'à ce qu'il poursuive la section 4 de ce protocole. Si les diapositives doivent être tachées d'huile rouge O tout de suite et sont encore humides, placez-les dans 60% isopropanol pendant 1 min pour accélérer le processus de séchage.
MISE EN GARDE: L'isopropanol est un liquide inflammable qui peut causer une irritation oculaire grave et peut causer de la somnolence ou des étourdissements. Conserver dans un endroit bien aéré et prendre des mesures de précaution lors de la manipulation. - Fixer les sections recueillies pour l'immunohistochimie ou l'immunofluorescence dans l'acétone pure à froid pendant 10 min. Sécher à température ambiante pendant 30 min. Entreposez les sections à -20 oC.
- Fixer les sections recueillies pour la coloration huile rouge O et la coloration rouge Picrosirius de collagène dans 4 % de formaldéhyde pendant 10 min. Rincer à l'eau déionisée, sécher et conserver à température ambiante jusqu'à ce qu'il poursuive la section 4 de ce protocole. Si les diapositives doivent être tachées d'huile rouge O tout de suite et sont encore humides, placez-les dans 60% isopropanol pendant 1 min pour accélérer le processus de séchage.
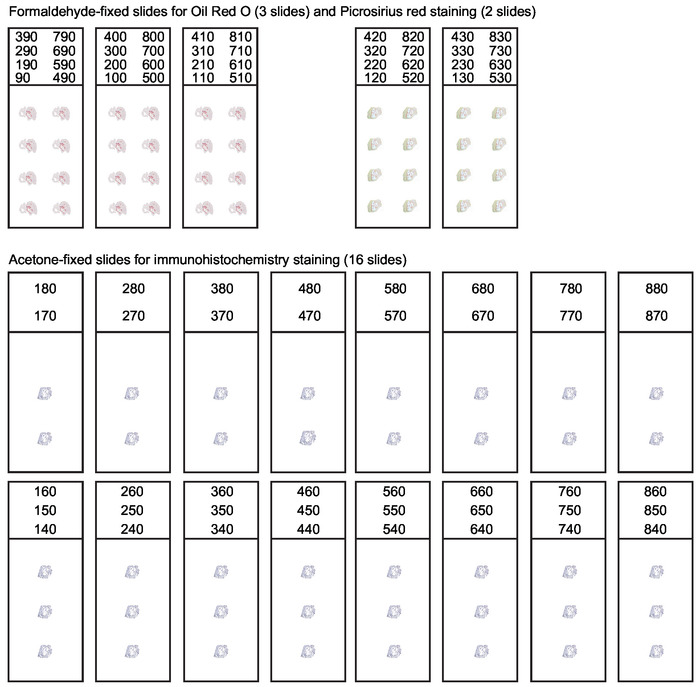
Figure 3 : Organisation de diapositives pour les sections sérielles de la racine aortique. Pendant la cryosection de la racine aortique, toutes les sections de 10 m d'épaisseur couvrant les 800 premiers mètres de l'aorte ascendante doivent être collectées. Une organisation systématique de diapositives est nécessaire pour obtenir des sections appropriées pour diverses applications. L'analyse de la composition de lésion inclut habituellement la coloration rouge d'huile d'O pour des lipides et la coloration rouge de Picrosirius pour le collagène. Les sections restantes sont rassemblées et acétone-fixées pour l'immunohistochimie et la coloration d'immunofluorescence. Ce chiffre a été modifié à partir de Gister et al30. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
4. Huile rouge O Coloration et Quantification de l'athérosclérose dans les racines aortiques
- Préparer une solution saturée Oil Red O en dissolvant 1 g de Pétrole Red O en 100 ml d'isopropanol. Remuer la solution dans une bouteille foncée pendant 1 heure à température ambiante. La solution saturée peut être conservée pendant plusieurs mois.
REMARQUE: Il est conseillé d'avoir de l'équipement de laboratoire désigné pour la coloration Oil Red O, car il est difficile de nettoyer l'équipement qui a été en contact avec la solution. - Préparer une solution de travail en mélangeant 75 ml de la solution saturée Oil Red O avec 50 ml d'eau déionisée. Laisser reposer à température ambiante pendant 10 min. Filtrer à travers un papier filtre qualitatif.
- Placer les glissières dans la solution de travail Oil Red O pendant 20 min. Rincer à l'eau du robinet pendant 5 min.
- Pour faciliter la visualisation des tissus, tachez l'hématoxyline de Mayer pendant 1 min. Rincer à l'eau tiède du robinet pendant 5 min. Tous les noyaux doivent maintenant être tachés dans la couleur bleue, ajuster le temps de coloration pour optimiser le résultat.
- Les glissements de montagne dans un milieu de montage aqueux (p. ex., la gélatine de glycérol de Kaiser). Réchauffer la gélatine de glycérol de Kaiser à 40 oC pour la rendre fluide avant utilisation. Il n'est pas nécessaire de sécher les lames puisque le milieu de montage est à base d'eau. Veillez à éviter la formation de bulles d'air lors de l'ajout du verre de couverture.
MISE EN GARDE: La gélatine de glycérol de Kaiser contient du phénol, qui est soupçonné de causer des défauts génétiques. Utilisez de l'équipement de protection individuelle au besoin. - Acquérir des micrographes numériques à l'aide d'une caméra reliée à un microscope léger. Habituellement, la paroi complète du navire et les limites des lésions pouvaient être clairement visualisées par un grossissement 50 fois plus important. Enregistrer les images haute résolution, de préférence en format de fichier image étiqueté (TIFF).
- Effectuer une analyse de la taille des lésions à l'aide d'un système logiciel d'analyse d'images assisté par ordinateur. L'huile rouge O est un colorant diazo lysochrome qui tache les lipides neutres et visualise les plaques athérosclérotiques avec une couleur rouge intense, ce qui aide la quantification des lésions.
REMARQUE : La quantification de lésions doit être faite d'une manière aveuglée et il est conseillé qu'un deuxième investigateur confirme les résultats obtenus.- Utilisez la fonction de quantification de la zone dans le logiciel d'analyse d'image pour définir la superficie totale du navire en encerclant la lame élastique externe de la paroi du navire aortique (figure 2B). Dans ImageJ, sélectionnez l'outil de sélection du polygone et encerclez la zone par des clics répétitifs. Sélectionnez ensuite la mesure dans le menu d'analyse. La surface totale du navire est affichée dans la fenêtre de résultat.
- Continuer à quantifier les lésions athérosclérotiques dans la couche intimale du vaisseau, définie par la lame élastique interne et la limite luminale. Habituellement les lésions sur des cuspides de valve sont exclues de la mesure27. Dans ImageJ, sélectionnez l'outil de sélection à main levée et encerclez toutes les plaques tout en appuyant sur la touche Alt. Sélectionnez la mesure dans le menu d'analyse pour afficher la zone du navire sans lésion dans la fenêtre de résultat.
- Calculer la surface relative de lésion en soustrayant la zone exempte de lésion de la surface totale du navire, puis en divisant le résultat avec la superficie totale du navire.
REMARQUE: Calibrer les résultats dans le logiciel d'analyse d'image en fonction du grossissement utilisé pour obtenir une zone de lésion absolue en micromètre carré.
- Définissez la zone teintée d'Huile Rouge O dans les lésions en utilisant une fonction de seuil de couleur dans le logiciel d'analyse d'image pour calculer le pourcentage de zone positive de l'huile rouge O de la surface totale de lésion.
- Dans ImageJ, encerclez toute la zone de lésion en utilisant l'outil de sélection à main levée tout en appuyant sur la touche de décalage. Sélectionnez la mesure dans le menu d'analyse pour afficher la zone de lésion totale est dans la fenêtre de résultat.
- Sélectionnez clairement à l'extérieur dans le menu d'édition. Modifier le type d'image en 8 bits dans le menu d'images.
- Définir un seuil rouge pour la zone négative Oil Red O en sélectionnant le seuil dans le sous-menu d'ajustement du menu d'image. Cliquez sur appliquer. Rendre l'image binaire en sélectionnant cette option dans le sous-menu binaire du menu de processus.
REMARQUE: Habituellement, la coloration Oil Red O varie d'un lot à l'autre. Par conséquent, le seuil de couleur n'est recommandé que dans le même lot de coloration. Le résultat devrait être présenté avec une description de la façon dont le seuil a été déterminé et normalisé. - Analysez l'image en sélectionnant les particules d'analyse dans le menu d'analyse et cliquez sur ok. La zone de lésion négative total Oil Red O est maintenant affichée dans la fenêtre de résumé. Calculer la zone relative du rouge o en soustraire la zone négative du pétrole rouge O de la surface totale de lésion, puis en se divisant avec la surface totale de lésion.
Résultats
Dans les modèles de souris de l'athérosclérose les lésions les plus importantes ont tendance à se développer dans la racine aortique et l'arc aortique. Ce protocole décrit la quantification de l'athérosclérose dans la racine aortique, l'arc aortique, et l'artère brachiocéphalique dans une souris simple. Les lésions mesurables dans l'aorte descendante thoracique et l'aorte abdominale sont seulement présentes dans les animaux présentant la maladie avancée. Dans ce protocole, ces parties ne sont pas analysées pour la charge athérosclérotique, mais enregistrées pour l'analyse ultérieure des niveaux d'ARNm ou d'autres analyses. Les sections sérielles des lésions athérosclérotiques dans la racine aortique sont habituellement affichées dans un graphique avec la taille de lésion sur l'axe de yet la distance au sinus aortique sur le x-axe28. Les vraies coupes transversales sont cruciales pour la quantification de la taille des lésions. Les sections obliques peuvent surestimer la taille des lésions et une inclinaison de seulement 20 degrés pourrait surestimer la surface de lésion absolue de 15 %29. Toutefois, le calcul de la fraction de lésion de la superficie totale du navire rend le résultat moins sensible aux différences d'angle possibles au cours de la section (figure4A). Une méthode statistique appropriée pour détecter les différences entre les groupes est habituellement une analyse régulière à deux voies de la variance (ANOVA). Les tests post-tests Bonferroni sont ensuite effectués pour détecter les différences à certains niveaux. La différence la moins significative de Fisher pourrait également être utilisée comme test de suivi à ANOVA. Il réduit la probabilité d'erreurs statistiques de type II, mais ne tient pas compte de comparaisons multiples. En outre, il pourrait être illustratif de calculer la zone sous la courbe ou la taille moyenne des lésions par souris et de présenter les données dans une parcelle de point pour visualiser davantage la variation individuelle au sein des groupes (Figure 4B).
L'huile rouge O est un colorant diazo rouge vif liposoluble, qui tache les lipides neutres. Les lipides polaires dans les membranes cellulaires ne sont pas tachés. La coloration rouge O à l'huile peut être effectuée sur des échantillons frais, congelés ou fixés en formaline, mais pas sur des échantillons incorporés à la paraffine en raison de l'élimination des lipides dans le processus de déparaffinisation requis. Une quantification de l'accumulation de lipides lésions pourrait être effectuée en délimitant la zone positive de l'huile rouge O de la surface totale de lésion (Figure 4C). L'hématoxylin produit une coloration bleue des noyaux cellulaires, qui est utile pour visualiser la morphologie de plaque. Les artères coronaires droites et gauches divergent habituellement de l'aorte autour de 250 m du sinus aortique27,qui coïncident souvent avec les tailles de lésion les plus importantes. Les sections transversales de cette région sont souvent affichées comme des résultats représentatifs (figure 4D).

Figure 4 : Lésions atherosclérotiques dans la racine aortique. (A) Vingt-huit semaines de chimères mâles de moelle ont alimenté le régime occidental pendant huit semaines ont été évaluées pour déterminer l'effet des cellules T Smad7-déficientes sur le développement d'athérosclérose. Ldlr expérimental-/- les chimères ont reçu la moelle osseuse Cd4-Cre -Smad7fl/fl et les contrôles ont reçu la moelle osseuse Cd4-CreetSmad7fl/MD. Le graphique montre la quantification de la zone de lésion athérosclérotique de huit sections consécutives, 100 - 800 m du sinus aortique affiché comme fraction de lésion de la surface totale du navire (Cd4-Cre-Smad7fl //Ldlr-/- n-6, Cd4-Cre-Smad7fl/fl/Ldlr-/- n ' 9, 2 voies ANOVA avec le post-test de Bonferroni, graphique montre moyenne 'SEM, accolades indiquent le niveau d'importance pour la comparaison de souche). (B) L'intrigue à points combinés et le graphique à barres montre la zone moyenne de lésion athérosclérotique des sections de racine aortique (Cd4-Cre-Smad7fl //Ldlr-/- n -6, Cd4-Cre-Smad7fl/fl/ Ldlr-/- n ' 9, Student's t-test) (C) Fraction of Oil Red O-stained area in the lesions (Cd4-Cre-Smad7fl//Ldlr-/- n ' 4, Cd4-Cre'Smad7fl/fl /Ldlr-/- n -6, Student's t-test, ns'non-significant) (B-C) Lespoints représentent des souris individuelles et les barres montrent la moyenne des micrographies représentatives montrant la coloration de l'huile rouge O (en rouge couleur) de lipides neutres dans la racine aortique 300 m de sinus aortique (grossissement 50x), barre d'échelle de 500 m. Ce chiffre a été modifié à partir de Gister et al.31. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Huile Red O pourrait être utilisé pour la coloration des aortes en face préparée, mais ce protocole utilise Soudan IV, un autre colorant diazo liposoluble pratique. Soudan IV visualise clairement les plaques athérosclérotiques d'une couleur orange-rouge en taclant les lipides, les triglycérides et les lipoprotéines. Enlever le fond sombre dans les images représentatives des arcs aortiques en face pourrait améliorer l'affichage visuel (Figure 5A). Habituellement, la taille des lésions est normalement répartie en groupes, ce qui permet des tests statistiques avec le testt-test de l'étudiant entre les groupes. Une parcelle de point qui montre à la fois les souris individuelles et la moyenne, qui est comparée entre les groupes, est une façon informative d'afficher les résultats (Figure 5B-C). Puisque la variation au sein des groupes est typiquement différente entre les endroits dans l'arbre vasculaire, des calculs séparés de puissance sont habituellement nécessaires. La variation inutile peut être évitée par la compétence de méthode et la normalisation de protocole. Il est important d'obtenir des résultats statistiquement significatifs, mais la pertinence biologique d'une différence observée doit toujours être prise en considération.
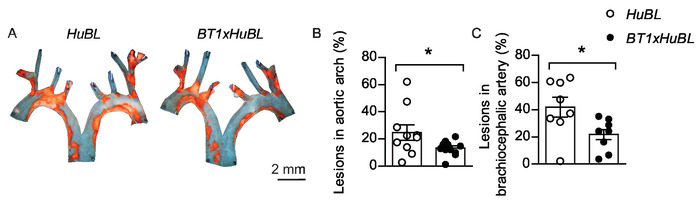
Figure 5 : Lésions atherosclérotiques dans l'arc aortique et l'artère brachiocéphalique. (A) Représentant en visage micrographies d'arcs aortiques avec des plaques chargées de lipides tachées de Soudan IV (en couleur orange) de souris de 20 semaines nourri régime occidental pendant dix semaines, visualisé ensemble. Barre d'échelle de 2 mm. Les souris ldlr-/- ( HuBL)ont été utilisées comme témoins et le groupe expérimental était composé de souris transgéniques TCR avec des lymphocytes T réactifs LDL (BT1) croisés à des souris HuBL. (B) Lésions atherosclérotiques dans l'arc aortique (HuBL n 10, BT1xHuBL n 12; L'étudiant t-test). (C) Lésions atherosclérotiques dans l'artère brachiocéphalique (HuBL n 8, BT1xHuBL n - 9, Student's t-test). (B-C) Les points représentent des souris individuelles, les barres montrent la moyenne de 'SEM. 'p '0,05. Ce chiffre a été modifié à partir de Gister et al.32. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Figure supplémentaire 1 : Organisation alternative de diapositives pour les sections sérielles de la racine aortique. Une organisation systématique simplifiée de diapositives pour la collecte des sections de la racine aortique. La collection permet la coloration oil Red O pour les lipides et immunohistochemistry ou la coloration immunofluorescence. Des diapositives dédiées pour la coloration rouge Picrosirius de collagène sont omises. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les maladies cardiovasculaires sont le principal tueur dans le monde et de nouvelles mesures préventives sont nécessaires2. Les modèles de souris de la maladie fournissent une plate-forme complète pour l'étude de la pathophysiologie et des traitements expérimentaux13. Une quantification fiable de la taille des lésions est essentielle à cette approche. Cependant, les méthodes de quantification diffèrent d'un laboratoire à l'autre. La normalisation et l'optimisation sont un processus continu depuis les années 198013,27,33,34. Les racines aortiques sont apparues comme le site le plus populaire pour quantifier l'athérosclérose expérimentale. Des coupes transversales de plaques permettent de comparer le volume de la plaque entre les groupes. En préparations face sont favorisés pour la quantification des lésions dans les segments plus grands de l'aorte. La méthode en face visualise la quantité de plaque et permet la quantification de la couverture de la plaque, mais ne tiennent pas compte de l'épaisseur de la plaque. La pertinence biologique des différences observées est étayée par des résultats cohérents à différents endroits dans l'arbre vasculaire. L'évaluation du développement de l'athérosclérose à différents endroits traite des effets spécifiques possibles au site. L'effet des cellules hématopoïétiques transplantées sur le développement d'athérosclérose peut être évalué dans le Ldlr hypercholestérolémique -/- chimères. Cependant, l'irradiation de corps entier affecte le processus d'athérosclérose avec des effets spécifiques de site. Des lésions atherosclérotiques plus proéminentes sont développées dans la racine aortique, tandis que le développement réduit de lésion est observé dans les arcs aortiques35.
Il est important de noter que non seulement la taille des lésions doit être abordée dans les études sur l'athérosclérose expérimentale. La composition des lésions est également un paramètre clé. Plusieurs dispositifs de plaque ont été associés aux manifestations de la maladie chez l'homme36. La section en série de la racine aortique laisse plusieurs sections disponibles pour une analyse minutieuse de la composition de la plaque. La rupture de plaque chez l'homme est caractérisée par un chapeau fibreux mince avec peu de cellules lisses de muscle, le contenu clairsemé de collagène et des signes d'inflammation dans les plaques36. Bien que la rupture de plaque soit un événement rare dans les modèles de souris de l'athérosclérose, les marqueurs pour la stabilité de plaque sont instructifs pour évaluer. Les approches translationnelles pourraient confirmer les résultats mécanistes des modèles de souris et découvrir des caractéristiques importantes de la maladie humaine31. L'état inflammatoire des plaques atherosclérotiques pourrait être déterminé par la coloration immunohistochemistry de VCAM-1, de classe II de MHC, de macrophages, et de lymphocytes30. Certains protocoles utilisent des sections longitudinales dans le plan coronal de l'arc aortique ou de l'artère brachiocéphale pour mesurer la taille et la composition des lésions athérosclérotiques37. Cependant, cette méthode alternative ne laisse que peu de sections à analyser, ce qui limite ses applications.
Une première étape critique dans ce protocole est la capacité de récolter les aortes efficacement. La coordination œil-main sous le microscope nécessite de la pratique et est cruciale à la fois pour la microdissection et l'épinglage ultérieur de l'arc aortique. La prochaine étape critique de ce protocole est la collecte de sections série à partir de la racine aortique. Quatre-vingts sections consécutives doivent être collectées pour chaque souris, ce qui nécessite à la fois de la concentration et de la patience. La compétence méthodologique pourrait accélérer considérablement les processus décrits. Néanmoins, la quantification de la lésion athérosclérotique est toujours une tâche longue. Les nouvelles technologies, la manipulation automatisée et l'imagerie des petits animaux pourraient faciliter la quantification de l'athérosclérose expérimentale à l'avenir. La progression de l'athérosclérose est lente et la plupart des protocoles expérimentaux dans les modèles de souris prennent plus de quatre mois pour compléter13. Par conséquent, les aortes doivent être collectées de manière optimisée aux points de terminaison d'étude. Ce protocole fournit un guide complet pour récolter efficacement les aortes et le traitement proposé prépare les aortes pour une utilisation polyvalente, y compris la quantification des lésions dans la racine aortique, l'arc aortique et l'artère brachiocéphalique. Espérons que le protocole peut réduire la variabilité expérimentale, améliorer la fiabilité des résultats, et conduire à des résultats qui ouvriront la voie à de nouveaux traitements contre l'athérosclérose.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous remercions tous les anciens membres de l'unité expérimentale de recherche cardiovasculaire de Gâran K Hansson qui a contribué à l'élaboration de ce protocole au cours du dernier quart de siècle. Nous sommes particulièrement reconnaissants pour les contributions d'Antonino Nicoletti, Xinghua Zhou, Anna-Karin Robertson et Inger Bodin. Ces travaux ont été soutenus par la subvention du projet 06816 et le soutien de Linné 349-2007-8703 du Conseil suédois de la recherche, et par des subventions de la Fondation suédoise Heart-Lung, du Conseil du comté de Stockholm, de la Fondation du professeur Nanna Svartz, de Loo et de Hans Osterman. Foundation for Medical Research, Karolinska Institutet's Research Foundation et Foundation for Geriatric Diseases à l'Institut Karolinska.
matériels
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | 20066.296 | For fixation of sections for immunohistochemistry. |
| Black electrical insulation tape (50 mm wide) | Any specialized retailer | - | To create pinning beds for aortic arches. |
| Centrifuge | Eppendorf | 5417C | Benchtop microcentrifuge. |
| Cork board | Any specialized retailer | - | For cutting hearts in the preparation to cryomount aortic roots. |
| Cryostat | Thermo Scientific | Microm HM 560 | For serial cryosectioning of aortic roots. |
| Deionized water | - | - | For rinsing and preparation of solutions. |
| Digital camera | Leica Microsystems | DC480 | 5.1 megapixel CCD for high-resolution images of aortic arches and aortic root sections. |
| Dissecting scissors (10 cm, straight) | World Precision Instruments | 14393 | For general dissection of organs. |
| Dumont forceps #5 (11 cm, straight) | World Precision Instruments | 500341 | For microdissection of aorta. |
| Ethanol 70% (v/v) | VWR Chemicals | 83801.290 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Ethanol absolute ≥99.8% | VWR Chemicals | 20821.310 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Formaldehyde 4% stabilised, buffered (pH 7.0) | VWR Chemicals | 9713.1000 | Harmful by inhalation, in contact with skin and if swallowed. |
| ImageJ | NIH | - | Image analysis software. |
| Iris forceps (10 cm, curved, serrated) | World Precision Instruments | 15915-G | Used as anatomical forceps. |
| Isopropanol | Merck | 1096341011 | Flammable liquid, causes serious eye irritation, and may cause drowsiness or dizziness. |
| Kaiser's glycerol gelatine | Merck | 1092420100 | Aqueous mounting medium containing phenol. Suspected of causing genetic defects. |
| Light microscope | Leica Microsystems | DM LB2 | For analysis during sectioning and documentation of Oil Red O stained micrographs. |
| Mayer's hematoxylin | Histolab | 1820 | Non-toxic staining solution without chloral hydrate, but causes serious eye irritation. |
| Mayo scissors (17 cm, straight) | World Precision Instruments | 501751-G | For general dissection. |
| Micro Castroviejo needle holder (9 cm, straight) | World Precision Instruments | 503376 | For pinning of aortic arches. |
| Microcentrifuge tubes | Corning | MCT-175-C | Polypropylene microtubes with snaplock cap. |
| Microlance 3 needles, 23 gauge | BD | 300800 | For blood collection. |
| Microlance 3 needles, 27 gauge | BD | 302200 | For perfusion of mice. |
| Microvette 500 µL, K3 EDTA | Sarstedt | 20.1341.100 | For blood collection. |
| Microvette 500 µL, Lithium Heparin | Sarstedt | 20.1345.100 | For blood collection. |
| Minutien insect pins, 0.10 mm | Fine Science Tools | 26002-10 | For pinning of aortic arches. |
| Oil Red O | Sigma-Aldrich | O0625 | Not classified as a hazardous substance or mixture. |
| Optimum cutting temperature (OCT) cryomount | Histolab | 45830 | For embedding tissue. |
| Parafilm M | Bemis | PM992 | Paraffin wax film used to create pinning beds for aortic arches. |
| Petri dishes (100 mm x 20 mm) | Any cell culture supplier | - | Proposed as a storage container for pinned aortas. |
| Phosphate buffered saline (PBS) | - | - | Sterile and RNase-free solution is required for perfusion of mice. |
| Qualitative filter paper (grade 1001) | Munktell | 120006 | For filtering Oil Red O working solution (typical retention 2-3 µm). |
| RNAlater RNA stabilization reagent | Qiagen | 76106 | For stabilization of RNA in tissue samples |
| RNaseZap RNase Decontamination Solution | Invitrogen | AM9780 | A surface decontamination solution that destroys RNases on contact. |
| Scalpel handle #3 (13 cm) | World Precision Instruments | 500236 | For cutting hearts in the preparation to cryomount aortic roots. |
| Standard scalpel blade #10 | World Precision Instruments | 500239 | For cutting hearts in the preparation to cryomount aortic roots. |
| Stereomicroscope | Leica Microsystems | MZ6 | For dissection and en face documentation |
| Sudan IV | Sigma-Aldrich | S4261 | Not classified as a hazardous substance or mixture. |
| Superfrost Plus microscope slides | Thermo Scientific | J1800AMNZ | To collect aortic root sections. |
| Tissue forceps (15 cm) | World Precision Instruments | 501741-G | For general dissection. |
| Tissue-Tek cryomolds (10 mm x 10 mm x 5 mm) | Sakura | 4565 | For embedding aortic roots in OCT. |
| Vannas scissors (8 cm, straight) | World Precision Instruments | 503378 | For microdissection of aorta. |
Références
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859), 2095-2128 (2012).
- Gistera, A., Hansson, G. K. The immunology of atherosclerosis. Nature Reviews Nephrology. 13 (6), 368-380 (2017).
- Hansson, G. K. Inflammation, atherosclerosis, and coronary artery disease. New England Journal of Medicine. 352 (16), 1685-1695 (2005).
- Williams, K. J., Tabas, I. The response-to-retention hypothesis of early atherogenesis. Arteriosclerosis, Thrombosis, and Vascular Biology. 15 (5), 551-561 (1995).
- Pentikainen, M. O., Oorni, K., Ala-Korpela, M., Kovanen, P. T. Modified LDL - trigger of atherosclerosis and inflammation in the arterial intima. Journal of Internal Medicine. 247 (3), 359-370 (2000).
- Ruuth, M., et al. Susceptibility of low-density lipoprotein particles to aggregate depends on particle lipidome, is modifiable, and associates with future cardiovascular deaths. European Heart Journal. 39 (27), 2562-2573 (2018).
- Nakashima, Y., Raines, E. W., Plump, A. S., Breslow, J. L., Ross, R. Upregulation of VCAM-1 and ICAM-1 at atherosclerosis-prone sites on the endothelium in the ApoE-deficient mouse. Arteriosclerosis, Thrombosis, and Vascular Biology. 18 (5), 842-851 (1998).
- Goldstein, J. L., Ho, Y. K., Basu, S. K., Brown, M. S. Binding site on macrophages that mediates uptake and degradation of acetylated low density lipoprotein, producing massive cholesterol deposition. Proceedings of the National Academy of Sciences of the United States of America. 76 (1), 333-337 (1979).
- Paigen, B., Morrow, A., Brandon, C., Mitchell, D., Holmes, P. Variation in susceptibility to atherosclerosis among inbred strains of mice. Atherosclerosis. 57 (1), 65-73 (1985).
- Russell, E. S. Origins and history of mouse inbred strains: contributions of Clarence Cook Little. Origins of Inbred Mice, Morse, HC, eds. (Academic Press, NY). , 33-43 (1978).
- Waterston, R. H., et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Gistera, A., Ketelhuth, D. F. J. Lipid-driven immunometabolic responses in atherosclerosis. Current Opinion in Lipidology. 29 (5), 375-380 (2018).
- Maganto-Garcia, E., Tarrio, M., Lichtman, A. H. Mouse models of atherosclerosis. Current Protocols in Immunology. Chapter 15, Unit 15.24.11-23 (2012).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Zhang, S. H., Reddick, R. L., Piedrahita, J. A., Maeda, N. Spontaneous hypercholesterolemia and arterial lesions in mice lacking apolipoprotein E. Science. 258 (5081), 468-471 (1992).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. Journal of Clinical Investigation. 92 (2), 883-893 (1993).
- Ishibashi, S., Goldstein, J. L., Brown, M. S., Herz, J., Burns, D. K. Massive xanthomatosis and atherosclerosis in cholesterol-fed low density lipoprotein receptor-negative mice. Journal of Clinical Investigation. 93 (5), 1885-1893 (1994).
- Ketelhuth, D. F., Gistera, A., Johansson, D. K., Hansson, G. K. T cell-based therapies for atherosclerosis. Current Pharmaceutical Design. 19 (33), 5850-5858 (2013).
- Skalen, K., et al. Subendothelial retention of atherogenic lipoproteins in early atherosclerosis. Nature. 417 (6890), 750-754 (2002).
- Boren, J., et al. Identification of the low density lipoprotein receptor-binding site in apolipoprotein B100 and the modulation of its binding activity by the carboxyl terminus in familial defective apo-B100. Journal of Clinical Investigation. 101 (5), 1084-1093 (1998).
- Sanan, D. A., et al. Low density lipoprotein receptor-negative mice expressing human apolipoprotein B-100 develop complex atherosclerotic lesions on a chow diet: no accentuation by apolipoprotein(a). Proceedings of the National Academy of Sciences of the United States of America. 95 (8), 4544-4549 (1998).
- Gistera, A., et al. Vaccination against T-cell epitopes of native ApoB100 reduces vascular inflammation and disease in a humanized mouse model of atherosclerosis. Journal of Internal Medicine. , (2017).
- Johnson, J. L., Jackson, C. L. Atherosclerotic plaque rupture in the apolipoprotein E knockout mouse. Atherosclerosis. 154 (2), 399-406 (2001).
- Calara, F., et al. Spontaneous plaque rupture and secondary thrombosis in apolipoprotein E-deficient and LDL receptor-deficient mice. The Journal of Pathology. 195 (2), 257-263 (2001).
- Caligiuri, G., Levy, B., Pernow, J., Thoren, P., Hansson, G. K. Myocardial infarction mediated by endothelin receptor signaling in hypercholesterolemic mice. Proceedings of the National Academy of Sciences of the United States of America. 96 (12), 6920-6924 (1999).
- Daugherty, A., et al. Recommendation on Design, Execution, and Reporting of Animal Atherosclerosis Studies: A Scientific Statement From the American Heart Association. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (9), e131-e157 (2017).
- Paigen, B., Morrow, A., Holmes, P. A., Mitchell, D., Williams, R. A. Quantitative assessment of atherosclerotic lesions in mice. Atherosclerosis. 68 (3), 231-240 (1987).
- Purcell-Huynh, D. A., et al. Transgenic mice expressing high levels of human apolipoprotein B develop severe atherosclerotic lesions in response to a high-fat diet. Journal of Clinical Investigation. 95 (5), 2246-2257 (1995).
- Nicoletti, A., Kaveri, S., Caligiuri, G., Bariety, J., Hansson, G. K. Immunoglobulin treatment reduces atherosclerosis in apo E knockout mice. Journal of Clinical Investigation. 102 (5), 910-918 (1998).
- Gistera, A., Ketelhuth, D. F. Immunostaining of Lymphocytes in Mouse Atherosclerotic Plaque. Methods in Molecular Biology. 1339, 149-159 (2015).
- Gistera, A., et al. Transforming growth factor-beta signaling in T cells promotes stabilization of atherosclerotic plaques through an interleukin-17-dependent pathway. Science Translational Medicine. 5 (196), 196ra100 (2013).
- Gistera, A., et al. Low-Density Lipoprotein-Reactive T Cells Regulate Plasma Cholesterol Levels and Development of Atherosclerosis in Humanized Hypercholesterolemic Mice. Circulation. 138 (22), 2513-2526 (2018).
- Daugherty, A., Whitman, S. C. Quantification of atherosclerosis in mice. Methods in Molecular Biology. 209, 293-309 (2003).
- Baglione, J., Smith, J. D. Quantitative assay for mouse atherosclerosis in the aortic root. Methods in Molecular Biology. 129, 83-95 (2006).
- Schiller, N. K., Kubo, N., Boisvert, W. A., Curtiss, L. K. Effect of gamma-irradiation and bone marrow transplantation on atherosclerosis in LDL receptor-deficient mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 21 (10), 1674-1680 (2001).
- Naghavi, M., et al. From vulnerable plaque to vulnerable patient: a call for new definitions and risk assessment strategies: Part I. Circulation. 108 (14), 1664-1672 (2003).
- Seijkens, T. T. P., et al. Targeting CD40-Induced TRAF6 Signaling in Macrophages Reduces Atherosclerosis. Journal of the American College of Cardiology. 71 (5), 527-542 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon