Method Article
Quantificação da aterosclerose em camundongos
Neste Artigo
Resumo
Os modelos murinos de aterosclerose são ferramentas úteis para investigar vias patogênicas em nível molecular, mas necessitam de quantificação padronizada do desenvolvimento da lesão. Este protocolo descreve um método aperfeiçoado para determinar o tamanho da lesão nos vasos arteriais principais que incluem a raiz aórtica, o arco aórtico, e a artéria braquiocefálico.
Resumo
A doença cardiovascular é a principal causa de morte no mundo. A causa subjacente na maioria dos casos é a aterosclerose, que é em parte uma doença inflamatória crônica. Estudos de aterosclerose experimental têm elucidado o papel do colesterol e inflamação no processo da doença. Isto conduziu aos testes clínicos bem sucedidos com os agentes farmacêuticos que reduzem manifestações clínicas da aterosclerose. As experiências cuidadosas e bem controladas em modelos do rato da doença poderiam mais elucidar a patogénese da doença, que não é compreendida inteiramente. A análise padronizada da lesão é importante para reduzir a variabilidade experimental e aumentar a reprodutibilidade. A determinação do tamanho da lesão na raiz aórtica, arco aórtico e artéria braquiocefálico são desfechos comuns na aterosclerose experimental. Este protocolo fornece uma descrição técnica para a avaliação da aterosclerose em todos esses sites em um único mouse. O protocolo é particularmente útil quando o material é limitado, como é freqüentemente o caso quando os animais geneticamente modificados estão sendo caracterizados.
Introdução
A doença cardiovascular é a principal causa de morte no mundo com cardiopatia isquêmica e acidente vascular cerebral, representando um em cada quatro óbitos1. A maioria dos casos é causada pela aterosclerose, uma doença caracterizada por um acúmulo lento de placas lipido-carregadas com sinais de inflamação crônica em artérias de grande e médio porte2. A doença geralmente permanece despercebida ao longo de várias décadas até que uma ruptura ou erosão da placa provoca uma trombose arterial que leva a lesão tecidual isquêmica.
Uma artéria normal consiste em uma camada íntima com células endoteliais e células musculares lisas escassamente distribuídas, uma camada de mídia com células musculares lisas e lamelas elásticas, e uma camada adventícia circundante com tecido conjuntivo solto3. Uma retenção intimal de LDL compensa o desenvolvimento da aterosclerose4. Acúmulo e modificação de lipoproteínas levam à agregação e aprisionamento dentro da íntima arterial5. Uma resposta inflamatória é evocada pelas lipoproteínas presas e modificadas6. As células endoteliais começam a expressar moléculas de adesão, como a VCAM-1 em sítios da árvore arterial com fluxo sanguíneo turbulento, levando ao recrutamento de monócitos circulantes e outros leucócitos7. Os monócitos infiltrantes diferenciam-se em macrófagos que engolem lipídios com transformação subsequente em células de espuma de macrófagos8.
A aterosclerose tem sido estudada em modelos de mouse com frequência crescente desde meados da década de 1980. C57BL/6 é a cepa de camundongo mais comumente usada para esses estudos, sendo utilizada como fundo genético para a maioria das cepas geneticamente modificadas9. Esta estirpe foi estabelecida na década de 192010, e seu genoma foi publicado em 200211. Experimentos em modelos de mouse têm vários benefícios: as colônias se reproduzem rapidamente, a habitação é eficiente em termos espaciais e a inreprodução reduz a variabilidade experimental. O modelo também permite manipulações genéticas, tais como apagamentos genéticos direcionados e inserção de transgenes. Isto conduziu à compreensão fisiopatológica nova da doença e aos alvos novos da terapia12.
Wild-tipo C57BL/6 camundongos são naturalmente resistentes à aterosclerose. Eles têm a maior parte do colesterol circulante em HDL, e lesões ateroscleróticas complexas não são formadas mesmo quando alimentados com uma dieta de alto teor de gordura e alto colesterol13. Camundongos hipercolesterolêmicos, como APOE-/- no fundo C57Bl/6, são, portanto, utilizados como modelos experimentais de aterosclerose14,15. A falta de ApoE prejudica a captação hepatic de lipoproteínas do remanescente e perturba severamente o metabolismo do lipido. Em APOE-/- camundongos, o colesterol circulante é predominantemente em partículas de VLDL, e os camundongos desenvolvem placas ateroscleróticas complexas em uma dieta de ração regular.
LDLR-/- camundongos imitam o desenvolvimento da aterosclerose observada em humanos com hipercolesterolemia familiar16. O LDLR-/- camundongos precisam de um tipo ocidental dieta para desenvolver aterosclerose17. Dieta ocidental imita a ingestão de alimentos humanos e geralmente contém 0,15% de colesterol. O receptor de LDL reconhece ApoB100 e APOE e Medeia a captação de partículas de LDL através do endocytosis. Os receptores de LDL são fundamentais para a depuração hepática de LDL de circulação, enquanto a expressão do receptor de LDL em células hematopoiéticas não influencia este processo. Isso abre a possibilidade de transplante de medula óssea de LDLR+/+ células em LDLR hipercolesterolêmica -/- receptores e avaliação do desenvolvimento da aterosclerose. As quimeras da medula óssea têm sido comumente usadas para estudar a participação de células hematopoiéticas na aterosclerose experimental. Entretanto, o transplante de medula óssea pode influenciar o tamanho e a composição das placas ateroscleróticas, tornando a interpretação dos resultados ambíguo.
Diferentes variantes de APOE-/- e LDLR-/- camundongos com alterações genéticas adicionais foram desenvolvidas para estudar processos específicos da doença18. Um exemplo é os camundongos APOB100humanos LDLR-/- (hubl) que carregam o gene APOB100 humano de comprimento total19,20. Estes ratos desenvolvem hipercolesterolemia e aterosclerose em uma dieta de ração regular. No entanto, o desenvolvimento de placas ateroscleróticas complexas leva pelo menos seis meses e protocolos experimentais mais curtos costumam usar dieta ocidental21. Uma grande fração do colesterol do plasma está circulando em partículas de LDL, que dá a ratos de hubl um perfil mais humano-como da lipoproteína dislipidêmicos comparado ao APOE-/- e ao LDLR-/- ratos. Os ratos de Hubl igualmente permitem estudos do apob humano como um Autoantigen22.
Os modelos de camundongo da aterosclerose desenvolvem placas ateroscleróticas complexas com características compartilhadas da doença humana. No entanto, as placas são bastante resistentes à ruptura com o infarto do miocárdio que se seguiu. A aterothrombosis é apenas esporadicamente detectada e experimentalmente desafiadora para avaliar23,24,25. Modelos especiais de ruptura da placa foram desenvolvidos, mas o campo experimental carece de um modelo confiável e reprodutível para avaliação de agentes estabilizadores de placas.
A quantificação da aterosclerose tem sido relatada de inúmeras maneiras na literatura. Esforços recentes tentaram padronizar o delineamento experimental, a execução e o relato de estudos em animais26. Os investigadores têm diferentes preferências e técnicas adaptadas aos seus laboratórios. A maioria dos projetos de pesquisa também são únicos de uma forma que exigem algumas modificações de protocolo. Devido à natureza multifatorial da doença, os controles ideais variam entre os projetos. As condições locais e a falta de padronização podem provocar diferenças observadas no desenvolvimento da doença, o que dificulta o avanço do campo de pesquisa. As diferenças na variabilidade experimental também significam que os cálculos estatísticos de poder precisam ser baseados em estudos-piloto condições locais.
A quantificação da aterosclerose é recomendada em vários locais da árvore vascular. Este protocolo descreve como obter resultados da raiz aórtica, do arco aórtico e da artéria braquiocefálico em um único rato, além de deixar o resto da aorta toracoabdominal para outras análises. As preparações da cara do en permitem a quantificação rápida de chapas lipido-carregadas no arco aórtico. A carga da doença na artéria braquiocefálico pode igualmente ser quantificada se os espécimes forem indicados com cuidado. Quanto mais demorado o Cross-seccionamento da raiz aórtica deixa várias seções disponíveis para avaliação detalhada da composição da placa.
Protocolo
Todos os experimentos com animais exigem aprovação por autoridades éticas.
1. sacrifício do rato e microdissecção da aorta
- Sacrificar o mouse por CO2 asfixia e peso recorde.
- Pulverize o rato com o etanol 70% para evitar a contaminação da pele das amostras. Coloque o mouse em uma posição supina. Do entalhe do jugular, faça uma incisão do midline usando a tesoura de Mayo que estende a quase para baixo ao osso púnico.
Atenção: Alta percentagem de etanol é altamente inflamável e pode causar irritação ocular grave. Tome medidas cautelares. - Use uma agulha de 23 G para exsanguinar o rato pela punctura cardíaca através da parede do tórax. Este procedimento geralmente produz 750 μL de sangue de um rato de 20 semanas de idade. Tipicamente, colete a metade do volume em um tubo EDTA-revestido Tri-Potassium e a outra metade em um soro ou em um tubo heparina-revestido do lítio. Gire delicadamente os tubos e mantenha-os na temperatura ambiente até um processamento mais adicional.
- Use tesouras de Mayo para cortar o peritônio parietal na linha média para abrir a cavidade abdominal. Segure o processo xifóide com fórceps do tecido e corte aberto o peritônio lateralmente em ambos os lados e continue a abrir o diafragma.
- Use a tesoura de Mayo para abrir a cavidade torácica cortando através da gaiola da costela como lateralmente como possível. Isto permitirá ângulos largos para os instrumentos quando microdissecting a aorta mais tarde.
- Faça uma incisão no aurícula direito para a drenagem fluida da perfusão. Insira uma agulha de 27 G através do ápice do coração na direção craniana. Mantenha a agulha fixada no ventrículo esquerdo, enquanto perfusing lentamente o rato com 10 mL de soro fisiológico com tampão de fosfato gelado (PBS) durante o mínimo de 2 min. Observe o fígado mudando de cor e ficando mais pálida.
Nota: Alguns protocolos utilizam a perfusão de paraformaldeído, mas isso interfere com várias aplicações a jusante, como a análise imuno-histoquímica de linfócitos. Conseqüentemente, nenhuma fixação da perfusão com paraformaldeído é executada neste protocolo. - Órgãos de dissecar de interesse (por exemplo, linfonodos, baço, fígado, intestino, almofadas de gordura inguinal, rins, etc.) usando fórceps anatômicos e tesouras de dissecação.
- Corte a traquéia e o esôfago no lado direito do coração sem danificar o arco aórtico. Corte o diafragma e as estruturas que fixam as vísceras ao retroperitoneum, deixando o coração, a aorta, e os rins in situ. Dobre afastado os pulmões e as vísceras caudalmente e cubra-os com um guardanapo para começar a microdissecção retroperitoneal de nós de linfa para-aórticos e da aorta abdominal.
- Inicie a microdissecção um estereomicroscópio a uma ampliação de 6x. Comece a dissecar a bifurcação aórtica levantando o tecido circunvizinho com o fórceps de Dumont e cortando a tensão com tesouras de Vannas.
- Continue a dissecção da aorta abdominal cranialmente. Corte os ramos abdominais da aorta e livre a aorta proximalmente através do hiato aórtico no diafragma.
Nota: A microdissecção requer uma coordenação precisa do olho-mão através do estereomicroscópio, que leva alguma prática para dominar.
- Continue a dissecção da aorta abdominal cranialmente. Corte os ramos abdominais da aorta e livre a aorta proximalmente através do hiato aórtico no diafragma.
- Retire o tecido adiposo que cobre a aorta torácica. Dissece com cuidado o dorsalmente do timo para liberar o arco aórtico com filiais. Continue dissecando as artérias carótidas tão distalmente quanto possível na cavidade torácica. Em casos especiais, a dissecção cervical pode ser realizada para incluir a bifurcação carotídea.
- Limpe os instrumentos por enxaguados consecutivos em água desionizada, solução de descontaminação de RNase, etanol a 70% e PBS antes de realmente cortar a aorta. Levante o coração pelo ápice com o fórceps. Corte a aorta perto do coração e coloque o coração inteiro em um tubo com PBS. O coração pode ser armazenado no gelo por um par de horas antes do processamento continuado e cryomounting a raiz aórtica.
- Corte o arco aórtico de acordo com a Figura 1a. Coloque o arco aórtico em um tubo contendo 1 mL de formaldeído 4% durante a noite a 4 ° c. O espécime poderia ser armazenado desta maneira por diversos anos antes de fixar e de análise.
Atenção: Formaldeído pode causar câncer, reações alérgicas na pele, e é prejudicial se ingerido. Use o equipamento de proteção pessoal conforme necessário. - Dissecar a aorta descendente remanescente e colocá-lo em uma solução de estabilização de RNA ou congelamento de pressão para posterior análise de RNA ou outra aplicação. Otimizar o fluxo de trabalho para minimizar o tempo de dissecção é crucial para evitar a degradação excessiva do RNA.
- Coloque os tubos de coleta de sangue (coletados na etapa 1,3) em uma centrífuga. Gire para baixo os tubos separados do plasma e do soro em 1.500 x g por 15 minutos na temperatura ambiente. Transfira com cuidado o plasma e o soro aos tubos do microcentrifugador e armazene-o em-80 ° c. A coleta de EDTA e plasma heparinizado ou soro deixa possibilidades para múltiplas aplicações a jusante.
- Coloque o coração em uma cama de cortiça com o lado ventral virado para cima. Fixar o coração para a cortiça com uma agulha através do ápice. Segure a base do coração com fórceps anatômicos.
- Use um bisturi para cortar o 2/3 apical do coração com a direção do corte sendo como uma linha entre as duas aurículas com o bisturi angular 20 ° caudalmente no plano sagital e 20 ° cranialmente no plano transversal (Figura 1b).
- Incorpore a raiz aórtica no composto de temperatura de corte ideal (OCT), que envolve, mas não se infiltram no tecido. Mergulhe a base do coração em composto de OCT. Aperte suavemente o coração com a pinça para encher a raiz aórtica com OCT e remover quaisquer bolhas de ar.
- Transfira a amostra para a parte inferior de um crimoleiro preenchido com OCT. A raiz aórtica deve agora ser perpendicular à superfície inferior. Coloque o coração montado em gelo seco para congelar. Guarde os espécimes em sacos de fecho de correr em-80 ° c até prosseguir a criseccionamento de acordo com a secção 3 deste protocolo.

Figura 1: coração e arco aórtico in situ. (A) pulmões, traquéia, esôfago e Timo são removidos para exibir o arco aórtico in situ em um APOE-/- mouse feminino de 20 semanas de idade na dieta de ração regular em uma micrografia, barra de escala = 2 mm. As linhas pontilhadas indicam onde cortar o arco aórtico e seus galhos. (B) uma representação esquemática do coração e da aorta. A linha pontilhada em vermelho indica onde cortar o coração antes de cryomounting a raiz aórtica. Por favor clique aqui para ver uma versão maior desta figura.
2. análise de face en do arco aórtico e artéria braquiocefálico
- Prepare camas fixando para a análise do en-face de arcos aórticos. Dobre um segmento de película de cera de parafina oito vezes para fazer uma superfície plana de 25 mm x 25 mm. Enrole-o com fita isolante elétrica preta para fazer um fundo escuro para a aorta. Coloque uma etiqueta na parte traseira da cama fixando e use um lápis de chumbo para escrever o número de identificação do mouse (a tinta normal da caneta desaparecerá no processo de coloração).
- Transfira o arco aórtico para o leito fixando e coloque uma gota de PBS em cima dela. Comece limpando a aorta do tecido adiposo periadventícia restante um stereomicroscope.
- Use as tesouras de Vannas e o fórceps de Dumont para descascar delicadamente afastado todo o tecido adiposo circunvizinho sem manipular ou danificar a aorta. O Sudão IV manchará o tecido adiposo brilhantemente e é crucial remover todo o tal tecido neste momento.
Nota: Mantenha a aorta úmida em todos os momentos aplicando PBS adicional quando necessário.
- Use as tesouras de Vannas e o fórceps de Dumont para descascar delicadamente afastado todo o tecido adiposo circunvizinho sem manipular ou danificar a aorta. O Sudão IV manchará o tecido adiposo brilhantemente e é crucial remover todo o tal tecido neste momento.
- Abra a aorta no plano coronal introduzindo a tesoura de Vannas no lúmen aórtico para expor a superfície intimal. Comece a cortar a curvatura externa do arco ascendente na direção distal e continue a abrir os galhos, incluindo a artéria braquiocefálico. Poupe a parte dorsal da região torácica descendente.
- Corte abrir a curvatura menor e dobre abrir a aorta para exibir a superfície intimal.
Nota: Esta etapa exige habilidades motoras finas e precisa de alguma prática para dominar.
- Corte abrir a curvatura menor e dobre abrir a aorta para exibir a superfície intimal.
- Fixe o arco aberto à cama fixando usando a extremidade sem corte de pinos minutien do inseto. Use um micro suporte da agulha de Castroviejo para põr os pinos no lugar. Dobre delicadamente os pinos longe da amostra quando no lugar. Fixar a aorta plana na cama sem esticar o espécime. Armazene o arco fixado voltado para baixo em uma placa de Petri preenchida com PBS a 4 ° c.
Nota: O protocolo pode ser pausado aqui. - Prepare uma solução de trabalho do Sudão IV. Misture 1 g de pó de Sudão IV, 100 mL de etanol a 70% e 100 mL de acetona num frasco escuro e mexa suavemente durante 10 min. Não há nenhuma necessidade de filtrar a solução e pode ser usado por um par meses se mantido escuro na temperatura ambiente. Se a cor de coloração não for satisfatória, uma nova solução pode ser feita e os espécimes manchados novamente.
Atenção: A acetona é um líquido inflamável que pode causar irritação ocular grave. Conservar em local bem ventilado e tomar medidas cautelares ao manusear. - Arranje cinco pratos de Petri no banco do laboratório: um enchido com o etanol de 70%, um enchido com o Sudão IV que trabalha a solução, dois encheu-se com o etanol de 80%, e um encheu-se com PBS.
- Comece por enxaguar o espécime em etanol a 70% durante 5 min colocando a cama fixante no primeiro prato de Petri com o arco virado para baixo. Transfira a amostra para a solução de trabalho do Sudão IV e deixe-a manchar o arco por 7 min.
- Em seguida, enxágüe em etanol 80% por 3 min duas vezes para senhor a superfície intimal normal. O tempo de destaining pode ser ajustado para otimizar os resultados. Por último, enxaguar em PBS antes de colocar o espécime de volta na placa de Petri original.
- Adquira micrografias usando um estereomicroscópio a uma ampliação de 10 vezes conectada a uma câmera digital. Tire fotos do arco fixado submerso em PBS usando pequenos pesos metálicos (20 mm x 10 mm x 5 mm) para segurar a cama fixando para o fundo de uma placa de Petri. Coloque uma régua ao lado da aorta para a calibração da imagem.
- Use um software de análise de imagem (por exemplo, ImageJ) para determinar a área da lesão e a superfície intimal total. Na falta de marcos anatômicos para definir o arco aórtico, a medida é geralmente realizada desde o início da aorta ascendente até o primeiro ramo intercostal (Figura 2a). Use o recurso de quantificação de área no software para cercar manualmente a área total do arco intimal.
Nota: a quantificação da lesão deve ser feita de forma cega e é aconselhável que um segundo investigador confirme os resultados.- No ImageJ, selecione a ferramenta de seleção de polígono e cerque a área do arco total por cliques repetitivos. Em seguida, selecione a medida no menu analisar para exibir a área do arco total na janela de resultado.
- Em seguida, cerque todas as chapas manchadas de Sudão IV no arco. O Sudão IV é um corante Diazo lisocromo que mancha lipídios, triglicérides e lipoproteínas com uma cor laranja-avermelhada. No ImageJ, selecione a ferramenta de seleção à mão livre e cerque todas as placas enquanto pressiona a tecla Alt. Clique em medir no menu analisar para exibir a área de arco livre de lesões na janela de resultados.
- Calcule a área relativa da lesão subtraindo a área livre de lesão da área total do arco e, em seguida, dividindo o resultado com a área total do arco.
- Fixar cuidadosamente as artérias subclávia e carotídea para possibilitar a quantificação da lesão na artéria braquiocefálico (Figura 2A). A quantificação das lesões nas artérias subclávias e nas artérias carotídeas comuns é geralmente muito desafiadora e não significativa, respectivamente.
- Em ImageJ, cerque ambas as partes da artéria braciocephalic usando a ferramenta da seleção do polígono ao pressionar a tecla Shift. Clique em medir no menu analisar para exibir a área da artéria braquiocefálico total na janela de resultados.
- Em seguida, selecione a ferramenta de seleção à mão livre e cerque todas as placas na artéria Braquiocefálica enquanto pressiona a tecla Alt. Clique na medida no menu de análise para exibir a área da artéria braquiocefálico sem lesão na janela de resultados.
- Calcule a área relativa da lesão subtraindo a área livre de lesão da área da artéria braquiocefálico total e, em seguida, dividindo o resultado com a área total da artéria braquiocefálico.

Figura 2: quantificação da lesão aterosclerótica. (A) arco aórtico de um homem de 20 semanas de idade APOB100-transgénico LDLR-/- (hubl) rato alimentado dieta ocidental por dez semanas fixadas abertas e manchadas para placas ricas em lipídios com o Sudão IV. A área de superfície do arco aórtico total é esboçada com a linha pontilhada no branco no micrograph, barra da escala = 2 milímetros. As linhas pontilhadas no contorno amarelo a área de superfície total da artéria braquiocefálico. (B) seção transversal da raiz aórtica a 400 μm do seio aórtico em um LDLR masculino de 20 semanas de idade -/- rato alimentado dieta ocidental durante oito semanas visualizado em uma micrografia, escala bar = 500 μm. As linhas pontilhadas em preto descrevem a área total do vaso e as lesões ateroscleróticas coradas com óleo vermelho O localizado na íntima arterial. Por favor clique aqui para ver uma versão maior desta figura.
3. criseccionamento da raiz aórtica
- Ajuste a temperatura do criostat a-20 ° c e a espessura da seção a 10 μm. Monte o bloco OCT contendo a raiz aórtica no suporte do espécime com o tecido ventricular voltado para fora. Ao começar a cortar, ajuste bem o alinhamento da superfície da seção para ser paralela ao suporte do espécime.
- Remova a OCT circundante excessiva para facilitar a coleta de seções sem dobras. A raiz aórtica deve agora ser posicionada perpendicular à lâmina de faca, uma vez que a base do coração foi colocada corretamente no molde.
- Colete as seções de controle iniciais em lâminas de microscópio comuns, que serão descartadas. As primeiras secções só devem conter tecido muscular cardíaco. Avance o corte por 200 μm no momento. Colete uma seção e verifique o progresso com um microscópio de luz.
- Ao aproximar-se do trato de saída do ventrículo esquerdo, verifique cada 100 μm o microscópio. Quando as indicações iniciais de uma parede do vaso são observadas, diminua o ritmo para 50 μm.
Nota: Quando a primeira cúspide aórtica aparece, este será ponto zero para coletar seções. Pode ser difícil ver quando as cuspes aparecem exatamente, mas uma localização exata é crucial para realizar comparações de lesões na mesma região. -
Incline a amostra para o ponto zero cúspide para alinhar o plano de corte com as duas outras cuspes. Isto é crucial para a obtenção de secções transversais verdadeiras da aorta. Faça um desenho da raiz aórtica, indicando as cuspas como elas aparecem, e conte cada seção de 10 μm que são cortadas a partir do ponto zero em diante.
- Quando uma segunda cúspide aparecer, incline ligeiramente a amostra novamente para longe da cúspide para alinhar a amostra com a terceira cúspide. A diferença de nível entre as cuspes não deve exceder 50 μm. comece a coletar seções em slides do nível 90 μm e avante.
- Colete seções de acordo com o planejamento de slides na Figura 3. A coleta de seções pode ser iniciada a partir de 190 μm se a raiz aórtica for superior a 50 μm inclinada, para permitir que mais espaço alinhe a raiz em uma posição reta. Continuar a seccionamento até atingir o nível 800 μm a partir do ponto zero. Se ainda houver placas visíveis neste nível, a coleção pode ser expandida para 1.000 μm.
Nota: Uma organização simplificada de slides é apresentada na Figura 1 suplementar, o que pode aumentar A velocidade de corte. O planejamento de slides ideal deve ser decidido dependendo do plano do projeto.
-
Corrija as seções após a coleta.
- Fixar as secções recolhidas para coloração de óleo vermelho O e coloração vermelha de Picrosirius de colagénio em formaldeído a 4% durante 10 min. Enxague em água desionizada, seque e armazene em temperatura ambiente até prosseguir com a secção 4 neste protocolo. Se os slides devem ser manchados com óleo vermelho O imediatamente e ainda estão molhados, colocá-los em 60% isopropanol por 1 min para acelerar o processo de secagem.
Atenção: Isopropanol é um líquido inflamável que pode causar irritação ocular grave e pode causar sonolência ou tonturas. Conservar em local bem ventilado e tomar medidas cautelares ao manusear. - Fixar as secções coletadas para imunohistoquímica ou imunofluorescência em acetona pura gelada por 10 min. secar em temperatura ambiente por 30 min. secções da loja em-20 ° c.
- Fixar as secções recolhidas para coloração de óleo vermelho O e coloração vermelha de Picrosirius de colagénio em formaldeído a 4% durante 10 min. Enxague em água desionizada, seque e armazene em temperatura ambiente até prosseguir com a secção 4 neste protocolo. Se os slides devem ser manchados com óleo vermelho O imediatamente e ainda estão molhados, colocá-los em 60% isopropanol por 1 min para acelerar o processo de secagem.
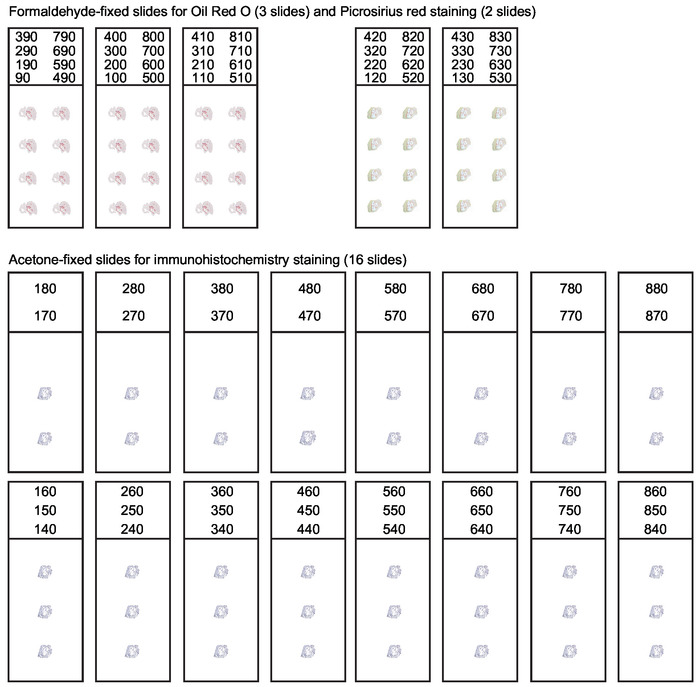
Figura 3: organização de slides para seções seriais da raiz aórtica. Durante o criossecção da raiz aórtica cada seção grossa de 10 μm que mede o primeiro 800 μm da aorta de ascensão deve ser coletada. Uma organização de slide sistemática é necessária para obter seções adequadas para várias aplicações. A análise da composição da lesão geralmente inclui coloração de óleo vermelho O para lipídios e coloração vermelha de Picrosirius para colágeno. As seções restantes são coletadas e acetona-fixado para a mancha immunohistochemistry e da imunofluorescência. Este número foi modificado de Gisterå et al30. Por favor clique aqui para ver uma versão maior desta figura.
4. óleo vermelho O coloração e quantificação da aterosclerose em raízes aórticas
- Prepare uma solução saturada de óleo vermelho O dissolvendo 1 g de óleo vermelho O em 100 mL de isopropanol. Mexa a solução em uma garrafa escura por 1 hora à temperatura ambiente. A solução saturada pode ser mantida por vários meses.
Nota: É aconselhável ter designado o equipamento de laboratório para O óleo vermelho O que mancha desde que é difícil limpar o equipamento que estêve em contacto com a solução. - Prepare uma solução de trabalho misturando 75 mL da solução saturada Oil Red O com 50 mL de água desionizada. Deixe ficar em temperatura ambiente por 10 min. filtrar através de um papel de filtro qualitativo.
- Coloque os slides em óleo vermelho O solução de trabalho para 20 min. enxágüe em água da torneira por 5 min.
- Para auxiliar a visualização tecidual, manchar com hematoxilina de Mayer por 1 min. enxágüe em água morna da torneira por 5 min. Todos os núcleos devem agora ser manchados na cor azul, ajustar o tempo de coloração para otimizar o resultado.
- Monte slides em um meio de montagem aquosa (por exemplo, gelatina de glicerol de Kaiser). Aqueça a gelatina de glicerol de Kaiser a 40 ° c para torná-lo fluido antes de usar. Não é necessário secar as lâminas, uma vez que o meio de montagem é à base de água. Tenha cuidado para evitar a formação de bolhas de ar ao adicionar o vidro da tampa.
Atenção: A gelatina de glicerol de Kaiser contém fenol, que é suspeita de causar defeitos genéticos. Use o equipamento de proteção pessoal conforme necessário. - Adquira micrografias digitais usando uma câmera conectada a um microscópio de luz. Geralmente os limites cheios da parede e da lesão da embarcação podiam claramente ser visualizados pela ampliação de 50 vezes. Salvar imagens de alta resolução, de preferência em formato de arquivo de imagem Tagged (TIFF).
- Realize a análise do tamanho da lesão usando um sistema de software de análise de imagem assistido por computador. O óleo vermelho O é um corante Diazo lisocromo que mancha lipídios neutros e visualiza placas ateroscleróticas com uma cor vermelha intensa, que auxilia na quantificação da lesão.
Nota: a quantificação da lesão deve ser feita de forma cega e é aconselhável que um segundo investigador confirme os resultados obtidos.- Use o recurso de quantificação de área no software de análise de imagem para definir a área total do vaso circundando a lâmina elástica externa da parede do vaso aórtico (Figura 2b). No ImageJ, selecione a ferramenta de seleção de polígono e cerque a área por cliques repetitivos. Em seguida, selecione a medida no menu analisar. A área total do vaso é exibida na janela de resultados.
- Continuar a quantificar as lesões ateroscleróticas na camada intimal do vaso, definida pela lâmina elástica interna e o limite luminal. Geralmente, as lesões nas cuspas valvares são excluídas da medida27. No ImageJ, selecione a ferramenta de seleção à mão livre e cerque todas as placas enquanto pressiona a tecla Alt. Selecione a medida no menu de análise para exibir a área da embarcação livre de lesões na janela de resultados.
- Calcule a área relativa da lesão subtraindo a área livre de lesão da área total do vaso e, em seguida, dividindo o resultado com a área total do vaso.
Nota: Calibre os resultados no software de análise da imagem de acordo com a ampliação usada para obter a área absoluta da lesão no micrômetro quadrado.
- Definir a área manchada de óleo vermelha nas lesões usando um recurso de limiar de cor no software de análise de imagem para calcular a porcentagem de óleo vermelho O área positiva da área total da lesão.
- No ImageJ, circunda toda a área da lesão usando a ferramenta de seleção à mão livre enquanto pressiona a tecla Shift. Selecione a medida no menu analyze para exibir a área total da lesão na janela de resultados.
- Selecione limpar fora no menu de edição. Altere o tipo de imagem para 8 bits no menu de imagem.
- Defina um limite vermelho para a área negativa de óleo vermelho O selecionando o limite no submenu de ajuste do menu de imagem. Clique em aplicar. Faça a imagem binária selecionando esta opção no submenu binário do menu do processo.
Nota: Geralmente O óleo vermelho O que mancha varia entre lotes. Daqui, a limiarização da cor é recomendada somente dentro do mesmo lote de coloração. O resultado deve ser apresentado juntamente com uma descrição de como o limiar foi determinado e padronizado. - Analise a imagem selecionando analisar partículas no menu analisar e clique em OK. Total de óleo vermelho O negativo área da lesão agora é exibido na janela de resumo. Calcule a área positiva do óleo vermelho o relativo subtraindo a área negativa do óleo vermelho o da área total da lesão e então dividindo com a área total da lesão.
Resultados
Em modelos de camundongo da aterosclerose as lesões mais proeminentes tendem a se desenvolver na raiz aórtica e no arco aórtico. Este protocolo descreve a quantificação da aterosclerose na raiz aórtica, no arco aórtico e na artéria braquiocefálico em um único camundongo. Lesões mensuráveis na aorta torácica descendente e na aorta abdominal estão presentes apenas em animais com doença prévia. Neste protocolo, essas partes não são analisadas quanto à carga aterosclerótica, mas salvas para posterior análise dos níveis de mRNA ou outras análises. Seções seriais de lesões ateroscleróticas na raiz aórtica são geralmente exibidas em um gráfico com tamanho de lesão no eixo ye distância até o seio aórtico no eixo x28. As secções transversais verdadeiras são cruciais para a quantificação do tamanho da lesão. Cortes oblíquos podem superestimar os tamanhos das lesões e uma inclinação de apenas 20 ° poderia superestimar a superfície da lesão absoluta em 15%29. Entretanto, o cálculo da fração da lesão da área total do vaso torna o resultado menos sensível às possíveis diferenças angulares durante o corte (figura 4a). Um método estatístico adequado para detectar diferenças entre os grupos é geralmente uma análise de variância (ANOVA) regular de 2 vias. Os pós-testes de Bonferroni são então realizados para detectar diferenças em certos níveis. A diferença menos significativa de Fisher também pode ser usada como um teste de acompanhamento para ANOVA. Reduz a probabilidade de erros estatísticos do tipo II, mas não conta para comparações múltiplas. Além disso, pode ser ilustrativo calcular a área a curva ou o tamanho médio da lesão por mouse e apresentar os dados em um gráfico de pontos para visualizar ainda mais a variação individual dentro dos grupos (Figura 4B).
O óleo vermelho O é um corante vermelho brilhante solúvel em gordura Diazo, que mancha lipídios neutros. Os lipídios polares nas membranas celulares não são manchados. A coloração de óleo vermelho O pode ser realizada em amostras frescas, congeladas ou formalina-fixas, mas não em amostras encaixadas em parafina devido à remoção de lipídios no processo de desparaffinização necessário. A quantificação da acumulação lipídica do lesional pode ser realizada por meio de deturpando a área positiva do óleo vermelho O da área total da lesão (Figura 4C). A hematoxilina produz uma coloração azul de núcleos celulares, o que é útil para visualizar a morfologia da placa. As artérias coronárias direita e esquerda geralmente divergem da aorta em torno de 250 μm do seio aórtico27, que muitas vezes coincidem com os tamanhos de lesão mais proeminentes. As secções transversais desta região são frequentemente apresentadas como resultados representativos (Figura 4D).

Figura 4: lesões ateroscleróticas na raiz aórtica. (A) vinte e oito semanas de idade, quimeras de medula óssea masculina alimentados com dieta ocidental durante oito semanas foram avaliados para determinar o efeito de células T deficientes Smad7no desenvolvimento da aterosclerose. A LDLR-/- quimeras experimental recebeu a medula óssea CD4-CRE+Smad7fl/FL e os controles receberam CD4-CRE+Smad7fl/+ medula óssea. O gráfico mostra a quantificação da área da lesão aterosclerótica de oito seções consecutivas, 100-800 μm do seio aórtico exibido como fração de lesão da superfície total do vaso (CD4-CRE+Smad7fl/+/LDLR-/- n = 6, CD4-CRE+Smad7fl/FL/LDLR-/- n = 9, 2-Way Anova com Bonferroni ' s Post Test, gráfico mostra média ± sem, chaves indicam nível de significância para comparação de deformação). (B) a parcela de pontos combinada e o gráfico de barras mostram a área de lesão aterosclerótica média das seções da raiz aórtica (CD4-CRE+Smad7fl/+/LDLR-/- n = 6, CD4-CRE+Smad7fl/FL/ LDLR-/- n = 9, teste tde Student) (C) fração da área manchada de óleo vermelha nas lesões (CD4-CRE+Smad7fl/+/LDLR-/- n = 4, CD4-CRE+Smad7fl/FL /LDLR-/- n = 6, teste tde Student, NS = não-significante) (B-C) pontos representam ratos e barras individuais mostram médias ± sem. (D) micrografias representativas que mostram a coloração do óleo vermelho O (em vermelho cor) de lipídios neutros na raiz aórtica 300 μm do seio aórtico (ampliação de 50x), barra de escala = 500 μm. *p ≤ 0, 5, * * *p ≤ 0, 1. Este número foi modificado de Gisterå et al.31. Por favor clique aqui para ver uma versão maior desta figura.
O óleo vermelho O poderia ser usado para a mancha de aortas preparados en-face, mas este protocolo usa O Sudão IV, outro corante Diazo solúvel em gordura conveniente. O Sudão IV visualiza claramente placas ateroscleróticas em cor laranja-avermelhada por coloração de lipídios, triglicérides e lipoproteínas. A remoção do fundo escuro em imagens representativas dos arcos aórticos en face pode aumentar a exibição Visual (Figura 5a). Normalmente, o tamanho da lesão é normalmente distribuído dentro de grupos, permitindo testes estatísticos com o teste tde Student entre os grupos. Um gráfico de pontos que mostra ambos os camundongos individuais e a média, que é comparado entre os grupos, é uma maneira informativa de exibir os resultados (Figura 5b-C). Desde que a variação dentro dos grupos é tipicamente diferente entre posições na árvore vascular, os cálculos de poder separados são geralmente necessários. A variação desnecessária pode ser evitada pela proficiência do método e pela padronização do protocolo. A obtenção de resultados estatisticamente significantes é importante, mas a relevância biológica para uma diferença observada sempre precisa ser considerada também.
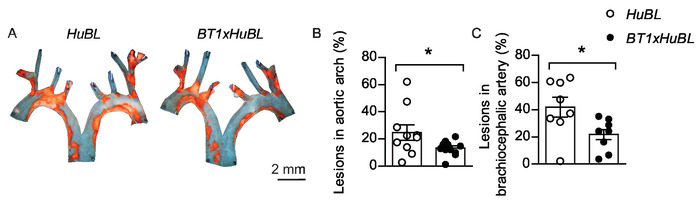
Figura 5: lesões ateroscleróticas no arco aórtico e na artéria braquiocefálico. A) micrografias representativas de arcos aórticos com placas carregadas de lipídeos coradas com Sudão IV (em cor laranja) de ratos de 20 semanas alimentados com dieta ocidental durante dez semanas, visualizados em conjunto. Barra de escala = 2 mm. os camundongos APOB100-transgênicos -/- (hubl) humanos foram utilizados como controles e o grupo experimental consistiu de camundongos TCR-transgênicos com células T LDL-reativas (BT1) mestiços para camundongos hubl . (B) lesões ateroscleróticas no arco aórtico (hubl n = 10, BT1xHuBL n = 12; Teste tde Student). (C) lesões ateroscleróticas na artéria braquiocefálico (hubl n = 8, BT1xHuBL n = 9, teste tde Student). (B-C) Os pontos representam camundongos individuais, as barras mostram média ± SEM. *p ≤ 0, 5. Este número foi modificado de Gisterå et al.32. Por favor clique aqui para ver uma versão maior desta figura.
Complementar Figura 1: organização alternativa de slides para seções seriais da raiz aórtica. Uma organização simplificada da corrediça sistemática para a coleção das seções da raiz aórtica. A coleção permite a coloração de óleo vermelho O para lipídios e imunohistoquímica ou coloração por imunofluorescência. Slides dedicados para Picrosirius coloração vermelha de colágeno são omitidos. Por favor, clique aqui para baixar este arquivo.
Discussão
A doença cardiovascular é o principal assassino do mundo e novas medidas preventivas são necessárias2. Os modelos de camundongo da doença fornecem uma plataforma abrangente para investigação de fisiopatologia e tratamentos experimentais13. A quantificação confiável do tamanho da lesão é essencial para essa abordagem. No entanto, os métodos de quantificação diferem entre laboratórios. Padronização e otimização têm sido um processo contínuo desde a década de 198013,27,33,34. As raízes aórticas surgiram como o local mais popular para quantificar a aterosclerose experimental. Secções transversais de placas permitem a comparação do volume da chapa entre os grupos. As preparações de face são favorecidas para a quantificação da lesão em segmentos maiores da aorta. O método do en-face visualiza a quantidade da chapa e permite a quantificação da cobertura da área da chapa, mas não toma a espessura da chapa na consideração. A relevância biológica para as diferenças observadas é fundamentada por resultados coerentes em diferentes locais da árvore vascular. Avaliar o desenvolvimento da aterosclerose em diferentes locais aborda possíveis efeitos específicos do local. O efeito das células hematopoiéticas transplantadas no desenvolvimento da aterosclerose pode ser avaliado em LDLR-/- quimeras hipercolesterolêmica. No entanto, a irradiação de todo o corpo afeta o processo de aterosclerose com efeitos específicos do local. Lesões ateroscleróticas mais proeminentes são desenvolvidas na raiz aórtica, enquanto o desenvolvimento reduzido da lesão é observado nos arcos aórticos35.
É importante ressaltar que não apenas o tamanho da lesão precisa ser abordado em estudos de aterosclerose experimental. A composição da lesão também é um parâmetro chave. Diversas características da chapa foram associadas com as manifestações da doença nos seres humanos36. O seccionamento serial da raiz aórtica deixa várias seções disponíveis para análise cuidadosa da composição da placa. A ruptura da placa em seres humanos caracteriza-se por um tampão fibroso fino com poucas células musculares lisas, conteúdo de colágeno esparso e sinais de inflamação nas placas36. Embora a ruptura da placa seja um evento raro em modelos do rato da aterosclerose, os marcadores para a estabilidade da chapa são informativos a avaliar. As aproximações translational podiam confirmar resultados mecanicista dos modelos do rato e descobrir características importantes da doença humana31. O estado inflamatório das placas ateroscleróticas pode ser determinado pela coloração imuno-histoquímica de VCAM-1, classe II de MHC, macrófagos e linfócitos30. Alguns protocolos utilizam cortes longitudinais no plano coronal do arco aórtico ou da artéria braquiocefálico para mensuração do tamanho e composição da lesão aterosclerótica37. No entanto, esse método alternativo deixa apenas algumas seções a serem analisadas, o que limita suas aplicações.
Um passo crítico inicial neste protocolo é a capacidade de colher aortas de forma eficiente. A coordenação mão-olho o microscópio exige a prática e é crucial para a microdissecção e a fixação subseqüente do arco aórtico. A próxima etapa crítica neste protocolo é a coleta de seções seriais da raiz aórtica. 80 seções consecutivas devem ser coletadas para cada mouse, o que requer foco e paciência. A proficiência metodológica poderia acelerar consideravelmente os processos descritos. No entanto, a quantificação da lesão aterosclerótica ainda é uma tarefa demorada. Novas tecnologias, manuseio automatizado e imagens de pequenos animais podem facilitar a quantificação da aterosclerose experimental no futuro. A progressão da aterosclerose é lenta e a maioria dos protocolos experimentais em modelos de mouse levam mais de quatro meses para completar13. Portanto, aortas precisam ser coletadas de forma otimizada nos pontos de extremidade do estudo. Este protocolo fornece um guia detalhado para colher aortas eficientemente e o processamento proposto prepara aortas para o uso de múltiplos propósitos que inclui a quantificação da lesão na raiz aórtica, no arco aórtico, e na artéria braquiocefálico. Esperemos que o protocolo pode reduzir a variabilidade experimental, aumentar a confiabilidade dos resultados, e levar a descobertas que irá pavimentar o caminho para novos tratamentos contra a aterosclerose.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a todos os membros do passado da unidade experimental de pesquisa cardiovascular de Göran K Hansson que ajudou a desenvolver este protocolo ao longo do último trimestre do século. Estamos particularmente gratos pelas contribuições de Antonino Nicoletti, Xinghua Zhou, Anna-Karin Robertson e Inger Bodin. Este trabalho foi apoiado pela concessão 06816 do projeto e pelo apoio 349-2007-8703 de Linnaeus do Conselho de pesquisa Sueco, e por concessões da Fundação sueco do coração-pulmão, do Conselho do Condado de Éstocolmo, da Fundação do professor Nanna Svartz, do Loo e do Hans Osterman Fundação para a pesquisa médica, Fundação da pesquisa de Karolinska Institutet e Fundação para doenças geriatric em Karolinska Institutet.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | 20066.296 | For fixation of sections for immunohistochemistry. |
| Black electrical insulation tape (50 mm wide) | Any specialized retailer | - | To create pinning beds for aortic arches. |
| Centrifuge | Eppendorf | 5417C | Benchtop microcentrifuge. |
| Cork board | Any specialized retailer | - | For cutting hearts in the preparation to cryomount aortic roots. |
| Cryostat | Thermo Scientific | Microm HM 560 | For serial cryosectioning of aortic roots. |
| Deionized water | - | - | For rinsing and preparation of solutions. |
| Digital camera | Leica Microsystems | DC480 | 5.1 megapixel CCD for high-resolution images of aortic arches and aortic root sections. |
| Dissecting scissors (10 cm, straight) | World Precision Instruments | 14393 | For general dissection of organs. |
| Dumont forceps #5 (11 cm, straight) | World Precision Instruments | 500341 | For microdissection of aorta. |
| Ethanol 70% (v/v) | VWR Chemicals | 83801.290 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Ethanol absolute ≥99.8% | VWR Chemicals | 20821.310 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Formaldehyde 4% stabilised, buffered (pH 7.0) | VWR Chemicals | 9713.1000 | Harmful by inhalation, in contact with skin and if swallowed. |
| ImageJ | NIH | - | Image analysis software. |
| Iris forceps (10 cm, curved, serrated) | World Precision Instruments | 15915-G | Used as anatomical forceps. |
| Isopropanol | Merck | 1096341011 | Flammable liquid, causes serious eye irritation, and may cause drowsiness or dizziness. |
| Kaiser's glycerol gelatine | Merck | 1092420100 | Aqueous mounting medium containing phenol. Suspected of causing genetic defects. |
| Light microscope | Leica Microsystems | DM LB2 | For analysis during sectioning and documentation of Oil Red O stained micrographs. |
| Mayer's hematoxylin | Histolab | 1820 | Non-toxic staining solution without chloral hydrate, but causes serious eye irritation. |
| Mayo scissors (17 cm, straight) | World Precision Instruments | 501751-G | For general dissection. |
| Micro Castroviejo needle holder (9 cm, straight) | World Precision Instruments | 503376 | For pinning of aortic arches. |
| Microcentrifuge tubes | Corning | MCT-175-C | Polypropylene microtubes with snaplock cap. |
| Microlance 3 needles, 23 gauge | BD | 300800 | For blood collection. |
| Microlance 3 needles, 27 gauge | BD | 302200 | For perfusion of mice. |
| Microvette 500 µL, K3 EDTA | Sarstedt | 20.1341.100 | For blood collection. |
| Microvette 500 µL, Lithium Heparin | Sarstedt | 20.1345.100 | For blood collection. |
| Minutien insect pins, 0.10 mm | Fine Science Tools | 26002-10 | For pinning of aortic arches. |
| Oil Red O | Sigma-Aldrich | O0625 | Not classified as a hazardous substance or mixture. |
| Optimum cutting temperature (OCT) cryomount | Histolab | 45830 | For embedding tissue. |
| Parafilm M | Bemis | PM992 | Paraffin wax film used to create pinning beds for aortic arches. |
| Petri dishes (100 mm x 20 mm) | Any cell culture supplier | - | Proposed as a storage container for pinned aortas. |
| Phosphate buffered saline (PBS) | - | - | Sterile and RNase-free solution is required for perfusion of mice. |
| Qualitative filter paper (grade 1001) | Munktell | 120006 | For filtering Oil Red O working solution (typical retention 2-3 µm). |
| RNAlater RNA stabilization reagent | Qiagen | 76106 | For stabilization of RNA in tissue samples |
| RNaseZap RNase Decontamination Solution | Invitrogen | AM9780 | A surface decontamination solution that destroys RNases on contact. |
| Scalpel handle #3 (13 cm) | World Precision Instruments | 500236 | For cutting hearts in the preparation to cryomount aortic roots. |
| Standard scalpel blade #10 | World Precision Instruments | 500239 | For cutting hearts in the preparation to cryomount aortic roots. |
| Stereomicroscope | Leica Microsystems | MZ6 | For dissection and en face documentation |
| Sudan IV | Sigma-Aldrich | S4261 | Not classified as a hazardous substance or mixture. |
| Superfrost Plus microscope slides | Thermo Scientific | J1800AMNZ | To collect aortic root sections. |
| Tissue forceps (15 cm) | World Precision Instruments | 501741-G | For general dissection. |
| Tissue-Tek cryomolds (10 mm x 10 mm x 5 mm) | Sakura | 4565 | For embedding aortic roots in OCT. |
| Vannas scissors (8 cm, straight) | World Precision Instruments | 503378 | For microdissection of aorta. |
Referências
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859), 2095-2128 (2012).
- Gistera, A., Hansson, G. K. The immunology of atherosclerosis. Nature Reviews Nephrology. 13 (6), 368-380 (2017).
- Hansson, G. K. Inflammation, atherosclerosis, and coronary artery disease. New England Journal of Medicine. 352 (16), 1685-1695 (2005).
- Williams, K. J., Tabas, I. The response-to-retention hypothesis of early atherogenesis. Arteriosclerosis, Thrombosis, and Vascular Biology. 15 (5), 551-561 (1995).
- Pentikainen, M. O., Oorni, K., Ala-Korpela, M., Kovanen, P. T. Modified LDL - trigger of atherosclerosis and inflammation in the arterial intima. Journal of Internal Medicine. 247 (3), 359-370 (2000).
- Ruuth, M., et al. Susceptibility of low-density lipoprotein particles to aggregate depends on particle lipidome, is modifiable, and associates with future cardiovascular deaths. European Heart Journal. 39 (27), 2562-2573 (2018).
- Nakashima, Y., Raines, E. W., Plump, A. S., Breslow, J. L., Ross, R. Upregulation of VCAM-1 and ICAM-1 at atherosclerosis-prone sites on the endothelium in the ApoE-deficient mouse. Arteriosclerosis, Thrombosis, and Vascular Biology. 18 (5), 842-851 (1998).
- Goldstein, J. L., Ho, Y. K., Basu, S. K., Brown, M. S. Binding site on macrophages that mediates uptake and degradation of acetylated low density lipoprotein, producing massive cholesterol deposition. Proceedings of the National Academy of Sciences of the United States of America. 76 (1), 333-337 (1979).
- Paigen, B., Morrow, A., Brandon, C., Mitchell, D., Holmes, P. Variation in susceptibility to atherosclerosis among inbred strains of mice. Atherosclerosis. 57 (1), 65-73 (1985).
- Russell, E. S. Origins and history of mouse inbred strains: contributions of Clarence Cook Little. Origins of Inbred Mice, Morse, HC, eds. (Academic Press, NY). , 33-43 (1978).
- Waterston, R. H., et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Gistera, A., Ketelhuth, D. F. J. Lipid-driven immunometabolic responses in atherosclerosis. Current Opinion in Lipidology. 29 (5), 375-380 (2018).
- Maganto-Garcia, E., Tarrio, M., Lichtman, A. H. Mouse models of atherosclerosis. Current Protocols in Immunology. Chapter 15, (2012).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Zhang, S. H., Reddick, R. L., Piedrahita, J. A., Maeda, N. Spontaneous hypercholesterolemia and arterial lesions in mice lacking apolipoprotein E. Science. 258 (5081), 468-471 (1992).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. Journal of Clinical Investigation. 92 (2), 883-893 (1993).
- Ishibashi, S., Goldstein, J. L., Brown, M. S., Herz, J., Burns, D. K. Massive xanthomatosis and atherosclerosis in cholesterol-fed low density lipoprotein receptor-negative mice. Journal of Clinical Investigation. 93 (5), 1885-1893 (1994).
- Ketelhuth, D. F., Gistera, A., Johansson, D. K., Hansson, G. K. T cell-based therapies for atherosclerosis. Current Pharmaceutical Design. 19 (33), 5850-5858 (2013).
- Skalen, K., et al. Subendothelial retention of atherogenic lipoproteins in early atherosclerosis. Nature. 417 (6890), 750-754 (2002).
- Boren, J., et al. Identification of the low density lipoprotein receptor-binding site in apolipoprotein B100 and the modulation of its binding activity by the carboxyl terminus in familial defective apo-B100. Journal of Clinical Investigation. 101 (5), 1084-1093 (1998).
- Sanan, D. A., et al. Low density lipoprotein receptor-negative mice expressing human apolipoprotein B-100 develop complex atherosclerotic lesions on a chow diet: no accentuation by apolipoprotein(a). Proceedings of the National Academy of Sciences of the United States of America. 95 (8), 4544-4549 (1998).
- Gistera, A., et al. Vaccination against T-cell epitopes of native ApoB100 reduces vascular inflammation and disease in a humanized mouse model of atherosclerosis. Journal of Internal Medicine. , (2017).
- Johnson, J. L., Jackson, C. L. Atherosclerotic plaque rupture in the apolipoprotein E knockout mouse. Atherosclerosis. 154 (2), 399-406 (2001).
- Calara, F., et al. Spontaneous plaque rupture and secondary thrombosis in apolipoprotein E-deficient and LDL receptor-deficient mice. The Journal of Pathology. 195 (2), 257-263 (2001).
- Caligiuri, G., Levy, B., Pernow, J., Thoren, P., Hansson, G. K. Myocardial infarction mediated by endothelin receptor signaling in hypercholesterolemic mice. Proceedings of the National Academy of Sciences of the United States of America. 96 (12), 6920-6924 (1999).
- Daugherty, A., et al. Recommendation on Design, Execution, and Reporting of Animal Atherosclerosis Studies: A Scientific Statement From the American Heart Association. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (9), (2017).
- Paigen, B., Morrow, A., Holmes, P. A., Mitchell, D., Williams, R. A. Quantitative assessment of atherosclerotic lesions in mice. Atherosclerosis. 68 (3), 231-240 (1987).
- Purcell-Huynh, D. A., et al. Transgenic mice expressing high levels of human apolipoprotein B develop severe atherosclerotic lesions in response to a high-fat diet. Journal of Clinical Investigation. 95 (5), 2246-2257 (1995).
- Nicoletti, A., Kaveri, S., Caligiuri, G., Bariety, J., Hansson, G. K. Immunoglobulin treatment reduces atherosclerosis in apo E knockout mice. Journal of Clinical Investigation. 102 (5), 910-918 (1998).
- Gistera, A., Ketelhuth, D. F. Immunostaining of Lymphocytes in Mouse Atherosclerotic Plaque. Methods in Molecular Biology. 1339, 149-159 (2015).
- Gistera, A., et al. Transforming growth factor-beta signaling in T cells promotes stabilization of atherosclerotic plaques through an interleukin-17-dependent pathway. Science Translational Medicine. 5 (196), (2013).
- Gistera, A., et al. Low-Density Lipoprotein-Reactive T Cells Regulate Plasma Cholesterol Levels and Development of Atherosclerosis in Humanized Hypercholesterolemic Mice. Circulation. 138 (22), 2513-2526 (2018).
- Daugherty, A., Whitman, S. C. Quantification of atherosclerosis in mice. Methods in Molecular Biology. 209, 293-309 (2003).
- Baglione, J., Smith, J. D. Quantitative assay for mouse atherosclerosis in the aortic root. Methods in Molecular Biology. 129, 83-95 (2006).
- Schiller, N. K., Kubo, N., Boisvert, W. A., Curtiss, L. K. Effect of gamma-irradiation and bone marrow transplantation on atherosclerosis in LDL receptor-deficient mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 21 (10), 1674-1680 (2001).
- Naghavi, M., et al. From vulnerable plaque to vulnerable patient: a call for new definitions and risk assessment strategies: Part I. Circulation. 108 (14), 1664-1672 (2003).
- Seijkens, T. T. P., et al. Targeting CD40-Induced TRAF6 Signaling in Macrophages Reduces Atherosclerosis. Journal of the American College of Cardiology. 71 (5), 527-542 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados