Method Article
마우스에서 동맥 경화증의 정량화
요약
죽상 동맥 경화증의 뮤린 모형은 분자 수준에 병원성 통로를 조사하기 위하여 유용한 공구입니다, 그러나 병변 발달의 표준화한 정량화가 요구됩니다. 이 프로토콜은 대동맥 근, 대동맥 아치 및 brachiocephalic 동맥을 포함하여 주요 동맥 혈관에 있는 병변 크기를 결정하기 위하여 최적화된 방법을 기술합니다.
초록
심혈관 질환은 세계에서 사망의 주요 원인입니다. 대부분의 경우 근본 원인은 동맥 경화증이며, 이는 부분적으로 만성 염증성 질환입니다. 실험적인 죽상 동맥 경화증 연구는 질병 과정에서 콜레스테롤과 염증의 역할을 해명했습니다. 이것은 죽상 동맥 경화증의 임상 표현을 감소시키는 약제와 성공적인 임상 시험으로 이끌어 냈습니다. 질병의 마우스 모형에 있는 신중하고 잘 통제된 실험은 완전히 이해되지 않는 질병의 병인을 더 해명할 수 있었습니다. 표준화된 병변 분석은 실험적 변동성을 줄이고 재현성을 높이는 데 중요합니다. 대동맥 근, 대동맥 아치 및 brachiocephalic 동맥에 있는 병변 크기를 결정하는 것은 실험적인 동맥 경화증에 있는 일반적인 종점입니다. 이 프로토콜은 단일 마우스에서 이러한 모든 부위에서 동맥경화증의 평가를 위한 기술적 설명을 제공한다. 이 프로토콜은 유전자 변형 동물이 특징지어지는 경우가 많듯이 물질이 제한될 때 특히 유용합니다.
서문
심혈관 질환은 허혈성 심장 질환과 뇌졸중으로 세계에서 사망의 주요 원인은 4 명 중 1 명에 대한1. 대부분의 경우 동맥 경화증에 의해 발생, 큰 및 중간 크기의 동맥에 만성 염증의 징후와 지질 라덴 플라크의 느린축적을 특징으로하는 질병 2. 질병은 일반적으로 패의 파열 또는 침식이 허혈성 조직 손상으로 이끌어 내는 동맥 혈전증을 이끌어 내릴 때까지 수십 년 동안 주목되지 않는 남아 있습니다.
정상적인 동맥은 내피 세포가있는 인티마 층과 드물게 분포된 평활근 세포, 평활근 세포및 탄성 라멜라를 가진 미디어 층, 느슨한결합 조직을 가진 주변의 출현 층 3으로 구성됩니다. LDL의 친밀한 유지는 동맥 경화증 개발을상쇄 4. 지단백질의 축적 및 수정은 동맥 인두 내의 응집 및 함정으로 이어진다5. 염증 반응은 갇혀 수정 된 지단백질 6에의해 유발됩니다. 내피 세포는 난류 혈류를 가진 동맥 나무의 부위에서 VCAM-1과 같은 접착 분자를 발현하기 시작하여 순환 단핵구 및 기타백혈구 7의 모집으로 이어진다. 침투 하는 단핵구는 대 식 세포에 후속 변환으로 지질을 삼켜대 식 세포로 분화 8.
죽상 동맥 경화증은 1980 년대 중반 이후 증가 주파수와 마우스 모델에서 공부 하고있다. C57BL/6은 이러한 연구를 위해 가장 일반적으로 사용되는 근친 마우스 균주이며, 유전자 변형 균주9의 대부분에 대한 유전 적 배경으로 사용된다. 이 균주는 1920 년대10에서설립되었으며, 그 게놈은 2002년 11년에 발표되었다. 마우스 모델의 실험에는 여러 가지 이점이 있습니다: 식민지는 빠르게 재현되고, 하우징은 공간 효율적이며, 근친 교배는 실험적 변동성을 감소시킵니다. 모형은 또한 표적한 유전자 삭제 및 전이유전자의 삽입과 같은 유전 조작을 허용합니다. 이것은 질병 및 새로운 치료 표적12의새로운 병리생리학 이해로 이끌어 냈습니다.
야생형 C57BL/6 마우스는 동맥경화증에 자연적으로 내성이 있습니다. 그(것)들은 HDL에 있는 순환 하는 콜레스테롤의 대부분을 가지고 있고, 복잡한 동맥 경화성 병변은 고지방 및 고콜레스테롤규정식13를공급하더라도 형성되지 않습니다. 고콜레스테롤 마우스, 예민한 마우스, 예민한-apoe--- C57BL/6-배경에, 따라서 죽상 동맥 경화증의 실험 적인 모형으로 사용된다14, 15. ApoE의 부족은 잔여 지단백질의 간 섭취를 손상시키고 가혹하게 지질 물질 대사를 교배합니다. Apoe-/- 마우스에서, 순환 콜레스테롤은 VLDL 입자에서 주로, 마우스는 일반 차우 다이어트에 복잡 한 죽상 경화 증크를 개발.
Ldlr-/- 마우스는 가족성 콜레스테롤 혈증을 가진 인간에서 보인 동맥 경화증의 발달을 모방합니다16. Ldlr-/- 마우스는 죽상 동맥 경화증을 개발하기 위하여 서양 형 규정식이 필요합니다17. 서양 식단은 인간의 음식 섭취량을 모방하고 일반적으로 0.15 % 콜레스테롤을 포함합니다. LDL 수용체는 ApoB100 및 ApoE를 인식하고 내분비증을 통해 LDL 입자의 섭취를 중재합니다. LDL 수용 체는 순환에서 LDL의 간 정리에 대 한 기본, 조혈 세포에서 LDL 수용 체 수용 체 발현이이 과정에 영향을 하지 않는 동안. 이것은 콜레스테롤 성 Ldlr에 Ldlr+/+ 세포의 골수 이식에 대 한 가능성을 엽니다 -/- 받는 사람 및 동맥 경화 증 개발의 평가. 골수 키메라는 일반적으로 실험적인 죽상 동맥 경화증에 있는 조혈 세포의 참가를 공부하기 위하여 이용되었습니다. 그러나, 골수 이식 은 죽상 경화성 플라크의 크기와 구성에 영향을 미칠 수 있습니다.
추가 유전 변경을 가진 Apoe-/- 및 Ldlr-/- 마우스의 다른 변이체는 질병의 특정 프로세스를 공부하기 위하여 개발되었습니다18. 일례로 인간 APOB100-형질전환 Ldlr-/- (HuBL)마우스는 전신 인간 APOB100 유전자 를 운반하는19,20이다. 이 마우스는 정규 차우 규정식에 콜레스테롤 혈증 및 동맥 경화증을 개발합니다. 그러나, 복잡한 죽상 경화성 플라크의 발달은 적어도 6 달 및 짧은 실험 프로토콜은 일반적으로 서양 규정식21를이용합니다. 혈장 콜레스테롤의 큰 분율은 LDL 입자에서 순환하고, 이는 HuBL 마우스에게 Apoe-/- 및 Ldlr-/- 마우스에 비해 더 인간적인 dyslipidemic 지단백질 단면도를 줍니다. HuBL 마우스는 또한 자가 항원 (22)으로 인간 apoB의 연구를 허용합니다.
죽상 동맥 경화증의 마우스 모델은 인간의 질병의 공유 기능을 가진 복잡한 죽상 경화성 플라크를 개발합니다. 그러나, 플라크는 계속되는 심근 경색으로 파열에 상당히 저항합니다. 아테로스롬보전증은23,24,25를평가하기 위해 산발적으로 검출되고 실험적으로 도전적이다. 플라크 파열의 특수 모델이 개발되었지만 실험 분야는 플라크 안정화 제의 평가를위한 신뢰할 수 있고 재현 가능한 모델이 부족합니다.
죽상 동맥 경화증의 정량화는 문헌에서 여러 가지 방법으로 보고되었습니다. 최근 동물 연구의 실험 설계, 실행 및 보고를 표준화하기 위한 노력26. 조사관은 그들의 실험실에 적응하는 다른 환경 설정 및 기술이 있습니다. 대부분의 연구 프로젝트는 또한 일부 프로토콜 수정을 요구하는 방식으로 고유합니다. 질병의 다인성 특성으로 인해 최적의 제어는 프로젝트마다 다릅니다. 현지 조건 및 표준화의 부족은 연구 필드의 진보를 방해하는 질병 발달에 있는 관찰한 다름을 일으키는 원인이 될 수 있습니다. 실험 적 가변성의 차이는 또한 통계적 전력 계산이 현지 조건하에서 파일럿 연구를 기반으로 해야 한다는 것을 의미합니다.
동맥 경화증의 정량화는 혈관 나무의 여러 위치에서 권장됩니다. 이 프로토콜은 대동맥 뿌리, 대동맥 아치 및 brachiocephalic 동맥에서 단일 마우스에서 결과를 얻는 방법뿐만 아니라 다른 분석을 위해 나머지 thoraco복부 대동맥을 떠나는 방법을 설명합니다. En 얼굴 제제는 대동맥 아치에서 지질 함유 플라크의 신속한 정량화를 허용합니다. 검체 세포막 동맥의 질병 부담은 표본이 신중하게 표시되는 경우 정량화 될 수 있습니다. 대동맥 근의 시간이 더 소요될수록 플라크 조성물의 상세한 평가에 사용할 수 있는 여러 섹션이 남습니다.
프로토콜
모든 동물 실험은 윤리 당국의 승인이 필요합니다.
1. 마우스 희생과 오르타의 미세 해부
- CO2 질식에 의해 마우스를 희생하고 기록 무게.
- 시료의 모피 오염을 방지하기 위해 70 % 에탄올로 마우스를 스프레이하십시오. 마우스를 척추 위치에 놓습니다. 경질 노치에서 마요 가위를 사용하여 중간 선을 절개하여 음모 뼈까지 거의 연장하십시오.
주의 사항: 높은 비율의 에탄올은 인화성이 높으며 심각한 눈 자극을 일으킬 수 있습니다. 예방 조치를 취하십시오. - 23 G 바늘을 사용하여 흉부 벽을 통해 심장 천자에 의해 마우스를 exsanguinate합니다. 이 절차는 일반적으로 20 주 오래된 마우스에게서 혈액의 750 μL를 산출합니다. 전형적으로, 삼중 칼륨 EDTA 코팅 관에 부피의 반을 수집하고 나머지 절반은 혈청 또는 리튬 헤파린 코팅 튜브에 수집한다. 튜브를 부드럽게 돌리고 추가 가공이 될 때까지 실온에서 보관하십시오.
- 마요 네즈 가위를 사용하여 중간선의 정수리 복막을 잘라 복강을 엽니다. 조직 집게로 xiphoid 과정을 잡고 양쪽으로 측면으로 peritoneum을 열고 다이어프램을 열어 계속 합니다.
- 마요네즈 가위를 사용하여 흉곽을 가능한 한 측면으로 절단하여 흉부 구멍을 엽니다. 이것은 나중에 대인을 미세 하게 도금하는 동안 계측기의 광각을 가능하게 합니다.
- 관류 유체 배수를위한 오른쪽 귀리클에 절개를합니다. 두개골 방향으로 심장의 정점을 통해 27G 바늘을 삽입합니다. 최소 2분 동안 10 mL 의 얼음-차가운 인산완충식염수(PBS)로 마우스를 천천히 교전시키면서 좌심실에서 바늘을 고정시키고 창백해지는 간을 관찰합니다.
참고: 몇몇 프로토콜은 파라포름알데히드 관류를 이용하지만, 이것은 림프구의 면역성 화학 분석과 같은 몇몇 다운스트림 응용을 방해합니다. 따라서, 파라포름알데히드와 관류 고정은이 프로토콜에서 수행되지 않습니다. - 해부학 적 집게와 해부 가위를 사용하여 관심기관 (예 : 림프절, 비장, 간, 내장, 환각 지방 패드, 신장 등)을 해부하십시오.
- 대동맥 아치를 손상시키지 않고 심장 오른쪽에 기관과 식도를 잘라. 내장을 레트로페리톤에 부착하는 다이어프램과 구조물을 자르고 심장, 대동맥 및 신장을 그대로 둡습니다. 폐와 내장을 접어서 냅킨으로 덮어 파라 대동맥 림프절과 복부 대동맥의 복강 내분면을 시작합니다.
- 6배 배율로 입체 현미경으로 미세 해부를 시작합니다. Dumont 집게로 주변 조직을 들어 올리고 Vannas 가위로 장력 하에서 절단하여 대동맥 분기를 해부하기 시작합니다.
- 복부 대동맥을 두개골로 해부하십시오. 대동맥에서 복부 가지를 자르고 대동맥을 횡격막의 대동맥 틈새를 통해 근접하게 풀어냅니다.
참고: 미세 해부는 스테레오 현미경을 통해 정확한 손과 눈의 협응을 필요로하며, 이를 마스터하는 데 약간의 연습이 필요합니다.
- 복부 대동맥을 두개골로 해부하십시오. 대동맥에서 복부 가지를 자르고 대동맥을 횡격막의 대동맥 틈새를 통해 근접하게 풀어냅니다.
- 흉부 대반을 덮는 지방 조직을 제거하십시오. 신중하게 나뭇 가지대동맥 아치를 해제하기 위해 흉선 의 dorsally 해부. 흉강에서 경동맥을 가능한 한 비하적으로 해부하십시오. 특별한 경우에, 목 해부는 경동맥 분기를 포함하기 위하여 수행될 수 있었습니다.
- 실제로 대강물을 절단하기 전에 탈이온수, RNase 오염 제거 용액, 70 % 에탄올 및 PBS에서 연속 헹구어로 기기를 청소하십시오. 집게로 정점에 의해 마음을 들어 올립니다. 대인을 심장에 가깝게 자르고 전체 심장을 PBS가있는 튜브에 놓습니다. 심장은 대동맥 뿌리를 계속 처리하고 냉동 장착하기 전에 몇 시간 동안 얼음에 저장 될 수 있습니다.
- 그림 1A에따라 대동맥 아치를 잘라. 대동맥 아치를 4°C에서 밤새 4% 포름알데히드의 1 mL을 함유하는 튜브에 넣는다. 견본은 고정하고 분석하기 전에 몇 년 동안 이 방법으로 저장될 수 있었습니다.
주의 사항: 포름알데히드는 암, 알레르기 성 피부 반응을 일으킬 수 있으며 삼키면 유해합니다. 필요에 따라 개인 보호 장비를 사용하십시오. - 나머지 내림차순 대류를 해부하고 RNA 안정화 용액에 넣거나 후속 RNA 분석 또는 기타 응용 을 위해 동결스냅. 과도한 RNA 분해를 피하기 위해 해부 시간을 최소화하기 위해 작업 흐름을 최적화하는 것이 중요합니다.
- 혈액 채취 튜브(1.3단계에서 수집)를 원심분리기에 넣습니다. 별도의 플라즈마 와 혈청 튜브를 실온에서 15 분 동안 1,500 x g에서 회전시면 됩니다. 플라즈마와 혈청을 미세 원심 분리튜브로 조심스럽게 옮기고 -80°C에서 보관하십시오. EDTA 와 헤파린화된 플라즈마 또는 혈청을 모두 수집하면 여러 다운스트림 응용 분야에 대한 가능성이 남습니다.
- 심장을 코르크 침대에 놓고 복부 쪽을 위로 향합니다. 정점을 통해 바늘로 코르크에 마음을 고정합니다. 해부학 적 집게로 심장의 기초를 잡으하십시오.
- 메스를 사용하여 절단 방향이 시상면에서 20°로 기울어진 두 오리클 과 횡단 평면에서 20°의 두개골로 절단되는 방향으로 심장의 정점 2/3을 잘라냅니다(그림1B).
- 최적의 절삭 온도 (OCT) 화합물에 대동맥 뿌리를 포함, 이는 둘러싸고 있지만, 조직에 침투하지 않습니다. OCT 화합물에 심장의 기초를 담가. 부드럽게 OCT와 대동맥 뿌리를 채우고 기포를 제거하기 위해 집게로 마음을 짜내.
- 10월로 채워진 저금종의 바닥으로 시편을 옮김을 옮김. 대동맥 근은 이제 아래쪽 표면에 수직이어야 합니다. 마른 얼음에 장착 된 심장을 넣어 동결합니다. 이 프로토콜의 섹션 3에 따라 냉동 절편을 추구할 때까지 지퍼 잠금 백에 시편을 -80°C에 보관하십시오.

그림 1: 심장과 대동맥 아치의 경우. (a) 폐, 기관, 식도 및 흉선제거는 20주 령 암컷 아포에-/- 마우스를 현미경으로 일반 차우 다이어트에 대동맥 아치를 표시하기 위해, 스케일 바 = 2 mm. 점선은 대동맥 아치와 그 가지를 잘라낼 위치를 나타냅니다. (B) 심장과 대반의 개략적 묘사. 빨간색 점선은 대동맥 뿌리를 저온 설치하기 전에 심장을 잘라낼 위치를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 대동맥 아치와 브라키오세팔릭 동맥의 얼굴 분석
- 대동맥 아치의 얼굴 분석을 위해 고정 침대를 준비합니다. 파라핀 왁스 필름 의 세그먼트를 8 번 접어 평평한 25mm x 25mm 표면을 만듭니다. 대반에 대한 어두운 배경을 만들기 위해 검은 색 전기 절연 테이프로 포장. 고정 침대 뒷면에 레이블을 놓고 리드 연필을 사용하여 마우스 식별 번호를 작성합니다(일반 펜 잉크는 염색 과정에서 사라집니다).
- 대동맥 아치를 고정 침대로 옮기고 그 위에 PBS 한 방울을 놓습니다. 스테레오 현미경의 밑에 남아있는 periadventitial 지방 조직에서 대동맥을 청소를 시작합니다.
- Vannas 가위와 Dumont 집게를 사용하여 대불을 조작하거나 손상시키지 않고 주변의 모든 지방 조직을 부드럽게 벗겨냅니다. 수단 IV는 지방 조직을 밝게 염색하고 이 시점에서 모든 조직을 제거하는 것이 중요합니다.
참고: 필요할 때 추가 PBS를 적용하여 대불위를 항상 촉촉하게 유지하십시오.
- Vannas 가위와 Dumont 집게를 사용하여 대불을 조작하거나 손상시키지 않고 주변의 모든 지방 조직을 부드럽게 벗겨냅니다. 수단 IV는 지방 조직을 밝게 염색하고 이 시점에서 모든 조직을 제거하는 것이 중요합니다.
- 대동맥 루멘에 Vannas 가위를 도입하여 관상 면에서 대동맥을 열어 친밀한 표면을 노출시다. 말단 방향으로 오름차순 아치의 외부 곡률을 절단하고 brachiocephalic 동맥을 포함하여 가지를 열어 계속 잘라 시작합니다. 내림차순 흉부 지역의 등도 부분을 절약하십시오.
- 작은 곡률을 열고 대장을 접어 친밀한 표면을 표시합니다.
참고: 이 단계는 미세 한 모터 기술을 필요로하고 마스터하는 몇 가지 연습이 필요합니다.
- 작은 곡률을 열고 대장을 접어 친밀한 표면을 표시합니다.
- minutien 곤충 핀의 무딘 끝을 사용하여 열린 아치를 고정 침대에 고정합니다. 마이크로 카스트로비에호 바늘 홀더를 사용하여 핀을 제자리에 놓습니다. 제자리에 있을 때 핀을 시편에서 부드럽게 구부립니다. 표본을 스트레칭하지 않고 침대에 대강타를 평평하게 고정합니다. 4°C에서 PBS로 채워진 페트리 접시에 아래쪽을 향한 고정된 아치를 보관합니다.
참고: 여기에서 프로토콜을 일시 중지할 수 있습니다. - 수단 IV의 작업 솔루션을 준비합니다. 수단 IV 파우더 1 g, 70% 에탄올 100 mL, 아세톤 100 mL를 어두운 병에 넣고 10분간 부드럽게 저어줍니다. 용액을 필터링 할 필요가 없으며 실온에서 어둡게 유지하면 몇 달 동안 사용할 수 있습니다. 염색 색상이 만족스럽지 않으면 새로운 용액을 만들 수 있으며 시편이 다시 염색될 수 있습니다.
주의 사항: 아세톤은 심각한 눈 자극을 일으킬 수 있는 인화성 액체입니다. 통풍이 잘 되는 곳에 보관하고 취급 시 예방 조치를 취하십시오. - 실험실 벤치에 페트리 접시 5개를 준비합니다: 70% 에탄올로 채워진 요리, 수단 IV 작업 용액으로 채워진 요리, 80% 에탄올로 채워진 요리, PBS로 채워진 요리 1개.
- 첫 번째 페트리 접시에 고정 침대를 놓고 아치가 아래쪽을 향하여 70 % 에탄올로 시편을 헹구는 것으로 시작합니다. 검체를 수단 IV 작업 용액으로 옮기고 아치를 7 분 동안 얼룩지게하십시오.
- 다음으로, 80% 에탄올로 3분 간 2회 헹구어 정상적인 자궁 표면을 탈색시다. 결과를 최적화하기 위해 디스테인링 시간을 조정할 수 있습니다. 마지막으로, 표본을 원래의 페트리 접시에 다시 넣기 전에 PBS에서 헹구어 넣습니다.
- 디지털 카메라에 연결된 10배 배율로 입체 현미경을 사용하여 현미경을 수집합니다. 작은 금속 분동(20mm x 10mm x 5mm)을 사용하여 PBS에 잠긴 고정 된 아치의 사진을 찍어 페트리 접시의 바닥에 고정 침대를 고정합니다. 이미지 보정을 위해 대열권 옆에 눈금자를 놓습니다.
- 이미지 분석 소프트웨어(예: ImageJ)를 사용하여 병변 면적과 총 자궁 표면을 결정합니다. 대동맥 아치를 정의하는 해부학 적 랜드 마크가 부족한 경우, 측정은 일반적으로 오름차순 대동맥의 시작부터 첫번째 늑간 분기까지 수행됩니다 (그림 2A). 소프트웨어의 영역 정량화 기능을 사용하여 전체 암시적 아치 영역을 수동으로 둘러싸습니다.
참고 : 병변 정량화는 맹목적인 방식으로 수행해야하며 두 번째 조사자가 결과를 확인하는 것이 좋습니다.- ImageJ에서 다각형 선택 도구를 선택하고 반복클릭으로 전체 아치 영역을 둘러싸습니다. 그런 다음 분석 메뉴에서 측정값을 선택하여 결과 창에 총 아치 영역을 표시합니다.
- 다음으로, 아치에 있는 모든 수단 IV 스테인드 플라크를 둘러싸는다. 수단 IV는 오렌지-레드 컬러로 지질, 트리글리세라이드 및 지단백질을 염색하는 리소크롬 디아조 염료입니다. ImageJ에서 자유형 선택 도구를 선택하고 Alt 키를 누를 때 모든 플라크를 둘러싸습니다. 분석 메뉴에서 측정값을 클릭하여 결과 창에 병변이 없는 아치 영역을 표시합니다.
- 전체 아치 영역에서 병변없는 영역을 빼고 결과를 총 아치 영역으로 나누어 상대 병변 영역을 계산합니다.
- 쇄골 동맥과 경동맥을 조심스럽게 고정하여 brachiocephalic 동맥에서 병변 정량화를 가능하게합니다 (그림 2A). 쇄골 동맥 과 일반적인 경동맥에 있는 병변의 정량화는 일반적으로 아주 도전적이고 의미없는, 각각입니다.
- ImageJ에서 시프트 키를 누를 때 다각형 선택 도구를 사용하여 브라시오두팔릭 동맥의 두 조각을 둘러싸습니다. 분석 메뉴에서 측정값을 클릭하여 결과 창에 총 brachiocephalic 동맥 영역을 표시합니다.
- 다음으로, 자유형 선택 도구를 선택하고 Alt 키를 누른 상태에서 brachiocephalic 동맥에 있는 모든 플라크를 둘러싸는다. 분석 메뉴에서 측정값을 클릭하여 병변이 없는 브라치오세팔릭 동맥 영역을 결과 창에 표시합니다.
- 전체 brachiocephalic 동맥 영역에서 병변 없는 영역을 빼고 그 결과를 총 brachiocephalic 동맥 영역으로 나누어 상대 병변 영역을 계산합니다.

도 2: 죽상 경화성 병변 정량화. (A) 20주 령 남성 인간 APOB100-형질전환 Ldlr-/- (HuBL)마우스에서 대동맥 아치를 10주 동안 서양 식단에 고정하고 수단 IV로 지질이 풍부한 플라크를 위해 염색하였다. 총 대동맥 아치 표면적은 현미경, 스케일 바 = 2 mm에서 흰색의 점선으로 윤곽이 그려져 있습니다. 노란색의 점선은 brachiocephalic 동맥의 전체 표면적을 윤곽. (B) 대동맥 근 단면에서 대동맥 부비동으로부터 400 μm에서 20주 령 남성 Ldlr-/- 마우스는 현미경으로 시각화된 8주 동안 서양 식단을 공급하고, 스케일 바 = 500 μm을 가졌다. 검은 색의 점선은 총 혈관 영역과 동맥 친시에 국한 된 오일 레드 O로 염색 된 죽상 경화성 병변을 윤곽. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 대동맥 근의 냉동 부속
- 저온 온도를 -20°C에서 설정하고 단면 두께를 10 μm로 설정합니다. 절단을 시작하는 동안 단면의 정렬을 시편 홀더와 평행하게 미세 조정합니다.
- 겹이 들지 않고 섹션을 쉽게 수집할 수 있도록 과도한 주변 OCT를 제거합니다. 이제 대동맥 근이 심장의 기저부가 금형에 올바르게 배치되었다는 점을 감안할 때 칼날과 수직으로 배치되어야 합니다.
- 폐기 될 일반 현미경 슬라이드에 초기 제어 섹션을 수집합니다. 첫 번째 섹션은 심장 근육 조직을 포함해야. 당시 200 μm까지 단면을 진행한다. 섹션을 수집하고 빛 현미경으로 진행 상황을 확인합니다.
- 좌심실 유출관에 가까워질 때, 현미경으로 매 100 μm마다 확인하십시오. 용기 벽의 초기 징후가 관찰되면 속도를 50 μm로 느리게 합니다.
참고: 첫 번째 대동맥 cusp가 나타나면 섹션을 수집하기 위한 점 0이 됩니다. cusps가 정확하게 나타나는 때 보기 어려울 수 있습니다, 그러나 정확한 현지화는 동일 지구에 있는 병변의 비교를 능력을 발휘하기 위하여 중요합니다. -
단면 평면을 다른 두 cusps와 정렬하려면 시편을 점 0 cusp 쪽으로 기울입니다. 이것은 대강의 진정한 단면을 얻기 위해 중요합니다. 대동맥 근을 도면하여 커프가 나타나는 대로 표시하고 점 0에서 이후로 절단되는 10 μm 섹션마다 계산합니다.
- 두 번째 커프가 나타나면 시편을 커프에서 다시 약간 기울여 시편을 세 번째 커프와 정렬합니다. cusps 사이의 레벨 차이는 50 μm을 초과해서는 안됩니다. 레벨 90 μm 이후의 슬라이드에서 섹션을 수집하기 시작합니다.
- 그림3의 슬라이드 계획에 따라 섹션을 수집합니다. 대동맥 뿌리가 50 μm 이상 기울어진 경우 섹션 의 수집은 190 μm부터 시작하여 루트를 직선 위치에 정렬할 수 있는 추가 공간을 허용합니다. 점 0에서 레벨 800 μm에 도달할 때까지 단면화를 계속합니다. 이 수준에서 여전히 보이는 플라크가 있는 경우 컬렉션은 1,000 μm로 확장될 수 있습니다.
참고: 단순화된 슬라이드 조직은 섹션 속도 향상을 수 있는 추가 그림1에 표시됩니다. 최적의 슬라이드 계획은 프로젝트 계획에 따라 결정되어야 합니다.
-
수집 후 섹션을 수정합니다.
- 오일 레드 O 염색 및 피크로시리우스 적색 콜라겐을 4% 포름알데히드에 10분 동안 채취한 부분을 수정합니다. 슬라이드가 오일 레드 O로 즉시 염색되어야하고 여전히 젖은 경우, 건조 과정을 가속화하기 위해 1 분 동안 60 % 이소 프로판올에 놓습니다.
주의 사항: 이소프로판올은 심각한 눈 자극을 유발할 수 있으며 졸음이나 현기증을 유발할 수 있는 인화성 액체입니다. 통풍이 잘 되는 곳에 보관하고 취급 시 예방 조치를 취하십시오. - 얼음 차가운 순수 아세톤에서 면역 성 화학 또는 면역 형광을 위해 수집 된 섹션을 10 분 동안 고정. 실온에서 30 분 동안 건조. -20 °C의 섹션을 저장하십시오.
- 오일 레드 O 염색 및 피크로시리우스 적색 콜라겐을 4% 포름알데히드에 10분 동안 채취한 부분을 수정합니다. 슬라이드가 오일 레드 O로 즉시 염색되어야하고 여전히 젖은 경우, 건조 과정을 가속화하기 위해 1 분 동안 60 % 이소 프로판올에 놓습니다.
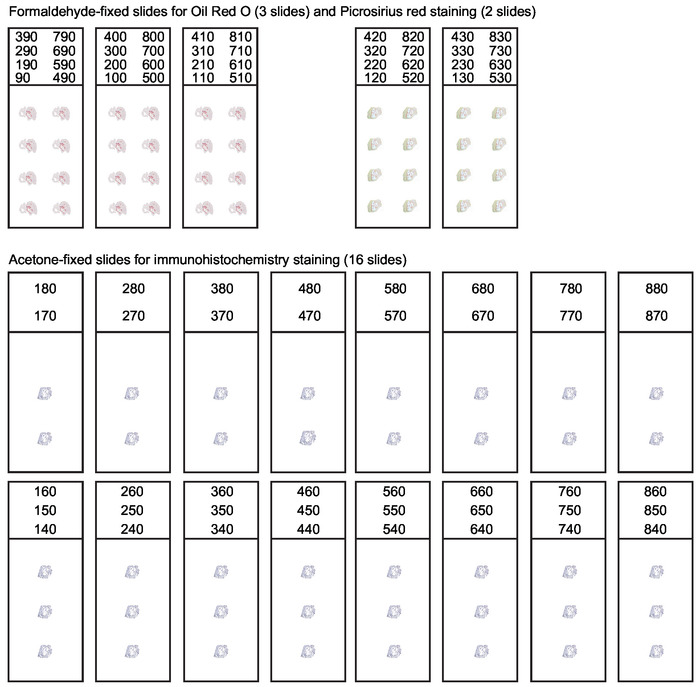
그림 3: 대동맥 루트의 직렬 섹션에 대한 슬라이드 구성입니다. 대동맥 의 처음 800 μm에 걸친 10 μm 두께의 섹션마다 대동맥 뿌리를 극저온 절제하는 동안 수집되어야한다. 다양한 응용 분야에 적합한 섹션을 얻으려면 체계적인 슬라이드 조직이 필요합니다. 병변 조성물의 분석은 일반적으로 지질에 대한 오일 레드 O 염색및 콜라겐에 대한 피크로시리우스 적색 염색을 포함한다. 나머지 절편은 면역 히스토화학 및 면역 형광 염색을 위해 수집되고 아세톤 고정됩니다. 이 그림은 Gisterå 외30에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 대동맥 근에 있는 동맥 경화증의 기름 빨간 O 염색 그리고 정량화
- 이소프로판올 100 mL에 오일 레드 O 1 g을 용해시킴으로써 포화 오일 레드 O 용액을 준비한다. 실온에서 1시간 동안 어두운 병에 용액을 저어줍니다. 포화 용액은 몇 달 동안 보관 할 수 있습니다.
참고: 솔루션과 접촉한 장비를 청소하기 어렵기 때문에 오일 레드 O 염색을 위한 실험실 장비를 지정하는 것이 좋습니다. - 포화 오일 레드 O 용액 의 75 mL를 탈이온수 50 mL와 혼합하여 작동 용액을 준비하십시오. 실온에서 10분 동안 방치하십시오.
- 오일 레드 O 작업 용액에 슬라이드를 20 분 동안 헹구고 수돗물에 5 분 동안 헹구십시오.
- 조직 시각화를 돕기 위해 메이어의 헤마톡실린을 1분 동안 얼룩지게 합니다. 이제 모든 핵은 파란색으로 염색되고 염색 시간을 조정하여 결과를 최적화해야 합니다.
- 수성 마운팅 매체(예: 카이저의 글리세롤 젤라틴)에 슬라이드를 장착합니다. 사용하기 전에 유체를 만들기 위해 40 °C에 따뜻한 카이저의 글리세롤 젤라틴. 장착 매체가 수성이므로 슬라이드를 건조할 필요가 없습니다. 커버 유리를 추가할 때 기포가 형성되지 않도록 주의하십시오.
주의 사항: Kaiser의 글리세롤 젤라틴에는 유전적 결함을 유발하는 것으로 의심되는 페놀이 함유되어 있습니다. 필요에 따라 개인 보호 장비를 사용하십시오. - 광 현미경에 연결된 카메라를 사용하여 디지털 현미경을 수집합니다. 일반적으로 전체 혈관 벽 및 병변 경계는 50 배 배 배 확대로 명확하게 시각화 될 수 있습니다. 태그가 지정된 이미지 파일 형식(TIFF)으로 고해상도 이미지를 저장하는 것이 좋습니다.
- 컴퓨터 보조 이미지 분석 소프트웨어 시스템을 사용하여 병변 크기 분석을 수행합니다. 오일 레드 O는 중성 지질을 염색하고 병변 정량화를 돕는 강렬한 붉은 색으로 죽상 경화성 플라크를 시각화하는 리소크롬 디아조 염료입니다.
참고 : 병변 정량화는 맹목적인 방식으로 수행해야하며 두 번째 조사자가 얻은 결과를 확인하는 것이 좋습니다.- 이미지 분석 소프트웨어에서 면적 정량화 기능을 사용하여 대동맥 용기 벽의 외부 탄성 라미나(그림2B)를둘러싸서 전체 용기 면적을 정의합니다. ImageJ에서 다각형 선택 도구를 선택하고 반복클릭으로 영역을 둘러싸습니다. 그런 다음 분석 메뉴에서 측정값을 선택합니다. 총 선박 영역이 결과 창에 표시됩니다.
- 내부 탄성 라미나 및 발광 경계에 의해 정의 된 혈관의 친밀한 층에서 죽상 경화성 병변을 정량화하십시오. 일반적으로 판막 cusps에 병변은 측정27에서제외됩니다. ImageJ에서 자유형 선택 도구를 선택하고 Alt 키를 누를 때 모든 플라크를 둘러싸습니다. 분석 메뉴에서 측정값을 선택하여 결과 창에 병변이 없는 혈관 영역을 표시합니다.
- 전체 혈관 영역에서 병변없는 영역을 빼고 결과를 전체 혈관 영역으로 나누어 상대 병변 면적을 계산합니다.
참고: 사용된 배율에 따라 이미지 분석 소프트웨어의 결과를 보정하여 제곱 마이크로미터에서 절대 병변 영역을 얻었다.
- 이미지 분석 소프트웨어에서 색상 임계값 특징을 사용하여 병변내의 오일 적색 O 염색 영역을 정의하여 전체 병변 영역의 오일 레드 O 양성 영역의 백분율을 계산합니다.
- ImageJ에서 시프트 키를 누를 때 자유형 선택 도구를 사용하여 모든 병변 영역을 둘러싸습니다. 분석 메뉴에서 측정값을 선택하여 총 병변 영역이 결과 창에 표시됩니다.
- 편집 메뉴에서 외부 지우기 선택을 선택합니다. 이미지 메뉴에서 이미지 유형을 8비트로 변경합니다.
- 이미지 메뉴의 조정 하위 메뉴에서 임계값을 선택하여 오일 레드 O 음수 영역에 대한 빨간색 임계값을 설정합니다. 적용을 클릭합니다. 프로세스 메뉴의 이진 하위 메뉴에서 이 옵션을 선택하여 이미지 바이너리를 만듭니다.
참고: 일반적으로 오일 레드 O 염색배치마다 다릅니다. 따라서 색상 임계값은 동일한 염색 배치 내에서만 권장됩니다. 임계값이 결정되고 표준화된 방법에 대한 설명과 함께 결과를 제공해야 합니다. - 분석 메뉴에서 입자 분석을 선택하여 그림을 분석하고 확인을 클릭합니다. 총 오일 레드 O 음의 병변 영역은 이제 요약 창에 표시됩니다. 총 병변 영역에서 오일 레드 O 음의 영역을 빼고 전체 병변 영역으로 나누어 상대 오일 레드 O 양성 영역을 계산합니다.
결과
죽상 동맥 경화증의 마우스 모델에서 가장 눈에 띄는 병변은 대동맥 뿌리와 대동맥 아치에서 발생하는 경향이 있다. 이 프로토콜은 대동맥 근, 대동맥 아치 및 단일 마우스에서 brachiocephalic 동맥의 동맥 경화증의 정량화를 설명합니다. 흉부 하강 대류와 복부 대류의 측정 가능한 병변은 사전 질병이있는 동물에서만 존재합니다. 이 프로토콜에서는, 이 부분은 죽상 경화성 부담을 위해 분석되지 않으며, mRNA 수준 또는 그밖 분석의 후속 분석을 위해 저장됩니다. 대동맥 근에 있는 죽상 경화성 병변의 직렬 단면도는 일반적으로 x축28에 있는대동맥 부비동에 y-축 및 거리에 병변 크기로 그래프에 표시됩니다. 진정한 단면은 병변 크기 정량화에 매우 중요합니다. 경사 섹션은 병변 크기를 과대 평가 할 수 있으며 20 °의 기울기는 절대 병변 표면을 15 %29로과대 평가 할 수 있습니다. 그러나, 전체 혈관 영역의 병변 분율을 계산하면 단면화 동안가능한 각도 차이에 대한 결과가 덜 민감해진다(도 4A). 그룹 간의 차이를 감지하는 적절한 통계 방법은 일반적으로 분산(ANOVA)의 정기적인 2방향 분석입니다. 본페로니 사후 검사는 특정 수준에서 차이를 감지하기 위해 수행됩니다. 피셔의 가장 유의한 차이는 ANOVA에 대한 후속 테스트로도 사용될 수 있습니다. 형식 II 통계 적 오류의 가능성을 줄이지만 여러 비교를 고려하지 않습니다. 또한, 마우스당 곡선 또는 평균 병변 크기 하에서 영역을 계산하고 도트 플롯에 데이터를 제시하여 그룹 내의 개별변동을 더욱 시각화하는 것을 예시할 수 있다(도 4B).
오일 레드 O는 중성 지질을 염색하는 지용성 밝은 붉은 색소 염료입니다. 세포막의 극성 지질은 얼룩지지 않습니다. 오일 레드 O 염색은 신선, 냉동 또는 포르말린 고정 샘플에서 수행될 수 있지만 필요한 탈파라핀화 공정에서 지질제거로 인해 파라핀이 내장된 샘플에서는 수행되지 않습니다. 레시오날 지질 축적의 정량화는 총 병변 영역의 오일 레드 O 양성영역을 임계값화하여 수행될 수 있었다(도 4C). 헤마톡실린은 세포 핵의 파란색 염색을 생성하며, 이는 플라크 형태를 시각화하는 데 도움이됩니다. 좌우 관상 동맥은 일반적으로 대동맥에서 약 250 μm에서 대동맥에서 발산하는 대동맥부비동 27,이는 수시로 가장 눈에 띄는 병변 크기와 일치합니다. 이 영역의 횡단면은 종종 대표적인결과로 표시됩니다(그림 4D).

그림 4: 대동맥 근에 있는 죽상 경화성 병변. (a) 28주령의 남성 골수 키메라를 8주 동안 서양 식단에 공급하여 Smad7-결핍T 세포가 동맥경화증 발달에 미치는 영향을 확인하기 위해 평가하였다. 실험적 Ldlr-/- 키메라는 Cd4-Cre+Smad7fl/fl 골수를 받았으며, 대조군은 Cd4-Cre+Smad7fl/+ 골수를 받았습니다. 그래프는 총 혈관 표면의 병변 분율로 표시된 대동맥 부비동으로부터 8개의 연속적인 섹션으로부터 죽상 경화성 병변 영역의 정량화를보여줍니다(Cd4-Cre+Smad7fl/+/Ldlr-/- n=6, Cd4-Cre+Smad7fl/fl/Ldlr-/- n = 9, 본페로니의 사후 테스트가 있는 2방향 ANOVA, 그래프는 ±SEM을 의미하며, 중괄호는 변형률 비교에 대한 유의 수준을 나타낸다. (B) 결합 된 도트 플롯과 막대 그래프는 대동맥 뿌리 섹션에서 평균 죽상 경화성 병변 영역을 보여줍니다 (Cd4-Cre+Smad7fl /+/ Ldlr-/- n =6, Cd4-Cre+Smad7fl/fl/ Ldlr-/- n = 9, 학생의 t-test) (C) 병변의 오일 레드 O 염색 영역 (Cd4-Cre+Smad7fl/+/Ldlr-/- n = 4, Cd4-Cre+Smad7fl/fl/fl /Ldlr-/- n = 6, 학생의 t-test, ns=비유의미) (B -C)도트는 개별 마우스를 나타내고 바는 ±SEM을 나타내며 (D) 오일 레드 O 염색을 보여주는 대표적인 현미경 사진 (빨간색) color) 대동맥 부비동으로부터 300 μm의 대동맥 근에서 중성 지질의 (50배 배율), 스케일 바 = 500 μm. *p ≤ 0.05, ***p ≤ 0.001. 이 그림은 Gisterå 외31에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
오일 레드 O는 앙페이스 준비 대단표의 염색에 사용될 수 있지만,이 프로토콜은 수단 IV, 또 다른 편리한 지용성 디아조 염료를 사용합니다. 수단 IV는 지질, 트리글리세라이드 및 지단백질을 염색하여 주황색-붉은 색의 죽상 경화성 플라크를 명확하게 시각화합니다. en 얼굴 대동맥 아치의 대표적인 이미지에서 어두운 배경을 제거하면시각적 디스플레이가 향상될 수 있습니다(도 5A). 일반적으로 병변 크기는 일반적으로 그룹 사이 학생의 t-테스트를 가진 통계적인 시험을 허용하는 단 내의 분배됩니다. 개별 마우스와 그룹 간에 비교되는 평균을 모두 보여주는 점 도표는 결과를 표시하는 유익한 방법입니다(그림5B-C). 그룹 내의 변화는 일반적으로 혈관 트리의 위치 간에 다르기 때문에 일반적으로 별도의 전력 계산이 필요합니다. 방법 숙련도와 프로토콜 표준화를 통해 불필요한 변형을 피할 수 있습니다. 통계적으로 유의한 결과를 얻는 것도 중요하지만 관찰된 차이에 대한 생물학적 관련성도 항상 고려해야 합니다.
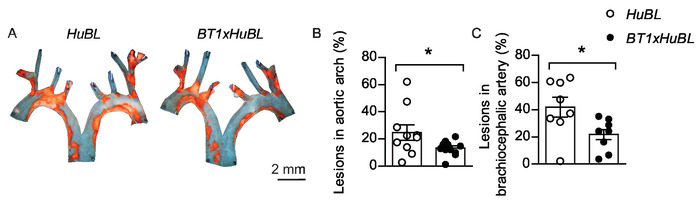
그림 5: 대동맥 및 brachiocephalic 동맥에 있는 죽상 경화성 병변. (A) 대표적인 en 얼굴 대동맥 아치의 현미경 사진으로 20주 령생생에서 수단 IV(주황색)로 염색된 지질 함유 플라크를 10주 동안 서양 식단을 함께 가시화하였다. 스케일 바 = 2 mm. 인간 APOB100-형질전환 Ldlr-/- (HuBL)마우스를 대조군으로 사용하였고, 실험군은 LDL 반응성 T 세포를 가진 TCR-형질전환 마우스로 구성되었다(BT1) HuBL 마우스에 교배하였다. (B) 대동맥 경화성 병변 (HuBL n = 10, BT1xHuBL n = 12; 학생의 t-test). (C) brachiocephalic 동맥에 있는 동맥 경화성 병변 (HuBL n = 8, BT1xHuBL n = 9, 학생의 t-test). (B-C) 도트는 개별 마우스를 나타내고, 바는 ±SEM. *p ≤ 0.05를 나타낸다. 이 그림은 Gisterå 외32에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
추가 그림 1: 대동맥 루트의 직렬 섹션에 대한 슬라이드의 대체 조직입니다. 대동맥 루트에서 섹션을 수집하기위한 단순화 된 체계적인 슬라이드 조직. 이 컬렉션은 지질 및 면역 기능 화학 또는 면역 형광 염색을 위한 오일 레드 O 염색을 가능하게 합니다. 콜라겐의 피크로시리우스 레드 염색전용 슬라이드는 생략됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
심혈관 질환은 세계의 주요 살인자이며 새로운 예방 측정이 필요합니다2. 질병의 마우스 모델은 병리생리학 및 실험 적 치료의 조사를위한 포괄적 인 플랫폼을 제공합니다13. 신뢰할 수 있는 병변 크기 정량화는 이 접근을 위해 필수적입니다. 그러나 정량화 방법은 실험실마다 다릅니다. 표준화 및 최적화는 1980년대13,27,33,34이후 지속적인 프로세스였습니다. 대동맥 뿌리는 실험적인 죽상 동맥 경화증을 정량화하는 가장 인기있는 사이트로 부상했습니다. 플라크의 단면은 그룹 간의 플라크 볼륨을 비교할 수 있습니다. En 얼굴 제제는 대류의 더 큰 세그먼트에서 병변 정량화를 선호한다. en face 방법은 플라크 수량을 시각화하고 플라크 영역 커버리지의 정량화를 가능하게 하지만 플라크 두께를 고려하지 않습니다. 관찰된 차이에 대한 생물학적 관련성은 혈관 트리의 상이한 위치에서 일관된 결과에 의해 입증됩니다. 다른 위치에서 동맥 경화 증 개발 평가 가능한 사이트 특정 효과 해결. 죽상 동맥 경화증 발달에 이식 된 조혈 세포의 효과는 콜레스테롤 성 Ldlr-/- 키메라에서 평가 될 수있다. 그러나, 전신 조사는 사이트 특정 효력을 가진 동맥 경화증 프로세스에 영향을 미칩니다. 더 눈에 띄는 죽상 경화성 병변은 대동맥 근에서 개발되고, 감소 된 병변 발달은 대동맥 아치(35)에서관찰된다.
중요한 것은 병변 크기뿐만 아니라 실험적 죽상 동맥 경화증의 연구에서 다루어져야한다는 것입니다. 병변 조성물은 또한 중요한 매개변수이다. 몇몇 패는 인간36에있는 질병의 표현과 연관되었습니다. 대동맥 근의 직렬 단면은 플라크 조성물을 주의 깊게 분석하는 데 사용할 수 있는 여러 섹션을 남깁니다. 인간에서플라크 파열은 평활근 세포가 거의 없는 얇은 섬유질 캡, 플라크(36)에서의콜라겐 함량 및 염증의 징후를 특징으로 한다. 플라크 파열은 동맥 경화증의 마우스 모델에서 드문 사건이지만, 플라크 안정성을위한 마커는 평가하는 유익한. 번역 접근법은 마우스 모형에서 기계론적인 사실 인정을 확인하고 인간 질병31의중요한 특징을 밝힐 수 있었습니다. 죽상 경화성 플라크의 염증 상태는 VCAM-1, MHC 클래스 II, 대식세포 및 림프구30의면역 성 화학 염색에 의해 결정될 수 있었다. 일부 프로토콜은 동맥 경화성 병변 크기 및 조성물37을측정하기 위한 대동맥 아치 또는 brachiocephalic 동맥의 관상 측면에서 세로 절편을 사용한다. 그러나 이 대체 방법은 분석할 섹션이 거의 남지 므로 응용 프로그램이 제한됩니다.
이 프로토콜의 초기 중요한 단계는 대류물을 효율적으로 수확하는 기능입니다. 현미경의 밑에 손 과 눈 조정은 연습을 요구하고 현미경 과 대동맥 아치의 후속 고정을 위해 둘 다 중요합니다. 이 프로토콜의 다음 중요한 단계는 대동맥 루트의 직렬 섹션 모음입니다. 각 마우스에 대해 80개의 연속 섹션을 수집해야 하며, 이 섹션은 초점과 인내심이 모두 필요합니다. 방법론적 숙련도는 설명된 프로세스의 속도를 상당히 높일 수 있습니다. 그럼에도 불구하고, 죽상 경화성 병변 정량화는 여전히 시간이 많이 걸리는 작업입니다. 새로운 기술, 자동 취급 및 작은 동물 화상 진찰은 미래에 실험적인 동맥 경화증의 정량화를 촉진할 수 있습니다. 동맥 경화증의 진행은 느리고 마우스 모형에 있는 대부분의 실험적인 프로토콜은13를완료하는 4 달 이상 걸립니다. 따라서 대원수는 스터디 엔드포인트에서 최적화된 방식으로 수집되어야 합니다. 이 프로토콜은 대동맥을 효율적으로 수확하는 포괄적 인 가이드를 제공하며 제안 된 처리는 대동맥 뿌리, 대동맥 아치 및 brachiocephalic 동맥의 병변 정량을 포함한 다목적 용도로 대동맥을 준비합니다. 바라건대 프로토콜은 실험 적 가변성을 감소시킬 수 있습니다, 결과의 신뢰성을 향상, 동맥 경화증에 대한 새로운 치료에 대한 길을 열 것입니다 연구 결과로 이어질.
공개
저자는 공개 할 것이 없다.
감사의 말
우리는 지난 반세기 동안이 프로토콜을 개발하는 데 도움이 괴란 K 핸슨의 실험 심장 혈관 연구 단위의 모든 과거 회원에게 감사드립니다. 안토니노 니콜레티, 싱화 저우, 안나 카린 로버트슨, 잉거 보딘의 공헌에 특히 감사드립니다. 이 작품은 프로젝트 보조금 06816및 Linnaeus가 스웨덴 연구 위원회의 349-2007-8703을 지원하고 스웨덴 심장 폐 재단, 스톡홀름 카운티 위원회, 교수 난나 스바르츠 재단, 루와 한스 오스테만에서 보조금에 의해 지원되었다 카롤린스카 연구소의 의학 연구 재단, 카롤린스카 인스티튜트의 연구 재단 및 노인성 질환 재단.
자료
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | 20066.296 | For fixation of sections for immunohistochemistry. |
| Black electrical insulation tape (50 mm wide) | Any specialized retailer | - | To create pinning beds for aortic arches. |
| Centrifuge | Eppendorf | 5417C | Benchtop microcentrifuge. |
| Cork board | Any specialized retailer | - | For cutting hearts in the preparation to cryomount aortic roots. |
| Cryostat | Thermo Scientific | Microm HM 560 | For serial cryosectioning of aortic roots. |
| Deionized water | - | - | For rinsing and preparation of solutions. |
| Digital camera | Leica Microsystems | DC480 | 5.1 megapixel CCD for high-resolution images of aortic arches and aortic root sections. |
| Dissecting scissors (10 cm, straight) | World Precision Instruments | 14393 | For general dissection of organs. |
| Dumont forceps #5 (11 cm, straight) | World Precision Instruments | 500341 | For microdissection of aorta. |
| Ethanol 70% (v/v) | VWR Chemicals | 83801.290 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Ethanol absolute ≥99.8% | VWR Chemicals | 20821.310 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Formaldehyde 4% stabilised, buffered (pH 7.0) | VWR Chemicals | 9713.1000 | Harmful by inhalation, in contact with skin and if swallowed. |
| ImageJ | NIH | - | Image analysis software. |
| Iris forceps (10 cm, curved, serrated) | World Precision Instruments | 15915-G | Used as anatomical forceps. |
| Isopropanol | Merck | 1096341011 | Flammable liquid, causes serious eye irritation, and may cause drowsiness or dizziness. |
| Kaiser's glycerol gelatine | Merck | 1092420100 | Aqueous mounting medium containing phenol. Suspected of causing genetic defects. |
| Light microscope | Leica Microsystems | DM LB2 | For analysis during sectioning and documentation of Oil Red O stained micrographs. |
| Mayer's hematoxylin | Histolab | 1820 | Non-toxic staining solution without chloral hydrate, but causes serious eye irritation. |
| Mayo scissors (17 cm, straight) | World Precision Instruments | 501751-G | For general dissection. |
| Micro Castroviejo needle holder (9 cm, straight) | World Precision Instruments | 503376 | For pinning of aortic arches. |
| Microcentrifuge tubes | Corning | MCT-175-C | Polypropylene microtubes with snaplock cap. |
| Microlance 3 needles, 23 gauge | BD | 300800 | For blood collection. |
| Microlance 3 needles, 27 gauge | BD | 302200 | For perfusion of mice. |
| Microvette 500 µL, K3 EDTA | Sarstedt | 20.1341.100 | For blood collection. |
| Microvette 500 µL, Lithium Heparin | Sarstedt | 20.1345.100 | For blood collection. |
| Minutien insect pins, 0.10 mm | Fine Science Tools | 26002-10 | For pinning of aortic arches. |
| Oil Red O | Sigma-Aldrich | O0625 | Not classified as a hazardous substance or mixture. |
| Optimum cutting temperature (OCT) cryomount | Histolab | 45830 | For embedding tissue. |
| Parafilm M | Bemis | PM992 | Paraffin wax film used to create pinning beds for aortic arches. |
| Petri dishes (100 mm x 20 mm) | Any cell culture supplier | - | Proposed as a storage container for pinned aortas. |
| Phosphate buffered saline (PBS) | - | - | Sterile and RNase-free solution is required for perfusion of mice. |
| Qualitative filter paper (grade 1001) | Munktell | 120006 | For filtering Oil Red O working solution (typical retention 2-3 µm). |
| RNAlater RNA stabilization reagent | Qiagen | 76106 | For stabilization of RNA in tissue samples |
| RNaseZap RNase Decontamination Solution | Invitrogen | AM9780 | A surface decontamination solution that destroys RNases on contact. |
| Scalpel handle #3 (13 cm) | World Precision Instruments | 500236 | For cutting hearts in the preparation to cryomount aortic roots. |
| Standard scalpel blade #10 | World Precision Instruments | 500239 | For cutting hearts in the preparation to cryomount aortic roots. |
| Stereomicroscope | Leica Microsystems | MZ6 | For dissection and en face documentation |
| Sudan IV | Sigma-Aldrich | S4261 | Not classified as a hazardous substance or mixture. |
| Superfrost Plus microscope slides | Thermo Scientific | J1800AMNZ | To collect aortic root sections. |
| Tissue forceps (15 cm) | World Precision Instruments | 501741-G | For general dissection. |
| Tissue-Tek cryomolds (10 mm x 10 mm x 5 mm) | Sakura | 4565 | For embedding aortic roots in OCT. |
| Vannas scissors (8 cm, straight) | World Precision Instruments | 503378 | For microdissection of aorta. |
참고문헌
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859), 2095-2128 (2012).
- Gistera, A., Hansson, G. K. The immunology of atherosclerosis. Nature Reviews Nephrology. 13 (6), 368-380 (2017).
- Hansson, G. K. Inflammation, atherosclerosis, and coronary artery disease. New England Journal of Medicine. 352 (16), 1685-1695 (2005).
- Williams, K. J., Tabas, I. The response-to-retention hypothesis of early atherogenesis. Arteriosclerosis, Thrombosis, and Vascular Biology. 15 (5), 551-561 (1995).
- Pentikainen, M. O., Oorni, K., Ala-Korpela, M., Kovanen, P. T. Modified LDL - trigger of atherosclerosis and inflammation in the arterial intima. Journal of Internal Medicine. 247 (3), 359-370 (2000).
- Ruuth, M., et al. Susceptibility of low-density lipoprotein particles to aggregate depends on particle lipidome, is modifiable, and associates with future cardiovascular deaths. European Heart Journal. 39 (27), 2562-2573 (2018).
- Nakashima, Y., Raines, E. W., Plump, A. S., Breslow, J. L., Ross, R. Upregulation of VCAM-1 and ICAM-1 at atherosclerosis-prone sites on the endothelium in the ApoE-deficient mouse. Arteriosclerosis, Thrombosis, and Vascular Biology. 18 (5), 842-851 (1998).
- Goldstein, J. L., Ho, Y. K., Basu, S. K., Brown, M. S. Binding site on macrophages that mediates uptake and degradation of acetylated low density lipoprotein, producing massive cholesterol deposition. Proceedings of the National Academy of Sciences of the United States of America. 76 (1), 333-337 (1979).
- Paigen, B., Morrow, A., Brandon, C., Mitchell, D., Holmes, P. Variation in susceptibility to atherosclerosis among inbred strains of mice. Atherosclerosis. 57 (1), 65-73 (1985).
- Russell, E. S. Origins and history of mouse inbred strains: contributions of Clarence Cook Little. Origins of Inbred Mice, Morse, HC, eds. (Academic Press, NY). , 33-43 (1978).
- Waterston, R. H., et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Gistera, A., Ketelhuth, D. F. J. Lipid-driven immunometabolic responses in atherosclerosis. Current Opinion in Lipidology. 29 (5), 375-380 (2018).
- Maganto-Garcia, E., Tarrio, M., Lichtman, A. H. Mouse models of atherosclerosis. Current Protocols in Immunology. Chapter 15, (2012).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Zhang, S. H., Reddick, R. L., Piedrahita, J. A., Maeda, N. Spontaneous hypercholesterolemia and arterial lesions in mice lacking apolipoprotein E. Science. 258 (5081), 468-471 (1992).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. Journal of Clinical Investigation. 92 (2), 883-893 (1993).
- Ishibashi, S., Goldstein, J. L., Brown, M. S., Herz, J., Burns, D. K. Massive xanthomatosis and atherosclerosis in cholesterol-fed low density lipoprotein receptor-negative mice. Journal of Clinical Investigation. 93 (5), 1885-1893 (1994).
- Ketelhuth, D. F., Gistera, A., Johansson, D. K., Hansson, G. K. T cell-based therapies for atherosclerosis. Current Pharmaceutical Design. 19 (33), 5850-5858 (2013).
- Skalen, K., et al. Subendothelial retention of atherogenic lipoproteins in early atherosclerosis. Nature. 417 (6890), 750-754 (2002).
- Boren, J., et al. Identification of the low density lipoprotein receptor-binding site in apolipoprotein B100 and the modulation of its binding activity by the carboxyl terminus in familial defective apo-B100. Journal of Clinical Investigation. 101 (5), 1084-1093 (1998).
- Sanan, D. A., et al. Low density lipoprotein receptor-negative mice expressing human apolipoprotein B-100 develop complex atherosclerotic lesions on a chow diet: no accentuation by apolipoprotein(a). Proceedings of the National Academy of Sciences of the United States of America. 95 (8), 4544-4549 (1998).
- Gistera, A., et al. Vaccination against T-cell epitopes of native ApoB100 reduces vascular inflammation and disease in a humanized mouse model of atherosclerosis. Journal of Internal Medicine. , (2017).
- Johnson, J. L., Jackson, C. L. Atherosclerotic plaque rupture in the apolipoprotein E knockout mouse. Atherosclerosis. 154 (2), 399-406 (2001).
- Calara, F., et al. Spontaneous plaque rupture and secondary thrombosis in apolipoprotein E-deficient and LDL receptor-deficient mice. The Journal of Pathology. 195 (2), 257-263 (2001).
- Caligiuri, G., Levy, B., Pernow, J., Thoren, P., Hansson, G. K. Myocardial infarction mediated by endothelin receptor signaling in hypercholesterolemic mice. Proceedings of the National Academy of Sciences of the United States of America. 96 (12), 6920-6924 (1999).
- Daugherty, A., et al. Recommendation on Design, Execution, and Reporting of Animal Atherosclerosis Studies: A Scientific Statement From the American Heart Association. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (9), (2017).
- Paigen, B., Morrow, A., Holmes, P. A., Mitchell, D., Williams, R. A. Quantitative assessment of atherosclerotic lesions in mice. Atherosclerosis. 68 (3), 231-240 (1987).
- Purcell-Huynh, D. A., et al. Transgenic mice expressing high levels of human apolipoprotein B develop severe atherosclerotic lesions in response to a high-fat diet. Journal of Clinical Investigation. 95 (5), 2246-2257 (1995).
- Nicoletti, A., Kaveri, S., Caligiuri, G., Bariety, J., Hansson, G. K. Immunoglobulin treatment reduces atherosclerosis in apo E knockout mice. Journal of Clinical Investigation. 102 (5), 910-918 (1998).
- Gistera, A., Ketelhuth, D. F. Immunostaining of Lymphocytes in Mouse Atherosclerotic Plaque. Methods in Molecular Biology. 1339, 149-159 (2015).
- Gistera, A., et al. Transforming growth factor-beta signaling in T cells promotes stabilization of atherosclerotic plaques through an interleukin-17-dependent pathway. Science Translational Medicine. 5 (196), (2013).
- Gistera, A., et al. Low-Density Lipoprotein-Reactive T Cells Regulate Plasma Cholesterol Levels and Development of Atherosclerosis in Humanized Hypercholesterolemic Mice. Circulation. 138 (22), 2513-2526 (2018).
- Daugherty, A., Whitman, S. C. Quantification of atherosclerosis in mice. Methods in Molecular Biology. 209, 293-309 (2003).
- Baglione, J., Smith, J. D. Quantitative assay for mouse atherosclerosis in the aortic root. Methods in Molecular Biology. 129, 83-95 (2006).
- Schiller, N. K., Kubo, N., Boisvert, W. A., Curtiss, L. K. Effect of gamma-irradiation and bone marrow transplantation on atherosclerosis in LDL receptor-deficient mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 21 (10), 1674-1680 (2001).
- Naghavi, M., et al. From vulnerable plaque to vulnerable patient: a call for new definitions and risk assessment strategies: Part I. Circulation. 108 (14), 1664-1672 (2003).
- Seijkens, T. T. P., et al. Targeting CD40-Induced TRAF6 Signaling in Macrophages Reduces Atherosclerosis. Journal of the American College of Cardiology. 71 (5), 527-542 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유