Method Article
Количественная оценка атеросклероза у мышей
В этой статье
Резюме
Моринмодели атеросклероза являются полезными инструментами для исследования патогенных путей на молекулярном уровне, но требуют стандартизированной количественной оценки развития поражения. Этот протокол описывает оптимизированный метод для определения размера поражения в основных артериальных сосудов, включая корень аорты, аортальной арки, и брахиоцефалической артерии.
Аннотация
Сердечно-сосудистые заболевания являются основной причиной смерти в мире. Основной причиной в большинстве случаев является атеросклероз, который частично является хроническим воспалительным заболеванием. Экспериментальные исследования атеросклероза прояснили роль холестерина и воспаления в процессе заболевания. Это привело к успешным клиническим испытаниям с фармацевтическими агентами, которые уменьшают клинические проявления атеросклероза. Тщательные и хорошо контролируемые эксперименты в мышиных моделях болезни могут еще больше прояснить патогенез болезни, который не до конца понятен. Стандартизированный анализ поражения имеет важное значение для снижения экспериментальной изменчивости и повышения воспроизводимости. Определение размера поражения корня аорты, аортальной арки и брахиоцефалической артерии являются общими конечными точками в экспериментальном атеросклерозе. Этот протокол предоставляет техническое описание для оценки атеросклероза на всех этих участках в одной мыши. Протокол особенно полезен, когда материал ограничен, как это часто бывает при характеристике генетически модифицированных животных.
Введение
Сердечно-сосудистые заболевания являются основной причиной смерти в мире с ишемической болезни сердца и инсульта приходится один из каждых четырех смертей1. Большинство случаев вызваны атеросклерозом, заболеванием, характеризующимся медленным накоплением липидных бляшек с признакамихронического воспаления в крупных и средних артериях 2. Болезнь обычно остается незамеченной в течение нескольких десятилетий, пока разрыв или эрозия бляшки вызывает артериальный тромбоз, который приводит к повреждению ишемической ткани.
Нормальная артерия состоит из интимального слоя с эндотелиальными клетками и редко распределенных гладких мышечных клеток, медиаслой с гладкими мышечнымиклетками и эластичным ламеллами, а также окружающего авантюрного слоя с рыхлой соединительной тканью 3. Интимное удержание ЛПНП компенсирует развитие атеросклероза4. Накопление и модификация липопротеинов приводят к агрегациии захвату в артериальной интиме 5. Воспалительная реакция вызывается захваченных и модифицированных липопротеинов6. Эндотелиальные клетки начинают выражать молекулы адгезии, такие как VCAM-1 на участках артериального дерева с турбулентным кровотоком, что приводит к набору циркулирующих моноцитов и других лейкоцитов7. Проникающие моноциты дифференцируются в макрофаги, которые поглощают липид с последующей трансформацией в клетки пены макрофагов8.
Атеросклероз изучался в моделях мышей с возрастающей частотой с середины 1980-х годов. C57BL/6 является наиболее часто используемым штаммом инбредных мышей для этих исследований, и он используется в качестве генетического фона для большинства генетически модифицированных штаммов9. Этот штамм был создан в 1920-х годов10, и его геном был опубликован в 2002году 11. Эксперименты в моделях мышей имеют несколько преимуществ: колонии размножаются быстро, корпус является пространственно-эффективным, а инбридинг снижает экспериментальную изменчивость. Модель также допускает генетические манипуляции, такие как целевые удаления генов и вставка трансгенов. Это привело к новому патофизиологическому пониманию болезни и новой терапии целей12.
Мышей дикого типа C57BL/6 естественно устойчивы к атеросклерозу. Они имеют большую часть циркулирующего холестерина в ЛПВП, и сложные атеросклеротические поражения не образуются даже при кормлении с высоким содержанием жира и высоким содержанием холестерина диеты13. Гиперхолестеринемические мыши, такие как Apoe-/- на c57BL/6-фон, поэтому используются в качестве экспериментальных моделей атеросклероза14,15. Отсутствие ApoE ухудшает печенок поглощения остатков липопротеинов и серьезно возмущает метаболизм липидов. В Apoe-/- мышей, циркулирующих холестерина в основном в частицах VLDL, и мышей развивать сложные атеросклеротические бляшки на регулярной диете чау.
Ldlr-/- мыши имитируют развитие атеросклероза видели у людей с семейной гиперхолестеринемии16. Ldlr-/- мышам нужна западная диета типа для развития атеросклероза17. Западная диета имитирует потребление пищи человеком и обычно содержит 0,15% холестерина. Рецептор ЛПНП распознает ApoB100 и ApoE и опосредует поглощение частиц ЛПНП через эндоцитоз. LdL рецепторы имеют основополагающее значение для печени очистки ЛПНП от кровообращения, в то время как выражение рецепторов ЛПНП в гематоподетические клетки не влияет на этот процесс. Это открывает возможность для трансплантации костного мозга клеток Лдлра в гиперхолестеринемический Ldlr-/- реципиенты и оценки развития атеросклероза. Химеры костного мозга обычно используются для изучения участия гематопоитических клеток в экспериментальном атеросклерозе. Однако трансплантация костного мозга может повлиять на размер и состав атеросклеротических бляшек, что делает интерпретацию результатов неоднозначной.
Различные варианты Apoe-/- и Ldlr-/- мышей с дополнительными генетическими изменениями были разработаны для изучения специфических процессов заболевания18. Одним из примеров является человек APOB100-трансгенных Ldlr-/- (HuBL) мышей, которые несут в полнометражный человеческий ген APOB100 19,20. Эти мыши развивают гиперхолестеринемию и атеросклероз на регулярной диете чау. Однако разработка сложных атеросклеротических бляшек занимает не менее шести месяцев, а в более коротких экспериментальных протоколах обычно используется западная диета21. Большая часть холестерина плазмы циркулирует в частицах ЛПНП, что дает huBL мышей более человека, как дислипидемический профиль липопротеинов по сравнению с Apoe-/- и Ldlr-/- мышей. HuBL мышей также позволяют исследования человека апоБ как аутоантиген22.
Мышиные модели атеросклероза развивают сложные атеросклеротические бляшки с общими особенностями болезни человека. Тем не менее, бляшки довольно устойчивы к разрыву с последующим инфарктом миокарда. Атеротромбоз только время от времени обнаружены и экспериментально сложной для оценки23,24,25. Разработаны специальные модели разрыва бляшек, но в экспериментальном поле отсутствует надежная и воспроизводимая модель для оценки стабилизирующих средств налета.
Количественная оценка атеросклероза была зарегистрирована во многих отношениях в литературе. Недавние усилия пытались стандартизировать экспериментальный дизайн, выполнение и отчетность исследований на животных26. Следователи имеют различные предпочтения и методы, адаптированные к их лабораториям. Большинство исследовательских проектов также уникальны таким образом, что они требуют некоторых изменений протокола. Из-за многофакторного характера заболевания оптимальный контроль варьируется в зависимости от проекта. Местные условия и отсутствие стандартизации могут вызывать наблюдаемые различия в развитии болезней, что препятствует развитию научно-исследовательской области. Различия в экспериментальной изменчивости также означают, что расчеты статистической мощности должны основываться на экспериментальных исследованиях в местных условиях.
Количественная оценка атеросклероза рекомендуется в нескольких местах в сосудистом дереве. Этот протокол описывает, как получить результаты от корня аорты, аортальной арки, и брахиоцефалической артерии в одной мыши, в дополнение к оставляя остальную часть торакоабдоминальной аорты для других анализов. En лица препараты позволяют быстрой количественной оценки липидных нагруженные бляшки в аорты арки. Бремя болезни в брахиоцефалической артерии также может быть количественно, если образцы тщательно отображаются. Чем больше времени занимает поперечное сечение корня аорты оставляет несколько разделов, доступных для детальной оценки состава бляшек.
протокол
Все эксперименты на животных требуют одобрения этических властей.
1. Мышь жертвоприношения и микродиссекции аорты
- Пожертвуйте мышью CO2 удушьем и рекордным весом.
- Спрей мыши с 70% этанола, чтобы избежать меха загрязнения образцов. Поместите мышь в положение на спине. С яремной выемки, сделать разрез средней линии с помощью ножниц Майо расширения его почти до лобковой кости.
ПРЕДЕКТО: Высокий процент этанола является легковоспламеняющимся и может вызвать серьезное раздражение глаз. Примите меры предосторожности. - Используйте 23 G иглу, чтобы exsanguinate мыши сердечный прокол через грудную клетку. Эта процедура обычно дает 750 л крови от 20-недельной мыши. Как правило, собрать половину объема в три калия ЭДТА покрытием трубки, а другая половина в сыворотке или литие в трубке с покрытием гепарина. Аккуратно поверните трубки и держите их при комнатной температуре до дальнейшей обработки.
- Используйте ножницы Майо, чтобы сократить теменной брюшной брюшной полости в средней линии, чтобы открыть брюшной полости. Держите процесс xiphoid с щипками ткани и отрезать вскрыть брюшной потрошение боково с обеих сторон и продолжать открывать диафрагму.
- Используйте ножницы Майо, чтобы открыть грудную полость, прорезая грудную клетку как можно более боковую клетку. Это позволит широкие углы для инструментов в то время как микрорасчленения аорты позже.
- Сделайте разрез в правом ушном раковине для дренажа перфузионной жидкости. Вставьте 27 G иглу через вершину сердца в направлении черепа. Держите иглу фиксированной в левом желудочке в то время как медленно пронизывает мышь с 10 мл льда ледяной фосфат буферной солевой (PBS) в течение минимум 2 мин. Наблюдайте печени смещения в цвет и получать бледнее.
ПРИМЕЧАНИЕ: Некоторые протоколы используют перфузию параформальдегида, но это мешает нескольким приложениям вниз по течению, таким как иммуногистохимия анализа лимфоцитов. Поэтому в этом протоколе не проводится перфузионная фиксация параформальдегида. - Рассекать интересующие органы (например, лимфатические узлы, селезенку, печень, кишечник, паховые жировые площадки, почки и т.д.) с помощью анатомических щипцы и вскрытия ножниц.
- Вырезать трахею и пищевод на правой стороне сердца, не повреждая аорты арки. Вырезать диафрагмы и структур, прикрепляющих внутренности к retroperitoneum, оставляя сердце, аорта, и почки на месте. Сложите легкие и внутренности caudally и покрыть их салфеткой, чтобы начать ретроперитонеальный микродиссецид парааортических лимфатических узлов и брюшной аорты.
- Начните микродиссекцию под стереомикроскопом при 6-x увеличении. Начните вскрывать аортатической бифуркации, поднимая окружающие ткани с щипцы Дюмон и резки под напряжением с Ножницами Vannas.
- Продолжить вскрытие брюшной аорты кранистом. Вырежьте брюшные ветви из аорты и освободите аорту проксимально через аортальный перерыв в диафрагме.
ПРИМЕЧАНИЕ: Микродиссекция требует точной координации рук и глаз через стереомикроскоп, который занимает некоторую практику, чтобы освоить.
- Продолжить вскрытие брюшной аорты кранистом. Вырежьте брюшные ветви из аорты и освободите аорту проксимально через аортальный перерыв в диафрагме.
- Удалите жировую ткань, покрывающую грудную аорту. Тщательно вскрыть дорсалли тимуса, чтобы освободить аорты арки с ветвями. Продолжайте вскрывать сонную артерию как можно более дистативно в грудной полости. В особых случаях вскрытие шеи может быть выполнено, чтобы включить сонной бифуркации.
- Очистите приборы путем последовательных полосканий в деионизированной воде, RNase обеззараживания решение, 70% этанола, и PBS до фактического резки аорты. Поднимите сердце вершиной с щипками. Вырезать аорту близко к сердцу и поместить все сердце в трубку с PBS. Сердце может храниться на льду в течение нескольких часов, прежде чем продолжить обработку и криомонтаж корня аорты.
- Вырезать аорты арки в соответствии с рисунком 1A. Положите аортальную арку в трубку, содержащую 1 мл 4% формальдегида на ночь при 4 градусах Цельсия. Образец может храниться таким образом в течение нескольких лет, прежде чем закрепления и анализа.
ПРЕДЕКТО: Формальдегид может вызвать рак, аллергические кожные реакции, и вредно при проглатывании. При необходимости используйте средства индивидуальной защиты. - Вскрыть оставшиеся нисходящие аорты и поместить его в раствор стабилизации РНК или оснастки заморозить его для последующего анализа РНК или другого применения. Оптимизация рабочего потока для минимизации времени вскрытия имеет решающее значение для предотвращения чрезмерной деградации РНК.
- Положите трубки для сбора крови (собранные в шаге 1.3) в центрифугу. Спин вниз отдельных плазменных и сывороточных труб на 1500 х г в течение 15 минут при комнатной температуре. Аккуратно перенесите плазму и сыворотку в микроцентрифугные трубки и храните при -80 градусах Цельсия. Сбор как EDTA и гепарина плазмы или сыворотки оставляет возможности для нескольких приложений вниз по течению.
- Поместите сердце на пробковую кровать с брюшной стороной вверх. Закрепите сердце пробкой иглой через вершину. Держите основание сердца с анатомическими щипками.
- Используйте скальпель, чтобы отрезать атлетические 2/3 сердца с направлением разреза в качестве линии между двумя ушами с скальпелем под углом 20 "caudally в сагитальной плоскости и 20" cranially в поперечной плоскости (Рисунок 1B).
- Встраивайте корень аорты в оптимальное соединение резки (OCT), которое окружает, но не проникает в ткани. Погрузите основание сердца в соединение OCT. Аккуратно сожмите сердце щипками, чтобы заполнить корень аорты с OCT и удалить любые пузырьки воздуха.
- Перенесите образец на дно криомолда, наполненного OCT. Корень аорты теперь должен быть перпендикулярно нижней поверхности. Положите установленное сердце на сухой лед, чтобы заморозить. Храните образцы в мешках с замком на молнии в -80 градусов по Цельсию до тех пор, пока не проводит криосекции в соответствии с разделом 3 в этом протоколе.

Рисунок 1: Сердце и аортальная арка на месте. (A) Легкие, трахея, пищевод, и тимуса удаляются для отображения аорты арки на месте в 20 недель женщины Apoe-/- мышь на регулярной диете чау в микрографе, шкала бар 2 мм. Пунктирные линии указывают, где вырезать аортированную арку и ее ветви. (B) Схематическое изображение сердца и аорты. Пунктирная линия красным цветом указывает, где разрезать сердце перед криомонтажом корня аорты. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
2. Ан анализ лица аортальной арки и брахиоцефалической артерии
- Подготовьте прижимая кровати для en анализа лица аорты арки. Сложите сегмент парафиновой восковой пленки восемь раз, чтобы сделать плоскую поверхность 25 мм х 25 мм. Оберните его черной электрической изоляционной лентой, чтобы сделать темный фон для аорты. Поместите этикетку на обратной стороне прикалывающей кровати и используйте свинцовые карандаши, чтобы написать идентификационный номер мыши (нормальные чернила пера исчезнут в процессе окрашивания).
- Перенесите аортальная арка на прижимную кровать и поместите каплю PBS на нее. Начните очистку аорты от оставшейся периавантюрной жировой ткани под стереомикроскопом.
- Используйте ножницы Vannas и щипцы Dumont, чтобы аккуратно отслаивать все окружающие жировые ткани, не манипулируя и не повреждая аорту. Судан IV будет пятно жировой ткани ярко, и очень важно, чтобы удалить все такие ткани на данный момент.
ПРИМЕЧАНИЕ: Держите аорту влажной во все времена применения дополнительных PBS, когда это необходимо.
- Используйте ножницы Vannas и щипцы Dumont, чтобы аккуратно отслаивать все окружающие жировые ткани, не манипулируя и не повреждая аорту. Судан IV будет пятно жировой ткани ярко, и очень важно, чтобы удалить все такие ткани на данный момент.
- Отрежьте аорту в корональной плоскости, введя ножницы Vannas в просвет аорты, чтобы разоблачить интимальную поверхность. Начните резать внешнюю кривизну восходящей арки в дистальном направлении и продолжайте разрезать ветви, включая брахиоцефалическую артерию. Избавьтесь от торсовой части нисходящей грудной области.
- Откройте меньшую кривизну и сложите аорту, чтобы отобразить интимальную поверхность.
ПРИМЕЧАНИЕ: Этот шаг требует мелкой моторики и требует некоторой практики, чтобы освоить.
- Откройте меньшую кривизну и сложите аорту, чтобы отобразить интимальную поверхность.
- Прикрепите открытую арку к прижимающей кровати, используя тупой конец булавок насекомых minutien. Используйте микро Castroviejo держатель иглы поставить булавки на месте. Аккуратно согните булавки от образца, когда на месте. Прикрепите аорту на кровать, не растягивая образец. Храните закрепленную арку, обращенную вниз, в чашке Петри, наполненной PBS при 4 градусах Цельсия.
ПРИМЕЧАНИЕ: Протокол можно приложить здесь. - Подготовьте рабочее решение Судана IV. Смешайте 1 г порошка Судана IV, 100 мл 70% этанола и 100 мл ацетона в темной бутылке и аккуратно перемешайте в течение 10 мин. Нет необходимости фильтровать раствор, и его можно использовать в течение нескольких месяцев, если он стемнеет при комнатной температуре. Если окрашивание цвета не является удовлетворительным, новое решение может быть сделано и образцы окрашенных снова.
ПРЕДЕКТО: Ацетон является легковоспламеняющейся жидкостью, которая может вызвать серьезное раздражение глаз. Хранить в хорошо проветриваемом месте и принимать меры предосторожности при обращении. - Упорядочить пять блюд Петри на лабораторной скамейке: один заполнен 70% этанола, один заполнен Судан IV рабочего решения, два заполнены 80% этанола, и один заполнен PBS.
- Начните с промывки образца в 70% этанола в течение 5 минут, поместив прикалкум в первой чашке Петри с аркой, обращенной вниз. Перенесите образец в рабочее решение Sudan IV и дайте ему запятнать арку на 7 минут.
- Далее, промыть в 80% этанола в течение 3 минут дважды, чтобы дестананормальная нормальная интимальная поверхность. Время дестабилизации может быть скорректировано для оптимизации результатов. Наконец, промыть в PBS, прежде чем положить образец обратно в оригинальное блюдо Петри.
- Приобретайте микрографы с помощью стереомикроскопа в 10 раз больше, связанное с цифровой камерой. Сфотографируйте закрепленную арку, погруженную в PBS, используя небольшие металлические веса (20 мм х 10 мм х 5 мм), чтобы держать прижимную кровать на дне чашки Петри. Поместите линейку рядом с аортой для калибровки изображения.
- Используйте программное обеспечение для анализа изображений (например, ImageJ) для определения области поражения и общей интимной поверхности. При отсутствии анатомических ориентиров для определения аортальной арки измерение обычно проводится от начала восходящей аорты до первой межреберной ветви(рисунок 2А). Используйте функцию количественной оценки области в программном обеспечении, чтобы вручную окружить общую область интимной арки.
ПРИМЕЧАНИЕ: Квантовая оценка поражения должна быть сделана в ослепленном способе и целесообразно что второй исследователь подтверждает результаты.- В ImageJ выберите инструмент выбора полигона и окружите общую площадь арки повторяющимися щелчками. Затем выберите меру в меню анализа, чтобы отобразить общую площадь арки в окне результата.
- Затем окружите все суданIV окрашенные таблички в арке. Судан IV является лисохром диазо краситель, который пятна липидов, триглицеридов и липопротеинов с оранжево-красным цветом. В ImageJ выберите инструмент выбора от руки и окружите все бляшки при нажатии клавиши Alt. Нажмите меру в меню анализа, чтобы отобразить область арки без поражений в окне результата.
- Рассчитайте относительную область поражения, вычитая область, свободную от поражения, из общей площади арки, а затем разделив результат с общей площадью арки.
- Тщательно прикрепите подклавиновые и сонные артерии, чтобы обеспечить количественную оценку поражения в брахиоцефалической артерии (рисунок 2A). Количественная оценка поражений в подклавианных артериях и общих сонных артериях, как правило, очень сложная и не имеет смысла, соответственно.
- В ImageJ окружите обе части брациоцефалической артерии, используя инструмент выбора полигона при нажатии клавиши смены. Нажмите меру в меню анализа, чтобы отобразить общую область брахиоцефалической артерии в окне результата.
- Затем выберите инструмент выбора от руки и окружите все бляшки в брахиоцефалической артерии, нажав на клавишу Alt. Нажмите меру в меню анализа, чтобы отобразить область брахиоцефалической артерии в окне результата.
- Рассчитайте относительную область поражения, вычитая область, свободную от поражения, из общей области брахиоцефалической артерии, а затем разделив результат с общей областью брахиоцефалической артерии.

Рисунок 2: Атеросклеротическая оценка поражения. (A) А ) Аорты арки из 20 недель мужчины ЧЕЛОВЕКА APOB100-трансгенных Ldlr-/- (HuBL) мышь кормили западной диеты в течение десяти недель возлагали открытыми и окрашенных для липидов богатых бляшек с Суданом IV. Общая площадь аортальной арки очерчена пунктирной линией в белом на микрографе, шкала бар 2 мм. Пунктирные линии в желтом контуре общей площади поверхности брахиоцефалической артерии. (B) аорты корень поперечного сечения на 400 мкм от аорты синуса в 20 недель мужчина Ldlr-/- мышь кормили западной диеты в течение восьми недель визуализированы в микрографе, шкала бар 500 мкм. Пунктирные линии в черном контуре общей площади судна и атеросклеротических поражений окрашенных маслом Red O локализованы в артериальной интиме. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
3. Криосекция корня аорты
- Установите температуру криостата при -20 градусов по Цельсию и толщину сечения до 10 мкм. Установите блок OCT, содержащий корень аорты на держателе образца, с желудочковой тканью, обращенной наружу. При начале разреза, тонкой настройки выравнивания поверхности секции, чтобы быть параллельным образца держателя.
- Удалите чрезмерное окружающее OCT, чтобы было легче собирать секции без складок. Корень аорты теперь должен быть расположен перпендикулярно лезвию ножа, учитывая, что основание сердца было помещено правильно в форму.
- Соберите начальные разделы управления на обычных слайдах микроскопа, которые будут отброшены. Первые разделы должны содержать только мышечную ткань сердца. Прогресс секции на 200 мкм в то время. Соберите секцию и проверьте ход работ ы с помощью светового микроскопа.
- При приближении к левому желудочку оттока, проверить каждые 100 мкм под микроскопом. При наблюдении первоначальных признаков стенки судна замедлите темп до 50 мкм.
ПРИМЕЧАНИЕ: Когда появляется первый аортачный пик, это будет нулевой точкой для сбора разделов. Это может быть трудно понять, когда cusps появляются точно, но точная локализация имеет решающее значение для выполнения сравнения поражений в том же регионе. -
Наклоните образец к точке нулевой порог, чтобы выровнять плоскость раздела с двумя другими cusps. Это имеет решающее значение для получения истинных поперечных сечений аорты. Сделайте рисунок корня аорты, указывая cusps, как они появляются, и рассчитывать каждые 10 мкм раздел, которые вырезаны из точки нуля и далее.
- Когда появляется второй порог, слегка наклоните образец снова от порога, чтобы выровнять образец с третьим порогом. Разница в уровне между cusps не должна превышать 50 мкм. Начните собирать участки на слайдах от уровня 90 мкм и далее.
- Сбор разделов в соответствии с слайд планирования в Рисунке 3. Сбор секций может быть начат с 190 мкм, если корень аорты более 50 мкм наклонен, чтобы позволить дальнейшее пространство для выравнивания корня в прямом положении. Продолжайте сечение до достижения уровня 800 мкм от точки нуля. Если на этом уровне все еще есть видимые таблички, коллекция может быть расширена до 1000 мкм.
ПРИМЕЧАНИЕ: Упрощенная организация слайдов представлена на дополнительнойрисунке 1, что может увеличить скорость секции. Оптимальное планирование слайдов должно определяться в зависимости от плана проекта.
-
Исправьте разделы после сбора.
- Исправить разделы, собранные для oil Red O окрашивания и Picrosirius красное окрашивание коллагена в 4% формальдегида в течение 10 мин. Промыть в деионизированной воды, сухой, и хранить в комнатной температуре до достижения с разделом 4 в этом протоколе. Если горки должны быть окрашены маслом Red O сразу и по-прежнему мокрые, поместите их в 60% изопропанол в течение 1 мин, чтобы ускорить процесс сушки.
ПРЕДЕКТО: Изопропанол является легковоспламеняющейся жидкостью, которая может вызвать серьезное раздражение глаз и может вызвать сонливость или головокружение. Хранить в хорошо проветриваемом месте и принимать меры предосторожности при обращении. - Зафиксировать секции, собранные для иммуногистохимии или иммунофлуоресценции в ледяном чистом ацетоне в течение 10 мин. Сухой при комнатной температуре в течение 30 мин. Хранить секции в -20 градусов по Цельсию.
- Исправить разделы, собранные для oil Red O окрашивания и Picrosirius красное окрашивание коллагена в 4% формальдегида в течение 10 мин. Промыть в деионизированной воды, сухой, и хранить в комнатной температуре до достижения с разделом 4 в этом протоколе. Если горки должны быть окрашены маслом Red O сразу и по-прежнему мокрые, поместите их в 60% изопропанол в течение 1 мин, чтобы ускорить процесс сушки.
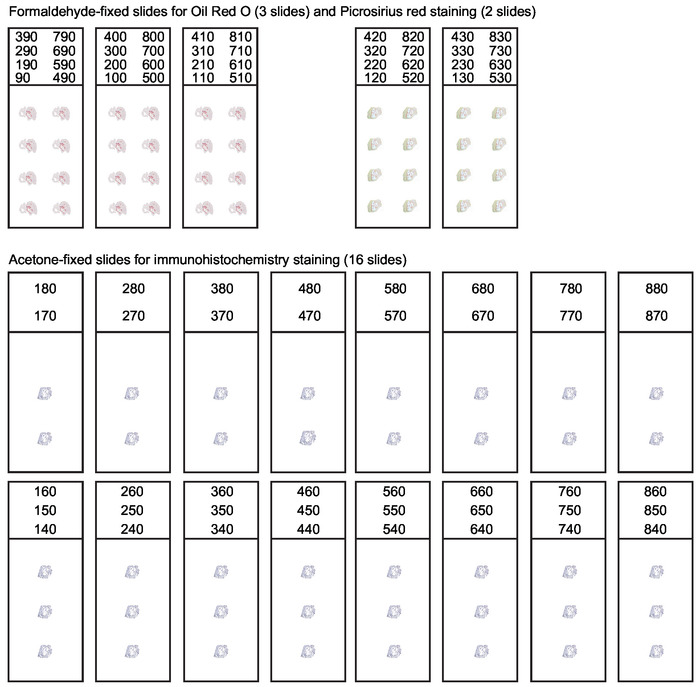
Рисунок 3: Организация слайдов для серийных секций корня аорты. Во время криосекции корня аорты каждые 10 мкм толщиной раздел, охватывающий первые 800 мкм восходящей аорты должны быть собраны. Для получения подходящих секций для различных приложений необходима систематическая организация слайдов. Анализ состава поражения обычно включает в себя масло Красный O окрашивания для липидов и Picrosirius красный окрашивание для коллагена. Остальные секции собираются и ацетон-фиксируется для иммуногистохимии и иммунофлуоресценции окрашивания. Эта цифра была изменена от Гистере и др. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
4. Нефть Красный O окрашивание и количественификация атеросклероза в аортальных корней
- Приготовьте насыщенный раствор Oil Red O, растворив 1 г масла Red O в 100 мл изопропанола. Перемешать раствор в темной бутылке в течение 1 часа при комнатной температуре. Насыщенный раствор можно хранить в течение нескольких месяцев.
ПРИМЕЧАНИЕ: Целесообразно иметь специальное лабораторное оборудование для окрашивания Oil Red O, так как трудно чистить оборудование, которое находится в контакте с раствором. - Подготовьте рабочее решение, перемешив7 55 мл насыщенного раствора Oil Red O с 50 мл деионированной воды. Пусть стоять в комнатной температуре в течение 10 мин. Фильтр через качественную фильтровальную бумагу.
- Поместите горки в oil Red O рабочим раствором на 20 мин. Промыть в водопроводной воде в течение 5 минут.
- Чтобы помочь визуализации тканей, пятно с гематоксилин Майера в течение 1 мин. Промыть в теплой водопроводной воды в течение 5 мин. Все ядра теперь должны быть окрашены в синий цвет, настроить время окрашивания для оптимизации результата.
- Горные горки в водной монтажной среде (например, глицерол желатин кайзера). Теплый глицерол желатин кайзера до 40 градусов по Цельсию, чтобы сделать его жидкостью перед использованием. Нет необходимости сушить горки, так как монтажная среда основана на воде. Будьте осторожны, чтобы избежать образования пузырьков воздуха при добавлении крышки стекла.
ПРЕДЕКТО: Глицерол желатин кайзера содержит фенол, который подозревается в причинении генетических дефектов. При необходимости используйте средства индивидуальной защиты. - Приобретайте цифровые микрографы с помощью камеры, подключенной к световому микроскопу. Обычно полная стена сосуда и границы поражения могут быть четко визуализированы в 50 раз больше. Сохранить изображения с высоким разрешением, предпочтительно в формате тегами файлов изображений (TIFF).
- Выполняйте анализ размера поражения с помощью компьютерной системы анализа изображений. Масло Red O является лизохром диазо краситель, который пятна нейтральных липидов и визуализирует атеросклеротические бляшки с интенсивным красным цветом, который помогает квадроции поражения.
ПРИМЕЧАНИЕ: Количественная оценка поражения должна быть сделана в ослепленном способе, и желательно, чтобы второй следователь подтвердил полученные результаты.- Используйте функцию количественной оценки области в программном обеспечении для анализа изображений для определения общей площади судна, окружая внешнюю эластичную ламину стенки аортального сосуда(рисунок 2B). В ImageJ выберите инструмент выбора полигона и окружите область повторяющимися щелчками. Затем выберите меру в меню анализа. Общая площадь судна отображается в окне результата.
- Продолжайте количественно определять атеросклеротические поражения в интимальном слое сосуда, определяемого внутренней эластичной ламиной и световой границей. Обычно поражения на клапанных cusps исключаются из измерения27. В ImageJ выберите инструмент выбора от руки и окружите все бляшки при нажатии клавиши Alt. Выберите меру в меню анализа, чтобы отобразить область судна без поражений в окне результата.
- Рассчитайте относительную площадь поражения, вычитая область, свободную от поражения, из общей площади судна, а затем разделив результат с общей площадью судна.
ПРИМЕЧАНИЕ: Калибровать результаты в программном обеспечении анализа изображений в соответствии с использованным увеличением для получения абсолютной площади поражения в квадратный микрометр.
- Определите область Oil Red O-stained в области поражений с помощью функции цветового порога в программном обеспечении для анализа изображений для расчета процента положительной области Oil Red O от общей области поражения.
- В ImageJ окружите всю область поражения, используя инструмент выбора от руки при нажатии клавиши смены. Выберите меру в меню анализа для отображения общей области поражения в окне результата.
- Выберите четкое снаружи в меню для отсеиваний. Измените тип изображения на 8-битный в меню изображения.
- Установите красный порог для отрицательной области Oil Red O, выбрав порог в настройке подменю меню изображения. Нажмите применить. Сделайте изображение двоичным, выбрав эту опцию в двоичном подменю меню процесса.
ПРИМЕЧАНИЕ: Обычно масло Красный O окрашивание варьируется между партиями. Таким образом, цветовой порог рекомендуется только в той же партии окрашивания. Результат должен быть представлен вместе с описанием того, как порог определяется и стандартизируется. - Проанализируйте картинку, выбрав анализировать частицы в меню анализа и нажмите ОК. Общая область отрицательного поражения масла Red O теперь отображается в сводном окне. Рассчитайте относительную положительную область Oil Red O, вычитая отрицательную область Oil Red O из общей области поражения, а затем разделив с общей площадью поражения.
Результаты
В моделях мыши атеросклероза наиболее заметные поражения, как правило, развиваются в корнях аорты и аорты арки. Этот протокол описывает количественную оценку атеросклероза в корнях аорты, аортальной арке и брахиоцефалической артерии в одной мыши. Измеримые поражения в грудной нисходящей аорты и брюшной аорты присутствуют только у животных с заранее болезни. В этом протоколе эти части не анализируются на атеросклеротические нагрузки, а сохраняются для последующего анализа уровней мРНК или других анализов. Серийные участки атеросклеротических поражений в корнях аорты обычно отображаются на графике с размером поражения на y-оси и расстоянием до синуса аорты на x-оси28. Истинные поперечные сечения имеют решающее значение для количественной оценки размера поражения. Косые секции могут переоценить размеры поражений и наклона только 20 "может переоценить абсолютную поверхность поражения на 15%29. Тем не менее, расчет доли поражения общей площади судна делает результат менее чувствительным к возможным различиям угла во время секции(рисунок 4A). Соответствующий статистический метод для выявления различий между группами, как правило, регулярный 2-путь анализа дисперсии (ANOVA). Затем послетесты Bonferroni проводятся для выявления различий на определенных уровнях. Наименее существенная разница Фишера может также использоваться в качестве последующего теста для ANOVA. Это снижает вероятность статистических ошибок типа II, но не учитывает несколько сравнений. Кроме того, это может быть иллюстративным для расчета площади под кривой или средний размер поражения на мышь и представить данные в точка участка для дальнейшей визуализации отдельных изменений в группах (Рисунок 4B).
Масло Red O - жирорастворимый ярко-красный диазокрас, который окрашивает нейтральные липиды. Полярные липиды в клеточных мембранах не окрашены. Масло Red O окрашивание может быть выполнено на свежих, замороженных или формалина фиксированной образцов, но не на парафина встроенных образцов из-за удаления липидов в процессе требуемой депарафинизации. Количественная оценка накопления поражений липидов может быть выполнена путем цветового порога положительной области oil Red O общей области поражения(рисунок 4C). Гематоксилин производит голубое окрашивание ядер клеток, что полезно визуализировать морфологию бляшек. Правые и левые коронарные артерии обычно расходятся с аортой около 250 мкм от аортальной синуса27, которые часто совпадают с наиболее заметными размерами поражения. Поперечные сечения из этого региона часто отображаются в качестве репрезентативных результатов(рисунок 4D).

Рисунок 4: Атеросклеротические поражения в корнях аорты. (A) Двадцать восемь недель мужчины химер костного мозга кормили западной диеты в течение восьми недель были оценены, чтобы определить влияние Smad7-дефицитНыхТ-клеток на развитие атеросклероза. Экспериментальные Ldlr-/- химеры получили Cd4-Cre ssmad7fl/fl костного мозга и контроля получил Cd4-Cre smad7fl / " костный мозг. На графике показана количественная оценка области атеросклеротического поражения из восьми последовательных секций, 100 - 800 мкм от аортального синуса, отображаемого как часть поражения общей поверхности судна (Cd4-CreиSmad7fl/'/Ldlr-/- n'6, Cd4-CreиSmad7 fl/fl/Ldlr-/- n No 9, 2-путь ANOVA с послетестом Bonferroni, график показывает среднее ЗНАЧЕНИЕ SEM, скобки указывают уровень значимости для сравнения напряжения). (B) Комбинированный точка сюжета и бар график показывает среднее атеросклеротическое поражения области из аорты корневых разделов (Cd4-Cre smad7fl //Ldlr-/- n'6, Cd4-Cre sSmad7fl/fl/ Ldlr-/- n no 9, Студенческий т-тест) (C) Фракция нефти Красный O-окрашенные области в поражениях (Cd4-Cressmad7fl /Ldlr-/- n No 4, Cd4-CresSmad7fl/fl /Ldlr-/- n No 6, Студенческий т-тест, нс-не-значительный) (B-C) Точки представляют отдельные мыши и бары показывают среднее значение ЗСЭМ. (D) Представитель микрографов, показывающих масло Red O окрашивания (в красном цвет) нейтральных липидов в корень аорты 300 мкм от синуса аорты (50x увеличение), Шкала бар 500 мкм. Эта цифра была изменена от Гистере и др.31. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Масло Red O может быть использован для окрашивания ан лицо подготовлены аорты, но этот протокол использует Судан IV, другой удобный жирорастворимый диазо краситель. Судан IV четко визуализирует атеросклеротические бляшки оранжево-красного цвета путем окрашивания липидов, триглицеридов и липопротеинов. Удаление темного фона в репрезентативных изображениях аортических арок en face может повысить визуальный дисплей(рисунок 5A). Обычно размер поражения обычно распределяется по группам, что позволяет проводить статистическое тестирование с помощью t-test студента между группами. Точка сюжет, который показывает, как отдельных мышей и среднее, которое сравнивается между группами, является информативным способом для отображения результатов(рисунок 5B-C). Поскольку вариации в группах, как правило, различны между местами в сосудистом дереве, обычно необходимы отдельные расчеты мощности. Ненужных изменений можно избежать путем повышения квалификации метода и стандартизации протокола. Получение статистически значимых результатов имеет важное значение, но биологическая значимость наблюдаемой разницы всегда должна быть рассмотрена также.
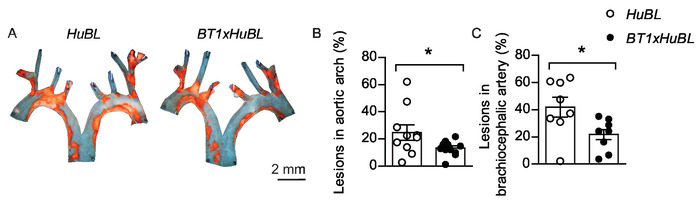
Рисунок 5: Атеросклеротические поражения в аортальной арке и брахиоцефалической артерии. (A) Представитель ан лицо микрографов аорты арки с липидными нагруженные бляшки окрашенных Судан IV (в оранжевом цвете) от 20 недель мышей кормили западной диеты в течение десяти недель, визуализированные вместе. Шкала бар 2 мм. Человек APOB100-трансгенных Ldlr-/- (HuBL) мышей были использованы в качестве контроля и экспериментальной группы состояла из TCR-трансгенных мышей с ЛПНП-реактивных Т-клеток (BT1) перекресток к huBL мышей. (B) Атеросклеротические поражения в аортированной арке (HuBL n 10, BT1xHuBL n 12; Студенческий t-тест). (C) Атеросклеротические поражения в брахиоцефалической артерии (HuBL N No 8, BT1xHuBL n No 9, Студент т-тест). (B-C) Точки представляют отдельных мышей, бары показывают среднее (SEM. Эта цифра была изменена от Гистере и др.32. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительная рисунок 1: Альтернативная организация слайдов для серийных секций корня аорты. Упрощенная систематическая организация слайдов для сбора секций из корня аорты. Коллекция позволяет масло Красный O окрашивания для липидов и иммуногистохимии или иммунофлуоресцентного окрашивания. Выделенные слайды для Picrosirius красный окрашивание коллагена опущены. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Сердечно-сосудистые заболевания является основной причиной смерти в мире и новые профилактические измерения необходимы2. Мышиные модели заболевания обеспечивают комплексную платформу для исследования патофизиологии и экспериментального лечения13. Для такого подхода необходима количества надежного поражения. Однако методы количественной оценки различаются между лабораториями. Стандартизация и оптимизация были непрерывным процессом с 1980-х годов13,27,33,34. Корни аорты стали самым популярным местом количественной оценки экспериментального атеросклероза. Поперечные сечения бляшек позволяют сравнивать объем бляшек между группами. En лицо препараты благоприятствования для поражения количественной оценки в больших сегментах аорты. Метод en face визуализирует количество налета и позволяет количественно определить покрытие площади бляшки, но не учитывает толщину бляшек. Биологическая значимость наблюдаемых различий подтверждается согласованными результатами в разных местах сосудистого дерева. Оценка развития атеросклероза в разных местах направлена на устранение возможных специфических эффектов. Влияние пересаженных гематопоитических клеток на развитие атеросклероза можно оценить в гиперхолестеринемом Лдлере-/- химерах. Тем не менее, облучение всего тела влияет на процесс атеросклероза с конкретными эффектами сайта. Более заметные атеросклеротические поражения развиваются в корнях аорты, в то время как снижение развития поражения наблюдается в аортических арках35.
Важно отметить, что необходимо учитывать не только размер поражения при изучении экспериментального атеросклероза. Композиция из лежа также является ключевым параметром. Несколько особенностей бляшки были связаны с проявлениями заболевания у людей36. Серийное сечение корня аорты оставляет несколько участков, доступных для тщательного анализа состава бляшек. Разрыв бляшек у человека характеризуется тонкой волокнистой крышкой с несколькими гладкими мышечными клетками, редким содержанием коллагена и признаками воспаления в бляшках36. Хотя разрыв налета является редким событием в мышиных моделях атеросклероза, маркеры стабильности бляшки являются информативными для оценки. Переводные подходы могут подтвердить механистические выводы из моделей мыши и выявить важные особенности болезни человека31. Воспалительный статус атеросклеротических бляшек можно определить путем иммуногистохимии окрашивания VCAM-1, MHC класса II, макрофагов и лимфоцитов30. Некоторые протоколы используют продольные секции в корональной плоскости аортальной арки или брахиоцефалической артерии для измерения размера атеросклеротического поражения и состава37. Однако этот альтернативный метод оставляет лишь несколько разделов для анализа, что ограничивает его применение.
Первоначальным важным шагом в этом протоколе является способность эффективно собирать аорты. Координация рук и глаз под микроскопом требует практики и имеет решающее значение как для микрорассечения, так и для последующего закрепления аорты арки. Следующим важным шагом в этом протоколе является сбор серийных разделов из корня аорты. Восемьдесят последовательных разделов должны быть собраны для каждой мыши, которая требует как фокус и терпение. Методологическая квалификация может значительно ускорить описанные процессы. Тем не менее, атеросклеротическая оценка поражения по-прежнему занимает много времени. Новая технология, автоматизированная обработка и визуализация мелких животных могут способствовать количественной оценке экспериментального атеросклероза в будущем. Прогрессирование атеросклероза медленно и большинство экспериментальных протоколов в моделях мыши занять более четырех месяцев, чтобы завершить13. Поэтому аорты должны быть собраны оптимизированным способом в конечных точках исследования. Этот протокол обеспечивает всеобъемлющее руководство для сбора аорты эффективно и предлагаемой обработки готовит аорты для многоцелевого использования, включая поражения количественного поражения в корень аорты, аортальной арки, и брахиоцефалической артерии. Надеемся, что протокол может уменьшить экспериментальную изменчивость, повысить надежность результатов, и привести к выводам, которые проложат путь для новых методов лечения атеросклероза.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим всех прошлых членов экспериментального подразделения сердечно-сосудистых исследований Герана К Ханссона, которые помогли разработать этот протокол на протяжении последней четверти века. Мы особенно признательны за вклад Антонино Николетти, Синхуа Чжоу, Анны-Карин Робертсон и Ингер Бодин. Эта работа была поддержана грантом проекта 06816 и поддержкой Linnaeus 349-2007-8703 от Шведского научного совета, а также грантами Шведского фонда сердца-лунга, Стокгольмского окружного совета, фонда профессора Нанны Сварц, Лоо и Ханса Остермена Фонд медицинских исследований, Научно-исследовательский фонд Каролинского института и Фонд гериатрических заболеваний Каролинского института.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetone | VWR Chemicals | 20066.296 | For fixation of sections for immunohistochemistry. |
| Black electrical insulation tape (50 mm wide) | Any specialized retailer | - | To create pinning beds for aortic arches. |
| Centrifuge | Eppendorf | 5417C | Benchtop microcentrifuge. |
| Cork board | Any specialized retailer | - | For cutting hearts in the preparation to cryomount aortic roots. |
| Cryostat | Thermo Scientific | Microm HM 560 | For serial cryosectioning of aortic roots. |
| Deionized water | - | - | For rinsing and preparation of solutions. |
| Digital camera | Leica Microsystems | DC480 | 5.1 megapixel CCD for high-resolution images of aortic arches and aortic root sections. |
| Dissecting scissors (10 cm, straight) | World Precision Instruments | 14393 | For general dissection of organs. |
| Dumont forceps #5 (11 cm, straight) | World Precision Instruments | 500341 | For microdissection of aorta. |
| Ethanol 70% (v/v) | VWR Chemicals | 83801.290 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Ethanol absolute ≥99.8% | VWR Chemicals | 20821.310 | Highly flammable liquid and vapour, store in a well-ventilated place, and keep cool. |
| Formaldehyde 4% stabilised, buffered (pH 7.0) | VWR Chemicals | 9713.1000 | Harmful by inhalation, in contact with skin and if swallowed. |
| ImageJ | NIH | - | Image analysis software. |
| Iris forceps (10 cm, curved, serrated) | World Precision Instruments | 15915-G | Used as anatomical forceps. |
| Isopropanol | Merck | 1096341011 | Flammable liquid, causes serious eye irritation, and may cause drowsiness or dizziness. |
| Kaiser's glycerol gelatine | Merck | 1092420100 | Aqueous mounting medium containing phenol. Suspected of causing genetic defects. |
| Light microscope | Leica Microsystems | DM LB2 | For analysis during sectioning and documentation of Oil Red O stained micrographs. |
| Mayer's hematoxylin | Histolab | 1820 | Non-toxic staining solution without chloral hydrate, but causes serious eye irritation. |
| Mayo scissors (17 cm, straight) | World Precision Instruments | 501751-G | For general dissection. |
| Micro Castroviejo needle holder (9 cm, straight) | World Precision Instruments | 503376 | For pinning of aortic arches. |
| Microcentrifuge tubes | Corning | MCT-175-C | Polypropylene microtubes with snaplock cap. |
| Microlance 3 needles, 23 gauge | BD | 300800 | For blood collection. |
| Microlance 3 needles, 27 gauge | BD | 302200 | For perfusion of mice. |
| Microvette 500 µL, K3 EDTA | Sarstedt | 20.1341.100 | For blood collection. |
| Microvette 500 µL, Lithium Heparin | Sarstedt | 20.1345.100 | For blood collection. |
| Minutien insect pins, 0.10 mm | Fine Science Tools | 26002-10 | For pinning of aortic arches. |
| Oil Red O | Sigma-Aldrich | O0625 | Not classified as a hazardous substance or mixture. |
| Optimum cutting temperature (OCT) cryomount | Histolab | 45830 | For embedding tissue. |
| Parafilm M | Bemis | PM992 | Paraffin wax film used to create pinning beds for aortic arches. |
| Petri dishes (100 mm x 20 mm) | Any cell culture supplier | - | Proposed as a storage container for pinned aortas. |
| Phosphate buffered saline (PBS) | - | - | Sterile and RNase-free solution is required for perfusion of mice. |
| Qualitative filter paper (grade 1001) | Munktell | 120006 | For filtering Oil Red O working solution (typical retention 2-3 µm). |
| RNAlater RNA stabilization reagent | Qiagen | 76106 | For stabilization of RNA in tissue samples |
| RNaseZap RNase Decontamination Solution | Invitrogen | AM9780 | A surface decontamination solution that destroys RNases on contact. |
| Scalpel handle #3 (13 cm) | World Precision Instruments | 500236 | For cutting hearts in the preparation to cryomount aortic roots. |
| Standard scalpel blade #10 | World Precision Instruments | 500239 | For cutting hearts in the preparation to cryomount aortic roots. |
| Stereomicroscope | Leica Microsystems | MZ6 | For dissection and en face documentation |
| Sudan IV | Sigma-Aldrich | S4261 | Not classified as a hazardous substance or mixture. |
| Superfrost Plus microscope slides | Thermo Scientific | J1800AMNZ | To collect aortic root sections. |
| Tissue forceps (15 cm) | World Precision Instruments | 501741-G | For general dissection. |
| Tissue-Tek cryomolds (10 mm x 10 mm x 5 mm) | Sakura | 4565 | For embedding aortic roots in OCT. |
| Vannas scissors (8 cm, straight) | World Precision Instruments | 503378 | For microdissection of aorta. |
Ссылки
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859), 2095-2128 (2012).
- Gistera, A., Hansson, G. K. The immunology of atherosclerosis. Nature Reviews Nephrology. 13 (6), 368-380 (2017).
- Hansson, G. K. Inflammation, atherosclerosis, and coronary artery disease. New England Journal of Medicine. 352 (16), 1685-1695 (2005).
- Williams, K. J., Tabas, I. The response-to-retention hypothesis of early atherogenesis. Arteriosclerosis, Thrombosis, and Vascular Biology. 15 (5), 551-561 (1995).
- Pentikainen, M. O., Oorni, K., Ala-Korpela, M., Kovanen, P. T. Modified LDL - trigger of atherosclerosis and inflammation in the arterial intima. Journal of Internal Medicine. 247 (3), 359-370 (2000).
- Ruuth, M., et al. Susceptibility of low-density lipoprotein particles to aggregate depends on particle lipidome, is modifiable, and associates with future cardiovascular deaths. European Heart Journal. 39 (27), 2562-2573 (2018).
- Nakashima, Y., Raines, E. W., Plump, A. S., Breslow, J. L., Ross, R. Upregulation of VCAM-1 and ICAM-1 at atherosclerosis-prone sites on the endothelium in the ApoE-deficient mouse. Arteriosclerosis, Thrombosis, and Vascular Biology. 18 (5), 842-851 (1998).
- Goldstein, J. L., Ho, Y. K., Basu, S. K., Brown, M. S. Binding site on macrophages that mediates uptake and degradation of acetylated low density lipoprotein, producing massive cholesterol deposition. Proceedings of the National Academy of Sciences of the United States of America. 76 (1), 333-337 (1979).
- Paigen, B., Morrow, A., Brandon, C., Mitchell, D., Holmes, P. Variation in susceptibility to atherosclerosis among inbred strains of mice. Atherosclerosis. 57 (1), 65-73 (1985).
- Russell, E. S. Origins and history of mouse inbred strains: contributions of Clarence Cook Little. Origins of Inbred Mice, Morse, HC, eds. (Academic Press, NY). , 33-43 (1978).
- Waterston, R. H., et al. Initial sequencing and comparative analysis of the mouse genome. Nature. 420 (6915), 520-562 (2002).
- Gistera, A., Ketelhuth, D. F. J. Lipid-driven immunometabolic responses in atherosclerosis. Current Opinion in Lipidology. 29 (5), 375-380 (2018).
- Maganto-Garcia, E., Tarrio, M., Lichtman, A. H. Mouse models of atherosclerosis. Current Protocols in Immunology. Chapter 15, (2012).
- Plump, A. S., et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell. 71 (2), 343-353 (1992).
- Zhang, S. H., Reddick, R. L., Piedrahita, J. A., Maeda, N. Spontaneous hypercholesterolemia and arterial lesions in mice lacking apolipoprotein E. Science. 258 (5081), 468-471 (1992).
- Ishibashi, S., et al. Hypercholesterolemia in low density lipoprotein receptor knockout mice and its reversal by adenovirus-mediated gene delivery. Journal of Clinical Investigation. 92 (2), 883-893 (1993).
- Ishibashi, S., Goldstein, J. L., Brown, M. S., Herz, J., Burns, D. K. Massive xanthomatosis and atherosclerosis in cholesterol-fed low density lipoprotein receptor-negative mice. Journal of Clinical Investigation. 93 (5), 1885-1893 (1994).
- Ketelhuth, D. F., Gistera, A., Johansson, D. K., Hansson, G. K. T cell-based therapies for atherosclerosis. Current Pharmaceutical Design. 19 (33), 5850-5858 (2013).
- Skalen, K., et al. Subendothelial retention of atherogenic lipoproteins in early atherosclerosis. Nature. 417 (6890), 750-754 (2002).
- Boren, J., et al. Identification of the low density lipoprotein receptor-binding site in apolipoprotein B100 and the modulation of its binding activity by the carboxyl terminus in familial defective apo-B100. Journal of Clinical Investigation. 101 (5), 1084-1093 (1998).
- Sanan, D. A., et al. Low density lipoprotein receptor-negative mice expressing human apolipoprotein B-100 develop complex atherosclerotic lesions on a chow diet: no accentuation by apolipoprotein(a). Proceedings of the National Academy of Sciences of the United States of America. 95 (8), 4544-4549 (1998).
- Gistera, A., et al. Vaccination against T-cell epitopes of native ApoB100 reduces vascular inflammation and disease in a humanized mouse model of atherosclerosis. Journal of Internal Medicine. , (2017).
- Johnson, J. L., Jackson, C. L. Atherosclerotic plaque rupture in the apolipoprotein E knockout mouse. Atherosclerosis. 154 (2), 399-406 (2001).
- Calara, F., et al. Spontaneous plaque rupture and secondary thrombosis in apolipoprotein E-deficient and LDL receptor-deficient mice. The Journal of Pathology. 195 (2), 257-263 (2001).
- Caligiuri, G., Levy, B., Pernow, J., Thoren, P., Hansson, G. K. Myocardial infarction mediated by endothelin receptor signaling in hypercholesterolemic mice. Proceedings of the National Academy of Sciences of the United States of America. 96 (12), 6920-6924 (1999).
- Daugherty, A., et al. Recommendation on Design, Execution, and Reporting of Animal Atherosclerosis Studies: A Scientific Statement From the American Heart Association. Arteriosclerosis, Thrombosis, and Vascular Biology. 37 (9), (2017).
- Paigen, B., Morrow, A., Holmes, P. A., Mitchell, D., Williams, R. A. Quantitative assessment of atherosclerotic lesions in mice. Atherosclerosis. 68 (3), 231-240 (1987).
- Purcell-Huynh, D. A., et al. Transgenic mice expressing high levels of human apolipoprotein B develop severe atherosclerotic lesions in response to a high-fat diet. Journal of Clinical Investigation. 95 (5), 2246-2257 (1995).
- Nicoletti, A., Kaveri, S., Caligiuri, G., Bariety, J., Hansson, G. K. Immunoglobulin treatment reduces atherosclerosis in apo E knockout mice. Journal of Clinical Investigation. 102 (5), 910-918 (1998).
- Gistera, A., Ketelhuth, D. F. Immunostaining of Lymphocytes in Mouse Atherosclerotic Plaque. Methods in Molecular Biology. 1339, 149-159 (2015).
- Gistera, A., et al. Transforming growth factor-beta signaling in T cells promotes stabilization of atherosclerotic plaques through an interleukin-17-dependent pathway. Science Translational Medicine. 5 (196), (2013).
- Gistera, A., et al. Low-Density Lipoprotein-Reactive T Cells Regulate Plasma Cholesterol Levels and Development of Atherosclerosis in Humanized Hypercholesterolemic Mice. Circulation. 138 (22), 2513-2526 (2018).
- Daugherty, A., Whitman, S. C. Quantification of atherosclerosis in mice. Methods in Molecular Biology. 209, 293-309 (2003).
- Baglione, J., Smith, J. D. Quantitative assay for mouse atherosclerosis in the aortic root. Methods in Molecular Biology. 129, 83-95 (2006).
- Schiller, N. K., Kubo, N., Boisvert, W. A., Curtiss, L. K. Effect of gamma-irradiation and bone marrow transplantation on atherosclerosis in LDL receptor-deficient mice. Arteriosclerosis, Thrombosis, and Vascular Biology. 21 (10), 1674-1680 (2001).
- Naghavi, M., et al. From vulnerable plaque to vulnerable patient: a call for new definitions and risk assessment strategies: Part I. Circulation. 108 (14), 1664-1672 (2003).
- Seijkens, T. T. P., et al. Targeting CD40-Induced TRAF6 Signaling in Macrophages Reduces Atherosclerosis. Journal of the American College of Cardiology. 71 (5), 527-542 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены