Method Article
Electrocardiografía de superficie In Vivo para pez cebra adulto
En este artículo
Resumen
Aquí, presentamos un método confiable, mínimamente invasivo y rentable para registrar e interpretar electrocardiogramas en peces de cebra adultos anestesiados vivos.
Resumen
Las formas de onda del electrocardiograma del pez cebra adulto y las de los humanos son notablemente similares. Estas similitudes de electrocardiograma mejoran el valor del pez cebra no sólo como modelo de investigación para la electrofisiología cardíaca humana y miopatías, sino también como un modelo sustituto en la detección farmacéutica de alto rendimiento para posibles cardiotoxicidades humanos, como la prolongación del intervalo QT. Como tal, la electrocardiografía in vivo para peces cebra adultos es una herramienta de fenotipado eléctrico que es necesaria, si no indispensable, para caracterizaciones electrofisiológicas in vivo transversales o longitudinales. Sin embargo, con demasiada frecuencia, la falta de un método de grabación fiable, práctico y rentable sigue siendo un desafío importante que impide que esta herramienta de diagnóstico in vivo sea más accesible. Aquí, describimos un enfoque práctico y directo de la electrocardiografía in vivo para peces cebra adultos utilizando un sistema de bajo mantenimiento, rentable y completo que produce grabaciones consistentes y confiables. Ilustramos nuestro protocolo utilizando peces cebra macho adultos sanos de 12-18 meses de edad. También introducimos una rápida estrategia de interpretación en tiempo real para la validación de la calidad para garantizar la precisión de los datos y la robustez al principio del proceso de grabación del electrocardiograma.
Introducción
El corazón del pez cebra (Danio rerio) se encuentra anteroventrally a la cavidad torácica entre el opérculo y las fajas pectorales. El corazón está encerrado bastante holgadamente dentro de un saco pericárdico de color plateado. Anatómicamente, el corazón del pez cebra es diferente de los corazones humanos de cuatro cámaras y otros mamíferos debido a su escala diminuta (100 veces más pequeña que el corazón humano) y su estructura de dos cámaras que consiste en sólo una aurícula y un ventrículo. No obstante, las formas de onda del electrocardiograma (ECG) y laduración del intervalo QT de ambas especies son notablemente similares (Figura 1). En consecuencia, el pez cebra ha surgido como un modelo popular para el estudio de las arritmias heredadas humanas1,2,3 y para la detección de drogas de alto rendimiento de posibles cardiotoxicidades humanas4,5 , como la prolongación del INTERVALO.
En la evaluación rutinaria de las enfermedades cardíacas humanas, el ECG de superficie corporal se ha convertido en la herramienta de diagnóstico no invasiva de primera línea más ampliamente utilizada desde su invención por Einthoven en 1903. En cambio, desde la primera adaptación del método de registro de ECG de superficie corporal para peces cebra adultos en 20066 y varias modificaciones a partir de entonces7, esta técnica ha permanecido en gran medida inaccesible para muchos investigadores en el campo a pesar de la popularidad de este modelo animal. Para otros investigadores que realizaron interrogaciones in vivo de ECG para peces cebra adultos, amplias variaciones entre los operadores llevaron a la incoherencia en los hallazgos de ECG de diferentes estudios. Las razones comunes incluyen dispositivos y software especializados engorrosos y costosos, baja relación señal-ruido y confusión con respecto a la colocación del electrodo, todo agravado por una comprensión incompleta de las características de ECG de pez cebra para adultos y mecanismos tisulares subyacentes. Dado que el ECG in vivo es la única herramienta de diagnóstico para el fenotipo eléctrico de pez cebra vivo, existe una clara necesidad de un método estandarizado para mejorar la sensibilidad y especificidad, reproducibilidad y accesibilidad.
Aquí, presentamos un enfoque práctico, confiable y validado para registrar e interpretar los electrocardiogramas in vivo del pez cebra (Figura2). Usando un solo cable bipolar en el plano frontal, investigamos los cambios en las formas de onda de ECG y las duraciones de intervalos del pez cebra adulto aB saludable anestetizado vivo.
Protocolo
Todos los experimentos en este estudio se llevaron a cabo de acuerdo con la Guía de los Institutos Nacionales de Salud de los Estados Unidos para el Cuidado y Uso de Animales de Laboratorio. Todos los protocolos de los animales en este estudio fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de UCLA.
1. Preparación de la configuración experimental
- Mantener el pez cebra en sistemas de acuariodes de flujo a través de una luz de 14 h, fotoperiodo oscuro de 10 h a 28 oC a 0,5 oC. Alimentarse con alimentos en escamas todos los días y camarones vivos de salmuera (Artemia nauplii) dos veces al día. En este estudio, el núcleo de peces cebra de UCLA mantuvo y alimentó el pez cebra de la UCLA.
- El día del experimento, transporte el pez cebra del acuario al laboratorio.
- Configure el sistema de grabación ECG in vivo conectando las piezas esenciales del equipo e insertando los tres electrodos de acero inoxidable codificados por colores en los tres portales de acceso de color del amplificador (Figura3). Inicie el sistema al inicio de una sesión de registro y/o análisis del ECG.
- Procurar herramientas necesarias, como un temporizador / cronómetro, una esponja húmeda con una hendidura para sostener el pescado, fórceps, tijeras, pipetas Pasteur, y platos de cultivo (100 mm x 20 mm).
2. Inducción de anestesia
- Prepare la anestesia de inmersión para el control del dolor y la inmovilización de los peces para evitar artefactos de movimiento durante la adquisición de datos de ECG. La mayoría de los laboratorios utilizan tricaína de inmersión (etil 3-aminobenzoato de metanoesulfonato, MS-222).
- Para hacer la solución de tricaína 0,4% en stock, combine los siguientes elementos en una botella de vidrio oscuro atornillada: 400 mg de triaína en polvo, 98 ml de agua destilada doble y 2 ml de 1 M Tris (pH 9). Ajuste al pH 7.0 usando 1 N NaOH o 1 N HCl según sea necesario8.
- Para realizar la solución de inmersión final de tricaína, determine la concentración mínima adecuada para la edadde pezcebra 9 , tamaño, estado metabólico, cepa, modelo de enfermedad, objetivos científicos y duración procesal.
- Realizar un estudio de concentración-respuesta de tricaína, valorando hacia arriba o hacia abajo de la concentración recomendada de 168 mg/L (o 0.0168%)9 si es necesario, para alcanzar el nivel 4 de la anestesia dentro de 3 min con el menor número posible de toxicidades cardiorrespiratorias. Por ejemplo, en este estudio, la inmersión del pez cebra AB de tipo salvaje de 12-18 meses de edad en una solución de 0.02-0.04% de tricaína inducirá el nivel 4 de la anestesia dentro de 3 min.
NOTA: En el nivel 4 de la anestesia, el equilibrio y el tono muscular se pierden por completo y la tasa de movimiento opercular se reduce8. - Si es necesario, consulte al veterinario en el Comité Institucional de Cuidado y Uso de Animales (IACUC) para obtener orientación adicional sobre la idoneidad de la selección de anestésicos y vía de administración.
- Sumerja un pez cebra adulto en un plato que contenga solución de tricaína de la concentración más baja predeterminada y aprobada por la IACUC (por ejemplo, 0,02-0,04% en este estudio) para inducir el nivel 4 de la anestesia en un plazo de 3 min (Figura2).
- Para el protocolo ECG de supervivencia, mantenga la sesión de grabación del ECG lo más breve posible (menos de 10 min). Para sesiones breves de grabación de ECG que duran menos de 15 minutos, no es necesario el mantenimiento de la anestesia.
- Para largas sesiones de grabación de ECG que duran horas, utilice un paralítico intramuscular de acción prolongada y un sistema de perfusión oral para proporcionar una amplia hidratación y oxigenación6.
3. Colocación de plomo ECG
- Una vez que el pez cebra mantenga el nivel 4 de anestesia durante 3 s, utilice un par de fórceps contundentes para transferir el pez inmediatamente a la hendidura de la esponja húmeda con su superficie ventral superior para la colocación de electrodos de plomo ECG (Figura4).
- Inserte suavemente los tres electrodos de plomo ECG en la musculatura del pez a aproximadamente 1 mm de profundidad para establecer un cable bipolar en el plano frontal que sea paralelo a la orientación craneal caudal-derecha izquierda del eje principal cardíaco.
- Coloque el electrodo positivo (rojo) en la línea media ventral a nivel del bulbo arterioso, es decir, a 1-2 mm por encima de una línea imaginaria que conecta los dos bordes inferiores de los opérculos (Figura4A).
- Coloque el electrodo negativo (negro) caudalmente y 0,5-1,0 mm a la izquierda lateralmente al electrodo positivo, a una distancia mayor que la longitud máxima del pez cebra adulto (Figura4A).
- Coloque el electrodo de referencia (verde) caudalmente, cerca de la región anal.
NOTA: Dado que el eje principal cardíaco varía un poco de peces a peces, para maximizar las amplitudes de las ondas R y T, ajuste las posiciones de plomo haciendo sólo pequeños cambios sistemáticos a través del ensayo y el error. Por ejemplo, cambie un electrodo (positivo o negativo), en lugar de ambos electrodos, a la vez y realice cambios graduales en una dirección especificada antes de cambiar a otra dirección en lugar de hacer cambios erráticos en direcciones aleatorias.
4. Grabación ECG
- Abra el programa de adquisición de datos ECG. Seleccione una configuración deseada en los menús desplegables para rango, paso bajo y paso alto. Por ejemplo, el siguiente ajuste en el sistema de grabación ECG in vivo utilizado en este experimento produce una relación señal-ruido consistente y satisfactoria para un pez cebra adulto normal: rango "2 mV", paso bajo "120 Hz" y paso alto "0.03 s".
- Pulse Iniciar para iniciar la grabación continua de ECG sin huecos a una frecuencia de muestreo de 1 kHz.
- Para optimizar el posicionamiento del cable para obtener la máxima relación señal-ruido, pulse Detener para detener la grabación de ECG y revise el seguimiento del ECG poco después del primer intento de grabación para cada corazón. Para diagnosticar que un ECG adulto de pez cebra es normal, confirme que se cumplen todos los cuatro criterios de validación siguientes (Figura 1):
- Criterio 1: Asegúrese de que todas las formas de onda ECG (P, QRS y T) sean distintas y fácilmente visibles.
- Criterio 2: Asegúrese de que la onda P sea positiva.
- Criterio 3: Asegúrese de que el complejo NET QRS sea positivo (es decir, la amplitud de onda R es mayor que la suma de las amplitudes de onda Q y S).
- Criterio 4: Asegúrese de que la onda T sea positiva.
- Si se espera un ECG normal, vuelva a colocar los electrodos (pruebe primero el electrodo negativo) si es necesario, hasta que se cumplan los cuatro criterios de validación.
- Si se espera una onda T normal, pero la onda T es demasiado pequeña, cambie la posición de los electrodos para maximizar la amplitud de la onda T.
- Reanude el registro ECG después de optimizar el posicionamiento del cable. Guarde los barridos de ECG para su posterior análisis.
5. Recuperación de la anestesia
- Al final de la sesión de grabación del ECG, retire cuidadosamente los electrodos sin dañar a los peces. Transfiera el pescado al agua fresca y oxigenada libre de tricaína.
- Para facilitar la recuperación de la anestesia, chorro de agua sobre las branquias vigorosamente con una pipeta Pasteur hasta que el pez reanude el movimiento regular de las branquias o la natación.
- Monitorear el pescado para la recuperación completa de la anestesia (típicamente 1-2 min), como lo indica la capacidad de los peces para nadar en posición vertical durante al menos 5 s.
6. Interpretación del ECG
- Defina la configuración del análisis.
- Conozca la interfaz del software (Tablade materiales)leyendo el manual de instrucciones del software de análisis de datos ECG.
NOTA: Aunque las siguientes instrucciones son específicas del software comercial utilizado en nuestro laboratorio, las tareas básicas a realizar son esencialmente las mismas en cualquier paquete de software para el análisis de ECG. - Abra el programa de análisis de datos ECG. En el menú Archivo, seleccione Abrir para abrir el archivo ECG de interés y mostrar el seguimiento ECG completo. Utilice el ratón para arrastrar una sección de interés en el seguimiento de ECG para analizar.
- En el menú Análisis de ECG, seleccione Configuración de ECG para abrir un cuadro de diálogo para predefinir varios parámetros para el análisis automático de software (figura5A).
- Conozca la interfaz del software (Tablade materiales)leyendo el manual de instrucciones del software de análisis de datos ECG.
- Analiza el ritmo cardíaco y la frecuencia.
NOTA: La frecuencia cardíaca depende de varios factores, incluyendo la edad y la tensión del pez cebra, los agentes de anestesia (por ejemplo, tricaína, isoflurano, etc.) y la concentración, el uso de anestesia (agente único 5 , 7 frente a los agentes combinados 5) y la concentración, el uso de anestesia (agente único5,7 frente a los agentes combinados5)y tiempo de exposición5. Por ejemplo, en este estudio la frecuencia cardíaca del pez cebra AB de 12-18 meses de edad después de 3-5 minutos de inmersión en 0,02-0,04% de solución de tricaína fue de 116 a 17 latidos por minuto (n a 9), consistente con los informes bibliográficos de frecuencia cardíaca para este grupo de edad y anestésico5,7.- Determinar si el ritmo cardíaco es sinusal o no, regular o irregular.
NOTA: La presencia (o ausencia) del ritmo sinusal se basa en la presencia (o ausencia) de una onda P vertical que precede a cada QRS por un intervalo normal de PR (por ejemplo, 60-65 ms para el pez cebra AB de 10-12 meses de edad deLiu et al.en este estudio). La regularidad del ritmo auricular y ventricular (o irregularidad) se basa en la regularidad (o irregularidad) de los intervalos sucesivos de PP o RR, respectivamente. - Para determinar la frecuencia cardíaca, asegúrese de que el software identifica correctamente todas las ondas P y R. Sobre la base de estas identificaciones automáticas (o correcciones manuales) de las ondas P y R, el software mide automáticamente todos los intervalos PP y RR en la selección de ECG, calcula los promedios de intervalo para generar la velocidad atrial y ventricular.
NOTA: La tasa atrial es el intervalo promedio de PP, mientras que la tasa ventricular es el intervalo promedio de RR. Para determinar la frecuencia cardíaca, la identificación correcta de las ondas P y R es crítica. - Corrija cualquier error de identificación automática moviendo los cursores fuera de lugar a las ondas P y R adecuadas (Figura5B).
NOTA: Si el corazón está en el ritmo sinusal, la velocidad atrial y la frecuencia ventricular son las mismas debido a la correspondencia uno a uno entre las ondas sinuosas P y los complejos QRS. Sin embargo, en el caso de la disociación auriculoventricular (por ejemplo, en taquicardia ventricular o bloqueo auriculoventricular de tercer grado), se pierde esta correspondencia uno a uno entre las ondas P y los complejos QRS; por lo tanto, hay dos frecuencias cardíacas porque la frecuencia auricular es diferente de la tasa ventricular. - Determinar la frecuencia cardíaca en función de al menos cinco ciclos cardíacos completos consecutivos si el ritmo cardíaco es regular, o una tira de al menos seis segundos si el ritmo cardíaco es irregular.
- Determinar si el ritmo cardíaco es sinusal o no, regular o irregular.
- Calcular intervalos y duraciones de onda.
- Vaya a Análisis de ECG > Vista de promedio para concatenar n (por ejemplo, 5) ciclos cardíacos consecutivos en una sola señal promedio (Figura5C).
NOTA: Si las formas de onda de ECG de un ciclo cardíaco individual difieren sustancialmente de la señal promedio, estudie ese ciclo cardíaco por separado sin concatenación. - Asegúrese de que el software identifique correctamente el inicio y el final de la onda P, el complejo QRS y la onda T que se muestran en la ventana Vista de promedio (figura5C). Sobre la base de estas identificaciones automáticas (o correcciones manuales) de estas ondas e intervalos, el software mide automáticamente las duraciones definidas convencionalmente.
NOTA: El intervalo PR se extiende desde el inicio de la onda P hasta el inicio del complejo QRS (o el complejo RS si la onda Q no es visible). La duración qrS se extiende desde el inicio de la onda Q (o la onda R si la onda Q no es visible) hasta el final de la onda S (es decir, el punto J; Figura 1). El intervalo QT se extiende desde el inicio de la onda Q (o la onda R si la onda Q no es visible) hasta el final de la onda T. Por lo tanto, para calcular intervalos y duraciones, la identificación correcta del inicio y el final de la onda P, el complejo QRS y la onda R es crítica. - Corrija cualquier error de identificación automática moviendo los cursores extraviados a las posiciones adecuadas.
- Seleccione el pico negativo de la onda S como el final del complejo QRS7 porque el punto J del pez cebra que indica el final de la onda S puede ser particularmente difícil de identificar con precisión. Esto causará una ligera subestimación de la verdadera duración QRS.
NOTA: El software de análisis ECG corrige automáticamente el intervalo QT a la velocidad ventricular (o intervalo RR) para generar el intervalo QT QTc corregido utilizando el método preseleccionado por el usuario en el paso 6.1.3, por ejemplo, Bazett (Figura 5A). La fórmula de Bazett (1920) QTc - QT / RR es la más popular y la primera de varios métodos propuestos para corregir el intervalo QT humano para la frecuencia cardíaca. Debido a que la precisión de la fórmula de Bazett ha sido cuestionada, consulte otros métodos propuestos para los seres humanos10,11 y pez cebra6 (Figura5D).
- Vaya a Análisis de ECG > Vista de promedio para concatenar n (por ejemplo, 5) ciclos cardíacos consecutivos en una sola señal promedio (Figura5C).
- Interprete las anomalías del ECG reconociendo excepciones para los cuatro criterios de validación del paso 4.3.
- Reconocer excepciones para el criterio 1. En ausencia de ondas P (lo que indica la ausencia de ritmo sinusal), confíe en los intervalos RR y la duración de QRS para diagnosticar el ritmo cardíaco. Por ejemplo, si los intervalos RR son irregulares, diagnostique la fibrilación auricular; si los intervalos RR son regulares y el QRS es normalmente estrecho, diagnosticar el ritmo de escape de unión; por otro lado, si los intervalos RR son regulares y el QRS es anormalmente prolongado, diagnosticar el ritmo de escape ventricular.
- Reconocer excepciones para el criterio 2. Cuando la onda P es negativa (o invertida), diagnostique la activación auricular retrógrada de un marcapasos ectópico (como un sitio auricular aguas abajo del nódulo sinusal, el nódulo auriculoventricular o el ventrículo).
- Reconocer excepciones para el criterio 3. Cuando las ondas Q altas y estrechas presentan ondas P negativas y T negativas, diagnostique la inversión de plomo debido a un cambio erróneo de las posiciones positivas y negativas del electrodo porque esas ondas Q altas y estrechas eran ondas R verdaderas invertidas por error (Figura6D ). Por el contrario, cuando las ondas Q anchas presentan ondas P positivas después de una lesión cardíaca significativa, diagnostique el infarto de miocardio porque esas ondas Q amplias son ondas Q patológicas verdaderas.
- Reconocer excepciones para el criterio 4. Cuando la onda T está invertida, inspeccione la activación ventricular para identificar si la anormalidad de la repolarización ventricular es primaria o secundaria. Confíe en el escenario clínico para reducir el diagnóstico correcto de una lista diferencial de anomalías primarias de repolarización ventricular (a partir de efectos farmacológicos o isquemia miocárdica; Figura 6C) Frente a la anormalidad de la repolarización ventricular secundaria (debido a la activación ventricular aberrante de la preexcitación, ectología ventricular o ritmo ventricular).
- Exportar conclusiones del ECG.
- Seleccione Vista de tabla para revisar todas las mediciones de ECG. Seleccione las medidas de interés para copiar y pegar en el documento deseado (por ejemplo, hoja de cálculo de Excel).
- Para exportar un seguimiento de ECG, resalte una sección de interés en el barrido de ECG mediante el icono de lupa. Copie y pegue en el documento deseado (por ejemplo, Word o PowerPoint).
Resultados
La Figura 1 ilustra la relevancia clínica del método presentado aquí. La electrocardiografía superficial in vivo para peces cebra adultos es una herramienta de fenotipado eléctrico esencial debido a las notables similitudes entre el pez cebra y el ECG humano a pesar de sus vastas diferencias anatómicas. El corazón del pez cebra tiene sólo una aurícula y un ventrículo en contraste con el corazón humano con dos aurículas y dos ventrículos (fila superior; derecha e izquierda, respectivamente). Sin embargo, a pesar de su aparente simplicidad anatómica, el corazón del pez cebra comparte varias características del ECG con el corazón humano (fila inferior; derecha e izquierda, respectivamente) Por lo tanto, el corazón del pez cebra ha surgido como un modelo sustituto para el electrofisiología5,12,13. La Figura 1 ilustra una onda Q pequeña pero distinta de un pez cebra vivo y saludable de 14 meses de edad. Sin embargo, en el ECG de pez cebra, el posicionamiento de plomo no está comúnmente optimizado para demostrar la onda Q. Por lo tanto, la onda Q es comúnmente invisible, y un complejo RS es más comúnmente visto que el complejo QRS completo en ECG de pez cebra.
La Figura 2 resume los cuatro pasos de acción esenciales para llevar a cabo una electrocardiografía in vivo mínimamente invasiva para peces cebra adultos. Después de la inducción de la anestesia (paso 1) y la colocación de electrodos (paso 2), registramos señales de ECG basales (paso 3) de peces cebra saludables de tipo salvaje AB de 12 a 18 meses de edad (n .9). Nuestra técnica de inserción de electrodos fue mínimamente invasiva porque no necesitábamos pelar escamas de pescado ni realizar pericardiotomía. Después de la adquisición de datos, revisamos y verificamos manualmente cada registro ECG (paso 4) para evitar posibles interpretaciones erróneas por el análisis automático del software.
La Figura 3 muestra los tres componentes indispensables de un sistema típico de adquisición y procesamiento de datos ECG: un hardware de adquisición de datos de alto rendimiento, un amplificador diferencial de alta ganancia y un equipo cargado con software para datos ectlcados adquisición y análisis. En nuestro laboratorio, adaptamos un sistema comercial de registro ECG in vivo diseñado originalmente para pequeños modelos de mamíferos (como ratones, ratas y conejos) para adaptarse al modelo de pez cebra adulto.
La Figura 4 demuestra que la colocación adecuada del plomo requiere alinear el plomo con el supuesto eje cardíaco principal. En el registro de ECG in vivo de pez cebra, debido a que sólo se utiliza un solo cable, el posicionamiento de plomo adecuado para maximizar simultáneamente las amplitudes de onda R y T es fundamental. Para maximizar las amplitudes de onda R y T, alineamos los electrodos de plomo positivos y negativos con el eje principal cardíaco, presumiblemente en la orientación craneal caudal izquierda a derecha. Después de la toracotomía y pericardiotomía para abrir el saco pericárdico y exponer el corazón, el eje principal cardíaco se hace evidente (Figura4B línea blanca discontinua). De hecho, la pericardiotomía para exponer el corazón es una estrategia comúnmente utilizada para aumentar la relación señal-ruido7 a costa de convertir la grabación de ECG de un procedimiento mínimamente invasivo en un procedimiento altamente invasivo.
La Figura 5 ilustra los pasos críticos en el análisis del ECG. En primer lugar, hemos predefinido los distintos parámetros para el análisis automático de software mediante el cuadro de diálogo Configuración de ECG (figura5A). Debido a que reutilizamos un equipo de grabación de ECG existente diseñado para modelos de mamíferos para acomodar peces cebra adultos, la configuración de Detección y Análisis para el pez cebra no está disponible. Seleccionamos el Preset Humano en su lugar, dada la notable similitud del ECG de pez cebra con el ECG humano (Figura5A). En segundo lugar, verificamos manualmente la identificación automática de ECG de software (en negro) de los picos de onda R y corrigimos (en rojo) cualquier error de identificación automática de onda R antes de ordenar al software que vuelva a calcular la velocidad ventricular media. Por ejemplo, en la Figura 5B,una onda P grande en relación con la onda R engañó al software para que identificara erróneamente las ondas R, lo que llevó al posterior error de cálculo automático del intervalo RR o de la velocidad ventricular. Por lo tanto, la verificación humana y las correcciones apropiadas según sea necesario son fundamentales en el análisis del ECG. En tercer lugar, evaluamos rápidamente la regularidad del ritmo y calculamos la duración media de las ondas y los intervalos utilizando la vista Promedio (Figura5C)para concatenar varios ciclos cardíacos consecutivos (verde) en una sola señal promedio (negro). Aquí en la Figura 5C,la desviación insignificante entre cada uno de los nueve ciclos cardíacos y la señal media aboga por la excelente regularidad rítmica de este corazón de pez cebra. Por último, hemos permitido que el software corrija automáticamente el intervalo QT para la frecuencia cardíaca utilizando Bazett, uno de los siete métodos diferentes disponibles (Figura5D).
Figura 6A -C demuestra cómo la profundidad de colocación de los electrodos afecta a las amplitudes de las señales ECG. Cuando insertamos incorrectamente los electrodos demasiado superficialmente en la dermis (Figura6A),el plomo era "indirecto" (más de dos diámetros cardíacos del corazón, similar a los cables de extremidades ECG humanos indirectos I, II y III) y la tensión señales eran pequeñas. Cuando insertamos adecuadamente los electrodos 1 mm más profundo en la musculatura pectoralis (Figura6B),el plomo se volvió "semidirecto" (en proximidad pero no en contacto directo con el corazón) y las señales de voltaje aumentaron. Las formas de onda eclovene se hicieron fácilmente visibles. Sin embargo, cuando insertamos incorrectamente los electrodos aún más profundo en el ventrículo (Figura6C),el plomo se volvió "directo" (en contacto directo con el corazón) y las señales de voltaje aumentaron aún más. La amplitud de onda R en la Figura 6C se elevó por ocho veces en comparación con la Figura 6A y por cuatro veces en comparación con la Figura 6B. Sin embargo, la traza del ECG en la Figura 6C reveló nuevos signos de lesión en el miocardio ventricular, como la nueva depresión ST y la nueva inversión de ondas T.
La Figura 6D demuestra cómo las inusuales inversiones de todas las formas de onda ECG (P, Q, R, S y T) deben indicar un error de inversión de plomo, en el que los electrodos positivos y negativos cambiaron de lugar. Tenga en cuenta que, por definición, Q y S siempre son negativos, mientras que R siempre es positivo.
Figura 6E -F muestra cómo la profundidad inapropiada de la anestesia puede afectar la calidad de la grabación de ECG in vivo. En la Figura 6E,la anestesia inadecuada (0,017% tricaína) condujo a la falta de inmovilización del pez cebra por completo. Los artefactos de movimiento resultantes redujeron la relación señal-ruido al contaminar la señal (asterisco) y aumentar el ruido (flechas). Por el contrario, en la Figura 6F,la anestesia por sobredosis (0,08% tricaína) indujo bradiarritmia sinusal grave, así como cambios en el segmento ST y la onda T.
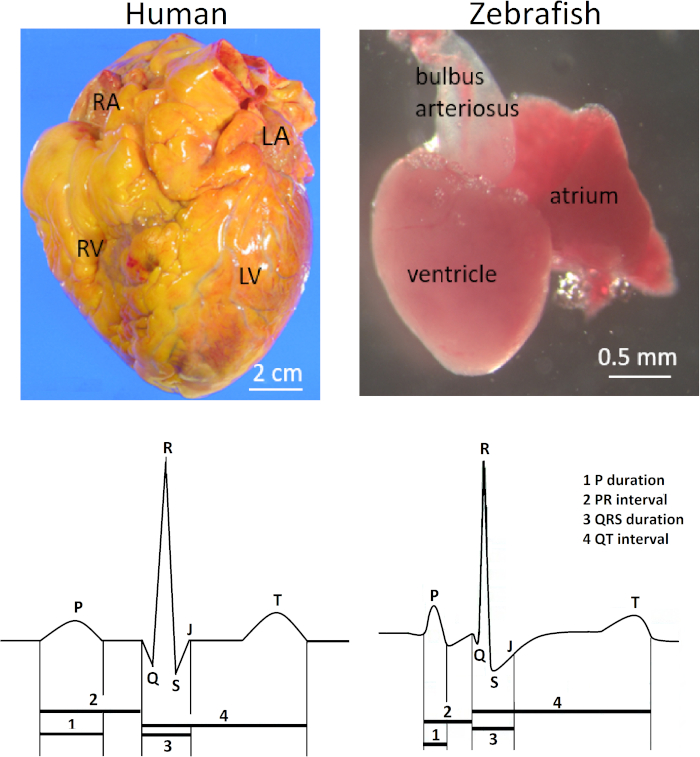
Figura 1: Anatomía contrastante y ECG de corazones humanos y de peces cebra. En contraste con el corazón humano con dos aurículas y dos ventrículos, el corazón del pez cebra tiene sólo una aurícula y un ventrículo (fila superior). Abreviaturas: RA, aurícula derecha; LA, aurícula izquierda; RV, ventrículo derecho; LV: ventrículo izquierdo. El corazón del pez cebra comparte varias características comunes de ECG con el corazón humano (fila inferior). Haga clic aquí para ver una versión más grande de esta figura.
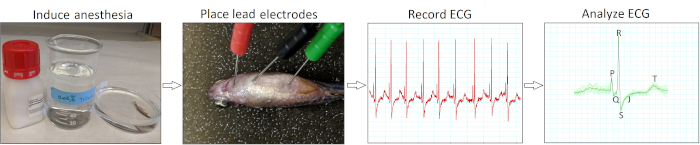
Figura 2: Protocolo de grabación in vivo ECG mínimamente invasivo. Un diagrama de flujo esquemático ilustra cuatro pasos de acción críticos para llevar a cabo un interrogatorio de ECG in vivo: inducir anestesia, colocar electrodos de plomo ECG, registrar ECG y analizar las grabaciones de ECG. Haga clic aquí para ver una versión más grande de esta figura.
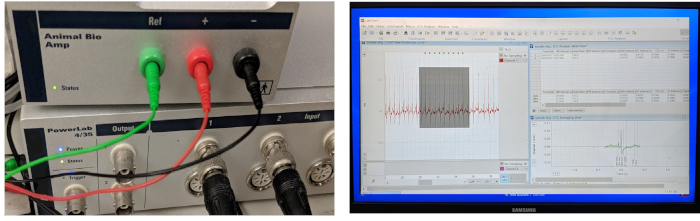
Figura 3: Sistema de adquisición y procesamiento de datos ECG. Los tres componentes clave de un sistema de grabación ECG in vivo integrado incluyen un hardware para adquirir datos, un amplificador y un software informático para la adquisición y el análisis de datos. El amplificador viene con tres microelectrodos de acero inoxidable de calibre 29 listos para usar. Haga clic aquí para ver una versión más grande de esta figura.
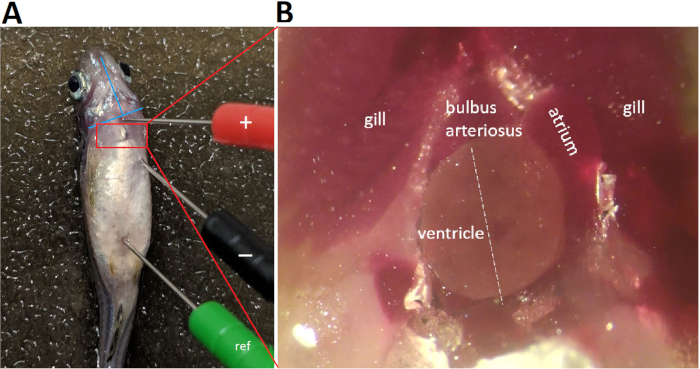
Figura 4: Colocación de plomo ECG. Tres electrodos de acero inoxidable codificados por colores de 29 calibres se insertan firmemente en la musculatura del pez a aproximadamente 1 mm de profundidad. La colocación del electrodo negativo (negro) y el electrodo positivo (rojo) establece un cable bipolar en el plano frontal, a lo largo de una orientación craneal izquierda caudal a derecha. Abreviatura: ref, electrodo de referencia Haga clic aquí para ver una versión más grande de esta figura.
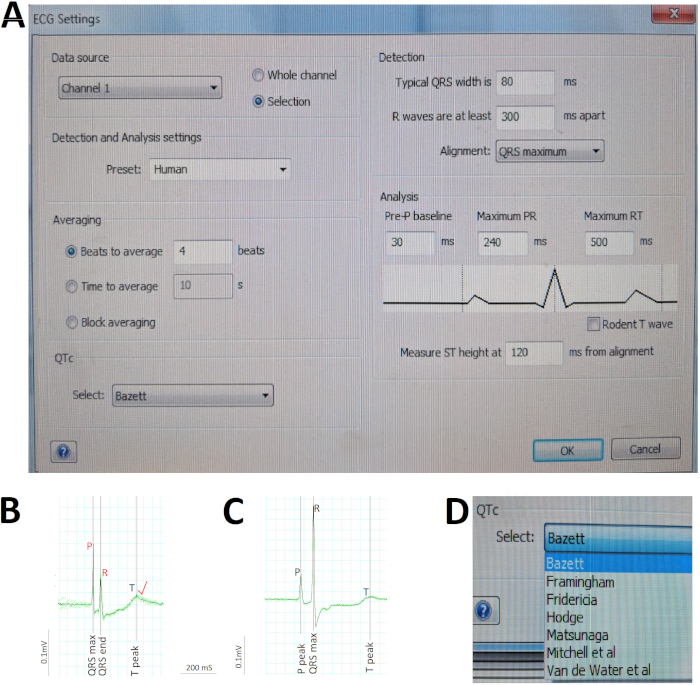
Figura 5: C ritical en el análisis del ECG. (A) Defina previamente los distintos parámetros para el análisis automático de software. (B) Corregir manualmente (rojo) dos identificaciones erróneas automáticas por el software (negro) de las ondas P y R para corregir el error de cálculo del software de la velocidad atrial y ventricular. (C) Concatenar nueve ciclos cardíacos consecutivos (verde) en una sola señal media (negro) para evaluar rápidamente las regularidades/irregularidades del ritmo y calcular las duraciones medias de las ondas y los intervalos. (D) Corrija el intervalo QT para la frecuencia cardíaca utilizando uno de los diversos métodos, como Bazett. Haga clic aquí para ver una versión más grande de esta figura.
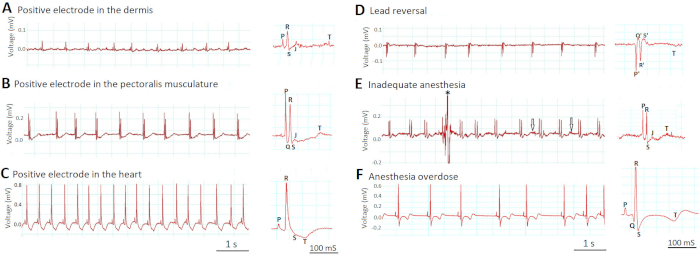
Figura 6: Efectos de la colocación del plomo y la profundidad de la anestesia en las señales de ECG. Dos pasos más críticos que determinan el éxito de la grabación de ECG in vivo son la colocación de plomo (A-D) y la profundidad de la anestesia (E-F). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Al registrar in vivo ECG para peces cebra adultos por medio de una sola ventaja como hemos demostrado en este estudio, hay una serie de advertencias relativas a la calidad y validez de los resultados del registro del ECG. En primer lugar, al elegir los anestésicos apropiados y determinar la concentración mínima necesaria de anestesia, profundidad y duración, equilibrar las cardiotoxicidades anestésicas contra la necesidad crítica de suprimir los artefactos de movimiento y la determinación a priori para un diseño experimental de supervivencia frente a terminal. Aprovechar la potencia sinérgica de una combinación de anestésicos múltiples de diferentes clases de fármacos5,14 y paralíticos1,6 para reducir la dosis de agentes individuales5 o administrar una dosis de bajo mantenimiento después de una dosis de inducción más alta son estrategias típicas. Sin embargo, a pesar de sus conocidas toxicidades cardiorrespiratorias potenciales, incluyendo la muerte8, la tricaína sigue siendo la más utilizada, la mejor disponible, y el único anestésico aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para el pez cebra Anestesia. La tricaína se ha utilizado popularmente en la grabación de ECG de pez cebra adulto ya sea como un solo agente o en combinación con otros anestésicos o paralíticos.
En segundo lugar, se puede garantizar la precisión de la colocación del plomo al menos para el pez cebra normal y saludable utilizando nuestros cuatro criterios de validación para un ECG de pez cebra adulto normal. De los cuatro criterios de validación que proponemos aquí, los dos últimos criterios juntos confirman la concordancia fundamental entre la polaridad de la onda R y la de la onda T en un ECG5normal,7,15. Esta concordancia de ondas R y T es una similitud fortuita, pero crítica, entre el pez cebra y el ECG humano16,17 ECG normal que contribuye a la relevancia clínica del modelo del corazón del pez cebra como sustituto del Electrofisiología. Sin embargo, varias afecciones benignas o malignas pueden invalidar cualquiera de los cuatro criterios de validación. Por ejemplo, la concordancia de onda R y T se pierde en la isquemia miocárdica7,15. Esta pérdida de concordancia de ondas R y T en la isquemia miocárdica es otra semejanza llamativa entre el pez cebra y el ECG humano que contribuye a la relevancia clínica del modelo de infarto de miocardio del pez cebra.
Por último, recomendamos una práctica estándar en el análisis de ECG. Con la llegada de la tecnología, el software de análisis eclovenpuede generar interpretación automática de ECG. Sin embargo, recomendamos encarecidamente que los seres humanos entrenados siempre reinterpreten y verifiquen todos los ECG en función del escenario clínico respectivo que conduce a la grabación de ECG. La excesiva dependencia rutinaria únicamente de la interpretación automática por parte de un software de análisis de ECG es desaconsejable, particularmente en presencia de variantes comunes normales de ECG, patologías cardíacas o colocación de plomo subóptima.
Este estudio se centra en el método mínimamente invasivo para breves sesiones de grabación de ECG. Sin embargo, en caso de que surja la necesidad de sesiones de registro de ECG prolongadas terminales que duran horas, las modificaciones son necesarias para proporcionar la oxigenación adecuada, hidratación y anestesia por perfusión continua6.
Además, mejore la relación señal-ruido de al menos tres maneras. Elegir un amplificador más potente es a menudo una opción costosa, si no poco práctica. Abrir el saco pericárdico para reducir el conductor de volumen es un enfoque razonable, aunque invasivo, que se ha adoptado7. La colocación estratégica del cable para alinear el eje de plomo en una dirección paralela al eje cardíaco principal (Figura4B)maximizará las señales de voltaje del ECG, pero puede requerir ensayo y error, especialmente en ausencia de pericardiotomía.
El método de interrogación in vivo de ECG para el pez cebra adulto que presentamos aquí ofrece cuatro ventajas principales. En primer lugar, nuestro enfoque mínimamente invasivo solo requiere la inserción de electrodos, pero no la eliminación de la escala de pescado ni la toracotomía-pericardiotomía. Por lo tanto, al minimizar el dolor para los peces, nuestro enfoque permite interrogaciones repetidas de ECG en estudios de supervivencia longitudinal. En segundo lugar, cuando los anestésicos suprimen adecuadamente el movimiento de los peces, el sistema de grabación ecg in vivo de nuestro estudio produce constantemente una relación señal-ruido satisfactoria con señales brutas libres de ruido. En tercer lugar, la validación de calidad de cuatro criterios que proponemos aquí garantiza la precisión y robustez de los datos al principio de la adquisición de datos del ECG y minimiza las variaciones dependientes del operador. Por último, en particular, nuestro último criterio de validación (la onda T normal es vertical) encapsula la concordancia de la onda R y la onda T, una característica importante similar al humano del ECG normal del pez cebra (Figura1).
Sin embargo, todavía existen cuatro limitaciones principales a la metodología actual de ECG in vivo para el pez cebra adulto por nuestro grupo y otros.
En primer lugar, la falta de cooperación en el tema requiere la necesidad de anestesia con sus consecuencias limitantes de toxicidad cardiorrespiratoria. Para el interrogatorio in vivo de ECG, mientras que los pacientes humanos nunca necesitan sedación, el pez cebra siempre requiere anestésicos o paralíticos, todos los cuales causan toxicidades cardiorrespiratorias variables.
En segundo lugar, la necesidad de asegurar los cables de ECG conectados eleva ligeramente la invasividad de un procedimiento no invasivo. Mientras que la colocación de plomo en el registro de ECG de superficie corporal en humanos es totalmente no invasiva porque los electrodos se adhieren a la epidermis humana, la colocación de plomo para el registro in vivo de ECG de peces cebra es más invasiva porque, como mínimo, los electrodos de acero deben perforar la piel del pez para una inserción segura en la musculatura del pez.
Las dos últimas limitaciones se derivan de las limitaciones anatómicas del pecho y el corazón del pez cebra. En tercer lugar, el tamaño minúsculo del corazón adulto del pez cebra requiere una reducción drástica en el número de cables de ECG. Mientras que los seres humanos acomodan fácilmente doce plomos en una grabación estándar de ECG, el pez cebra adulto normalmente puede acomodar sólo un solo cable unipolar o bipolar. La ramificación de un solo cable ECG es el desafío de optimizar simultáneamente las amplitudes de las tres ondas P, R y T. Por lo tanto, no se puede exagerar la importancia de una colocación óptima y precisa del plomo en el interrogatorio del ECG de peces cebra. En el pez cebra, la onda T presenta un desafío de detección único porque a menudo es la más pequeña de estas tres ondas. Por lo tanto, la amplitud de la onda T del pez cebra debe recibir prioridad de optimización sobre las ondas P y R típicamente más grandes.
En cuarto lugar, determinar el eje cardíaco principal del pez cebra para maximizar la amplitud de la onda R puede ser difícil. La razón es que el corazón del pez cebra tiene más libertad de movimiento dentro de su saco pericárdico suelto en comparación con el corazón humano dentro de su pericardio similar a un guante de forma.
En general, estas limitaciones estimularán la innovación futura de los métodos. Con la llegada de la impresión 3D y la electrónica deformable18, hay esperanza de implantación directa de plomo un día en despertar, alerta, nadar pez cebra utilizando un 'cierre cardíaco' de sensores de electrodos inalámbricos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por los Institutos Nacionales de Salud R01 HL141452 a TPN. ADInstruments amablemente proporcionó una generosa financiación para sufragar el costo de la publicación de acceso abierto, pero no tenía ningún papel en el diseño experimental, la adquisición de datos, el análisis de datos de este estudio o cualquier acceso al manuscrito antes de su publicación.
Materiales
| Name | Company | Catalog Number | Comments |
| Culture dishes | Fisher Scientific | FB087571 | 100 mm x 20 mm |
| Dumont Forceps | Fine Sciense Tools | 11253-20 | 0.1 x 0.06 mm |
| FE136 Animal Bio Amp | AD Instruments | FE231 | |
| Iris Forceps | Fine Sciense Tools | 11064-07 | 0.6 x 0.5 mm |
| LabChart 8 Pro | AD Instruments | Software with ECG Module | |
| Needle electrodes for Animal Bio Amp | AD Instruments | MLA1213 | 29 gauge |
| Plastic Disposable Transfer Pipets | Fisher Scientific | 13-669-12 | 6 in., 1.2 mL |
| PowerLab 4/35 | AD Instruments | 4//35 | |
| Scissors | Fine Sciense Tools | 15000-08 | 2.5 mm, 0.075 mm |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma | E10521-10G | MS-222 |
Referencias
- Arnaout, R., et al. Zebrafish model for human long QT syndrome. Proceedings of the National Academy of Sciences of the United States of America. 104 (27), 11316-11321 (2007).
- Hassel, D., et al. Deficient zebrafish ether-a-go-go-related gene channel gating causes short-QT syndrome in zebrafish reggae mutants. Circulation. 117 (7), 866-875 (2008).
- Meder, B., et al. Reconstitution of defective protein trafficking rescues Long-QT syndrome in zebrafish. Biochemical and Biophysical Research Communication. 408 (2), 218-224 (2011).
- Sieber, S., et al. Zebrafish as a preclinical in vivo screening model for nanomedicines. Advanced Drug Delivery Reviews. , (2019).
- Lin, M. H., et al. Development of a rapid and economic in vivo electrocardiogram platform for cardiovascular drug assay and electrophysiology research in adult zebrafish. Science Reports. 8 (1), 15986 (2018).
- Milan, D. J., Jones, I. L., Ellinor, P. T., MacRae, C. A. In vivo recording of adult zebrafish electrocardiogram and assessment of drug-induced QT prolongation. American Journal of Physiology-Heart and Circulation Physiology. 291 (1), H269-H273 (2006).
- Liu, C. C., Li, L., Lam, Y. W., Siu, C. W., Cheng, S. H. Improvement of surface ECG recording in adult zebrafish reveals that the value of this model exceeds our expectation. Science Reports. 6, 25073 (2016).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. Ilar Journal. 53 (2), 192-204 (2012).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Sagie, A., Larson, M. G., Goldberg, R. J., Bengtson, J. R., Levy, D. An improved method for adjusting the QT interval for heart rate (the Framingham Heart Study). American Journal of Cardiology. 70 (7), 797-801 (1992).
- Luo, S., Michler, K., Johnston, P., Macfarlane, P. W. A comparison of commonly used QT correction formulae: the effect of heart rate on the QTc of normal ECGs. Journal of Electrocardiology. 37 Suppl, 81-90 (2004).
- Vornanen, M., Hassinen, M. Zebrafish heart as a model for human cardiac electrophysiology. Channels (Austin). 10 (2), 101-110 (2016).
- Tsai, C. T., et al. In-vitro recording of adult zebrafish heart electrocardiogram - a platform for pharmacological testing). Clinica Chimica Acta. 412 (21-22), 1963-1967 (2011).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of American Association of Lab Animal Sciences. 53 (2), 198-203 (2014).
- Sun, Y., et al. Activation of the Nkx2.5-Calr-p53 signaling pathway by hyperglycemia induces cardiac remodeling and dysfunction in adult zebrafish. Disease Model and Mechanism. 10 (10), 1217-1227 (2017).
- Franz, M. R., Bargheer, K., Rafflenbeul, W., Haverich, A., Lichtlen, P. R. Monophasic action potential mapping in human subjects with normal electrocardiograms: direct evidence for the genesis of the T wave. Circulation. 75 (2), 379-386 (1987).
- Chiale, P. A., et al. The multiple electrocardiographic manifestations of ventricular repolarization memory. Current Cardiology Reviews. 10 (3), 190-201 (2014).
- Xu, L., et al. 3D multifunctional integumentary membranes for spatiotemporal cardiac measurements and stimulation across the entire epicardium. Nature Communications. 5, 3329 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados