Method Article
Elettrocarcardio in superficie in vivo per il pesce zebra adulto
In questo articolo
Riepilogo
Qui, presentiamo un metodo affidabile, minimamente invasivo e conveniente per registrare e interpretare gli elettrocardiogrammi nel pesce zebra adulto anestesizzato vivo.
Abstract
Le forme d'onda dell'elettrocardiogramma del pesce zebra adulto e quelle degli esseri umani sono notevolmente simili. Queste somiglianze elettrocardiogramma migliorano il valore del pesce zebra non solo come modello di ricerca per l'elettrofisiologia e la miopatia cardiaca umana, ma anche come modello surrogato nello screening farmaceutico ad alto throughput per potenziali cardiotossicità esseri umani, come il prolungamento del QT. Come tale, l'elettrocardiografia in vivo per il pesce zebra adulto è uno strumento di fenotipizzazione elettrica che è necessario, se non indispensabile, per caratterizzazioni elettrofisiologiche in vivo trasversali o longitudinali. Tuttavia, troppo spesso, la mancanza di un metodo di registrazione affidabile, pratico ed economico rimane una sfida importante che impedisce a questo strumento diagnostico in vivo di diventare più facilmente accessibile. Qui descriviamo un approccio pratico e diretto all'elettrocardiografia in vivo per il pesce zebra adulto utilizzando un sistema a bassa manutenzione, conveniente e completo che produce registrazioni coerenti e affidabili. Illustriamo il nostro protocollo utilizzando pesci zebra maschi adulti sani di 12-18 mesi di età. Introduciamo anche una rapida strategia di interpretazione in tempo reale per la convalida della qualità per garantire l'accuratezza e la robustezza dei dati nelle prime fasi del processo di registrazione dell'elettrocardiogramma.
Introduzione
Il cuore di pesce zebra (Danio rerio) si trova anteroventrally alla cavità toracica tra l'opercolo e le cinture pettorali. Il cuore è racchiuso piuttosto liberamente all'interno di un sacco pericardico color argento. Anatomicamente, il cuore di pesce zebra è diverso dai cuori umani a quattro camere e altri mammiferi a causa della sua scala diminutiva (100 volte più piccola del cuore umano) e della sua struttura a due camere costituita da un solo atrio e un ventricolo. Ciò nonostante, le forme d'onda dell'elettrocardiogramma (ECG) e la durata dell'intervallo QT di entrambe le specie sono notevolmente simili (Figura 1). Di conseguenza, il pesce zebra è emerso come un modello popolare per studiare le aritmie ereditate umane1,2,3 e per lo screening farmacologico ad alto consumo di potenziali cardiotossicità umane4,5 , come il prolungamento del QT.
Nella valutazione di routine delle malattie cardiache umane, l'ECG della superficie corporea è diventato lo strumento diagnostico non invasivo di prima linea più utilizzato dalla sua invenzione da parte di Einthoven nel 1903. Al contrario, dal primo adattamento del metodo di registrazione ECG corpo-superficie per il pesce zebra adulto nel 20066 e diverse modifiche successivamente7, questa tecnica è rimasta in gran parte inaccessibile a molti ricercatori nel settore nonostante la popolarità di questo modello animale. Per altri ricercatori che hanno effettuato interrogatori ECG in vivo per il pesce zebra adulto, ampie variazioni tra gli operatori hanno portato a incoerenze nei risultati ECG da diversi studi. Le ragioni più comuni includono dispositivi e software specializzati ingombranti e costosi, basso rapporto segnale-rumore e confusione per quanto riguarda il posizionamento degli elettrodi, il tutto ulteriormente aggravato da una comprensione incompleta delle caratteristiche ECG del pesce zebra adulto e meccanismi tissutali sottostanti. Dato che l'ECG in vivo è l'unico strumento diagnostico per fenotipizzare elettricamente il pesce zebra vivo, vi è una chiara necessità di un metodo standardizzato per migliorare la sensibilità e la specificità, la riproducibilità e l'accessibilità.
Qui, presentiamo un approccio pratico, affidabile e convalidato per registrare e interpretare gli elettrocardiogrammi in vivo del pesce zebra (Figura 2). Utilizzando un singolo piombo bipolare nel piano frontale, abbiamo studiato i cambiamenti nelle forme d'onda ECG e le durate di intervallo del pesce zebra adulto AB di tipo selvatico sano anestesizzato sano.
Protocollo
Tutti gli esperimenti in questo studio sono stati condotti in conformità con la Guida nazionale degli Stati Uniti per la cura e l'uso degli animali da laboratorio. Tutti i protocolli sugli animali in questo studio sono stati approvati dall'UCLA Institutional Animal Care and Use Committee.
1. Preparazione dell'allestito sperimentale
- Mantenere il pesce zebra in sistemi di acquario flow-through su un fotoperiodo scuro di 14 ore su 14 ore e 10 h scuro a 28 gradi centigradi e 0,5 gradi centigradi. Nutrire con cibo fiocco quotidiano e gamberetti salamoia dal vivo (Artemia nauplii) due volte al giorno. In questo studio, il pesce zebra è stato mantenuto e nutrito con il nucleo del pesce zebra UCLA.
- Il giorno dell'esperimento, trasportare il pesce zebra dall'acquario al laboratorio.
- Impostare il sistema di registrazione ECG in vivo collegando i pezzi essenziali dell'apparecchiatura e inserendo i tre elettrodi in acciaio inossidabile codificati a colori nei tre portali di accesso abbinati al colore dell'amplificatore (Figura 3). Avviare il sistema all'inizio di una sessione di registrazione e/o analisi ECG.
- Procurarsi gli strumenti necessari, come un timer / cronometro, una spugna bagnata con una spugna per tenere il pesce, pinze, forbici, pasteur pipette e piatti di coltura (100 mm x 20 mm).
2. Induzione di anestesia
- Preparare l'anestesia di immersione per il controllo del dolore e l'immobilizzazione dei pesci per evitare artefatti di movimento durante l'acquisizione dei dati ECG. La maggior parte dei laboratori utilizza tricaine di immersione (ethyl 3-aminobenzoate metanososulfonato, MS-222).
- Per rendere la soluzione di riserva della tricaina 0,4%, combinare i seguenti elementi in una bottiglia di vetro scuro a vite: 400 mg di polvere di tricaina, 98 mL di acqua a doppia distillata e 2 mL di 1 M Tris (pH 9). Regolare su pH 7.0 utilizzando 1 N NaOH o 1 N HCl in base alle esigenze8.
- Per fare la soluzione di immersione finale tricaina, determinare la concentrazione minima che è appropriata per l'etàdi pescezebra 9 , dimensioni, stato metabolico, ceppo, modello di malattia, obiettivi scientifici, e durata procedurale.
- Eseguire uno studio di risposta alla concentrazione di tricaina, titrating su o giù dalla concentrazione raccomandata di 168 mg/L (o 0.0168%)9 se necessario, per raggiungere il livello 4 di anestesia entro 3 min con il minor numero possibile di tossicità cardiorespiratoria. Ad esempio, in questo studio, l'immersione di pesce zebra AB di tipo selvatico di 12-18 mesi di età in una soluzione di 0,02-0,04% tricaina indurrà il livello 4 di anestesia entro 3 min.
NOTA: Al livello 4 di anestesia, l'equilibrio e il tono muscolare vengono completamente persi e la velocità di movimento opercolare si riduce8. - Se necessario, consultare il veterinario del Comitato istituzionale per la cura e l'uso degli animali (IACUC) per ulteriori indicazioni sull'adeguatezza della selezione degli anestetici e del percorso di somministrazione.
- Immergere un pesce zebra adulto in un piatto contenente una soluzione tricaina della concentrazione più bassa predeterminata e approvata da IACUC (ad esempio, 0,02-0,04% in questo studio) per indurre il livello 4 di anestesia entro 3 min (Figura 2).
- Per la sopravvivenza protocollo ECG, mantenere la sessione di registrazione ECG il più breve possibile (meno di 10 min). Per brevi sessioni di registrazione ECG di durata inferiore a 15 min, la manutenzione dell'anestesia non è necessaria.
- Per lunghe sessioni di registrazione ECG della durata di ore, utilizzare un sistema paralitico intramuscolare ad azione prolungata e un sistema di perfusione orale per fornire un'ampia idratazione e ossigenazione6.
3. Posizionamento dei lead ECG
- Una volta che il pesce zebra mantiene il livello 4 di anestesia per 3 s, utilizzare un paio di pinze contundenti per trasferire il pesce immediatamente sulla spugna umida fessura con la sua superficie ventrale più in alto per il posizionamento di elettrodi di piombo ECG (Figura 4).
- Inserire delicatamente i tre elettrodi di piombo ECG nella muscolatura del pesce a circa 1 mm di profondità per stabilire un piombo bipolare nel piano frontale che parallelamente all'orientamento cranico caudale-destro sinistro dell'asse principale cardiaco.
- Posizionare l'elettrodo positivo (rosso) nella linea mediana ventrale al livello del bulbus arteriosus, cioè a 1-2 mm sopra una linea immaginaria che collega i due bordi inferiori degli operculums (Figura 4A).
- Posizionare l'elettrodo negativo (nero) caudally e 0,5-1,0 mm lasciati lateralmente all'elettrodo positivo, ad una distanza maggiore della lunghezza apicobasale massima del ventricolo adulto del pesce zebra adulto (Figura 4A).
- Posizionare l'elettrodo di riferimento (verde) caudally, vicino alla regione anale.
NOTA: Poiché l'asse principale cardiaco varia un po 'da pesce a pesce, per massimizzare le ampiezze delle onde R e T, regolare le posizioni di piombo facendo solo piccole modifiche sistematiche attraverso tentativi ed errori. Ad esempio, modificare un elettrodo (positivo o negativo), invece di entrambi gli elettrodi, alla volta e apportare modifiche graduali in una direzione specificata prima di passare a un'altra direzione invece di apportare modifiche irregolari in direzioni casuali.
4. Registrazione ECG
- Aprire il programma di acquisizione dati ECG. Selezionare l'impostazione desiderata dai menu a discesa per intervallo, passaggio basso e passaggio alto. Ad esempio, la seguente impostazione nel sistema di registrazione ECG in vivo utilizzato in questo esperimento produce un rapporto segnale-rumore costante e soddisfacente per un normale pesce zebra adulto: gamma "2 mV", passaggio basso "120 Hz" e passaggio alto "0,03 s".
- Premere Start per avviare la registrazione ECG senza spazi continui a una velocità di campionamento di 1 kHz.
- Per ottimizzare il posizionamento del piombo per un rapporto segnale-rumore massimo, premere Stop per interrompere la registrazione ECG e rivedere la traccia ECG subito dopo il primo tentativo di registrazione per ogni cuore. Per diagnosticare che un ECG di pesce zebra adulto è normale, verificare che tutti i seguenti quattro criteri di convalida siano soddisfatti (Figura 1):
- Criterio 1: Assicurarsi che tutte le forme d'onda ECG (P, QRS e T) siano distinte e facilmente visibili.
- Criterio 2: Assicurarsi che l'onda P sia positiva.
- Criterio 3: Assicurarsi che il complesso QRS netto sia positivo (cioè l'ampiezza dell'onda R è maggiore della somma delle ampiezza delle onde Q e S).
- Criterio 4: Assicurarsi che l'onda T sia positiva.
- Se è previsto un ECG normale, riposizionare gli elettrodi (provare prima l'elettrodo negativo) se necessario, fino a quando tutti e quattro i criteri di convalida non sono soddisfatti.
- Se è prevista una normale onda T, ma l'onda T è troppo piccola, riposizionare gli elettrodi per massimizzare l'ampiezza dell'onda T.
- Riprendere la registrazione ECG dopo aver ottimizzato il posizionamento dei lead. Salvare le sweep ECG per l'analisi successiva.
5. Recupero dall'anestesia
- Alla fine della sessione di registrazione ECG, rimuovere con attenzione gli elettrodi senza ferire il pesce. Trasferire il pesce in acqua di pesce fresca e ossigenata senza tricaina.
- Per facilitare il recupero dall'anestesia, spruzzare l'acqua sulle branchie vigorosamente con una pipetta Pasteur fino a quando il pesce riprende il movimento regolare della branchia o il nuoto.
- Monitorare il pesce per il recupero completo dall'anestesia (in genere 1-2 min), come indicato dalla capacità di pesce di nuotare in posizione verticale per almeno 5 s.
6. Interpretazione ECG
- Definire le impostazioni di analisi.
- Conoscere l'interfaccia software (Tabella dei materiali) leggendo il manuale operativo del software di analisi dei dati ECG.
NOTA: Anche se le indicazioni riportate di seguito sono specifiche del software commerciale utilizzato nel nostro laboratorio, le attività di base da eseguire sono essenzialmente le stesse in qualsiasi pacchetto software per l'analisi ECG. - Aprire il programma di analisi dei dati ECG. Dal menu File, selezionare Apri per aprire il file ECG di interesse e visualizzare la traccia ECG completa. Utilizzare il mouse per trascinare una sezione di interesse nella traccia ECG da analizzare.
- Dal menu Analisi ECG, selezionare Impostazioni ECG per aprire una finestra di dialogo per predefinire varie impostazioni dei parametri per l'analisi automatica del software (Figura 5A).
- Conoscere l'interfaccia software (Tabella dei materiali) leggendo il manuale operativo del software di analisi dei dati ECG.
- Analizzare il ritmo cardiaco e la frequenza.
NOTA: la frequenza cardiaca dipende da diversi fattori, tra cui l'età e la tensione del pesce zebra, gli agenti di anestesia (adesempio, la tricaina, l'isoflurane, ecc.) e la concentrazione, l'uso dell'anestesia (agente singolo 5,7 contro agenti combinati 5 ) e gli agenti combinati5e tempo di esposizione5. Ad esempio, in questo studio la frequenza cardiaca del pesce zebra AB di tipo selvatico di 12-18 mesi dopo 3-5 minuti di immersione nella soluzione di 0,02-0,04% di tricaina è stata di 116 battiti al minuto (n - 9), coerente con i rapporti di letteratura sulla frequenza cardiaca per questa fascia di età e anestetico 5,7.- Determinare se il ritmo cardiaco è sinus o no, regolare o irregolare.
NOTA: La presenza (o assenza) del ritmo del seno si basa sulla presenza (o assenza) di un'onda P eretta che precede ogni QRS da un normale intervallo di PR (ad esempio, 60-65 ms per il pesce zebra AB di liu et al. di 10-12 mesi 7 e 12-18 mesi in questo studio). La regolarità del ritmo atriale e ventricolare (o irregolarità) si basa sulla regolarità (o irregolarità) degli intervalli successivi di PP o RR, rispettivamente. - Per determinare la frequenza cardiaca, assicurarsi che il software identifichi correttamente tutte le onde P e R. Sulla base di queste identificazioni automatiche (o correzioni manuali) delle onde P e R, il software misura automaticamente tutti gli intervalli PP e RR nella selezione ECG, calcola le medie di intervallo per generare il tasso atriale e ventricolare.
NOTA: Il tasso atriale è l'intervallo medio di PP, mentre il tasso ventricolare è l'intervallo RR medio. Per determinare la frequenza cardiaca, è fondamentale la corretta identificazione delle onde P e R. - Correggere eventuali errori di identificazione automatica spostando i cursori spostati sulle onde P e R appropriate (Figura 5B).
NOTA: Se il cuore è in ritmo sinusale, la frequenza atriale e la velocità ventricolare sono le stesse a causa della corrispondenza uno-a-uno tra le onde del sinusa e i complessi QRS. Tuttavia, nel caso della dissociazione atrioventricolare (ad esempio, in tachicardia ventricolare o blocco atrioventricoculare di terzo grado), questa corrispondenza uno-a-uno tra le onde P e i complessi QRS viene persa; pertanto, ci sono due frequenze cardiache perché la frequenza atriale è diversa dalla frequenza ventricolare. - Determinare la frequenza cardiaca in base ad almeno cinque cicli cardiaci completi consecutivi se il ritmo cardiaco è regolare, o una striscia di almeno sei secondi se il ritmo cardiaco è irregolare.
- Determinare se il ritmo cardiaco è sinus o no, regolare o irregolare.
- Calcolare gli intervalli e le durate delle onde.
- Passare a ECG Analysis > Averaging View per concatenare n (ad esempio, 5) cicli cardiaci consecutivi in un unico segnale medio (Figura 5C).
NOTA: Se le forme d'onda ECG di un singolo ciclo cardiaco divergono sostanzialmente dal segnale medio, studiare il ciclo cardiaco separatamente senza concatenazione. - Assicurarsi che il software identifichi correttamente l'inizio e la fine dell'ondata P, del complesso QRS e dell'onda T visualizzati nella finestra Vista media (Figura5C). Sulla base di queste identificazioni automatiche (o correzioni manuali) di queste onde e intervalli, il software misura automaticamente le durate come definite convenzionalmente.
NOTA: l'intervallo PR si estende dall'inizio dell'onda P all'inizio del complesso QRS (o il complesso RS se l'onda Q non è visibile). La durata QRS si estende dall'inizio dell'onda Q (o l'onda R se l'onda Q non è visibile) fino alla fine dell'onda S (cioè il punto J; Figura 1). L'intervallo QT si estende dall'inizio dell'onda Q (o l'onda R se l'onda Q non è visibile) fino alla fine dell'onda T. Pertanto, per calcolare intervalli e durate, è fondamentale l'identificazione corretta dell'inizio e della fine dell'onda P, del complesso QRS e dell'onda R. - Correggere eventuali errori di identificazione automatica spostando i cursori spostati nelle posizioni appropriate.
- Selezionare il picco negativo dell'onda S come fine del complesso QRS7 perché il punto J del pesce zebra che indica la fine dell'onda S può essere particolarmente difficile da identificare con precisione. Ciò causerà una leggera sottovalutazione della durata effettiva del QRS.
NOTA: il software di analisi ECG corregge automaticamente l'intervallo QT al tasso ventricolare (o intervallo RR) per generare l'intervallo QT corretto QTc utilizzando il metodo preselezionato dall'utente nel passaggio 6.1.3, ad esempio Bazett (Figura 5A). La formula di Bazett (1920) QTc - QT / RR è il più popolare e il primo di diversi metodi proposti per correggere l'intervallo QT umano per la frequenza cardiaca. Poiché l'accuratezza della formula di Bazett è stata messa in discussione, fare riferimento ad altri metodi proposti per gli esseri umani10,11 e pesce zebra6 (Figura 5D).
- Passare a ECG Analysis > Averaging View per concatenare n (ad esempio, 5) cicli cardiaci consecutivi in un unico segnale medio (Figura 5C).
- Interpretare le anomalie ECG riconoscendo le eccezioni per i quattro criteri di convalida al passaggio 4.3.
- Riconoscere le eccezioni per il criterio 1.Recognize exceptions for criterion 1. In assenza di onde P (che indica l'assenza di ritmo sinusale), fare affidamento sugli intervalli RR e sulla durata QRS per diagnosticare il ritmo cardiaco. Ad esempio, se gli intervalli RR sono irregolarmente irregolari, diagnosticare la fibrillazione atriale; se gli intervalli RR sono regolari e il QRS è normalmente stretto, diagnosticare il ritmo di fuga giunzionale; d'altra parte, se gli intervalli RR sono regolari e il QRS è anormalmente prolungato, diagnosticare il ritmo di fuga ventricolare.
- Riconoscere le eccezioni per il criterio 2.Recognize exceptions for criteriat 2. Quando l'onda P è negativa (o invertita), diagnosticare l'attivazione atriale retrograda da un pacemaker ectopico (come un sito atriale a valle del nodo del sinus, del nodo atrioventricolare o del ventricolo).
- Riconoscere le eccezioni per il criterio 3.Recognize exceptions for criterion 3. Quando le onde Q alte e strette si presentano con onde P e T negative negative, diagnosticare l'inversione del piombo a causa di un interruttore errato delle posizioni degli elettrodi positivi e negative perché quelle onde Q alte e strette erano vere onde R erroneamente invertite (Figura6D ). Al contrario, quando le onde Q di grandi dimensioni presentano onde P positive a seguito di lesioni cardiache significative, diagnosticare l'infarto miocardico perché quelle onde Q ampie sono vere onde Di Se patologiche.
- Riconoscere le eccezioni per il criterio 4.Recognize exceptions for criterion 4. Quando l'onda T viene invertita, ispezionare l'attivazione ventricolare per identificare se l'anomalia di ripolarizzazione ventricolare è primaria o secondaria. Affidarsi allo scenario clinico per restringere la diagnosi corretta da un elenco differenziale di anomalia di ripolarizzazione ventricolare primaria (da effetti farmacologici o ischemia miocardiale; Figura 6C) rispetto all'anomalia della ripolarizzazione ventricolare secondaria (a causa dell'attivazione ventricolare aberrante da pre-eccitazione, ectopy ventricolare o stimolazione ventricolare).
- Esportare i risultati ECG.
- Selezionare Vista tabella per esaminare tutte le misurazioni ECG. Selezionare le misure di interesse da copiare e incollare nel documento desiderato (ad esempio, foglio di calcolo Excel).
- Per esportare una traccia ECG, evidenziare una sezione di interesse nella sweep ECG utilizzando l'icona della lente di ingrandimento. Copiare e incollare nel documento desiderato (ad esempio, Word o PowerPoint).
Risultati
La figura 1 illustra la rilevanza clinica del metodo qui presentato. L'elettrocardiografia superficiale in vivo per il pesce zebra adulto è uno strumento essenziale di fenotipizzazione elettrica a causa delle notevoli somiglianze tra il pesce zebra e l'ECG umano, nonostante le loro vaste differenze anatomiche. Il cuore di pesce zebra ha un solo atrio e un ventricolo in contrasto con il cuore umano con due atri e due ventricoli (in alto fila; destra e sinistra, rispettivamente). Tuttavia, nonostante la sua apparente semplicità anatomica, il cuore del pesce zebra condivide diverse caratteristiche ECG con il cuore umano (riga inferiore; destra e sinistra, rispettivamente) Pertanto, il cuore del pesce zebra è emerso come un modello surrogato per il cuore umano elettrofisiologia5,12,13. La figura 1 illustra un'onda Q piccola ma distinta da un pesce zebra vivo e sano di 14 mesi. Tuttavia, nel pesce zebra ECG, il posizionamento del piombo non è comunemente ottimizzato per dimostrare l'onda Q. Pertanto, l'onda Q è comunemente invisibile, e un complesso RS è più comunemente visto rispetto al complesso QRS completo in eCG di pesce zebra.
La Figura 2 riassume i quattro passaggi d'azione essenziali per condurre un'elettrocardiografia in vivo minimamente invasiva per i pesci zebra adulti. A seguito dell'induzione dell'anestesia (fase 1) e del posizionamento degli elettrodi (passaggio 2), abbiamo registrato i segnali ECG di base (fase 3) da pesci zebra AB di tipo selvatico sani di 12 a 18 mesi di età (n - 9). La nostra tecnica di inserimento degli elettrodi era solo minimamente invasiva perché non avevamo bisogno di sbucciare le squame di pesce o eseguire la pericardiotomia. In seguito all'acquisizione dei dati, abbiamo esaminato e verificato manualmente ogni registrazione ECG (passaggio 4) per evitare potenziali interpretazioni errate da parte dell'analisi automatica del software.
La figura 3 mostra i tre componenti indispensabili di un tipico sistema di acquisizione ed elaborazione dei dati ECG: un hardware di acquisizione dati ad alte prestazioni, un amplificatore differenziale ad alto guadagno e un computer caricato con un software per i dati ECG l'acquisizione e l'analisi. Nel nostro laboratorio, abbiamo adattato un sistema di registrazione ECG commerciale esistente in vivo originariamente progettato per piccoli modelli di mammiferi (come topi, ratti e conigli) per ospitare il modello di pesce zebra adulto.
La Figura 4 dimostra che un corretto posizionamento del piombo richiede l'allineamento del piombo con il presunto asse principale cardiaco. Nella registrazione ECG in vivo del pesce zebra, poiché viene utilizzato un solo lead, è fondamentale un corretto posizionamento del piombo per massimizzare contemporaneamente sia le ampiezze delle onde R che T. Per massimizzare le ampiezze delle onde R e T, abbiamo allineato gli elettrodi di piombo positivi e negativi con l'asse principale cardiaco, presumibilmente nell'orientamento cranio cavoale sinistro a destro. Dopo la toracotomia e la pericardiotomia per aprire il sacco pericardico ed esporre il cuore, l'asse principale cardiaco diventa evidente (Figura4B linea tratteggiata bianca). Infatti, la pericardiotomia per esporre il cuore è una strategia comunemente utilizzata per aumentare il rapporto segnale-rumore7 al costo della conversione della registrazione ECG da una procedura minimamente invasiva in una procedura altamente invasiva.
Nella figura 5 vengono illustrati i passaggi critici dell'analisi ECG. In primo luogo, sono state definite le varie impostazioni dei parametri per l'analisi automatica del software utilizzando la finestra di dialogo Impostazioni ECG (Figura5A). Poiché riutilizziamo un'apparecchiatura di registrazione ECG esistente progettata per i modelli di mammiferi per accogliere i pesci zebra adulti, l'impostazione Rilevamento e analisi per il pesce zebra non è disponibile. Abbiamo scelto invece il Preset Umano, data la notevole somiglianza tra eSCG di pesce zebra con l'ECG umano (Figura 5A). In secondo luogo, abbiamo verificato manualmente l'identificazione ECG automatica del software (in nero) dei picchi delle onde R e corretto (in rosso) eventuali errori di identificazione automatica dell'onda R prima di comandare al software di ricalcolare il tasso medio di ventricolare. Ad esempio, nella figura 5B, una grande onda P in relazione all'onda R ingannato il software in modo errato identificare le onde R, portando al successivo calcolo automatico errato dell'intervallo RR o tasso ventricolare. Pertanto, la verifica umana e le correzioni appropriate in base alle esigenze sono fondamentali nell'analisi ECG. In terzo luogo, abbiamo rapidamente valutato la regolarità del ritmo e calcolato la durata media delle onde e degli intervalli utilizzando la vista in media ( Figura5C) per concatenare diversi cicli cardiaci consecutivi (verde) in un unico segnale medio (nero). Qui in Figura 5C, la deviazione trascurabile tra ciascuno dei nove cicli cardiaci e il segnale medio sostiene l'eccellente regolarità del ritmo di questo cuore di pesce zebra. Infine, abbiamo abilitato il software per correggere automaticamente l'intervallo QT per la frequenza cardiaca utilizzando Bazett, uno dei sette diversi metodi disponibili (Figura 5D).
Figura 6A -C dimostra come la profondità del posizionamento degli elettrodi influenzi le ampiezza dei segnali ECG. Quando abbiamo erroneamente inserito gli elettrodi troppo superficialmente nel derma (Figura 6A), il piombo era "indiretto" -like (più di due diametri cardiaci dal cuore, simile allo standard indiretto umano ECG limb I, II, e III) e la tensione i segnali erano piccoli. Quando abbiamo inserito opportunamente gli elettrodi 1 mm più in profondità nella muscolatura pettorale (Figura 6B), il piombo è diventato "semidiretto" (in prossimità ma non a contatto diretto con il cuore) e i segnali di tensione sono aumentati. Le forme d'onda ECG sono diventate facilmente visibili. Tuttavia, quando abbiamo erroneamente inserito gli elettrodi ancora più in profondità nel ventricolo (Figura 6C), il piombo è diventato "diretto" (a contatto diretto con il cuore) e i segnali di tensione sono aumentati ulteriormente. L'ampiezza dell'onda R nella figura 6C è aumentata di otto volte rispetto alla figura 6A e di quattro volte rispetto alla figura 6B. Tuttavia, la traccia ECG nella Figura 6C ha rivelato nuovi segni di lesioni al miocardio ventricolare, come la nuova depressione ST e nuova inversione delle onde T.
Figura 6D dimostra come le inversioni insolite di tutte le forme d'onda ECG (P, Q, R, S, e T) dovrebbero segnalare un errore di inversione di piombo, in cui gli elettrodi positivi e negativi commutati posto. Si noti che per definizione Q e S sono sempre negativi mentre R è sempre positivo.
Figura 6E -F mostra come la profondità di anestesia inappropriata possa compromettere la qualità della registrazione ECG in vivo. Nella figura 6E, l'anestesia inadeguata (0,017% tricaina) ha portato al mancato immobilizzazione del pesce zebra completamente. Gli artefatti di movimento risultanti abbassarono il rapporto segnale-rumore contaminando il segnale (asterisco) sia aumentando il rumore (frecce). Al contrario, nella figura 6F, l'anestesia in overdose (0,08% tricaina) ha indotto gravi sinus bradyarrhythmia così come i cambiamenti del segmento ST e onda T.
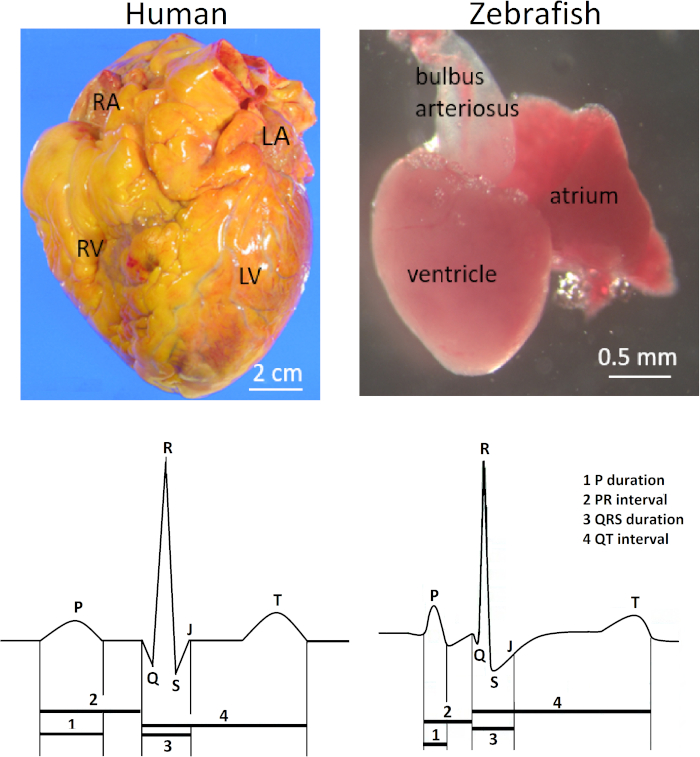
Figura 1: A differenza di anatomia ed ECG dei cuori umani e di pesce zebra. In contrasto con il cuore umano con due atri e due ventricoli, il cuore di pesce zebra ha un solo atrio e un ventricolo (fila superiore). Abbreviazioni: RA, atrio destro; LA, atrio sinistro; RV, ventricolo destro; LV: ventricolo sinistro. Il cuore del pesce zebra condivide diverse caratteristiche ECG comuni con il cuore umano (riga inferiore). Fare clic qui per visualizzare una versione più grande di questa figura.
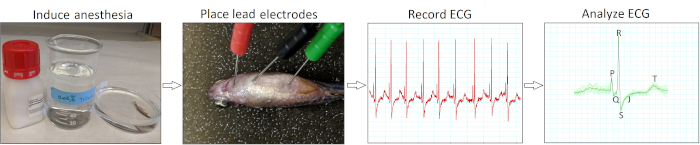
Figura 2: Protocollo di registrazione ECG in vivo minimamente invasivo. Un diagramma di flusso schematico illustra quattro fasi di azione critica nello svolgimento di un interrogatorio ECG in vivo: indurre l'anestesia, posizionare gli elettrodi di piombo ECG, registrare e analizzare l'ECG e analizzare le registrazioni ECG. Fare clic qui per visualizzare una versione più grande di questa figura.
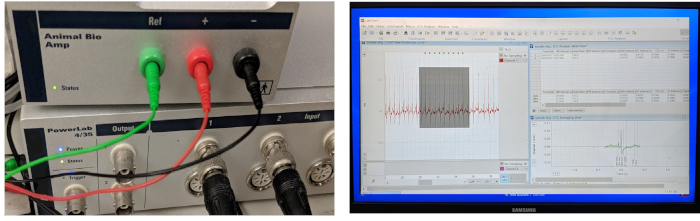
Figura 3: Sistema di acquisizione ed elaborazione dei dati ECG. I tre componenti chiave di un sistema di registrazione ECG integrato in vivo includono un hardware per l'acquisizione di dati, un amplificatore e un software per computer per l'acquisizione e l'analisi dei dati. L'amplificatore è dotato di tre microelettrodi in acciaio inossidabile 29 calibro pronti all'uso. Fare clic qui per visualizzare una versione più grande di questa figura.
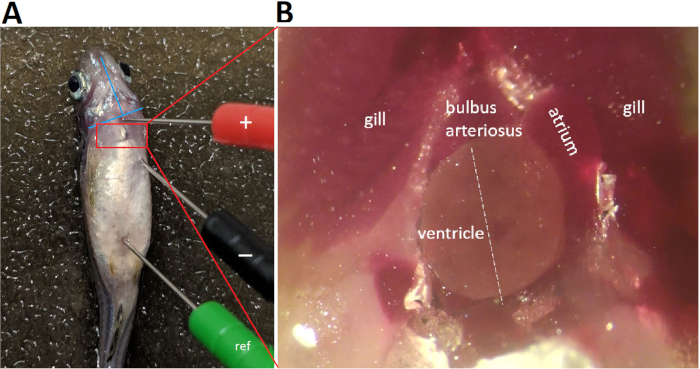
Figura 4: Posizionamento dei lead ECG. Tre elettrodi in acciaio inossidabile codificati a 29 calibro 29 vengono inseriti in modo sicuro nella muscolatura del pesce a circa 1 mm di profondità. Il posizionamento dell'elettrodo negativo (nero) e dell'elettrodo positivo (rosso) stabilisce un piombo bipolare nel piano frontale, lungo un orientamento cranio cavoale sinistro a destro. Abbreviazione: ref, elettrodo di riferimento Clicca qui per visualizzare una versione più grande di questa figura.
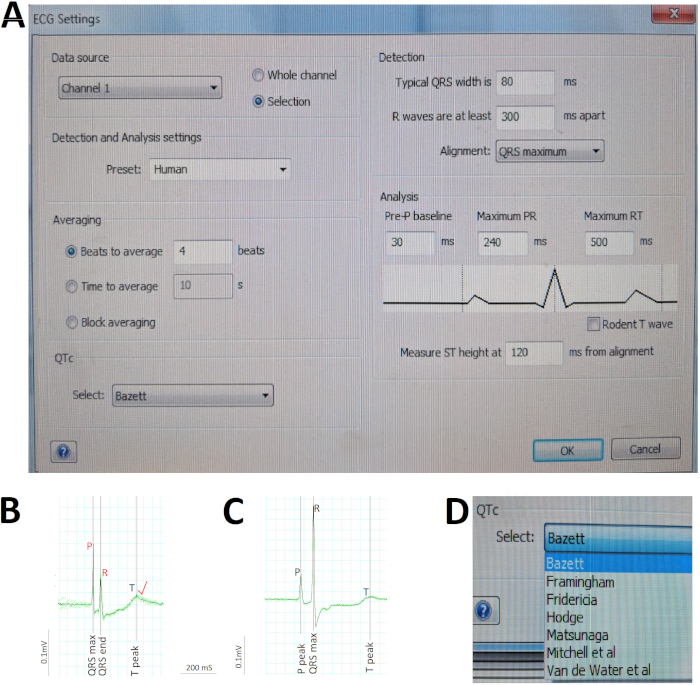
Figura 5: C nell'analisi ECG. (A) Predefinire le varie impostazioni dei parametri per l'analisi automatica del software. (B) Correggere manualmente (rosso) due errori di identificazione automatica da parte del software (nero) delle onde P e R per correggere il calcolo errato del software del tasso atriale e ventricolare. (C) Concatenare nove cicli cardiaci consecutivi (verdi) in un unico segnale medio (nero) per valutare rapidamente le regolarità/irregolarità ritmiche e calcolare le durate medie di onde e intervalli. (D) Correggere l'intervallo QT per la frequenza cardiaca utilizzando uno dei vari metodi, ad esempio Bazett. Fare clic qui per visualizzare una versione più grande di questa figura.
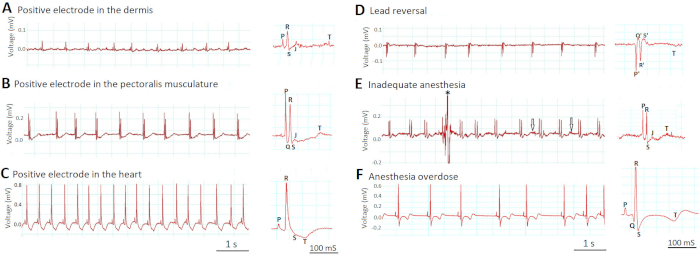
Figura 6: Effetti del posizionamento del piombo e della profondità dell'anestesia sui segnali ECG. Due passaggi più critici che determinano il successo della registrazione ECG in vivo sono il posizionamento del lead (A-D) e la profondità dell'anestesia (E-F). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Quando si registra ECG in vivo per il pesce zebra adulto per mezzo di un singolo lead, come abbiamo dimostrato in questo studio, ci sono una serie di avvertimenti sulla qualità e la validità dei risultati della registrazione ECG. In primo luogo, nella scelta degli anestetici appropriati e nel determinare la concentrazione minima dell'anestesia, della profondità e della durata, bilanciare le cardiotossicità anestetiche con la necessità critica di sopprimere gli artefatti di movimento e la determinazione preventiva per una progettazione sperimentale terminale. Sfruttando la potenza sinergica di una combinazione di anestetici multipli provenienti da diverse classi di farmaci5,14 e paralitici1,6 per abbassare la dose di singoli agenti5 o somministrazione una dose di bassa manutenzione che segue una dose di induzione più elevata sono strategie tipiche. Tuttavia, nonostante le sue ben note potenziali tossicità cardiorespiratorie, tra cui la morte8, la tricaina è ancora la più utilizzata, la migliore disponibile e l'unica anestetico approvata dalla Food and Drug Administration (FDA) statunitense per il pesce zebra Anestesia. La tricaina è stata popolarmente utilizzata nella registrazione ECG del pesce zebra adulto sia come singolo agente che in combinazione con altri anestetici o paralitici.
In secondo luogo, la precisione di posizionamento del piombo può essere garantita almeno per il pesce zebra normale sano utilizzando i nostri quattro criteri di convalida per un normale ECG di pesce zebra adulto. Dei quattro criteri di convalida che proponiamo qui, gli ultimi due criteri confermano insieme la concordanza fondamentale tra la polarità dell'onda R e quella dell'onda T in una normale ECG5,7,15. Questa concordanza delle onde R e T è una somiglianza fortuita, ma critica, tra il pesce zebra e l'uomo16,17 ECG normale che contribuisce alla rilevanza clinica del modello di cuore del pesce zebra come surrogato per il cuore umano Elettrofisiologia. Tuttavia, diverse condizioni benigne o maligne possono invalidare uno dei quattro criteri di convalida. Ad esempio, la concordanza delle onde R e T si perde nell'ischemia miopidea7,15. Questa perdita di concordanza delle onde R e T nell'ischemia miocardiale è un'altra sorprendente somiglianza tra il pesce zebra e l'ECG umano che contribuisce alla rilevanza clinica del modello di infarto miocardico del pesce zebra.
Infine, raccomandiamo una prassi standard nell'analisi ECG. Con l'avvento della tecnologia, il software di analisi ECG è in grado di generare un'interpretazione ECG automatica. Tuttavia, consigliamo vivamente che gli esseri umani addestrati reinterpretino e verifichino sempre tutti gli ECG in base al rispettivo scenario clinico che porta alla registrazione ECG. L'eccessiva dipendenza di routine esclusivamente dall'interpretazione automatica da parte di un software di analisi ECG è sconsigliabile, in particolare in presenza di comuni varianti ECG normali, patologie cardiache o posizionamento del piombo non ottimale.
Questo studio si concentra sul metodo minimamente invasivo per brevi sessioni di registrazione ECG. Tuttavia, in caso di necessità di sessioni di registrazione ECG prolungate terminali della durata di ore, sono necessarie modifiche per fornire un'adeguata ossigenazione, idratazione e anestesia mediante perfusione continua6.
Inoltre, migliorare il rapporto segnale-rumore di uno dei tre modi. La scelta di un amplificatore più potente è spesso un'opzione costosa, se non impraticabile. Aprire il sacco pericardio per ridurre il conduttore del volume è un approccio ragionevole, anche se invasivo, che è stato adottato7. Posizionamento strategico del piombo per allineare l'asse di piombo in una direzione parallela all'asse cardiaco principale (Figura 4B) massimizza i segnali di tensione ECG, ma può richiedere tentativi ed errori, soprattutto in assenza di pericardiotomia.
Il metodo di interrogatorio ECG in vivo per il pesce zebra adulto che abbiamo presentato qui offre quattro vantaggi principali. In primo luogo, il nostro approccio minimamente invasivo richiede solo l'inserimento di elettrodi, ma nessuna rimozione della scala di pesce o toracotomia-pericardiotomia. Pertanto, riducendo al minimo il dolore per i pesci, il nostro approccio consente ripetuti interrogatori ECG negli studi di sopravvivenza longitudinale. In secondo luogo, quando gli anestetici sopprimono adeguatamente il movimento dei pesci, il sistema di registrazione ECG in vivo nel nostro studio produce costantemente un rapporto segnale-rumore soddisfacente con segnali grezzi privi di rumore. In terzo luogo, la convalida della qualità a quattro criteri che proponiamo qui garantisce l'accuratezza e la robustezza dei dati nelle prime fasi dell'acquisizione dei dati ECG e riduce al minimo le variazioni dipendenti dall'operatore. Infine, in particolare, il nostro ultimo criterio di convalida (l'onda T normale è verticale) incapsula la concordanza dell'onda R e dell'onda T, un'importante caratteristica umana del normale ECG (Figura 1).
Tuttavia, esistono ancora quattro limitazioni principali all'attuale metodologia ECG in vivo per il pesce zebra adulto da parte del nostro gruppo e di altri.
In primo luogo, la mancanza di cooperazione in materia richiede la necessità di anestesia con le sue limitazioni delle conseguenze di tossicità cardiorespiratoria. Per l'interrogatorio ECG in vivo, mentre i pazienti umani non hanno mai bisogno di sedazione, il pesce zebra ha sempre bisogno di anestetici o paralitici, che causano tossicità cardiorespiratorie variabili.
In secondo luogo, la necessità di garantire i cavi ECG collegati eleva leggermente l'invasività di una procedura altrimenti non invasiva. Mentre il posizionamento del piombo nella registrazione ECG del corpo-superficie dell'uomo è del tutto non invasivo perché gli elettrodi aderiscono all'epidermide umana, il posizionamento del piombo per la registrazione ECG in vivo del pesce zebra è più invasivo perché, come minimo, gli elettrodi in acciaio devono forare la pelle del pesce per l'inserimento sicuro nella muscolatura di pesce.
Le ultime due limitazioni derivano dai vincoli anatomici del petto e del cuore del pesce zebra. In terzo luogo, la dimensione minuscola del cuore di pesce zebra adulto richiede una drastica riduzione del numero di cavi ECG. Mentre gli esseri umani ospitano prontamente dodici cavi in una registrazione ECG standard, il pesce zebra adulto può in genere ospitare solo un singolo piombo unipolare o bipolare. La ramificazione di un singolo cavo ECG è la sfida per ottimizzare contemporaneamente le ampiezza di tutte e tre le onde P, R e T. Pertanto, l'importanza di un posizionamento ottimale e accurato del piombo nell'interrogatorio ECG del pesce zebra non può essere sopravvalutata. Nel pesce zebra, l'onda T presenta una sfida di rilevamento unica perché è spesso la più piccola di queste tre onde. Pertanto, l'ampiezza delle onde T del pesce zebra dovrebbe ricevere la priorità di ottimizzazione sulle onde P e R tipicamente più grandi.
Quarto, determinare l'asse cardiaco principale del pesce zebra per massimizzare l'ampiezza dell'onda R può essere difficile. La ragione è che il cuore del pesce zebra ha più libertà di movimento all'interno del suo sacco pericardico sciolto rispetto al cuore umano all'interno del suo pericardio simile a un guanto.
Nel complesso, queste limitazioni stimoleranno l'innovazione dei metodi futuri. Con l'avvento della stampa 3D e dell'elettronica deformabile18,c'è speranza per l'impianto diretto del piombo un giorno in veglia, vigile, pesce zebra nuoto utilizzando un 'calzino cardiaco' di sensori di elettrodi wireless.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dai National Institutes of Health R01 HL141452 a TPN. ADInstruments ha gentilmente fornito generosi finanziamenti per coprire il costo dell'editoria ad accesso aperto, ma non ha avuto alcun ruolo nella progettazione sperimentale, nell'acquisizione dei dati, nell'analisi dei dati di questo studio o nell'accesso al manoscritto prima della pubblicazione.
Materiali
| Name | Company | Catalog Number | Comments |
| Culture dishes | Fisher Scientific | FB087571 | 100 mm x 20 mm |
| Dumont Forceps | Fine Sciense Tools | 11253-20 | 0.1 x 0.06 mm |
| FE136 Animal Bio Amp | AD Instruments | FE231 | |
| Iris Forceps | Fine Sciense Tools | 11064-07 | 0.6 x 0.5 mm |
| LabChart 8 Pro | AD Instruments | Software with ECG Module | |
| Needle electrodes for Animal Bio Amp | AD Instruments | MLA1213 | 29 gauge |
| Plastic Disposable Transfer Pipets | Fisher Scientific | 13-669-12 | 6 in., 1.2 mL |
| PowerLab 4/35 | AD Instruments | 4//35 | |
| Scissors | Fine Sciense Tools | 15000-08 | 2.5 mm, 0.075 mm |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma | E10521-10G | MS-222 |
Riferimenti
- Arnaout, R., et al. Zebrafish model for human long QT syndrome. Proceedings of the National Academy of Sciences of the United States of America. 104 (27), 11316-11321 (2007).
- Hassel, D., et al. Deficient zebrafish ether-a-go-go-related gene channel gating causes short-QT syndrome in zebrafish reggae mutants. Circulation. 117 (7), 866-875 (2008).
- Meder, B., et al. Reconstitution of defective protein trafficking rescues Long-QT syndrome in zebrafish. Biochemical and Biophysical Research Communication. 408 (2), 218-224 (2011).
- Sieber, S., et al. Zebrafish as a preclinical in vivo screening model for nanomedicines. Advanced Drug Delivery Reviews. , (2019).
- Lin, M. H., et al. Development of a rapid and economic in vivo electrocardiogram platform for cardiovascular drug assay and electrophysiology research in adult zebrafish. Science Reports. 8 (1), 15986 (2018).
- Milan, D. J., Jones, I. L., Ellinor, P. T., MacRae, C. A. In vivo recording of adult zebrafish electrocardiogram and assessment of drug-induced QT prolongation. American Journal of Physiology-Heart and Circulation Physiology. 291 (1), H269-H273 (2006).
- Liu, C. C., Li, L., Lam, Y. W., Siu, C. W., Cheng, S. H. Improvement of surface ECG recording in adult zebrafish reveals that the value of this model exceeds our expectation. Science Reports. 6, 25073 (2016).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. Ilar Journal. 53 (2), 192-204 (2012).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Sagie, A., Larson, M. G., Goldberg, R. J., Bengtson, J. R., Levy, D. An improved method for adjusting the QT interval for heart rate (the Framingham Heart Study). American Journal of Cardiology. 70 (7), 797-801 (1992).
- Luo, S., Michler, K., Johnston, P., Macfarlane, P. W. A comparison of commonly used QT correction formulae: the effect of heart rate on the QTc of normal ECGs. Journal of Electrocardiology. 37 Suppl, 81-90 (2004).
- Vornanen, M., Hassinen, M. Zebrafish heart as a model for human cardiac electrophysiology. Channels (Austin). 10 (2), 101-110 (2016).
- Tsai, C. T., et al. In-vitro recording of adult zebrafish heart electrocardiogram - a platform for pharmacological testing). Clinica Chimica Acta. 412 (21-22), 1963-1967 (2011).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of American Association of Lab Animal Sciences. 53 (2), 198-203 (2014).
- Sun, Y., et al. Activation of the Nkx2.5-Calr-p53 signaling pathway by hyperglycemia induces cardiac remodeling and dysfunction in adult zebrafish. Disease Model and Mechanism. 10 (10), 1217-1227 (2017).
- Franz, M. R., Bargheer, K., Rafflenbeul, W., Haverich, A., Lichtlen, P. R. Monophasic action potential mapping in human subjects with normal electrocardiograms: direct evidence for the genesis of the T wave. Circulation. 75 (2), 379-386 (1987).
- Chiale, P. A., et al. The multiple electrocardiographic manifestations of ventricular repolarization memory. Current Cardiology Reviews. 10 (3), 190-201 (2014).
- Xu, L., et al. 3D multifunctional integumentary membranes for spatiotemporal cardiac measurements and stimulation across the entire epicardium. Nature Communications. 5, 3329 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon