Method Article
Eletrocardiografia de superfície vivo para zebrafish adulto
Neste Artigo
Resumo
Aqui, apresentamos um método confiável, minimamente invasivo e econômico para registrar e interpretar eletrocardiogramas em zebrafish adulto anestesiado ao vivo.
Resumo
As formas de onda do electrocardiograma do zebrafish adulto e daquelas dos seres humanos são notàvelmente similares. Estas similaridades do electrocardiograma aumentam o valor do zebrafish não somente como um modelo da pesquisa para a electrofisiologia e os miopatias cardíacos humanos mas igualmente como um modelo substituto no exame farmacêutico da taxa de transferência elevada para cardiotoxicities potenciais a humanos, como prolongamento do intervalo QT. Como tal, a eletrocardiografia in vivo para o zebrafish adulto é uma ferramenta de fenotipagem elétrica que é necessária, se não indispensável, para caracterizações eletrofisiológicas transversais ou longitudinais in vivo. No entanto, com demasiada frequência, a falta de um método de gravação fiável, prático e rentável continua a ser um grande desafio que impede esta ferramenta de diagnóstico in vivo de se tornar mais prontamente acessível. Aqui, descrevemos uma abordagem prática e direta para a eletrocardiografia in vivo para o zebrafish adulto usando um sistema de baixa manutenção, econômico e abrangente que produz gravações consistentes e confiáveis. Nós ilustramos nosso protocolo usando o zebrafish masculino adulto saudável de 12-18 meses da idade. Também apresentamos uma estratégia de interpretação rápida em tempo real para validação de qualidade para garantir a precisão dos dados e robustez no início do processo de gravação do eletrocardiograma.
Introdução
O coração do zebrafish (Danio rerio) é localizado anteroventrally à cavidade torácica entre o opérculo e as cintas peitorais. O coração é fechado rather frouxamente dentro de um saco pericárdico Silver-colored. Anatomicamente, o coração zebrafish é diferente dos quatro-sepados humanos e outros corações de mamíferos por causa de sua escala diminutiva (100 vezes menor do que o coração humano) e sua estrutura de duas câmaras consistindo de apenas um átrio e um ventrículo. No entanto, as formas de onda do eletrocardiograma (ECG) e a duração do intervalo QT de ambas as espécies são notavelmente semelhantes (Figura 1). Assim, o zebrafish surgiu como um modelo popular para o estudo de arritmias hereditárias humanas1,2,3 e para a triagem de medicamentos de alta produtividade de potenciais carditoxicidades humanas4,5 , como prolongamento do intervalo QT.
Na avaliação rotineira de doenças cardíacas humanas, o ECG da corpo-superfície transformou-se a ferramenta diagnóstica não invasora de primeira linha o mais extensivamente usada desde sua invenção por Einthoven em 1903. Em contraste, desde a primeira adaptação do método de gravação de ECG do corpo-superfície para o zebrafish adulto em 20066 e diversas modificações depois disso7, esta técnica remanesceu pela maior parte inacessível a muitos investigadores no campo apesar a popularidade deste modelo animal. Para outros pesquisadores que realizaram a interrogação in vivo de ECG para o zebrafish adulto, as variações largas entre operadores conduziram à inconsistência em resultados de ECG dos estudos diferentes. As razões comuns incluem os dispositivos e o software especializados complicados e caros, a baixa relação do sinal-à-ruído, e a confusão a respeito da colocação do elétrodo, tudo agravado ainda por uma compreensão incompleta das características adultas do ECG do zebrafish e mecanismos de tecido subjacente. Tendo em conta que o ECG in vivo é a única ferramenta diagnóstica para o fenótipo de zebrafish vivo, há uma clara necessidade de um método padronizado para melhorar a sensibilidade e especificidade, reprodutibilidade e acessibilidade.
Aqui, apresentamos uma abordagem prática, confiável e validada para registrar e interpretar os eletrocardiogramas de zebrafish in vivo (Figura 2). Usando uma única ligação bipolar no plano frontal, nós investigamos as mudanças em formas de onda de ECG e durações do intervalo de zebrafish saudável do selvagem-tipo sadio anestesiado vivo de AB do adulto.
Protocolo
Todos os experimentos deste estudo foram conduzidos de acordo com o guia nacional de saúde dos EUA para o cuidado e uso de animais de laboratório. Todos os protocolos animais deste estudo foram aprovados pelo Comitê institucional de cuidado e uso de animais da UCLA.
1. preparação do conjunto experimental
- Mantenha o zebrafish em sistemas do aquário do fluxo-através em uma luz de 14 h, fotoperíodo escuro de 10 h em 28 ° c ± 0,5 ° c. Alimente com alimento do floco diário e camarão vivo da salmoura (náuplios de Artemia) duas vezes por dia. O zebrafish neste estudo foi mantido e alimentado pelo núcleo de zebrafish da UCLA.
- No dia do experimento, transporte Zebrafish do aquário para o laboratório.
- Configure o sistema de gravação de ECG in vivo conectando as peças essenciais do equipamento e inserindo os três eletrodos de aço inoxidável codificados por cores nos três portais de acesso com correspondência de cores do amplificador (Figura 3). Inicie o sistema no início de uma sessão de gravação e/ou análise de ECG.
- Adquirir ferramentas necessárias, tais como um temporizador/cronômetro, uma esponja molhada com uma fenda para segurar o peixe, fórceps, tesouras, pipetas Pasteur, e pratos de cultura (100 mm x 20 mm).
2. indução anestésica
- Prepare anestesia de imersão para controle da dor e imobilização de peixes para evitar artefatos de movimento durante a aquisição de dados de ECG. A maioria dos laboratórios utiliza a tricaína de imersão (metilo 3-aminobenzoato Methanesulfonate, MS-222).
- Para fazer a solução de estoque de tricaína 0,4%, combine os seguintes itens em uma garrafa de vidro escura aparafusada: 400 mg de pó de tricaína, 98 mL de água destilada dupla e 2 mL de Tris de 1 M (pH 9). Ajuste ao pH 7,0 usando 1 N NaOH ou 1 N HCl como necessário8.
- Para fazer a solução de imersão final de tricaína, determine a concentração mínima apropriada para a idade de zebrafish9, tamanho, estado metabólico, estirpe, modelo de doença, objetivos científicos e duração processual.
- Realize um estudo de concentração-resposta tricaína, titulando para cima ou para baixo da concentração recomendada de 168 mg/L (ou 0, 168%)9 se necessário, para atingir o nível 4 de anestesia dentro de 3 min com o menor número possível de toxicidades cardiorespiratórias. Por exemplo, neste estudo, a imersão do tipo selvagem AB zebrafish de 12-18 meses de idade em uma solução de tricaína 0,02-0,04% induzirá o nível 4 de anestesia dentro de 3 min.
Nota: no nível 4 da anestesia, o equilíbrio e o tônus muscular são completamente perdidos e a taxa de movimento opercular é reduzida8. - Se necessário, consulte o veterinário no Comitê institucional de cuidados e uso de animais (IACUC) para obter orientações adicionais sobre a adequação da seleção de anestésico (s) e via de administração.
- Mergulhe um zebrafish adulto em um prato contendo a solução de tricaína da menor concentração pré-determinada e aprovada pelo IACUC (por exemplo, 0,02-0,04% neste estudo) para induzir o nível 4 de anestesia dentro de 3 min (Figura 2).
- Para o protocolo de ECG da sobrevivência, mantenha a sessão de gravação de ECG tão breve como possível (sob 10 minutos). Para breves sessões de gravação de ECG com duração inferior a 15 min, a manutenção da anestesia não é necessária.
- Para longas sessões de gravação de ECG com duração de horas, use um paralítico intramuscular de ação prolongada e um sistema de perfusão oral para proporcionar uma ampla hidratação e oxigenação6.
3. colocação da ligação de ECG
- Uma vez que o zebrafish mantem o nível 4 da anestesia para 3 s, use um par de fórceps sem corte para transferir imediatamente os peixes na fenda úmida da esponja com sua superfície ventral mais superior para a colocação de elétrodos de ligação de ECG (Figura 4).
- Insira suavemente os três eletrodos de eletrodo de ECG na musculatura dos peixes a aproximadamente 1 mm de profundidade para estabelecer uma ligação bipolar no plano frontal que se assemelha à orientação craniana caudal-direita esquerda do eixo principal cardíaco.
- Posicione o eletrodo positivo (vermelho) na linha média ventral ao nível do bulbus arteriosus, ou seja, a 1-2 mm acima de uma linha imaginária que conecta as duas bordas inferiores dos operculums (figura 4a).
- Posicione o eletrodo negativo (preto) caudalmente e 0,5-1,0 mm à esquerda lateralmente ao eletrodo positivo, a uma distância maior que o comprimento apicobasal máximo do ventrículo zebrafish adulto (figura 4a).
- Posicione o eletrodo de referência (verde) caudally, perto da região anal.
Nota: uma vez que o eixo principal cardíaco varia um pouco de peixe para peixe, para maximizar as amplitudes de onda R e T, ajustar as posições de chumbo, fazendo apenas pequenas, mudanças sistemáticas através de tentativa e erro. Por exemplo, alterar um eletrodo (positivo ou negativo), em vez de ambos os eletrodos, em um momento e fazer mudanças graduais em uma direção especificada antes de mudar para outra direção em vez de fazer alterações erráticas em direções aleatórias.
4. gravação de ECG
- Abra o programa de aquisição de dados ECG. Selecione uma configuração desejada nos menus de lista suspensa para intervalo, passagem baixa e passagem alta. Por exemplo, a seguinte configuração no sistema de gravação de ECG in vivo usado neste experimento produz uma relação sinal-ruído consistente e satisfatória para um zebrafish adulto normal: intervalo "2 mV", passagem baixa "120 Hz" e passagem alta "0, 3 s".
- Pressione Start para iniciar a gravação de ECG sem Gap contínua a uma taxa de amostragem de 1 kHz.
- Para otimizar o posicionamento da ligação para a relação sinal-ruído máxima, pressione parar para parar a gravação de ECG e rever o traço de ECG logo após a primeira tentativa de gravação para cada coração. Para diagnosticar que um ECG de zebrafish adulto é normal, confirme que todos os quatro critérios de validação a seguir estão satisfeitos (Figura 1):
- Critério 1: Assegure-se de que todas as formas de onda do ECG (P, QRS e T) sejam distintas e prontamente visíveis.
- Critério 2: Assegure-se de que a onda P seja positiva.
- Critério 3: Assegure-se de que o complexo QRS líquido seja positivo (ou seja, a amplitude da onda R é maior que a soma das amplitudes das ondas Q e S).
- Critério 4: Assegure-se de que a onda T seja positiva.
- Se for esperado um ECG normal, reposicione os eletrodos (tente primeiro o eletrodo negativo), se necessário, até que todos os quatro critérios de validação estejam satisfeitos.
- Se uma onda T normal é esperada, mas a onda T é muito pequena, reposicionar os eletrodos para maximizar a amplitude da onda T.
- Retomar a gravação de ECG após otimizar o posicionamento de chumbo. Guarde as varreduras de ECG para análise subsequente.
5. recuperação da anestesia
- No final da sessão de gravação de ECG, Retire cuidadosamente os eletrodos sem ferir o peixe. Transfira os peixes para água fresca e oxigenada sem tricaína.
- Para facilitar a recuperação da anestesia, esguinchar a água sobre as guelras vigorosamente com uma pipeta de Pasteur até que o peixe retenha o movimento ou a natação regular da brânquia.
- Monitore os peixes para a recuperação completa da anestesia (tipicamente 1-2 min), como indicado pela habilidade dos peixes de nadar verticalmente por pelo menos 5 s.
6. interpretação de ECG
- Defina as configurações de análise.
- Conheça a interface de software (tabela de materiais) lendo o manual de operação do software de análise de dados de ECG.
Nota: embora as direções abaixo sejam específicas do software comercial utilizado em nosso laboratório, as tarefas básicas a serem realizadas são essencialmente as mesmas em qualquer pacote de software para análise de ECG. - Abra o programa de análise de dados de ECG. No menu arquivo , selecione abrir para abrir o arquivo ECG de interesse e exibir o traço de ECG completo. Use o mouse para arrastar uma seção de interesse no traço de ECG para analisar.
- No menu análise de ECG , selecione ajustes de ECG para abrir uma caixa de diálogo para pré-definir várias configurações de parâmetros para a análise automática de software (Figura 5a).
- Conheça a interface de software (tabela de materiais) lendo o manual de operação do software de análise de dados de ECG.
- Analise o ritmo cardíaco e a taxa.
Nota: a frequência cardíaca depende de vários factores, incluindo a idade e estirpe de zebrafish, agentes anestésicos (por exemplo, tricaína, isoflurano, etc.) e concentração, utilização da anestesia (agente único5,7 vs. agentes combinados5) e tempo de exposição5. Por exemplo, neste estudo, a frequência cardíaca de 12-18 meses de idade do tipo selvagem AB zebrafish após 3-5 min de imersão em solução de tricaína a 0,02-0,04% foi de 116 ± 17 batimentos por minuto (n = 9), consistente com relatos de literatura de frequência cardíaca para esta faixa etária e anestésico5,7.- Determine se o ritmo cardíaco é sinusal ou não, regular ou irregular.
Nota: a presença (ou ausência) do ritmo sinusal baseia-se na presença (ou ausência) de uma onda P ereta que precede cada QRS por um intervalo de RP normal (por exemplo, 60-65 MS para Liu et al. ' s 10-12 mês-velho7 e 12-18 mês-velho selvagem-tipo AB zebrafish neste estudo). A regularidade do ritmo atrial e ventricular (ou irregularidade) baseia-se na regularidade (ou irregularidade) de intervalos sucessivos de PP ou RR, respectivamente. - Para determinar a frequência cardíaca, certifique-se de que o software identifica corretamente todas as ondas P e R. Com base nessas identificações automáticas (ou correções manuais) das ondas P e R, o software mede automaticamente todos os intervalos PP e RR na seleção do ECG, calcula as médias do intervalo para gerar a taxa atrial e ventricular.
Nota: a taxa atrial é o intervalo médio de PP, enquanto a taxa ventricular é o intervalo RR médio. Para determinar a frequência cardíaca, a identificação correta das ondas P e R é crítica. - Corrija os erros de identificação automática movendo os cursores extraviadas para as ondas P e R apropriadas (Figura 5b).
Nota: se o coração estiver no ritmo sinusal, a taxa atrial e a taxa ventricular são as mesmas por causa da correspondência um-para-um entre as ondas do seio P e os complexos QRS. No entanto, no caso de dissociação atrioventricular (por exemplo, em taquicardia ventricular ou bloqueio atrioventricular de terceiro grau), esta correspondência um-para-um entre as ondas P e os complexos QRS é perdida; Conseqüentemente, há duas taxas de coração porque a taxa atrial é diferente da taxa ventricular. - Determine a frequência cardíaca com base em pelo menos cinco ciclos cardíacos completos consecutivos se o ritmo cardíaco for regular ou uma faixa de pelo menos seis segundos se o ritmo cardíaco for irregular.
- Determine se o ritmo cardíaco é sinusal ou não, regular ou irregular.
- Calcule intervalos e durações de onda.
- Ir para análise de ECG > média de visualização para concatenar n (por exemplo, 5) ciclos cardíacos consecutivos em um único sinal médio (Figura 5C).
Nota: se as formas de onda de ECG de um ciclo cardíaco individual divergem substancialmente do sinal médio, estude esse ciclo cardíaco separada sem concatenação. - Assegure-se de que o software identifique corretamente o começo e o fim da onda P, do complexo QRS, e da onda de T indicada na janela da vista de média (Figura 5C). Com base nessas identificações automáticas (ou correções manuais) dessas ondas e intervalos, o software mede automaticamente as durações conforme definido convencionalmente.
Nota: o intervalo PR estende-se desde o início da onda P até o início do complexo QRS (ou o complexo RS se a onda Q não estiver visível). A duração do QRS se estende desde o início da onda Q (ou a onda R se a onda Q não estiver visível) até o final da onda S (ou seja, o ponto J; Figura 1). O intervalo QT se estende desde o início da onda Q (ou a onda R se a onda Q não estiver visível) até o final da onda T. Portanto, para calcular intervalos e durações, a identificação correta do início e do término da onda P, do complexo QRS e da onda R é crítica. - Corrija os erros de identificação automática movendo os cursores extraviadas para as posições apropriadas.
- Selecione o pico negativo da onda S como o fim do complexo QRS7 porque o ponto J zebrafish que sinaliza o fim da onda s pode ser particularmente difícil de identificar com precisão. Isso causará uma ligeira subestimar a duração verdadeira QRS.
Nota: o software de análise de ECG corrige automaticamente o intervalo QT para a taxa ventricular (ou intervalo RR) para gerar o intervalo QT corrigido QTc usando o método pré-selecionado pelo usuário na etapa 6.1.3, por exemplo, Bazett (Figura 5a). A fórmula de Bazett (1920) QTc = Qt/√ RR é a mais popular e a primeira de vários métodos propostos para corrigir o intervalo QT humano para a frequência cardíaca. Porque a exatidão da fórmula de Bazett foi questionada, refira outros métodos propor para seres humanos10,11 e zebrafish6 (Figura 5D).
- Ir para análise de ECG > média de visualização para concatenar n (por exemplo, 5) ciclos cardíacos consecutivos em um único sinal médio (Figura 5C).
- Interpretar anomalias de ECG reconhecendo exceções para os quatro critérios de validação na etapa 4,3.
- Reconheça exceções para o critério 1. Na ausência de quaisquer ondas P (o que indica a ausência de ritmo sinusal), dependem dos intervalos RR e da duração do QRS para diagnosticar o ritmo cardíaco. Por exemplo, se os intervalos RR forem irregularmente irregulares, diagnosticar fibrilação atrial; Se os intervalos RR são regulares e o QRS é normalmente estreito, diagnosticar o ritmo de escape juncional; por outro lado, se os intervalos RR forem regulares e o QRS for anormalmente prolongado, diagnosticar o ritmo de escape ventricular.
- Reconheça exceções para o critério 2. Quando a onda P é negativa (ou invertida), diagnostica a ativação atrial retrógrada de um pacemaker ectópica (tal como um local atrial a jusante do nó da cavidade, do nó atrioventricular, ou do ventrículo).
- Reconheça exceções para o critério 3. Quando as ondas Q altas e estreitas apresentam com P negativa e ondas T negativas, diagnostiquem a reversão da ligação devido a um interruptor errôneo das posições positivas e negativas do elétrodo porque aquelas ondas altas e estreitas de Q eram ondas verdadeiras de R invertidas equivocadamente (Figura 6D ). Ao contrário, quando as ondas Q largas apresentam com as ondas positivas de P que seguem ferimento cardíaco significativo, diagnosticam o infarction miocárdico porque aquelas ondas Q largas são ondas patológicas verdadeiras de Q.
- Reconheça exceções para o critério 4. Quando a onda T é invertida, inspecione a ativação ventricular para identificar se a anormalidade da repolarização ventricular é primária ou secundária. Confie no cenário clínico para restringir o diagnóstico correto de uma lista diferencial de anormalidade de repolarização ventricular primária (a partir de efeitos de drogas ou isquemia miocárdica; Figura 6C) vs. anormalidade da repolarização ventricular secundária (devido à ativação ventricular aberrante de pré-excitação, ectopia ventricular ou estimulação ventricular).
- Resultados da exportação ECG.
- Selecione exibição de tabela para revisar todas as medições de ECG. Selecione as medições de interesse para copiar e colar no documento desejado (por exemplo, planilha do Excel).
- Para exportar um traço de ECG, realce uma seção de interesse na varredura de ECG usando o ícone da lupa. Copie e cole no documento desejado (por exemplo, Word ou PowerPoint).
Resultados
A Figura 1 ilustra a relevância clínica do método aqui apresentado. A eletrocardiografia de superfície in vivo para o zebrafish adulto é uma ferramenta de fenotipagem elétrica essencial por causa das similaridades notáveis entre o zebrafish e o ECG humano apesar de suas diferenças anatômicas vastas. O coração de zebrafish tem somente um vestíbulo e um ventrículo em contraste com o coração humano com dois átrios e dois ventrículos (fileira superior; direita e esquerda, respectivamente). No entanto, apesar de sua aparente simplicidade anatômica, o coração de zebrafish compartilha várias características de ECG com o coração humano (fileira inferior; direita e esquerda, respectivamente) portanto, o coração de zebrafish surgiu como um modelo substituto para o cardíaco humano eletrofisiologia5,12,13. A Figura 1 ilustra uma onda Q pequena mas distinta de um zebrafish vivo, saudável dos meses de idade 14. No entanto, no ECG de zebrafish, o posicionamento de chumbo não é comumente otimizado para demonstrar a onda Q. Portanto, a onda Q é comumente invisível, e um complexo RS é mais comumente visto do que o complexo QRS completo em ECG zebrafish.
A Figura 2 resume os quatro passos de ação essenciais para realizar eletrocardiografia minimamente invasiva in vivo para o zebrafish adulto. Após a indução anestésica (etapa 1) e a colocação do eletrodo (etapa 2), registramos sinais de ECG basal (etapa 3) de zebrafish saudável do tipo selvagem AB de 12 a 18 meses de idade (n = 9). Nossa técnica da inserção do elétrodo era somente minimamente invasora porque nós não precisamos de descascar escalas de peixes ou de executar pericardiotomy. Após a aquisição de dados, analisamos e constatamos manualmente cada gravação de ECG (etapa 4) para evitar a má interpretação potencial por análise automática de software.
A Figura 3 mostra os três componentes indispensáveis de um sistema típico de aquisição e processamento de dados de ECG: um hardware de aquisição de dados de alto desempenho, um amplificador diferencial de alto ganho e um computador carregado com software para dados de ECG aquisição e análise. Em nosso laboratório, adaptamos um sistema de gravação de ECG comercial in vivo existente originalmente projetado para pequenos modelos de mamíferos (como camundongos, ratos e coelhos) para acomodar o modelo de zebrafish adulto.
A Figura 4 demonstra que a colocação apropriada da ligação exige alinhar a ligação com o eixo principal cardíaco presumido. Em zebrafish in vivo ECG gravação, porque apenas um único chumbo é usado, posicionamento de chumbo adequada para maximizar simultaneamente tanto R e T amplitudes de onda é crítico. Para maximizar as amplitudes das ondas R e T, alinharam-se os eletrodos de chumbo positivo e negativo com o eixo principal cardíaco, presumivelmente no caudal esquerdo para a orientação craniana direita. Após toracotomia e pericardiotomia para abrir o saco pericárdico e expor o coração, o eixo principal cardíaco torna-se aparente (Figura 4B linha tracejada branca). Na verdade, a pericardiotomia para expor o coração é uma estratégia comumente usada para aumentar a relação sinal-ruído7 ao custo de converter a gravação de ECG de um minimamente invasivo em um procedimento altamente invasivo.
A Figura 5 ilustra etapas críticas na análise de ECG. Primeiramente, nós pré-definimos as várias configurações de parâmetros para análise automática de software usando a caixa de diálogo Configurações de ECG (Figura 5a). Porque nós Repurpose um equipamento existente da gravação de ECG projetado para modelos mamíferos para acomodar o zebrafish adulto, a definição da deteção e da análise para o zebrafish não está disponível. Selecionamos o preset humano em vez disso, dada a notável similaridade do ECG de zebrafish ao ECG humano (Figura 5a). Em segundo, nós verific manualmente a identificação automática do ECG do software (no preto) dos picos da onda de R e corrija (no vermelho) todos os erros da auto-identificação da onda de R antes de comandar o software para recalcular a taxa ventricular média. Por exemplo, na Figura 5b, uma onda P grande em relação à onda r enganou o software para identificar incorretamente as ondas r, levando ao descálculo automático subsequente do intervalo RR ou da taxa ventricular. Portanto, a verificação humana e as correções apropriadas, conforme necessário, são críticas na análise do ECG. Em terceiro lugar, avaliamos rapidamente a regularidade do ritmo e calculámos a duração média das ondas e intervalos utilizando a vista de média (Figura 5C) para concatenar vários ciclos cardíacos consecutivos (verde) em um único sinal médio (preto). Aqui na Figura 5C, o desvio insignificante entre cada um dos nove ciclos cardíacos e o sinal médio argumenta pela excelente regularidade rítmica deste coração zebrafish. Por fim, permiti que o software corrija automaticamente o intervalo QT para freqüência cardíaca usando Bazett, um dos sete métodos diferentes disponíveis (Figura 5D).
Figura 6a -C demonstra como a profundidade da colocação do eletrodo afeta as amplitudes dos sinais de ECG. Quando inserimos incorretamente os eletrodos muito superficialmente na derme (Figura 6a), o chumbo foi "indireto"-Like (mais de dois diâmetros cardíacos do coração, semelhante ao padrão indireto do membro ECG humano leva I, II e III) e a tensão sinais eram pequenos. Quando inserimos apropriadamente os eletrodos 1 mm mais profundamente na musculatura peitoral (Figura 6B), o chumbo tornou-se "semidireto" (em estreita proximidade, mas não em contato direto com o coração) e os sinais de tensão aumentaram. As formas de onda de ECG tornaram-se prontamente visíveis. No entanto, quando inserimos incorretamente os eletrodos ainda mais profundos no ventrículo (Figura 6C), o chumbo tornou-se "direto" (em contato direto com o coração) e os sinais de tensão aumentaram ainda mais. A amplitude da onda R na Figura 6C aumentou em oito vezes em comparação com a Figura 6a e por quatro vezes em comparação com a Figura 6B. Entretanto, o traço de ECG na Figura 6C revelou sinais novos da lesão ao miocárdio ventricular, tal como a depressão nova do St e a inversão nova da onda de T.
A Figura 6D demonstra como as inversões incomuns de todas as formas de onda de ECG (P, Q, R, S, e T) devem sinalizar um erro da reversão da ligação, em que os elétrodos positivos e negativos comutam o lugar. Note que por definição Q e S são sempre negativos, enquanto R é sempre positivo.
Figura 6E -F mostra como a profundidade inadequada da anestesia pode prejudicar a qualidade da gravação in vivo de ECG. Na Figura 6E, a anestesia inadequada (0, 17% tricaína) levou à incapacidade de imobilizar o zebrafish completamente. Os artefatos de movimento resultantes reduziram a relação sinal-ruído, tanto contaminando o sinal (asterisco) quanto aumentando o ruído (setas). No contraste, na Figura 6F, a anestesia uma overdose (tricaine 0, 8%) induziu a bradarritmia severa da cavidade assim como mudanças do segmento do St e da onda de T.
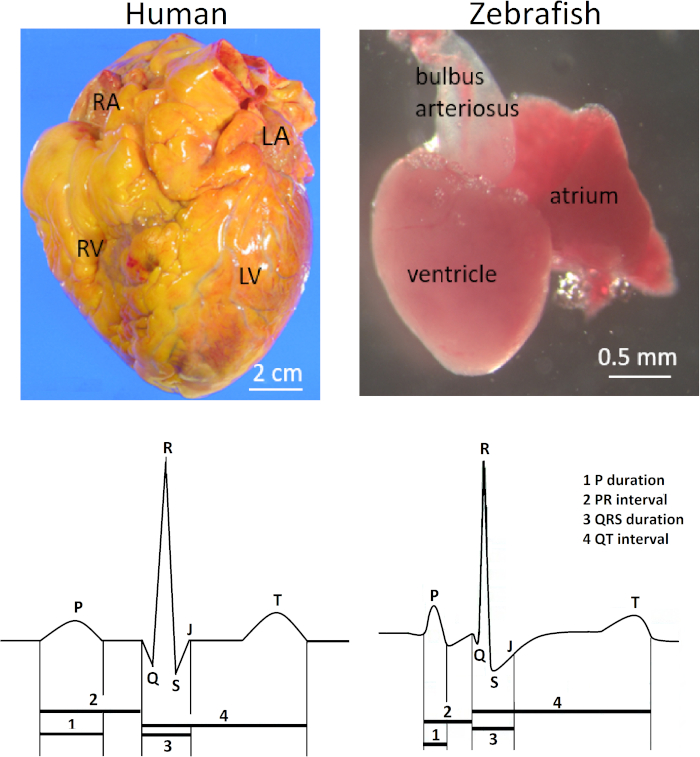
Figura 1: Anatomia contrastante e ECG de corações humanos e zebrafish. Em contraste com o coração humano com dois átrios e dois ventrículos, o coração de zebrafish tem apenas um átrio e um ventrículo (fileira superior). Abreviaturas: RA, átrio direito; LA, átrio esquerdo; RV, ventrículo direito; LV: ventrículo esquerdo. O coração do zebrafish compartilha de diversas características comuns de ECG com o coração humano (fileira inferior). Por favor clique aqui para ver uma versão maior desta figura.
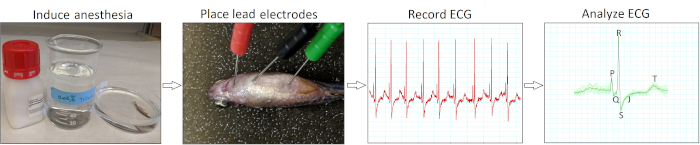
Figura 2: protocolo de gravação de ECG minimamente invasivo in vivo. Um fluxograma esquemático ilustra quatro etapas de ação crítica na realização de um interrogatório de ECG in vivo: induzir anestesia, colocar eletrodos de eletrodo de ECG, registrar ECG e analisar as gravações de ECG. Por favor clique aqui para ver uma versão maior desta figura.
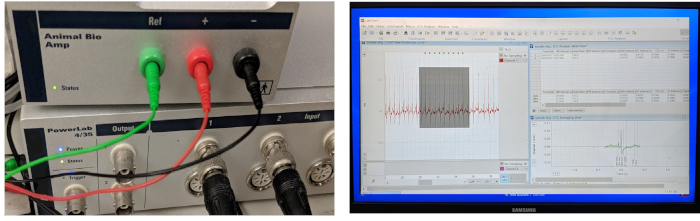
Figura 3: Sistema de aquisição e processamento de dados de ECG. Os três componentes principais de um sistema integrado de gravação de ECG in vivo incluem um hardware para adquirir dados, um amplificador e software de computador para aquisição e análise de dados. O amplificador vem com três pronto-a-usar 29-calibre de aço inoxidável microeletrodos. Por favor clique aqui para ver uma versão maior desta figura.
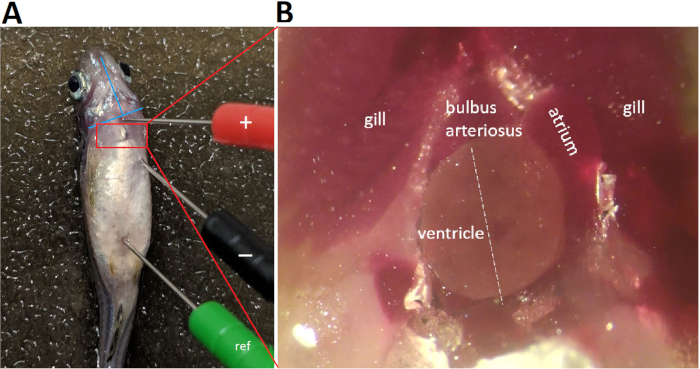
Figura 4: Colocação da ligação de ECG. 3 29-os elétrodos de aço inoxidável codificados por cores do calibre são introduzidos firmemente na musculatura dos peixes a aproximadamente 1 milímetro na profundidade. A colocação do eletrodo negativo (preto) e o eletrodo positivo (vermelho) estabelecem uma ligação bipolar no plano frontal, ao longo de uma orientação esquerda caudal a direita craniana. Abreviatura: REF, eletrodo de referência por favor clique aqui para ver uma versão maior desta figura.
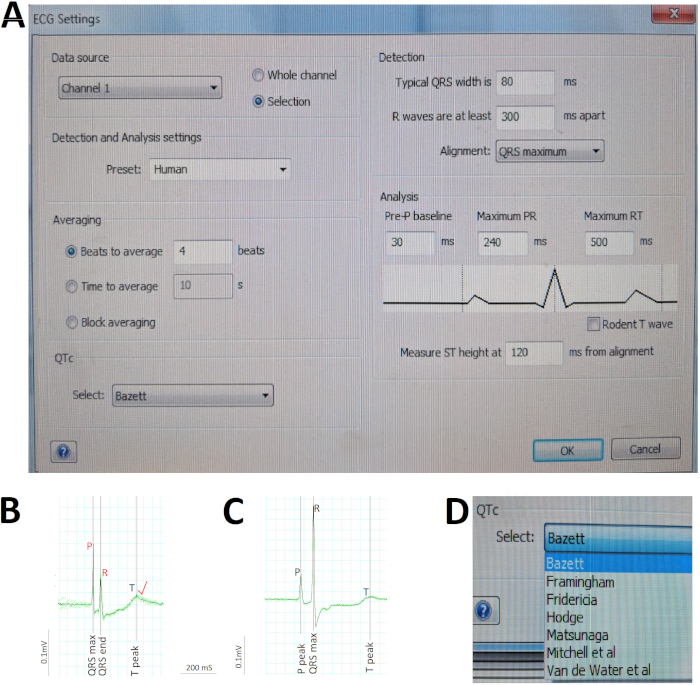
Figura 5: C etapas ao na análise de ECG. (A) pré-definir as várias configurações de parâmetros para análise automática de software. (B) corrigir manualmente (vermelho) duas misidentificações automáticas pelo software (preto) das ondas P e R para retificar o erro de cálculo do software da taxa atrial e ventricular. (C) concatenar nove ciclos cardíacos consecutivos (verde) em um único sinal médio (preto) para avaliar rapidamente regularidades/irregularidades do ritmo e calcular durações médias de ondas e intervalos. (D) corrija o intervalo QT para a frequência cardíaca usando um dos vários métodos, como o bazett. Por favor clique aqui para ver uma versão maior desta figura.
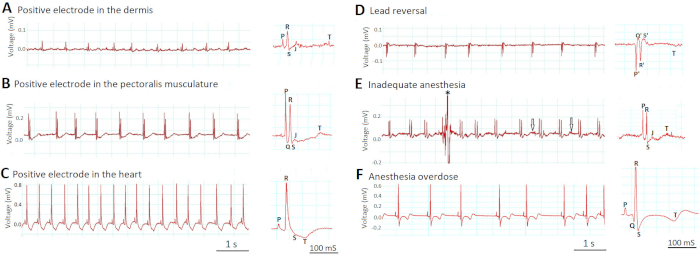
Figura 6: efeitos da colocação da ligação e da profundidade da anestesia nos sinais de ECG. Duas etapas mais críticas que determinam o sucesso da gravação in vivo de ECG são a colocação da ligação (A-D) e a profundidade da anestesia (e-F). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Ao registrar o ECG in vivo para o zebrafish adulto por meio de uma única ligação como nós demonstramos neste estudo, há um número de advertências a respeito da qualidade e da validez dos resultados do registro de ECG. Em primeiro lugar, ao escolher os anestésicos apropriados e determinar a concentração mínima necessária de anestesia, profundidade e duração, equilibrar as cardiotoxidades anestésicas contra a necessidade crítica de suprimir artefatos de movimento e a determinação a priori para um projeto experimental de sobrevivência vs. terminal. Capitalizando a potência sinergística de uma combinação de anestésicos múltiplos de diferentes classes de fármacos5,14 e paraléticos1,6 para diminuir a dose de agentes individuais5 ou administrar uma dose de baixa manutenção após uma dose de indução mais elevada são estratégias típicas. No entanto, apesar de suas conhecidas toxicidades cardiorrespiratórias, incluindo a morte8, a tricaína ainda é a mais utilizada, a melhor disponível, e a única anestésica aprovada pela administração de alimentos e drogas dos EUA (FDA) para zebrafish Anestesia. Tricaína tem sido popularmente utilizado na gravação de ECG de zebrafish adulto, quer como um único agente ou em combinação com outros anestésicos ou paraléticos.
Em segundo lugar, a exatidão da colocação da ligação pode ser assegurada pelo menos para o zebrafish normal saudável usando nossos quatro critérios de validação para um ECG adulto normal do zebrafish. Dos quatro critérios de validação que propomos aqui, os dois últimos critérios juntos confirmam a concordância fundamental entre a polaridade da onda R e a da onda T em um ECG normal5,7,15. Esta concordância da onda R e T é uma semelhança fortuita, porém crítica, entre o zebrafish e o humano16,17 ECG normal que contribui para a relevância clínica do modelo do coração de zebrafish como um substituto para o cardíaco humano Eletrofisiologia. No entanto, várias condições benignas ou malignas podem invalidar qualquer um dos quatro critérios de validação. Por exemplo, a concordância da onda R e T é perdida na isquemia miocárdica7,15. Essa perda da concordância da onda R e T na isquemia miocárdica é outra semelhança marcante entre o zebrafish e o ECG humano que contribui para a relevância clínica do modelo de infarto do miocárdio zebrafish.
Por fim, recomendamos uma prática padrão na análise de ECG. Com o advento da tecnologia, o software da análise de ECG pode gerar a interpretação automática de ECG. Entretanto, nós recomendamos fortemente que os seres humanos treinados devem sempre reinterpretar e verificar todos os ECGs baseados no scenario clínico respectivo que conduz à gravação de ECG. A dependência excessiva da rotina unicamente na interpretação automática por um software da análise de ECG é desaconselhável, particular na presença de variações normais comuns de ECG, de patologias cardíacas, ou de colocação suboptimal da ligação.
Este estudo centra-se no método minimamente invasivo para sessões breves de gravação de ECG. No entanto, deve surgir a necessidade de sessões de registro de ECG prolongadas por horas duradouras, modificações são necessárias para fornecer oxigenação, hidratação e anestesia adequadas por perfusão contínua6.
Adicionalmente, realce a relação sinal-ruído por um de pelo menos três maneiras. Escolher um amplificador mais potente é muitas vezes uma opção dispendiosa, se não impraticável. Abrir o saco pericárdico para reduzir o volume condutor é uma abordagem razoável, embora invasiva, que foi adotada7. A colocação estratégica da ligação para alinhar o eixo da ligação em um sentido paralelo ao eixo cardíaco principal (Figura 4B) maximizará os sinais da tensão de ECG mas pode exigir o teste e o erro, especial na ausência de pericardiotomy.
O método de interrogação in vivo de ECG para zebrafish adulto que apresentamos aqui oferece quatro vantagens principais. Primeiramente, nossa aproximação minimamente invasora exige somente a inserção do elétrodo, mas nenhuma remoção da escala de peixes ou thoracotomy-pericardiotomy. Conseqüentemente, minimizando a dor para os peixes, nossa aproximação permite interrogatórios repetidos de ECG em estudos longitudinais da sobrevivência. Em segundo lugar, quando os anestésicos suprimem adequadamente o movimento dos peixes, o sistema de gravação in vivo de ECG em nosso estudo produz consistentemente uma relação sinal-ruído satisfatória com sinais brutos sem ruído. Em terceiro lugar, a validação de qualidade de quatro critérios que propomos aqui assegura a exatidão e robustez dos dados no início da aquisição de dados do ECG e minimiza as variações dependentes do operador. Por fim, em particular, nosso último critério de validação (a onda T normal é ereto) encapsula a concordância da onda R e da onda T, uma característica humana-semelhante importante do ECG normal de zebrafish (Figura 1).
No entanto, ainda existem quatro grandes limitações para a atual metodologia de ECG in vivo para o zebrafish adulto por nosso grupo e outros.
Em primeiro lugar, a falta de cooperação do sujeito requer a necessidade de anestesia com suas conseqüências de toxicidade cardiorrespiratória limitante. Para a interrogação de ECG in vivo, enquanto os pacientes humanos nunca necessitam de sedação, o zebrafish sempre requer anestésicos ou paraléticos, os quais causam toxicidades cardiorrespiratórias variáveis.
Em segundo, a necessidade de fixar o ECG Unido conduz ligeiramente eleva a invasividade de um procedimento de outra maneira não-invasor. Considerando que a colocação da ligação na gravação de ECG do corpo-superfície dos seres humanos é inteiramente não-invasora porque os elétrodos aderem à epiderme humana, colocação da ligação para a gravação in vivo de ECG do zebrafish são mais invasoras porque, no mínimo, os elétrodos de aço devem perfure a pele dos peixes para a inserção segura na musculatura dos peixes.
As duas últimas limitações decorrem das restrições anatômicas do peito e do coração de zebrafish. Em terceiro lugar, o tamanho minúsculo do coração adulto do zebrafish necessita uma redução drástica no número de ligações de ECG. Quando os seres humanos acomodem prontamente doze ligações em uma gravação padrão de ECG, o zebrafish adulto pode tipicamente acomodar somente uma única ligação unipolar ou bipolar. O ramificação de uma única ligação de ECG é o desafio para aperfeiçoar simultaneamente as amplitudes de todas as três ondas de P, de R, e de T. Daqui, a importância da colocação óptima e exata da ligação na interrogação de ECG do zebrafish não pode ser exagerada. Em zebrafish, a onda T apresenta um desafio de detecção único, porque muitas vezes é a menor dessas três ondas. Conseqüentemente, a amplitude da onda de zebrafish T deve receber a prioridade da optimização sobre as ondas tipicamente maiores do P e do R.
Em quarto lugar, determinar o principal eixo cardíaco do zebrafish para maximizar a amplitude da onda R pode ser desafiador. A razão é que o coração do zebrafish tem mais liberdade de movimento dentro de seu saco pericárdico frouxo comparado ao coração humano dentro de seu formulário-encaixe luva-como o pericárdio.
Globalmente, essas limitações estimularão a inovação do método futuro. Com o advento da impressão 3D e da eletrônica deformável18, há esperança para a implantação direta de chumbo um dia em acordado, alerta, natação zebrafish usando uma ' meia cardíaca ' de sensores de eletrodo sem fio.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelos institutos nacionais de saúde R01 HL141452 para a TPN. A ADInstruments gentilmente forneceu financiamento generoso para financiar o custo da publicação de acesso aberto, mas não teve nenhum papel no desenho experimental, aquisição de dados, análise de dados deste estudo ou qualquer acesso ao manuscrito antes da publicação.
Materiais
| Name | Company | Catalog Number | Comments |
| Culture dishes | Fisher Scientific | FB087571 | 100 mm x 20 mm |
| Dumont Forceps | Fine Sciense Tools | 11253-20 | 0.1 x 0.06 mm |
| FE136 Animal Bio Amp | AD Instruments | FE231 | |
| Iris Forceps | Fine Sciense Tools | 11064-07 | 0.6 x 0.5 mm |
| LabChart 8 Pro | AD Instruments | Software with ECG Module | |
| Needle electrodes for Animal Bio Amp | AD Instruments | MLA1213 | 29 gauge |
| Plastic Disposable Transfer Pipets | Fisher Scientific | 13-669-12 | 6 in., 1.2 mL |
| PowerLab 4/35 | AD Instruments | 4//35 | |
| Scissors | Fine Sciense Tools | 15000-08 | 2.5 mm, 0.075 mm |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma | E10521-10G | MS-222 |
Referências
- Arnaout, R., et al. Zebrafish model for human long QT syndrome. Proceedings of the National Academy of Sciences of the United States of America. 104 (27), 11316-11321 (2007).
- Hassel, D., et al. Deficient zebrafish ether-a-go-go-related gene channel gating causes short-QT syndrome in zebrafish reggae mutants. Circulation. 117 (7), 866-875 (2008).
- Meder, B., et al. Reconstitution of defective protein trafficking rescues Long-QT syndrome in zebrafish. Biochemical and Biophysical Research Communication. 408 (2), 218-224 (2011).
- Sieber, S., et al. Zebrafish as a preclinical in vivo screening model for nanomedicines. Advanced Drug Delivery Reviews. , (2019).
- Lin, M. H., et al. Development of a rapid and economic in vivo electrocardiogram platform for cardiovascular drug assay and electrophysiology research in adult zebrafish. Science Reports. 8 (1), 15986 (2018).
- Milan, D. J., Jones, I. L., Ellinor, P. T., MacRae, C. A. In vivo recording of adult zebrafish electrocardiogram and assessment of drug-induced QT prolongation. American Journal of Physiology-Heart and Circulation Physiology. 291 (1), H269-H273 (2006).
- Liu, C. C., Li, L., Lam, Y. W., Siu, C. W., Cheng, S. H. Improvement of surface ECG recording in adult zebrafish reveals that the value of this model exceeds our expectation. Science Reports. 6, 25073 (2016).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. Ilar Journal. 53 (2), 192-204 (2012).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Sagie, A., Larson, M. G., Goldberg, R. J., Bengtson, J. R., Levy, D. An improved method for adjusting the QT interval for heart rate (the Framingham Heart Study). American Journal of Cardiology. 70 (7), 797-801 (1992).
- Luo, S., Michler, K., Johnston, P., Macfarlane, P. W. A comparison of commonly used QT correction formulae: the effect of heart rate on the QTc of normal ECGs. Journal of Electrocardiology. 37 Suppl, 81-90 (2004).
- Vornanen, M., Hassinen, M. Zebrafish heart as a model for human cardiac electrophysiology. Channels (Austin). 10 (2), 101-110 (2016).
- Tsai, C. T., et al. In-vitro recording of adult zebrafish heart electrocardiogram - a platform for pharmacological testing). Clinica Chimica Acta. 412 (21-22), 1963-1967 (2011).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of American Association of Lab Animal Sciences. 53 (2), 198-203 (2014).
- Sun, Y., et al. Activation of the Nkx2.5-Calr-p53 signaling pathway by hyperglycemia induces cardiac remodeling and dysfunction in adult zebrafish. Disease Model and Mechanism. 10 (10), 1217-1227 (2017).
- Franz, M. R., Bargheer, K., Rafflenbeul, W., Haverich, A., Lichtlen, P. R. Monophasic action potential mapping in human subjects with normal electrocardiograms: direct evidence for the genesis of the T wave. Circulation. 75 (2), 379-386 (1987).
- Chiale, P. A., et al. The multiple electrocardiographic manifestations of ventricular repolarization memory. Current Cardiology Reviews. 10 (3), 190-201 (2014).
- Xu, L., et al. 3D multifunctional integumentary membranes for spatiotemporal cardiac measurements and stimulation across the entire epicardium. Nature Communications. 5, 3329 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados