Method Article
В Vivo поверхности Электрокардиография для взрослых зебрафиш
В этой статье
Резюме
Здесь мы представляем надежный, минимально инвазивный и экономически эффективный метод записи и интерпретации электрокардиограмм у живой анестезии взрослых зебры.
Аннотация
Электрокардиограмма волн взрослых зебры и людей удивительно похожи. Эти сходства электрокардиограммы повышают ценность зебры не только как исследовательская модель для сердечной электрофизиологии и миопатий человека, но и как суррогатная модель в высокой пропускной фармскрининге на потенциальную кардиотоксичность людей, таких как продление ЗТ. Таким образом, in vivo электрокардиография для взрослых зебры является электрическим фенотипированием инструмент, который необходим, если не незаменим, для поперечного или продольного in vivo электрофизиологических характеристик. Однако слишком часто отсутствие надежного, практичного и экономически эффективного метода записи остается серьезной проблемой, препятствующей тому, чтобы этот диагностический инструмент in vivo стал более доступным. Здесь мы описываем практический, простой подход к электрокардиографии in vivo для взрослых зебры с использованием низкой технической, экономичной и всеобъемлющей системы, которая дает последовательную, надежную запись. Мы иллюстрируем наш протокол с использованием здоровых взрослых самцов зебры в возрасте 12-18 месяцев. Мы также внедряем стратегию быстрой интерпретации в реальном времени для проверки качества для обеспечения точности и надежности данных на ранних стадиях процесса записи электрокардиограммы.
Введение
Зебрафиш(Danio rerio) сердце расположено anteroventrally к грудной полости между оперкулумом и грудными поясами. Сердце заключено довольно свободно в серебристого цвета перикардиальный мешок. Анатомически сердце зебры отличается от четырехкамерных человеческих и других сердец млекопитающих из-за его уменьшительной шкалы (в 100 раз меньше человеческого сердца) и его двухкамерной структуры, состоящей только из одного предсердия и одного желудочка. Тем не менее, волновые формы электрокардиограммы (ЭКГ) и продолжительность интервала ЗТ обоих видов удивительно схожи(рисунок 1). Соответственно, зебрафиш стала популярной моделью для изучения унаследованных человеком аритмий1,2,3 и для высокопроходимых наркотиков скрининга потенциальных сердечно-токсичности человека4,5 , таких как продление ЗТ.
В обычной оценке сердечных заболеваний человека, экг-экг поверхности тела стала наиболее широко используемым первым неинвазивным диагностическим инструментом с момента его изобретения Эйнховеном в 1903 году. В отличие от этого, с момента первой адаптации тела поверхности ЭКГ записи метода для взрослых зебры в 2006 году6 и несколько модификаций после7, этот метод остается в значительной степени недоступным для многих исследователей в этой области, несмотря на популярность этой модели животных. Для других исследователей, которые выполняли в vivo ЭКГ допроса для взрослых зебры, широкие различия между операторами привели к несоответствию в выводах ЭКГ из различных исследований. Общие причины включают громоздкие и дорогие специализированные устройства и программное обеспечение, низкое соотношение сигнала к шуму, и путаница в отношении размещения электрода, все еще усугубляется неполным пониманием взрослых зебры ЭКГ особенности и механизмов тканей. Учитывая, что in vivo ECG является единственным диагностическим инструментом для электрически фенотипа живой зебры, существует явная потребность в стандартизированном методе для улучшения чувствительности и специфичности, воспроизводимости и доступности.
Здесь мы представляем практический, надежный и проверенный подход к записи и интерпретации электрокардиограмм зебрафиш в vivo(рисунок 2). Используя один биполярный свинец в лобной плоскости, мы исследовали изменения в волновых формах ЭКГ и интервалах продолжительности живой анестезии здорового дикого типа AB взрослых зебры.
протокол
Все эксперименты в этом исследовании были проведены в соответствии с Национальными институтами США здравоохранения Руководство по уходу и использованию лабораторных животных. Все протоколы животных в этом исследовании были одобрены UCLA институционального ухода за животными и использования комитета.
1. Подготовка экспериментального
- Поддержание зебры в проточных аквариумных системах на 14 ч свет, 10 ч темный фотопериод при 28 кв 0,5 градусов по Цельсию. Кормите хлопьями ежедневно и живыми рассолом креветками(Artemia nauplii)два раза в день. Зебрафиш в этом исследовании были сохранены и кормили UCLA Зебрафиш Core.
- В день эксперимента транспортируйте зебры из аквариума в лабораторию.
- Настройка системы записи IN vivo ECG путем подключения основных элементов оборудования и вставки трех цветных электродов из нержавеющей стали в три цветных порталов доступа усилителя (Рисунок 3). Запустите систему в начале сессии записи и/или анализа ЭКГ.
- Приобретите необходимые инструменты, такие как таймер/стоп-час, влажная губка с щелью для хранения рыбы, щипцы, ножницы, пипетки Pasteur и культурные блюда (100 мм х 20 мм).
2. Индукция анестезии
- Подготовьте анестезию погружения для контроля боли и иммобилизации рыб, чтобы избежать артефактов движения во время приобретения данных ЭКГ. Большинство лабораторий используют погружение трикаин (этил 3-аминобензоат метанесульфонат, МС-222).
- Чтобы сделать трикаин 0,4% бульона решение, объединить следующие элементы в винт-крышкой темного стекла бутылку: 400 мг трикаина порошок, 98 мл двойной дистиллированной воды, и 2 мл 1 M Tris (pH 9). Отрегулируйте к pH 7.0 используя 1 NNaOH или 1 N HCl по мере необходимости 8.
- Чтобы сделать раствор конечного погружения трикаина, определите минимальную концентрацию, которая подходит для зебры 9 лет, размер, метаболическое состояние, напряжение, модель заболевания, научные цели и процедурную продолжительность.
- Выполните исследование концентрации трикаина-реакции, отравляя вверх или вниз от рекомендуемой концентрации 168 мг/л (или 0,0168%)9, если это необходимо, чтобы достичь уровня 4 анестезии в течение 3 минут с наименьшим количеством возможных кардиореспираторных токсичности. Например, в этом исследовании, погружение дикого типа AB зебры 12-18 месяцев в 0,02-0,04% трикаин раствор вызовет уровень 4 анестезии в течение 3 мин.
ПРИМЕЧАНИЕ: На уровне 4 анестезии, равновесие и мышечный тонус полностью потеряны и скорость движения оперкулярного снижается8. - При необходимости проконсультируйтесь с ветеринаром в Институциональном комитете по уходу за животными и использованию (IACUC) для получения дополнительных рекомендаций о целесообразности выбора анестезии (ы) и маршрута его применения.
- Погрузите взрослую зебрафишввую в блюдо, содержащее трикаин-раствор самой низкой предопределенной и одобренной IACUC концентрации (например, 0,02-0,04% в данном исследовании), чтобы вызвать уровень 4 анестезии в течение 3 мин(рисунок 2).
- Для выживания протокол ЭКГ, держать сессии записи ЭКГ как можно краток (до 10 мин). Для кратких сеансов записи ЭКГ продолжительностью менее 15 минут, анестезия не требуется.
- Для длительных сеансов записи ЭКГ продолжительностьювнесколько часов используйте длительное действие внутримышечной паралитического и перфузионной системы перфузии для обеспечения достаточной гидратации и оксигенации 6.
3. ЭКГ свинца размещения
- После того, как зебрафиш поддерживает уровень 4 анестезии в течение 3 с, использовать пару тупых щипцы для передачи рыбы сразу же на влажную губку щели с его брюшной поверхности верхней для размещения ЭКГ свинца электродов (Рисунок 4).
- Аккуратно вставьте три ЭКГ свинца электродов в мускулатуру рыбы примерно на 1 мм в глубину, чтобы установить биполярный свинец в лобной плоскости, что параллели левой каудально-правой черепной ориентации сердечной основной оси.
- Расположите положительный (красный) электрод в брюшной средней линии на уровне артериального артериата, т.е. на 1-2 мм над воображаемым линией, соединяющей два нижних края оперкулумов(рисунок 4А).
- Расположите отрицательный (черный) электрод каудально и 0,5-1,0 мм, оставшийся сбоковой к положительному электроду, на расстоянии, превышающее максимальную апикобазальскую длину брюшного вентилятора для взрослых зебры(рисунок 4A).
- Расположите эталонный (зеленый) электрод caudally, вблизи анальной области.
ПРИМЕЧАНИЕ: Поскольку сердечная основная ось несколько варьируется от рыбы к рыбе, чтобы максимизировать амплитуды волны R и T, отрегулируйте позиции свинца, делая только небольшие, систематические изменения методом проб и ошибок. Например, изменить один электрод (положительный или отрицательный), а не оба электрода, за один раз и сделать постепенные изменения в одном указанном направлении, прежде чем перейти в другое направление, а не делать неустойчивые изменения в случайных направлениях.
4. Запись ЭКГ
- Откройте программу сбора данных ЭКГ. Выберите желаемую настройку из выпадающих меню для диапазона, низкий проход, и высокий проход. Например, следующая настройка в системе записи IN vivo ECG, используемая в этом эксперименте, дает согласованное, удовлетворительное соотношение сигнала к шуму для нормальной взрослой зебры: диапазон "2 мВ", низкий проход "120 Гц" и высокий проход "0,03 с".
- Нажмите Начало, чтобы начать непрерывную безразрывную запись ЭКГ со скоростью отбора проб 1 кГц.
- Чтобы оптимизировать позиционирование свинца для максимального соотношения сигнала к шуму, нажмите Stop, чтобы остановить запись ЭКГ и просмотреть след ЭКГ вскоре после самой первой попытки записи для каждого сердца. Чтобы диагностировать, что взрослая ЭКГ зебры является нормальным, подтвердите, что все следующие четыре критерия проверки удовлетворяются(рисунок 1):
- Критерий 1: Убедитесь, что все формы ЭКГ (P, ЗРС и T) отличаются и легко видны.
- Критерий 2: Убедитесь, что волна P положительна.
- Критерий 3: Убедитесь, что чистый комплекс ЗРС является положительным (т.е. амплитуда Волны R больше, чем сумма амплитуд ы и S волны).
- Критерий 4: Убедитесь, что волна Т положительна.
- Если ожидается нормальная ЭКГ, переположите электроды (попробуйте отрицательный электрод сначала) в случае необходимости, пока не будут выполнены все четыре критерия проверки.
- Если ожидается нормальная волна Т, но волна Т слишком мала, переместите электроды, чтобы максимизировать амплитуду Волны Т.
- Возобновить запись ЭКГ после оптимизации позиционирования свинца. Сохранить ЭКГ зачисток для последующего анализа.
5. Восстановление после анестезии
- В конце сеанса записи ЭКГ тщательно удалите электроды, не повреждая рыбу. Перенесите рыбу в свежую, насыщенную кислородом рыбную воду без трикаина.
- Чтобы облегчить восстановление после анестезии, брызги воды над жабры энергично с пастерной пипеткой, пока рыба не возобновит регулярное движение жаберных или плавание.
- Мониторинг рыбы для полного восстановления после анестезии (обычно 1-2 мин), о чем свидетельствует способность рыбы плавать вертикально, по крайней мере 5 с.
6. Интерпретация ЭКГ
- Определите параметры анализа.
- Знайте интерфейс программного обеспечения(Таблица материалов), читая руководство по эксплуатации программного обеспечения анализа данных ЭКГ.
ПРИМЕЧАНИЕ: Хотя приведенные ниже направления специфичны для коммерческого программного обеспечения, используемого в нашей лаборатории, основные задачи, которые необходимо выполнить, по существу, одинаковы в любом программном пакете для анализа ЭКГ. - Откройте программу анализа данных ЭКГ. Из меню файла выберите Open, чтобы открыть интересуемый ФАЙЛ ЭКГ и отобразить полный след ЭКГ. Используйте мышь, чтобы вытащить раздел интереса к eCG след для анализа.
- Из меню анализа ЭКГ выберите настройки ЭКГ, чтобы открыть окно диалога, чтобы предварительно определить различные параметры параметров для автоматического анализа программного обеспечения (рисунок5A).
- Знайте интерфейс программного обеспечения(Таблица материалов), читая руководство по эксплуатации программного обеспечения анализа данных ЭКГ.
- Проанализируйте сердечный ритм и скорость.
ПРИМЕЧАНИЕ: Частота сердечных приступов зависит от нескольких факторов, в том числе возраста и деформации зебры, анестезирующих агентов (например, трикаин, изофруран и т.д.) и концентрации, использования анестезии (один агент5,7 против комбинированных агентов5) и времяэкспозиции 5. Например, в этом исследовании частота сердечных сокращений 12-18 месяцев дикого типа AB зебры после 3-5 мин погружения в 0,02-0,04% трикаин решение было 116 и 17 ударов в минуту (n No 9), в соответствии с литературой доклады о частоте сердечных сокращений для этой возрастной группы и анестезия5,7.- Определите, является ли сердечный ритм синусом или нет, регулярным или нерегулярным.
ПРИМЕЧАНИЕ: Наличие (или отсутствие) синусового ритма основано на наличии (или отсутствии) вертикальной волны P, предшествующей каждой ОРС, нормальным интервалом PR (например, 60-65 мс для Лю и ал. 10-12 месяцев7 и 12-18 месячных диких ab зебр ы в этом исследовании). Регулярность регулярки предсердий и желудочков (или нерегулярности) основана на регулярности (или нерегулярности) последовательных интервалов PP или RR, соответственно. - Чтобы определить частоту сердечных приступов, убедитесь, что программное обеспечение правильно идентифицирует все P и R волны. На основе этих автоматических идентификаций (или ручных исправлений) волн P и R, программное обеспечение автоматически измеряет все интервалы PP и RR в выборе ЭКГ, вычисляет средние интервалы для генерации скорости предсердий и желудочков.
ПРИМЕЧАНИЕ: Частота предсердий является средним интервалом PP в то время как желудочковая частота является средним интервалом RR. Для определения частоты сердечных приступов решающее значение имеет правильное определение волн P и R. - Исправьте любые ошибки автоматической идентификации, перемещая неуместные курсоры на соответствующие волны P и R(рисунок 5B).
ПРИМЕЧАНИЕ: Если сердце находится в синусовом ритме, скорость предсердий и желудочковая скорость одинаковы из-за один-к-одному соответствия между синусом P волн и комплексов ЗРС. Однако, в случае атриовентрикулярной диссоциации (например, при желудочковой тахикардии или атриовентрикулярном блоке третьей степени) эта одинока-одна корреспонденция между волнами и комплексами РС; Поэтому, Есть два частоты сердечных приступов, потому что частота предсердий отличается от нормы желудочков. - Определите частоту сердечных приступов на основе по крайней мере пяти последовательных полных сердечных циклов, если сердечный ритм является регулярным, или полосой, по крайней мере шесть секунд, если сердечный ритм нерегулярно.
- Определите, является ли сердечный ритм синусом или нет, регулярным или нерегулярным.
- Рассчитайте интервалы и продолжительность волны.
- Перейти к ЭКГ Анализ (Усреднее Вид concatenate n (например, 5) последовательных сердечных циклов в один средний сигнал (рисунок5C).
ПРИМЕЧАНИЕ: Если ЭКГ волновые формы индивидуального сердечного цикла существенно отличаются от среднего сигнала, изучайте этот сердечный цикл отдельно без конкатации. - Убедитесь, что программное обеспечение правильно определяет начало и конец волны P, комплекса RS и волны T, отображаемые в окне Усредневого просмотра(рисунок 5C). На основе этих автоматических идентификаций (или ручных исправлений) этих волн и интервалов, программное обеспечение автоматически измеряет продолжительность, как это определено условно.
ПРИМЕЧАНИЕ: Интервал PR простирается от начала волны P до начала комплекса ЗРС (или комплекса RS, если волна не видна). Продолжительность RS простирается от начала волны q (или волны R, если волна не видна) до конца волны S (т.е. точки J; Рисунок 1). Интервал кТ простирается от начала волны q (или волны R, если волна не видна) до конца волны Т. Таким образом, для расчета интервалов и продолжительности, правильное определение начала и конца волны P, комплекса ЗРС и Волны R имеет решающее значение. - Исправьте любые ошибки автоматической идентификации, перемещая неуместные курсоры в соответствующие позиции.
- Выберите отрицательный пик волны S в конце комплекса ЗРС 7, потому что точка зебры J, которая сигнализирует о конце волны S, может быть особенно трудно определить точно. Это приведет к небольшой недооценке истинной продолжительности РС.
ПРИМЕЧАНИЕ: Программное обеспечение анализа ЭКГ автоматически корректирует интервал ЗТ к скорости желудочка (или интервал RR) для генерации исправленного интервала ЗТ с помощью метода, предварительно выбранного пользователем в шаге 6.1.3, например, Bazett (Рисунок 5A). Формула Базетта (1920 г.) зТК КТ / ЗРР является самой популярной и первой из нескольких методов, предложенных для коррекции интервала для сердечного ритма человека. Поскольку точность формулы Базетт была поставлена под сомнение, обратитесь к другим методам, предлагаемым для людей10,11 и зебры6 (Рисунок 5D).
- Перейти к ЭКГ Анализ (Усреднее Вид concatenate n (например, 5) последовательных сердечных циклов в один средний сигнал (рисунок5C).
- Интерпретируйте аномалии ЭКГ, признавая исключения для четырех критериев проверки в шаге 4.3.
- Распознать исключения для критерия 1. При отсутствии каких-либо Волн P (что указывает на отсутствие синусового ритма), полагаться на интервалы RR и продолжительность РС для диагностики сердечного ритма. Например, если интервалы ОР нерегулярно, диагностируют мерцательную аритмию; если интервалы RR являются регулярными и ЗРС, как правило, узкие, диагностировать перекрестный ритм побега; с другой стороны, если интервалы RR являются регулярными и ЗРС аномально затягивается, диагностировать желудочковый ритм побега.
- Распознать исключения для критерия 2. Когда волна P отрицательна (или перевернута), диагностировать ретроградную активацию предсердий от эктопического кардиостимулятора (например, участка предсердий вниз по течению синусового узла, атриовентрикулярного узла или желудочка).
- Распознать исключения для критерия 3. Когда высокие и узкие волны, присутствующие с отрицательными P и отрицательными Волнами T, диагностировать разворот свинца из-за ошибочного переключения положительных и отрицательных позиций электрода, потому что эти высокие и узкие волны были истинными R-волнами, ошибочно перевернутыми (Рисунок 6D ). В отличие от этого, когда широкие волны, присутствующие с положительными волнами P после значительной сердечной травмы, диагностировать инфаркт миокарда, потому что эти широкие волны являются истинными патологическими волнами.
- Распознать исключения для критерия 4. Когда волна T инвертирована, проинспектировать активацию желудочка для того чтобы определить ли аномалия реполяризации желудочка первичная или вторично. Опирайтесь на клинический сценарий, чтобы сузить правильный диагноз из дифференциального списка первичной аномалии реполяризации желудочков (от лекарственного эффекта или ишемии миокарда; Рисунок 6С) против вторичной аномалии реполяризации желудочков (из-за аномальной активации желудочков от предвозбуждения, желудочковой эктопии или желудочковой ходьбы).
- Выводы экспортной ЭКГ.
- Выберите таблицу View для анализа всех измерений ЭКГ. Выберите интересные измерения для копирования и вставки в нужный документ (например, электронная таблица Excel).
- Для экспорта следа ЭКГ выделите раздел, представляющий интерес к ЭКГ, используя значок увеличификатора. Копировать и вставить в нужный документ (например, Word или PowerPoint).
Результаты
Рисунок 1 иллюстрирует клиническую значимость метода, представленного здесь. В vivo поверхности электрокардиографии для взрослых зебры является важным электрическим фенотипирование инструмент из-за замечательного сходства между зебрафиш и человека ЭКГ, несмотря на их огромные анатомические различия. Сердце зебры имеет только один предсердий и один желудочек в отличие от человеческого сердца с двумя предсердиями и двумя желудочками (верхний ряд; правый и левый, соответственно). Однако, несмотря на свою кажущуюся анатомическую простоту, сердце зебры разделяет несколько особенностей ЭКГ с человеческим сердцем (нижний ряд; правый и левый, соответственно) Поэтому сердце зебры стало суррогатной моделью для сердца человека электрофизиологии5,12,13. Рисунок 1 иллюстрирует небольшую, но отчетливую волну от живой, здоровой 14-месячной зебры. Тем не менее, в ЭКГ зебры, сивное позиционирование обычно не оптимизировано, чтобы продемонстрировать волну К. Таким образом, волна Q обычно невидима, и комплекс RS чаще всего встречается, чем полный комплекс ЗРС в ЭКГ зебры.
Рисунок 2 обобщает четыре основных действия для проведения минимально инвазивной электрокардиографии in vivo для взрослых зебр. После индукции анестезии (шаг 1) и размещения электрода (шаг 2), мы записали исходные сигналы ЭКГ (шаг 3) от здорового дикого типа AB зебры от 12 до 18 месяцев (n No 9). Наша техника вставки электрода была малоагрессивной, потому что нам не нужно было чистить рыбьи чешуйки или выполнять перикардиотомию. После получения данных мы вручную рассмотрели и проверили каждую запись ЭКГ (шаг 4), чтобы избежать потенциального неправильного толкования с помощью автоматического анализа программного обеспечения.
На рисунке 3 показаны три незаменимых компонента типичной системы сбора и обработки данных ЭКГ: высокопроизводительное оборудование для сбора данных, высокопроизводительный дифференциальный усилитель и компьютер, загруженный с программным обеспечением для данных ЭКГ приобретение и анализ. В нашей лаборатории мы адаптировали существующую коммерческую систему записи IN vivo ECG, первоначально разработанную для малых моделей млекопитающих (таких как мыши, крысы и кролики) для размещения модели взрослых зебры.
Рисунок 4 показывает, что правильное размещение свинца требует выравнивания свинца с предполагаемой сердечной основной оси. В зебрафиш in vivo ECG записи, потому что только один свинец используется, надлежащее позиционирование свинца, чтобы максимизировать одновременно как R и T волны амплитуды имеет решающее значение. Чтобы максимизировать амплитуды волн R и T, мы выровняли положительные и отрицательные электроды свинца с сердечной основной оси, предположительно в левой каудальной правой черепной ориентации. После торакотомии и перикардиотомии, чтобы открыть перикардиальный мешок и разоблачить сердце, сердечная основная ось становится очевидной(Рисунок 4B белая пунктирной линии). В самом деле, перикардиотомия подвергать сердце является широко используемой стратегией для увеличения сигнала к шуму соотношение7 за счет преобразования записи ЭКГ от минимально инвазивных в высокоинвазивной процедуры.
На рисунке 5 иллюстрируются критические шаги в анализе ЭКГ. Во-первых, мы предопределили различные параметры параметров для автоматического анализа программного обеспечения с помощью окна диалога экг-принас(рисунок 5A). Поскольку мы перепрофилируем существующее оборудование для записи ЭКГ, предназначенное для моделей млекопитающих для размещения взрослых зебр, установка обнаружения и анализа для зебры недоступна. Мы выбрали человека Preset вместо этого, учитывая замечательное сходство зебры ЭКГ человека ЭКГ(рисунок 5A). Во-вторых, мы вручную проверили программное обеспечение автоматической идентификации ЭКГ (в черном) пиков волн R и исправить (красным) любые ошибки R волны автоматической идентификации до командования программного обеспечения для перерасчета средней скорости желудочков. Например, на рисунке 5Bбольшая волна P по отношению к r-волне обманула программное обеспечение, введя ошибку в r-волнах, что привело к последующему автоматическому просчету интервала RR или скорости желудочков. Поэтому проверка человека и соответствующие по мере необходимости имеют решающее значение при анализе ЭКГ. В-третьих, мы быстро оценили регулярность ритма и вычислили среднюю продолжительность волн и интервалов с помощью Усредненный вид (рисунок5C), чтобы совпьировать несколько последовательных сердечных циклов (зеленый) в один средний сигнал (черный). Здесь, на рисунке 5C, незначительное отклонение между каждым из девяти сердечных циклов и средний сигнал утверждает, для отличной регулярности ритма этого сердца зебры. Наконец, мы позволили программному обеспечению автоматически исправить интервал зТ для частоты сердечных приступов с помощью Bazett, один из семи различных методов, доступных (Рисунок 5D).
Рисунок 6A -C демонстрирует, как глубина размещения электродов влияет на амплитуды сигналов ЭКГ. Когда мы неправильно вставили электроды слишком поверхностно в дерму(Рисунок 6A), свинец был "косвенным" - как (более двух сердечных диаметров от сердца, похожих на косвенные стандартные КОНЕЧНОСТи ЭКГ человека приводит I, II и III) и напряжения сигналы были небольшими. Когда мы соответствующим образом вставили электроды на 1 мм глубже в мускулатуру pectoralis(рисунок 6B),свинец стал "полупрямым" (в непосредственной близости, но не в непосредственном контакте с сердцем) и сигналы напряжения увеличились. Волновые формы ЭКГ стали легко видны. Однако, когда мы неправильно вставили электроды еще глубже в желудочек(рисунок 6C),свинец стал "прямым" (при прямом контакте с сердцем) и сигналы напряжения увеличились дальше. Амплитуда волны R на рисунке 6С увеличилась в восемь раз по сравнению с рисунком 6А и в четыре раза по сравнению с рисунком 6B. Тем не менее, ЭКГ след на рисунке 6C показали новые признаки повреждения желудочковой миокарда, такие как новая депрессия ST и новые T волны инверсии.
Рисунок 6D демонстрирует, как необычные инверсии всех волн ЭКГ (P, q, R, S и T) должны сигнализировать о ошибке разворота свинца, в которой положительные и отрицательные электроды переключились на место. Обратите внимание, что по определению и S всегда отрицательные в то время как R всегда является положительным.
Рисунок 6E -F показывает, как неуместная глубина анестезии может ухудшить качество записи IN vivo ECG. На рисунке 6Eнеадекватная анестезия (0,017% трикаина) привела к полному неспособности полностью обездвижить зебры. Полученные артефакты движения снизили соотношение сигнала к шуму, загрязняя сигнал (звездочка), так и увеличивая шум (стрелки). В отличие от этого, на рисунке 6F, передозировка анестезии (0,08% трикаина) индуцированной тяжелой синусбраритии, а также изменения сегмента ST и Т волны.
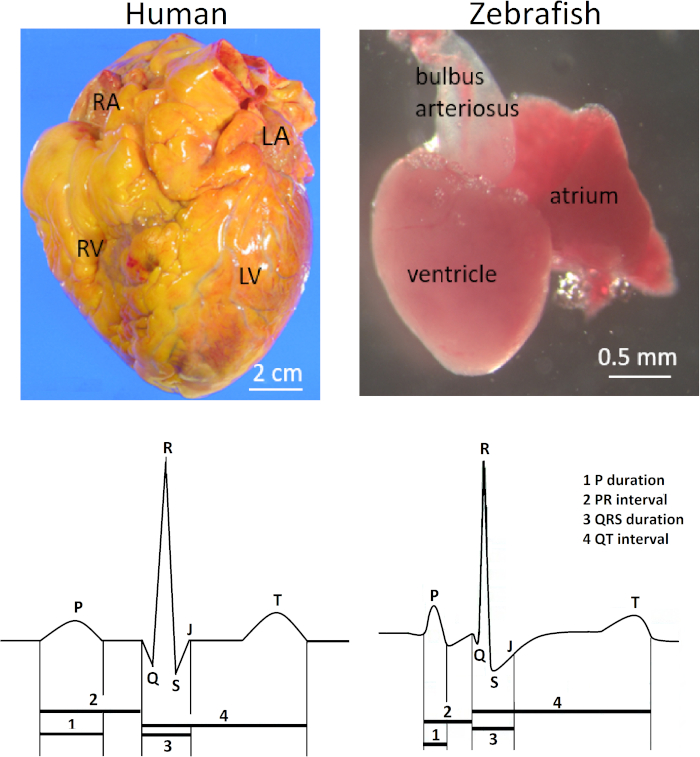
Рисунок 1: Контрастная анатомия и ЭКГ человеческих и зебровых сердец. В отличие от человеческого сердца с двумя предсердиями и двумя желудочками, сердце зебры имеет только одно предсердие и один желудочек (верхний ряд). Аббревиативы: РА, правый атриум; Лос-Анджелес, левое атриум; Р.В., правый желудочек; LV: левый желудочек. Сердце зебры разделяет несколько общих особенностей ЭКГ с человеческим сердцем (нижний ряд). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
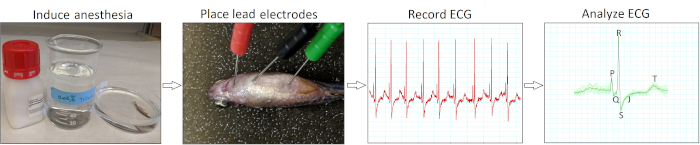
Рисунок 2: Минимально инвазивный протокол записи ЭКГ in vivo. Схематическая диаграмма потока иллюстрирует четыре критических шага действий в проведении инг-опроса in vivo ECG: индуцировать анестезию, разместить электроды ЭКГ, записать ЭКГ и проанализировать записи ЭКГ. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
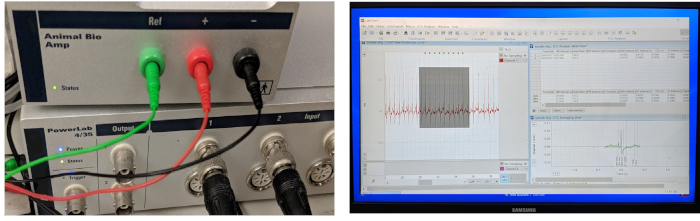
Рисунок 3: Система сбора и обработки данных ЭКГ. Три ключевых компонента интегрированной системы записи ЭКГ vivo включают аппаратное обеспечение для получения данных, усилитель и компьютерное программное обеспечение для сбора и анализа данных. Усилитель поставляется с тремя готовыми к использованию 29-калиберными микроэлектродами из нержавеющей стали. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
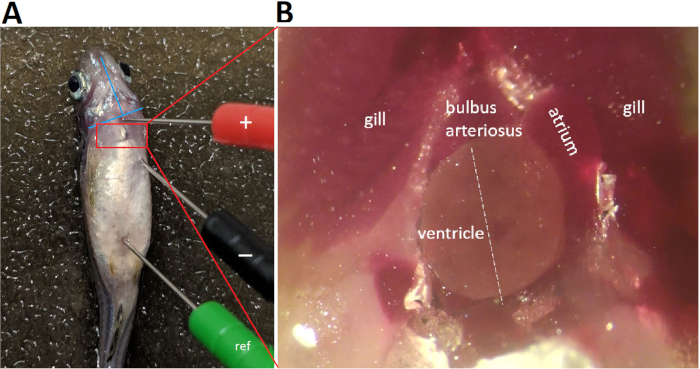
Рисунок 4: ЭКГ свинца размещения. Три 29-калиберных цветных электрода из нержавеющей стали надежно вставляются в мускулатуру рыбы глубиной около 1 мм. Размещение отрицательного (черного) электрода и положительного (красного) электрода устанавливает биполярный свинец в лобной плоскости, вдоль левого каудаля к правой черепной ориентации. Аббревиатив: рефери, эталонный электрод Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
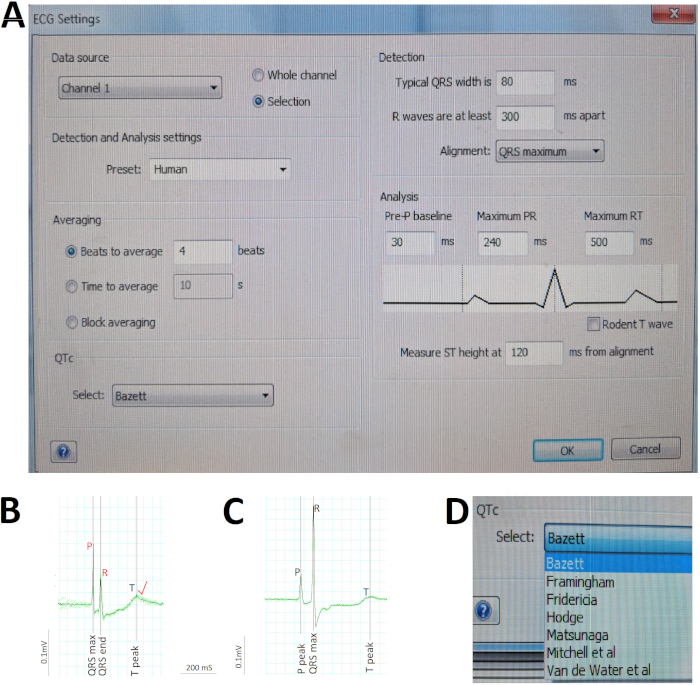
Рисунок 5: C ритические шаги в анализе ЭКГ. (A) Предварительно определить различные параметры параметров для автоматического анализа программного обеспечения. (B) Ручно исправлять (красный) 2 автоматических misidentifications программным обеспечением (черным) волн P и R для того чтобы исправить просчет просчета просчета проислотого промыкта предсердий и желудочковой скорости. (C) Concatenate девять последовательных сердечных циклов (зеленый) в один средний сигнал (черный), чтобы быстро оценить ритм регулярности / нерегулярности и вычислить среднюю продолжительность волн и интервалов. (D) Исправьте интервал ЗТ для частоты сердечных приступов с помощью одного из различных методов, таких как Bazett. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
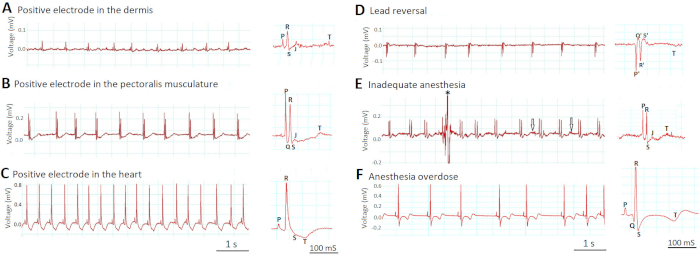
Рисунок 6: Влияние размещения свинца и глубины анестезии на сигналы ЭКГ. Два наиболее важных шага, которые определяют успех записи in vivo ECG являются размещение свинца(A-D) и глубина анестезии (E-F). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
При записи in vivo ECG для взрослых зебры с помощью одного свинца, как мы продемонстрировали в этом исследовании, существует ряд оговорок относительно качества и достоверности результатов записи ЭКГ. Во-первых, при выборе соответствующих анестезии и определении минимальнонеобходимой концентрации анестезии, глубины и продолжительности, сбалансировать анестезию кардиотоксичности с критической необходимостью для подавления движения артефактов и априори определение выживания против терминала экспериментального дизайна. Капитализация на синергетической потенции сочетание нескольких анестезий изразличных классов наркотиков 5,14 и паралитиков1,6, чтобы снизить дозу отдельных агентов5 или введения низкая доза обслуживания после более высокой дозы индукции являются типичными стратегиями. Однако, несмотря на его хорошо известные потенциальные сердечно-респираторные токсичности, в том числе смерть8, трикаин по-прежнему наиболее широко используется, лучший доступный, и только обезбол, утвержденных США пищевых продуктов и медикаментов (FDA) для зебры Анестезии. Tricaine широко используется в ЭКГ записи взрослых зебры либо в качестве одного агента или в сочетании с другими анестезии или паралитических.
Во-вторых, точность размещения свинца может быть обеспечена по крайней мере для здоровой нормальной зебры, используя наши четыре критерия проверки для нормальной кКГ зебры для взрослых. Из четырех критериев проверки, которые мы предлагаем здесь, последние два критерия вместе подтверждают фундаментальное соответствие междуполярностью волны R и волной Т в обычной ЭКГ 5,7,15. Это R и T волна согласование является случайной, но критическое сходство между зебрафиш и человека16,17 нормальных ЭКГ, что способствует клинической актуальности модели сердца зебры в качестве суррогата для сердца человека Электрофизиологии. Однако несколько доброкачественных или злокачественных условий могут привести к аннулированию любого из четырех критериев проверки. Например, r и T волновой конкорд теряетсяв миокардиальной ишемии 7,15. Эта потеря R и T волны соответствия в ишемии миокарда является еще одним поразительным сходством между зебрафиш и человека ЭКГ, что способствует клинической актуальности модели инфаркта миокарда зебры.
Наконец, мы рекомендуем стандартную практику в анализе ЭКГ. С появлением технологии программное обеспечение для анализа ЭКГ может генерировать автоматическую интерпретацию ЭКГ. Тем не менее, мы настоятельно рекомендуем, чтобы обученные люди всегда должны переосмыслить и проверить все ЭКГ на основе соответствующего клинического сценария, ведущего к записи ЭКГ. Регулярная чрезмерная зависимость исключительно от автоматической интерпретации программным обеспечением анализа ЭКГ нецелесообразна, особенно при наличии обычных нормальных вариантов ЭКГ, сердечных патологий или неоптимального размещения свинца.
Это исследование фокусируется на минимально инвазивный метод для кратких сессий записи ЭКГ. Однако, если возникнет необходимость в терминальных длительных сеансах записи ЭКГ продолжительностью в несколько часов,необходимы изменения для обеспечения адекватной оксигенации, гидратации и анестезии путем непрерывного перфузии 6.
Кроме того, увеличьте соотношение сигнала к шуму одним из по крайней мере трех способов. Выбор более мощного усилителя часто является дорогостоящим, если не непрактичным вариантом. Открытие перикардиальный мешок для уменьшения объема проводника является разумным, хотя и инвазивным, подход, который был принят7. Стратегическое размещение свинца для выравнивания свинцовой оси в направлении, параллельном основной оси сердца(рисунок 4B) позволит максимизировать сигналы напряжения ЭКГ, но может потребовать проб и ошибок, особенно при отсутствии перикардиотомии.
Метод допроса IN vivo ECG для взрослых зебры, который мы представили здесь, предлагает четыре основных преимущества. Во-первых, наш минимально инвазивный подход требует только вставки электрода, но не удаление рыбной шкалы или торакотомии-перикардиотомии. Таким образом, сводя к минимуму боль для рыбы, наш подход позволяет повторные допросы ЭКГ в продольных исследований выживания. Во-вторых, когда анестезия адекватно подавляет движение рыбы, система записи ECG in vivo в нашем исследовании последовательно дает удовлетворительное соотношение сигнала к шуму с бесшумными необработанными сигналами. В-третьих, предлагаемая нами заявка на качество четырех критериев обеспечивает точность и надежность данных на ранних стадиях получения данных ЭКГ и сводит к минимуму вариации, зависящие от оператора. Наконец, в частности, наш последний критерий проверки (нормальная волна Т в вертикальном положении) инкапсулирует соответствие волны R и T волны, важной человекоподобной особенностью нормальной ЭКГ зебры(рисунок 1).
Тем не менее, по-прежнему существуют четыре основных ограничения текущей методологии IN vivo ECG для взрослых зебры нашей группой и другими.
Во-первых, отсутствие предметного сотрудничества обусловливает необходимость анестезии с ее ограничивающими последствиями сердечно-респираторной токсичности. Для in vivo ЭКГ допроса, в то время как человеческие пациенты никогда не нуждаются в седанности, зебравсегда всегда требуют анестезии или паралитических веществ, все из которых вызывают переменную сердечно-респираторную токсичности.
Во-вторых, необходимость обеспечения прилагаемых ЭКГ приводит несколько повышает инвазивность в противном случае неинвазивной процедуры. В то время как свинец размещения в теле поверхности ЭКГ записи людей является совершенно неинвазивным, потому что электроды придерживаются человеческого эпидермиса, свинец размещения для in vivo ЭКГ записи зебры является более инвазивным, потому что, как минимум, стальные электроды должны прокола рыбьей кожи для безопасной вставки в мускулатуру рыбы.
Последние два ограничения связаны с анатомическими ограничениями груди и сердца зебры. В-третьих, мизерный размер сердца взрослой зебры требует резкого сокращения количества ЭКГ-проводов. Пока люди охотно приспосабливали 12 руководства в стандартной записи ECG, взрослые zebrafish могут типично приспособить только одиночный однополярный или биполярный свинец. Последствия одного свинца ЭКГ является задачей для оптимизации одновременно амплитуды всех трех Волн P, R и T. Таким образом, важность оптимального и точного размещения свинца в зебрафиш ЭКГ допроса не может быть переоценена. В зебрафиш, волна T представляет собой уникальную проблему обнаружения, потому что это часто самый маленький из этих трех волн. Таким образом, амплитуда волны зебрафиш T должна получить приоритет оптимизации по сравнению с обычно большими волнами P и R.
В-четвертых, определение основной оси сердца зебры, чтобы максимизировать амплитуда волны R может быть сложной задачей. Причина в том, что сердце зебры имеет больше свободы движения в его свободной перикардиальный мешок по сравнению с человеческим сердцем в форме облегающие перчатки, как перикард.
В целом, эти ограничения будут стимулировать будущие инновации метода. С появлением 3D-печати и деформируемой электроники18, есть надежда на прямую имплантацию свинца один день в бодрствования, оповещения, плавание зебры с помощью "сердечный носок" беспроводных датчиков электрода.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Национальными институтами здравоохранения R01 HL141452 в TPN. ADInstruments любезно предоставил щедрое финансирование для покрытия расходов на публикацию открытого доступа, но не принимал ажиотажа ни в экспериментальном проектировании, сборе данных, анализе данных этого исследования, ни в доступе к рукописи до публикации.
Материалы
| Name | Company | Catalog Number | Comments |
| Culture dishes | Fisher Scientific | FB087571 | 100 mm x 20 mm |
| Dumont Forceps | Fine Sciense Tools | 11253-20 | 0.1 x 0.06 mm |
| FE136 Animal Bio Amp | AD Instruments | FE231 | |
| Iris Forceps | Fine Sciense Tools | 11064-07 | 0.6 x 0.5 mm |
| LabChart 8 Pro | AD Instruments | Software with ECG Module | |
| Needle electrodes for Animal Bio Amp | AD Instruments | MLA1213 | 29 gauge |
| Plastic Disposable Transfer Pipets | Fisher Scientific | 13-669-12 | 6 in., 1.2 mL |
| PowerLab 4/35 | AD Instruments | 4//35 | |
| Scissors | Fine Sciense Tools | 15000-08 | 2.5 mm, 0.075 mm |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma | E10521-10G | MS-222 |
Ссылки
- Arnaout, R., et al. Zebrafish model for human long QT syndrome. Proceedings of the National Academy of Sciences of the United States of America. 104 (27), 11316-11321 (2007).
- Hassel, D., et al. Deficient zebrafish ether-a-go-go-related gene channel gating causes short-QT syndrome in zebrafish reggae mutants. Circulation. 117 (7), 866-875 (2008).
- Meder, B., et al. Reconstitution of defective protein trafficking rescues Long-QT syndrome in zebrafish. Biochemical and Biophysical Research Communication. 408 (2), 218-224 (2011).
- Sieber, S., et al. Zebrafish as a preclinical in vivo screening model for nanomedicines. Advanced Drug Delivery Reviews. , (2019).
- Lin, M. H., et al. Development of a rapid and economic in vivo electrocardiogram platform for cardiovascular drug assay and electrophysiology research in adult zebrafish. Science Reports. 8 (1), 15986 (2018).
- Milan, D. J., Jones, I. L., Ellinor, P. T., MacRae, C. A. In vivo recording of adult zebrafish electrocardiogram and assessment of drug-induced QT prolongation. American Journal of Physiology-Heart and Circulation Physiology. 291 (1), H269-H273 (2006).
- Liu, C. C., Li, L., Lam, Y. W., Siu, C. W., Cheng, S. H. Improvement of surface ECG recording in adult zebrafish reveals that the value of this model exceeds our expectation. Science Reports. 6, 25073 (2016).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. Ilar Journal. 53 (2), 192-204 (2012).
- Westerfield, M. . The zebrafish book: a guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Sagie, A., Larson, M. G., Goldberg, R. J., Bengtson, J. R., Levy, D. An improved method for adjusting the QT interval for heart rate (the Framingham Heart Study). American Journal of Cardiology. 70 (7), 797-801 (1992).
- Luo, S., Michler, K., Johnston, P., Macfarlane, P. W. A comparison of commonly used QT correction formulae: the effect of heart rate on the QTc of normal ECGs. Journal of Electrocardiology. 37 Suppl, 81-90 (2004).
- Vornanen, M., Hassinen, M. Zebrafish heart as a model for human cardiac electrophysiology. Channels (Austin). 10 (2), 101-110 (2016).
- Tsai, C. T., et al. In-vitro recording of adult zebrafish heart electrocardiogram - a platform for pharmacological testing). Clinica Chimica Acta. 412 (21-22), 1963-1967 (2011).
- Collymore, C., Tolwani, A., Lieggi, C., Rasmussen, S. Efficacy and safety of 5 anesthetics in adult zebrafish (Danio rerio). Journal of American Association of Lab Animal Sciences. 53 (2), 198-203 (2014).
- Sun, Y., et al. Activation of the Nkx2.5-Calr-p53 signaling pathway by hyperglycemia induces cardiac remodeling and dysfunction in adult zebrafish. Disease Model and Mechanism. 10 (10), 1217-1227 (2017).
- Franz, M. R., Bargheer, K., Rafflenbeul, W., Haverich, A., Lichtlen, P. R. Monophasic action potential mapping in human subjects with normal electrocardiograms: direct evidence for the genesis of the T wave. Circulation. 75 (2), 379-386 (1987).
- Chiale, P. A., et al. The multiple electrocardiographic manifestations of ventricular repolarization memory. Current Cardiology Reviews. 10 (3), 190-201 (2014).
- Xu, L., et al. 3D multifunctional integumentary membranes for spatiotemporal cardiac measurements and stimulation across the entire epicardium. Nature Communications. 5, 3329 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены