Method Article
Imagen de ATP intracelular en rebanadas de tejido organotípico del cerebro del ratón utilizando el sensor basado en FRET ATeam1.03YEMK
En este artículo
Resumen
Describimos un protocolo para la expresión específica de tipo celular del sensor basado en FRET genéticamente codificado ATeam1.03YEMK en cultivos de rebanadas organotípicas del forebrain del ratón. Además, mostramos cómo utilizar este sensor para imágenes dinámicas de los niveles de ATP celular en neuronas y astrocitos.
Resumen
La actividad neuronal en el sistema nervioso central (SNC) evoca una alta demanda de energía celular proporcionada por la descomposición del trifosfato de adenosina (ATP). Se necesita una gran parte de ATP para reinstalar gradientes de iones a través de membranas plasmáticas degradadas por la señalización eléctrica de las neuronas. Hay evidencia de que los astrocitos -aunque no generan señales eléctricas rápidas en sí mismos- se someten a una mayor producción de ATP en respuesta a la actividad neuronal y apoyan a las neuronas activas proporcionándoles metabolitos energéticos. El reciente desarrollo de sensores codificados genéticamente para diferentes metabolitos ahora permite el estudio de tales interacciones metabólicas entre las neuronas y los astrocitos. Aquí, describimos un protocolo para la expresión específica de tipo celular del sensor de transferencia de energía de resonancia de fluorescencia sensible a ATP (FRET-) ATeam1.03YEMK en cultivos de rebanadas de tejido organotípico del hipocampo y la corteza del ratón utilizando vectores virales asociados adeno (AAV). Además, demostramos cómo este sensor se puede emplear para la medición dinámica de los cambios en los niveles de ATP celular en las neuronas y astrocitos tras los aumentos en el potasio extracelular y después de la inducción de la isquemia química (es decir, una inhibición del metabolismo de la energía celular).
Introducción
La actividad eléctrica excitatoria de las neuronas se basa en gran medida en el flujo de cationes como el sodio (Na+) y el potasio (K+) a través de sus membranas plasmáticas. Por lo tanto, se requiere el mantenimiento de los gradientes electroquímicos de estos dos iones para la señalización. Esto se logra mediante el celular Na+/K+-ATPase (NKA), una bomba transmembrana electrogénica ubicuamente expresada, que extruye 3 Na+ fuera de la célula a cambio de 2K+ desde el espacio extracelular, requiriendo el consumo de una molécula de ATP por ciclo de transporte1. Además de la NKA, hay varios otros transportadores de iones que consumen ATP, incluyendo la membrana plasmática Ca2+-ATPase, que es vital para la homeostasis intracelular Ca2+ y su exportación después de la influencia inducida por la actividad2. En vesículas presinápticas, un tipo vacuolar H+-ATPase (v-ATPase) crea el gradiente de protones necesario para la admisión de neurotransmisores en este compartimiento3.
Mientras que la actividad de las neuronas por lo tanto requiere una cantidad sustancial de ATP4, no exhiben una capacidad significativa para el almacenamiento de energía. En su lugar, parecen depender de interacciones metabólicas con astrocitos vecinos, las principales reservas de glucógeno en el cerebro5. Se ha sugerido que el glucógeno astrocítico desempeña un papel importante en el apoyo a las necesidades de energía neuronal; y un fenómeno clave en este acoplamiento neurometabólico propuesto entre los dos tipos de células es la capacidad de los astrocitos para aumentar su producción de ATP en respuesta a la actividad neuronal6,7,8. Esta hipótesis, conocida como transbordador de lactato astrocito-neurona (ANLS), todavía está en debate, porque otros trabajos han proporcionado evidencia de que las neuronas también pueden aumentar su propia tasa de glucólisis en respuesta a la estimulación9,10,lo que refleja la necesidad de otros métodos y enfoques para estudiar la interacción neuro-glia.
La investigación del metabolismo de la energía celular y los niveles de ATP en neuronas y astrocitos para dilucidar las interacciones metabólicas de la neuro-glia se ha visto obstaculizada durante mucho tiempo por la falta de sondas adecuadas para la detección de cambios en las concentraciones de metabolitos en células vivas en el tejido cerebral. La última década, sin embargo, ha proporcionado un aumento en el desarrollo de nuevas herramientas y nuevas sondas fluorescentes codificadas genéticamente para diferentes metabolitos, incluyendo sensores para ATP, lactato, piruvato y otros11,12. Usando estas herramientas, ahora es posible abordar directamente las preguntas relacionadas con el consumo de ATP celular y los cambios en los niveles de energía celular a nivel de una sola célula y de una manera específica de tipo celular en el tejido cerebral intacto13.
En el presente trabajo, describimos un procedimiento para visualizar la dinámica de ATP citosólico en neuronas y astrocitos de rebanadas de cerebro organotípico cultivadas. Mostramos cómo emplear vectores virales asociados adeno-asociados (AAV) para la expresión específica de tipo celular del nanosensor DE ATP codificado genéticamente ATeam1.03YEMK (14) en neuronas y astrocitos de rebanadas de cerebro de ratón que se pueden mantener en el cultivo celular durante varias semanas15. Se describe un procedimiento de cómo extraer la cicatriz glial que cubre las rebanadas de tejido cultivado, que mejora la accesibilidad óptica y la imagen de las células en las capas de tejido organotípico debajo. Por último, mostramos cómo ATeam1.03YEMK se puede utilizar para realizar imágenes basadas en FRET de los cambios en los niveles de ATP celular en esta preparación. Este método alberga las principales ventajas de que no requiere procedimientos quirúrgicos del cerebro, proporciona altos niveles de expresión del sensor y la especificidad del tipo celular en rebanadas cerebrales cultivadas, reduciendo la invasividad o el estrés en las células en comparación con otros métodos, como la transfección por electroporación o transducción con otros vectores virales10,16,17. Además, este protocolo se puede aplicar a otros nanosensores basados en FRET, entre ellos variantes de ATeam1.03 que proporcionan menor afinidad de enlace para ATP14.
Protocolo
El presente estudio se llevó a cabo de conformidad estricta con las directrices institucionales de la Universidad Heinrich Heine de Dusseldorf, así como con la Directiva del Consejo de la Comunidad Europea (2010/63/UE). Todos los experimentos que utilizan cultivos organotípicos de rebanadas cerebrales fueron comunicados y aprobados por la Oficina de Bienestar Animal de la Instalación de Cuidado y Uso Animal de la Universidad Heinrich Heine de Dusseldorf (número de acto institucional: O50/05). De conformidad con las recomendaciones de la Comisión Europea18, los animales de hasta 10 días de edad fueron asesinados por decapitación.
1. Preparación de cultivos organotípicos de rebanadas cerebrales (OTC)
- El día anterior o al menos 30 minutos antes del procedimiento
- Preparar el plato Petri (bajo condiciones estériles). Retire la tapa de la placa de 6 pocillos y coloque 800-850 ml de medio OTC en cada pocil. Conservar la placa en la incubadora (37oC, 5% CO 2/95% O2) hasta que sea necesario.
- Preparar los platos de lavado Petri (bajo condiciones estériles). Añadir 3 ml de HBSS a cada plato Petri de 30 mm. Se requiere un total de 5 platos por procedimiento. Colóquelos en la incubadora (37 oC, 5% CO2/95% O2) durante al menos 30 minutos, durante la noche hasta que sea necesario.
- Prepare el ACSF(Tabla 1). Mantenga la salina sin glucosa a 4oC hasta el día siguiente.
| Salines y medios - Formulación | ||||
| Nombre | Abreviatura | Composición | Concentración [mM] | Comentarios |
| Solución de líquido cefalorraquídeo artificial | ACSF | Nacl | 125 | Burbuja con 5% CO2/95% O2, pH 7.4 |
| Kcl | 2.5 | Siempre agregue glucosa justo antes de su uso. | ||
| CaCl2 | 2 | No almacenar durante más de un día con glucosa | ||
| MgCl2 | 1 | 310 mOsm/L | ||
| NaH2PO4 | 1.25 | |||
| NaHCO3 | 26 | |||
| Glucosa | 20 | |||
| Experimental ACSF | E-ACSF | Nacl | 136 | Burbuja con 5% CO2/95% O2, pH 7.4 |
| Kcl | 3 | Siempre agregue glucosa justo antes de su uso. | ||
| CaCl2 | 2 | No almacenar durante más de un día con glucosa | ||
| MgCl2 | 1 | 320 mOsm/L | ||
| NaH2PO4 | 1.25 | |||
| NaHCO3 | 24 | |||
| Glucosa | 5 | |||
| Lactato | 1 | |||
| Solución de isquemia química | Cis | Nacl | 136 | Burbuja con 5% CO2/95% O2, pH 7.4 |
| Kcl | 3 | 318 mOsm/L | ||
| CaCl2 | 2 | |||
| MgCl2 | 1 | |||
| NaH2PO4 | 1.25 | |||
| NaHCO3 | 24 | |||
| 2, 2-Desoxiglucosa | 2 | |||
| NaN3 | 5 | |||
| 8 mM de potasio ACSF | 8 mM K+ ACSF | Nacl | 128 | Burbuja con 5% CO2/95% O2, pH 7.4 |
| Kcl | 8 | 320 mOsm/L | ||
| CaCl2 | 2 | |||
| MgCl2 | 1 | |||
| NaH2PO4 | 1.25 | |||
| NaHCO3 | 24 | |||
| Glucosa | 5 | |||
| Lactato | 1 | |||
| ACSF con búfer de hepes | H-ACSF | Nacl | 125 | Ajustado al pH 7.4 con NaOH |
| Kcl | 3 | Agregue siempre la glucosa justo antes de usar | ||
| CaCl2 | 2 | No almacenar durante más de un día con glucosa | ||
| MgSO4 | 2 | 310 mOsm/L (ajustado con sacarosa) | ||
| NaH2PO4 | 125 | |||
| Hepes | 25 | |||
| Glucosa | 10 | |||
| Solución de sal equilibrada de Hanks | HBSS | Sigma (número de catálogo H9394). | ||
| Salina tamponada con fosfato de Dulbecco | DPBS | Gibco (número de catálogo 14287-080) | ||
| Medio de Cultura Organotípica | Medio OTC | suero de caballo inactivado por calor | 20% | 34oC, 5 % CO2, pH 7,4, en condiciones de cultivo |
| Mem | 79% | 320 mOsm/L | ||
| L-glutamina | 1 | |||
| Insulina | 0,01 mg/ml | |||
| Nacl | 14.5 | |||
| MgSO4 | 2 | |||
| CaCl2 | 1.44 | |||
| Acido ascórbico | 0.00125 % | |||
| D-glucosa | 13 |
Tabla 1: Composición de la solución.
- El día de la preparación, añadir la glucosa al ACSF, colocarla en hielo y empezar a burbujear con 95% O2/5% CO2 durante al menos 30 min para dar lugar a un pH de 7.4.
- Disección y corte
- Sacrificar el ratón (BalbC, ambos sexos) en los días postnatales 6 a 8 por decapitación rápida y colocar la cabeza en un plato de vidrio Petri que contiene ACSF helado.
- Exponga el cráneo cortando la piel desde la espalda hasta la punta posterior del hueso nasal. Luego, corte cuidadosamente el cráneo del foramen magnum usando una tijera quirúrgica y exponga el cerebro.
NOTA: Verificar que el procedimiento esté de acuerdo con las directrices de la institución. - Retire el cerebro y colóquelo en una membrana de filtro en una placa de Petri helada llena de ACSF.
- Separar los hemisferios y realizar un corte parasagital en un ángulo de 45o. Fije un hemisferio en la etapa de tejido vibratomo con superpegamento. Transfiera inmediatamente el bloque de tejido al baño de vibratome que contiene ACSF helado (burbuja con 5% CO2/95% O2). Finalmente alinee el tejido. Mantenga el segundo hemisferio en hielo frío ACSF hasta el corte.
- Ajustar el vibratomo para cortar las rodajas a 250-400 m. El corte a 250 m producirá aproximadamente 12 rodajas por animal (400 m: 7 rodajas).
- Después de cortar la rebanada(Figura 1A),identificar la formación del hipocampo en función de su aspecto morfológico típico(Figura 1) y aislarla utilizando agujas hipodérmicas (23 calibre, 1"), manteniendo la parte de la corteza cerebral adyacente al hipocampo.
NOTA: Preservar el neocórtex mientras se sacrifica ayuda a preservar la integridad del hipocampo. Sin embargo, el hipocampo puede ser aislado y cultivado sin corteza si es necesario. - Coloque la rebanada en una malla en ACSF caliente (34 oC, burbujeada con 5% de CO2/95% O2) hasta que se recojan todas las rodajas.
- Transfiera las rodajas al armario de flujo laminar para continuar en condiciones estériles.
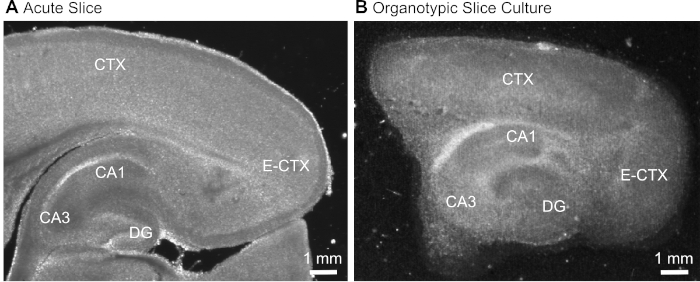
Figura 1: Imágenes representativas de transmisión de preparaciones agudas y organotípicas de corte cerebral. Comparación de una rebanada cerebral parasagittal agudamente aislada (A) y una rebanada cerebral organotípica parasagittal mantenida en cultivo durante 12 días(B) utilizando microscopía de transluminación de campo ancho. DG - gyrus dentado; CA1/3 - CA1/CA3-región del hipocampo; E-CTX - Corteza entorhinal; CTX (neo-) corteza. Haga clic aquí para ver una versión más grande de esta figura.
2. Cultoring the Slices
- Transfiera suavemente las rodajas del ACSF a uno de los platos precalentados de Petri llenos de solución de sal estéril de Hank utilizando una pipeta Pasteur de vidrio estéril invertido.
NOTA: La esterilización del tejido se logra por dilución (paso 3.2). Transfiera el menor ACSF posible al plato Petri. - Cambie la pipeta y transfiera las rodajas a la segunda placa Petri. Repita el proceso 5 veces en general. Transfiera el menor HBSS posible a los siguientes platos de Petri.
- Coloque suavemente una rebanada a la vez en la parte superior de la plaquita de cultivo. Repita el proceso para cada sector. Evite las turbulencias en la pipeta y espere hasta que la rebanada descienda hasta la punta de la pipeta Pasteur. Uno puede colocar hasta 4 rodajas en una sola membrana.
- Retire cuidadosamente cualquier exceso de solución de Hank de la parte superior de la plaquita usando una punta fina.
- Mantener los cultivos(Figura 2) en una incubadora en la interfaz entre el gas (carbogen, 95% O2 /5% CO2) y el líquido a 37oC hasta el día del experimento. Sustituya el medio cada 2-3 días.
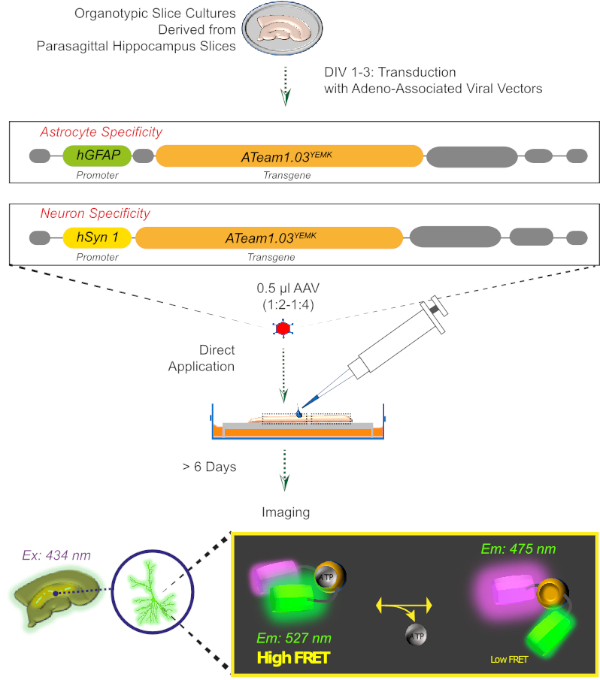
Figura 2: Principio de la imagen ATP basada en FRET en rebanadas de cerebro organotípico sórpicas cultivadas utilizando el sensor codificado genéticamente ATeam1.03YEMK. Representación esquemática del protocolo presentado en este trabajo. Brevemente, las rebanadas organotípicas parasagittales, cultivadas durante 1-3 días, se transduyen con un vector viral asociado a dedeno que contiene ya sea, el hGFAP- específico del astrocito o el promotor de hSyn específico de la neurona y la secuencia para la expresión de ATeam1.03YEMK. Las alícuotas diluidas de estos vectores (1:2-1:4) se aplican directamente en la parte superior de una rebanada, que se mantiene en condiciones de cultivo durante al menos 6 días más. Los cambios en los niveles de ATP intracelular se pueden visualizar en las células que expresan el sensor excitando a 434 nm y adquiriendo la emisión de fluorescencia simultáneamente a 527 (aceptador) y 475 (donante) nm. Haga clic aquí para ver una versión más grande de esta figura.
3. Expresión de sensores ATP con un vector viral asociado a Aadeno (Figura 2)
NOTA: ¡Asegúrese de cumplir con todos los requisitos para el manejo de organismos modificados genéticamente!
- Para manejar el vector viral, vectores virales asociados a la adeno aicuotas (AAV2/5) a 1-2 l para evitar la congelación y descongelación repetidas. Conservar las alícuotas a -80oC.
- Coloque un matraz que contenga un 10% de lejía en el banco estéril para desechar todo el material residual usado que estaba en contacto con el vector.
- Para la transducción, prepare una dilución de 1 l del vector con 2-3 l de DPBS. Las soluciones de stock normalmente exhiben un rumbo físico en la magnitud de 1012 genomas virales por ml (vg/mL).
- Transfiera un inserto que contenga una rebanada cultivada en la capucha estéril.
- Sin tocar el tejido, aplicar 0,5 l del vector diluido directamente en la parte superior de cada rebanada.
NOTA: Una mejor expresión en las capas más profundas del tejido se obtiene transduciendo rodajas cultivadas a 1-3 días in vitro (DIV). La transducción de cultivos más antiguos podría dar lugar a una expresión predominante de las células en la cicatriz glial circundante o una expresión baja en las neuronas, respectivamente. - Finalmente, vuelva a colocar las rodajas en la incubadora y manténgalas durante al menos 6 días más. No cambie el medio el día de la transducción.
4. Extracción de la cicatriz glial(Figura 3)
- Justo antes de iniciar un experimento, transfiera un inserto que contenga rodajas cultivadas en la campana estéril y colóquelo en un plato de 30 mm, que contenga 1 ml de medio OCT o MEM.
- Coloque el plato debajo del estereoscopio y concéntrese en la superficie de la rebanada.
- Utilice dos agujas hipodérmicas estériles (23 G, 1") para hacer un corte corto a la derecha en los bordes estrechos de una rebanada elegida(Figura 3). Este procedimiento liberará la tensión en la superficie creada por la cicatriz glial haciendo que se retraiga, exponiendo así las capas subyacentes (ver Figura 5).
NOTA: La primera capa de tejido (cicatriz glial) está formada principalmente por astrocitos reactivos. En las imágenes de campo ancho, esta capa de tejido denso resultará en dispersión adicional de la luz, lo que resultará en imágenes borrosas. Extracción de la cicatriz es por lo tanto ventajoso para obtener una mejor visibilidad de las capas más profundas, que contienen el tejido organotípico adecuado. Por lo tanto, tenga cuidado de realizar este corte exclusivamente en el borde y en la capa superior de la preparación de la rebanada solamente y no dañar el tejido por debajo. No observamos diferencias entre los datos obtenidos en los OCC con cicatrices gliales con los de los OTCs sin cicatrices (datos no mostrados). - Retire el sector preparado de la plaquita. Para ello, utilice un bisturí estéril e extérelo haciendo cortes paralelos rectos a la membrana, formando un cuadrado o un triángulo con la rebanada en el centro, mientras sostiene los bordes de la membrana con pinzas. Si la plaquita aloja rebanadas adicionales, transfiérala de nuevo a la placa original y a la incubadora. La tensión superficial del medio evitará su fuga sobre la superficie de la membrana.
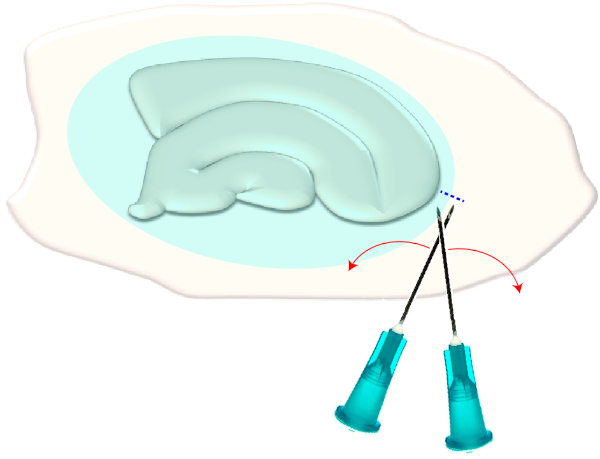
Figura 3: Ilustración esquemática de la eliminación mecánica de la cicatriz del glial. La figura muestra un cultivo de rebanada de hipocampo que está cubierto por una cicatriz glial (elipsoide azulado). Al cortar una vez las puntas de dos agujas de jeringa en el polo más pequeño del cultivo y en el borde de la cicatriz del glial (línea azul discontinua), la cicatriz se volverá a un lado. Haga clic aquí para ver una versión más grande de esta figura.
5. Imágenes ATP basadas en FRET (Figura 4)
- Antes del experimento, preparar E-ACSF y hacer burbujas con 95% O2/5% CO2 durante al menos 30 minutos para obtener un pH de 7.4. Encienda la fuente de luz fluorescente (lámpara de xenón) del monocromador(Figura 4). Comience la perfusión justo antes de sacar la rebanada de la incubadora.
NOTA: Mantenga la salina burbujeante con 95% O2 y 5% CO2 durante todo el experimento. - Transfiera la rebanada a una cámara experimental que se perfunde constantemente con E-ACSF recién carbogenado utilizando una bomba peristáltica(Figura 4). A continuación, fije el sector con una cuadrícula. Coloque la cámara en la etapa del microscopio y conecte el sistema de perfusión. Se recomienda un tubo de laboratorio a prueba de gas para perfusión.
NOTA: Los experimentos se pueden realizar a temperatura ambiente o cerca de la temperatura fisiológica, dependiendo del diseño experimental. Compruebe la estabilidad y fiabilidad del flujo de perfusión para evitar cambios de enfoque inducidos por el movimiento del tejido y/o cambios en la tensión de cizallamiento. Las velocidades de perfusión estándar para el trabajo de corte, utilizadas por nosotros y muchos otros laboratorios, son de 1,5-2,5 ml/min.
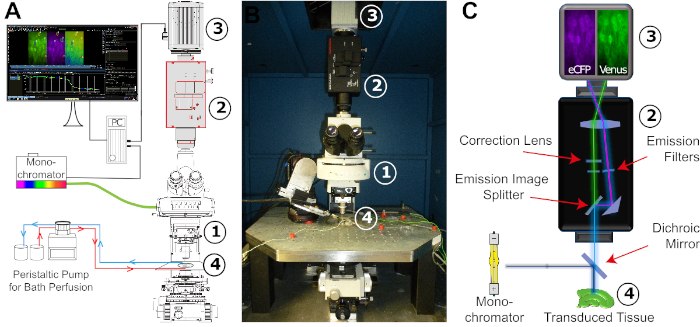
Figura 4: Configuración de la configuración de imágenes FRET. (A) Ilustración esquemática de los diferentes componentes y su disposición espacial necesaria para la configuración de imágenes FRET. La disposición consiste en un monocromónico con una lámpara de xenón como fuente de luz, un microscopio vertical de etapa fija (1), un sistema de divisor de imágenes (2), una cámara CCD o CMOS digital para la grabación de lapso de tiempo (3) y un baño experimental adaptado para perfusión constante estable (4). La perfusión del baño se realiza mediante una bomba peristáltica con caudal ajustable. (B) Imagen del espacio de trabajo experimental. La configuración de imágenes FRET está montada en una mesa amortiguada por vibraciones que lleva una etapa de traducción x/y, en la que se incrusta el baño experimental. Números: véase (A). (C) Vista esquemática de la vía de luz desde el monocromático hasta la cámara digital. Indicado es la posición de los diferentes filtros y el espejo dicoico. Números: véase (A). Haga clic aquí para ver una versión más grande de esta figura.
- Ponga la rebanada cultivada en el foco usando la luz de transmisión. Identificar el área donde se realizarán los experimentos (ejemplo: región CA1 del hipocampo). Antes de iniciar los experimentos de diagnóstico por imágenes, espere al menos 15 minutos para permitir que los sectores se adapten a las condiciones salinas. Para la configuración de la configuración experimental, vea la figura 4.
- Encienda la cámara y el software de imágenes. A continuación, seleccione el cubo de filtro adecuado.
- Emocione la proteína fluorescente del donante (eCFP) a 435/17 nm (435 nm). Ajuste el tiempo de exposición entre 40 y 90 ms.
NOTA: La fuerte exposición de las rodajas a la luz fluorescente puede dar lugar a efectos fototóxicos. - La excitación a 435 nm produce tanto a 475 nm (eCFP; donante) como a 527 nm (Venus; aceptador). Divida la emisión de fluorescencia a 500 nm con un divisor de imagen de emisión y utilice filtros de paso de banda en 483/32 y 542/27 para aislar aún más la fluorescencia del donante y del aceptador. Una expresión fuerte puede dar lugar a la saturación de los detectores. En este caso, puede utilizar un filtro de densidad neutra para reducir la intensidad de la excitación.
- Seleccione una región de interés (ROI) aparentemente desprovista de fluorescencia celular para la resta de fondo. A continuación, cree los IU que delicen los cuerpos celulares.
- Establezca la frecuencia de adquisición de la imagen y el tiempo de grabación general. Para experimentos largos (>30 min), se recomienda una frecuencia de adquisición de 0,2-0,5 Hz para prevenir la fototoxicidad.
- Inicie la grabación. Se recomienda registrar al menos 5 minutos en condiciones de referencia para garantizar la estabilidad de la preparación.
NOTA: Ajuste el enfoque de la celda durante la grabación si es necesario. - Para inducir cambios en el ATP intracelular, transfiera el tubo de perfusión del ACSF estándar a una salina que contenga inhibidores metabólicos (por ejemplo, CEI, ver Tabla 1 y siguientes). Alternativamente, utilice una solución salina con concentración elevada de potasio para imitar la liberación de potasio de las neuronas activas.
NOTA: La perfusión de aplicación por baño es un proceso relativamente lento, que actúa globalmente sobre toda la preparación. Tome nota de la hora en la que la nueva solución realmente comenzó a entrar en el baño experimental. Dependiendo de la distancia entre la cámara y el depósito de la salina, así como de la velocidad de la perfusión, se debe considerar un tiempo de retardo.
6. Documentación de alta resolución de fluorescencia celular de ATeam
- Directamente después de las grabaciones, transfiera la cámara de grabación que contiene el cultivo de la rebanada al microscopio de escaneo láser confocal.
NOTA: Ten especial cuidado. Debido a posibles fotodaños, realice este paso solo después de los experimentos. Para fines de documentación, se puede intercambiar el E-ACSF con H-ACSF. Por lo tanto, no es necesariamente necesario un sistema de perfusión. - Tome las pilas z con la resolución z más alta posible en la configuración óptica dada.
- Aplique un algoritmo de desconvolución para aumentar la resolución de la imagen.
Resultados
Los vectores AAV son una herramienta confiable para expresar selectivamente genes extraños en células dentro del tejido vivo16. La aplicación directa de AAVs que contienen el casete de secuencia de ATeam1.03YEMK y un promotor específico da como resultado una alta expresión del sensor en el tipo de celda elegido. En div 14 (10 días después de una transducción), las neuronas que expresan ATeam bajo el promotor de la sinapsina humana se encuentran a alta densidad en el neocórtex de rodajas de tejido cultivado a profundidades de hasta 50 m por debajo de la superficie de la rebanada(Figura 5A). Se pueden lograr resultados comparables en el hipocampo(Figura 5B).
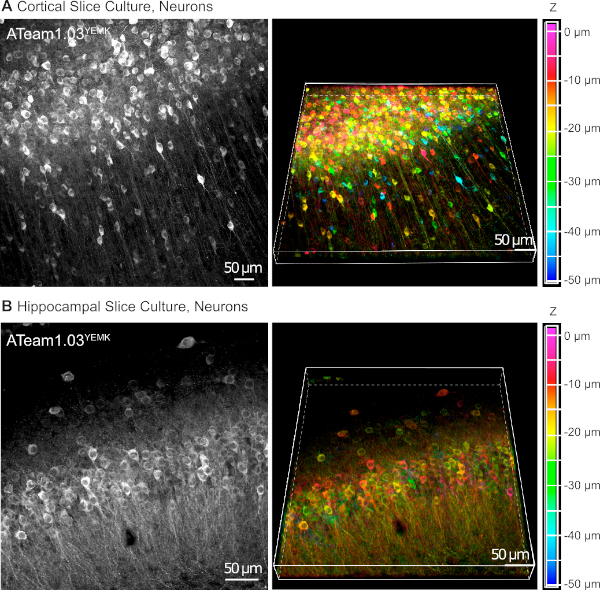
Figura 5: Visualización de neuronas que expresan ATeam1.03YEMK en rebanadas de cerebro organotípico parasagittal cultivado. Las imágenes de la izquierda corresponden a proyecciones de enfoque extendido de 43 secciones ópticas (1,05 m cada una) de tejido cortical (A) y (B) de 70 secciones ópticas (0,6 m cada una) de tejido hipocampal. Las imágenes de la derecha representan la vista de volumen de la misma proyección. Las celdas están codificadas por colores según su profundidad en relación con la superficie del sector, como indica la escala de color de la derecha. Haga clic aquí para ver una versión más grande de esta figura.
Para la medición de los niveles de ATP en astrocitos, ATeam1.03YEMK se expresa bajo el control del promotor de la proteína ácida fibrilar glial humana (GFAP). Esto resulta en la transducción eficiente de las células tanto en el neocórtex como en el hipocampo de las rebanadas de tejido cultivado(Figura 6). En particular, se pueden distinguir dos fenotipos morfológicos diferentes, dependiendo de la profundidad en relación con la superficie de las preparaciones de las rodajas. En la primera capa superficial, las células se caracterizan por procesos primarios gruesos que están dispuestos predominantemente en paralelo a la superficie. Estas células presentan dominios fuertemente superpuestos, creando una malla densa de astrocitos aparentemente reactivos (Figura 6). En capas más profundas (30-60 m de la superficie), los astrocitos transducidos exhiben procesos celulares finos que forman dominios en gran medida esféricos y su morfología se asemeja a la de los astrocitos in situ como se informó anteriormente19,20,21 ( Figura6). Para obtener una mejor transducción de astrocitos de capa más profunda, así como un mejor acceso óptico a estas capas más profundas, el tejido cicatricial glial se puede extraer como se describe en el paso 4.
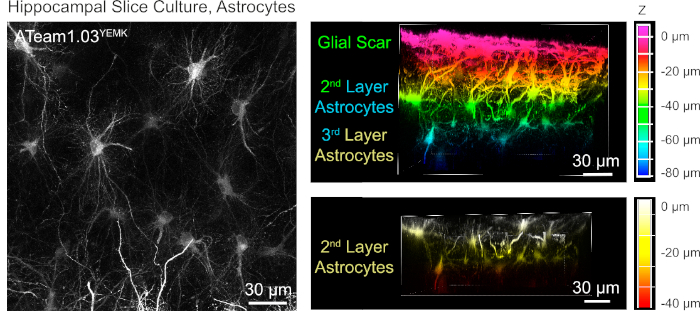
Figura 6: Visualización de astrocitos que expresan ATeam1.03YEMK en rebanadas de cerebro organotípicos parasagittales cultivados. La imagen de la izquierda corresponde a una proyección de enfoque extendido de 191 secciones ópticas (0,45 m cada una). A efectos ilustrativos, la cicatriz glial fue excluida de la proyección de los astrocitos. Las imágenes de la derecha representan la vista de volumen de la misma proyección antes y después de la eliminación de la cicatriz del glial. Las celdas están codificadas por colores según su profundidad en relación con la superficie del sector, como indican las escalas de color de la derecha. Haga clic aquí para ver una versión más grande de esta figura.
La expresión exitosa de ATeam1.03YEMK permite la medición dinámica de los cambios en los niveles de ATP en neuronas o astrocitos, dependiendo del promotor utilizado (ver arriba). Los experimentos se realizaron en un baño experimental constantemente perfundido con E-ACSF (burbuja con 95% O2/5% CO2). En las rebanadas organotípicas que expresan ATeam1.03YEMK en neuronas hipocampales, se seleccionaron regiones de interés (ROI) antes de iniciar el registro, representando los somatas de las células piramidales(Figura 7A). Además, se eligió una región para la resta de fondo(Figura 7A). La emisión de Venus, así como la fluorescencia eCFP, se recogió para cada uno de estos ROC por separado y se representó como nivel de emisión de fluorescencia a lo largo del tiempo(Figura 7B). Después de registrar la fluorescencia bajo condiciones de control durante varios minutos para asegurar una línea de base estable, el metabolismo celular se inhibió al exponer la preparación de la rebanada a una solución salina libre de glucosa, a la que se añadieron 5 mM de azida sódica (NaN3) durante un minuto(Figura 7B). Esta manipulación indujo cambios opuestos en la intensidad de emisión del par FRET(Figura 7B,paneles izquierdos), con una disminución de Venus (527 nm) y un aumento de la emisión de eCFP (475 nm). El cálculo de la relación FRET dividiendo la emisión de fluorescencia de Venus por la de eCFP (FVenus/FeCFP) dio lugar a señales que reflejan los cambios relativos en los niveles de ATP intracelular, la llamada "relación ATeam FRET"(Figura 7B,panel derecho). En todas las neuronas registradas (n a 70 células en n a 5 rebanadas), NaN3 causó una disminución reversible en la relación ATeam FRET, lo que indica una disminución reversible en los niveles de ATP intracelular tras la inhibición del metabolismo celular.
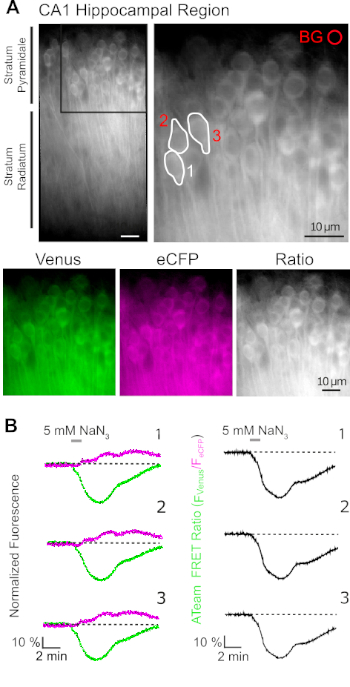
Figura 7: Demostración de la imagen de relación ATeam FRET de lapso de tiempo. (A) Arriba a la izquierda: Imagen de fluorescencia de campo ancho de la capa piramidal y radiatum de estrato de la región CA1 de una rebanada de hipocampo organotípico cultivado que expresa ATeam1.03YEMK en neuronas. Arriba a la derecha: Vista ampliada de la sección en caja como se indica a la izquierda. Las líneas blancas delinean las regiones de interés (ROI) 1-3 que representan los cuerpos celulares de las neuronas piramidales CA1 elegidas para el análisis en (B). BG representa el ROI elegido para la corrección de fondo. Parte inferior: Imágenes pseudocolores que representan la emisión de fluorescencia de Venus (verde), eCFP (púrpura) y la relación de Venus/eCFP. (B) Registro de lapso de tiempo en ROIs 1-3, que representa los cuerpos de células neuronales (ver A). Las trazas a la izquierda muestran la emisión normalizada de fluorescencia de Venus (verde) y eCFP (magenta). Las trazas de la derecha muestran la relación aTeam FRET correspondiente. Tenga en cuenta que la perfusión con 5 mM NaN3 en ausencia de glucosa extracelular durante 1 minuto (barra gris) induce una disminución reversible en la relación ATeam FRET, lo que indica una disminución en la concentración de ATP intracelular. Haga clic aquí para ver una versión más grande de esta figura.
Para garantizar la estabilidad de la preparación y el sensor en condiciones de experimento a largo plazo, las rebanadas que expresaban ATeam en neuronas o astrocitos se perfundieron constantemente con ACSF durante períodos prolongados (>50 min; n a 12 células cada una, N a 3 OTCs de 3 cerebros). En estas condiciones, la relación FRET de ATeam no cambió(Figura 8). La exposición de los preparados a la ISC que contienen inhibidores metabólicos ("Isquemia química", ver Tabla 1), en cambio, dio lugar de nuevo a la caída esperada en la relación ATeam FRET como se observó anteriormente.
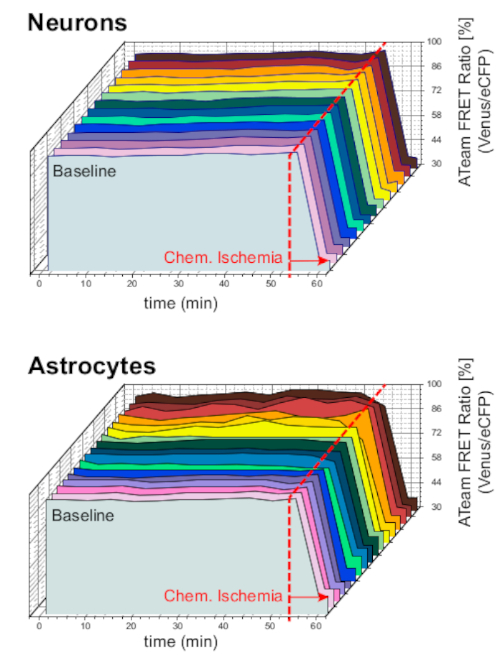
Figura 8: Experimentos de línea de base que emplean ATeam. Imágenes de relación FRET de ATeam a largo plazo en 14 células diferentes en condiciones basales en neuronas (arriba) y astrocitos (abajo). Los datos se tomaron en condiciones comparables que otros datos experimentales. Al final de cada medición, la isquemia química se produjo por perfusión con SCI, como indica la flecha. NOTA: Las relaciones asoFRET de línea de base son estables en el tiempo en condiciones de referencia. Haga clic aquí para ver una versión más grande de esta figura.
A continuación, analizamos las respuestas de las neuronas y astrocitos expresando ATeam1.03YEMK a un aumento en la concentración de potasio extracelular. Después de establecer una línea de base estable, las neuronas fueron perfundidas con una solución salina en la que la concentración de potasio se incrementó de 3 a 8 mM durante 3 minutos(Figura 9A). Sin embargo, esta manipulación no dio lugar a un cambio detectable en la relación FRET de ATeam (n a 56 celdas en n a 5 sectores). Para asegurarse de que el sensor reaccionó a un cambio en los niveles de ATP, las rebanadas fueron expuestas de nuevo a un período sostenido de isquemia química provocada por la sustitución de E-ACSF por CIS. La isquemia química dio lugar a una rápida disminución de la relación FRET de ATeam a un nivel nuevo y estable, lo que indica el agotamiento nominal de ATP después de 2-3 min(Figura 9A).
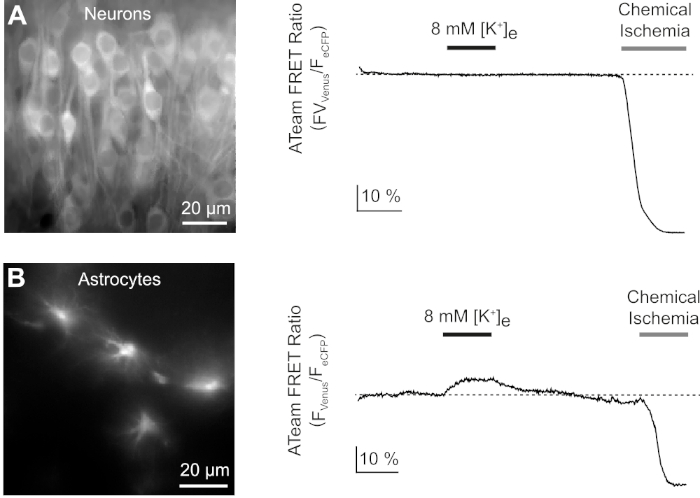
Figura 9: Experimentos representativos que ilustran los cambios en los niveles de ATP en neuronas y astrocitos. (A,B): Las imágenes de la izquierda muestran fluorescencia de ATeam de neuronas y astrocitos ubicados en la región del hipocampo CA1 de rodajas organotípicas. Las trazas de la derecha representan las grabaciones de lapso de tiempo de la relación ATeam FRET obtenidas a partir de un ROI posicionado sobre un solo cuerpo de celda. En ambos experimentos, las rodajas fueron sometidas por primera vez a un aumento en la concentración de potasio extracelular durante 3 minutos (ver barra), seguido de una exposición final a la isquemia química. Tenga en cuenta que mientras que las neuronas no responden a la elevación del potasio extracelular (A), los astrocitos reaccionan con un aumento en ATP (B). Haga clic aquí para ver una versión más grande de esta figura.
El mismo protocolo experimental se realizó con rebanadas, en las que ATeam1.03YEMK se expresaba en astrocitos. En contraste con lo observado en las neuronas, los astrocitos reaccionaron al aumento del potasio extracelular en un aumento reversible de la relación ATeam FRET, lo que indica un aumento en los niveles de ATP intracelular (n a 70 células en n a 5 rebanadas)(Figura 9B). La exposición posterior a la isquemia química dio lugar, como se esperaba, a una gran caída de la relación ATeam FRET, indicativa del agotamiento nominal del ATP intracelular(Figura 9B).
Discusión
Aquí, demostramos un procedimiento para la expresión específica de tipo celular de ATeam1.03YEMK, un nanosensor genéticamente codificado basado en FRET14,para la medición de cambios en los niveles de ATP en astrocitos o neuronas en cultivos de rebanadas de tejido organotípico del cerebro del ratón15. En grabaciones ejemplares, mostramos que un aumento en la concentración de potasio extracelular no resulta en un cambio en las concentraciones de ATP en las neuronas, mientras que los niveles astrocíticos de ATP aumentan en respuesta a esta manipulación. Además, nuestros resultados demuestran que tras la inhibición del metabolismo celular, la relación ATeam1.03YEMK FRET cae rápidamente en ambos tipos de células, lo que indica una rápida disminución del ATP intracelular.
La expresión de ATeam1.03YEMK en cultivos de rebanadas organotípicas requiere el mantenimiento del tejido en cultivo en condiciones controladas durante al menos 7-10 días. Alternativamente, ATeam1.03YEMK también se puede emplear para la medición de ATP en rebanadas de tejido cerebral agudamente aisladas y en nervios ópticos de ratones13,15. Las mediciones en tejidos agudamente aislados, sin embargo, requieren la generación de animales transgénicos o una aplicación estereotáctica de vectores virales en el cerebro, que implican experimentación animal y protocolos estrictos de cuidado animal. En este sentido, la expresión ATeam1.03YEMK en cultivos de rebanadas de tejido organotípico representa una alternativa útil y valiosa22,23. Desde hace muchos años, los cultivos de rebanadas de tejido organotípico sirven como un sistema modelo establecido para estudiar las propiedades neuronales, conectividad y desarrollo24,25,26. No sólo mantienen la arquitectura general del tejido y la laminación(Figura 1),sino que también albergan las propiedades preferenciales de los cultivos celulares, como la accesibilidad superior y el control directo de las condiciones experimentales. Los cultivos de rebanadas de tejido organotípico también se emplean rutinariamente para expresar genes extraños mediante el uso de vectores virales27. Se han notificado varios tipos de vectores virales para suministrar transgenes en el tejido cerebral16,28. Los vectores adenovirales inducen una alta expresión en las células gliales, pero no en las neuronas del hipocampo16,y podrían generar reactividad del glial17. Los vectores virales asociados a los adenos como se utilizan aquí emergen como una buena alternativa15,y su eficacia también se ha demostrado in vivo29.
Aunque se utiliza principalmente para el estudio de las propiedades neuronales, estudios recientes han establecido que los cultivos de rebanadas de tejido organotípico también se pueden emplear para el análisis de astrocitos. Las rodajas cultivadas suelen estar cubiertas por una capa de astrocitos reactivos19,30 (Figura 5), pero los astrocitos exhiben una morfología y citoarquitectura más nativas y no reactivas en capas más profundas19,30 (Figura 5). En el presente estudio, describimos un procedimiento para la eliminación mecánica de la cicatriz del glial exterior, lo que resulta en una mejor accesibilidad experimental y óptica de los astrocitos nativos dentro de las capas de tejido organotípico adecuadas. Además, su eliminación mejora la eficacia de la expresión en capas más profundas de las rebanadas organotípicas; si no se elimina la cicatriz del glial, la transducción por AAV podría tender a limitarse a las capas celulares superficiales.
Varios factores mecánicos externos deben tenerse en cuenta al realizar experimentos en rebanadas de tejido. Una variación en la velocidad de perfusión del baño puede inducir movimientos de toda la preparación y/o inducir cambios en el enfoque, lo que resulta en cambios transitorios artificiales de la señal del sensor. Además, tanto los astrocitos como las neuronas han sido reportados para responder a la deformación mecánica como impuesta por altas tasas de perfusión32,33. En nuestras manos, el uso de una bomba peristáltica fiable, junto con el mantenimiento de volúmenes pequeños y estables de solución salina entre el tejido y el objetivo (menisco) resulta en una señal FRET estable en condiciones basales a la velocidad de perfusión utilizada aquí (1,5-2,5 ml/min; Figura 8).
En el presente estudio, también demostramos que las imágenes basadas en FRET con ATeam1.03YEMK se pueden emplear para monitorear los niveles de ATP en neuronas y astrocitos. Un medio alternativo introducido anteriormente para la medición de ATP celular es el llamado ensayo luciferina-luciferasa34,35,36,37. Este enfoque, sin embargo, se basa en imágenes de bioluminiscencia y sólo proporciona una resolución temporal y espacial bastante baja en parte debido a los altos niveles de ruido de fondo. Otro método empleado rutinariamente en los últimos años fue la toma de imágenes de los cambios en la concentración de magnesio intracelular utilizando el verde magnesio fluoróforo sensible al ion38,39,40. Este enfoque se relaciona con la observación de que un consumo de ATP resulta en la liberación de su magnesio cofactor. Por lo que las imágenes con verde magnesio sólo proporcionan una estimación secundaria de los cambios en los niveles de ATP. Además, el verde magnesio también es sensible a los cambios en el calcio intracelular, introduciendo otra dificultad a la hora de interpretar los resultados obtenidos con este método.
El reciente desarrollo de nanosensores codificados genéticamente para la toma directa de imágenes de metabolitos celulares, por lo tanto, representó un gran paso adelante11,12. Se generaron varios sensores diferentes que se pueden emplear para la medición de ATP intracelular36,41,42,43. Entre ellos se encuentran el indicador de ATP fluorescente ratiométrico "QUEEN"41 así como PercevalHR, que detecta la relación ATP:ADP42. Si bien esta última sonda es una herramienta valiosa para el estudio del estado energético de las células, requiere la medición simultánea de los cambios en el pH42.
ATeam es un nanosensor del que existen varias variantes, que, entre otras, difieren en su afinidad vinculante con ATP14. In vitro, ATeam1.03YEMK exhibe una Kd de 1,2 mM a 37 oC, que está cerca de los niveles de ATP celular determinados en diferentes tipos de células neuronales, que van desde el hipotálamo y el cerebelo34 hasta el hipocampo37,44,45. En las mediciones de la cubeta, la reducción de la temperatura en 10 oC dio lugar a una disminución significativa en la afinidad de unión de ATeam1.03YEMK a ATP, lo que sugiere que podría no ser ideal para imágenes celulares a temperatura ambiente14. Nuestro estudio anterior15, sin embargo, demostró que el comportamiento y la respuesta de ATeam1.03YEMK expresado en neuronas y astrocitos a diferentes manipulaciones es similar en casi fisiológica y a temperatura ambiente, lo que indica que el sensor permite la determinación confiable de los niveles de ATP intracelular en ambas condiciones. Además, nuestros experimentos anteriores abordaron la sensibilidad al pH de ATeam1.03YEMK expresada dentro de las células15,mostrando que es insensible a los cambios en el pH intracelular en aproximadamente 0.1-0.2 unidades de pH. Si la Kd en el rango de mM bajo es una preocupación, las variantes alternativas de ATeam podrían utilizarse14, entre ellas variantes de cambio rojo de ATeam ("GO-ATeam")43.
Nuestros experimentos con ATeam1.03YEMK demuestran que un aumento en la concentración de potasio extracelular solo en unos pocos mM (de 3 a 8 mM) resulta en un aumento transitorio en la relación ATeam1.03YEMK en astrocitos en el cultivo de rebanadas organotípicas. Esta observación confirma estudios anteriores15,46 e indica claramente que los astrocitos responden a la liberación de potasio por las neuronas activas con un aumento en su producción de ATP, probablemente como consecuencia de una estimulación del Na+/K+-ATPase y el Na+/HCO3- cotransportador, respectivamente47,48. En contraste con esto, las neuronas no mostraron una respuesta, que está en línea con el trabajo anterior, así15. Ambos tipos de células, sin embargo, reaccionaron rápida y fuertemente a la inhibición de la glucólisis celular y la respiración mitocondrial como se muestra antes de15. En condiciones de isquemia química, las relaciones FRET de ATeam cayeron a un nuevo nivel estable, lo que indica un agotamiento nominal de ATP celular. Este último resultado sugiere que tanto las neuronas como los astrocitos exhiben un consumo relevante de ATP también en condiciones de estado estacionario sin estimulación adicional por activación sináptica o aplicación de neurotransmisores. En conjunto, llegamos a la conclusión de que las imágenes basadas en FRET con nanosensores codificados genéticamente, entre ellos ATeam1.03YEMK,proporcionarán un enfoque valioso para dilucidar los procesos celulares que son responsables de los cambios en los niveles de ATP intracelular y el consumo de ATP celular en diferentes condiciones.
Divulgaciones
Los autores no declaran intereses en competencia. Los autores recibieron apoyo financiero que permite la publicación de acceso abierto por Nikon Microscope Solutions, Dusseldorf, Alemania, que produce instrumentos utilizados en el artículo de vídeo. La compañía no participó en el diseño de los experimentos presentados aquí, ni en su ejecución, ni en el manejo de datos, ni en la escritura manuscrita.
Agradecimientos
Los autores desean agradecer a Claudia Roderigo y Simone Durry por su asistencia técnica experta. Agradecemos al Dr. Niklas J. Gerkau y al M.Sc. Joel Nelson por su asistencia en la preparación de las culturas de las rebanadas organotípicas. La investigación en el laboratorio del autor fue financiada por la Asociación Alemana de Investigación (DFG; PARA 2795: Ro 2327/13-1 y SPP 1757: Ro 2327/8-2 a CRR; y SPP 1757: Financiación de Young Glia Start-Up a RL).
Materiales
| Name | Company | Catalog Number | Comments |
| 2-deoxyglucose | Alfa Aesar | L07338 | Non-metabolizable glucose analog |
| 36-IMA-410-019 Argon laser | Melles Griot | 488 nm wavelength argon | |
| Ascorbic acid | Carl Roth | 3525.1 | Antioxidant, Vitamin C |
| band pass filters 483/32 | AHF Analysentechnik AG | Splitter compatible emmision filter | |
| band pass filters 542/27 | AHF Analysentechnik AG | Splitter compatible emmision filter | |
| Beamsplitter T 455 LP | AHF Analysentechnik AG | Excitation dichroic mirror | |
| Beamsplitter T 505 LPXR | AHF Analysentechnik AG | Splitter dichroic | |
| Confocal laser scannig microscope C1 | Nikon Microscope Solutions | Modular confocal microscope system C1 | |
| Data processing Origin Pro 9.0.0 (64-bit) | OriginLab corporation | Scientific graphing and data analysis software | |
| D-glucose monohydrate | Caelo | 2580-1kg | |
| DPBS | GIBCO/Life | 14190250 | Dulbecco's phosphate-buffered saline |
| Eclipse E 600FN upright microscope | Nikon Microscope Solutions | ||
| Eclipse FN1 upright microscope | Nikon Microscope Solutions | ||
| Experimental chamber | custom build | Perfusion chamber for live-cell imaging | |
| EZ-C1 Silver Version 3.91 | Nikon Microscope Solutions | Imaging software for confocal microscope | |
| Hanks' Balanced Salt solution | Sigma-Aldrich | H9394 | With Phenol Red for pH monitoring |
| HERAcell 150 | Thermo Scientific | CO2 incubator HERAcell ® 150 with decontamination routine | |
| HERAsafe KS/KSP | Thermo Scientific | Safety Cabinet | |
| Horse serum | GIBCO/Life | 26050088 | Heat inactivated |
| Huygens Professional | SVI Imaging | Deconvolution software | |
| Image J 1.52i | Wayne Rasban national Institute of Health | Image processing Software available in the public domain | |
| Insulin | Sigma-Aldrich | I6634 | Insulin from bovine pancreas |
| IP serie peristaltic pump | Ismatec | High-precisionmulti-channel pump | |
| Layout software, Illustrator CS6 | Adobe | Vector graphics editor | |
| L-glutamine | GIBCO/Life | 25030024 | |
| Microm HM 650 V | Thermo Scientific | Vibration microtome. Thermo scientific discontinued the production of the device in the meantime. Any other slicer or tissue chopper siutable for slicing living tissue is fine, too. | |
| Microscope stage | custom build | ||
| Microsoft Excel 16 | Microsoft | Spreadsheet software for basic data processing | |
| Millicell culture insert | Merck Millipore | PICM0RG50 | Hydrophilized PTFE, pore size 0.4 μm |
| Minimum Essential Medium Eagle | Sigma-Aldrich | M7278 | Synthetic cell culture media |
| Monochromator Polychrome V | Thermo Scientific/FEI | Ultra fast switching monochromator | |
| NaN3 (Sodium Azide) | Sigma-Aldrich | S-8032 | Mitochondrial inhibitor (complex IV inhibitor). CAUTION: Azide is toxic. Be aware not to accidentally ingest or inhale it, and prevent ist absoption through the skin. |
| Nikon Fluor 40x / 0.80 W DIC M ∞/0 WD 2.0 | Nikon Microscope Solutions | Water Immersion Microscope Objective | |
| NIS Elements 4.50 advanced Research | Nikon Microscope Solutions | Imaging software. Upgraded version for FRET imaging | |
| ORCA-Flash4.0 | Hamamatsu Photonics | Digital CMOS camera | |
| Perfusion tubing | Pro Liquid GmbH | Tygon tubing, 1.52 x 322 mm (Wd: 0.85) | |
| Photoshop CS 6 Version 13.0 | Adobe | Image processing software | |
| Sodium L-lactate | Sigma-Aldrich | 71718-10G | |
| ssAAV-2/2-hSyn1-ATeam1.03YEMK-WPRE-hGHp(A) | ETH Zürich | v244 | Single-stranded AAV vector that induces the expression of ATeam1.03YEMK under the control of the human synapsin 1 promoter fragment hSyn1. |
| ssAAV-5/2-hGFAP-hHBbI/E-ATeam1.03YEMK-WPRE-bGHp(A) | ETH Zürich | v307 | Single-stranded AAV vector that induces the expression of ATeam1.03YEMK under the control of the human glial fibrillary acidic protein promoter fragment ABC1D. |
| WVIEW GEMINI optic system | Hamamatsu Photonics | Emission Image Splitter |
Referencias
- Sweadner, K. J. Isozymes of the Na+/K+-ATPase. Biochimica et Biophysica Acta. 988, 185-220 (1989).
- Clapham, D. E. Calcium signaling. Cell. 131, 1047-1058 (2007).
- Cotter, K., Stransky, L., McGuire, C., Forgac, M. Recent Insights into the Structure, Regulation, and Function of the V-ATPases. Trends in Biochemical Sciences. 40, 611-622 (2015).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75, 762-777 (2012).
- Brown, A. M., Ransom, B. R. Astrocyte glycogen and brain energy metabolism. Glia. 55, 1263-1271 (2007).
- Hertz, L., et al. Roles of astrocytic Na+,K+-ATPase and glycogenolysis for K+ homeostasis in mammalian brain. Journal of Neuroscience Research. 93, 1019-1030 (2015).
- Allaman, I., Belanger, M., Magistretti, P. J. Astrocyte-neuron metabolic relationships: For better and for worse. Trends in Neurosciences. 34, 76-87 (2011).
- Barros, L. F., Deitmer, J. W. Glucose and lactate supply to the synapse. Brain Research Reviews. 63, 149-159 (2010).
- Diaz-Garcia, C. M., et al. Neuronal Stimulation Triggers Neuronal Glycolysis and Not Lactate Uptake. Cell Metabolism. 26, 361-374 (2017).
- Diaz-Garcia, C. M., et al. Quantitative in vivo imaging of neuronal glucose concentrations with a genetically encoded fluorescence lifetime sensor. Journal of Neuroscience Research. 97, 946-960 (2019).
- Barros, L. F., et al. Current technical approaches to brain energy metabolism. Glia. 66, 1138-1159 (2018).
- Tantama, M., Hung, Y. P., Yellen, G. Optogenetic reporters: Fluorescent protein-based genetically encoded indicators of signaling and metabolism in the brain. Progress in Brain Research. 196, 235-263 (2012).
- Trevisiol, A., et al. Monitoring ATP dynamics in electrically active white matter tracts. eLife. 6, e24241(2017).
- Imamura, H., et al. Visualization of ATP levels inside single living cells with fluorescence resonance energy transfer-based genetically encoded indicators. Proceedings of the National Academy of Sciences of the United States of America. 106, 15651-15656 (2009).
- Lerchundi, R., et al. FRET-based imaging of intracellular ATP in organotypic brain slices. Journal of Neuroscience Research. , 1-13 (2018).
- Ehrengruber, M. U., et al. Gene transfer into neurons from hippocampal slices: comparison of recombinant Semliki Forest Virus, adenovirus, adeno-associated virus, lentivirus, and measles virus. Molecular and Cellular Neurosciences. 17, 855-871 (2001).
- Woo, J., et al. Functional Characterization of Resting and Adenovirus-Induced Reactive Astrocytes in Three-Dimensional Culture. Experimental Neurobiology. 26, 158-167 (2017).
- Close, B., et al. Recommendations for euthanasia of experimental animals: Part 2. DGXT of the European Commission. Laboratory Animals. 31, 1-32 (1997).
- Benediktsson, A. M., Schachtele, S. J., Green, S. H., Dailey, M. E. Ballistic labeling and dynamic imaging of astrocytes in organotypic hippocampal slice cultures. Journal of Neuroscience Methods. 141, 41-53 (2005).
- Lanjakornsiripan, D., et al. Layer-specific morphological and molecular differences in neocortical astrocytes and their dependence on neuronal layers. Nature Communications. 9, 1623(2018).
- Bushong, E. A., Martone, M. E., Ellisman, M. H. Examination of the relationship between astrocyte morphology and laminar boundaries in the molecular layer of adult dentate gyrus. The Journal of Comparative Neurology. 462, 241-251 (2003).
- Frotscher, M., Zafirov, S., Heimrich, B. Development of identified neuronal types and of specific synaptic connections in slice cultures of rat hippocampus. Progress in Neurobiology. 45, vii-xxviii (1995).
- Galimberti, I., et al. Long-term rearrangements of hippocampal mossy fiber terminal connectivity in the adult regulated by experience. Neuron. 50, 749-763 (2006).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37, 173-182 (1991).
- Forster, E., Zhao, S., Frotscher, M. Laminating the hippocampus. Nature Reviews. Neuroscience. 7, 259-267 (2006).
- Holopainen, I. E. Organotypic Hippocampal Slice Cultures: A Model System to Study Basic Cellular and Molecular Mechanisms of Neuronal Cell Death, Neuroprotection, and Synaptic Plasticity. Neurochemical Research. 30, 1521-1528 (2005).
- Teschemacher, A. G., et al. Targeting specific neuronal populations using adeno- and lentiviral vectors: applications for imaging and studies of cell function. Experimental Physiology. 90, 61-69 (2005).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Advances in Genetics. 87, 125-197 (2014).
- Mächler, P., et al. In Vivo Evidence for a Lactate Gradient from Astrocytes to Neurons. Cell Metabolism. 23, 94-102 (2016).
- Schreiner, A. E., Berlinger, E., Langer, J., Kafitz, K. W., Rose, C. R. Lesion-Induced Alterations in Astrocyte Glutamate Transporter Expression and Function in the Hippocampus. ISRN Neurology. 2013, 893605(2013).
- Haber, M., Zhou, L., Murai, K. K. Cooperative astrocyte and dendritic spine dynamics at hippocampal excitatory synapses. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 26, 8881-8891 (2006).
- Neary, J. T., Kang, Y., Tran, M., Feld, J. Traumatic injury activates protein kinase B/Akt in cultured astrocytes: role of extracellular ATP and P2 purinergic receptors. Journal of Neurotrauma. 22, 491-500 (2005).
- Xia, J., et al. Neurons respond directly to mechanical deformation with pannexin-mediated ATP release and autostimulation of P2X7 receptors. The Journal of Physiology. 590, 2285-2304 (2012).
- Ainscow, E. K., Mirshamsi, S., Tang, T., Ashford, M. L., Rutter, G. A. Dynamic imaging of free cytosolic ATP concentration during fuel sensing by rat hypothalamic neurones: evidence for ATP-independent control of ATP-sensitive K+ channels. The Journal of Physiology. 544, 429-445 (2002).
- Arcuino, G., et al. Intercellular calcium signaling mediated by point-source burst release of ATP. Proceedings of the National Academy of Sciences of the United States of America. 99, 9840-9845 (2002).
- Rajendran, M., Dane, E., Conley, J., Tantama, M. Imaging Adenosine Triphosphate (ATP). The Biological Bulletin. 231, 73-84 (2016).
- Rangaraju, V., Calloway, N., Ryan, T. A. Activity-driven local ATP synthesis is required for synaptic function. Cell. 156, 825-835 (2014).
- Chatton, J. Y., Pellerin, L., Magistretti, P. J. GABA uptake into astrocytes is not associated with significant metabolic cost: implications for brain imaging of inhibitory transmission. Proceedings of the National Academy of Sciences of the United States of America. 100, 12456-12461 (2003).
- Magistretti, P. J., Chatton, J. Y. Relationship between L-glutamate-regulated intracellular Na+ dynamics and ATP hydrolysis in astrocytes. Journal of Neural Transmission (Vienna). 112, 77-85 (2005).
- Langer, J., et al. Rapid sodium signaling couples glutamate uptake to breakdown of ATP in perivascular astrocyte endfeet. Glia. 65, 293-308 (2017).
- Yaginuma, H., et al. Diversity in ATP concentrations in a single bacterial cell population revealed by quantitative single-cell imaging. Scientific Reports. 4, 6522(2014).
- Tantama, M., Martinez-Francois, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nature Communications. 4, 2550(2013).
- Nakano, M., Imamura, H., Nagai, T., Noji, H. Ca2+ Regulation of Mitochondrial ATP Synthesis Visualized at the Single Cell Level. ACS Chemical Biology. 6, 709-715 (2011).
- Mollajew, R., Toloe, J., Mironov, S. L. Single KATP channel opening in response to stimulation of AMPA/kainate receptors is mediated by Na+ accumulation and submembrane ATP and ADP changes. The Journal of Physiology. 591, 2593-2609 (2013).
- Pathak, D., et al. The Role of Mitochondrially Derived ATP in Synaptic Vesicle Recycling. The Journal of Biological Chemistry. 290, 22325-22336 (2015).
- Karus, C., Mondragao, M. A., Ziemens, D., Rose, C. R. Astrocytes restrict discharge duration and neuronal sodium loads during recurrent network activity. Glia. 63, 936-957 (2015).
- Larsen, B. R., Stoica, A., MacAulay, N. Managing Brain Extracellular K+ during Neuronal Activity: The Physiological Role of the Na+/K+-ATPase Subunit Isoforms. Frontiers in Physiology. 7, 141(2016).
- Ruminot, I., et al. NBCe1 mediates the acute stimulation of astrocytic glycolysis by extracellular K+. The Journal of Neuroscience : The Official Journal of the Society for Neuroscience. 31, 14264-14271 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados