Method Article
Imaging di ATP intracellulare in fette di tessuto organicino del cervello del topo utilizzando il sensore basato su FRET ATeam1.03YEMK
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo un protocollo per l'espressione specifica del tipo di cellula del sensore basato su FRET codificato geneticamente ATeam1.03YEMK nelle colture di sezioni organotipiche del prosencefalo del topo. Inoltre, mostriamo come utilizzare questo sensore per l'imaging dinamico dei livelli di ATP cellulare in neuroni e astrociti.
Abstract
L'attività neuronale nel sistema nervoso centrale (CNS) evoca un'elevata domanda di energia cellulare fornita dalla rottura del triposfato di adenosina (ATP). Una grande quota di ATP è necessaria per reinstallare gradienti di ioni attraverso le membrane plasmatiche degradate dalla segnalazione elettrica dei neuroni. Ci sono prove che gli astrociti - pur non generando segnali elettrici veloci stessi - subiscono una maggiore produzione di ATP in risposta all'attività neuronale e supportano i neuroni attivi fornendo metaboliti energetici a loro. Il recente sviluppo di sensori geneticamente codificati per diversi metaboliti ora consente lo studio di tali interazioni metaboliche tra neuroni e astrociti. Qui, descriviamo un protocollo per l'espressione specifica di tipo cellulare del sensore DI fluorescenza sensibile all'ATP (FRET-) ATeam1.03YEMK nelle colture di sezioni di tessuto organotipico dell'ippocampo e della corteccia di topo utilizzando vettori virali associati ad adeno (AAV). Inoltre, dimostriamo come questo sensore può essere impiegato per la misurazione dinamica dei cambiamenti nei livelli di ATP cellulare nei neuroni e negli astrociti in seguito agli aumenti di potassio extracellulare e all'induzione di ischemia chimica (cioè, un'inibizione del metabolismo dell'energia cellulare).
Introduzione
L'attività elettrica eccitatoria dei neuroni si basa in gran parte sul flusso di cazioni come il sodio(Na) e il potassio(K) attraverso le loro membrane plasmatiche. Per la segnalazione è quindi necessaria la manutenzione dei gradienti elettrochimici di questi due ioni. Ciò è possibile da parte della cellula Na,/K-ATPase (NKA), una pompa transmembrana elettrogenica ampiamente espressa, che estrude 3Na , fuori dalla cellula in cambio di 2K , dallo spazio extracellulare, che richiede il consumo di una molecola di ATP per ciclo di trasporto1. Oltre all'NKA, ci sono diversi altri trasportatori di ioni che consumano ATP, tra cui la membrana plasmatica Ca2 ,ATPase, che è vitale per l'omeostasi intracellulare Ca2 e la sua esportazione a seguito dell'afflusso indotto dall'attività2. Nelle vesciche presynaptiche, un vacuolar-tipo H-ATPase(v-ATPase) crea il gradiente protone necessario per l'assorbimento del neurotrasmettitore in questo compartimento3.
Mentre l'attività dei neuroni richiede quindi una notevole quantità di ATP4, essi non presentano una capacità significativa per lo stoccaggio di energia. Invece, sembrano fare affidamento sulle interazioni metaboliche con gli astrociti vicini, i principali depositi di glicogeno nel cervello5. È stato suggerito che il glicogeno astrocitico svolge effettivamente un ruolo importante nel sostenere il fabbisogno di energia neuronale; e un fenomeno chiave in questo accoppiamento neuro-metabolico proposto tra i due tipi di cellule è la capacità degli astrociti di aumentare la loro produzione di ATP in risposta all'attività neuronale6,7,8. Questa ipotesi, conosciuta come astrocito-neurone lattato shuttle (ANLS), è ancora in discussione, perché altri lavori hanno fornito prove che i neuroni possono anche aumentare il proprio tasso di glicolisi in risposta alla stimolazione9,10, riflettendo la necessità di ulteriori metodi e approcci per studiare l'interazione neuro-glia.
Lo studio del metabolismo dell'energia cellulare e dei livelli di ATP nei neuroni e negli astrociti per chiarire le interazioni metaboliche neuro-glia è stato a lungo ostacolato dalla mancanza di sonde adatte per il rilevamento dei cambiamenti nelle concentrazioni di metaboliti nelle cellule viventi nel tessuto cerebrale. L'ultimo decennio, tuttavia, ha fornito un aumento nello sviluppo di nuovi strumenti e nuove sonde fluorescenti geneticamente codificate per diversi metaboliti, tra cui sensori per ATP, lattato, pirattae e altri11,12. Utilizzando questi strumenti, è ora possibile affrontare direttamente le questioni relative al consumo di ATP cellulare e ai cambiamenti nei livelli di energia cellulare a livello di singola cellula e in modo specifico di tipo cellulare nel tessuto cerebrale intatto13.
Nel lavoro attuale, descriviamo una procedura per visualizzare le dinamiche ATP citosoliche su neuroni e astrociti di fette di cervello organotipiche coltivate. Mostriamo come utilizzare vettori virali associati ad eno (AAV) per l'espressione specifica di tipo cellulare del geneticamente codificato ATP-nanosensor ATeam1.03YEMK (14) in neuroni e astrociti di fette di cervello di topo che possono essere mantenuti nella coltura cellulare per diverse settimane15. Viene descritta una procedura su come rimuovere la cicatrice gliali che copre le fette di tessuto coltivato, che migliora l'accessibilità ottica e l'imaging delle cellule negli strati del tessuto organotipipico sottostanti. Infine, viene illustrato come ATeam1.03YEMK può essere utilizzato per eseguire l'imaging basato su FRET dei cambiamenti nei livelli di ATP cellulare in questa preparazione. Questo metodo ospita i principali vantaggi che non richiede procedure chirurgiche del cervello, fornisce alti livelli di espressione del sensore e della specificità del tipo di cellula nelle fette cerebrali coltivate, riducendo l'invasività o lo stress nelle cellule rispetto ad altri metodi, come la trasfezione per elettroporazione o la trasduzione con altri vettori virali10,16,17. Inoltre, questo protocollo può essere applicato ad altri nanosensori basati su FRET, tra cui varianti di ATeam1.03 che forniscono una minore affinità di legame per ATP14.
Protocollo
Il presente studio è stato condotto in stretta conformità con gli orientamenti istituzionali dell'Università di Heinrich Heine di Dusseldorf e della direttiva del Consiglio della Comunità europea (2010/63/UE). Tutti gli esperimenti che utilizzano colture organotipiche di fette di cervello sono stati comunicati e approvati dall'Ufficio per il benessere degli animali presso l'Animal Care and Use Facility dell'Università di Heine di Heinrich (numero di atto istituzionale: O50/05). Conformemente alle raccomandazioni della Commissione europea18,animali fino a 10 giorni di età sono stati uccisi per decapitazione.
1. Preparazione delle colture di fette di cervello organotipiche (OTC)
- Il giorno prima o almeno 30 minuti prima della procedura
- Preparare il piatto Petri (in condizioni sterili). Rimuovere il coperchio della piastra 6 e mettere 800-850 L di mezzo OTC in ogni pozzo. Tenere la piastra nell'incubatrice (37 gradi centigradi, 5% CO2/95% O2) fino a quando richiesto.
- Preparare i piatti Petri di lavaggio (in condizioni sterili). Aggiungere 3 mL di HBSS ad ogni piatto Petri di 30 mm. È richiesto un totale di 5 piatti per procedura. Metteteli nell'incubatrice (37 gradi centigradi, 5% CO2/95% O2) per almeno 30 min - fino a quando richiesto.
- Preparare l'ACSF (Tabella 1). Mantenere la salina senza glucosio a 4 gradi centigradi fino al giorno successivo.
| Salines e media - Formulazione | ||||
| Nome | Abbreviazione | Composizione | Concentrazione [mM] | Commenti |
| Soluzione di liquido cerebrospinale artificiale | ACSF | Nacl | 125 | Bollato con 5% CO2/95% O2, pH 7.4 |
| Kcl | 2.5 | Aggiungere sempre il glucosio prima dell'uso. | ||
| CaCl2 | 2 | Non conservare per più di un giorno con glucosio | ||
| MgCl2 | 1 | 310 mOsm/L | ||
| NaH2PO4 | 1.25 | |||
| NaHCO3 | 26 | |||
| Glucosio | 20 | |||
| Sperimentale ACSF | E-ACSF | Nacl | 136 | Bollato con 5% CO2/95% O2, pH 7.4 |
| Kcl | 3 | Aggiungere sempre il glucosio prima dell'uso. | ||
| CaCl2 | 2 | Non conservare per più di un giorno con glucosio | ||
| MgCl2 | 1 | 320 mOsm/L | ||
| NaH2PO4 | 1.25 | |||
| NaHCO3 | 24 | |||
| Glucosio | 5 | |||
| Lattato | 1 | |||
| Soluzione Ischemia chimica | Cis | Nacl | 136 | Bollato con 5% CO2/95% O2, pH 7.4 |
| Kcl | 3 | 318 mOsm/L | ||
| CaCl2 | 2 | |||
| MgCl2 | 1 | |||
| NaH2PO4 | 1.25 | |||
| NaHCO3 | 24 | |||
| 2, 2-Deoxyglucose | 2 | |||
| NaN3 | 5 | |||
| 8 mM di potassio ACSF | 8 mM K- ACSF | Nacl | 128 | Bollato con 5% CO2/95% O2, pH 7.4 |
| Kcl | 8 | 320 mOsm/L | ||
| CaCl2 | 2 | |||
| MgCl2 | 1 | |||
| NaH2PO4 | 1.25 | |||
| NaHCO3 | 24 | |||
| Glucosio | 5 | |||
| Lattato | 1 | |||
| ACSF con buffer di epes | H-ACSF | Nacl | 125 | Regolato a pH 7.4 con NaOH |
| Kcl | 3 | Aggiungere sempre il glucosio prima dell'uso | ||
| CaCl2 | 2 | Non conservare per più di un giorno con glucosio | ||
| MGSO4 | 2 | 310 mOsm/L (regolato con saccarosio) | ||
| NaH2PO4 | 125 | |||
| Evase | 25 | |||
| Glucosio | 10 | |||
| Hanks' Balanced Salt Solution | HBSS | Sigma (numero di catalogo H9394). | ||
| Saline con buffer di fosfato di Dulbecco | I DDB | Gibco (numero di catalogo 14287-080) | ||
| Mezzo di cultura organotipica | Media OTC | siero di cavallo inattivato dal calore | 20% | 34oC, 5 % CO2, pH 7,4, in condizioni di coltura |
| Mem | 79% | 320 mOsm/L | ||
| L-glutamina | 1 | |||
| Insulina | 0,01 mg/mL | |||
| Nacl | 14.5 | |||
| MGSO4 | 2 | |||
| CaCl2 | 1.44 | |||
| Acido ascorbico | 0.00125 % | |||
| D-glucosio | 13 |
Tabella 1: composizione della soluzione.
- Il giorno della preparazione, aggiungere il glucosio all'ACSF, posizionarlo sul ghiaccio e iniziare a spumeggiare con 95% O2/5% CO2 per almeno 30 min per provocare un pH di 7.4.
- Dissezione e affettatura
- Sacrificare il topo (BalbC, entrambi i sessi) nei giorni postnatali 6 a 8 con una rapida decapitazione e posizionare la testa in un piatto di vetro Petri contenente ACSF ghiacciato.
- Esponi il cranio tagliando la pelle dalla schiena fino alla punta posteriore dell'osso nasale. Quindi, tagliare con attenzione il cranio dal forame magnum utilizzando una forbice chirurgica ed esporre il cervello.
NOT: Verificare che la procedura sia conforme alle linee guida dell'istituzione. - Rimuovere il cervello e posizionarlo su una membrana filtrante in un piatto Petri ghiacciato riempito con ACSF.
- Separare gli emisferi ed eseguire un taglio parasagittale con un angolo di 45 gradi. Fissare un emisfero allo stadio del tessuto vibratoma con supercolla. Trasferire immediatamente il blocco di tessuto al bagno vibratoma contenente ACSF ghiacciato (bollito con 5% CO2/95% O2). Infine allineare il tessuto. Mantenere il secondo emisfero in ACSF ghiacciato fino a quando affettare.
- Regolare il vibratoma in modo da tagliare le fette a 250-400 m. Affettare a 250 m produrrà circa 12 fette per animale (400 m: 7 fette).
- Dopo aver tagliato la fetta (Figura 1A), identificare la formazione dell'ippocampo in base al suo aspetto morfologico tipico (Figura 1) e isolarla utilizzando aghi ipodermici (23 gauge, 1"), mantenendo la parte della corteccia cerebrale adiacente all'ippocampo.
NOT: Conservare la neocorteccia durante la coltura aiuta a preservare l'integrità dell'ippocampo. Tuttavia, l'ippocampo può essere isolato e coltivato senza corteccia se necessario. - Posizionare la fetta su una rete in una rete riscaldata, ACSF (34 gradi centigradi, bollita con 5% CO2/95% O2) fino a quando tutte le fette sono raccolte.
- Trasferire le fette nell'armadio a flusso laminare per continuare in condizioni sterili.
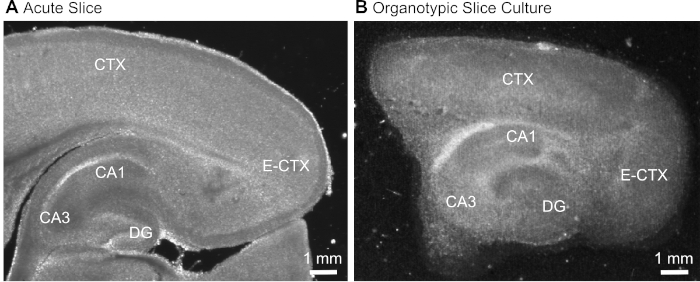
Figura 1: Immagini di trasmissione rappresentative di preparazioni acuta e organotipica del cervello. Confronto tra una fetta di cervello parasagittale acutamente isolata (A) e una fetta di cervello organotipipico parasagittale mantenuta in coltura per 12 giorni (B) utilizzando la microscopia transluminazione a campo largo. DG - giro dentato; CA1/3 - CA1/CA3-regione dell'ippocampo; E-CTX - Corteccia entorasale; CTX - corteccia (neo-) . Fare clic qui per visualizzare una versione più grande di questa figura.
2. Coltivare le fette
- Trasferire delicatamente le fette dall'ACSF in uno dei piatti Petri preriscaldati riempiti con sterile soluzione di sale hank utilizzando una pasteurtta in vetro sterile invertito.
NOT: La sterilizzazione del tessuto si ottiene con la diluizione (passaggio 3.2). Trasferire il minor numero possibile di ACSF al piatto Petri. - Cambiare la pipetta e trasferire le fette al secondo piatto Petri. Ripetere il processo 5 volte in generale. Trasferire il minor numero possibile di HBSS ai seguenti piatti Petri.
- Posizionare delicatamente una fetta alla volta sulla parte superiore dell'inserto di coltura. Ripetere il processo per ogni sezione. Evitare turbolenze nella pipetta e attendere che la fetta si discosti fino alla punta della pipetta Pasteur. Si può posizionare fino a 4 fette su una singola membrana.
- Rimuovere con cautela la soluzione di Hank in eccesso dalla parte superiore dell'inserto utilizzando una punta fine.
- Mantenere le colture (Figura 2) in un'incubatrice all'interfaccia tra il gas (carbogen, 95% O2 /5% CO2) e il liquido a 37 gradi centigradi fino al giorno dell'esperimento. Sostituire il supporto ogni 2-3 giorni.
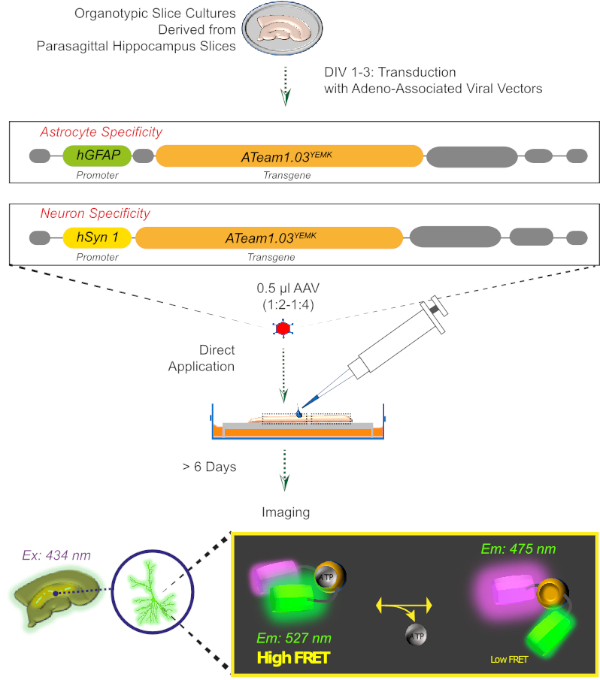
Figura 2: Principio dell'imaging ATP basato su FRET nelle fette cerebrali organotipiche coltivate utilizzando il sensore codificato geneticamente ATeam1.03YEMK. Rappresentazione schematica del protocollo presentato in questo lavoro. In breve, le fette di organotipipico parasagittale, coltivate per 1-3 giorni, vengono tradurine con un vettore virale associato ad adeno contenente hGFAP- astrocitatore-specifico o hSyn-promotore specifico del neurone e la sequenza per l'espressione di ATeam1.03YEMK. Le aliquote diluite di questi vettori (1:2-1:4) vengono applicate direttamente sulla parte superiore di una fetta, che viene mantenuta in condizioni di coltura per almeno 6 giorni. I cambiamenti nei livelli ATP intracellulari possono quindi essere visualizzati nelle cellule che esprimono il sensore eccensionandolo a 434 nm e acquisendo simultaneamente l'emissione di fluorescenza a 527 (accettatore) e 475 (donatore) nm. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Espressione di sensori ATP con un vettore virale associato ad Aadeno (Figura 2)
NOT: Assicurati di soddisfare tutti i requisiti per la gestione di organismi geneticamente modificati!
- Per gestire il vettore virale, i vettori virali associati adeno -adeno (AAV2/5) a 1-2 -L per evitare ripetuti congelamento e scongelamento. Conservare gli aliquote a -80 gradi centigradi.
- Posizionare un pallone contenente il 10% di candeggina sul banco sterile per scartare tutto il materiale residuo usato che era in contatto con il vettore.
- Per la trasduzione, preparare una diluizione di 1 l l del vettore con 2-3 l di DPBS. Le soluzioni stock normalmente presentano un titolo fisico nella grandezza di 1012 genomi virali per mL (vg/mL).
- Trasferire un inserto contenente una fetta coltivata nel cofano sterile.
- Senza toccare il tessuto, applicare 0,5 l di l del vettore diluito direttamente sulla parte superiore di ogni fetta.
NOT: Una migliore espressione negli strati più profondi del tessuto si ottiene trasducendo le fette coltivate a 1-3 giorni in vitro (DIV). La trasduzione delle culture più vecchie potrebbe provocare un'espressione predominante delle cellule nella cicatrice gliale circostante o una bassa espressione nei neuroni, rispettivamente. - Infine, riporre le fette nell'incubatrice e mantenerle per almeno altri 6 giorni. Non cambiare il mezzo il giorno della trasduzione.
4. Rimozione della cicatrice gliale (Figura 3)
- Poco prima di iniziare un esperimento, trasferire un inserto contenente fette coltivate nel cofano sterile e posizionarlo in un piatto da 30 mm, contenente 1 mL di media OCT o MEM.
- Posizionare il piatto sotto lo stereoscopio e concentrarsi sulla superficie della fetta.
- Utilizzare due aghi ipodermici sterili (23 G, 1") per effettuare una breve traversata proprio sui bordi stretti di una fetta scelta (Figura 3). Questa procedura rilascerà la tensione nella superficie creata dalla cicatrice gliale facendola ritrarne, esponendo così i livelli sottostanti (vedere Figura 5).
NOT: Il primo strato tissutale (cicatrice gliale) è formato principalmente da astrociti reattivi. Nell'imaging ad ampio campo, questo strato di tessuto denso si tradurrà in un'ulteriore dispersione della luce, con conseguente immagini sfocate. Rimuovere la cicatrice è quindi vantaggioso per ottenere una migliore visibilità degli strati più profondi, che contengono il tessuto organotico appropriato. Quindi, fare attenzione a eseguire questo taglio esclusivamente sul bordo e nello strato superiore della preparazione della fetta solo e non danneggiare il tessuto sottostante. Non abbiamo osservato differenze tra i dati ottenuti negli OTC con cicatrici gliali con quelli provenienti da OTC senza cicatrici (dati non mostrati). - Rimuovere la sezione preparata dall'inserto. A tal fine, utilizzare un bisturi sterile e accisa facendo tagli paralleli dritti alla membrana, formando un quadrato o un triangolo con la fetta al centro, tenendo i bordi della membrana con una pinzetta. Se l'inserto ospita fette aggiuntive, trasferirlo nuovamente nella piastra originale e nell'incubatrice. La tensione superficiale del mezzo impedirà la sua perdita sulla superficie della membrana.
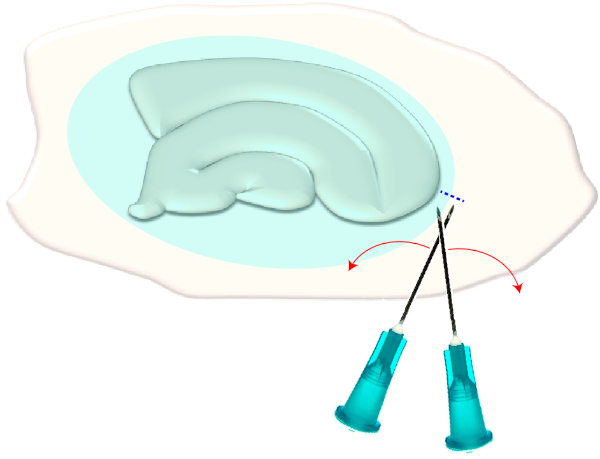
Figura 3: Illustrazione schematica della rimozione meccanica della cicatrice gliale. La figura mostra una coltura fetta ippocampale che è coperta da una cicatrice gliale (ellissoide bluastra). Con una volta tosare le punte di due aghi di siringa al più piccolo polo della cultura e ai margini della cicatrice gliale (linea tratteggiata blu), la cicatrice si capovolgerà da parte. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Imaging ATP basato su FRET(Figura 4)
- Prima dell'esperimento, preparare e-ACSF e bolla con 95% O2/5% CO2 per almeno 30 min per ottenere un pH di 7.4. Accendere la sorgente luminosa fluorescente (lampada Xenon) del monocromatore (Figura 4). Avviare la perfusione appena prima di estrarre la fetta dall'incubatrice.
NOT: Mantenere la salina bollata con 95% O2 e 5% CO2 durante l'intero esperimento. - Trasferire la fetta in una camera sperimentale che viene costantemente perfusa con E-ACSF appena carbogenata utilizzando una pompa peristale (Figura 4). Quindi, fissare la sezione con una griglia. Posizionare la camera sullo stadio del microscopio e collegare il sistema di perfusione. Tubi da laboratorio a prova di gas sono raccomandati per la perfusione.
NOT: Gli esperimenti possono essere eseguiti a temperatura ambiente o vicino a temperatura fisiologica, a seconda del progetto sperimentale. Controllare la stabilità e l'affidabilità del flusso di perfusione per evitare cambiamenti di messa a fuoco indotti dal movimento del tessuto e/o cambiamenti nello stress da taglio. Le velocità standard di perfusione per il lavoro a fette, utilizzate da noi e da molti altri laboratori, sono 1,5-2,5 mL/min.
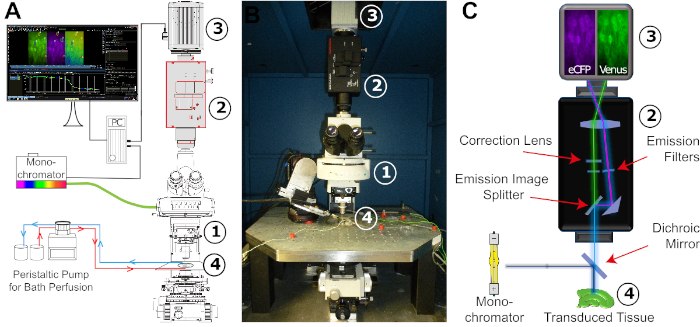
Figura 4: Configurazione della configurazione di imaging FRET. (A) Illustrazione schematica dei diversi componenti e della loro disposizione spaziale necessaria per la configurazione dell'imaging FRET. La disposizione è costituita da un monocromatico con una lampada allo xeno come fonte di luce, un microscopio a stadio fisso verticale (1), un sistema di splitter di immagini (2), una telecamera CCD o CMOS digitale per la registrazione time-lapse (3), e un bagno sperimentale adattato per una perfusione costante stabile (4). La perfusione del bagno è realizzata da una pompa peristale con portata regolabile. (B) Immagine dello spazio di lavoro sperimentale. La configurazione di imaging FRET è montata su un tavolo smorzato dalle vibrazioni che trasporta uno stadio x/y-traduzionale, in cui è incorporato il bagno sperimentale. Numeri: vedere (A). (C) Vista schematica del percorso luminoso dal monocromatore alla fotocamera digitale. Indicato è la posizione dei diversi filtri e il mirror dichroic. Numeri: vedere (A). Fare clic qui per visualizzare una versione più grande di questa figura.
- Portare a fuoco la fetta coltivata utilizzando la luce di trasmissione. Identificare l'area in cui devono essere effettuati gli esperimenti (ad esempio, regione CA1 dell'ippocampo). Prima di iniziare gli esperimenti di imaging, attendere almeno 15 min per consentire alle fette di adattarsi alle condizioni saline. Per la configurazione dell'installazione sperimentale, vedere Figura 4.
- Accendere la fotocamera e il software di imaging. Selezionare quindi il cubo del filtro corretto.
- Eccitare la proteina fluorescente del donatore (eCFP) a 435/17 nm (435 nm). Impostare il tempo di esposizione compreso tra 40 e 90 ms.
NOT: Una forte esposizione di fette alla luce fluorescente può provocare effetti fototossici. - L'eccitazione a 435 nm comporta emissioni sia a 475 nm (eCFP; donatore) che a 527 nm (Venus; accettatore). Dividere l'emissione di fluorescenza a 500 nm con uno splitter di immagini di emissione e utilizzare filtri di passat a banda 483/32 e 542/27 per isolare ulteriormente la fluorescenza del donatore e dell'accettatore. L'espressione forte potrebbe comportare la saturazione dei rivelatori. In questo caso, è possibile utilizzare un filtro a densità neutra per ridurre l'intensità dell'eccitazione.
- Selezionare una regione di interesse (ROI) apparentemente priva di fluorescenza cellulare per la sottrazione in background. Quindi, creare ROIs delineando i corpi cellulari.
- Impostare la frequenza di acquisizione dell'immagine e il tempo di registrazione complessivo. Per lunghi esperimenti (>30 min), si consiglia una frequenza di acquisizione di 0,2-0,5 Hz per prevenire la fototossicità.
- Avviare la registrazione. Si raccomanda di registrare almeno 5 min in condizioni di base per garantire la stabilità della preparazione.
NOT: Regolare la messa a fuoco della cella durante la registrazione, se necessario. - Per indurre cambiamenti nell'ATP intracellulare, trasferire il tubo di perfusione dall'ACSF standard a una salina contenente inibitori metabolici (ad esempio CIS, vedere tabella 1 e inferiore). In alternativa, utilizzare una salina con elevata concentrazione di potassio per imitare il rilascio di potassio dai neuroni attivi.
NOT: L'applicazione per perfusione bagno è un processo relativamente lento, che agisce globalmente sull'intera preparazione. Prendere nota del momento in cui la nuova soluzione ha effettivamente iniziato ad entrare nel bagno sperimentale. A seconda della distanza tra la camera e il serbatoio della salina, nonché della velocità della perfusione, è necessario considerare un tempo di ritardo.
6. Documentazione ad alta risoluzione della fluorescenza cellulare ATeam
- Subito dopo le registrazioni, trasferire la camera di registrazione contenente la coltura della fetta al microscopio a scansione laser confocale.
NOT: Fai particolare attenzione. A causa di potenziali danni fotografici, eseguire questo passaggio solo dopo gli esperimenti. Ai fini della documentazione, si può scambiare l'E-ACSF con H-ACSF. Pertanto, un sistema di perfusione non è necessariamente necessario. - Prendere z-stacks alla più alta risoluzione z possibile alla configurazione ottica data.
- Applicare un algoritmo di deconvoluzione per aumentare la risoluzione dell'immagine.
Risultati
I vettori AAV sono uno strumento affidabile per esprimere selettivamente geni estranei nelle cellule all'interno del tessuto vivente16. L'applicazione diretta di AAV contenenti la cassetta di sequenza di ATeam1.03YEMK e di un promotore specifico determina un'alta espressione del sensore nel tipo di cella scelto. Al DIV 14 (10 giorni dopo una trasduzione), i neuroni che esprimono ATeam sotto il promotore della sinapsi umana si trovano ad alta densità nella neocorteccia delle fette di tessuto coltivato a profondità fino a 50 m sotto la superficie della fetta (Figura 5A). Risultati comparabili possono essere ottenuti nell'ippocampo (Figura 5B).
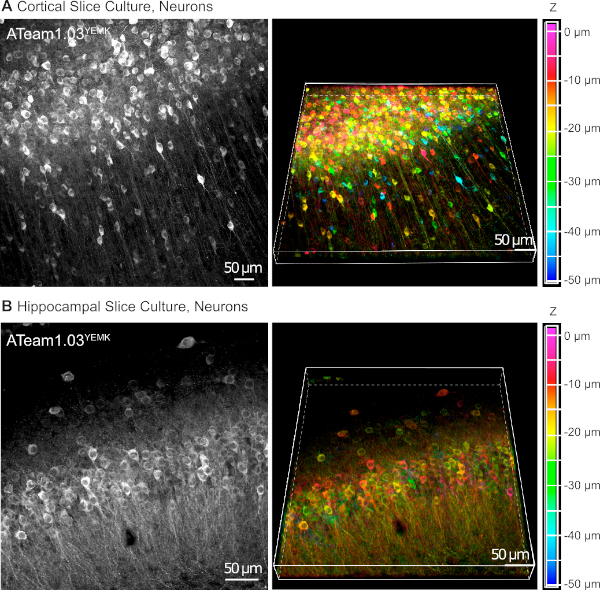
Figura 5: Visualizzazione dei neuroni che esprimono ATeam1.03YEMK in fette di cervello organosagittali coltivate coltivate. Le immagini a sinistra corrispondono a proiezioni di messa a fuoco estese di 43 sezioni ottiche (1,05 m ciascuna) di tessuto corticale (A) e (B)di 70 sezioni ottiche (0,6 m ciascuna) di tessuto ippocampale. Le immagini a destra rappresentano la vista volume della stessa proiezione. Le celle sono codificate a colori in base alla loro profondità rispetto alla superficie della sezione, come indicato dalla scala dei colori a destra. Fare clic qui per visualizzare una versione più grande di questa figura.
Per la misurazione dei livelli ATP negli astrociti, ATeam1.03YEMK è espresso sotto il controllo del promotore di proteine acide gliali umane (GFAP). Ciò si traduce in una trasduzione efficiente delle cellule sia nella neocorteccia che nell'ippocampo delle fette di tessuto coltivato (Figura 6). In particolare, due diversi fenotipi morfologici possono essere distinti, a seconda della profondità relativa alla superficie dei preparati della fetta. Nel primo strato superficiale, le cellule sono caratterizzate da processi primari spessi che sono prevalentemente disposti in parallelo alla superficie. Queste cellule presentano domini fortemente sovrapposti, creando una densa rete di astrociti apparentemente reattivi (Figura 6). Negli strati più profondi (30-60 m dalla superficie), gli astrociti trasdotti presentano processi cellulari fini che formano domini in gran parte sferici e la loro morfologia assomiglia a quella degli astrociti in situ come riportato in precedenza19,20,21 ( Figura6). Per ottenere una migliore traduzione di astrociti a strati più profondi e un migliore accesso ottico a questi strati più profondi, il tessuto cicatriziale gliale può essere rimosso come descritto nel passaggio 4.
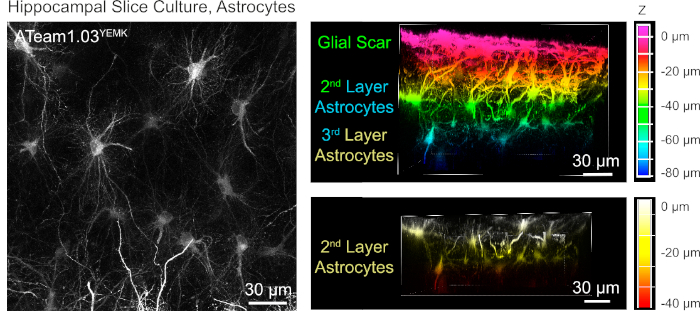
Figura 6: Visualizzazione degli astrociti che esprimono ATeam1.03YEMK in fette di cervello organosagitpico parasagittale coltivate. L'immagine a sinistra corrisponde a una proiezione di messa a fuoco estesa di 191 sezioni ottiche (0,45 m ciascuna). A scopo illustrativo, la cicatrice glial è stata esclusa dalla proiezione degli astrociti. Le immagini a destra rappresentano la vista volume della stessa proiezione prima e dopo la rimozione della cicatrice gliale. Le celle sono codificate a colori in base alla loro profondità rispetto alla superficie della sezione, come indicato dalle scale di colore a destra. Fare clic qui per visualizzare una versione più grande di questa figura.
L'espressione riuscita di ATeam1.03YEMK consente la misurazione dinamica dei cambiamenti nei livelli ATP nei neuroni o negli astrociti, a seconda del promotore utilizzato (vedi sopra). Gli esperimenti sono stati effettuati in un bagno sperimentale costantemente perfuso con E-ACSF (bollito con 95% O2/ 5% CO2). Nelle fette organotipiche che esprimono ATeam1.03YEMK nei neuroni ippocampali, sono state selezionate regioni di interesse (ROI) prima di iniziare la registrazione, che rappresentano i somata delle cellule piramidali (Figura 7A). Inoltre, è stata scelta una regione per la sottrazione dello sfondo(Figura 7A). L'emissione di Venere e la fluorescenza eCFP sono state poi raccolte per ciascuna di queste ROI separatamente e rappresentate come livello di emissione di fluorescenza nel tempo (Figura 7B). Dopo aver registrato la fluorescenza in condizioni di controllo per diversi minuti per garantire una linea di base stabile, il metabolismo cellulare è stato inibito esponendo la preparazione della fetta a una salina senza glucosio, a cui è stato aggiunto 5 mM di azide di sodio (NaN3) per un minuto (Figura 7B). Questa manipolazione ha indotto cambiamenti opposti nell'intensità delle emissioni della coppia FRET(Figura 7B, pannelli di sinistra), con una diminuzione di Venere (527 nm) e un aumento delle emissioni eCFP (475 nm). Il calcolo del rapporto FRET dividendo l'emissione di fluorescenza di Venere per quella di eCFP (FVenere/FeCFP) ha provocato segnali che riflettono le variazioni relative nei livelli ATP intracellulari, il cosiddetto "rapporto ATeam FRET"(Figura 7B, pannello destro). In tutti i neuroni registrati (n : 70 cellule in N - 5 fette), NaN3 ha causato una diminuzione reversibile nel rapporto ATeam FRET, indicando una diminuzione reversibile nei livelli intracellulari ATP sulla inibizione del metabolismo cellulare.
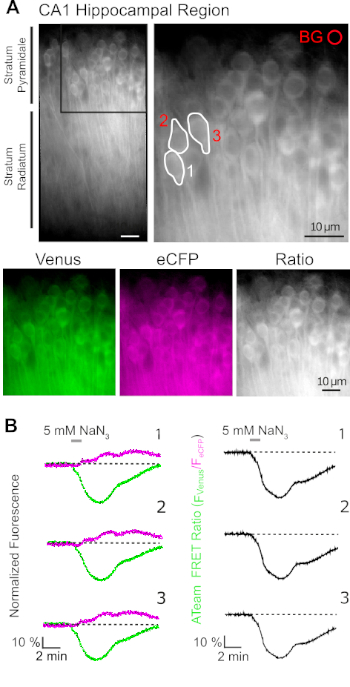
Figura 7: Dimostrazione del time lapse ATeam FRET ratio imaging. (A) In alto a sinistra: immagine a fluorescenza a campo largo dello strato piramidale e radiato dello strato piramidale e del radiato dello strato della regione CA1 di una fetta di ippocampo tipografica coltivata che esprime organoTeam1.03YEMK nei neuroni. In alto a destra: vista ingrandita della sezione boxed come indicato a sinistra. Le linee bianche delineano le regioni di interesse (ROI) 1-3 che rappresentano i corpi cellulari dei neuroni piramidali CA1 scelti per l'analisi in (B). BG rappresenta il ROI scelto per la correzione dello sfondo. In basso: immagini pseudo-colorate che rappresentano l'emissione di fluorescenza di Venere (verde), eCFP (viola) e il rapporto di Venere/eCFP. (B) Registrazione time lapse in ROIs 1-3, che rappresenta i corpi cellulari neuronali (vedi A). Tracce a sinistra mostrano l'emissione di fluorescenza normalizzata di Venere (verde) e eCFP (magenta). Le tracce a destra mostrano il rapporto ATeam FRET corrispondente. Si noti che la perfusione con 5 mM NaN3 in assenza di glucosio extracellulare per 1 minuto (barra grigia) induce una diminuzione reversibile del rapporto ATeam FRET, indicando una diminuzione della concentrazione ATP intracellulare. Fare clic qui per visualizzare una versione più grande di questa figura.
Per garantire la stabilità della preparazione e del sensore in condizioni di esperimento a lungo termine, le fette che esprimevano ATeam in neuroni o astrociti sono state costantemente perfuse con l'ACSF per periodi prolungati (>50 min; n - 12 cellule ciascuna, N - 3 OTC da 3 cervelli). In queste condizioni, il rapporto ATeam FRET non è stato modificato (Figura 8). Esporre al contrario i preparativi alla CSI contenente inibitori metabolici ("ischemia chimica", si vedala tabella 1 ), ha portato ancora una volta al previsto calo del rapporto ATeam FRET, come osservato in precedenza.
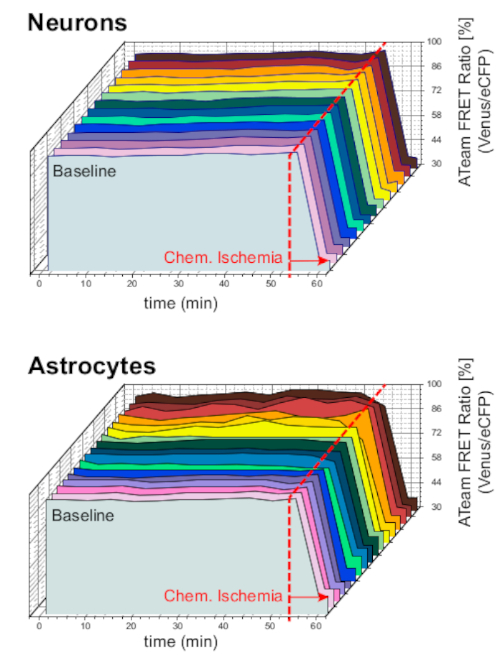
Figura 8: Esperimenti di base che impiegano ATeam. A lungo termine ATeam FRET rapporto imaging in 14 cellule diverse in condizioni di base in neuroni (in alto) e astrociti (in basso). I dati sono stati presi in condizioni comparabili rispetto ad altri dati sperimentali. Alla fine di ogni misurazione, l'ischemia chimica è stata suscitata dalla perfusione con CIS come indicato dalla freccia. NOTA: i rapporti ATeam FRET di base sono stabili nel tempo in condizioni di base. Fare clic qui per visualizzare una versione più grande di questa figura.
Successivamente, abbiamo analizzato le risposte di neuroni e astrociti che esprimono ATeam1.03YEMK ad un aumento della concentrazione extracellulare di potassio. Dopo aver stabilito una linea di base stabile, i neuroni sono stati perfusi con una salina in cui la concentrazione di potassio è stata aumentata da 3 a 8 mM per 3 minuti (Figura 9A). Questa manipolazione, tuttavia, non ha comportato una modifica rilevabile del rapporto ATeam FRET (n - 56 celle in N e 5 sezioni). Per garantire che il sensore reagisse a un cambiamento nei livelli ATP, le fette sono state poi nuovamente esposte a un periodo prolungato di ischemia chimica suscitata sostituendo E-ACSF con LA CSI. L'ischemia chimica ha provocato una rapida diminuzione del rapporto ATeam FRET a un nuovo livello stabile, indicando l'esaurimento nominale dell'ATP dopo 2-3 min(Figura 9A).
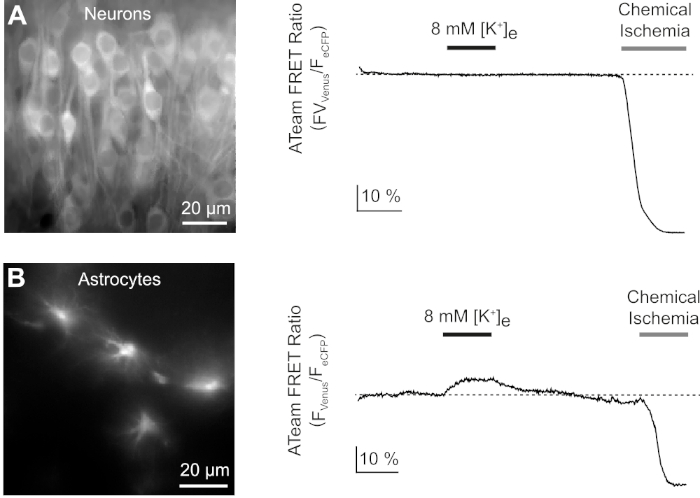
Figura 9: Esperimenti rappresentativi che illustrano i cambiamenti nei livelli di ATP nei neuroni e negli astrociti. (A,B): le immagini a sinistra mostrano la fluorescenza ATeam da neuroni e astrociti situati nella regione ippocampale CA1 di fette organotipiche. Le tracce a destra rappresentano le registrazioni time lapse del rapporto ATeam FRET ottenute da un ROI posizionato su un singolo corpo cellulare. In entrambi gli esperimenti, le fette sono state inizialmente sottoposte ad un aumento della concentrazione extracellulare di potassio per 3 minuti (vedi bar), seguita da un'esposizione finale all'ischemia chimica. Si noti che mentre i neuroni non rispondono all'elevazione del potassio extracellulare (A), gli astrociti reagiscono con un aumento dell'ATP (B). Fare clic qui per visualizzare una versione più grande di questa figura.
Lo stesso protocollo sperimentale è stato eseguito con fette, in cui ATeam1.03YEMK è stato espresso in astrociti. In contrasto con quanto osservato nei neuroni, gli astrociti hanno reagito all'aumento del potassio extracellulare con un aumento reversibile del rapporto ATeam FRET, indicando un aumento dei livelli ATP intracellulari (n : 70 cellule in N - 5 fette) (Figura 9B). La successiva esposizione all'ischemia chimica ha portato, come previsto, a un forte calo del rapporto ATeam FRET, indicativo dell'esaurimento nominale dell'ATP intracellulare (Figura 9B).
Discussione
Qui, dimostriamo una procedura per l'espressione specifica di tipo cellulare di ATeam1.03YEMK, un nanosensore basato su FRET, codificato geneticamente14, per la misurazione dei cambiamenti nei livelli DI ATP negli astrociti o neuroni nelle colture di sezioni di tessuto organotico del cervello del topocervello 15. Nelle registrazioni esemplari, mostriamo che un aumento della concentrazione di potassio extracellulare non si traduce in un cambiamento nelle concentrazioni di ATP nei neuroni, mentre i livelli di ATP astrocitici aumentano in risposta a questa manipolazione. Inoltre, i nostri risultati dimostrano che dopo l'inibizione del metabolismo cellulare, il rapporto ATeam1.03YEMK FRET diminuisce rapidamente in entrambi i tipi di cellule, indicando una rapida diminuzione dell'ATP intracellulare.
L'espressione di ATeam1.03YEMK nelle colture di fette organotipiche richiede il mantenimento del tessuto nella coltura in condizioni controllate per almeno 7-10 giorni. In alternativa, ATeam1.03YEMK può anche essere impiegato per la misurazione dell'ATP in fette di tessuto cerebrale acutamente isolate e nei nervi ottici dei topi13,15. Le misurazioni nel tessuto acutamente isolato, tuttavia, richiedono la generazione di animali transgenici o un'applicazione stereotassica di vettori virali nel cervello, coinvolgendo la sperimentazione animale e rigorosi protocolli di cura degli animali. A questo proposito, l'espressioneYEMK ATeam1.03 nelle colture di fette di tessuto organotipitico rappresenta un'alternativa utile e preziosa22,23. Da molti anni ormai, le colture di fette di tessuto organotipico fungono da sistema modello consolidato per studiare le proprietà neurali, la connettività e lo sviluppo24,25,26. Non solo mantengono l'architettura e la laminazione generale dei tessuti (Figura 1), ma ospitano anche le proprietà preferenziali delle colture cellulari come l'accessibilità superiore e il controllo diretto delle condizioni sperimentali. Le colture di fette di tessuto organitipotico sono anche regolarmente impiegate per esprimere geni estranei utilizzando vettori virali27. Diversi tipi di vettori virali sono stati segnalati per fornire transgeni nel tessuto cerebrale16,28. I vettori adenovirali inducono l'alta espressione nelle cellule gliali, ma non nei neuroni ippocampali16, e potrebbero generare reattività gliale17. Vettori virali associati ad Adeno come qui utilizzati emergono come una buona alternativa15, e la loro efficacia è stata mostrata anche in vivo29.
Mentre utilizzato principalmente per lo studio delle proprietà neuronali, recenti studi hanno stabilito che le colture di fette di tessuto organotipico possono anche essere impiegate per l'analisi degli astrociti. Le sezioni coltivate sono in genere coperte da uno strato di astrociti reattivi19,30 (Figura 5), ma gli astrociti presentano una morfologia e una citoarchitettura più native e non reattive nei livelli più profondi19,30 (Figura 5). Nel presente studio, descriviamo una procedura per la rimozione meccanica della cicatrice gliale esterna, che si traduce in una migliore accessibilità sperimentale e ottica degli astrociti nativi all'interno degli strati di tessuto organotipipico appropriati. Inoltre, la sua rimozione migliora l'efficacia dell'espressione negli strati più profondi delle fette organotipiche; se la cicatrice glialnon viene rimossa, la trasduzione da parte degli AAV potrebbe tendere ad essere limitata agli strati superficiali delle cellule.
Quando si eseguono esperimenti in fette di tessuto, è necessario considerare diversi fattori meccanici esterni. Una variazione nella velocità della perfusione del bagno può indurre movimenti dell'intera preparazione e/o indurre cambiamenti di messa a fuoco, con conseguenti cambiamenti transitori artificiali del segnale del sensore. Inoltre, sia gli astrociti che i neuroni sono stati segnalati per rispondere alla deformazione meccanica come imposta da alti tassi di perfusione32,33. Nelle nostre mani, utilizzando una pompa peristale affidabile, insieme al mantenimento di piccoli e stabili volumi di salina tra il tessuto e l'obiettivo (menisco) si traduce in un segnale FRET stabile in condizioni di base alla velocità di perfusione utilizzata qui (1.5-2.5 mL/min; Figura 8).
Nel presente studio, dimostriamo anche che l'imaging basato su FRET con ATeam1.03YEMK può essere impiegato per monitorare i livelli ATP in neuroni e astrociti. Un mezzo alternativo introdotto in precedenza per la misurazione dell'ATP cellulare è il cosiddetto analisi luciferina-luciferase34,35,36,37. Questo approccio, tuttavia, si basa sull'imaging della bioluminescenza e fornisce solo una risoluzione temporale e spaziale piuttosto bassa in parte a causa dei livelli di rumore di fondo piuttosto elevati. Un altro metodo regolarmente impiegato negli ultimi anni è stato l'imaging di cambiamenti nella concentrazione di magnesio intracellulare utilizzando il fluoroforo sensibile agli ioni38,39,40. Questo approccio si riferisce all'osservazione che un consumo di ATP comporta il rilascio del suo co-fattore di magnesio. L'imaging con colore verde magnesio fornisce quindi solo una stima secondaria dei cambiamenti nei livelli ATP. Inoltre, il colore del magnesio verde è anche sensibile ai cambiamenti nel calcio intracellulare, introducendo un'altra difficoltà nell'interpretare i risultati ottenuti con questo metodo.
Il recente sviluppo di nanosensori geneticamente codificati per l'imaging diretto dei metaboliti cellulari, quindi, ha rappresentato un grande passo avantidi 11,12. Sono stati generati diversi sensori che possono essere impiegati per la misurazione di ATP intracellulare36,41,42,43. Tra questi ci sono l'indicatore ATP fluorescente ratiometrico "QUEEN"41 così come PercevalHR, che rileva il rapporto ATP:ADP42. Mentre quest'ultima sonda è uno strumento prezioso per lo studio dello stato energetico delle cellule, richiede la misurazione simultanea dei cambiamenti nel pH42.
ATeam è un nanosensore di cui esistono diverse varianti, che - tra le altre - differiscono nella loro affinità vincolante per ATP14. In vitro, ATeam1.03YEMK esibisce un Kd di 1,2 mM a 37 , che è vicino ai livelli di ATP cellulare determinati in diversi tipi di cellule neuronali, che vanno da ipotalamo e cervelletto34 a ippocampo37,44,45. Nelle misurazioni della cuvette, l'abbassamento della temperatura di 10 gradi centigradi ha comportato una significativa diminuzione dell'affinità di legame tra ATeam1.03Da YEMK a ATP, suggerendo che potrebbe non essere ideale per l'imaging cellulare a temperaturaambiente 14. Il nostro studio precedente15, tuttavia, ha dimostrato che il comportamento e la risposta di ATeam1.03YEMK espressi in neuroni e astrociti a diverse manipolazioni è simile a temperatura quasi fisiologica e a temperatura ambiente, indicando che il sensore consente la determinazione affidabile dei livelli ATP intracellulare in entrambe le condizioni. Inoltre, i nostri esperimenti precedenti hanno affrontato la sensibilità al pH di ATeam1.03YEMK espressa all'interno delle cellule15,dimostrando che è insensibile ai cambiamenti nel pH intracellulare di circa 0,1-0,2 unità di pH. Se il Kd nella fascia mM bassa è un problema, varianti ATeam alternative potrebbero essere utilizzati14, tra cui varianti in rosso spostato di ATeam ("GO-ATeam")43.
I nostri esperimenti con ATeam1.03YEMK dimostrano che un aumento della concentrazione extracellulare di potassio di pochi mM solo (da 3 a 8 mM) si traduce in un aumento transitorio del rapporto ATeam1.03YEMK negli astrociti nella coltura delle fette organotipiche. Questa osservazione conferma gli studi precedenti15,46 e indica chiaramente che gli astrociti rispondono al rilascio di potassio da neuroni attivi con un aumento nella loro produzione di ATP, per lo più probabili come conseguenza di una stimolazione del Na-/K-ATPasee il Na-/HCO3- cotrasportoer, rispettivamente47,48. In contrasto con questo, i neuroni non hanno mostrato una risposta, che è in linea con il lavoro precedente pure15. Entrambi i tipi di cellule, tuttavia, hanno reagito rapidamente e fortemente all'inibizione della glicolisi cellulare e della respirazione mitocondriale, come mostrato primadel 15. In condizioni di ischemia chimica, i rapporti ATeam FRET sono scesi a un nuovo livello stabile, indicando un esaurimento nominale dell'ATP cellulare. Quest'ultimo risultato suggerisce che sia i neuroni che gli astrociti presentano un consumo rilevante di ATP anche in condizioni di stato costante senza stimolazione aggiuntiva per attivazione sinaptica o applicazione di neurotrasmettitori. Nel loro insieme, concludiamo che l'imaging basato su FRET con nanosensori geneticamente codificati, tra cui ATeam1.03YEMK,fornirà un approccio prezioso per chiarire i processi cellulari responsabili dei cambiamenti nei livelli di ATP intracellulare e del consumo di ATP cellulare in condizioni diverse.
Divulgazioni
Gli autori non dichiarano interessi concorrenti. Gli autori hanno ricevuto un sostegno finanziario che consente la pubblicazione ad accesso aperto da Nikon Microscope Solutions, Dusseldorf, Germania, che produce strumenti utilizzati nell'articolo video. L'azienda non è stata coinvolta nella progettazione degli esperimenti qui presentati, né nella loro esecuzione, né nella gestione dei dati, né nella scrittura del manoscritto.
Riconoscimenti
Gli autori desiderano ringraziare Claudia Roderigo e Simone Durry per l'assistenza tecnica esperta. Ringraziamo il Dr. Niklas J. Gerkau e M.Sc. Joel Nelson per l'assistenza nella preparazione delle colture di fette organotipiche. La ricerca nel laboratorio dell'autore è stata finanziata dalla German Research Association (DFG; PER 2795: Ro 2327/13-1 e SPP 1757: Ro 2327/8-2 a CRR; e SPP 1757: Finanziamento young Glia Start-Up per RL).
Materiali
| Name | Company | Catalog Number | Comments |
| 2-deoxyglucose | Alfa Aesar | L07338 | Non-metabolizable glucose analog |
| 36-IMA-410-019 Argon laser | Melles Griot | 488 nm wavelength argon | |
| Ascorbic acid | Carl Roth | 3525.1 | Antioxidant, Vitamin C |
| band pass filters 483/32 | AHF Analysentechnik AG | Splitter compatible emmision filter | |
| band pass filters 542/27 | AHF Analysentechnik AG | Splitter compatible emmision filter | |
| Beamsplitter T 455 LP | AHF Analysentechnik AG | Excitation dichroic mirror | |
| Beamsplitter T 505 LPXR | AHF Analysentechnik AG | Splitter dichroic | |
| Confocal laser scannig microscope C1 | Nikon Microscope Solutions | Modular confocal microscope system C1 | |
| Data processing Origin Pro 9.0.0 (64-bit) | OriginLab corporation | Scientific graphing and data analysis software | |
| D-glucose monohydrate | Caelo | 2580-1kg | |
| DPBS | GIBCO/Life | 14190250 | Dulbecco's phosphate-buffered saline |
| Eclipse E 600FN upright microscope | Nikon Microscope Solutions | ||
| Eclipse FN1 upright microscope | Nikon Microscope Solutions | ||
| Experimental chamber | custom build | Perfusion chamber for live-cell imaging | |
| EZ-C1 Silver Version 3.91 | Nikon Microscope Solutions | Imaging software for confocal microscope | |
| Hanks' Balanced Salt solution | Sigma-Aldrich | H9394 | With Phenol Red for pH monitoring |
| HERAcell 150 | Thermo Scientific | CO2 incubator HERAcell ® 150 with decontamination routine | |
| HERAsafe KS/KSP | Thermo Scientific | Safety Cabinet | |
| Horse serum | GIBCO/Life | 26050088 | Heat inactivated |
| Huygens Professional | SVI Imaging | Deconvolution software | |
| Image J 1.52i | Wayne Rasban national Institute of Health | Image processing Software available in the public domain | |
| Insulin | Sigma-Aldrich | I6634 | Insulin from bovine pancreas |
| IP serie peristaltic pump | Ismatec | High-precisionmulti-channel pump | |
| Layout software, Illustrator CS6 | Adobe | Vector graphics editor | |
| L-glutamine | GIBCO/Life | 25030024 | |
| Microm HM 650 V | Thermo Scientific | Vibration microtome. Thermo scientific discontinued the production of the device in the meantime. Any other slicer or tissue chopper siutable for slicing living tissue is fine, too. | |
| Microscope stage | custom build | ||
| Microsoft Excel 16 | Microsoft | Spreadsheet software for basic data processing | |
| Millicell culture insert | Merck Millipore | PICM0RG50 | Hydrophilized PTFE, pore size 0.4 μm |
| Minimum Essential Medium Eagle | Sigma-Aldrich | M7278 | Synthetic cell culture media |
| Monochromator Polychrome V | Thermo Scientific/FEI | Ultra fast switching monochromator | |
| NaN3 (Sodium Azide) | Sigma-Aldrich | S-8032 | Mitochondrial inhibitor (complex IV inhibitor). CAUTION: Azide is toxic. Be aware not to accidentally ingest or inhale it, and prevent ist absoption through the skin. |
| Nikon Fluor 40x / 0.80 W DIC M ∞/0 WD 2.0 | Nikon Microscope Solutions | Water Immersion Microscope Objective | |
| NIS Elements 4.50 advanced Research | Nikon Microscope Solutions | Imaging software. Upgraded version for FRET imaging | |
| ORCA-Flash4.0 | Hamamatsu Photonics | Digital CMOS camera | |
| Perfusion tubing | Pro Liquid GmbH | Tygon tubing, 1.52 x 322 mm (Wd: 0.85) | |
| Photoshop CS 6 Version 13.0 | Adobe | Image processing software | |
| Sodium L-lactate | Sigma-Aldrich | 71718-10G | |
| ssAAV-2/2-hSyn1-ATeam1.03YEMK-WPRE-hGHp(A) | ETH Zürich | v244 | Single-stranded AAV vector that induces the expression of ATeam1.03YEMK under the control of the human synapsin 1 promoter fragment hSyn1. |
| ssAAV-5/2-hGFAP-hHBbI/E-ATeam1.03YEMK-WPRE-bGHp(A) | ETH Zürich | v307 | Single-stranded AAV vector that induces the expression of ATeam1.03YEMK under the control of the human glial fibrillary acidic protein promoter fragment ABC1D. |
| WVIEW GEMINI optic system | Hamamatsu Photonics | Emission Image Splitter |
Riferimenti
- Sweadner, K. J. Isozymes of the Na+/K+-ATPase. Biochimica et Biophysica Acta. 988, 185-220 (1989).
- Clapham, D. E. Calcium signaling. Cell. 131, 1047-1058 (2007).
- Cotter, K., Stransky, L., McGuire, C., Forgac, M. Recent Insights into the Structure, Regulation, and Function of the V-ATPases. Trends in Biochemical Sciences. 40, 611-622 (2015).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75, 762-777 (2012).
- Brown, A. M., Ransom, B. R. Astrocyte glycogen and brain energy metabolism. Glia. 55, 1263-1271 (2007).
- Hertz, L., et al. Roles of astrocytic Na+,K+-ATPase and glycogenolysis for K+ homeostasis in mammalian brain. Journal of Neuroscience Research. 93, 1019-1030 (2015).
- Allaman, I., Belanger, M., Magistretti, P. J. Astrocyte-neuron metabolic relationships: For better and for worse. Trends in Neurosciences. 34, 76-87 (2011).
- Barros, L. F., Deitmer, J. W. Glucose and lactate supply to the synapse. Brain Research Reviews. 63, 149-159 (2010).
- Diaz-Garcia, C. M., et al. Neuronal Stimulation Triggers Neuronal Glycolysis and Not Lactate Uptake. Cell Metabolism. 26, 361-374 (2017).
- Diaz-Garcia, C. M., et al. Quantitative in vivo imaging of neuronal glucose concentrations with a genetically encoded fluorescence lifetime sensor. Journal of Neuroscience Research. 97, 946-960 (2019).
- Barros, L. F., et al. Current technical approaches to brain energy metabolism. Glia. 66, 1138-1159 (2018).
- Tantama, M., Hung, Y. P., Yellen, G. Optogenetic reporters: Fluorescent protein-based genetically encoded indicators of signaling and metabolism in the brain. Progress in Brain Research. 196, 235-263 (2012).
- Trevisiol, A., et al. Monitoring ATP dynamics in electrically active white matter tracts. eLife. 6, e24241(2017).
- Imamura, H., et al. Visualization of ATP levels inside single living cells with fluorescence resonance energy transfer-based genetically encoded indicators. Proceedings of the National Academy of Sciences of the United States of America. 106, 15651-15656 (2009).
- Lerchundi, R., et al. FRET-based imaging of intracellular ATP in organotypic brain slices. Journal of Neuroscience Research. , 1-13 (2018).
- Ehrengruber, M. U., et al. Gene transfer into neurons from hippocampal slices: comparison of recombinant Semliki Forest Virus, adenovirus, adeno-associated virus, lentivirus, and measles virus. Molecular and Cellular Neurosciences. 17, 855-871 (2001).
- Woo, J., et al. Functional Characterization of Resting and Adenovirus-Induced Reactive Astrocytes in Three-Dimensional Culture. Experimental Neurobiology. 26, 158-167 (2017).
- Close, B., et al. Recommendations for euthanasia of experimental animals: Part 2. DGXT of the European Commission. Laboratory Animals. 31, 1-32 (1997).
- Benediktsson, A. M., Schachtele, S. J., Green, S. H., Dailey, M. E. Ballistic labeling and dynamic imaging of astrocytes in organotypic hippocampal slice cultures. Journal of Neuroscience Methods. 141, 41-53 (2005).
- Lanjakornsiripan, D., et al. Layer-specific morphological and molecular differences in neocortical astrocytes and their dependence on neuronal layers. Nature Communications. 9, 1623(2018).
- Bushong, E. A., Martone, M. E., Ellisman, M. H. Examination of the relationship between astrocyte morphology and laminar boundaries in the molecular layer of adult dentate gyrus. The Journal of Comparative Neurology. 462, 241-251 (2003).
- Frotscher, M., Zafirov, S., Heimrich, B. Development of identified neuronal types and of specific synaptic connections in slice cultures of rat hippocampus. Progress in Neurobiology. 45, vii-xxviii (1995).
- Galimberti, I., et al. Long-term rearrangements of hippocampal mossy fiber terminal connectivity in the adult regulated by experience. Neuron. 50, 749-763 (2006).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37, 173-182 (1991).
- Forster, E., Zhao, S., Frotscher, M. Laminating the hippocampus. Nature Reviews. Neuroscience. 7, 259-267 (2006).
- Holopainen, I. E. Organotypic Hippocampal Slice Cultures: A Model System to Study Basic Cellular and Molecular Mechanisms of Neuronal Cell Death, Neuroprotection, and Synaptic Plasticity. Neurochemical Research. 30, 1521-1528 (2005).
- Teschemacher, A. G., et al. Targeting specific neuronal populations using adeno- and lentiviral vectors: applications for imaging and studies of cell function. Experimental Physiology. 90, 61-69 (2005).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Advances in Genetics. 87, 125-197 (2014).
- Mächler, P., et al. In Vivo Evidence for a Lactate Gradient from Astrocytes to Neurons. Cell Metabolism. 23, 94-102 (2016).
- Schreiner, A. E., Berlinger, E., Langer, J., Kafitz, K. W., Rose, C. R. Lesion-Induced Alterations in Astrocyte Glutamate Transporter Expression and Function in the Hippocampus. ISRN Neurology. 2013, 893605(2013).
- Haber, M., Zhou, L., Murai, K. K. Cooperative astrocyte and dendritic spine dynamics at hippocampal excitatory synapses. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 26, 8881-8891 (2006).
- Neary, J. T., Kang, Y., Tran, M., Feld, J. Traumatic injury activates protein kinase B/Akt in cultured astrocytes: role of extracellular ATP and P2 purinergic receptors. Journal of Neurotrauma. 22, 491-500 (2005).
- Xia, J., et al. Neurons respond directly to mechanical deformation with pannexin-mediated ATP release and autostimulation of P2X7 receptors. The Journal of Physiology. 590, 2285-2304 (2012).
- Ainscow, E. K., Mirshamsi, S., Tang, T., Ashford, M. L., Rutter, G. A. Dynamic imaging of free cytosolic ATP concentration during fuel sensing by rat hypothalamic neurones: evidence for ATP-independent control of ATP-sensitive K+ channels. The Journal of Physiology. 544, 429-445 (2002).
- Arcuino, G., et al. Intercellular calcium signaling mediated by point-source burst release of ATP. Proceedings of the National Academy of Sciences of the United States of America. 99, 9840-9845 (2002).
- Rajendran, M., Dane, E., Conley, J., Tantama, M. Imaging Adenosine Triphosphate (ATP). The Biological Bulletin. 231, 73-84 (2016).
- Rangaraju, V., Calloway, N., Ryan, T. A. Activity-driven local ATP synthesis is required for synaptic function. Cell. 156, 825-835 (2014).
- Chatton, J. Y., Pellerin, L., Magistretti, P. J. GABA uptake into astrocytes is not associated with significant metabolic cost: implications for brain imaging of inhibitory transmission. Proceedings of the National Academy of Sciences of the United States of America. 100, 12456-12461 (2003).
- Magistretti, P. J., Chatton, J. Y. Relationship between L-glutamate-regulated intracellular Na+ dynamics and ATP hydrolysis in astrocytes. Journal of Neural Transmission (Vienna). 112, 77-85 (2005).
- Langer, J., et al. Rapid sodium signaling couples glutamate uptake to breakdown of ATP in perivascular astrocyte endfeet. Glia. 65, 293-308 (2017).
- Yaginuma, H., et al. Diversity in ATP concentrations in a single bacterial cell population revealed by quantitative single-cell imaging. Scientific Reports. 4, 6522(2014).
- Tantama, M., Martinez-Francois, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nature Communications. 4, 2550(2013).
- Nakano, M., Imamura, H., Nagai, T., Noji, H. Ca2+ Regulation of Mitochondrial ATP Synthesis Visualized at the Single Cell Level. ACS Chemical Biology. 6, 709-715 (2011).
- Mollajew, R., Toloe, J., Mironov, S. L. Single KATP channel opening in response to stimulation of AMPA/kainate receptors is mediated by Na+ accumulation and submembrane ATP and ADP changes. The Journal of Physiology. 591, 2593-2609 (2013).
- Pathak, D., et al. The Role of Mitochondrially Derived ATP in Synaptic Vesicle Recycling. The Journal of Biological Chemistry. 290, 22325-22336 (2015).
- Karus, C., Mondragao, M. A., Ziemens, D., Rose, C. R. Astrocytes restrict discharge duration and neuronal sodium loads during recurrent network activity. Glia. 63, 936-957 (2015).
- Larsen, B. R., Stoica, A., MacAulay, N. Managing Brain Extracellular K+ during Neuronal Activity: The Physiological Role of the Na+/K+-ATPase Subunit Isoforms. Frontiers in Physiology. 7, 141(2016).
- Ruminot, I., et al. NBCe1 mediates the acute stimulation of astrocytic glycolysis by extracellular K+. The Journal of Neuroscience : The Official Journal of the Society for Neuroscience. 31, 14264-14271 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon