Method Article
FRET 기반 센서 ATeam1.03YEMK를 사용하여 마우스 뇌의 오르가노티픽 조직 슬라이스에서 세포 내 ATP 이미징
요약
우리는 마우스 전뇌의 오르노티픽 슬라이스 배양에서 유전자 로 코딩된 FRET 기반 센서 ATeam1.03YEMK의 세포 형 특이적 발현에 대한 프로토콜을 기술한다. 또한, 우리는 뉴런과 성상 세포에서 세포 ATP 수준의 동적 이미징을 위해이 센서를 사용하는 방법을 보여줍니다.
초록
중추 신 경계에서 신경 활동 (CNS) 아데노신 삼인산의 고장에 의해 제공 하는 세포 에너지에 높은 수요를 불러 일으킨다 (ATP). ATP의 큰 몫은 뉴런의 전기 신호에 의해 저하 플라즈마 멤브레인에 걸쳐 이온 그라데이션을 다시 설치하는 데 필요합니다. 성상 세포는 - 빠른 전기 신호를 생성하지 않는 동안 - 신경 활동에 응하여 ATP의 증가 생산을 겪고 그(것)들에게 에너지 대사 산물을 제공해서 활성 뉴런을 지원한다는 기록이 있습니다. 다른 대사 산물에 대한 유전자 부신 센서의 최근 개발은 이제 뉴런과 성상 세포 사이의 이러한 대사 상호 작용의 연구를 가능하게. 여기서, 우리는 아데노 관련 바이러스 벡터(AAV)를 사용하여 마우스 해마 및 피질의 오르노티피 조직 슬라이스 배양에서 ATP 민감성 형광 에너지 전달-(FRET-) 센서 ATeam1.03YEMK의 세포 형 특이적 발현에 대한 프로토콜을 기술한다. 또한, 우리는 이 센서가 세포 외 칼륨의 증가와 화학 적 허혈의 유도 (즉, 세포 에너지 대사의 억제)에 따라 뉴런과 성상 세포에서 세포 ATP 수준의 변화의 동적 측정을 위해 사용될 수있는 방법을 보여줍니다.
서문
뉴런의 흥분성 전기 적 활성은 주로 나트륨 (Na+) 및 칼륨 (K+)과같은 양이온의 플럭스에 기초합니다. 따라서 이 두 이온의 전기화학적 구배의 유지보수가 신호화에 필요합니다. 이는 세포 밖 공간에서 2 K+를 대가로 세포에서 3 Na+를 압출하는 유비쿼터스 발현 된 전기 제닉 트랜스 멤브레인 펌프인 Na+/K+-ATPase (NKA)에 의해 달성되며, 수송 주기 당 ATP의 한 분자의 소비를요구한다. NKA 이외에, 혈장 막Ca2+-ATPase를 포함하여 몇몇 다른 ATP 소모이온 수송기는, 세포내 Ca2+ 항상성 및 그 수출 에 필수적인 활동 유도한 유입2. 시냅스 소포에서, 공병형 H+-ATPase(v-ATPase)는 이 구획으로 신경 전달 물질 섭취에 필요한 양성자 구배를 생성한다3.
뉴런의 활성은 이렇게 상당한 양의 ATP4를필요로하지만, 그들은 에너지의 저장을위한 상당한 용량을 나타내지 않는다. 대신, 그(것)들은 두뇌에 있는 주요 글리코겐 저장인 이웃 성상 세포와의 신진 대사 상호 작용에 의존하는 것처럼 보입니다5. 그것은 성상 세포 글리코겐 실제로 신경 에너지 요구를 지 탱하는 데 중요 한 역할을 제안 되었습니다.; 그리고 두 세포 유형 간의 제안된 신경 대사 결합의 주요 현상은 신경 활성6,7,8에반응하여 ATP 생산을 증가시키는 성상세포의 능력이다. 성상 세포 -뉴런 락테이트 셔틀 (ANLS)으로 알려진이 가설은 여전히 논쟁의 여지가 있습니다, 다른 연구는 뉴런이자극에대한 응답으로 당해의 자신의 속도를 증가시킬 수 있다는 증거를 제공했기 때문에9,10,신경 - glia 상호 작용을 연구하는 추가 방법 및 접근의 필요성을 반영.
신경-glia 대사 상호 작용을 해명 하는 신경-glia 대사 상호 작용을 해명 하는 신경 및 성상 세포에서 세포 에너지 대사 및 ATP 수준의 조사 긴 뇌 조직에서 살아있는 세포에서 대사 산물 농도의 변화의 변화에 대 한 적합 한 프로브의 부족에 의해 방해 되었습니다. 그러나 지난 10년 동안 ATP, 젖산, 피루바테 및 기타11,12의센서를 포함하여 다른 대사 산물에 대한 새로운 도구 및 새로운 유전자 부화 형광 프로브의 개발에 급증을 제공했습니다. 이러한 도구를 이용하여, 이제 는 세포 ATP 소비와 관련된 질문을 직접 해결할 수 있으며, 단일 세포 수준에서 세포 형 특정 방식으로 세포 형 에너지 레벨의 변화와 관련된 문제를 그대로 뇌조직(13)으로해결할 수 있다.
본 작품에서, 우리는 뉴런과 배양 organotypic 뇌 조각의 성상 세포에 세포성 ATP 역학을 시각화하는 절차를 설명합니다. 우리는 몇주동안 세포 배양에서 유지될 수 있는 마우스 뇌의 뉴런 및 성상세포에서 유전자 부호분석된 ATP-나노센서 ATeam1.03 YEMK(14)의 세포형 특이적 발현을 위해 아데노 관련 바이러스 벡터(AAV)를 사용하는 방법을 보여준다. 배양 된 조직 조각을 덮는 신경교 흉터를 제거하는 방법에 대한 절차가 설명되어, 이는 광학 접근성및 아래 organotypic 조직 층에서 세포의 이미징을 향상시킵니다. 마지막으로, 우리는 ATeam1.03YEMK가 이 준비에 있는 세포 ATP 수준에 있는 변경의 FRET 기지를 둔 화상 진찰을 능력을 발휘하기 위하여 이용될 수 있는 방법을 보여줍니다. 이 방법은 외과적 뇌 시술을 필요로 하지 않는 주요 장점을 숙주하고, 배양된 뇌 슬라이스에서 센서 및 세포 유형 특이성의 높은 수준의 발현을 제공하며, 다른 바이러스 벡터와 전기천공 또는 형질전환과 같은 다른 방법과 비교하여 세포의 침습성 또는 스트레스를감소시키며, 10,16,17. 또한, 이 프로토콜은 ATP14에대해 낮은 결합 친화도를 제공하는 ATeam1.03의 변형들 중에서도 다른 FRET 기반 나노센서에 적용될 수 있다.
프로토콜
본 연구는 하인리히 하이네 대학 뒤셀도르프의 제도적 지침뿐만 아니라 유럽 공동체 이사회 지침에 따라 엄격하게 수행되었다 (2010/63/ EU). Organotypic 뇌 슬라이스 문화를 사용하여 모든 실험은 하인리히 하이네 대학 뒤셀도르프의 동물 관리 및 사용 시설에서 동물 복지 사무소에 전달및 승인되었다 (기관 행위 번호: O50/05). 유럽 위원회18의권고에 따라, 10 일까지 동물은 참수에 의해 살해되었다.
1. 오르가노티픽 브레인 슬라이스 문화(OTC) 준비
- 전날 또는 최소 30분 전에
- 페트리 접시를 준비합니다 (멸균 조건하에서). 6웰 플레이트의 뚜껑을 제거하고 각 우물에 800-850 μL의 OTC 배지를 놓습니다. 플레이트를 인큐베이터(37°C, 5% CO2/95%O2)에보관하십시오.
- 세척 페트리 접시를 준비 (멸균 조건하에서). 각 30mm 페트리 접시에 3 mL의 HBSS를 추가합니다. 수속당 총 5가지 요리가 필요합니다. 인큐베이터(37°C, 5% CO 2/95%O2)에적어도 30분 동안 - 필요할 때까지 하룻밤 동안 놓습니다.
- ACSF 를준비합니다(표 1). 포도당 없이 식염수의 다음 날까지 4°C로 유지하십시오.
| 식수 및 매체 - 배합 | ||||
| 이름 | 약어 | 구성 | 농도 [mM] | 코멘트 |
| 인공 뇌척수액 용액 | ACSF | Nacl | 125 | 5% CO2/95% O2,pH 7.4로 버블링 |
| KCl | 2.5 | 항상 사용 직전에 포도당을 추가하십시오. | ||
| CaCl2 | 2 | 포도당으로 하루 이상 보관하지 마십시오. | ||
| MgCl2 | 1 | ~ 310 mOsm / L | ||
| NaH2PO4 | 1.25 | |||
| 나코3 | 26 | |||
| 포도 당 | 20 | |||
| 실험 ACSF | E-ACSF | Nacl | 136 | 5% CO2/95% O2,pH 7.4로 버블링 |
| KCl | 3 | 항상 사용 직전에 포도당을 추가하십시오. | ||
| CaCl2 | 2 | 포도당으로 하루 이상 보관하지 마십시오. | ||
| MgCl2 | 1 | ~ 320 mOsm / L | ||
| NaH2PO4 | 1.25 | |||
| 나코3 | 24 | |||
| 포도 당 | 5 | |||
| 락 테이트 | 1 | |||
| 화학 허혈 용액 | Cis | Nacl | 136 | 5% CO2/95% O2,pH 7.4로 버블링 |
| KCl | 3 | ~ 318 mOsm / L | ||
| CaCl2 | 2 | |||
| MgCl2 | 1 | |||
| NaH2PO4 | 1.25 | |||
| 나코3 | 24 | |||
| 2, 2-디옥시글루코스 | 2 | |||
| NaN3 | 5 | |||
| 8 mM 칼륨 ACSF | 8mM K+ ACSF | Nacl | 128 | 5% CO2/95% O2,pH 7.4로 버블링 |
| KCl | 8 | ~ 320 mOsm / L | ||
| CaCl2 | 2 | |||
| MgCl2 | 1 | |||
| NaH2PO4 | 1.25 | |||
| 나코3 | 24 | |||
| 포도 당 | 5 | |||
| 락 테이트 | 1 | |||
| 헤페스 버퍼링 ACSF | H-ACSF | Nacl | 125 | NaOH를 사용하여 pH 7.4로 조정 |
| KCl | 3 | 사용하기 전에 항상 포도당을 추가합니다. | ||
| CaCl2 | 2 | 포도당으로 하루 이상 보관하지 마십시오. | ||
| MgSO4 | 2 | ~ 310 mOsm / L (자당으로 조정) | ||
| NaH2PO4 | 125 | |||
| 헤페스 (주)에페 | 25 | |||
| 포도 당 | 10 | |||
| 행크스의 균형 잡힌 소금 솔루션 | HBSS | 시그마 (카탈로그 번호 H9394). | ||
| 덜베코의 인산완식염수 | DPBS | 깁코 (카탈로그 번호 14287-080) | ||
| 오르가노티픽 문화 매체 | OTC 매체 | 열 불활성화 말 세럼 | 20% | 34°C, 5%CO2,pH 7.4, 배양 조건 하에서 |
| Mem | 79% | ~ 320 mOsm / L | ||
| L-글루타민 | 1 | |||
| 인슐린 | 0.01 mg/mL | |||
| Nacl | 14.5 | |||
| MgSO4 | 2 | |||
| CaCl2 | 1.44 | |||
| 아스코르브산 | 0.00125 % | |||
| D-포도당 | 13 |
표 1: 솔루션 컴포지션.
- 준비 당일, ACSF에 포도당을 추가하고 얼음위에 놓고 95% O2/5%CO2로 30분 이상 버블링을 시작하여 7.4의 pH를 생성합니다.
- 해부 및 슬라이스
- 산후 6일에서 8일까지 마우스(BalbC, 두 남녀 모두)를 급속한 참수로 희생시키고 얼음처럼 차가운 ACSF가 들어있는 유리 페트리 접시에 머리를 놓습니다.
- 비강 뼈의 뒤쪽 끝까지 피부를 뒤에서 절단하여 두개골을 노출. 그런 다음 외과 용 가위를 사용하여 두개골을 조심스럽게 자르고 뇌를 노출시하십시오.
참고: 절차가 기관의 지침에 부합하는지 확인하십시오. - 뇌를 제거하고 ACSF로 채워진 얼음 차가운 페트리 접시에 필터 멤브레인에 놓습니다.
- 반구를 분리하고 45°의 각도로 기생충 절단을 수행합니다. 수퍼 글루로 진동 조직 단계에서 한 반구를 수정하십시오. 즉시 얼음 차가운 ACSF를 포함하는 진동 욕조에 조직 블록을 전송 (5 % CO2/ 95 %O2거품). 마지막으로 조직을 정렬합니다. 두 번째 반구는 슬라이스될 때까지 얼음으로 차가운 ACSF에 보관하십시오.
- 250-400 μm에서 슬라이스를 잘라 비브라토메를 조정250 μm에서 슬라이스는 동물 당 약 12 슬라이스를 얻을 것이다 (400 μm : ~ 7 슬라이스).
- 슬라이스를 절단 한 후(그림 1A),전형적인 형태학적 외관에 기초하여 해마 형성을 식별하고피하주사바늘 (23 게이지, 1")을 사용하여 격리하고, 해마에 인접한 대뇌 피질의 일부를 유지한다.
참고: 배양하는 동안 신피질을 보존하면 해마의 무결성을 보존하는 데 도움이됩니다. 그러나, 해 마 는 필요한 경우 피 질 없이 격리 하 고 배양 될 수 있다. - 모든 슬라이스가 수집 될 때까지 온난 한 ACSF (34 ° C, 5 % CO2/ 95 % O2로거품을 낸)에 메쉬에 슬라이스를 놓습니다.
- 멸균 조건에서 계속하기 위해 슬라이스를 층류 캐비닛으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 더합니다.
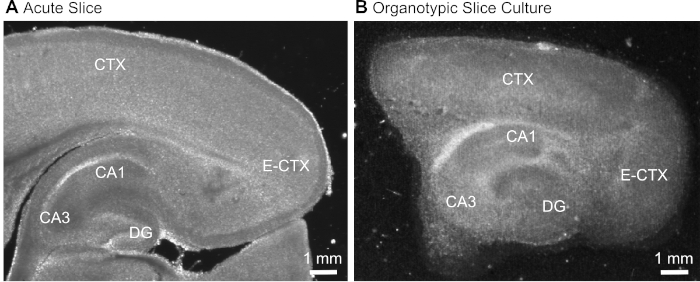
그림 1: 급성 및 오르노티픽 뇌 슬라이스 제제의 대표적인 투과 이미지. 급성 으로 단리된 기생충 뇌슬라이스(A)와12일 동안 배양에서 유지된 기생충 오르가노티치 뇌 슬라이스의비교(B)광시야 translumination 현미경을 사용하여. DG = 덴테이트 자이러스; CA1/3 = 해마의 CA1/CA3 영역; E-CTX = 내측 피질; CTX = (네오) 피질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 슬라이스 배양
- ACSF의 슬라이스를 거꾸로 된 멸균 유리 파스퇴르 피펫을 사용하여 멸균 행크의 소금 용액으로 채워진 미리 데운 페트리 요리 중 하나로 부드럽게 옮니다.
참고: 조직의 살균은 희석 (단계 3.2)에 의해 달성된다. 가능한 한 작은 ACSF를 페트리 접시에 옮김을 옮김을 드시면 됩니다. - 파이펫을 변경하고 두 번째 페트리 접시에 슬라이스를 전송합니다. 전체 프로세스를 5회 반복합니다. 다음 페트리 요리에 가능한 한 적은 HBSS를 전송합니다.
- 배양 삽입부 상단에 한 번에 한 조각을 부드럽게 놓습니다. 각 슬라이스에 대해 이 과정을 반복합니다. 파이펫의 난류를 피하고 슬라이스가 파스퇴르 파이펫 끝으로 내려갈 때까지 기다립니다. 하나는 단일 멤브레인에 최대 4 개의 슬라이스를 배치 할 수 있습니다.
- 미세 한 팁을 사용 하 여 삽입의 상단에서 여분의 행크의 용액을 신중 하 게 제거 합니다.
- 배양체(도2)를가스(카보겐, 95%O2/5% CO2)와액체를 실험당일까지 37°C에서 인큐베이터에 보관한다. 2-3일마다 매번 매체를 교체하십시오.
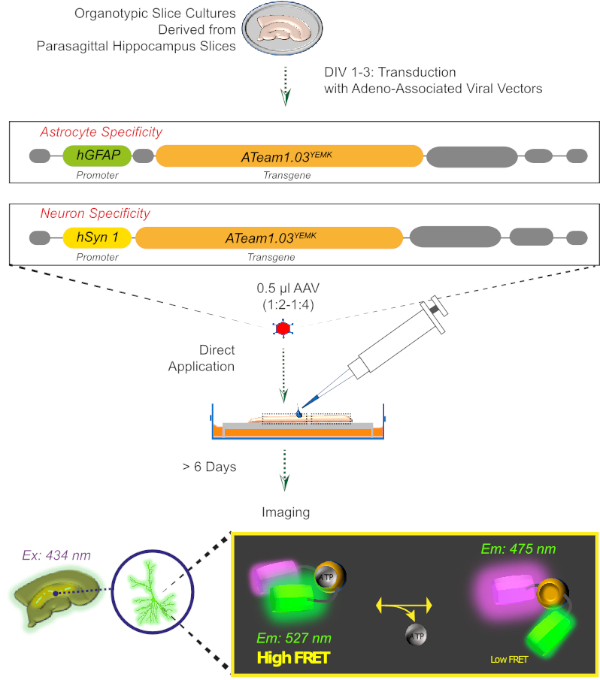
도 2: 유전자 인코딩센서 ATeam1.03YEMK를사용하여 배양된 organotypic 뇌 슬라이스에서 FRET 기반 ATP 이미징의 원리. 이 작업에 제시된 프로토콜의 개략적 표현입니다. 간략하게, 1-3일 동안 배양된 파라사조직성 오르가노티픽 슬라이스는, 아데노 관련 바이러스 벡터중 하나를 포함하는, 성상세포 특이적 hGFAP-또는 뉴런 특이적 hSyn-프로모터 및 ATeam1.03YEMK의발현을 위한 서열로 변환된다. 이러한 벡터의 희석 된 aliquots (1:2-1:4)는 슬라이스의 상단에 직접 적용되며, 이는 적어도 6 일 이상 배양 조건 하에서 유지됩니다. 세포내 ATP 수준의 변화는 434 nm에서 센서를 흥분시키고 527 (수용자) 및 475 (기증자) nm에서 동시에 형광 방출을 획득함으로써 센서를 표현하는 세포에서 시각화 될 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 아데노 관련 바이러스 벡터를 가진 ATP 센서의 표현(그림 2)
참고: 유전자 변형 생물의 처리에 대한 모든 요구 사항을 충족해야합니다!
- 바이러스 벡터를 처리하기 위해, aliquot 아데노 관련 바이러스 벡터(AAV2/5)를 1-2 μL에서 반복된 동결 및 해동을 피한다. 알리쿼트(aliquots)를 -80°C에 보관하십시오.
- 10% 표백제가 들어 있는 플라스크를 멸균 벤치에 놓고 벡터와 접촉한 사용된 모든 잔류 물질을 폐기합니다.
- 형질전환의 경우, DPBS의 2-3 μL로 벡터의 1 μL의 희석을 준비한다. 주식 용액은 일반적으로 mL 당 1012 바이러스 게놈 (vg /mL)의 크기에서 물리적 인 적규기를 나타낸다.
- 배양된 슬라이스가 포함된 인서트를 멸균 후드로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮
- 조직을 건드리지 않고 희석된 벡터의 0.5 μL을 각 슬라이스의 상단에 직접 적용합니다.
참고: 조직의 더 깊은 층에서 더 나은 발현은 시험관 내 1-3일 에서 배양된 슬라이스를 변환함으로써 수득된다(DIV). 이전 배양의 감전은 주변 신경교 흉터에 있는 세포의 우세한 표현 귀착될 지도 모르다 또는 뉴런에 있는 낮은 발현, 각각. - 마지막으로, 슬라이스를 인큐베이터에 다시 넣고 적어도 6 일 동안 유지하십시오. 변환 당일에 매체를 변경하지 마십시오.
4. 신경교 흉터 제거(그림 3)
- 실험을 시작하기 직전에 배양된 슬라이스가 들어 있는 인서트를 멸균 후드에 옮기고 OCT 배지 또는 MEM 1mL를 포함하는 30mm 접시에 넣습니다.
- 접시를 스테레오스코프 아래에 놓고 슬라이스 표면에 초점을 맞춥니다.
- 두 개의 멸균 피하 바늘(23G, 1")을 사용하여 선택한 슬라이스의 좁은 가장자리에서 짧은 크로스 컷을만듭니다(그림 3). 이 절차는 신경교 흉터에 의해 생성된 표면의 장력을 방출하여 후퇴시켜 기본 층을 노출시합니다(그림 5참조).
참고: 첫 번째 조직 층 (신경교 흉터)은 주로 반응성 성상 세포에 의해 형성됩니다. 광시야 영상에서, 이 조밀한 조직 층은 빛의 추가 산란귀착될 것이고, 흐릿한 심상 귀착됩니다. 흉터를 제거하는 것은 따라서 적절한 organotypic 조직을 포함하는 더 깊은 층의 더 나은 가시성을 얻는 것이 유리하다. 따라서, 단지 아래 조직을 손상하지 슬라이스 준비의 가장자리와 상부 층에서 독점적으로이 절단을 수행하도록주의하십시오. 우리는 흉터가없는 OTC (데이터가 표시되지 않음)에서 그와 신경교 흉터가있는 OTC에서 얻은 데이터 간의 차이를 관찰하지 않았습니다. - 준비된 슬라이스를 인서트를 제거합니다. 이를 위해 멸균 메스를 사용하여 멤브레인에 직선 병렬 컷을 만들어 핀셋으로 멤브레인의 가장자리를 유지하면서 중앙에 슬라이스가있는 사각형 또는 삼각형을 형성하여 절제하십시오. 삽입이 추가 슬라이스를 호스팅하는 경우 원래 플레이트로 다시 인큐베이터로 옮김을 전달합니다. 매질의 표면 장력은 멤브레인의 표면에 누출을 방지할 수 있습니다.
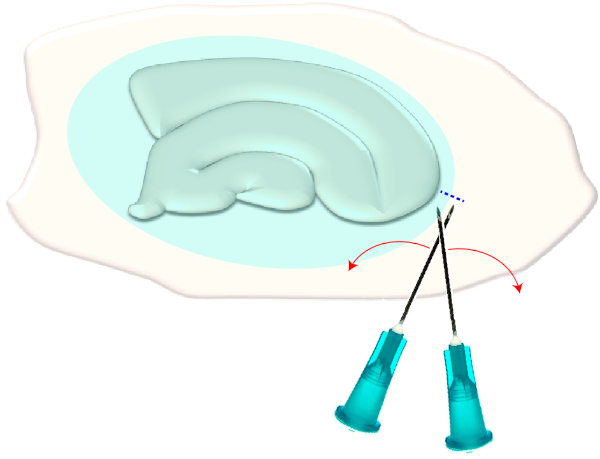
그림 3: 신경교 흉터의 기계적 제거에 대한 개략적 그림. 그림은 신경교 흉터 (푸른 타원)로 덮여 해마 슬라이스 문화를 보여줍니다. 한 번 문화의 가장 작은 극과 신경교 흉터 (파란색 파선)의 가장자리에 두 주사기 바늘의 끝을 전단하여 흉터가 옆으로 뒤집힙니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. FRET 기반 ATP 이미징(그림 4)
- 실험 전에, E-ACSF를 준비하고 7.4의 pH를 얻기 위해 적어도 30 분 동안 95 % O2/ 5 %CO2로 거품을 낸다. 단색화기의 형광광원(제논 램프)을 켭니다(그림4). 인큐베이터에서 슬라이스를 꺼내기 직전에 관류를 시작합니다.
참고: 전체 실험 동안 식염수 95%O2 및 5%CO2로 버블링된 상태를 유지합니다. - 연동 펌프를 사용하여 갓 카보겐화 된 E-ACSF로 지속적으로 관류되는 실험 챔버로 슬라이스를 옮니다(그림 4). 그런 다음 그리드로 슬라이스를 수정합니다. 챔버를 현미경 단계에 놓고 관류 시스템을 연결합니다. 관류에 가스 방지 실험실 튜브를 권장합니다.
참고: 실험은 실험 설계에 따라 실온 또는 생리적 온도 근처에서 수행될 수 있다. 관류 흐름의 안정성과 신뢰성을 확인하여 조직의 움직임 및/또는 전단 응력의 변화에 의해 유도된 초점의 변화를 방지합니다. 슬라이스 작업에 대한 표준 관류 속도, 우리와 다른 많은 실험실에 의해 사용, 1.5-2.5 mL / 분입니다.
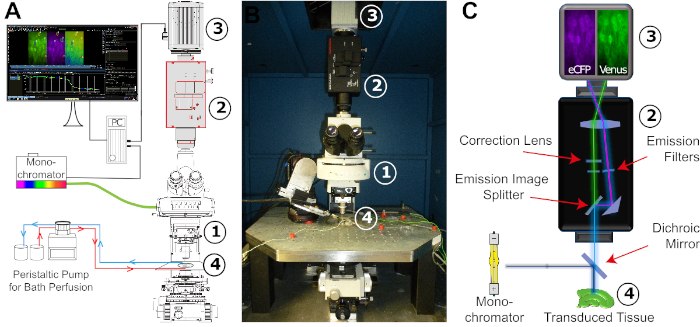
그림 4: FRET 이미징 설정의 구성. (A)FRET 이미징 설정에 필요한 다양한 구성 요소및 공간 배치에 대한 개략적 그림. 배열은 광원으로 크세논 램프가있는 단색화기, 직립 고정 단계 현미경 (1), 이미지 스플리터 시스템 (2), 타임 랩스 기록을위한 디지털 CCD 또는 CMOS 카메라 (3), 안정적인 상수 관류에 맞게 조정 된 실험 목욕 (4)으로 구성됩니다. 목욕 관류는 조정 가능한 유량의 연동 펌프에 의해 실현됩니다. (B)실험 작업 공간의 이미지입니다. FRET 이미징 설정은 x/y-번역 단계를 전달하는 진동 감쇠 테이블에 장착되어 실험용 욕조가 내장되어 있습니다. 숫자:(A)를참조하십시오. (C)단색화기에서 디지털 카메라로의 광 통로의 개략적 뷰. 표시된 것은 상이한 필터와 이색 거울의 위치이다. 숫자:(A)를참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 투과광을 사용하여 배양된 슬라이스를 초점으로 가져옵니다. 실험이 수행될 영역을 식별합니다(예: 해마의 CA1 영역). 이미징 실험을 시작하기 전에 슬라이스가 식염수 조건에 적응할 수 있도록 최소 15분 동안 기다립니다. 실험 설정의 구성은 그림 4를참조하십시오.
- 카메라와 이미징 소프트웨어를 켭타. 그런 다음 적절한 필터 큐브를 선택합니다.
- 435/17 nm(~435 nm)에서 공여체 형광 단백질(eCFP)을 자극한다. 노출 시간을 40~90ms 로 설정합니다.
참고: 형광등에 슬라이스를 강하게 노출하면 광독성 효과가 발생할 수 있습니다. - 435 nm에서 의 흥분은 475 nm (eCFP; 기증자) 및 527 nm (금성; 수용자)에서 방출됩니다. 방출 이미지 스플리터로 500 nm에서 형광 방출을 분할하고 483/32 및 542/27에서 밴드 패스 필터를 사용하여 기증자 및 수용자 형광을 추가로 분리합니다. 발현이 강하면 검출기의 채도가 높아질 수 있습니다. 이 경우 중립 밀도 필터를 사용하여 여기의 강도를 줄일 수 있습니다.
- 배경 빼기에는 셀룰러 형광이 없는 관심 영역(ROI)을 선택합니다. 그런 다음 ROI 를 생성하여 셀 바디를 삭제합니다.
- 이미지 수집 빈도와 전체 녹화 시간을 설정합니다. 긴(>30분) 실험의 경우 광독성을 방지하기 위해 0.2-0.5Hz의 획득 주파수를 권장합니다.
- 레코딩을 시작합니다. 준비의 안정성을 보장하기 위해 기준 조건하에서 적어도 5 분 을 기록하는 것이 좋습니다.
참고: 필요한 경우 레코딩 중에 셀의 초점을 조정합니다. - 세포내 ATP의 변화를 유도하기 위해, 관류 튜브를 표준 ACSF에서 대사 억제제가 함유된 식염수로 옮긴다(예: CIS, 표 1 및 아래 참조). 또는, 활성 뉴런에서 칼륨의 방출을 모방하기 위해 높은 칼륨 농도와 식염수를 사용합니다.
참고: 목욕 관류에 의한 적용은 전 세계적으로 전체 준비에 작용하는 비교적 느린 과정입니다. 새로운 솔루션이 실제로 실험용 욕조에 들어가기 시작한 시간을 기록해 둡을 기록해 둡을 기록해 둡을 살펴보세요. 챔버와 식염수의 저장소 사이의 거리뿐만 아니라 관류의 속도에 따라 지연 시간을 고려해야합니다.
6. 셀룰러 ATeam 형광의 고해상도 문서
- 기록 직후, 슬라이스 배양을 포함하는 기록 챔버를 공초점 레이저 스캔 현미경으로 옮김을 전달한다.
참고: 특별한주의를 기울이십시오. 잠재적인 광손상으로 인해 실험 후에만 이 단계를 수행합니다. 문서화를 위해 E-ACSF를 H-ACSF와 교환할 수 있습니다. 따라서 관류 시스템이 반드시 필요한 것은 아닙니다. - 지정된 광학 구성에서 가능한 가장 높은 z 해상도로 z 스택을 사용하십시오.
- 데선볼루션 알고리즘을 적용하여 이미지 해상도를 높입니다.
결과
AAV 벡터는 살아있는 조직16내의 세포에서 외래 유전자를 선택적으로 발현하는 신뢰할 수 있는 도구이다. ATeam1.03YEMK 및 특정 프로모터의 서열 카세트를 함유하는 AAV의 직접 적용은 선택된 세포 유형에서 센서의 높은 발현을 초래한다. DIV 14 (전이 후 ~ 10 일) 인간 시냅신 프로모터 하에서 ATeam을 발현하는 뉴런은 슬라이스 표면 아래 최대 50 μm의 깊이에서 배양 된 조직 슬라이스의 신피질에서 고밀도로 발견됩니다(그림 5A). 비교 가능한 결과는 해마에서 달성될 수있다(도 5B).
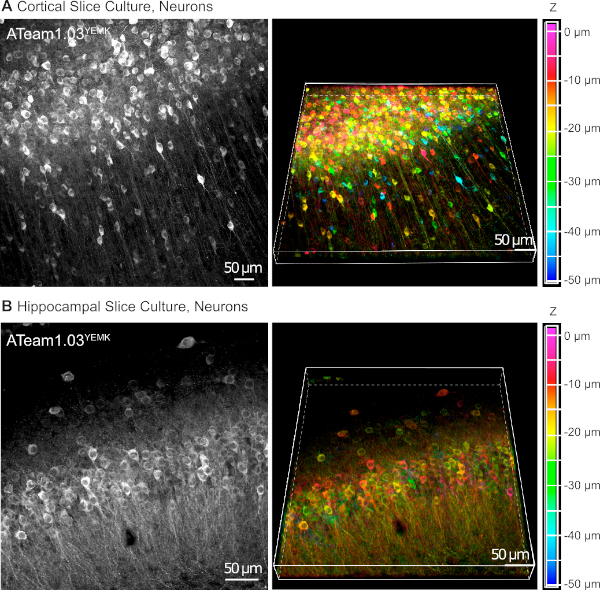
그림 5: 배양된 기생충 뇌 슬라이스에서 ATeam1.03YEMK를 발현하는 뉴런의 시각화. 왼쪽의 이미지는 해마 조직의 피질조직(A)및(B)70개의 광학 섹션(각각 0.6 μm)의 43개의 광학 섹션(각 1.05 μm)의 확장된 초점 투영에 해당한다. 오른쪽 이미지는 동일한 투영의 볼륨 뷰를 나타냅니다. 셀은 오른쪽의 색상 축척에 의해 표시된 대로 슬라이스 표면을 기준으로 깊이에 따라 색상으로 구분됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
성상 세포에서 ATP 수준의 측정을 위해, ATeam1.03YEMK는 인간 신경교 섬유성 단백질(GFAP) 프로모터의 제어 하에 발현된다. 이것은 배양된 조직 조각의 신피질 및 해마 둘 다에 있는 세포의 능률적인 transduction 결과(그림 6). 특히, 슬라이스 제제의 표면에 비해 깊이에 따라 두 개의 상이한 형태학적 표현형이 구별될 수 있다. 첫 번째, 표면 층에서, 세포는 주로 표면에 병렬로 배열되는 두꺼운 기본 프로세스를 특징으로한다. 이 세포는 명백하게 반응성 성상 세포의 조밀한 메쉬워크를 만드는 강하게 겹치는 도메인을 전시합니다(그림 6). 더 깊은 층 (표면에서 30-60 μm)에서, 트랜스 듀룩 성상 세포는 크게 구형 도메인을 형성하는 미세 한 세포 과정을 전시하고 그들의 형태는이전보고로 그 안에 성상 세포의 유사19,20, 21 (그림 6). 더 깊은 층 성상 세포의 더 나은 transduction을 얻기 위하여 는 이 더 깊은 층에 더 나은 광학 접근, 신경교 흉터 조직은 단계 4에서 기술한 것과 같이 제거될 수 있습니다.
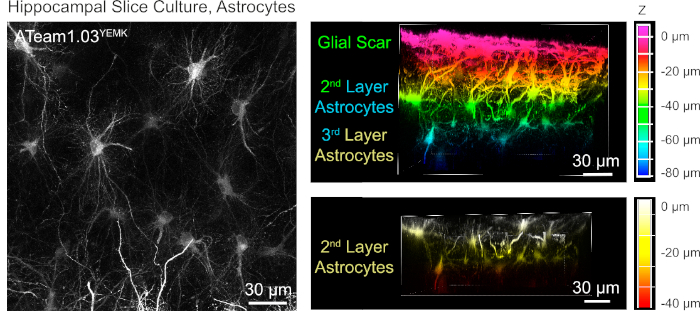
그림 6: 배양된 기생충 성모 뇌 슬라이스에서 ATeam1.03YEMK를 발현하는 성상 세포의 시각화. 왼쪽의 이미지는 191개의 광학 섹션(각각 0.45 μm)의 확장된 초점 투영에 해당합니다. 그림의 목적을 위해, 신경교 흉터는 성상 세포의 투영에서 제외되었다. 오른쪽 이미지는 신경교 흉터를 제거하기 전과 후에 동일한 투영의 볼륨 뷰를 나타냅니다. 셀은 오른쪽의 색상 축척에 의해 표시된 대로 슬라이스 표면을 기준으로 깊이에 따라 색상으로 구분됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
ATeam1.03YEMK의 성공적인 발현은 사용된 프로모터에 따라 뉴런 또는 성상 세포에서 ATP 수준의 변화의 동적 측정을 허용합니다(위 참조). 실험은 E-ACSF로 지속적으로 공류된 실험용 욕조에서 수행하였다(95%O2/5%CO2로버블링). 해마 뉴런에서 ATeam1.03YEMK를 발현하는 오르노티픽 슬라이스에서, 관심 영역(ROI)을 기록을 시작하기 전에 선택하였고, 피라미드 세포의 소마타를 나타내고(도7A). 또한 배경 빼기 영역이 선택되었습니다(그림7A). eCFP 형광뿐만 아니라 금성의 방출은 이들 각각의 ROI에 대해 별도로 수집된 후 시간에 따라 형광 방출 수준으로 도시하였다(도7B). 안정한 기준선을 보장하기 위해 몇 분 동안 조절 조건 하에서 형광을 기록한 후, 5 mM 나트륨 아지드(NaN3)를1분 동안 첨가한 포도당 프리 식염수에 슬라이스 제제를 노출시킴으로써 세포 대사를 억제하였다(도7B). 이러한 조작은 FRET 쌍의 방출 강도(도7B,좌측 패널)의 반대 변화, 금성(527 nm)의 감소 및 eCFP(475 nm) 방출의 증가와 함께 유도되었다. eCFP(F 금성/F eCFP)의 광석 방출을 eCFP(F금성/FeCFP)로나누어 FRET 비율을 계산하면 세포내 ATP 수준에서 상대적 변화를 반영하는 신호가 생성되었고, 소위 "ATeam FRET 비율"(그림7B,오른쪽 패널). 모든 기록된 뉴런(N = 70개의 N =5슬라이스의 세포)에서 NaN3는 세포 대사를 억제할 때 세포내 ATP 수치의 가역적 감소를 나타내는 ATeam FRET 비율의 가역적 감소를 일으켰다.
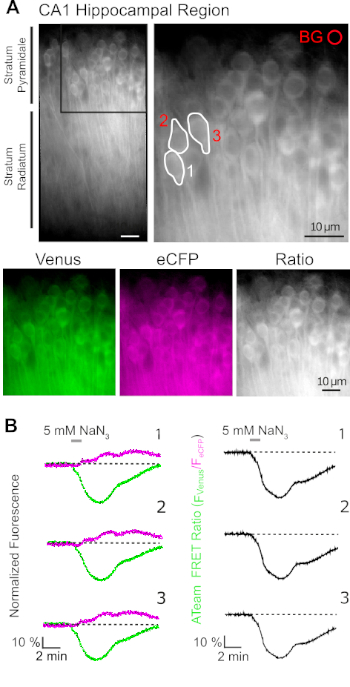
그림 7: 타임랩스 ATeam FRET 비율 이미징의 데모. (A)왼쪽 위: 뉴런에서 ATeam1.03YEMK를 발현하는 배양된 오르가노티픽 해마 슬라이스의 CA1 영역의 피라미드층 및 지층 라디툼의 광야 형광 이미지. 오른쪽 상단: 왼쪽에 표시된 대로 박스섹션의 확대보기입니다. 백색선은(B)에서분석을 위해 선택된 CA1 피라미드 뉴런의 세포체를 나타내는 관심 영역(ROIs) 1-3을 묘사한다. BG는 배경 보정을 위해 선택한 ROI를 나타냅니다. 아래: 금성(녹색), eCFP(보라색) 및 금성/eCFP의 비율을 나타내는 가짜 색 이미지. (B)신경 세포 체를 나타내는 ROIs 1-3의 시간 경과 기록(A참조). 좌측의 트레이스는 금성(녹색) 및 eCFP(마젠타)의 정규화된 형광 방출을 보여준다. 오른쪽의 트레이스는 해당 ATeam FRET 비율을 표시합니다. 1분 동안 세포외 포도당이 없는 상태에서 5 mM NaN3을 가진 관류는 ATeam FRET 비율의 가역적 감소를 유도하여 세포내 ATP 농도의 감소를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
장기 실험 조건하에서 제제 및 센서의 안정성을 보장하기 위해, 뉴런 또는 성상 세포에서 ATeam을 발현하는 슬라이스는 장시간 ACSF와 지속적으로 관류하였다(>50 분; n = 각 세포, N = 3개의 뇌에서 3개의 OTC). 이러한 조건하에서, ATeam FRET 비율은 변경되지않았다(그림 8). 대사 억제제("화학 허혈", 표 1참조)를 함유하는 CIS에 제제를 노출시키는 것은 대조적으로, 위에서 관찰된 바와 같이 ATeam FRET 비율의 예상 하락을 초래하였다.
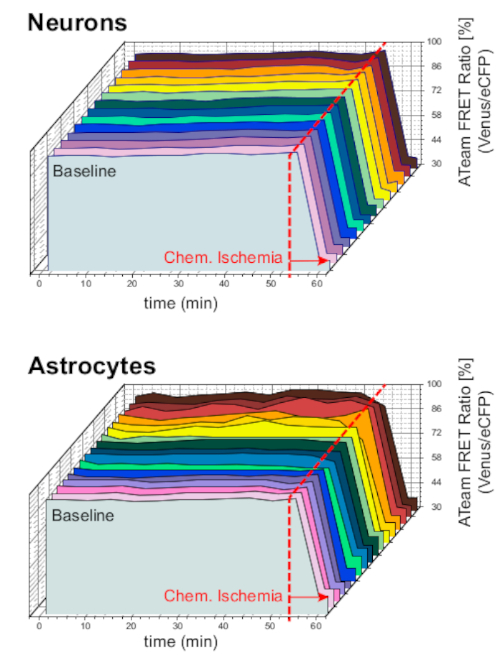
그림 8: ATeam을 사용하는 기준선 실험. 뉴런 (상단) 및 성상 세포 (아래)의 기준선 조건 하에서 14 개의 다른 세포에서 장기 ATeam FRET 비율 이미징. 데이터는 다른 실험 데이터와 유사한 조건에서 촬영되었습니다. 각 측정의 끝에서, 화학 허혈은 화살표에 의해 표시된 바와 같이 CIS와 관류에 의해 유도되었다. 참고: 기준선 ATeam FRET 비율은 기준 선 조건하에서 시간이 지남에 따라 안정적입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
다음으로, 세포외 칼륨 농도의 증가로 ATeam1.03YEMK를 발현하는 뉴런및 성상세포의 반응을 분석했습니다. 안정한 기준선을 확립한 후, 뉴런은 칼륨 농도가 3분 동안 3~8 mM으로 증가시킨 식염수로 관과하여(도9A). 그러나 이 조작은 ATeam FRET 비율(N = 5개의 슬라이스에서 n = 56셀)에서 감지 가능한 변경을 초래하지 않았습니다. 센서가 ATP 수준의 변화에 반응하도록 하기 위해, 슬라이스는 CIS에 의해 E-ACSF를 대체하여 유도된 화학 적 허혈의 지속적인 기간에 다시 노출되었습니다. 화학적 허혈은 ATeam FRET 비율이 새롭고 안정된 수준으로 급격히 감소하여 2-3분 후 ATP의 명목 고갈을나타냅니다(그림 9A).
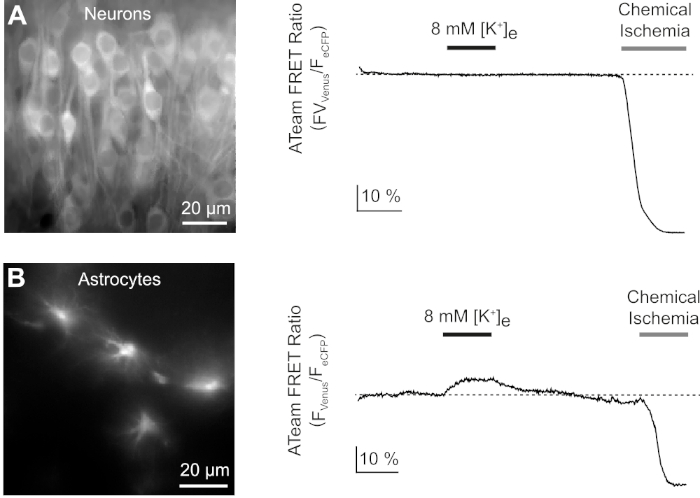
그림 9: 뉴런및 성상세포에서 ATP 수준의 변화를 보여주는 대표적인 실험. (A,B):왼쪽의 이미지는 오르가노티픽 슬라이스의 해마 CA1 영역에 위치한 뉴런과 성상세포로부터 ATeam 형광을 보여줍니다. 오른쪽의 트레이스는 단일 세포 체 위에 위치된 ROI로부터 얻은 ATeam FRET 비율의 타임랩스 기록을 나타냅니다. 두 실험에서, 슬라이스는 먼저 세포외 칼륨 농도의 증가를 3분 동안 실시하였다(바 참조), 화학적 허혈에 대한 최종 노출. 뉴런이 세포외 칼륨(A)의상승에 반응하지 않는 동안, 성상 세포는 ATP(B)의증가와 함께 반응합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
동일한 실험 프로토콜은 ATeam1.03YEMK가 성상 세포로 표현된 슬라이스로 수행되었습니다. 뉴런에서 관찰된 것과는 대조적으로, 성상세포는 ATeam FRET 비율의 가역적 증가에 의해 세포외 칼륨의 증가에 반응하여, 세포내 ATP 수치의 증가를 나타낸다(N = 5슬라이스의 70세포)(그림 9B). 화학 적 허혈에 대한 후속 노출은 예상대로 ATeam FRET 비율의 큰 하락으로, 세포 내 ATP의 명목 고갈을 나타냅니다(그림 9B).
토론
여기서, 마우스 뇌의 골상세포 또는 뉴런에서 ATP 수준의 변화를 측정하기 위한, FRET 기반의 유전자 부호화나노센서(14)인ATeam1.03YEMK의세포형 특이적 발현에 대한 시술을 입증한다15. 예시적인 기록에서, 우리는 세포 외 칼륨 농도의 증가가 뉴런의 ATP 농도의 변화를 초래하지 않는다는 것을 보여주고, 성상 세포 ATP 수준은 이 조작에 응하여 상승합니다. 더욱이, 우리의 결과는 세포 대사의 억제시, ATeam1.03YEMK FRET 비율이 두 세포 유형 모두에서 급격히 감소한다는 것을 입증하여 세포 내 ATP의 급격한 감소를 나타낸다.
오르노티픽 슬라이스 배양물에서 ATeam1.03YEMK의 발현은 적어도 7-10일 동안 조절된 조건 하에서 배양중인 조직의 유지를 필요로 한다. 대안적으로, ATeam1.03YEMK는 또한 급성 으로 단리된 뇌 조직 슬라이스 및 마우스13,15의시신경에서 ATP의 측정을 위해 사용될 수 있다. 그러나 급성 으로 분리 된 조직에서 측정, 유전자 변형 동물의 생성 또는 뇌에 바이러스 벡터의 입체 응용 프로그램을 필요로, 동물 실험 및 엄격한 동물 관리 프로토콜을 포함. 이와 관련하여, ATeam1.03YEMK 발현은 오르노티픽 조직 슬라이스 배양에서 유용하고 가치 있는대안(22,23)을나타낸다. 몇 년 동안, organotypic 조직 슬라이스 배양은 신경 특성, 연결 성 및 개발24,25,26을연구하는 확립 된 모델 시스템으로 서용을 한다. 이들은 일반적인 조직 구조 및 적층(그림1)을유지할 뿐만 아니라 우수한 접근성 및 실험 조건의 직접 제어와 같은 세포 배양의 우대 특성을 숙주한다. Organotypic 조직 슬라이스 배양은 또한 바이러스벡터(27)를이용하여 외국 유전자를 발현하기 위해 일상적으로 사용된다. 바이러스 벡터의 몇몇 모형은 뇌 조직으로 종족을 전달하기 위하여 보고되었습니다16,28. 아데노바이러스 벡터는 신경교 세포에서 높은 발현을 유도하지만, 해마뉴런(16)은아니며, 신경교반응성(17)을생성할 수 있다. 여기서 사용되는 아데노-관련 바이러스 벡터는 좋은대안(15)으로등장하고, 그 효과는 또한생체내 29에서나타났다.
주로 신경 특성의 연구에 사용 되 고 하는 동안, 최근 연구는 organotypic 조직 슬라이스 배양 또한 성상 세포의 분석에 대 한 고용 될 수 있다 설립. 배양된 슬라이스는 일반적으로 반응성 성상 세포층 층(19,30)에 의해 커버되지만, 성상세포는 더 깊은층19,30(그림 5)에서보다 네이티브, 비반응성 형태 및 세포아키텍처를 나타낸다. 본 연구에서, 우리는 적절한 organotypic 조직 층 내에서 네이티브 성상 세포의 더 나은 실험 및 광학 접근성을 초래하는 외부 신경교 흉터의 기계적 제거를위한 절차를 설명합니다. 더욱이, 그것의 제거는 organotypic 조각의 더 깊은 층에서 발현 효험을 향상시킨다; 신경교 흉터가 제거되지 않으면 AAV에 의한 전이가 피상적 세포 층으로 제한되는 경향이 있습니다.
조직 조각에서 실험을 수행 할 때 몇 가지 외부 기계적 요인을 고려해야합니다. 목욕 관류 속도의 변화는 전체 준비의 움직임을 유도하거나 초점의 변화를 유도하여 센서 신호의 인위적인 과도 변화를 초래할 수 있습니다. 더욱이, 성상세포및 뉴런 모두 높은 관류율32,33에의해 부과되는 기계적 변형에 반응하는 것으로 보고되었다. 우리의 손에, 신뢰할 수있는 연동 펌프를 사용하여, 조직과 목표 사이의 식염수의 작고 안정적인 볼륨을 유지와 함께 (반월 상 연골) 여기에 사용되는 관류 속도에서 기준 선 조건 하에서 안정적인 FRET 신호 결과 (1.5-2.5 mL / 분; 그림 8).
본 연구에서, 우리는 또한 ATeam1.03YEMK를 가진 FRET 기지를 둔 화상 진찰이 뉴런과 성상 세포에 있는 ATP 수준을 감시하기 위하여 이용될 수 있다는 것을 보여줍니다. 세포 ATP의 측정을 위해 이전에 도입된 대안수단은 소위 루시페린-루시퍼라아제분석분석34,35,36,37이다. 그러나 이 접근법은 생물 발광의 이미징을 기반으로 하며 배경 소음 수준이 높기 때문에 다소 낮은 시간및 공간 해상도를 제공합니다. 최근 몇 년 동안 일상적으로 사용되는 또 다른 방법은 이온에 민감한 플루오로포레 마그네슘 그린38,39,40을이용하여 세포내 마그네슘 농도의 변화를 이미징하는 것이었다. 이 접근법은 ATP를 섭취하면 마그네슘의 공동 인자 방출이 초래한다는 관측과 관련이 있습니다. 마그네슘 녹색으로 이미징하면 ATP 수준의 변화에 대한 보조 추정치만 제공합니다. 또한, 마그네슘 그린은 세포내 칼슘의 변화에 민감하며, 이 방법으로 얻은 결과를 해석할 때 또 다른 어려움을 초래합니다.
세포 대사 산물의 직접 이미징을위한 유전자 부호 화 된 나노 센서의 최근 개발, 따라서, 앞으로 큰 단계를 나타냈다11,12. 세포내 ATP36,41, 42,43의측정에 사용할 수 있는 여러 개의 상이한 센서가 생성되었다. 그 중 에는 ATP:ADP 비율42를감지하는 PercevalHR뿐만 아니라 비율메트릭 형광 ATP 표시기 "QUEEN"(41)이 있습니다. 후자의 프로브는 세포의 에너지 상태를 연구하는 데 유용한 도구이지만 pH42의변화를 동시에 측정해야합니다.
ATeam은 여러 변종이 존재하는 나노 센서로 ATP14에대한 구속적 친화성이 다릅니다. 시험관내에서, ATeam1.03YEMK는 37°C에서 1.2 mM의 Kd를 나타내며, 이는 시상하부 및 소뇌34에서 해마37,44,45에이르는 상이한 뉴런 세포 유형에서 결정된 세포 ATP 수준에 가깝다. 큐벳 측정에서 온도를 10°C로 낮추면 ATeam1.03YEMK에서 ATP로의 결합 친화도가 현저하게 감소하여 실온14에서세포 이미징에 적합하지 않을 수 있음을 시사합니다. 그러나 우리의 이전 연구15는,다른 조작에 신경과 성상 세포에서 표현된 ATeam1.03YEMK의 행동 그리고 반응이 거의 생리적 및 실온에서 유사하다는 것을 보여주었습니다, 센서가 두 조건 하에서 세포 내 ATP 수준의 믿을 수 있는 측정을 허용한다는 것을 나타내는. 또한, 우리의 이전 실험은 세포내부발현ATeam1.03YEMK의 pH 민감도를 해결하되, 약 0.1-0.2 pH 단위로 세포내 pH의 변화에 민감하지 않음을 나타냈다. 낮은 mM 범위의 Kd가 우려되는 경우, 대체 ATeam 변형이14,그 중 ATeam ("GO-ATeam")의 적색 변종 ("GO-ATeam")의14를사용할 수 있습니다.
ATeam1.03YEMK를 사용한 실험은 세포외 칼륨 농도가 3mMM에서 8mM까지만 증가하면 Organotypic 슬라이스 배양에서 성상 세포에서 ATeam1.03YEMK 비율이 일시적으로 증가한다는 것을 보여줍니다. 이 관찰은 이전 연구15,46을 확인하고 명확하게 성상세포가 ATP 생산의 증가와 활성 뉴런에 의해 칼륨의 방출에 반응한다는 것을 나타냅니다, 대부분 가능성이 Na+/ K+-ATPase및 Na+HCO3의자극의 결과로- cotransporter, 각각47,48. 이와 는 대조적으로, 뉴런은 이전 작업뿐만 아니라15와일치하는 응답을 보여주지 않았다. 그러나 두 세포 유형모두, 15일이전에 도시된 바와 같이 세포 당해 및 미토콘드리아 호흡의 억제에 신속하고 강하게 반응한다. 화학 허혈의 조건에서, ATeam FRET 비율은 세포 ATP의 명목 고갈을 나타내는 새로운 안정 수준으로 떨어졌다. 후자의 결과 제안 두 신경 세포 뿐만 아니라 성상 세포 는 또한 시 냅 스 활성화 또는 신경 전달 물질의 응용 프로그램에 의해 추가 자극 없이 정상 상태 조건 하에서 ATP의 관련 소비를 전시. 종합하면, 우리는 유전자 인코딩 된 나노 센서를 가진 FRET 기반 이미징, 그 중 ATeam1.03YEMK,다른 조건하에서 세포 내 ATP 수준 및 세포 ATP 소비의 변화에 대한 책임이있는 세포 과정을 해명하는 귀중한 접근 방식을 제공 할 것이라고 결론을 내렸다.
공개
저자는 경쟁적인 이익을 선언하지 않습니다. 저자는 비디오 기사에 사용되는 악기를 생산하는 니콘 현미경 솔루션, 뒤셀도르프, 독일에 의해 오픈 액세스 출판을 가능하게 재정 지원을받았다. 이 회사는 여기에 제시된 실험이나 실행, 데이터 처리 또는 원고 작성에 관여하지 않았습니다.
감사의 말
저자는 전문 기술 지원에 대한 클라우디아 로데리고와 시몬 듀리에게 감사드립니다. 니클라스 제이 게르카우 박사와 조엘 넬슨 M.Sc 오르가노티픽 슬라이스 문화를 준비하는 데 도움을 주신 것에 감사드립니다. 저자의 실험실에서 연구는 독일 연구 협회에 의해 투자되었다 (DFG; 2795년: Ro 2327/13-1 및 SPP 1757: Ro 2327/8-2 에서 CRR; 및 SPP 1757: RL에 젊은 Glia 스타트업 자금).
자료
| Name | Company | Catalog Number | Comments |
| 2-deoxyglucose | Alfa Aesar | L07338 | Non-metabolizable glucose analog |
| 36-IMA-410-019 Argon laser | Melles Griot | 488 nm wavelength argon | |
| Ascorbic acid | Carl Roth | 3525.1 | Antioxidant, Vitamin C |
| band pass filters 483/32 | AHF Analysentechnik AG | Splitter compatible emmision filter | |
| band pass filters 542/27 | AHF Analysentechnik AG | Splitter compatible emmision filter | |
| Beamsplitter T 455 LP | AHF Analysentechnik AG | Excitation dichroic mirror | |
| Beamsplitter T 505 LPXR | AHF Analysentechnik AG | Splitter dichroic | |
| Confocal laser scannig microscope C1 | Nikon Microscope Solutions | Modular confocal microscope system C1 | |
| Data processing Origin Pro 9.0.0 (64-bit) | OriginLab corporation | Scientific graphing and data analysis software | |
| D-glucose monohydrate | Caelo | 2580-1kg | |
| DPBS | GIBCO/Life | 14190250 | Dulbecco's phosphate-buffered saline |
| Eclipse E 600FN upright microscope | Nikon Microscope Solutions | ||
| Eclipse FN1 upright microscope | Nikon Microscope Solutions | ||
| Experimental chamber | custom build | Perfusion chamber for live-cell imaging | |
| EZ-C1 Silver Version 3.91 | Nikon Microscope Solutions | Imaging software for confocal microscope | |
| Hanks' Balanced Salt solution | Sigma-Aldrich | H9394 | With Phenol Red for pH monitoring |
| HERAcell 150 | Thermo Scientific | CO2 incubator HERAcell ® 150 with decontamination routine | |
| HERAsafe KS/KSP | Thermo Scientific | Safety Cabinet | |
| Horse serum | GIBCO/Life | 26050088 | Heat inactivated |
| Huygens Professional | SVI Imaging | Deconvolution software | |
| Image J 1.52i | Wayne Rasban national Institute of Health | Image processing Software available in the public domain | |
| Insulin | Sigma-Aldrich | I6634 | Insulin from bovine pancreas |
| IP serie peristaltic pump | Ismatec | High-precisionmulti-channel pump | |
| Layout software, Illustrator CS6 | Adobe | Vector graphics editor | |
| L-glutamine | GIBCO/Life | 25030024 | |
| Microm HM 650 V | Thermo Scientific | Vibration microtome. Thermo scientific discontinued the production of the device in the meantime. Any other slicer or tissue chopper siutable for slicing living tissue is fine, too. | |
| Microscope stage | custom build | ||
| Microsoft Excel 16 | Microsoft | Spreadsheet software for basic data processing | |
| Millicell culture insert | Merck Millipore | PICM0RG50 | Hydrophilized PTFE, pore size 0.4 μm |
| Minimum Essential Medium Eagle | Sigma-Aldrich | M7278 | Synthetic cell culture media |
| Monochromator Polychrome V | Thermo Scientific/FEI | Ultra fast switching monochromator | |
| NaN3 (Sodium Azide) | Sigma-Aldrich | S-8032 | Mitochondrial inhibitor (complex IV inhibitor). CAUTION: Azide is toxic. Be aware not to accidentally ingest or inhale it, and prevent ist absoption through the skin. |
| Nikon Fluor 40x / 0.80 W DIC M ∞/0 WD 2.0 | Nikon Microscope Solutions | Water Immersion Microscope Objective | |
| NIS Elements 4.50 advanced Research | Nikon Microscope Solutions | Imaging software. Upgraded version for FRET imaging | |
| ORCA-Flash4.0 | Hamamatsu Photonics | Digital CMOS camera | |
| Perfusion tubing | Pro Liquid GmbH | Tygon tubing, 1.52 x 322 mm (Wd: 0.85) | |
| Photoshop CS 6 Version 13.0 | Adobe | Image processing software | |
| Sodium L-lactate | Sigma-Aldrich | 71718-10G | |
| ssAAV-2/2-hSyn1-ATeam1.03YEMK-WPRE-hGHp(A) | ETH Zürich | v244 | Single-stranded AAV vector that induces the expression of ATeam1.03YEMK under the control of the human synapsin 1 promoter fragment hSyn1. |
| ssAAV-5/2-hGFAP-hHBbI/E-ATeam1.03YEMK-WPRE-bGHp(A) | ETH Zürich | v307 | Single-stranded AAV vector that induces the expression of ATeam1.03YEMK under the control of the human glial fibrillary acidic protein promoter fragment ABC1D. |
| WVIEW GEMINI optic system | Hamamatsu Photonics | Emission Image Splitter |
참고문헌
- Sweadner, K. J. Isozymes of the Na+/K+-ATPase. Biochimica et Biophysica Acta. 988, 185-220 (1989).
- Clapham, D. E. Calcium signaling. Cell. 131, 1047-1058 (2007).
- Cotter, K., Stransky, L., McGuire, C., Forgac, M. Recent Insights into the Structure, Regulation, and Function of the V-ATPases. Trends in Biochemical Sciences. 40, 611-622 (2015).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75, 762-777 (2012).
- Brown, A. M., Ransom, B. R. Astrocyte glycogen and brain energy metabolism. Glia. 55, 1263-1271 (2007).
- Hertz, L., et al. Roles of astrocytic Na+,K+-ATPase and glycogenolysis for K+ homeostasis in mammalian brain. Journal of Neuroscience Research. 93, 1019-1030 (2015).
- Allaman, I., Belanger, M., Magistretti, P. J. Astrocyte-neuron metabolic relationships: For better and for worse. Trends in Neurosciences. 34, 76-87 (2011).
- Barros, L. F., Deitmer, J. W. Glucose and lactate supply to the synapse. Brain Research Reviews. 63, 149-159 (2010).
- Diaz-Garcia, C. M., et al. Neuronal Stimulation Triggers Neuronal Glycolysis and Not Lactate Uptake. Cell Metabolism. 26, 361-374 (2017).
- Diaz-Garcia, C. M., et al. Quantitative in vivo imaging of neuronal glucose concentrations with a genetically encoded fluorescence lifetime sensor. Journal of Neuroscience Research. 97, 946-960 (2019).
- Barros, L. F., et al. Current technical approaches to brain energy metabolism. Glia. 66, 1138-1159 (2018).
- Tantama, M., Hung, Y. P., Yellen, G. Optogenetic reporters: Fluorescent protein-based genetically encoded indicators of signaling and metabolism in the brain. Progress in Brain Research. 196, 235-263 (2012).
- Trevisiol, A., et al. Monitoring ATP dynamics in electrically active white matter tracts. eLife. 6, e24241(2017).
- Imamura, H., et al. Visualization of ATP levels inside single living cells with fluorescence resonance energy transfer-based genetically encoded indicators. Proceedings of the National Academy of Sciences of the United States of America. 106, 15651-15656 (2009).
- Lerchundi, R., et al. FRET-based imaging of intracellular ATP in organotypic brain slices. Journal of Neuroscience Research. , 1-13 (2018).
- Ehrengruber, M. U., et al. Gene transfer into neurons from hippocampal slices: comparison of recombinant Semliki Forest Virus, adenovirus, adeno-associated virus, lentivirus, and measles virus. Molecular and Cellular Neurosciences. 17, 855-871 (2001).
- Woo, J., et al. Functional Characterization of Resting and Adenovirus-Induced Reactive Astrocytes in Three-Dimensional Culture. Experimental Neurobiology. 26, 158-167 (2017).
- Close, B., et al. Recommendations for euthanasia of experimental animals: Part 2. DGXT of the European Commission. Laboratory Animals. 31, 1-32 (1997).
- Benediktsson, A. M., Schachtele, S. J., Green, S. H., Dailey, M. E. Ballistic labeling and dynamic imaging of astrocytes in organotypic hippocampal slice cultures. Journal of Neuroscience Methods. 141, 41-53 (2005).
- Lanjakornsiripan, D., et al. Layer-specific morphological and molecular differences in neocortical astrocytes and their dependence on neuronal layers. Nature Communications. 9, 1623(2018).
- Bushong, E. A., Martone, M. E., Ellisman, M. H. Examination of the relationship between astrocyte morphology and laminar boundaries in the molecular layer of adult dentate gyrus. The Journal of Comparative Neurology. 462, 241-251 (2003).
- Frotscher, M., Zafirov, S., Heimrich, B. Development of identified neuronal types and of specific synaptic connections in slice cultures of rat hippocampus. Progress in Neurobiology. 45, vii-xxviii (1995).
- Galimberti, I., et al. Long-term rearrangements of hippocampal mossy fiber terminal connectivity in the adult regulated by experience. Neuron. 50, 749-763 (2006).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37, 173-182 (1991).
- Forster, E., Zhao, S., Frotscher, M. Laminating the hippocampus. Nature Reviews. Neuroscience. 7, 259-267 (2006).
- Holopainen, I. E. Organotypic Hippocampal Slice Cultures: A Model System to Study Basic Cellular and Molecular Mechanisms of Neuronal Cell Death, Neuroprotection, and Synaptic Plasticity. Neurochemical Research. 30, 1521-1528 (2005).
- Teschemacher, A. G., et al. Targeting specific neuronal populations using adeno- and lentiviral vectors: applications for imaging and studies of cell function. Experimental Physiology. 90, 61-69 (2005).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Advances in Genetics. 87, 125-197 (2014).
- Mächler, P., et al. In Vivo Evidence for a Lactate Gradient from Astrocytes to Neurons. Cell Metabolism. 23, 94-102 (2016).
- Schreiner, A. E., Berlinger, E., Langer, J., Kafitz, K. W., Rose, C. R. Lesion-Induced Alterations in Astrocyte Glutamate Transporter Expression and Function in the Hippocampus. ISRN Neurology. 2013, 893605(2013).
- Haber, M., Zhou, L., Murai, K. K. Cooperative astrocyte and dendritic spine dynamics at hippocampal excitatory synapses. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 26, 8881-8891 (2006).
- Neary, J. T., Kang, Y., Tran, M., Feld, J. Traumatic injury activates protein kinase B/Akt in cultured astrocytes: role of extracellular ATP and P2 purinergic receptors. Journal of Neurotrauma. 22, 491-500 (2005).
- Xia, J., et al. Neurons respond directly to mechanical deformation with pannexin-mediated ATP release and autostimulation of P2X7 receptors. The Journal of Physiology. 590, 2285-2304 (2012).
- Ainscow, E. K., Mirshamsi, S., Tang, T., Ashford, M. L., Rutter, G. A. Dynamic imaging of free cytosolic ATP concentration during fuel sensing by rat hypothalamic neurones: evidence for ATP-independent control of ATP-sensitive K+ channels. The Journal of Physiology. 544, 429-445 (2002).
- Arcuino, G., et al. Intercellular calcium signaling mediated by point-source burst release of ATP. Proceedings of the National Academy of Sciences of the United States of America. 99, 9840-9845 (2002).
- Rajendran, M., Dane, E., Conley, J., Tantama, M. Imaging Adenosine Triphosphate (ATP). The Biological Bulletin. 231, 73-84 (2016).
- Rangaraju, V., Calloway, N., Ryan, T. A. Activity-driven local ATP synthesis is required for synaptic function. Cell. 156, 825-835 (2014).
- Chatton, J. Y., Pellerin, L., Magistretti, P. J. GABA uptake into astrocytes is not associated with significant metabolic cost: implications for brain imaging of inhibitory transmission. Proceedings of the National Academy of Sciences of the United States of America. 100, 12456-12461 (2003).
- Magistretti, P. J., Chatton, J. Y. Relationship between L-glutamate-regulated intracellular Na+ dynamics and ATP hydrolysis in astrocytes. Journal of Neural Transmission (Vienna). 112, 77-85 (2005).
- Langer, J., et al. Rapid sodium signaling couples glutamate uptake to breakdown of ATP in perivascular astrocyte endfeet. Glia. 65, 293-308 (2017).
- Yaginuma, H., et al. Diversity in ATP concentrations in a single bacterial cell population revealed by quantitative single-cell imaging. Scientific Reports. 4, 6522(2014).
- Tantama, M., Martinez-Francois, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nature Communications. 4, 2550(2013).
- Nakano, M., Imamura, H., Nagai, T., Noji, H. Ca2+ Regulation of Mitochondrial ATP Synthesis Visualized at the Single Cell Level. ACS Chemical Biology. 6, 709-715 (2011).
- Mollajew, R., Toloe, J., Mironov, S. L. Single KATP channel opening in response to stimulation of AMPA/kainate receptors is mediated by Na+ accumulation and submembrane ATP and ADP changes. The Journal of Physiology. 591, 2593-2609 (2013).
- Pathak, D., et al. The Role of Mitochondrially Derived ATP in Synaptic Vesicle Recycling. The Journal of Biological Chemistry. 290, 22325-22336 (2015).
- Karus, C., Mondragao, M. A., Ziemens, D., Rose, C. R. Astrocytes restrict discharge duration and neuronal sodium loads during recurrent network activity. Glia. 63, 936-957 (2015).
- Larsen, B. R., Stoica, A., MacAulay, N. Managing Brain Extracellular K+ during Neuronal Activity: The Physiological Role of the Na+/K+-ATPase Subunit Isoforms. Frontiers in Physiology. 7, 141(2016).
- Ruminot, I., et al. NBCe1 mediates the acute stimulation of astrocytic glycolysis by extracellular K+. The Journal of Neuroscience : The Official Journal of the Society for Neuroscience. 31, 14264-14271 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유