Method Article
הדמיה של ATP תאיים בפרוסות רקמה אורגנותית של המוח העכבר באמצעות חיישן מבוסס-הסריג ATeam 1.03ימק
In This Article
Summary
אנו מתארים פרוטוקול עבור ביטוי מסוים בסוג תא של החיישן מקודד גנטית המבוסס על החיישנים ATeam 1.03ימק בתרבויות הפרוסות של העכבר הקדמי. יתר על כן, אנו מראים כיצד להשתמש בחיישן זה עבור הדמיה דינמית של רמות ATP סלולריים בנוירונים ו astrocytes.
Abstract
פעילות עצבית במערכת העצבים המרכזית (CN) מעוררת ביקוש גבוה לאנרגיה תאית המסופקת על-ידי פירוק של אדנוזין טריפוספט (ATP). נתח גדול של ATP צריך להתקין מחדש מעברי יונים על פני קרום פלזמה מושפל על ידי איתות חשמלי של נוירונים. יש הוכחות כי אסטרוציטים-בעוד לא לייצר אותות חשמליים מהירה עצמם-לעבור ייצור מוגבר של ATP בתגובה לפעילות עצבית ותמיכה נוירונים פעילים על ידי מתן אנרגיה מטבוליטים להם. ההתפתחות האחרונה של חיישנים מקודד גנטית עבור מטבוליטים שונים כעת מאפשר את המחקר של אינטראקציות מטבולית כגון בין נוירונים ו astrocytes. כאן, אנו מתארים פרוטוקול עבור ביטוי ספציפי לסוג תא של העברת האנרגיה הפלואורסצנטית הרגיש של ATP-(סריג-) חיישן ATeam 1.03ימק בתרבויות הפרוסות של רקמת העכבר של ההיפוקמפוס והקליפה באמצעות וקטורים הקשורים adeno ויראלי (aav). יתר על כן, אנו מדגימים כיצד חיישן זה יכול להיות מועסק עבור מדידה דינמית של שינויים ברמות ה-ATP הסלולר בנוירונים ו אסטרוציטים על עליות בתוך מסחטות אשלגן ובעקבות אינדוקציה של איסכמיה כימית (כלומר, עיכוב של מטבוליזם האנרגיה התאית).
Introduction
פעילות החשמל ההתרגשות של הנוירונים מבוססת בעיקר על שטף של הקטיונים כגון נתרן (Na+) ו אשלגן (K+) על פני קרום הפלזמה שלהם. כך נדרש לצורך איתות בתחזוקת מעברי הצבע האלקטרוכימי של שני יונים אלה. הדבר מבוצע על ידי Na הסלולר+/K+-ATPASE (nka), משאבת באופן אוביגניים הביע האלקטרו-ממברנות, אשר הבלטת משטח של 3 Na+ מתוך התא בתמורה עבור 2 K+ ממרחב החילוץ, המחייב צריכת מולקולה אחת של ATP לכל מחזור הובלה1. בנוסף ל-NKA, ישנם מספר מובילי היונים האחרים של ה-ATP הכוללים את קרום הפלזמה Ca2 +-atpase, שהוא חיוני עבור ca תאיים2 + הומאוסטזיס והיצוא שלה לאחר פעילות המושרה זרם2. ב שלפוחיות סינפטית מראש, מסוג H+-atpase (v-atpase) יוצר מעבר הצבע הפרוטונים הדרוש לספיגת נוירוטרנסמיטור לתוך תא זה3.
בעוד הפעילות של הנוירונים ובכך דורש כמות משמעותית של ATP4, הם אינם מהווים יכולת משמעותית לאחסון של אנרגיה. במקום, נראה שהם סומכים על אינטראקציות מטבולית עם אסטרוציטים השכנה, חנויות הגליקוגן הגדולות במוח5. יש כבר הציע כי הגליקוגן astrocytic אכן ממלא תפקיד חשוב בתמיכה האנרגיה העצבית צרכים; ותופעה מרכזית בתוספת זו מסוג נוירו-מטבולית המוצעת בין שני סוגי התא היא הקיבולת של אסטרוציטים להגדיל את ייצור ה-ATP שלהם בתגובה לפעילות עצבית6,7,8. השערה זו, המכונה astrocyte המעבורת לקטט (anls), הוא עדיין בדיון, כי עבודה אחרת סיפקה ראיות כי הנוירונים עשויים גם להגדיל את שיעור שלהם של גליקוליזיס בתגובה גירוי9,10, המשקף את הצורך של שיטות נוספות גישות ללמוד אינטראקציה נוירו-גליה.
החקירה של מטבוליזם האנרגיה התאית ורמות ATP בנוירונים ו אסטרוציטים כדי להבהיר את האינטראקציות נוירו-glia מטבולית כבר הושפע זמן רב על ידי חוסר בדיקות מתאימות לאיתור שינויים ריכוזי מטבוליזם בתאי החיים ברקמת המוח. העשור האחרון, עם זאת, סיפקה גל בפיתוח של כלים חדשים ובדיקה חדשה גנטית מקודד גנטי עבור מטבוליטים שונים, כולל חיישנים ל-ATP, לקטט, פירובט ואחרים11,12. באמצעות כלים אלה, ניתן כעת לטפל ישירות בשאלות הקשורות לצריכת ה-ATP הסלולרית ולשינויים ברמות האנרגיה התאית ברמת התא היחיד ובאופן ספציפי לסוג תא ברקמת מוח שלמה13.
בעבודה הנוכחית, אנו מתארים הליך להמחיש מסוג ATP הדינמיקה המוחית על נוירונים ו אסטרוציטים של פרוסות המוח אורגאוטימית תרבותית. אנו מראים כיצד להעסיק adeno-הקשורים וקטורים ויראליים (aav) עבור תא סוג ביטוי ספציפי של ATP מקודד גנטית-nanosensor ateam 1.03ימק (14) בנוירונים ו אסטרוציטים של פרוסות של מוח העכבר שניתן לשמור בתרבות התא במשך מספר שבועות15. הליך של איך להסיר את הצלקת גליה המכסה פרוסות רקמה תרבותית מתוארת, אשר משפר את הנגישות האופטית והדמיה של תאים בשכבות רקמה אורגנותמית מתחת. לבסוף, אנו מראים כיצד ATeam 1.03ימק ניתן להשתמש כדי לבצע הדמיה מבוססת-סריג של שינויים ברמות ה-ATP הסלולאריים בהכנה זו. שיטה זו מארחת את היתרונות העיקריים שהוא אינו דורש הליכים מוחית כירורגית, מספק רמות גבוהות של ביטוי של חיישן וסוג התא ספציפיות בפרוסות המוח התרבותי, הפחתת החלטיות או מתח בתאים לעומת שיטות אחרות, כמו העברה על ידי אלקטרופורציה או התמרה עם וקטורים נגיפי אחרים10,16,17. בנוסף, פרוטוקול זה ניתן להחיל על אחרים מבוסס הננו חיישנים, ביניהם גרסאות של ATeam 1.03 המספקים זיקה מחייבת נמוכה יותר עבור ATP14.
Protocol
המחקר הנוכחי נעשה בהתאמה קפדנית עם ההנחיות המוסדיות של היינריך היינה באוניברסיטת דיסלדורף, כמו גם ההנחיה האירופית מועצת הקהילה (2010/63/האיחוד האירופי). כל הניסויים המשתמשים בתרביות פרוסות המוח האורגאותיות התקשרו ואושרו על-ידי משרד הרווחה בבעלי חיים במכון הבריאות והשימוש של אוניברסיטת היינריך היינה, דיסלדורף (מספר חוק מוסדי: O50/05). בהתאם להמלצות של הנציבות האירופית18, בעלי חיים בני 10 ימים נהרגו על ידי עריפת ראש.
1. הכנת תרביות פרוסת המוח האורגנותית (OTCs)
- יום לפני או לפחות 30 דקות לפני ההליך
- הכן את צלחת פטרי (בתנאים סטריליים). הסר את המכסה של 6 צלחת הבאר ומקום 800-850 μL של מדיום OTC לתוך כל טוב. שמור את הצלחת בחממה (37 ° צ', 5% CO2/95% O2) עד הנדרש.
- הכינו את הכביסה של מנות פטרי (בתנאים סטריליים). הוסף 3 מ ל של HBSS על כל 30 מ"מ צלחת פטרי. סך של 5 מנות לכל שגרה נדרשת. מניחים אותם בחממה (37 ° c, 5% CO2/95% O2) לפחות 30 דקות — לילה עד הנדרש.
- הכן את ה-ACSF (שולחן 1). שמרו על תמיסת מלח ללא גלוקוז ב -4 ° c עד למחרת.
| סלינס ומדיה-ניסוח | ||||
| שם | קיצור | רכב | ריכוז [ממ מ] | ערות |
| שדרתי מלאכותית פתרון נוזלי | מיכל שגיא | מיכל שלמה | 125 | בוקבלד עם 5% CO2/95% O2, pH 7.4 |
| אשלגן כלורי | 2.5 | הוסף תמיד גלוקוז ימינה לפני השימוש. | ||
| מיכל2 | 2 | אין לאחסן יותר מיום אחד עם גלוקוז | ||
| מיכלהשני | 1 | ~ 310 מוכיזם/L | ||
| חנה2 | 1.25 | |||
| נחקו3 | 26 | |||
| גלוקוז | 20 | |||
| ניסיוני ACSF | E-ACSF | מיכל שלמה | 136 | בוקבלד עם 5% CO2/95% O2, pH 7.4 |
| אשלגן כלורי | 3 | הוסף תמיד גלוקוז ימינה לפני השימוש. | ||
| מיכל2 | 2 | אין לאחסן יותר מיום אחד עם גלוקוז | ||
| מיכלהשני | 1 | ~ 320 מוכיזם/L | ||
| חנה2 | 1.25 | |||
| נחקו3 | 24 | |||
| גלוקוז | מיכל 5 | |||
| לקטט | 1 | |||
| פתרון איסכמיה כימית | CIS | מיכל שלמה | 136 | בוקבלד עם 5% CO2/95% O2, pH 7.4 |
| אשלגן כלורי | 3 | ~ 318 מוכיזם/L | ||
| מיכל2 | 2 | |||
| מיכלהשני | 1 | |||
| חנה2 | 1.25 | |||
| נחקו3 | 24 | |||
| 2, 2-דיאוקסיגלוקוז | 2 | |||
| שלמה לוי | מיכל 5 | |||
| 8 מילימטר אשלגן ACSF | 8 מ"מ K+ acsf | מיכל שלמה | 128 | בוקבלד עם 5% CO2/95% O2, pH 7.4 |
| אשלגן כלורי | 8 | ~ 320 מוכיזם/L | ||
| מיכל2 | 2 | |||
| מיכלהשני | 1 | |||
| חנה2 | 1.25 | |||
| נחקו3 | 24 | |||
| גלוקוז | מיכל 5 | |||
| לקטט | 1 | |||
| הפסי-באגירה ACSF | H-ACSF | מיכל שלמה | 125 | מותאם ל-pH 7.4 עם NaOH |
| אשלגן כלורי | 3 | הוסף תמיד גלוקוז ממש לפני השימוש | ||
| מיכל2 | 2 | אין לאחסן יותר מיום אחד עם גלוקוז | ||
| מיכל בע | 2 | ~ 310 mOsm/L (מותאם עם סוכרוז) | ||
| חנה2 | 125 | |||
| חפסי | 25 | |||
| גלוקוז | 10 | |||
| תמיסת מלח מאוזנת של הנקס | מיכל בייס | סיגמא (קטלוג מספר H9394). | ||
| תמיסת מלח מוזרמת פוספט באגירה | מיכל בע | גבקו (קטלוג מספר 14287-080) | ||
| בינונית-תרבות אורגנותית | OTC מדיום | סרום לסוסים המופעל בחום | 20 | 34 ° צ', 5% CO2, pH 7.4, תחת מצב culturing |
| גברתי | 79% | ~ 320 מוכיזם/L | ||
| ל-גלוטמין | 1 | |||
| אינסולין | 0.01 מ"ג/mL | |||
| מיכל שלמה | 14.5 | |||
| מיכל בע | 2 | |||
| מיכל2 | 1.44 | |||
| חומצה אסקורבית | 0.00125% | |||
| D-גלוקוז | 13 |
טבלה 1: הרכב פתרון.
- ביום ההכנה, מוסיפים את הגלוקוז ל ACSF, מניחים אותו על הקרח ולהתחיל מבעבע עם 95% O2/5% CO2 עבור לפחות 30 דקות כדי לגרום pH של 7.4.
- חיתוך וחיתוך
- הקריבו את העכבר (בלבי, שני המינים) בימי הלידה 6 עד 8 על ידי עריפת ראש מהירה ומניחים את המוח בצלחת פטרי מזכוכית המכילה ACSF קר קרח.
- לחשוף את הגולגולת על ידי חיתוך העור מהגב עד הקצה האחורי של עצם האף. ואז, לחתוך בזהירות את הגולגולת מגנום האמן באמצעות מספריים כירורגית לחשוף את המוח.
הערה: ודא כי הנוהל הוא בהתאם להנחיות של המוסד. - הסר את המוח ומניחים אותו על קרום מסנן בצלחת פטרי קר הקרח מלא ACSF.
- הפרידו את האונות ובצעו את החיתוך הפאראלייתי בזווית של 45 °. לתקן את כחצי הכדור בשלב. הרקמות עם דבק-על מיד להעביר את בלוק הרקמה לאמבטיה הרטט המכיל הקרח קר ACSF (בובדם עם 5% CO2/95% O2). לבסוף ליישר את הרקמה. לשמור על האונה השנייה בקרח קר ACSF עד חיתוך.
- כוונן את הרטט כדי לחתוך פרוסות ב-250-400 יקרומטר. פריסה ב-250 יקרומטר תניב כ-12 פרוסות לכל חיה (400 יקרומטר: ~ 7 פרוסות).
- לאחר חיתוך הפרוסה (איור 1א), לזהות את היווצרות היפוקמאל בהתבסס על המראה האופייני שלה מורפולוגית (איור 1) ולבודד אותו באמצעות מחטים תת-עוריות (23 מד, 1 "), שמירה על החלק של קליפת המוח הסמוכה ההיפוקמפוס.
הערה: שמירה על קליפת המוח בעוד culturing מסייע לשמר את שלמות ההיפוקמפוס. עם זאת, ההיפוקמפוס יכול להיות מבודד ותרבותי ללא קליפת במידת הצורך. - מניחים את הפרוסה על רשת שינוי מחומם, ACSF (34 ° צ', בעבע עם 5% CO2/95% O2) עד שכל הפרוסות נאספים.
- העבירו את הפרוסות לארון הזרימה המבינארי כדי להמשיך בתנאים סטריליים.
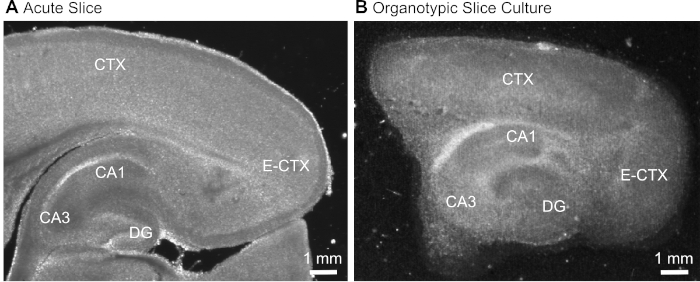
איור 1: העברת התמונות הייצוגית של ההכנות לחיתוך המוח החריף והאורגאותית. השוואה בין פרוסת המוח הפארא-מבודדת (A) לבין פרוסת המוח הפארא-אורגתית הנשמרת בתרבות במשך 12 יום (ב) באמצעות מיקרוסקופ לומיליציה מרחבית. די. ג'י. CA1/3 = CA1/CA3-אזור של ההיפוקמפוס; E-סי-טי-אקס-וורהיאל קליפת המוח; . סי. טי. אקס = (ניאו-) קליפת המוח אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. הפרוסות
- בעדינות להעביר את הפרוסות מ-ACSF לתוך אחד מנות פטרי מראש מחומם מילא את תמיסת המלח של האנק סטרילי באמצעות מזכוכית סטרילית הפוכה של פסטר.
הערה: עיקור הרקמה מושגת על ידי דילול (שלב 3.2). העברה כ-ACSF קטן ככל האפשר לצלחת פטרי. - מחליפים את הפיפטה ומעבירים את הפרוסות לצלחת השנייה בפטרי. חזור על התהליך 5 פעמים באופן כללי. העבירו כ-HBSS קטן ככל האפשר למנות פטרי הבאות.
- מקם בעדינות פרוסה אחת בכל פעם בחלק העליון של הוספת התרבות. חזור על התהליך עבור כל פרוסה. הימנע מturbulences בתוך הפיפטה והמתן עד שפורסים את הפרוסה לקצה הפיפטה של פסטר. אפשר למקם עד 4 פרוסות על קרום אחד.
- הסר בזהירות את הפתרון של האנק מהקצה העליון של ההוספה באמצעות עצה משובחת.
- שמור את התרבויות (איור 2) בחממה בממשק בין גז (קרבוגן, 95% O2 /5% CO2) ואת הנוזל ב 37 ° c עד יום הניסוי. החליפו את המדיום כל 2-3 ימים.
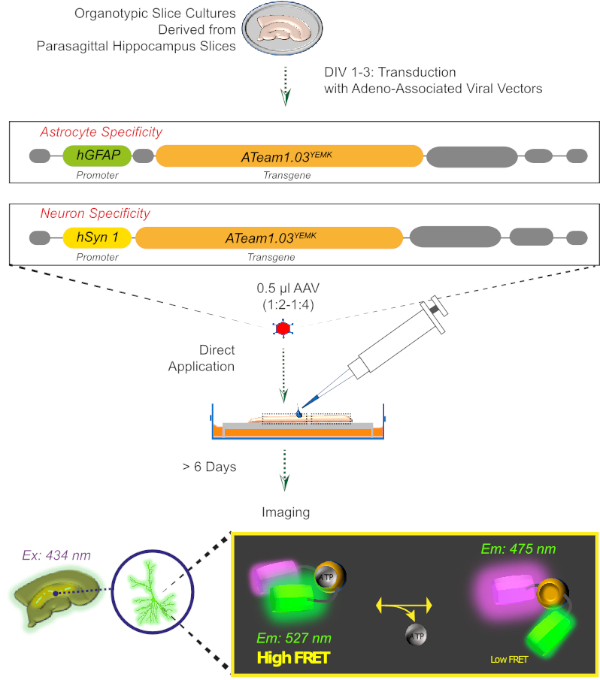
איור 2: עקרון הדמיה ATP מבוססת-סריג בפרוסות מוח אורגנוסטימיות מבוססות באמצעות חיישן מקודד גנטית ATeam 1.03ימק. ייצוג סכמטי של הפרוטוקול המוצג בעבודה זו. לזמן קצר, הפארא-בלתי מזוהה פרוסות אורגאואיות, שאינן מתרבות עבור 1-3 ימים, מותמרים בעזרת וקטור ויראלי המשויך לאדנו המכיל גם, את ההאופאפי הספציפי ביותר, או האוצין-יזם ספציפי-לעצב והרצף לביטוי של ATeam 1.03ימק. המרה מדולל של וקטורים אלה (1:2-1:4) מוחלים ישירות על החלק העליון של פרוסה, אשר נשמרת תחת תנאי culturing לפחות עוד 6 ימים. שינויים ברמות ATP תאיים אז יכול להיות דמיינו בתאים המבטאים את החיישן על ידי מרגש אותו ב 434 ננומטר ועל ידי רכישת פליטת הזריחה בו זמנית ב 527 (לקבל) ו 475 (תורם) nm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. ביטוי של חיישנים ATP עם וקטור ויראלי הקשורים Aadeno (איור 2)
הערה: הקפד לענות על כל הדרישות לטיפול של אורגניזמים ששונו גנטית!
- כדי להתמודד עם וקטור ויראלי, סדרת מחלקים adeno הקשורים וקטורי ויראלי (AAV2/5) ב 1-2 μl כדי למנוע קיפאון חוזר והפשרה. אחסן את הליאביטים ב-80 ° c.
- מניחים בקבוקון המכיל 10% אקונומיקה על הספסל סטרילי להשליך את כל החומר שיורית בשימוש שהיה במגע עם וקטור.
- לצורך התמרה, הכן דילול של 1 μL של הווקטור עם 2-3 μL של DPBS. פתרונות מניות בדרך כלל מוצג סיכוייו פיזית בסדר גודל של 1012 ויראלי גנום לכל mL (vg/mL).
- העבר הוספה המכילה פרוסה תרבותית למכסה המנוע הסטרילי.
- בלי לגעת ברקמה, להחיל 0.5 μL של וקטור מדולל ישירות לחלק העליון של כל פרוסה.
הערה: ביטוי טוב יותר ברבדים העמוקים יותר של הרקמה מושגת על ידי התמרה של פרוסות מתורקות ב1-3 ימים במבחנה (DIV). התמרה של התרבויות הישנות עלולה לגרום לביטוי משולט של תאים בצלקת גליה שמסביב או ביטוי נמוך בנוירונים, בהתאמה. - לבסוף, מניחים את הפרוסות חזרה לתוך החממה ושומרים אותם לפחות עוד 6 ימים. אין לשנות את המדיום ביום התמרה.
4. הסרת צלקת Glial (איור 3)
- בדיוק לפני תחילת הניסוי, להעביר הוספה המכילה פרוסות מתורבת לתוך המכסה הסטרילי ולמקם אותו לתוך צלחת 30 מ"מ, המכיל 1 מ ל של OCT או בינוני.
- מניחים את הצלחת תחת סטריאוסקופ ומתמקדים על פני השטח של הפרוסה.
- השתמש בשתי מחטים תת-עוריות (23 G, 1) כדי לבצע חתך קצר על הקצוות הצרים של פרוסה שנבחרה (איור 3). הליך זה ישחרר את המתח במשטח שנוצר על ידי הצלקת גליה גורמת לו לסגת, ובכך חשיפת השכבות הבסיסיות (ראה איור 5).
הערה: שכבת הרקמה הראשונה (הצלקת glial) נוצרת בעיקר על ידי astrocytes תגובתי. בהדמיית שדה רחב, שכבת רקמה צפופה זו תגרום לפיזור נוסף של האור, וכתוצאה מכך תמונות מטושטשות. הסרת הצלקת היא ובכך יתרון כדי להשיג ניראות טובה יותר של הרבדים עמוקים יותר, אשר מכילים את הרקמה האורגנותית הנכונה. כך, להיזהר לבצע את החיתוך הזה באופן בלעדי בקצה בשכבה העליונה של הכנת הפרוסה בלבד ולא לפגוע הרקמה מתחת. אנחנו לא הבחין הבדלים בין הנתונים שהתקבלו otcs עם צלקת גליה עם אלה מתוך צלקת חינם otcs (נתונים לא מוצגים). - הסר את הפרוסה המוכנה מההוספה. לשם כך, להשתמש באזמל סטרילי לבלו אותו על ידי ביצוע חתכים מקבילים ישר לקרום, יוצרים ריבוע או משולש עם הפרוסה במרכז, תוך החזקת הקצוות של קרום עם פינצטה. אם ההוספה מארחת פרוסות נוספות, העבירו אותה חזרה ללוח המקורי ולתוך החממה. מתח פני השטח של המדיום ימנע את הדליפה שלה על פני השטח של קרום.
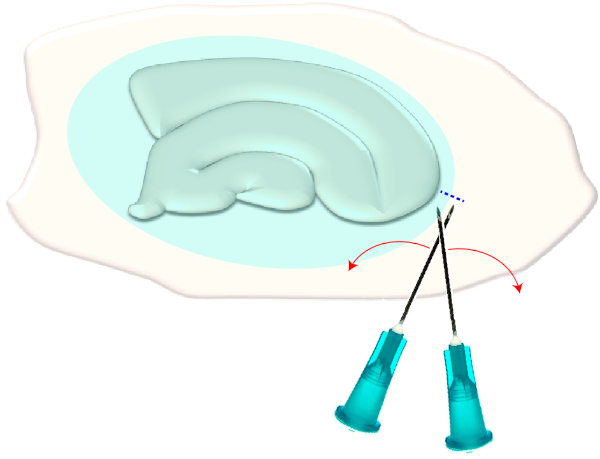
איור 3: איור סכמטי של ההסרה המכנית של צלקת גליה. הדמות מציגה תרבות פרוסה היפוקמאל אשר מכוסה על ידי צלקת גליה (כחלחל אליפסואיד). בפעם אחת הטיית את קצות שתי מחטי המזרק בקוטב הקטן ביותר של התרבות ובקצה הצלקת הגלילית (קו מקווקו כחול), הצלקת תהפוך בצד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
5. הדמיה ATP מבוססת-סריג (איור 4)
- לפני הניסוי, להכין E-ACSF ובועה אותו עם 95% O2/5% CO2 עבור לפחות 30 דקות כדי לקבל pH של 7.4. הפעל את מקור אור הפלורסנט (מנורת קסנון) של ה-monochromator (איור 4). התחילו את המיזוג לפני שאתם מתחילים את הפרוסה מהאינקובטור.
הערה: שמרו את התמיסת מלח עם 95% O2 ו 5% CO2 במהלך הניסוי כולו. - להעביר את הפרוסה לתוך תא ניסיוני, כי הוא כל הזמן עם E-ACSF טרי באמצעות משאבת הפריסטטיק (איור 4). לאחר מכן, תקן את הפרוסה ברשת. הניחו את החדר על מיקרוסקופ וחברו את מערכת הפרפיוז. צינורות גז-חסין מעבדה מומלצת לפרזיה.
הערה: ניתן לבצע ניסויים בטמפרטורת החדר או בסמוך לטמפרטורה הפיסיולוגית, בהתאם לתכנון הניסיוני. בדוק את היציבות והאמינות של זרימת ההיתוך כדי למנוע שינויים של מיקוד הנגרמת על ידי תנועה של הרקמה ו/או שינויים במתח הטיה. מהירויות מיזוג סטנדרטיות לעבודת פרוסה, המשמשת אותנו ומעבדות רבות אחרות, הן 1.5-2.5 mL/min.
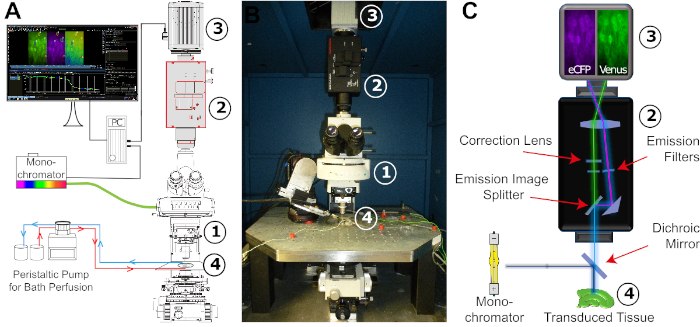
איור 4: קביעת התצורה של הגדרת הדמיה של ה-סריג. (א) תרשים סכמטי של הרכיבים השונים וההסדר המרחבי שלהם הנדרש לכיוונון ההדמיה. ההסדר מורכב monochromator עם מנורת קסנון כמקור אור, מיקרוסקופ ישר בשלב קבוע (1), מערכת מפצל תמונה (2), מצלמת CCD דיגיטלית או CMOS עבור הקלטה בזמן ההקלטה (3), ואמבטיה ניסיוני המותאם לפרזיה קבועה יציבה (4). משאבת האמבט ממומשת על ידי משאבה פריסטטית עם קצב זרימה מתכוונן. (ב) תמונה של סביבת העבודה הניסיונית. הכיוונון של ההדמיה מותקן על גבי שולחן הרטט הנושא את השלב x/y-translational שאליו מוטבע האמבט הניסיוני. מספרים: ראה (א). (ג) השקפה סכמטית של מסלול האור מ-monochromator למצלמה הדיגיטלית. מצוין הוא המיקום של המסננים השונים והשיקוף הדיקרואיק. מספרים: ראה (א). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הביאו את הפרוסה התרבותית לפוקוס באמצעות אור שידור. זיהוי האזור בו יבוצעו ניסויים (לדוגמה: אזור CA1 של ההיפוקמפוס). לפני תחילת ניסויים הדמיה, לחכות לפחות 15 דקות כדי לאפשר פרוסות להסתגל לתנאים מלוחים. לקביעת התצורה של הכיוונון הנסיוני, ראה איור 4.
- הפעל את המצלמה ואת תוכנת הדימות. לאחר מכן, בחר את קוביית המסנן המתאימה.
- לרגש חלבון פלורסנט התורם (eCFP) ב 435/17 nm (~ 435 nm). קבע את זמן החשיפה בין 40 ל-90 ms.
הערה: חשיפה חזקה של פרוסות לאור פלורסנט עלולה לגרום לאפקטים פוטורעילים. - הריגוש ב 435 ננומטר התוצאות פליטה בשני 475 nm (eCFP; תורם) ו 527 nm (ונוס; קבלה). לפצל את פליטת הזריחה ב 500 ננומטר עם מפצל תמונה פליטה ולהעסיק מסננים להעביר הלהקה ב 483/32 ו 542/27 כדי לבודד תורם נוסף ולאחר הזריחה. ביטוי חזק עלול לגרום לרוויה של הגלאים. במקרה זה, ייתכן שתשתמש במסנן דחיסות נייטרלית כדי להפחית את עוצמת העירור.
- בחר אזור מעניין (ROI) כנראה נטול פלואורסצנטית סלולרי לחיסור רקע. לאחר מכן, ליצור ROIs להתוות גופות תאים.
- קבע את תדירות רכישת התמונה ואת זמן ההקלטה הכולל. עבור ניסויים ארוכים (> 30 דקות), תדירות רכישה של 0.2-0.5 Hz מומלצת למניעת רעילות.
- . התחל את ההקלטה מומלץ להקליט לפחות 5 דקות תחת תנאים בסיסיים כדי להבטיח את יציבות ההכנה.
הערה: כוונן את מוקד התא במהלך ההקלטה במידת הצורך. - כדי לגרום שינויים ב-ATP תאיים, להעביר את צינור זלוף מן acsf סטנדרטי כדי מלוחים המכילים מעכבי מטבולית (g. CIS, לראות את שולחן 1 ומתחת). לחילופין, השתמש בתמיסת מלח עם ריכוז אשלגן מוגבר כדי לחקות שחרור של אשלגן מנוירונים פעילים.
הערה: יישום הפרזיה הוא תהליך איטי יחסית, הפועל באופן גלובלי על ההכנה כולה. שימו לב לזמן שבו הפתרון החדש התחיל למעשה להיכנס לאמבטיה הניסיונית. בהתאם למרחק בין החדר לבין מאגר התמיסת מלח, כמו גם על מהירות הפרזיה, יש לשקול זמן השהיה.
6. תיעוד ברזולוציה גבוהה של הסלולר הפלואורסצנטית
- ישירות לאחר ההקלטות, להעביר את חדר ההקלטה המכיל את תרבות הפרוסה למיקרוסקופ לייזר קונפוקלית וקד לסרוק.
הערה: . קח טיפול מיוחד בגלל נזקי פוטופוטנציאליים, לבצע צעד זה רק לאחר ניסויים. למטרות תיעוד, ניתן להחליף את ה-E-ACSF ב-H-ACSF. לכן, מערכת פרפיוז אינה נדרשת בהכרח. - קח את המחסניות z ברזולוציה הגבוהה ביותר של z האפשרית בתצורה האופטית הנתונה.
- החל אלגוריתם פירוק כדי להגדיל את רזולוציית התמונה.
תוצאות
וקטורים AAV הם כלי אמין באופן סלקטיבי לבטא גנים זרים בתאים בתוך רקמת חיים16. יישום ישיר של AAVs המכיל את הקלטת רצף של ATeam 1.03ימק ומיזם ספציפי מביא ביטוי גבוה של החיישן בסוג התא הנבחר. ב-DIV 14 (~ 10 ימים לאחר התמרה), נוירונים ביטוי ateam תחת היזם סינפסין האנושית נמצאים בצפיפות גבוהה בקליפת המוח של פרוסות הרקמה התרבותית במעמקי של עד 50 יקרומטר מתחת למשטח הפרוסה (איור 5א). תוצאות דומות ניתן להשיג בהיפוקמפוס (איור 5ב).
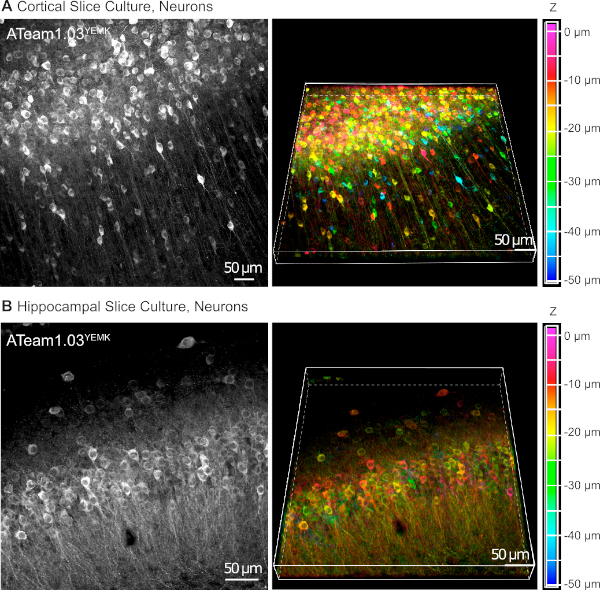
איור 5: ויזואליזציה של הנוירונים המבטא ATeam 1.03ימק בשנת הפארא-מתורבת של פרוסות מוח אורגנוטימיות. תמונות בצד שמאל תואמים התחזיות מיקוד מורחב של 43 מקטעים אופטיים (1.05 יקרומטר כל אחד) של רקמת קליפת המוח (א) ו (ב) של 70 מקטעים אופטיים (0.6 יקרומטר כל אחד) של רקמת ההיפוקאמאל. תמונות מימין מייצגות את תצוגת אמצעי האחסון של אותה הקרנה. התאים מסומנים בצבע בהתאם לעומק שלהם יחסית למשטח הפרוסה, כפי שמצוין בסולם הצבעים שבצד ימין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
למדידה של רמות ATP ב אסטרוציטים, ATeam 1.03ימק מתבטא תחת השליטה של חלבון חומצי האנושי fibrillary (GFAP) מקדם. התוצאה היא התמרה יעילה של תאים בקליפת המוח וההיפוקמפוס של פרוסות רקמה תרבותית (איור 6). בעיקר, שני פנוטיפים מורפולוגיים שונים ניתן להבדיל, בהתאם לעומק יחסית לפני השטח של ההכנות פרוסה. ברובד הראשון, השכבה השטחית, התאים מאופיינים בתהליכים ראשוניים עבים שמסודרים במקביל לפני השטח. תאים אלה מוצגים בתחומים חופפים מאוד, יצירת מאשר צפופה של האסטרוציטים כנראה תגובתי (איור 6). בשכבות עמוקות יותר (30-60 יקרומטר מפני השטח), מוצג התמרה של התערוכה הסלולרית משובח תהליכים סלולריים שיוצרים תחומים כדוריים ברובו והמבנה שלהם דומה לזה של אסטרוציטים באתרו כפי שדווח מוקדם יותר19,20,21 (איור 6). כדי להשיג התמרה טובה יותר של האסטרוציטים עמוק יותר, כמו גם גישה אופטית טובה יותר השכבות האלה עמוק יותר, רקמת צלקת גליה ניתן להסיר כמתואר בשלב 4.
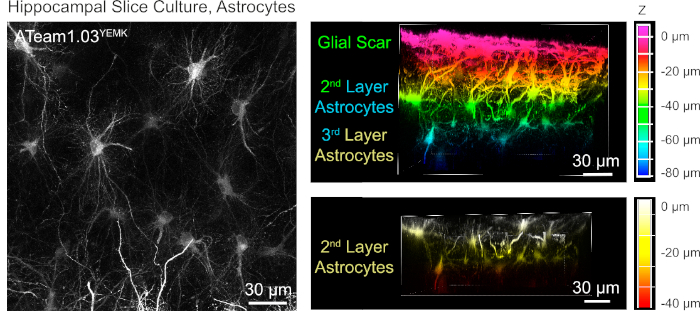
איור 6: ויזואליזציה של אסטרוציטים ביטוי ATeam 1.03ימק בשנת הפאראטילית התרבותית של המוח בפרוסות. התמונה בצד שמאל מקבילה לתחזית ממוקדת מורחבת של 191 מקטעים אופטיים (0.45 יקרומטר כל אחד). להמחשה, הצלקת גליה לא נכלל ההקרנה של האסטרוציטים. תמונות מימין מייצגות את תצוגת עוצמת הקול של אותה הקרנה לפני ואחרי הסרת הצלקת הגליאל. התאים מסומנים בצבע בהתאם לעומק שלהם יחסית למשטח הפרוסה, כפי שמצוין על-ידי סולמות הצבע בצד ימין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
ביטוי מוצלח של ATeam 1.03ימק מאפשר את המדידה הדינמית של שינויים ברמות ATP בנוירונים או באסטרוציטים, בהתאם ליזם המשמש (ראה לעיל). ניסויים נערכו באמבט ניסיוני כל הזמן עם E-ACSF (בעבע עם 95% O2/5% CO2). בפרוסות אורגאואיות המבטאות ATeam 1.03ימק בנוירונים, אזורים מעניינים (rois) נבחרו לפני התחלת ההקלטה, המייצגים את התאים האחרים של תאי הסחלב (איור 7א). יתר על כן, אזור לחיסור רקע נבחר (איור 7א). פליטת ונוס, כמו גם eCFP פלואורסצנטית נאסף אז עבור כל אחד ROIs אלה בנפרד מתואר כרמת פליטה של זריחה לאורך זמן (איור 7B). לאחר הקלטת זריחה תחת תנאי שליטה במשך כמה דקות כדי להבטיח בסיס יציב, חילוף החומרים הסלולר היה מעוכב על ידי חשיפת הכנת הפרוסה לתמיסת מלח נטול גלוקוז, שאליו 5 מ"מ נתרן (נאן3) התווסף לדקה אחת (איור 7ב). מניפולציה זו המושרה שינויים הפוך את עוצמת הפליטה של הזוג סריג (איור 7B, שמאל חלוניות), עם ירידה של ונוס (527 nm) ועלייה של הפליטה ecfp (475 nm). חישוב יחס סריג על ידי חלוקת פליטת הזריחה של ונוס על ידי eCFP (Fונוס/Fecfp) הביא אותות המשקפים את השינויים היחסיים ברמות ATP תאיים, מה שנקרא "ateam היחס הנכון" (איור 7B, הלוח הימני). בכל הנוירונים מוקלטים (n = 70 תאים N = 5 פרוסות), נאן3 גרם לירידה הפיכה ביחס ateam, המציין ירידה הפיכה ברמות ATP תאיים על עיכוב של חילוף החומרים הסלולרי.
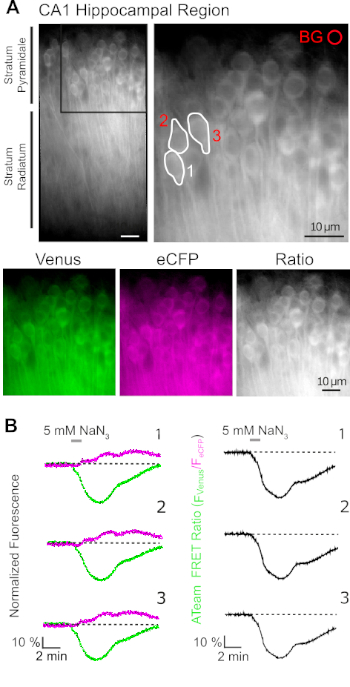
איור 7: הפגנה של צניחה בזמן ATeam יחס הדמיה. (א) למעלהמשמאל: תמונת הזריחה הרחבה של שכבת הפירמידה ושכבה רדיואטום של האזור CA1 של היפוקמאז בהידמית תרבותית המבטא ateam 1.03ימק בנוירונים. למעלה מימין: תצוגה מוגדלת של מקטע מסגרת כמצוין משמאל. קווים לבנים מצטלבים אזורים מעניינים (ROIs) 1-3 המייצגים את גופי התא של נוירונים CA1 מידאל שנבחרו לניתוח ב (ב). BG מייצג את ה-ROI שנבחר לתיקון רקע. בתחתית: תמונות בצבע דומה המייצגים פליטת זריחה של ונוס (ירוק), eCFP (סגול) ואת היחס של ונוס/eCFP. (ב) הקלטה של הזמן ב-rois 1-3, המייצג גופי תאים עצביים (ראה A). רשמים משמאל מראים פליטת קרינה מנורמלת של ונוס (ירוק) ו-eCFP (מגנטה). עקבות בצד ימין להראות את היחס המתאים ATeam לדאוג. שים לב כי זלוף עם 5 מ"מ נאן3 בהיעדר גלוקוז מתוך החילוץ עבור 1 דקה (בר אפור) משרה ירידה הפיך ביחס לדאוג ateam, המציין ירידה בריכוז ATP תאיים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כדי להבטיח את יציבות ההכנה ואת החיישן בתנאים ארוכי טווח הניסוי, פרוסות ביטוי ateam בנוירונים או אסטרוציטים היו כל הזמן עם acsf לתקופות ממושכות (> 50 דקות; n = 12 תאים כל אחד, n = 3 otcs מ 3 מוחות). בתנאים אלה לא השתנה יחס הפרט (איור 8). חשיפת ההכנות ל-CIS המכיל מעכבי מטבולית ("איסכמיה כימית", לראות את שולחן 1), לעומת זאת, שוב הביא את הירידה הצפויה ביחס לדאוג ateam כפי שנצפתה לעיל.
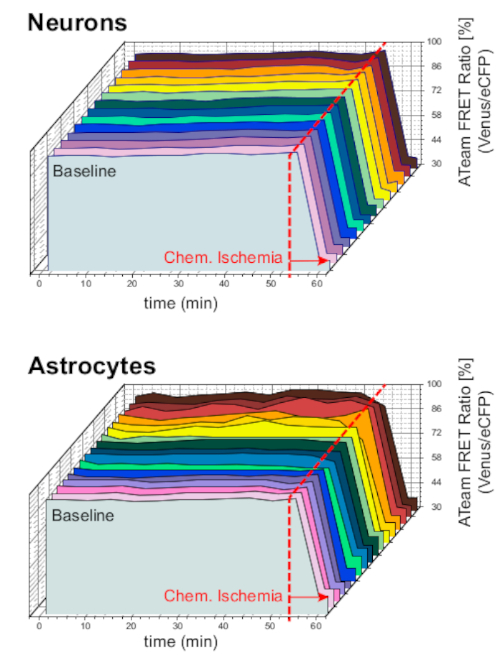
איור 8: ניסויים בסיסיים בהעסקת ATeam. לטווח ארוך ateam היחס הדמיה ב 14 תאים שונים בתנאים הבסיסיים בנוירונים (למעלה) ו אסטרוציטים (למטה). נתונים נלקחו בתנאים דומים כמו נתונים ניסיוניים אחרים. בסוף כל מדידה, איסכמיה כימית היתה מעוררת על ידי הפרזיה עם CIS כפי שמצוין על ידי החץ. הערה: היחס הבסיסי של ATeam הוא יציב לאורך זמן בתנאים בסיסיים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בשלב הבא, ניתחנו את התגובות של נוירונים ו אסטרוציטים המבטא ateam 1.03ימק לעלייה בריכוז היכולת המפוטאותאי. לאחר יצירת קו בסיס יציב, נוירונים היו מלוחים עם תמיסת מלח שבה ריכוז אשלגן הוגדלה מ 3 עד 8 מ"מ עבור 3 דקות (איור 9א). עם זאת, מניפולציה זו לא הייתה תוצאה של שינוי לזיהוי ביחס הטיפול ב-ATeam (n = 56 תאים ב-N = 5 פרוסות). כדי להבטיח שהחיישן הגיב לשינוי ברמות ה-ATP, הפרוסות נחשפו שוב לתקופה ממושכת של איסכמיה כימית שהגיבה על ידי החלפת E-ACSF על ידי CIS. איסכמיה כימית הביאה לירידה מהירה ב-ATeam ביחס לרמה חדשה ויציבה, המציינת דילול נומינלי של ATP אחרי 2-3 דקות (איור 9א).
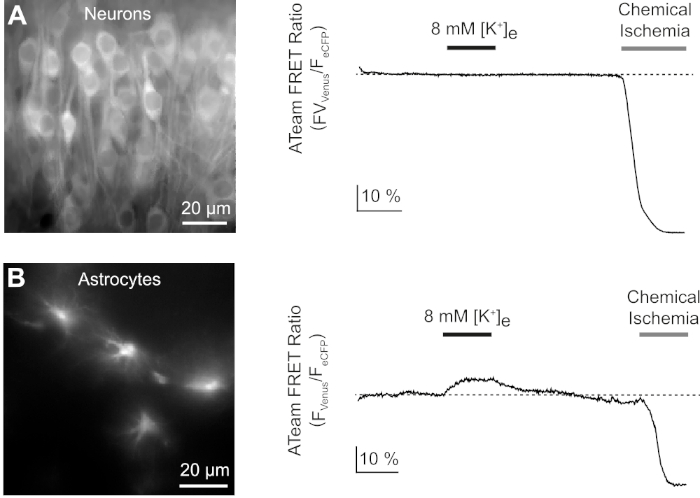
איור 9: ניסויים מייצגים הממחישות שינויים ברמות ATP בנוירונים ו אסטרוציטים. (א,ב): תמונות על התצוגה השמאלית ateam פלואורסצנטית מנוירונים ו אסטרוציטים הממוקם באזור CA1 היפוקמאל של פרוסות אורגאוסטיאית. עקבות בצד ימין מייצגים הקלטות לפקיעה זמן של יחס הדאגה ATeam המתקבל מתוך ROI ממוקם על גוף תא בודד. בשני הניסויים, הפרוסות הראשונות נחשפו לגידול בריכוז האשלגן במשך 3 דקות (ראה בר), ואחריו חשיפה סופית לאיסכמיה כימית. שים לב כי בעוד נוירונים לא מגיבים העלאת של אשלגן החילוץ (א), האסטרוציטים להגיב עם עלייה ב-ATP (ב). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
אותו פרוטוקול ניסיוני בוצע עם פרוסות, שבו ATeam 1.03ימק התבטא ב אסטרוציטים. בניגוד למה שנצפה בנוירונים, אסטרוציטים הגיב לעלייה אשלגן מסחטות על ידי עלייה הפיכה ביחס לדאוג ateam, המציין עלייה ברמות ATP תאיים (n = 70 תאים n = 5 פרוסות) (איור 9ב). החשיפה הבאה של איסכמיה כימית הביא, כצפוי, בירידה גדולה ביחס ATeam, הרומז על דלדול הנומינלי של ATP תאיים (איור 9ב).
Discussion
כאן, אנו להדגים הליך עבור הביטוי הספציפי התא של ATeam 1.03ימק, מבוסס על מבוססי מגנטית, ננוחיישן מקודד גנטי14, עבור מדידה של שינויים ברמות ATP ב אסטרוציטים או נוירונים בתרבויות הפרוסה של רקמת העכבר של המוח העכברים15. בהקלטות למופת, אנו מראים כי עלייה בריכוז אשלגן מתוך החילוץ אינו גורם לשינוי ריכוזי ATP בנוירונים, בעוד רמות ATP astrocytic לעלות בתגובה למניפולציה זו. יתר על כן, התוצאות שלנו להפגין כי על עיכוב של מטבוליזם הסלולר, ATeam 1.03ימק היחס הנכון טיפות במהירות בשני סוגי התא, המציין ירידה מהירה ב-ATP תאיים.
ביטוי של ATeam 1.03ימק בתרבויות הפרוסה האורגאולית מחייב תחזוקה של הרקמה בתרבות תחת תנאים מבוקרים לפחות 7-10 ימים. לחילופין, ateam 1.03ימק יכול גם להיות מועסק עבור מדידה של ATP ב מבודד ביותר פרוסות רקמת המוח בעצבים אופטיים של עכברים13,15. עם זאת, מדידות ברקמה מבודדת בחריפות, מצריכות את הדור של בעלי חיים טרנסגניים או יישום סטריאוטקטיקה של וקטורים ויראליים למוח, הכוללים ניסויים בבעלי חיים ופרוטוקולי טיפול קפדניים בבעלי חיים. בהקשר זה, הביטוי ateam 1.03ימק בתרבויות הפרוסות של רקמות הרקמה האורגאולית מייצג חלופה שימושית ובעלת ערך22,23. במשך שנים רבות, תרבויות אורגאוטימית של רקמה משמשות כמערכת מודל מבוססת לחקר תכונות עצביות, קישוריות ופיתוח24,25,26. הם לא רק לשמור על ארכיטקטורת רקמות כלליות למינציה (איור 1), אלא גם לארח את התכונות העליונות של תרביות תאים כגון נגישות מעולה ושליטה ישירה של התנאים הניסיוניים. הרקמות הפרוסות של הרקמה האורגנותית גם הן מועסקים באופן שגרתי כדי לבטא גנים זרים באמצעות וקטורים ויראליות27. מספר סוגים של וקטורים ויראליות דווחו לספק טרנסגנים לרקמת מוח16,28. וקטורים אדנונגיליים לגרום ביטוי גבוה בתאי גליה, אבל לא היפוקמאל נוירונים16, ועשוי ליצור תגובתיות פעילות מחודשת17. Adeno-וקטורים ויראליות הקשורים כפי שנעשה בשימוש כאן להגיח כחלופה טובה15, ואת האפקטיביות שלהם הוצגה גם ב vivo29.
בעוד בעיקר בשימוש למחקר של תכונות עצבי, מחקרים שנעשו לאחרונה הקימו כי הרקמות האורגאואליות הרקמה פרוסה יכול גם להיות מועסק לניתוח של אסטרוציטים. פרוסות מתרבות מכוסים בדרך כלל על ידי שכבה של אסטרוציטים התגובתית19,30 (איור 5), אבל אסטרוציטים מוצג יליד יותר, מורפולוגיה לא תגובתי ו ציטואדריכלות בשכבות עמוקות יותר19,30 (איור 5). במחקר הנוכחי, אנו מתארים הליך ההסרה המכנית של הצלקת גליה החיצוני, אשר מביא לנגישות ניסיוני ואופטי טוב יותר של האסטרוציטים יליד בתוך שכבות רקמות אורגאוטימית נכונה. כמו-כן, הסרתו משפרת את יעילות הביטוי ברבדים עמוקים יותר של הפרוסות האורגאואיות; אם הצלקת גליה לא יוסר, התמרה על ידי aavs עשוי להיות מוגבל לשכבות התא השטחית.
מספר גורמים מכניים חיצוניים צריכים להיחשב בעת ביצוע ניסויים בפרוסות רקמה. וריאציה על מהירות זלוף אמבטיה יכול לגרום לתנועות של ההכנה כולה ו/או לגרום לשינויים בפוקוס, וכתוצאה מכך שינויים ארעי מלאכותי של אות החיישן. יתר על כן, הן אסטרוציטים ונוירונים דווחו להגיב לדפורמציה מכני כגון מוטלות על ידי שיעורי זלוף גבוה32,33. בידינו, באמצעות המשאבה הפריסטלטית אמין, יחד עם שמירה על כמויות קטנות ויציבות של תמיסת מלח בין הרקמה לבין המטרה (meniscus) התוצאות לשמור יציבה האות תחת תנאים בסיסיים במהירות זלוף בשימוש כאן (1.5-2.5 mL/min; איור 8).
במחקר הנוכחי, אנו גם להדגים כי מבוסס על הדמיה עם ATeam 1.03ימק יכול להיות מועסק כדי לפקח על רמות ATP בנוירונים ו astrocytes. אמצעי חלופי הציג מוקדם יותר עבור מדידה של ATP הסלולר הוא כביכול לluciferin-לוציפראז שיטת34,35,36,37. גישה זו, עם זאת, מבוססת על הדמיה של biלומינסנציה, רק מספק הזמן נמוך למדי רזולוציה מרחבית חלקית בשל רמות רעש ברקע גבוה. שיטה נוספת המועסקים באופן שגרתי בשנים האחרונות היה הדמיה של שינויים בריכוז מגנזיום תאיים באמצעות מגנזיום fluorophoreה38הרגיש של היונים ירוק,39,40. גישה זו מתייחסת להתבוננות שצריכה של ATP גורמת לשחרורו של מגנזיום שיתוף הגורמים. הדמיה עם ירוק מגנזיום ובכך רק מספק הערכה משנית של שינויים ברמות ATP. יתר על כן, ירוק מגנזיום רגיש גם לשינויים בסידן תאיים, החדרת קושי אחר בעת פענוח תוצאות שהתקבלו עם שיטה זו.
הפיתוח האחרון של ננו חיישנים מקודד גנטית עבור הדמיה ישירה של מטבוליטים סלולריים, ולכן, ייצג צעד גדול קדימה11,12. חיישנים שונים מספר נוצרו כי יכול להיות מועסק עבור מדידה של ATP תאיים36,41,42,43. בין היתר, מחוון ה-ATP האומטרי ("QUEEN")41 , כמו גם הפרסיבל, החושי ה-atp: יחס ADP42. בעוד בדיקה האחרון הוא כלי רב ערך לחקר מעמד האנרגיה של תאים, זה דורש מדידה בו של שינויים ב-pH42.
ATeam הוא ננו חיישן שבו קיימים מספר משתנים, אשר-בין היתר-שונים בזיקה המחייב שלהם ל-ATP14. בתוך מבחנה, ATeam 1.03ימק מציג Kd של 1.2 מ"מ ב 37 ° c, אשר קרוב לרמות ATP סלולריים שנקבעו סוגים שונים של תאים עצביים, החל ההיפותלמוס ואת המוח המאלף34 להיפוקמפוס37,44,45. במדידות קובט, הפחתת הטמפרטורה ב-10 ° c הביאה לירידה משמעותית בזיקה המחייב של ATeam 1.03ימק ל-ATP, ומרמזת כי ייתכן שהיא אינה אידיאלית לדימות סלולרי בטמפרטורת החדר14. המחקר הקודם שלנו15, עם זאת, הפגינו כי ההתנהגות והתגובה של ateam 1.03ימק הביע בנוירונים ו אסטרוציטים למניפולציות שונות דומה באופן פיזיולוגי בטמפרטורת החדר, המציין כי החיישן מאפשר קביעה אמינה של רמות ה-ATP תאיים בשני התנאים. בנוסף, הניסויים הקודמים שלנו התייחס ל-pH רגישות של ATeam 1.03ימק בתוך תאים15, מראה כי זה לא רגיש לשינויים ב-ph תאיים על ידי כ 0.1-0.2 יחידות pH. אם ה-K d בטווח הנמוך מ"מ הוא דאגה, משתני ateam חלופיים עשויים לשמש14, ביניהם אדום העביר גרסאות של ATEAM (" GO-ateam ")43.
הניסויים שלנו באמצעות ateam 1.03ימק להדגים כי עלייה בריכוז היכולת המומנת של אשלגן על ידי כמה מ"מ בלבד (מ 3 עד 8 מ"מ) תוצאות עלייה ארעית ביחס ateam 1.03ימק ב אסטרוציטים בתרבות פרוסה של אורגנוסטימית. התבוננות זו מאשרת מחקרים מוקדמים יותר15,46 וברור מציין כי אסטרוציטים להגיב לשחרור של אשלגן על ידי הנוירונים פעילים עם עלייה בייצור ה-ATP שלהם, סביר להניח כתוצאה של גירוי של na+/k+-atpase ו Na+/hco3- coטרנספורטר, בהתאמה47,48. בניגוד לזה, נוירונים לא הראו תגובה, אשר בקנה אחד עם עבודה קודמת כמו גם15. שני התאים, עם זאת, במהירות ובחוזקה הגיבו לעיכוב של גליקוליזה הסלולר ונשימה מיטוכונדריאלי כפי שמוצג לפני15. בתנאים של איסכמיה כימית, יחסי ATeam היחס נפל לרמה יציבה חדשה, המציינת דלדול נומינלי של ATP הסלולר. התוצאה האחרונה עולה כי הן הנוירונים כמו גם אסטרוציטים התערוכה צריכה רלוונטית של ATP גם בתנאים יציבים ללא גירוי נוסף על ידי הפעלה סינפטית או יישום של נוירוטרנסמיטורים. יחד, אנו מסיקים כי הדמיה מבוססת על-ידי מבוסס-על-ידי שיטה מקודדת מבחינה גנטית, ביניהם ATeam 1.03ימק, תספק גישה בעלת ערך רב להסבר התהליכים הסלולריים האחראים לשינויים ברמות ה-atp התאיים ובצריכת ה-atp הסלולרית בתנאים שונים.
Disclosures
המחברים לא מצהירים על אינטרסים מתחרים. המחברים קיבלו תמיכה פיננסית המאפשרת פרסום גישה פתוחה על ידי מיקרוסקופ ניקון פתרונות, דיסלדורף, גרמניה, אשר מייצרת מכשירים המשמשים במאמר וידאו. החברה לא הייתה מעורבת בעיצוב הניסויים שהוצגו כאן, וגם לא בביצוע, ולא בטיפול בנתונים, ולא בכתב היד.
Acknowledgements
המחברים רוצים להודות לקלאודיה רודריגו וסימון דוררי לסיוע טכני מומחה. אנו מודים לד ר ניקלאס ג' גרקאו ולM.Sc יואל נלסון לסיוע בהכנת תרביות הפרוסה האורגאולית. מחקר במעבדה של המחבר מומן על ידי האגודה הגרמנית למחקר (DFG; עבור 2795: Ro 2327/13-1 ו SPP 1757: Ro 2327/8-2 ל-CRR; ו-SPP 1757: מימון הסטארט-Up הצעיר של גליה ל RL).
Materials
| Name | Company | Catalog Number | Comments |
| 2-deoxyglucose | Alfa Aesar | L07338 | Non-metabolizable glucose analog |
| 36-IMA-410-019 Argon laser | Melles Griot | 488 nm wavelength argon | |
| Ascorbic acid | Carl Roth | 3525.1 | Antioxidant, Vitamin C |
| band pass filters 483/32 | AHF Analysentechnik AG | Splitter compatible emmision filter | |
| band pass filters 542/27 | AHF Analysentechnik AG | Splitter compatible emmision filter | |
| Beamsplitter T 455 LP | AHF Analysentechnik AG | Excitation dichroic mirror | |
| Beamsplitter T 505 LPXR | AHF Analysentechnik AG | Splitter dichroic | |
| Confocal laser scannig microscope C1 | Nikon Microscope Solutions | Modular confocal microscope system C1 | |
| Data processing Origin Pro 9.0.0 (64-bit) | OriginLab corporation | Scientific graphing and data analysis software | |
| D-glucose monohydrate | Caelo | 2580-1kg | |
| DPBS | GIBCO/Life | 14190250 | Dulbecco's phosphate-buffered saline |
| Eclipse E 600FN upright microscope | Nikon Microscope Solutions | ||
| Eclipse FN1 upright microscope | Nikon Microscope Solutions | ||
| Experimental chamber | custom build | Perfusion chamber for live-cell imaging | |
| EZ-C1 Silver Version 3.91 | Nikon Microscope Solutions | Imaging software for confocal microscope | |
| Hanks' Balanced Salt solution | Sigma-Aldrich | H9394 | With Phenol Red for pH monitoring |
| HERAcell 150 | Thermo Scientific | CO2 incubator HERAcell ® 150 with decontamination routine | |
| HERAsafe KS/KSP | Thermo Scientific | Safety Cabinet | |
| Horse serum | GIBCO/Life | 26050088 | Heat inactivated |
| Huygens Professional | SVI Imaging | Deconvolution software | |
| Image J 1.52i | Wayne Rasban national Institute of Health | Image processing Software available in the public domain | |
| Insulin | Sigma-Aldrich | I6634 | Insulin from bovine pancreas |
| IP serie peristaltic pump | Ismatec | High-precisionmulti-channel pump | |
| Layout software, Illustrator CS6 | Adobe | Vector graphics editor | |
| L-glutamine | GIBCO/Life | 25030024 | |
| Microm HM 650 V | Thermo Scientific | Vibration microtome. Thermo scientific discontinued the production of the device in the meantime. Any other slicer or tissue chopper siutable for slicing living tissue is fine, too. | |
| Microscope stage | custom build | ||
| Microsoft Excel 16 | Microsoft | Spreadsheet software for basic data processing | |
| Millicell culture insert | Merck Millipore | PICM0RG50 | Hydrophilized PTFE, pore size 0.4 μm |
| Minimum Essential Medium Eagle | Sigma-Aldrich | M7278 | Synthetic cell culture media |
| Monochromator Polychrome V | Thermo Scientific/FEI | Ultra fast switching monochromator | |
| NaN3 (Sodium Azide) | Sigma-Aldrich | S-8032 | Mitochondrial inhibitor (complex IV inhibitor). CAUTION: Azide is toxic. Be aware not to accidentally ingest or inhale it, and prevent ist absoption through the skin. |
| Nikon Fluor 40x / 0.80 W DIC M ∞/0 WD 2.0 | Nikon Microscope Solutions | Water Immersion Microscope Objective | |
| NIS Elements 4.50 advanced Research | Nikon Microscope Solutions | Imaging software. Upgraded version for FRET imaging | |
| ORCA-Flash4.0 | Hamamatsu Photonics | Digital CMOS camera | |
| Perfusion tubing | Pro Liquid GmbH | Tygon tubing, 1.52 x 322 mm (Wd: 0.85) | |
| Photoshop CS 6 Version 13.0 | Adobe | Image processing software | |
| Sodium L-lactate | Sigma-Aldrich | 71718-10G | |
| ssAAV-2/2-hSyn1-ATeam1.03YEMK-WPRE-hGHp(A) | ETH Zürich | v244 | Single-stranded AAV vector that induces the expression of ATeam1.03YEMK under the control of the human synapsin 1 promoter fragment hSyn1. |
| ssAAV-5/2-hGFAP-hHBbI/E-ATeam1.03YEMK-WPRE-bGHp(A) | ETH Zürich | v307 | Single-stranded AAV vector that induces the expression of ATeam1.03YEMK under the control of the human glial fibrillary acidic protein promoter fragment ABC1D. |
| WVIEW GEMINI optic system | Hamamatsu Photonics | Emission Image Splitter |
References
- Sweadner, K. J. Isozymes of the Na+/K+-ATPase. Biochimica et Biophysica Acta. 988, 185-220 (1989).
- Clapham, D. E. Calcium signaling. Cell. 131, 1047-1058 (2007).
- Cotter, K., Stransky, L., McGuire, C., Forgac, M. Recent Insights into the Structure, Regulation, and Function of the V-ATPases. Trends in Biochemical Sciences. 40, 611-622 (2015).
- Harris, J. J., Jolivet, R., Attwell, D. Synaptic energy use and supply. Neuron. 75, 762-777 (2012).
- Brown, A. M., Ransom, B. R. Astrocyte glycogen and brain energy metabolism. Glia. 55, 1263-1271 (2007).
- Hertz, L., et al. Roles of astrocytic Na+,K+-ATPase and glycogenolysis for K+ homeostasis in mammalian brain. Journal of Neuroscience Research. 93, 1019-1030 (2015).
- Allaman, I., Belanger, M., Magistretti, P. J. Astrocyte-neuron metabolic relationships: For better and for worse. Trends in Neurosciences. 34, 76-87 (2011).
- Barros, L. F., Deitmer, J. W. Glucose and lactate supply to the synapse. Brain Research Reviews. 63, 149-159 (2010).
- Diaz-Garcia, C. M., et al. Neuronal Stimulation Triggers Neuronal Glycolysis and Not Lactate Uptake. Cell Metabolism. 26, 361-374 (2017).
- Diaz-Garcia, C. M., et al. Quantitative in vivo imaging of neuronal glucose concentrations with a genetically encoded fluorescence lifetime sensor. Journal of Neuroscience Research. 97, 946-960 (2019).
- Barros, L. F., et al. Current technical approaches to brain energy metabolism. Glia. 66, 1138-1159 (2018).
- Tantama, M., Hung, Y. P., Yellen, G. Optogenetic reporters: Fluorescent protein-based genetically encoded indicators of signaling and metabolism in the brain. Progress in Brain Research. 196, 235-263 (2012).
- Trevisiol, A., et al. Monitoring ATP dynamics in electrically active white matter tracts. eLife. 6, e24241(2017).
- Imamura, H., et al. Visualization of ATP levels inside single living cells with fluorescence resonance energy transfer-based genetically encoded indicators. Proceedings of the National Academy of Sciences of the United States of America. 106, 15651-15656 (2009).
- Lerchundi, R., et al. FRET-based imaging of intracellular ATP in organotypic brain slices. Journal of Neuroscience Research. , 1-13 (2018).
- Ehrengruber, M. U., et al. Gene transfer into neurons from hippocampal slices: comparison of recombinant Semliki Forest Virus, adenovirus, adeno-associated virus, lentivirus, and measles virus. Molecular and Cellular Neurosciences. 17, 855-871 (2001).
- Woo, J., et al. Functional Characterization of Resting and Adenovirus-Induced Reactive Astrocytes in Three-Dimensional Culture. Experimental Neurobiology. 26, 158-167 (2017).
- Close, B., et al. Recommendations for euthanasia of experimental animals: Part 2. DGXT of the European Commission. Laboratory Animals. 31, 1-32 (1997).
- Benediktsson, A. M., Schachtele, S. J., Green, S. H., Dailey, M. E. Ballistic labeling and dynamic imaging of astrocytes in organotypic hippocampal slice cultures. Journal of Neuroscience Methods. 141, 41-53 (2005).
- Lanjakornsiripan, D., et al. Layer-specific morphological and molecular differences in neocortical astrocytes and their dependence on neuronal layers. Nature Communications. 9, 1623(2018).
- Bushong, E. A., Martone, M. E., Ellisman, M. H. Examination of the relationship between astrocyte morphology and laminar boundaries in the molecular layer of adult dentate gyrus. The Journal of Comparative Neurology. 462, 241-251 (2003).
- Frotscher, M., Zafirov, S., Heimrich, B. Development of identified neuronal types and of specific synaptic connections in slice cultures of rat hippocampus. Progress in Neurobiology. 45, vii-xxviii (1995).
- Galimberti, I., et al. Long-term rearrangements of hippocampal mossy fiber terminal connectivity in the adult regulated by experience. Neuron. 50, 749-763 (2006).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37, 173-182 (1991).
- Forster, E., Zhao, S., Frotscher, M. Laminating the hippocampus. Nature Reviews. Neuroscience. 7, 259-267 (2006).
- Holopainen, I. E. Organotypic Hippocampal Slice Cultures: A Model System to Study Basic Cellular and Molecular Mechanisms of Neuronal Cell Death, Neuroprotection, and Synaptic Plasticity. Neurochemical Research. 30, 1521-1528 (2005).
- Teschemacher, A. G., et al. Targeting specific neuronal populations using adeno- and lentiviral vectors: applications for imaging and studies of cell function. Experimental Physiology. 90, 61-69 (2005).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Advances in Genetics. 87, 125-197 (2014).
- Mächler, P., et al. In Vivo Evidence for a Lactate Gradient from Astrocytes to Neurons. Cell Metabolism. 23, 94-102 (2016).
- Schreiner, A. E., Berlinger, E., Langer, J., Kafitz, K. W., Rose, C. R. Lesion-Induced Alterations in Astrocyte Glutamate Transporter Expression and Function in the Hippocampus. ISRN Neurology. 2013, 893605(2013).
- Haber, M., Zhou, L., Murai, K. K. Cooperative astrocyte and dendritic spine dynamics at hippocampal excitatory synapses. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 26, 8881-8891 (2006).
- Neary, J. T., Kang, Y., Tran, M., Feld, J. Traumatic injury activates protein kinase B/Akt in cultured astrocytes: role of extracellular ATP and P2 purinergic receptors. Journal of Neurotrauma. 22, 491-500 (2005).
- Xia, J., et al. Neurons respond directly to mechanical deformation with pannexin-mediated ATP release and autostimulation of P2X7 receptors. The Journal of Physiology. 590, 2285-2304 (2012).
- Ainscow, E. K., Mirshamsi, S., Tang, T., Ashford, M. L., Rutter, G. A. Dynamic imaging of free cytosolic ATP concentration during fuel sensing by rat hypothalamic neurones: evidence for ATP-independent control of ATP-sensitive K+ channels. The Journal of Physiology. 544, 429-445 (2002).
- Arcuino, G., et al. Intercellular calcium signaling mediated by point-source burst release of ATP. Proceedings of the National Academy of Sciences of the United States of America. 99, 9840-9845 (2002).
- Rajendran, M., Dane, E., Conley, J., Tantama, M. Imaging Adenosine Triphosphate (ATP). The Biological Bulletin. 231, 73-84 (2016).
- Rangaraju, V., Calloway, N., Ryan, T. A. Activity-driven local ATP synthesis is required for synaptic function. Cell. 156, 825-835 (2014).
- Chatton, J. Y., Pellerin, L., Magistretti, P. J. GABA uptake into astrocytes is not associated with significant metabolic cost: implications for brain imaging of inhibitory transmission. Proceedings of the National Academy of Sciences of the United States of America. 100, 12456-12461 (2003).
- Magistretti, P. J., Chatton, J. Y. Relationship between L-glutamate-regulated intracellular Na+ dynamics and ATP hydrolysis in astrocytes. Journal of Neural Transmission (Vienna). 112, 77-85 (2005).
- Langer, J., et al. Rapid sodium signaling couples glutamate uptake to breakdown of ATP in perivascular astrocyte endfeet. Glia. 65, 293-308 (2017).
- Yaginuma, H., et al. Diversity in ATP concentrations in a single bacterial cell population revealed by quantitative single-cell imaging. Scientific Reports. 4, 6522(2014).
- Tantama, M., Martinez-Francois, J. R., Mongeon, R., Yellen, G. Imaging energy status in live cells with a fluorescent biosensor of the intracellular ATP-to-ADP ratio. Nature Communications. 4, 2550(2013).
- Nakano, M., Imamura, H., Nagai, T., Noji, H. Ca2+ Regulation of Mitochondrial ATP Synthesis Visualized at the Single Cell Level. ACS Chemical Biology. 6, 709-715 (2011).
- Mollajew, R., Toloe, J., Mironov, S. L. Single KATP channel opening in response to stimulation of AMPA/kainate receptors is mediated by Na+ accumulation and submembrane ATP and ADP changes. The Journal of Physiology. 591, 2593-2609 (2013).
- Pathak, D., et al. The Role of Mitochondrially Derived ATP in Synaptic Vesicle Recycling. The Journal of Biological Chemistry. 290, 22325-22336 (2015).
- Karus, C., Mondragao, M. A., Ziemens, D., Rose, C. R. Astrocytes restrict discharge duration and neuronal sodium loads during recurrent network activity. Glia. 63, 936-957 (2015).
- Larsen, B. R., Stoica, A., MacAulay, N. Managing Brain Extracellular K+ during Neuronal Activity: The Physiological Role of the Na+/K+-ATPase Subunit Isoforms. Frontiers in Physiology. 7, 141(2016).
- Ruminot, I., et al. NBCe1 mediates the acute stimulation of astrocytic glycolysis by extracellular K+. The Journal of Neuroscience : The Official Journal of the Society for Neuroscience. 31, 14264-14271 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved