Method Article
Programa de Espectrograma Multitaper basado en Computadora para Datos Electroencefalográficos
En este artículo
Resumen
Este protocolo proporciona un programa MATLAB compilado de código abierto que genera espectrogramas multicórmores para datos electroencefalográficos.
Resumen
Los recursos web actuales proporcionan herramientas limitadas y fáciles de usar para calcular espectrogramas para visualizar y cuantificar datos electroencefalográficos (EEG). Este artículo describe un código fuente abierto basado en Windows para crear espectrogramas multitaper EEG. El programa compilado es accesible para los usuarios de Windows sin licencias de software. Para los usuarios de Macintosh, el programa se limita a aquellos con una licencia de software MATLAB. El programa se ilustra a través de espectrogramas EEG que varían en función de los estados de sueño y vigilia, y alteraciones inducidas por opiáceos en esos estados. Las EEG de ratones C57BL/6J se registraron de forma inalámbrica durante 4 horas después de la inyección intraperitoneal de salina (control del vehículo) y dosis antinociceptivas de morfina, buprenorfina y fentanilo. Los espectrogramas mostraron que la buprenorfina y la morfina causaron cambios similares en la potencia del EEG a 1-3 Hz y 8-9 Hz. Los espectrogramas después de la administración de fentanilo revelaron bandas de potencia medias máximas a 3 Hz y 7 Hz. Los espectrogramas desenmascarados efectos diferenciales de opiáceos en la frecuencia y potencia del EEG. Estos métodos basados en computadoras son generalizables en todas las clases de medicamentos y se pueden modificar fácilmente para cuantificar y mostrar una amplia gama de señales biológicas rítmicas.
Introducción
Los datos de EEG se pueden analizar productivamente en el dominio de frecuencia para caracterizar los niveles de excitación conductual y neurofisiológica1. Los espectrogramas multicóer transforman la forma de onda EEG en dominios de tiempo y frecuencia, lo que resulta en la visualización de la potencia de la señal dinámica a diferentes frecuencias a lo largo del tiempo. El espectrograma multicórmor utiliza el análisis de Fourier para producir estimaciones de densidad espectral. La estimación de la densidad espectral separa una forma de onda en las ondas sinusoidales puras que componen la señal y es análoga a la difracción de la luz blanca a través de un prisma para ver todo el espectro de colores2. El espectrograma multicóer del EEG representa la actividad combinada de múltiples redes de neuronas con patrones de descarga que oscilan a diferentes frecuencias2. Debido a su invariante de cambio de hora, la transformación de Fourier se considera la mejor transformación entre los dominios de tiempo y frecuencia3. El análisis de Fourier también tiene una serie de limitaciones. Las señales EEG no son estacionarias. Por lo tanto, es posible que no se perciban pequeños cambios en los métodos de Fourier y el análisis puede cambiar en función del tamaño del conjunto de datos. Sin embargo, las ventanas se utilizan al aplicar una transformación de Fourier a una señal no estacionaria. Esto supone que el espectro de la señal cambia sólo marginalmente durante períodos cortos de tiempo. Un método alternativo para el análisis espectral es la transformación de las ondas que puede ser más adecuada para detectar enfermedades cerebrales3.
Desde una perspectiva funcional, las diferentes oscilaciones que comprenden una señal EEG son fenotipos de menor nivel, rasgo característicos de nivel superior, fenotipos de estado como el sueño y la vigilia2, o la pérdida de vigilia causada por los anestésicos generales4,5,6. En cuanto a los estados de sueño y vigilia, el espectrograma ilustra claramente que los ritmos de sueño generados endógenamente son continuos y dinámicos7. Las descripciones cuantitativas de los estados de sueño y vigilia han implicado tradicionalmente un proceso de binning que asigna una clasificación de sueño o vigilia a cada época definida específicamente (por ejemplo, 10 s) de grabación EEG. A continuación, estas ubicaciones de estado se trazan en función del tiempo. Las gráficas de datos del curso de tiempo, a menudo conocidas como hipnogramas, se utilizan para diferenciar el sueño normal del sueño que se ve interrumpido por la enfermedad, administración de fármacos, cambios en los ritmos circadianos, trabajo por turnos, etc. Una limitación de las gráficas de hipnografíaes es que tergiversan las señales EEG expresando estados de excitación como formas de onda cuadradas. El trazado de hipnografía implica una discretización de los estados de excitación2 y no permite una visualización finamente granulada de las etapas intermedias o de transición. Además, las épocas de puntuación de 10 s producen una discretización del tiempo imponiendo un límite inferior en la escala de tiempo. El resultado de la discretización tanto del estado como del tiempo es la pérdida de información neurofisiológica sobre la interacción dinámica entre los estados de conciencia2 y la interrupción inducida por drogas de estos estados4. Por ejemplo, diferentes agentes anestésicos actúan sobre diferentes dianas moleculares y redes neuronales. La manipulación farmacológica de estas redes neuronales produce de forma fiable espectrogramas exclusivas de la droga, la dosis y la vía de administración4.
El presente protocolo fue desarrollado para facilitar la investigación sobre los mecanismos por los cuales los opioides alteran el sueño8, respirando9, nocicepción10,y neuroquímica cerebral11. Este protocolo describe los pasos necesarios para crear un espectrograma multitapered para análisis EEG que se puede completar utilizando software propietario o un sistema que no tiene licencias MATLAB. Los ratones C57BL/6J (B6) se utilizaron para validar la capacidad de este método basado en computadora para crear nuevos espectrogramas EEG durante los estados normales y no perturbados de sueño y vigilia y después de la administración sistémica de opiáceas. La fiabilidad y validez de los análisis se confirmaron mediante comparaciones sistemáticas de diferencias entre espectrogramas EEG después de que los ratones B6 recibieran inyecciones intraperitoneales de solución salina (control del vehículo) y dosis antinociceptivas de morfina, buprenorfina y fentanilo.
Los estudios cuantitativos de la dinámica del EEG del ratón neonatal tienen relevancia traslacional al proporcionar un modelo para los estudios destinados a lograr una mejor comprensión del EEG humano neonatal12. La cuantificación de la dinámica del EEG no es meramente descriptiva y puede contribuir a los enfoques de aprendizaje automático que pueden predecir la excitación basada en parte en los datos eEG13. El objetivo del presente informe es promover la ciencia traslacional proporcionando un código ampliamente accesible y fácil de usar para calcular espectrogramas multicórmores que caracterizan los cambios inducidos por fármacos en el EEG del ratón.
Protocolo
Todos los procedimientos relacionados con ratones se adhirieron a la Guía para el Cuidado y Uso de Animales de Laboratorio(8a edición, National Academies Press, Washington DC, 2011) y fueron revisados y aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Tennessee.
1. Implantación de electrodos de grabación y recopilación de datos iniciales
- Compre ratones y guárdelos en una habitación con humedad y temperatura controlada con acceso ad libitum a alimentos y agua. Permita que los ratones se adapten a su nuevo entorno durante una semana antes de la implantación quirúrgica de electrodos de grabación. El procedimiento de implantación se ha descrito detalladamente1,14.
- Esterilice todo el equipo quirúrgico.
- Anestetizar ratones con isoflurano a 2.5%-3% entregado en 100% de oxígeno.
- Después de la pérdida del reflejo de enderece, retire el ratón de la cámara de inducción de anestesia y transfiéralo a un marco estereotaxico.
- Aplique una pomada oftálmica en ambos ojos.
- Reduzca el isoflurano al 1,7%, entregado continuamente a través de una máscara.
- Haga una incisión del cuero cabelludo de la línea media para exponer el cráneo.
- Taladre dos craneotomías por encima de la corteza izquierda y derecha (cada una en las coordenadas estereoofilascas anteriores a 1,0 y laterales a 3,0 en relación con el bregma15).
- Inserte los electrodos EEG en cada craneotomía y asegúrelos con acrílico dental.
- Implante de electrodos bipolares en el músculo trapecio dorsal para registrar el electromiograma (EMG).
NOTA: Los cuatro electrodos se llevan a un telemetro inalámbrico implantado por vía subcutánea por encima del cuadrante inferior del cuerpo derecho. Estas técnicas quirúrgicas se pueden ver aquí (https://www.datasci.com/services/dsi-surgical-services/surgical-videos). - Después de la cirugía, administrar carprofeno analgésico y colocar el ratón en una jaula de recuperación caliente. Observe el ratón hasta que esté ambulatorio. Casa implantada ratones individualmente.
- Tras la recuperación completa de la cirugía, maneje ratones diariamente y evalúe la calidad de las grabaciones de EEG y EMG.
- Configure el sistema de adquisición de datos para registrar todas las señales a 1.000 mV.
- Obtenga grabaciones EEG y EMG durante el tiempo necesario.
- Puntuar cada cubo de 10 s de las grabaciones digitales EEG y EMG como vigilia, movimiento ocular rápido (REM) sueño, o sueño no REM (NREM) utilizando software de puntuación de sueño.
NOTA: Entre las cepas de ratón hay diferencias específicas del genotipo y del estado en la potencia del EEG expresadas como un porcentaje de la potencia total16. En ratones B6, los estados de vigilia se caracterizan por un EEG de frecuencia mixta de 75 a 100 mV, y por señales EMG que muestran un tono muscular prominente con grandes aumentos de amplitud durante el movimiento. Los criterios para la puntuación de sueño NREM incluyen una reducción en la amplitud de EMG en relación con la amplitud EMG de la vigilia. El EEG de sueño NREM tiene una frecuencia más lenta y una amplitud aumentada (100-150 mV) en comparación con la vigilia. El sueño REM se caracteriza por la atonía muscular y una señal eEG que es similar al EEG de la vigilia. - Instruya a dos personas para que anoten el mismo registro de forma independiente. Al menos una persona debe cegarse a la condición del tratamiento. Los valores de concordancia entre los dos marcadores de sueño deben ser superiores al 90%.
2. Instalaciones y equipos
- Amplifique y digitalice las señales EEG y EMG sin filtrar utilizando instrumentación y software de adquisición de datos.
NOTA: La caja de herramientas de análisis espectral de Chronux desarrollada en el Laboratorio Mitra del Laboratorio Cold Spring Harbor se utiliza para expresar señales EEG como potencia en relación con los dominios de tiempo y frecuencia.
3. Cálculo del espectrograma
- Si es un usuario de Windows, utilice el programa compilado.
- Si es un usuario de Macintosh, ejecute el archivo de código sin formato.
- Obtenga datos EEG sin procesar en formato de archivo EDF o CSV y colóquelos en la misma ubicación que el archivo de programa compilado.
- Asigne un nombre a los archivos de datos con las siguientes restricciones: los nombres deben constar únicamente de letras, números, guiones bajos o guiones.
- Asigne un nombre a los archivos de datos con las siguientes restricciones: los nombres de archivo no deben contener puntos, comas, espacios ni ningún otro símbolo.
- Descargue el Programa de Espectrograma Multitaper compilado (https://drive.google.com/).
- Inicie el programa de espectrograma y siga las indicaciones emergentes. Elija el tipo de archivo: *. CSV o *. Fed.
NOTA: Más detalles de instalación del programa se encuentran en el archivo readme.txt. - Escriba el nombre completo del archivo EEG (por ejemplo, 419eeg.edf o 419.eeg.csv).
- Seleccione parámetros para el cálculo del espectrograma: Predeterminado o Nuevo. Este paso requiere el tiempo de procesamiento más largo a medida que se calcula el espectrograma. La función de ventanas matemáticas (taper) proporciona estimaciones estadísticamente independientes del espectro subyacente. Cuanto más larga sea la duración de la grabación, más tiempo tardará este paso. En una plataforma de PC que ejecuta Windows 10, esto requería un máximo de aproximadamente 3 x 4 minutos para una grabación de 4 horas.
- Utilice los siguientes parámetros de espectrograma predeterminados:
Frecuencia de muestreo a 500 Hz. Esto representa el número de muestras por segundo.
fpass a 0,3 Hz y 30 Hz. Fpass define las frecuencias de entrada y controla el rango de frecuencias suministradas en la salida.
Relleno 2. El relleno funciona para interpolar finamente la salida sin afectar al cálculo del resultado de ninguna manera. Esto puede ayudar con la visualización y la identificación precisa de las líneas espectrales. El campo es cualquier entero de -1 y más.
Producto de ancho de banda de tiempo (NW) n.o 15. El producto de la duración temporal de la señal y la anchura espectral.
Número de cintas 29. Al elegir el número de cintas, es esencial utilizar 2NW-1. No hay límite en el número de cintas utilizadas. Los más tapers utilizados darán lugar a la inclusión de cintas con baja concentración en el ancho de banda de frecuencia especificado.
Promedio de prueba 1. Este parámetro rige si se realiza o no la prueba o el promedio de canal. Si este parámetro se establece en 0, no hay un promedio de canal y la función generará resultados independientes para cada prueba o canal pasado como datos de entrada. Sin embargo, si el promedio de prueba se establece en 1, la salida de resultados para el usuario se promedia en pruebas o canales.
Tiempo para calcular FFT 30 s. Se utiliza para seguir la evolución del espectro mediante el cálculo del espectro en muchas ventanas pequeñas.
Tamaño de paso de la ventana para el cálculo de FFT 5. La cantidad que avanza la ventana de tiempo deslizante después de realizar cada cálculo de espectro.
NOTA: Los parámetros de espectrograma predeterminados indicados en el paso 3.7.1 se pueden cambiar según sea necesario.
- Utilice los siguientes parámetros de espectrograma predeterminados:
- Introduzca títulos tanto para el espectrograma como para el EEG.
- Guarde el espectrograma resultante y el EEG.
- Guardar figuras haciendo clic en Archivo ( File) Guardar en la ventana de figura.
NOTA: Las cifras proporcionarán a los usuarios del programa resúmenes que pueden convertirse en cifras de calidad de publicación.
- Guardar figuras haciendo clic en Archivo ( File) Guardar en la ventana de figura.
4. Solución de problemas
- Descargue los datos de EEG de suspensión del ratón de muestra para el cálculo del espectrograma de muestra.
- Ejecute el programa con los datos de ejemplo para asegurarse de que el usuario está utilizando correctamente el programa. Encuentre las cifras de estos datos de muestra en el apéndice para asegurarse de que las cifras creadas a partir de los datos de muestra son precisas.
NOTA: Todos los equipos y materiales utilizados se han proporcionado en la Tabla de Materiales.
Resultados
Las siguientes figuras ilustran el tipo de ideas novedosas sobre los índices EEG de excitabilidad cerebral que son proporcionados por espectrogramas.
La Figura 1A ilustra similitudes y diferencias en el EEG cortical durante la vigilia, el sueño NREM y el sueño REM. Muchos investigadores utilizan este tipo de trazas, junto con las grabaciones de EMG (no mostradas), para cuantificar el sueño y la vigilia. La Figura 1B utiliza una gráfica de hipnografía para transmitir la organización temporal de los estados de sueño y vigilia basado en evaluaciones de grabaciones EEG y EMG. Los Estados fueron puntuados en épocas de 10 s y estas épocas fueron trazadas como el hipnograma durante los 14.400 s que componen la grabación de 4 h. Las gráficas de hipnografía no ilustran el hecho de que las transiciones entre estados son continuas y no lineales. A diferencia de una gráfica de hipnografía, el espectrograma(Figura 1C) ilustra cambios muy dinámicos en la frecuencia y potencia del EEG en función del tiempo. El espectrograma también resalta las similitudes entre la señal cortical EEG durante la vigilia y durante el sueño REM. Las tres cajas superpuestas en el espectrograma (Figura 1C) marca indica identificado como vigilia (WAKE), Sueño NREM, y sueño REM en el hipnograma anterior (Figura 1B) y se proporcionan para ayudar a visualizar los cambios detallados en la frecuencia y potencia Del EEG. El espectrograma para toda la grabación proporciona una apreciación matizada del EEG como un proceso continuo.
La Figura 2 proporciona cuatro espectrogramas multicórmores, cada uno de los que resume 4 h de grabaciones EEG después de la administración intraperitoneal de solución salina, morfina, buprenorfina y fentanilo. Las cuatro grabaciones son del mismo ratón y se iniciaron 2 h después del inicio de la luz. Los opiácicos, pero no la salina, inhibió el sueño NREM y REM, y aumentó la cantidad de vigilia. Una serie de características novedosas son visualizadas por los espectrogramas. La detección de nuevas características de EEG sugiere la posible aplicación para la diferenciación de opiáceos en un entorno de amenazas químicas. Después de la inyección salina(Figura 2A) la mayor cantidad de energía residía en el rango de 2 a 4 Hz, lo que indica el sueño NREM. Tenga en cuenta que los espectrogramas EEG fueron fundamentalmente alterados por la administración de opiáceos, y que cada opiáceo causó cambios espectrales únicos.
La Figura 3 demuestra que los cambios de EEG ilustrados por los espectrogramas se pueden cuantificar y expresar como potencia espectral dominante promedio de cada media frecuencia(Figura 3A)y como la potencia espectral media dentro de bandas de frecuencia EEG específicas(Figura 3B). Las mayores diferencias con la salina fueron causadas por buprenorfina y ocurrieron en los rangos delta y theta.
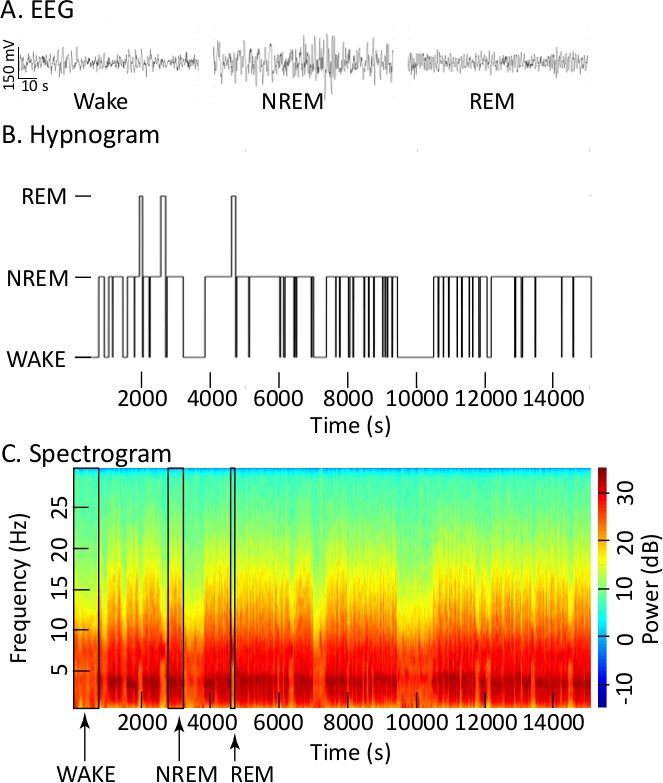
Figura 1: Grabaciones corticales de EEG utilizadas para crear hipnogramas y espectrogramas. (A) Formas de onda EEG registradas durante la vigilia, el sueño NREM y el sueño REM durante una grabación de línea de base (sin inyección). Cada rastro muestra 90 s de grabación. (B) El hipnograma utiliza la altura de las barras para transmitir el estado de conciencia (ordinado) frente a 4 h de grabación (abscisa). (C) Espectrograma cónico utilizando una barra de color para transmitir potencia EEG en decibelios (dB, coordenada derecha) o densidad de potencia espectral a diferentes frecuencias EEG en Hertz (Hz, coordenada izquierda) en función de 4 h de tiempo de grabación (abscisa). Se han añadido líneas verticales negras al espectrograma para delinear un episodio cada uno de vigilia, sueño NREM y sueño REM. (Parámetros de espectrograma: frecuencia de muestreo de 500 Hz, fpass a 0,3 Hz y 30 Hz, relleno 2, ancho de banda de tiempo 15, número de tapers 29, promedio de prueba 1, duración del tiempo de cálculo de FFT a 30 s, tamaño de paso de la ventana para el cálculo de FFT 5). Haga clic aquí para ver una versión más grande de esta figura.
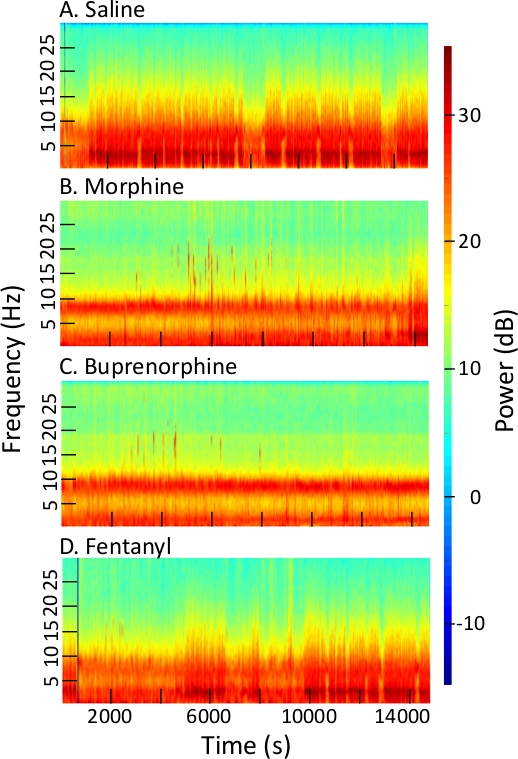
Figura 2: Espectrogramas que ilustran los cambios en la potencia y frecuencia del EEG causados por la administración de opiáceos. Cada espectrograma traza la frecuencia eEG en hercios (Hz, coordenada izquierda) y decibelios (dB) de potencia EEG utilizando una barra de color (coordenada derecha) durante 4 h (abscisa) después de la administración de (A) salina, (B) morfina, (C) buprenorfina, y (D) fentanilo. (Parámetros de espectrograma: frecuencia de muestreo de 500 Hz, fpass a 0,3 Hz y 30 Hz, relleno 2, ancho de banda de tiempo 15, número de tapers 29, promedio de prueba 1, tiempo para calcular FFT a 30 s, tamaño de paso de la ventana para el cálculo de FFT 5). Haga clic aquí para ver una versión más grande de esta figura.
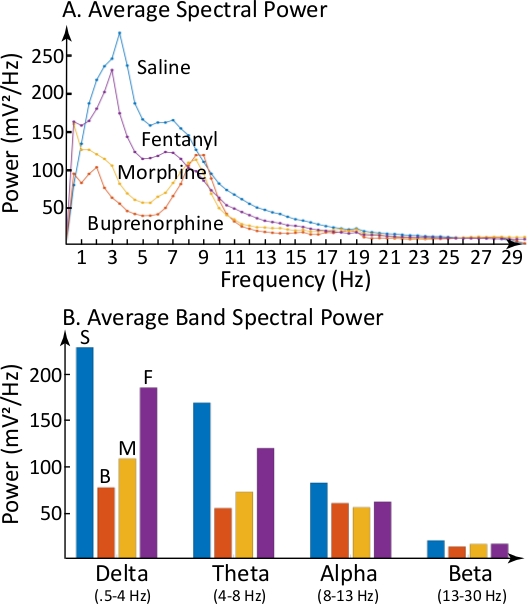
Figura 3: Opiátas alteró diferencialmente la potencia media del EEG dentro de las bandas de frecuencia delta y theta EEG. (A) Resume la potencia media del EEG durante cada grabación de 4 h que se muestra en la Figura 2. Las gráficas ordenadas tienen una potencia media de EEG en cada media frecuencia (abscisa). En relación con el control salino, cada una de las otras tres funciones muestran alteraciones específicas de opiáceos en la potencia media del EEG. (B) Ilustra la potencia media del EEG en cuatro bandas de frecuencia EEG (delta, theta, alpha y beta) después de la administración de salina (S), buprenorfina (B), morfina (M) y fentanilo (F). La codificación de color es la misma para las funciones de potencia en A y las bandas de potencia promedio en B. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El programa descrito aquí fue desarrollado para crear un espectrograma utilizando los nueve pasos descritos en la sección de protocolo 3, Cálculo del espectrograma. Estos pasos implican la adquisición del programa de espectrograma, asegurar el formato de archivo correcto y alterar los parámetros computacionales para la generación de espectrogramas de usuario únicos. Los usuarios pueden crear espectrogramas adaptados a una amplia gama de preguntas conceptuales y diseños experimentales. Con el fin de mejorar la facilidad y eficiencia de este proceso de desarrollo, es esencial proporcionar los datos EEG sin procesar en el formato de archivo correcto, nombrado según las restricciones descritas anteriormente. Aunque se han proporcionado señales de ejemplo para los datos de EEG del ratón, el programa de espectrograma es fácilmente aplicable a los datos EEG humanos y no humanos que están libres de limitaciones de procesamiento de señales.
El enfoque recomendado para la solución de problemas y la modificación del método es comenzar mediante el análisis de un conjunto de datos pequeño. Las principales salidas del programa a considerar incluyen parcelas del EEG filtrado, así como el espectrograma. Un aspecto atractivo del espectrograma cónico es que se puede aplicar a una amplia variedad de señales biológicas periódicas. La variedad va desde ritmos circadianos de larga duración (24 h)17 a ritmos muy rápidos como las velocidades de descarga de 1.000 Hz de una célula de Renshaw18.
El formato de datos es una restricción de este protocolo de espectrograma. El formato de datos europeo (EDF) se utiliza ampliamente con datos EEG. Sin embargo, hay muchas otras opciones de formato. Por esta razón, el archivo de código sin procesar se ha incluido (ver 3.2 anterior) en caso de que el usuario desee modificar el formato de archivo. Con respecto al archivo de programa sin procesar, otra limitación es la necesidad de experiencia con el lenguaje de programación de computadoras con el fin de alterar el formato de archivo. No todos los investigadores tienen acceso al software propietario y a la gama completa de plug-ins. Este protocolo fue desarrollado para eludir este problema proporcionando un programa compilado que se ejecuta en un dispositivo basado en WINDOWS sin licencias de software. Esto se logra a través del plugin RUNTIME que se incluye en el programa compilado y no requiere ningún registro de software por parte del usuario.
Esta rutina de espectrograma EEG es un programa novedoso, de código abierto, basado en computadora que permite a los usuarios crear espectrogramas personalizados y multicórmores a partir de una amplia gama de datos. El usuario tiene un control completo sobre todos los aspectos computacionales de la generación de espectrogramas. Sin procesamiento previo de señales y conocimientos de programación por computadora, los espectrogramas pueden ser difíciles de generar. El protocolo descrito aquí facilitará la generación de espectrogramas. Consulte la sección de material suplementario para obtener más lecturas de procesamiento de señal y guía de espectrograma multitaper.
Material Suplementario
http://chronux.org
http://www-users.med.cornell.edu/~jdvicto/pdfs/pubo08.pdf
http://www.fieldtriptoolbox.org/tutorial/timefrequencyanalysis/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4502759/#SD3-data
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Este trabajo apoyado en parte por una concesión de NIH HL-65272. Los autores agradecen a Zachary T. Glovak y Clarence E. Locklear por sus contribuciones a este proyecto.
Materiales
| Name | Company | Catalog Number | Comments |
| Dental acrylic | Lang Dental Manufacturing Co | Jet powder and liquid | |
| EEG/EMG Amplifier | Data Science International | model MX2 | |
| macOS Mojave | Apple | v10.14.4 | |
| MATLAB | Mathworks | v9.4.0.813654 | software for spectrogram comp. |
| Mouse anesthesia mask | David Kopf Instruments | model 907 | |
| Neuroscore | Data Science International | v3.3.9317-1 | software for scoring sleep and wakefulness |
| Ponemah | Data Science International | v5.32 | software for EEG/EMG Data Acquisition |
| Stereotaxic frame | David Kopf Instruments | model 962 | |
| Stereotaxic frame, mouse adapter | David Kopf Instruments | model 921 | |
| Windows 10 | Microsoft | v10.0.17763.503 | |
| Wireless Telemeter | Data Science International | model HD-X02 |
Referencias
- Wasilczuk, A. Z., Proekt, A., Kelz, M. B., McKinstry-Wu, A. R. High-density electroencephalographic acquisition in a rodent model using low-cost and open source resources. Journal of Visualized Experiments. 117, 10(2016).
- Prerau, M. J., Brown, R. E., Bianchi, M. T., Ellenbogen, J. M., Purdon, P. L. Sleep neurophysiological dynamics through the lens of multitaper spectral analysis. Physiology. 32, 60-92 (2017).
- Akin, M. Comparison of wavelet transform and FFT methods in the analysis of EEG signals. Journal of Medical Systems. 26 (3), 241-247 (2002).
- Purdon, P. L., Sampson, A., Pavone, A., Brown, E. N. Clinical electroencephalography for anesthesiologists Part 1: Background and basic signatures. Anesthesiology. 123 (4), 937-960 (2015).
- Liu, Q., et al. Frontal EEG temporal and spectral dynamics similarity analysis between propofol and desflurane induced anesthesia using Hilbert-Huang Transform. BioMed Research International. 2018, 4939480(2018).
- Akeju, O., et al. Spatiotemporal dynamics of dexmedetomidine-induced electroencephalogram oscillations. PLoS One. 11 (10), (2016).
- Ogilvie, R. D. The process of falling asleep. Sleep Medicine Reviews. 5 (3), 247-270 (2001).
- Baghdoyan, H. A., Lydic, R. Basic Neurochemistry. Brady, S. T., Albers, R. W., Price, D. L., Siegel, G. J. , Elsevier. 982-999 (2012).
- Angel, C., et al. Buprenorphine depresses respiratory variablity in obese mice with altered leptin signaling. Anesthesiology. 128 (5), 984-991 (2018).
- Glovak, Z. T., Mihalko, S., Baghdoyan, H. A., Lydic, R. Leptin status alters buprenorphine-induced antinociception in obese mice with dysfunctional leptin receptors. Neuroscience Letters. 660, 29-33 (2017).
- Zhang, X., et al. Morphine and fentanyl delivered to prefrontal cortex of behaving mice depress breathing and alter neurotransmitter concentrations. Anesthesia & Analgesia. , In Press (2019).
- Cornelissen, L., Kim, S. E., Purdon, P. L., Brown, E. N., Berde, C. B. Age-dependent electroencephalogram (EEG) patterns during sevoflurane general anesthesia in infants. eLIFE. 4, e06513(2015).
- Chini, M., et al. Neural correlates of anesthesia in newborn mice and humans. Front Neural Circuits. 13 (Article 38), 1-13 (2019).
- Flint, R. R., Chang, T., Lydic, R., Baghdoyan, H. A. GABA-A receptors in the pontine reticular formation of C57BL/6J mouse modulate neurochemical, electrographic, and behavioral phenotypes of wakefulness. Journal of Neuroscience. 30 (37), 12301-12309 (2010).
- Paxinos, G., Franklin, K. B. J. The Mouse Brain in Stereotaxic Coordinates. , 4th edn, Academic Press. (2018).
- Franken, P., Malafosse, A., Tafti, M. Genetic variation in EEG activity during sleep in inbred mice. American Journal of Physiology. 257 (4), (1998).
- Ko, C. H., et al. Emergence of noise-induced oscillations in the central circadian pacemaker. PLoS Biol. 8 (10), e1000513(2010).
- Steriade, M., Curró Dossi, R., Conteras, D. Electrophysiological properties of intralaminar thalamocortical cells discharging rhythmic (40 Hz) spike-bursts at 1000 Hz during waking and rapid eye movement sleep. Neuroscience. 56, 1-9 (1993).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados