Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de carcinogénesis de piel inducida por productos químicos utilizando Dimethylbenz[a]Anthracene y 12-O-Tetradecanoyl Phorbol-13-Acetate (DMBA-TPA)
En este artículo
Resumen
La carcinogénesis cutánea de dos etapas es inducida por dos productos químicos aplicados tópicamente. Un mutágeno 7,12-dimethylbenz[a]anthracene) causa mutaciones en las células epidérmicas y una aplicación continua del estimulador general del crecimiento 12-O-tetradecanoyl phorbol-13-acetate acelera la formación de papiloma de la piel.
Resumen
El cáncer es una de las enfermedades humanas más devastadoras. Los modelos experimentales de cáncer son importantes para obtener información sobre la compleja interacción de diferentes tipos de células y genes en la promoción de la progresión tumoral y para proporcionar una plataforma para probar la eficacia de diferentes enfoques terapéuticos. Uno de los modelos de cáncer inflamatorio experimental más comúnmente utilizados es el modelo de carcinogénesis cutánea de dos etapas DMBA-TPA. La formación de tumores se induce en este modelo mediante la aplicación tópica de dos productos químicos diferentes, 7,12-dimetilbenz[a]anthracene (DMBA) y 12-O-tetradecanoyl phorbol-13-acetate (TPA), que juntos papi causan la formación de causa en la piel. Como el resultado principal es la formación de papiloma en la piel, el modelo es una forma ideal, fiable y reproducible de abordar tanto la iniciación del tumor (supervivencia libre de tumores) como la progresión tumoral (número y tamaño de tumores visibles). Los efectos del tratamiento DMBA-TPA se transmiten a través de un mecanismo inflamatorio, lo que hace que este modelo sea especialmente adecuado para estudiar el papel del sistema inmunológico en la formación de tumores. Sin embargo, este modelo está restringido a la piel y otras superficies donde se pueden aplicar los productos químicos. En este artículo se proporciona un protocolo detallado para usar el modelo correctamente.
Introducción
El cáncer es una de las principales causas de muerte en el mundo. Por lo tanto, existe la demanda de desarrollar modelos de enfermedades experimentales fiables para obtener una mejor comprensión de la enfermedad, así como para explorar posibles enfoques terapéuticos. Uno de los modelos experimentales in vivo más utilizados para estudiar el desarrollo del cáncer de piel es el modelo de carcinogénesis cutánea de dos etapas inducido químicamentemodelo1,2. El modelo proporciona una herramienta para estudiar la iniciación, promoción y progresión del tumor, además de eventos específicos como la infiltración de células inmunitarias y la angiogénesis.
Para utilizar el modelo de carcinogénesis cutánea de dos etapas, la piel posterior de los ratones se trata con dos sustancias químicas diferentes que juntos inducen la formación de tumores. El modelo se inicia con una dosis baja del mutágeno, DMBA, seguida de una exposición prolongada al promotor tumoral, TPA3 (Figura 1). DMBA muta el ADN aleatoriamente mediante la formación de aductos covalentes con el ADN de células epidérmicas y células madre de queratinocitos primarios4,5,6,7. Algunas de estas mutaciones aleatorias tienen lugar en un protooncógeno, como Hras1 (también se detectan mutaciones en Kras y Nras) y la conversión de protooncogenes a oncogenes impulsa la formación tumoral bajo estímulos adecuados. TPA, a su vez, es el agente que promueve el crecimiento tumoral más comúnmente utilizado. Su diana molecular es la proteína quinasa C (PKC)8. TPA también activa la señalización Wnt/a-catenina que es crucial para la formación de tumores en el modelo9. La exposición repetida y prolongada al agente promotor conduce a una mayor señalización celular, una mayor producción de factores de crecimiento y una reacción inflamatoria local, que son evidentes debido al aumento de la síntesis de ADN y la infiltración de células inflamatorias en la piel tratada.
Se han identificado los principales mediadores inflamatorios en el modelo DMBA-TPA10. Se sabe que la interleucina-17A (IL-17A) es particularmente tumorigénica en el DMBA-TPA modelo11,12. Trabaja en sinergia con la interleucina 6 (IL-6) y participa en la captación de macrófagos y neutrófilos13,14. Además, se ha demostrado que los células CD4+ T y los neutrófilos son tumorígenos en el modelo DMBA-TPA. Por último, los macrófagos también pueden promover la tumorigenesis en el modelo15,16,17.
Durante la fase de promoción, se mejora la proliferación celular de las células mutadas y se mantiene una hiperplasia sostenida de la epidermis1. Esto conduce al desarrollo del papiloma en la piel en 10-20 semanas, después de lo cual los papilomas comienzan a convertirse en tumores malignos, carcinomas de células escamosas (SCC)2. Sin embargo, menos del 10% de los papilomas progresan a neoplasia maligna, aunque este porcentaje también depende del trasfondo genético de los ratones2,18. Durante décadas no se supo qué tipo de células fueron mutadas inicialmente en los tumores que conducen a la neoplasia maligna, a pesar de que algunos estudios habían reportado características claramente distintas en los tumores malignos en comparación con papilomas benignos19,20. Sin embargo, estudios recientes han aumentado en gran medida nuestra comprensión sobre el origen clónico de la formación de tumores en el DMBA-TPA modelo21. 22. 23. Se demostró que tanto las células epiteliales derivadas de la médula ósea como las células madre del folículo piloso contribuyen a la formación tumoral22. Estudios de trazado de linaje específicos de la etapa han revelado que los papilomas benignos son de origen monoclonal, pero reclutan nuevas poblaciones de células epiteliales21,23. Sin embargo, sólo uno de los clones celulares funciona como conductor de la carcinogénesis; contiene una mutación de Hras23. La progresión a la formación de carcinoma se asocia con un barrido clonal23.
El carcinógeno DMBA inicia la formación de papiloma y TPA promueve el crecimiento tumoral. Por lo tanto, la iniciación del tumor se puede estudiar por separado de la promoción interrumpiendo el experimento antes del período de tratamiento con TPA. A medida que la progresión del tumor se estudia semanalmente, ofrece una gran oportunidad para el análisis detallado del crecimiento tumoral a lo largo del estudio. Debido a que los tumores son generados por sustancias químicas externas, una mutación oncogénica en la línea germinal es innecesaria. Por lo tanto, el estudio de los efectos de un fondo genético (por ejemplo, nocaut/transgén frente a tipo salvaje) en la tumorigenesis es sencillo2. En resumen, el modelo de cáncer de piel DMBA/TPA es un enfoque particularmente útil para estudiar el papel del sistema inmunitario en la progresión tumoral, así como para la evaluación de los pasos de iniciación y promoción del tumor de forma independiente o interdependiente.
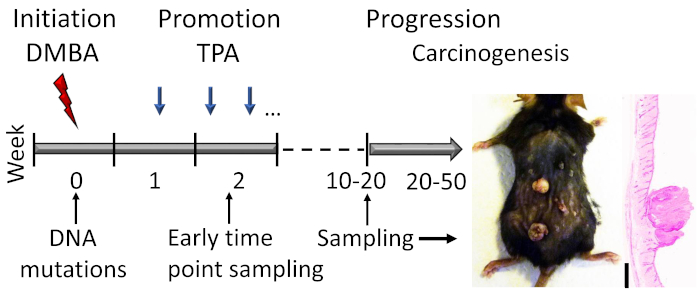
Figura 1: Esquema del modelo de carcinogénesis de la piel inducido por DMBA-TPA. El DMBA carcinógeno se aplica tópicamente para inducir mutaciones de ADN en la fase de iniciación del modelo. El agente promotor del crecimiento TPA se administra 2 veces a la semana para mejorar la proliferación celular durante la fase de promoción, lo que conduce al desarrollo de papilomas en la piel. Los animales son sacrificados después de que la respuesta del papiloma alcanza una meseta, generalmente dentro de las semanas 15-20, dependiendo del trasfondo genético de los ratones. Una pequeña proporción de los papilomas puede convertirse aún más en SCCs dentro de 20-50 semanas. Para estudiar los primeros eventos en la fase de iniciación y promoción temprana, se pueden recoger muestras (por ejemplo, poco después de la segunda solicitud de TPA). Se muestra una fotografía representativa y una sección transversal teñida de papilomas sobre una piel de ratón C57BL/6 después de 19 semanas de tratamiento. Barra de escala de 0,1 mm. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
El protocolo descrito aquí ha sido aprobado por el Comité Nacional de Etica Animal de Finlandia (número de protocolo ESAVI/23659/2018).
1. Animales experimentales, reactivos y equipos
- Use la edad y los ratones que coincidan con el sexo. Comience el estudio a las 7-9 semanas de edad, porque la piel en la mayoría de los ratones está en telógeno (la fase de reposo) alrededor de esa edad2.
- Observar el comportamiento de los animales durante el estudio y si luchan, lo que a menudo sucede con los machos, los albergan por separado. Las peleas pueden causar cortes en la piel, que promueven la formación de tumores. Los ratones hembras son preferidos debido a su comportamiento menos agresivo. El tamaño típico del grupo experimental varía entre 8-20 animales por grupo24,25,26,27.
NOTA: Los cálculos de potencia basados en la varianza biológica vista en estudios anteriores ayudan a elegir un tamaño de grupo suficientemente grande. Las cepas utilizadas como ejemplos en este artículo incluyen Balb/c y C57BL/6. Sin embargo, muchas otras cepas de ratón como SENCAR y FVB se han utilizado con el modelo DMBA-TPA, así como Wistar y Sprague-Dawley ratas2,28,29. Se necesita una licencia del comité nacional o local de trabajo animal antes del inicio del estudio. Además de las consideraciones generales de bienestar, las variables específicas del modelo son típicamente el carcinoma de células escamosas (CCS) y una infección de la piel. Rasguños en la piel debido a la picazón después de la aplicación de los productos químicos tumorigénicos en la acetona es típico, pero de lo contrario los animales deben mostrar ningún signo de malestar. Pesar regularmente (por ejemplo, 2 veces al mes) ayuda a evaluar el bienestar de los animales. - Utilice el DMBA y el TPA, ambos diluidos en acetona. La concentración de trabajo de DMBA es de 250 g/L. Una dosis para un animal es de 50 g de DMBA en 200 l de acetona. La concentración de stock de TPA es de 125 g/L y la concentración de tratamiento 25 g/L. Una dosis de TPA para un animal es de 5 g en 200 éL de acetona.
ADVERTENCIA: El DMBA es dañino si se ingiere y puede causar cáncer. La acetona se evapora rápidamente y es inflamable. Puede causar mareos e irritar los ojos. Utilice una máscara respiratoria y/o trabaje bajo un flujo de vacío. Cambie los guantes después de manipular cualquiera de estos productos químicos. Las jaulas ventiladas individualmente evitan la propagación de los productos químicos durante la vivienda de los ratones. Después de la aplicación, reúna las puntas de pipeta utilizadas para manipular el DMBA y deseche como residuos peligrosos.
NOTA: El DMBA debe estar protegido de la luz. El TPA diluido se almacena en -20 oC, preferiblemente protegido de la luz. - Procurar el siguiente equipo: una báscula, una afeitadora ordinaria para el pelaje, pipetas y puntas de un tamaño adecuado, una regla ordinaria, una cámara digital, un bloc de notas y un bolígrafo o una computadora para grabar los papilomas, un sistema de anestesia inhalada o un sistema de restrainer de ratón con una abertura en la parte posterior, y un sistema de narcosis de dióxido de carbono para sacrificar ratones.
2. Inducción y promoción del papiloma de la piel
- Afeitar la piel de la espalda y pesar el animal. Más tarde, afeitar la piel cuando sea necesario, pero no en el momento de la exposición química.
NOTA: Tenga cuidado al afeitarse alrededor de los papilomas y evite hacer cortes en la piel. Pesar cada animal cada 2 semanas para notar cualquier posible pérdida de peso. - Aplicar 50 g de DMBA en 200 ml de acetona por vía tópica en el área afeitada utilizando una pipeta 48 h después de afeitar el pelaje. Si es necesario, retenga al animal con anestesia por inhalación ligera o un recolector de ratón.
- Después de 7 días, dé la primera dosis de TPA. Aplicar 5 g de TPA en 200 ml de acetona tópicamente con una pipeta 2 veces a la semana, preferiblemente lunes y jueves o martes y viernes.
- Contar, grabar y fotografiar los papilomas todas las semanas. Una masa palpable de más de 1 mm de diámetro se considera un papiloma si permanece más de 1 semana. Marque cada papiloma individual en un mapa y enumere su tamaño cada semana. Almacene fotografías digitales.
3. Sacrificio de animales y recolección de muestras
- Continúe el tratamiento hasta que la respuesta del tumor alcance una meseta. Generalmente, se espera que la carga del papiloma aumente de 10 a 20 semanas después de la iniciación, dependiendo de la cepa del ratón utilizada. La meseta se espera en 15-20 semanas. Una pequeña proporción de los papilomas (menos del 3%) pueden convertirse en SCCs dentro de 20–50 semanas2.
- Sacrificar a los animales 24 h después de la última aplicación TPA. Utilice narcosis de dióxido de carbono con luxación cervical u otro método adecuado.
- Dependiendo de la cuestión de la investigación, reúna el material de muestra apropiado de los animales30,31.
- Por ejemplo, tome muestras de sangre antes del sacrificio y separe el plasma.
- Corte trozos de la piel para la tinción de inmunohistoquímica (IHC) (por ejemplo, hematoxilina y eosina, células proliferantes o inflamatorias).
- Utilice punzones de biopsia para recolectar piezas de la piel con tejido de papiloma o piel no papiloma (tratada) para la expresión génica (por ejemplo, qPCR) y/o análisis de proteínas (por ejemplo, Western blot o ELISA).
- Recoger una parte del bazo y los ganglios linfáticos que drenan la piel para el análisis de citometría de flujo si se desea un análisis más detallado de las poblaciones de células inmunitarias. También puede separar las capas epidérmicas y dérmicas para realizar análisis adicionales.
4. Estadísticas
- Dibuja una curva de supervivencia Kaplan-Meier del tiempo libre de papiloma y usa la prueba de clasificación de registro Mantel-Cox para la supervivencia. Dibuja una curva lineal del número de papilomas por semana. Dado que se trata de datos de recuento, utilice un modelo de regresión no lineal. Consulte a un estadístico si es necesario.
Resultados
El resultado principal es el tiempo de supervivencia (es decir, libre de papiloma) entre el tratamiento o los grupos de genotipos. El resultado secundario es el número de papilomas por semana en cada grupo(Figura 2). Los resultados esperados son una diferencia estadísticamente significativa en el tiempo libre del papiloma y en el número de papilomas entre los grupos experimentales (dos o más). Se recomienda contar el número de papilomas y dibujar una curva durante la fase de promoción ...
Discusión
El cáncer de piel inducido por DMBA-TPA es uno de los modelos de cáncer más utilizados porque es altamente reproducible y proporciona información sobre la progresión tumoral desde la iniciación hasta la neoplasia maligna. La medida clave del resultado, la formación del papiloma, es cuantitativa de manera fácil y fiable. El modelo aborda simultáneamente la iniciación del tumor (supervivencia libre de tumores) y la progresión (números y tamaños de tumores). El modelo es adecuado para estudiar diferentes compue...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por la Academia de Finlandia (grants 25013080481 y 25013142041 (I.J.), 286377 y 295814 (M.P.), 287907 (T.J.)), la Fundación P-ivikki y Sakari Sohlberg (M.P., T.J.), Fundación Médica Finlandesa (T.P.), La Investigación del Estado Competitivo Financiación del área de Responsabilidad Experta del Hospital Universitario de Tampere (subvención 9V049 y 9X044 (M.P.), 9X011 y 9V010 (T.J.)), Financiación Competitiva de la Investigación del Estado competitivo del área de Responsabilidad Experta de Fimlab Laboratories (subvención X51409 (I.J.)), Tays Fundación de Apoyo (I.J., M.P., T.J.), Tampere Tuberculosis Foundation (I.J., M.P., T.J.), la Fundación Cultural Finlandesa (M.V.), la Fundación Paulo (T.P.), la Sociedad del Cáncer de Finlandia (M.P.) y la Fundación Emil Aaltonen (T.P.).
Materiales
| Name | Company | Catalog Number | Comments |
| 1000 ul RPT XL Graduated Filter Tip (Sterile), Refill | Starlab | S1182-1730-C | |
| 300 ul RTP Graduated Filter Tip (sterile), Refill | Starlab | S1180-9710-C | |
| 7,12-Dimethylbenz[a]anthracene (DMBA) | Sigma | D3254-100MG | Harmful if swallowed and may cause cancer. Store protected from light. |
| Acetone | Sigma | 1000141011 | Evaporates rapidly and is inflammable. |
| Attane vet 1000 mg/g | Piramal Critical Care Limited | Liquid isoflurane for inhalation | |
| Battery-Operated Clipper Isis | Albert Kerlb GmbH | GT421 | For shaving the fur |
| CONTRAfluran-Restgasfilter | ZeoSys GmbH | For anesthesia | |
| Linex Nature N1030 Ruler 30 cm | Staples Business Advantage | 60383 | For measuring papillomas |
| Medium CO2 Chamber 300 x 200 x 200mm - Red | VetTech Solutions Ltd | AN045AR | For sacrifice |
| Mekasoft | Mekalasi | 23008 | Table cover |
| Mice (Balb/c JRj) | Janvier labs | Other strains also possible | |
| Mice (C57BL/6JRj) | Janvier labs | Other strains also possible | |
| Panasonic Lumix DMC-FS5 Digital Camera | Panasonic | ||
| Paraformaldehyde | Merck | 30525-89-4 | For histology samples |
| Phorbol 12-myristate 13-acetate aka 12-Otetradecanoylphorbol-13-acetate (TPA) | Enzo | BML-PE160-0001 | |
| Precision balance PLJ-C/PLJ-G | KERN & SOHN GmbH | PLJ 600-3CM | |
| Pre-Set CO2 System-2 Chamber-S/S Housing | VetTech Solutions Ltd | AN044BX | For sacrifice |
| RNAlater | Qiagen | 76104 | For nucleic acid samples |
| Tacta pipette 100-1000 ul | Sartorius | LH-729070 | |
| Tacta pipette 20-200 ul | Sartorius | LH-729060 | |
| UNO Anaesthetic Key Filler | Scintica instrumentation inc. | For anesthesia | |
| UNO Face Mask for Mouse | Scintica instrumentation inc. | For anesthesia | |
| UNO FM2200 Flowmeter | Scintica instrumentation inc. | For anesthesia | |
| UNO Gas Exhaust Unit | Scintica instrumentation inc. | For anesthesia | |
| UNO Induction Box | Scintica instrumentation inc. | For anesthesia | |
| UNO200VAP Vaporizer | Scintica instrumentation inc. | For anesthesia |
Referencias
- DiGiovanni, J. Multistage carcinogenesis in mouse skin. Pharmacology & Therapeutics. 54 (1), 63-128 (1992).
- Abel, E. L., Angel, J. M., Kiguchi, K., DiGiovanni, J. Multi-stage chemical carcinogenesis in mouse skin: fundamentals and applications. Nature Protocols. 4 (9), 1350-1362 (2009).
- Perez-Losada, J., Balmain, A. Stem-cell hierarchy in skin cancer. Nature Reviews. Cancer. 3 (6), 434-443 (2003).
- Bonham, K., et al. Activation of the cellular Harvey ras gene in mouse skin tumors initiated with urethane. Molecular Carcinogenesis. 2 (1), 34-39 (1989).
- Quintanilla, M., Brown, K., Ramsden, M., Balmain, A. Carcinogen-specific mutation and amplification of Ha-ras during mouse skin carcinogenesis. Nature. 322 (6074), 78-80 (1986).
- Nelson, M. A., Futscher, B. W., Kinsella, T., Wymer, J., Bowden, G. T. Detection of mutant Ha-ras genes in chemically initiated mouse skin epidermis before the development of benign tumors. Proceedings of the National Academy of Sciences of the United States of America. 89 (14), 6398-6402 (1992).
- Morris, R. J. A perspective on keratinocyte stem cells as targets for skin carcinogenesis. Differentiation. 72 (8), 381-386 (2004).
- Chung, Y. W., Kim, H. K., Kim, I. Y., Yim, M. B., Chock, P. B. Dual function of protein kinase C (PKC) in 12-O-tetradecanoylphorbol-13-acetate (TPA)-inducec manganese superoxide dismutase (MnSOD) expression: activation of CREB and FOXO3a by PKC-alpha phosphorylation and by PKC-mediated inactivation of Akt, respectively. The Journal of Biological Chemistry. 286 (34), 29681-29690 (2011).
- Su, Z., et al. Tumor promoter TPA activates Wnt/β-catenin signaling in a casein kinase 1-dependent manner. Proceedings of the National Academy of Sciences of the United States of America. 115 (32), 7522-7531 (2018).
- Swann, J. B., et al. Demonstration of inflammation-induced cancer and cancer immunoediting during primary tumorigenesis. Proceedings of the National Academy of Sciences of the United States of America. 105 (2), 652-656 (2008).
- Wang, L., Yi, T., Zhang, W., Pardoll, D. M., Yu, H. IL-17 enhances tumor development in carcinogen-induced skin cancer. Cancer Research. 70 (24), 10112-10120 (2010).
- He, D., et al. IL-17 mediated inflammation promotes tumor growth and progression in the skin. PLoS One. 7 (2), 32126 (2012).
- Roussel, L., et al. IL-17 promotes p38 MAPDK-dependent endothelial activation enhancing neutrophil recruitment to sites of inflammation. Journal of Immunology. 184 (8), 4531-4537 (2010).
- Wanqiu, H., Young-Hee, J., Hyun, S. K., Byung, S. K. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibition cellular apoptosis and cytotoxic T cell function. Journal of Virology. 88 (15), 8479-8489 (2014).
- Yusuf, N., et al. Antagonistic roles of CD4+ and CD8+ T-cells in 7,12-dimethylbenz(a)anthracene cutaneous carcinogenesis. Cancer Research. 68 (10), 3924-3930 (2008).
- Gong, L., et al. Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase. Molecular Cancer. 12 (1), 154 (2013).
- Vestweber, D., Wessel, F., Nottebaum, A. F. Similarities and differences in the regulation of leukocyte extravasation and vascular permeability. Seminars in Immunopathology. 36 (2), 177-192 (2014).
- Woodworth, C. D., et al. Strain-dependent differences in malignant conversion of mouse skin tumors is an inherent property of the epidermal keratinocyte. Carcinogenesis. 25 (9), 1771-1778 (2004).
- Tennenbaum, T., et al. The suprabasal expression of alpha 6 beta 4 integrin is associated with a high risk for malignant progression in mouse skin carcinogenesis. Cancer Research. 53 (20), 4803-4810 (1993).
- Hennings, H., Shores, R., Mitchell, P., Spangler, E. F., Yuspa, S. H. Induction of papillomas with a high probability of conversion to malignancy. Carcinogenesis. 6 (11), 1607-1610 (1985).
- Auto, Y., et al. Time-Series Analysis of Tumorigenesis in a Murine Skin Carcinogenesis Model. Scientific Reports. 8 (1), 12994 (2018).
- Park, H., et al. Bone marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Reeves, M. Q., Kandyba, E., Harris, S., Del Rosario, R., Balmain, A. Multicolour lineage tracing reveals clonal dynamics of squamous carcinoma evolution from initiation to metastasis. Nature Cell Biology. 20 (6), 699-709 (2018).
- Dao, V., et al. Prevention of carcinogen and inflammation-induced dermal cancer by oral rapamycin includes reducing genetic damage. Cancer Prevention Research. 5, 400-409 (2015).
- Yeong, L. T., Abdul Hamid, R., Saiful Yazan, L., Khaza’ai, H., Mohtarrudin, N. Low dose triterpene-quinone fraction from Ardisia crispa root precludes chemical-induced mouse skin tumor promotion. BMC Complementary and Alternative Medicine. 15 (1), 431 (2015).
- Kong, Y. H., Xu, S. P. Salidroside prevents skin carcinogenesis induced by DMBA/TPA in a mouse model through suppression of inflammation and promotion of apoptosis. Oncology Reports. 39 (6), 2513-2526 (2018).
- Jung, M., Bu, S. Y., Tak, K. H., Park, J. E., Kim, E. Anticarcinogenic effect of quercetin by inhibition of insulin-like growth factor (IGF)-1 signaling in mouse skin cancer. Nutrition Research and Practice. 7 (6), 439-445 (2013).
- Hu, Y. Q., Wang, J., Wu, J. H. Administration of resveratrol enhances cell-cycle arrest followed by apoptosis in DMBA-induced skin carcinogenesis in male Wistar rats. European review for medical and pharmacological sciences. 13, 2935-2946 (2016).
- Schweizer, J., Loehrke, H., Hesse, B., Goerttler, K. 7,12-Dimethylbenz[a]anthracene/12-O-tetradecanoyl-phorbol-13-acetate-mediated skin tumor initiation and promotion in male Sprague-Dawley rats. Carcinogenesis. 3 (7), 785-789 (1982).
- Vähätupa, M., et al. T-cell-expressed proprotein convertase FURIN inhibits DMBA/TPA-induced skin cancer development. Oncoimmunology. 5 (12), 1245266 (2016).
- May, U., et al. Resistance of R-Ras knockout mice to skin tumour induction. Scientific Reports. 5, 11663 (2015).
- Krajewska, M., et al. Image analysis algorithms for immunohistochemical assessment of cell death events and fibrosis in tissue sections. The Journal of Histochemistry and Cytochemistry. 57 (7), 649-663 (2009).
- Järvinen, T. A., Ruoslahti, E. Target-seeking antifibrotic compound enhances wound healing and suppresses scar formation in mice. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21671-21676 (2010).
- Schwarz, M., Münzel, P. A., Braeuning, A. Non-melanoma skin cancer in mouse and man. Archives of Toxicology. 87 (5), 783-798 (2013).
- Slaga, T. J. SENCAR mouse skin tumorigenesis model versus other strains and stocks of mice. Environmental Health Perspectives. 68, 27-32 (1986).
- Goerttler, K., Loehrke, H., Schweizer, J., Hesse, B. Systemic two-stage carcinogenesis in the epithelium of the forestomach of mice using 7,12-dimethylbenz(a)anthracene as initiator and the phorbol ester 12-O-tetradecanoylphorbol-13-acetate as promoter. Cancer Research. 39 (4), 1293-1297 (1979).
- Topping, D. C., Nettesheim, P. Promotion-like enhancement of tracheal carcinogenesis in rats by 12-O-tetradecanoylphorbol-13-acetate. Cancer Research. 40, 4352-4355 (1980).
- Wille, J. J. Circadian rhythm of tumor promotion in the two-stage model of mouse tumorigenesis. Cancer Letters. 190 (2), 143-149 (2003).
- Lee, Y. S., et al. Inhibition of skin carcinogenesis by suppression of NF-κB dependent ITGAV and TIMP-1 expression in IL32γ overexpressed condition. Journal of Experimental & Clinical Cancer Research. 37 (1), 293 (2018).
- Kiss, A., et al. Cell type-specific p38δ targeting reveals a context-, stage-, and sex-dependent regulation of skin carcinogenesis. International Journal of Molecular Sciences. 20 (7), 1532 (2019).
- Tomo-o, I., et al. Positron emission tomography imaging of DMBA/TPA mouse skin multi-step tumorigenesis. Molecular Oncology. 4 (2), 119-125 (2010).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454 (7203), 436-444 (2008).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews. Clinical Oncology. 12 (10), 584-596 (2015).
- Hennings, L., et al. Malignant conversion and metastasis of mouse skin tumors: a comparison of SENCAR and CD-1 mice. Environmental Health Perspectives. 68, 69-74 (1986).
- Gómez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Ouhtit, A., Ananthaswamy, H. N. A model for UV-induction of skin cancer. Journal of Biomedicine and Biotechnology. 1 (1), 5-6 (2001).
- Day, C. -. P., Marchalik, R., Merlino, G., Michael, H. T. Mouse models of UV-induced melanoma: genetics, pathology, and clinical relevance. Laboratory Investigation. 97 (6), 698-705 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados