Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Chemisch-induzierte Hautkarzinogenese Modell mit Dimethylbenz[a]Anthracen und 12-O-Tetradecanoyl Phorbol-13-Acetat (DMBA-TPA)
In diesem Artikel
Zusammenfassung
Die zweistufige Hautkarzinogenese wird durch zwei topisch aufgetragene Chemikalien induziert. Ein Mutagen7,12-Dimethylbenz[a]anthracen) verursacht Mutationen in den epidermalen Zellen und eine kontinuierliche Anwendung des allgemeinen Wachstumsstimulators 12-O-Tetradecanoyl phorbol-13-Acetat beschleunigt die Bildung von Hautpapilloma.
Zusammenfassung
Krebs ist eine der verheerendsten menschlichen Krankheiten. Experimentelle Krebsmodelle sind wichtig, um Einblicke in das komplexe Zusammenspiel verschiedener Zelltypen und Gene bei der Förderung der Tumorprogression zu gewinnen und eine Plattform zu bieten, um die Wirksamkeit verschiedener therapeutischer Ansätze zu testen. Eines der am häufigsten verwendeten experimentellen entzündlichen Krebsmodelle ist das zweistufige Modell der zweistufigen Hautkarzinogenese DMBA-TPA. Die Tumorbildung wird in diesem Modell durch die topische Anwendung von zwei verschiedenen Chemikalien induziert, 7,12-Dimethylbenz[a]anthracen (DMBA) und 12-O-Tetradecanoyl phorbol-13-acetat (TPA), die zusammen eine Papillomabildung in der Haut verursachen. Da das primäre Ergebnis die Papillomabildung in der Haut ist, ist das Modell eine ideale, zuverlässige und reproduzierbare Möglichkeit, sowohl die Tumorinitiierung (tumorfreies Überleben) als auch die Tumorprogression (Anzahl und Größe der sichtbaren Tumoren) anzugehen. Die Wirkung der DMBA-TPA-Behandlung wird über einen Entzündungsmechanismus übertragen, wodurch sich dieses Modell besonders für die Untersuchung der Rolle des Immunsystems bei der Tumorbildung eignet. Dieses Modell ist jedoch auf die Haut und andere Oberflächen beschränkt, auf denen die Chemikalien aufgetragen werden können. In diesem Artikel finden Sie ein detailliertes Protokoll, um das Modell erfolgreich zu verwenden.
Einleitung
Krebs ist eine der häufigsten Todesursachen in der Welt. Daher besteht die Forderung, zuverlässige experimentelle Krankheitsmodelle zu entwickeln, um ein besseres Verständnis der Krankheit zu erhalten und mögliche therapeutische Ansätze zu erforschen. Eines der am häufigsten verwendeten experimentellen In-vivo-Modelle zur Untersuchung der Entwicklung von Hautkrebs ist das chemisch induzierte zweistufige Hautkarzinogenesemodell1,2. Das Modell bietet ein Werkzeug, um Tumorinitiierung, Förderung und Progression zusätzlich zu bestimmten Ereignissen wie Immunzellinfiltration und Angiogenese zu untersuchen.
Um das zweistufige Hautkarzinogenesemodell zu verwenden, wird die Rückenhaut von Mäusen mit zwei verschiedenen Chemikalien behandelt, die zusammen eine Tumorbildung induzieren. Das Modell wird mit einer niedrigen Dosis der Mutagene, DMBA, gefolgt von einer längeren Exposition gegenüber dem Tumorpromotor, TPA3 (Abbildung 1) initiiert. DMBA mutiert DNA nach dem Zufallsprinzip, indem sie kovalente Addukte mit der DNA von epidermalen Zellen und primären Keratinozytenstammzellen4,5,6,7bildet. Einige dieser zufälligen Mutationen finden in einem Proto-Onkogen statt, wie Hras1 (Mutationen in Kras und Nras werden ebenfalls nachgewiesen) und die Umwandlung von Proto-Onkogenen in Onkogene treibt die Tumorbildung unter richtigen Reizen an. TPA wiederum ist das am häufigsten verwendete tumorwachstumsfördernde Mittel. Sein molekulares Ziel ist die Proteinkinase C (PKC)8. TPA aktiviert auch die Wnt/-Catenin-Signalisierung, die für die Tumorbildung im Modell9entscheidend ist. Wiederholte und längere Exposition gegenüber dem fördernden Mittel führt zu einer verbesserten Zellsignalisierung, erhöhter Produktion von Wachstumsfaktoren und einer lokalen Entzündungsreaktion, die aufgrund einer erhöhten DNA-Synthese und entzündlicher Zellinfiltration in der behandelten Haut offensichtlich sind.
Die wichtigsten Entzündungsmediatoren im DMBA-TPA-Modell wurden identifiziert10. Interleukin-17A (IL-17A) ist im DMBA-TPA Modell11,12als besonders tumorigen bekannt. Es arbeitet in Synergie mit Interleukin 6 (IL-6) und nimmt an Makrophagen und Neutrophilrekrutierung13,14. Darüber hinaus haben sich im DMBA-TPA-Modell gezeigt, dass CD4+ T-Zellen und Neutrophile tumoriogen sind. Schließlich können Makrophagen auch die Tumorgenese im Modell15,16,17fördern.
Während der Promotionsphase wird die Zellproliferation der mutierten Zellen verbessert und eine anhaltende Hyperplasie der Epidermis beibehalten1. Dies führt zu einer Papilloma-Entwicklung in der Haut in 10-20 Wochen, nach dem die Papillome beginnen, in bösartige Tumoren, Plattenepithelkarzinome (SCCs)2umzuwandeln. Allerdings kommen weniger als 10% der Papillome zu maligner Art, obwohl dieser Prozentsatz auch vom genetischen Hintergrund der Mäuse abhängt2,18. Jahrzehntelang war nicht bekannt, welche Art von Zellen zunächst in den Tumoren mutiert wurden, was zu Malignität führte, obwohl einige Studien deutlich ausgeprägte Merkmale in den bösartigen Tumoren im Vergleich zu gutartigen Papillomen19,20berichtet hatten. Neuere Studien haben jedoch unser Verständnis über den klonalen Ursprung der Tumorbildung im DMBA-TPA-Modell21starkverbessert. 22. 23. Es wurde nachgewiesen, dass sowohl knochenmarkabgeleitete Epithelzellen als auch Haarfollikelstammzellen zur Tumorbildung beitragen22. Stufenspezifische Linienverfolgungsstudien haben enthüllt, dass gutartige Papillome monoklonalen Ursprungs sind, aber sie rekrutieren neue Epithelzellpopulationen21,23. Allerdings fungiert nur einer der Zellklone als Fahrer für die Karzinogenese; es enthält eine Hras-Mutation23. Der Verlauf der Karzinombildung ist mit einem klonalen Sweepverbunden 23.
Das karzinogene DMBA initiiert die Papillomabildung und TPA fördert das Tumorwachstum. Daher kann die Tumorinitiation getrennt von der Förderung untersucht werden, indem das Experiment vor der TPA-Behandlungsphase unterbrochen wird. Da die Tumorprogression wöchentlich untersucht wird, bietet es eine große Chance für eine detaillierte Tumorwachstumsanalyse während der gesamten Studie. Da die Tumoren durch externe Chemikalien erzeugt werden, ist eine onkogene Mutation in der Keimbahn unnötig. Daher ist die Untersuchung der Auswirkungen eines genetischen Hintergrunds (z.B. Knockout/Transgen vs. Wildtyp) auf die Tumorgenese einfach2. Zusammenfassend ist das DMBA/TPA-Hautkrebsmodell ein besonders nützlicher Ansatz zur Untersuchung der Rolle des Immunsystems bei der Tumorprogression sowie zur Bewertung von Tumorinitiations- und Förderschritten unabhängig oder voneinander abhängig.
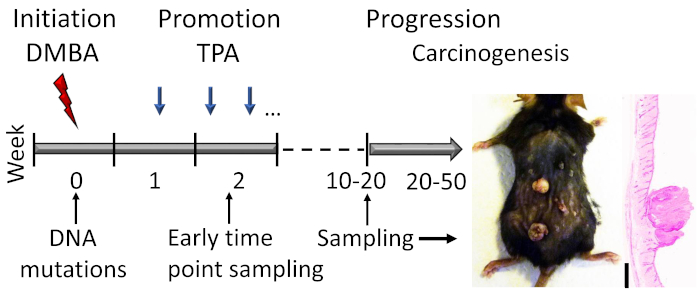
Abbildung 1: DMBA-TPA-induzierte Hautkarzinogenese Modell umriss. Das karzinogene DMBA wird topisch angewendet, um DNA-Mutationen in der Initiationsphase des Modells zu induzieren. Das wachstumsfördernde Mittel TPA wird 2x pro Woche verabreicht, um die Zellproliferation während der Promotionsphase zu verbessern, was zur Entwicklung von Papillomen in der Haut führt. Tiere werden geopfert, nachdem die Papilloma-Reaktion ein Plateau erreicht hat, in der Regel innerhalb von Wochen 15–20, abhängig vom genetischen Hintergrund der Mäuse. Ein kleiner Teil der Papillome kann sich innerhalb von 20 bis 50 Wochen zu SCCs weiterentwickeln. Um frühe Ereignisse in der Initiations- und Frühförderungsphase zu untersuchen, können Proben entnommen werden (z. B. kurz nach der zweiten TPA-Anwendung). Ein repräsentatives Foto und Hämatoxylin und Eosin gebeizten Querschnitt von Papillomen auf einer C57BL/6 Maushaut nach 19 Wochen Behandlung werden gezeigt. Maßstabsleiste = 0,1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Das hier beschriebene Protokoll wurde von der Finnischen Tierschutzkommission (Protokollnummer ESAVI/23659/2018) genehmigt.
1. Versuchstiere, Reagenzien und Ausrüstung
- Verwenden Sie Alter und geschlechtsspezifische Mäuse. Beginnen Sie die Studie im Alter von 7-9 Wochen, da die Haut bei den meisten Mäusen in Telogen (der Ruhephase) um dieses Alter2ist.
- Beobachten Sie das Verhalten der Tiere während des Studiums und wenn sie kämpfen, was oft bei Männchen geschieht, beherbergen sie getrennt. Kämpfe können Schnitte in der Haut verursachen, die die Tumorbildung fördern. Weibliche Mäuse werden aufgrund ihres weniger aggressiven Verhaltens bevorzugt. Die typische Versuchsgruppengröße variiert zwischen 8–20 Tieren pro Gruppe24,25,26,27.
ANMERKUNG: Leistungsberechnungen auf der Grundlage der biologischen Varianz, die in früheren Studien beobachtet wurde, helfen, eine ausreichend große Gruppengröße zu wählen. Die Stämme, die in diesem Artikel als Beispiele verwendet werden, sind Balb/c und C57BL/6. Allerdings wurden viele andere Mausstämme wie SENCAR und FVB mit dem DMBA-TPA-Modell sowie Wistar und Sprague-Dawley Ratten2,28,29verwendet. Vor Beginn der Studie ist eine Genehmigung des nationalen oder lokalen Ausschusses für Tierarbeit erforderlich. Neben allgemeinen Wohlfahrtserwägungen sind die modellspezifischen Endpunkte typischerweise Plattenepithelkarzinom (SCC) und eine Infektion der Haut. Kratzer in der Haut durch Juckreiz nach anwendung der tumorigenchemischen Chemikalien in Aceton ist typisch, aber ansonsten sollten die Tiere keine Anzeichen von Beschwerden zeigen. Regelmäßiges Wiegen (z.B. 2x pro Monat) hilft, das Wohlergehen der Tiere zu bewerten. - Verwenden Sie die DMBA und TPA, beide in Aceton verdünnt. Die Arbeitskonzentration von DMBA beträgt 250 g/L. Eine Dosis für ein Tier beträgt 50 g DMBA in 200 l Aceton. Die Lagerkonzentration von TPA beträgt 125 g/L und die Behandlungskonzentration 25 g/l. Eine TPA-Dosis für ein Tier beträgt 5 g in 200 l Aceton.
VORSICHT: DMBA ist schädlich, wenn es geschluckt wird und Kann Krebs verursachen. Aceton verdunstet schnell und ist entzündlich. Es kann Schwindel verursachen und die Augen reizen. Verwenden Sie eine Atemmaske und/oder arbeiten Sie unter einem Vakuumstrom. Wechseln Sie die Handschuhe nach dem Umgang mit einer dieser Chemikalien. Individuell belüftete Käfige verhindern die Ausbreitung der Chemikalien während der Unterbringung der Mäuse. Nach dem Auftragen die Pipettenspitzen für den Umgang mit dem DMBA sammeln und als gefährlichen Abfall entsorgen.
HINWEIS:Der DMBA muss vor Licht geschützt sein. Das verdünnte TPA wird in -20 °C gelagert, vorzugsweise lichtgeschützt. - Beschaffen Sie sich folgendes Gerät: eine Waage, ein gewöhnlicher Rasierer für das Fell, Pipetten und Spitzen einer entsprechenden Größe, ein gewöhnliches Lineal, eine Digitalkamera, einen Notizblock und einen Stift oder einen Computer zur Aufnahme der Papillome, ein inhaliertes Anästhesiesystem oder ein Maus-Restrainer mit einer Öffnung auf der Rückseite und einem Kohlendioxid-Narkosesystem zum Opfern von Mäusen.
2. Haut Papilloma Induktion und Förderung
- Rasieren Sie die Rückenhaut und wiegen Sie das Tier. Später rasieren Sie die Haut, wann immer nötig, aber nicht zum Zeitpunkt der chemischen Exposition.
HINWEIS: Seien Sie vorsichtig, wenn Sie sich um die Papillome rasieren und vermeiden Sie Schnitte auf der Haut. Wiegen Sie jedes Tier alle 2 Wochen, um mögliche Gewichtsverlust zu bemerken. - Mit einer Pipette 48 h nach dem Rasieren des Fells 50 g DMBA in 200 l Aceton topisch auf die rasierte Fläche auftragen. Halten Sie das Tier bei Bedarf mit einer leichten Inhalationsanästhesie oder einem Maus-Restrainer zurück.
- Geben Sie nach 7 Tagen die erste TPA-Dosis. Tragen Sie 5 g TPA in 200 l Aceton topisch mit einer Pipette 2x pro Woche auf, vorzugsweise Montag und Donnerstag oder Dienstag und Freitag.
- Zählen, aufzeichnen und fotografieren Sie die Papillome jede Woche. Eine fühlbare Masse von mehr als 1 mm Durchmesser gilt als Papilloma, wenn sie länger als 1 Woche bleibt. Markieren Sie jedes einzelne Papilloma auf einer Karte und listen Sie seine Größe jede Woche auf. Speichern Sie digitale Fotos.
3. Tieropfer und Probensammlung
- Setzen Sie die Behandlung fort, bis die Tumorreaktion ein Plateau erreicht. Im Allgemeinen wird erwartet, dass die Papillomabelastung 10 bis 20 Wochen nach der Initiation zunimmt, abhängig von der verwendeten Mausdehnung. Das Plateau wird in 15 bis 20 Wochen erwartet. Ein kleiner Teil der Papillome (unter 3%) kann sich innerhalb von 20–50 Wochen zu SCCs entwickeln2.
- Opfern Sie die Tiere 24 h nach der letzten TPA-Anwendung. Verwenden Sie Kohlendioxid-Narkose mit Zervixdislokation oder einer anderen geeigneten Methode.
- Je nach Forschungsfrage, sammeln Sie geeignetes Probenmaterial von den Tieren30,31.
- Nehmen Sie beispielsweise Blutproben vor dem Opfern und trennen Sie das Plasma.
- Schneiden Sie Hautstücke für die Immunhistochemie (IHC) Färbung (z. B. Hämatoxylin und Eosin, vermehrende oder entzündliche Zellen).
- Verwenden Sie Biopsie-Punchs, um Hautstücke mit Papillomagewebe oder Nicht-Papilloma (behandelte) Haut für die Genexpression (z. B. qPCR) und/oder Proteinanalysen (z. B. Western Blot oder ELISA) zu sammeln.
- Sammeln Sie ein Stück der Milz und hautabtropfenden Lymphknoten für die Analyse der Durchflusszytometrie, wenn eine detailliertere Analyse der Immunzellpopulationen gewünscht wird. Sie können auch epidermale und dermale Schichten für weitere Analysen trennen.
4. Statistik
- Zeichnen Sie eine Kaplan-Meier-Überlebenskurve der papillomafreien Zeit und verwenden Sie den Mantel-Cox-Log-Rank-Test für das Überleben. Zeichnen Sie eine lineare Kurve der Anzahl der Papillome pro Woche. Da es sich um Zähldaten handelt, verwenden Sie ein nichtlineares Regressionsmodell. Wenden Sie sich bei Bedarf an einen Statistiker.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Das Hauptergebnis ist das Überleben (d.h. Papilloma frei) Zeit zwischen der Behandlung oder Genotyp-Gruppen. Das sekundäre Ergebnis ist die Anzahl der Papillome pro Woche in jeder Gruppe (Abbildung 2). Die erwarteten Ergebnisse sind ein statistisch signifikanter Unterschied in der Papilloma-Freizeit und in der Anzahl der Papillome zwischen den experimentellen (zwei oder mehr) Gruppen. Es wird empfohlen, die Anzahl der Papillome zu zählen und während der Promotion-Phase (TPA) eine Kurve z...
Access restricted. Please log in or start a trial to view this content.
Diskussion
DMBA-TPA-induzierter Hautkrebs ist eines der am häufigsten verwendeten Krebsmodelle, da er sehr reproduzierbar ist und Informationen über die Tumorprogression von der Initiation bis zur Malignität liefert. Die wichtigste Ergebnismaßnahme, die Papillomabildung, ist einfach und zuverlässig quantitativ. Das Modell befasst sich sowohl mit der Tumorinitiation (tumorfreies Überleben) als auch mit der Progression (Tumorzahlen und -größen) gleichzeitig. Das Modell eignet sich zur Untersuchung verschiedener Verbindungen, ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde von der Akademie Finnlands (Stipendien 25013080481 und 25013142041 (I.J.), 286377 und 295814 (M.P.), 287907 (T.J.)), Päivikki und Sakari Sohlberg Foundation (M.P., T.J.), Finnish Medical Foundation (T.P.), Päivikki and Sakari Sohlberg Foundation (M.P., T.J.), Finanzierung des Expertenverantwortungsbereichs des Universitätsklinikums Tampere (Zuschuss 9V049 und 9X044 (M.P.), 9X011 und 9V010 (T.J.)), The Competitive State Research Financing of the Expert Responsibility Area of Fimlab Laboratories (Grant X51409 (I.J.)), Tays Support Foundation (I.J., M.P., T.J.), Tampere Tuberculosis Foundation (I.J., M.P., T.J.), die Finnish Cultural Foundation (M.V.), die Paulo Foundation (T.P.), Die Cancer Society of Finland (M.P.) und die Emil Aaltonen Foundation (T.P.).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 1000 ul RPT XL Graduated Filter Tip (Sterile), Refill | Starlab | S1182-1730-C | |
| 300 ul RTP Graduated Filter Tip (sterile), Refill | Starlab | S1180-9710-C | |
| 7,12-Dimethylbenz[a]anthracene (DMBA) | Sigma | D3254-100MG | Harmful if swallowed and may cause cancer. Store protected from light. |
| Acetone | Sigma | 1000141011 | Evaporates rapidly and is inflammable. |
| Attane vet 1000 mg/g | Piramal Critical Care Limited | Liquid isoflurane for inhalation | |
| Battery-Operated Clipper Isis | Albert Kerlb GmbH | GT421 | For shaving the fur |
| CONTRAfluran-Restgasfilter | ZeoSys GmbH | For anesthesia | |
| Linex Nature N1030 Ruler 30 cm | Staples Business Advantage | 60383 | For measuring papillomas |
| Medium CO2 Chamber 300 x 200 x 200mm - Red | VetTech Solutions Ltd | AN045AR | For sacrifice |
| Mekasoft | Mekalasi | 23008 | Table cover |
| Mice (Balb/c JRj) | Janvier labs | Other strains also possible | |
| Mice (C57BL/6JRj) | Janvier labs | Other strains also possible | |
| Panasonic Lumix DMC-FS5 Digital Camera | Panasonic | ||
| Paraformaldehyde | Merck | 30525-89-4 | For histology samples |
| Phorbol 12-myristate 13-acetate aka 12-Otetradecanoylphorbol-13-acetate (TPA) | Enzo | BML-PE160-0001 | |
| Precision balance PLJ-C/PLJ-G | KERN & SOHN GmbH | PLJ 600-3CM | |
| Pre-Set CO2 System-2 Chamber-S/S Housing | VetTech Solutions Ltd | AN044BX | For sacrifice |
| RNAlater | Qiagen | 76104 | For nucleic acid samples |
| Tacta pipette 100-1000 ul | Sartorius | LH-729070 | |
| Tacta pipette 20-200 ul | Sartorius | LH-729060 | |
| UNO Anaesthetic Key Filler | Scintica instrumentation inc. | For anesthesia | |
| UNO Face Mask for Mouse | Scintica instrumentation inc. | For anesthesia | |
| UNO FM2200 Flowmeter | Scintica instrumentation inc. | For anesthesia | |
| UNO Gas Exhaust Unit | Scintica instrumentation inc. | For anesthesia | |
| UNO Induction Box | Scintica instrumentation inc. | For anesthesia | |
| UNO200VAP Vaporizer | Scintica instrumentation inc. | For anesthesia |
Referenzen
- DiGiovanni, J. Multistage carcinogenesis in mouse skin. Pharmacology & Therapeutics. 54 (1), 63-128 (1992).
- Abel, E. L., Angel, J. M., Kiguchi, K., DiGiovanni, J. Multi-stage chemical carcinogenesis in mouse skin: fundamentals and applications. Nature Protocols. 4 (9), 1350-1362 (2009).
- Perez-Losada, J., Balmain, A. Stem-cell hierarchy in skin cancer. Nature Reviews. Cancer. 3 (6), 434-443 (2003).
- Bonham, K., et al. Activation of the cellular Harvey ras gene in mouse skin tumors initiated with urethane. Molecular Carcinogenesis. 2 (1), 34-39 (1989).
- Quintanilla, M., Brown, K., Ramsden, M., Balmain, A. Carcinogen-specific mutation and amplification of Ha-ras during mouse skin carcinogenesis. Nature. 322 (6074), 78-80 (1986).
- Nelson, M. A., Futscher, B. W., Kinsella, T., Wymer, J., Bowden, G. T. Detection of mutant Ha-ras genes in chemically initiated mouse skin epidermis before the development of benign tumors. Proceedings of the National Academy of Sciences of the United States of America. 89 (14), 6398-6402 (1992).
- Morris, R. J. A perspective on keratinocyte stem cells as targets for skin carcinogenesis. Differentiation. 72 (8), 381-386 (2004).
- Chung, Y. W., Kim, H. K., Kim, I. Y., Yim, M. B., Chock, P. B. Dual function of protein kinase C (PKC) in 12-O-tetradecanoylphorbol-13-acetate (TPA)-inducec manganese superoxide dismutase (MnSOD) expression: activation of CREB and FOXO3a by PKC-alpha phosphorylation and by PKC-mediated inactivation of Akt, respectively. The Journal of Biological Chemistry. 286 (34), 29681-29690 (2011).
- Su, Z., et al. Tumor promoter TPA activates Wnt/β-catenin signaling in a casein kinase 1-dependent manner. Proceedings of the National Academy of Sciences of the United States of America. 115 (32), 7522-7531 (2018).
- Swann, J. B., et al. Demonstration of inflammation-induced cancer and cancer immunoediting during primary tumorigenesis. Proceedings of the National Academy of Sciences of the United States of America. 105 (2), 652-656 (2008).
- Wang, L., Yi, T., Zhang, W., Pardoll, D. M., Yu, H. IL-17 enhances tumor development in carcinogen-induced skin cancer. Cancer Research. 70 (24), 10112-10120 (2010).
- He, D., et al. IL-17 mediated inflammation promotes tumor growth and progression in the skin. PLoS One. 7 (2), 32126(2012).
- Roussel, L., et al. IL-17 promotes p38 MAPDK-dependent endothelial activation enhancing neutrophil recruitment to sites of inflammation. Journal of Immunology. 184 (8), 4531-4537 (2010).
- Wanqiu, H., Young-Hee, J., Hyun, S. K., Byung, S. K. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibition cellular apoptosis and cytotoxic T cell function. Journal of Virology. 88 (15), 8479-8489 (2014).
- Yusuf, N., et al. Antagonistic roles of CD4+ and CD8+ T-cells in 7,12-dimethylbenz(a)anthracene cutaneous carcinogenesis. Cancer Research. 68 (10), 3924-3930 (2008).
- Gong, L., et al. Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase. Molecular Cancer. 12 (1), 154(2013).
- Vestweber, D., Wessel, F., Nottebaum, A. F. Similarities and differences in the regulation of leukocyte extravasation and vascular permeability. Seminars in Immunopathology. 36 (2), 177-192 (2014).
- Woodworth, C. D., et al. Strain-dependent differences in malignant conversion of mouse skin tumors is an inherent property of the epidermal keratinocyte. Carcinogenesis. 25 (9), 1771-1778 (2004).
- Tennenbaum, T., et al. The suprabasal expression of alpha 6 beta 4 integrin is associated with a high risk for malignant progression in mouse skin carcinogenesis. Cancer Research. 53 (20), 4803-4810 (1993).
- Hennings, H., Shores, R., Mitchell, P., Spangler, E. F., Yuspa, S. H. Induction of papillomas with a high probability of conversion to malignancy. Carcinogenesis. 6 (11), 1607-1610 (1985).
- Auto, Y., et al. Time-Series Analysis of Tumorigenesis in a Murine Skin Carcinogenesis Model. Scientific Reports. 8 (1), 12994(2018).
- Park, H., et al. Bone marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293(2018).
- Reeves, M. Q., Kandyba, E., Harris, S., Del Rosario, R., Balmain, A. Multicolour lineage tracing reveals clonal dynamics of squamous carcinoma evolution from initiation to metastasis. Nature Cell Biology. 20 (6), 699-709 (2018).
- Dao, V., et al. Prevention of carcinogen and inflammation-induced dermal cancer by oral rapamycin includes reducing genetic damage. Cancer Prevention Research. 5, Philadelphia Pa. 400-409 (2015).
- Yeong, L. T., Abdul Hamid, R., Saiful Yazan, L., Khaza’ai, H., Mohtarrudin, N. Low dose triterpene-quinone fraction from Ardisia crispa root precludes chemical-induced mouse skin tumor promotion. BMC Complementary and Alternative Medicine. 15 (1), 431(2015).
- Kong, Y. H., Xu, S. P. Salidroside prevents skin carcinogenesis induced by DMBA/TPA in a mouse model through suppression of inflammation and promotion of apoptosis. Oncology Reports. 39 (6), 2513-2526 (2018).
- Jung, M., Bu, S. Y., Tak, K. H., Park, J. E., Kim, E. Anticarcinogenic effect of quercetin by inhibition of insulin-like growth factor (IGF)-1 signaling in mouse skin cancer. Nutrition Research and Practice. 7 (6), 439-445 (2013).
- Hu, Y. Q., Wang, J., Wu, J. H. Administration of resveratrol enhances cell-cycle arrest followed by apoptosis in DMBA-induced skin carcinogenesis in male Wistar rats. European review for medical and pharmacological sciences. 13, 2935-2946 (2016).
- Schweizer, J., Loehrke, H., Hesse, B., Goerttler, K. 7,12-Dimethylbenz[a]anthracene/12-O-tetradecanoyl-phorbol-13-acetate-mediated skin tumor initiation and promotion in male Sprague-Dawley rats. Carcinogenesis. 3 (7), 785-789 (1982).
- Vähätupa, M., et al. T-cell-expressed proprotein convertase FURIN inhibits DMBA/TPA-induced skin cancer development. Oncoimmunology. 5 (12), 1245266(2016).
- May, U., et al. Resistance of R-Ras knockout mice to skin tumour induction. Scientific Reports. 5, 11663(2015).
- Krajewska, M., et al. Image analysis algorithms for immunohistochemical assessment of cell death events and fibrosis in tissue sections. The Journal of Histochemistry and Cytochemistry. 57 (7), 649-663 (2009).
- Järvinen, T. A., Ruoslahti, E. Target-seeking antifibrotic compound enhances wound healing and suppresses scar formation in mice. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21671-21676 (2010).
- Schwarz, M., Münzel, P. A., Braeuning, A. Non-melanoma skin cancer in mouse and man. Archives of Toxicology. 87 (5), 783-798 (2013).
- Slaga, T. J. SENCAR mouse skin tumorigenesis model versus other strains and stocks of mice. Environmental Health Perspectives. 68, 27-32 (1986).
- Goerttler, K., Loehrke, H., Schweizer, J., Hesse, B. Systemic two-stage carcinogenesis in the epithelium of the forestomach of mice using 7,12-dimethylbenz(a)anthracene as initiator and the phorbol ester 12-O-tetradecanoylphorbol-13-acetate as promoter. Cancer Research. 39 (4), 1293-1297 (1979).
- Topping, D. C., Nettesheim, P. Promotion-like enhancement of tracheal carcinogenesis in rats by 12-O-tetradecanoylphorbol-13-acetate. Cancer Research. 40, 4352-4355 (1980).
- Wille, J. J. Circadian rhythm of tumor promotion in the two-stage model of mouse tumorigenesis. Cancer Letters. 190 (2), 143-149 (2003).
- Lee, Y. S., et al. Inhibition of skin carcinogenesis by suppression of NF-κB dependent ITGAV and TIMP-1 expression in IL32γ overexpressed condition. Journal of Experimental & Clinical Cancer Research. 37 (1), 293(2018).
- Kiss, A., et al. Cell type-specific p38δ targeting reveals a context-, stage-, and sex-dependent regulation of skin carcinogenesis. International Journal of Molecular Sciences. 20 (7), 1532(2019).
- Tomo-o, I., et al. Positron emission tomography imaging of DMBA/TPA mouse skin multi-step tumorigenesis. Molecular Oncology. 4 (2), 119-125 (2010).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454 (7203), 436-444 (2008).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews. Clinical Oncology. 12 (10), 584-596 (2015).
- Hennings, L., et al. Malignant conversion and metastasis of mouse skin tumors: a comparison of SENCAR and CD-1 mice. Environmental Health Perspectives. 68, 69-74 (1986).
- Gómez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Ouhtit, A., Ananthaswamy, H. N. A model for UV-induction of skin cancer. Journal of Biomedicine and Biotechnology. 1 (1), 5-6 (2001).
- Day, C. -P., Marchalik, R., Merlino, G., Michael, H. T. Mouse models of UV-induced melanoma: genetics, pathology, and clinical relevance. Laboratory Investigation. 97 (6), 698-705 (2017).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten