このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ジメチルベンズを用いた化学的誘発性皮膚発癌モデル[a]アントラセンと12-O-テトラデカノイル・ホルボル-13-酢酸(DMBA-TPA)
要約
二段皮膚発癌は、局所的に適用される2つの化学物質によって誘発される。変異原7,12-ジメチルベンズ[a]アントラセン)は、表皮細胞の突然変異を引き起こし、一般的な増殖刺激剤12-O-テトラデカノイルホルボル-13-酢酸の連続的な適用は、皮膚乳頭腫形成を促進する。
要約
癌は最も壊滅的な人間の病気の一つです。実験的な癌モデルは、腫瘍の進行を促進する上で異なる細胞型および遺伝子の複雑な相互作用に関する洞察を得て、異なる治療アプローチの有効性をテストするためのプラットフォームを提供するために重要である。最も一般的に使用される実験的炎症性癌モデルの1つは、DMBA-TPA二段皮膚発癌モデルである。腫瘍形成は、7,12-ジメチルベンズ(a)アントラセン(DMBA)と12-O-テトラデカノイルホルボル-13-酢酸(TPA)の2つの異なる化学物質の局所適用によってこのモデルに誘導され、一緒に皮膚に乳頭腫形成を引き起こす。主な結果は皮膚における乳頭腫形成であるため、モデルは、腫瘍の開始(腫瘍を含まない生存)と腫瘍進行(目に見える腫瘍の数と大きさ)の両方に対処するための理想的で信頼性が高く、再現可能な方法です。DMBA-TPA治療の効果は炎症機構を介して伝達され、このモデルは腫瘍形成における免疫系の役割を研究するのに特に適している。しかし、このモデルは、化学物質を適用できる皮膚および他の表面に制限される。この記事では、モデルを正常に使用するための詳細なプロトコルが提供されています。
概要
癌は世界の主要な死因の一つである。したがって、疾患のより良い理解を得るために、また潜在的な治療アプローチを探求するために、信頼性の高い実験疾患モデルを開発する必要があります。皮膚癌の発症を研究するために生体内モデルで最も一般的に使用される実験の1つは、化学的に誘導された二段皮膚発癌モデル1、2である。このモデルは、免疫細胞浸潤や血管新生などの特定の事象に加えて、腫瘍の開始、促進、および進行を研究するためのツールを提供します。
二段皮膚発癌モデルを使用するために、マウスの背部皮膚は、一緒に腫瘍形成を誘導する2つの異なる化学物質で治療される。モデルは、変異原、DMBAの低用量で開始され、続いて腫瘍プロモーターへの長期暴露、TPA3(図1)。DMBAは、表皮細胞および原発性角化細胞幹細胞4、5、6、7のDNAと共有付加を形成することによりDNAをランダムに変異させる。これらのランダム突然変異の一部は、Hras1(KrasおよびNrasの突然変異も検出される)のようなプロトオンコジーンで起こり、プロトオンコゲ遺伝子を腫瘍遺伝子に変換すると、適切な刺激の下で腫瘍形成を促進する。TPAは、順番に、最も一般的に使用される腫瘍増殖促進剤である。その分子標的はプロテインキナーゼC(PKC)8である。TPAはまた、モデル9の腫瘍形成に不可欠なWnt/β-カテニンシグナル伝達を活性化する。促進剤への反復および長期暴露は、細胞シグナル伝達の増強、増殖因子の産生の増加、および治療された皮膚におけるDNA合成および炎症性細胞浸潤の増加によって明らかである局所炎症反応につながる。
DMBA-TPAモデルの主要な炎症メディエーターは10.インターロイキン-17A(IL-17A)は、DMBA-TPAモデル11、12において特に腫瘍原性であることが知られている。インターロイキン6(IL-6)との相乗効果で動作し、マクロファージおよび好中球募集13、14に参加しています。さらに、CD4+T細胞および好中球は、DMBA-TPAモデルにおいて腫瘍原性であることが示されている。最後に、マクロファージはまた、モデル15、16、17における腫瘍形成を促進することができる。
促進段階では、変異細胞の細胞増殖が増強され、表皮の持続的な過形成が1に維持される。これは、10〜20週で皮膚の乳頭腫の発症につながり、その後乳頭腫は悪性腫瘍に変換し始め、扁平上皮癌(SCC)2。しかしながら、乳頭腫の10%未満は悪性腫瘍に進行するが、この割合はマウス2、18の遺伝的背景にも依存する。何十年もの間、悪性腫瘍につながる腫瘍で最初にどのような種類の細胞が変異したのかは分かっていなかったが、良性乳頭腫19、20と比較した場合、悪性腫瘍の明らかに明確な特徴を報告していた。しかし、最近の研究は、DMBA-TPAモデル21における腫瘍形成のクローン起源に関する我々の理解を大幅に高めています。22.23.骨髄由来上皮細胞および毛包幹細胞の両方が腫瘍形成22に寄与することが実証された。ステージ特異的系統追跡研究は、良性乳頭腫がモノクローナル起源であることを明らかにしたが、彼らは新しい上皮細胞集団21、23を募集する。しかし、細胞クローンの1つだけは発癌のドライバーとして機能します。それはフラス突然変異23を含んでいます。癌形成への進行は、クローンススイープ23に関連している。
発がん性DMBAは乳頭腫形成を開始し、TPAは腫瘍の増殖を促進する。したがって、腫瘍開始は、TPA治療期間の前に実験を中断することによって、促進とは別に研究することができる。腫瘍の進行が毎週研究されているように、それは研究全体を通して詳細な腫瘍の成長分析のための素晴らしい機会を提供しています。腫瘍は外部化学物質によって生成されるため、生殖細胞系列の発癌性突然変異は不要である。従って、遺伝的背景(例えば、ノックアウト/トランスジーン対野生型)が腫瘍形成に及ぼす影響を研究することは、簡単な2である。要するに、DMBA/TPA皮膚癌モデルは、腫瘍進行における免疫系の役割を研究するだけでなく、腫瘍の開始および促進ステップを独立または相互に依存的に評価するための特に有用なアプローチである。
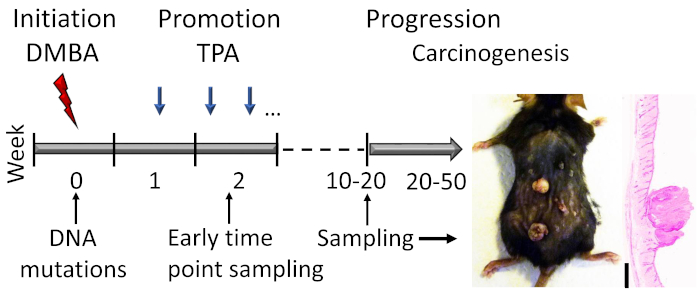
図1:DMBA-TPA誘発皮膚発癌モデルの概要発がん性DMBAは、モデルの開始段階でDNA突然変異を誘導するために局所的に適用される。増殖促進剤TPAは、促進段階の間に細胞増殖を増強するために週2倍投与され、皮膚における乳頭腫の発症につながる。動物は、乳頭腫応答が高原に達した後、マウスの遺伝的背景に応じて、通常15〜20週以内に犠牲にされる。乳頭腫のごく一部は、さらに20〜50週間以内にSCCに発展することができます。開始および早期プロモーション段階の初期の事象を研究するために、サンプルを収集することができる(例えば、2番目のTPAアプリケーションの直後)。19週間の治療後のC57BL/6マウス皮膚上の乳頭腫の代表的な写真およびヘマトキシリンおよびエオシン染色断面が示されている。スケール バー = 0.1 mm.ここをクリックすると、この図の大きなバージョンが表示されます。
プロトコル
ここで説明するプロトコルは、フィンランドの国家動物倫理委員会(プロトコル番号ESAVI/23659/2018)によって承認されています。
1. 実験動物・試薬・機器
- 年齢と性別に一致したマウスを使用します。ほとんどのマウスの皮膚は、その2歳の周りのテロゲン(休息段階)にあるので、7〜9週齢で研究を開始します。
- 研究中に動物の行動を観察し、彼らが戦う場合は、しばしば男性と起こる場合は、それらを別々に収容します。けんかは皮膚の切り傷を引き起こし、腫瘍形成を促進する。雌マウスは、攻撃的な行動が少ないため好ましい。典型的な実験群の大きさは、群24、25、26、27につき8〜20匹の動物の間で変化する。
メモ:以前の研究で見られた生物学的分散に基づく電力計算は、十分に大きなグループサイズを選択するのに役立ちます。この記事の例として使用される株には、Balb/c および C57BL/6 が含まれます。しかし、SENCARやFVBなどの他の多くのマウス株は、DMBA-TPAモデルだけでなく、ウィスターとスプレイグ・ドーリーラット2、28、29で使用されています。研究開始前に、動物の仕事の国家または地方委員会からのライセンスが必要です。一般的な福祉に関する考慮事項に加えて、モデル固有のエンドポイントは、典型的には扁平上皮癌(SCC)および皮膚の感染である。アセトン中の腫瘍性化学物質の適用後のかゆみによる皮膚の傷は典型的であるが、そうでなければ動物は不快感の徴候を示すべきではない。定期的に(例えば、月に2倍)体重を量ると、動物の福祉を評価するのに役立ちます。 - DMBAとTPAを使用し、両方ともアセトンで希釈します。DMBAの作動濃度は250 g/Lである。1匹の動物の用量は、アセトンの200μLでDMBAの50μgである。TPAのストック濃度は125g/L、処理濃度は25g/Lです。1匹の動物のTPA用量は、アセトンの200μLで5μgである。
注意: DMBAは飲み込むと有害であり、癌を引き起こす可能性があります。アセトンは急速に蒸発し、可燃性である。めまいを引き起こし、目を刺激する可能性があります。呼吸マスクを使用し、真空の流れの下で作業します。これらの化学物質のいずれかを取り扱った後、手袋を交換してください。個々に換気されたケージは、マウスの収容中に化学物質の拡散を防ぎます。塗布後、DMBAの取り扱いに使用するピペットチップを収集し、危険廃棄物として処分してください。
メモ:DMBAは光から保護する必要があります。希釈されたTPAは−20°Cに貯蔵され、好ましくは光から保護される。 - 次の機器を調達する:スケール、毛皮のための通常の剃毛器、適切なサイズのピペットとヒント、通常の定規、デジタルカメラ、メモ帳とパンピロマを記録するためのペンまたはコンピュータ、吸入麻酔システムまたはマウス拘束器背面の開口部と、マウスを犠牲にするための二酸化炭素ナルコシスシステムを備えています。
2. 皮膚乳頭腫の誘導と促進
- 背中の皮膚を剃り、動物の重さを量る。後で、化学暴露時ではなく、必要なときにはいつでも皮膚を剃ります。
メモ:乳頭腫の周りを剃るときは注意し、皮膚に切り傷を与えないでください。潜在的な体重減少に気づくには、2週間ごとに各動物の体重を量ります。 - 毛皮を削った後、ピペット48時間を使用して、シェービングエリアに200μLのアセトンに50μgのDMBAを塗布します。必要に応じて、光吸入麻酔またはマウス拘束剤を使用して動物を拘束する。
- 7日後、最初のTPA用量を与える。週2xのピペット、好ましくは月曜日、木曜日または火曜日と金曜日に、200°Lのアセトンに5μgのTPAを局所的に適用します。
- 毎週乳頭腫を数え、記録し、撮影します。直径1mmを超える触知可能な塊は、それが1週間より長くとどまる場合、乳頭腫とみなされます。地図上の個々の乳頭腫をマークし、毎週そのサイズをリストします。デジタル写真を保存します。
3. 動物の犠牲とサンプルコレクション
- 腫瘍応答が高原に達するまで治療を続ける。一般に、乳頭腫の負担は、使用されるマウス株に応じて、開始後10〜20週増加すると予想される。高原は15~20週間で予定されています。乳頭腫の小さな割合(3%以下)20~50週間以内にSCCに発展する可能性があります。
- 最後のTPAアプリケーションの後に動物24時間を犠牲にします。子宮頸部脱臼または別の適切な方法で二酸化炭素ナルコシスを使用してください。
- 研究の質問に応じて、動物30、31から適切なサンプル材料を収集する。
- 例えば、犠牲の前に血液サンプルを採取し、血漿を分離する。
- 免疫ヒストケミストリー(IHC)染色のための皮膚の切断片(例えば、ヘマトキシリンおよびエオシン、増殖または炎症性細胞)。
- 生検パンチを使用して、遺伝子発現(例えば、qPCR)および/またはタンパク質分析(例えば、ウェスタンブロットまたはELISA)のために乳頭腫組織または非乳頭腫(治療)皮膚のいずれかで皮膚片を収集します。
- 免疫細胞集団のより詳細な分析が望まれる場合は、フローサイトメトリー分析のために脾臓と皮膚を排出するリンパ節の一部を収集します。さらに分析するために、表皮層と真皮層を分離することもできます。
4. 統計
- 乳頭腫フリー時間のカプランマイヤー生存曲線を描き、生存のためのマンテルコックスログランクテストを使用します。週あたりの乳頭腫の数の線形曲線を描きます。これはカウント データであるため、非線形回帰モデルを使用します。必要に応じて統計学者に相談してください。
結果
主な結果は、治療または遺伝子型群間の生存(すなわち、乳頭腫フリー)時間である。二次的な結果は、各グループの週あたりの乳頭腫の数です(図2)。期待される結果は、乳頭腫の自由時間と実験(2つ以上)群間の乳頭腫の数において統計的に有意な差である。その段階でのグループ間の違いを把握するために、パピロマの数をカウントし、プロモーション(TPA)フェーズ中に...
ディスカッション
DMBA-TPA誘発性皮膚癌は、非常に再現性が高く、開始から悪性腫瘍への腫瘍進行に関する情報を提供するため、最も一般的に使用される癌モデルの1つである。主要な結果測定は、乳頭腫形成が容易かつ確実に定量的である。このモデルは、腫瘍開始(腫瘍フリー生存)と進行(腫瘍数とサイズ)の両方に同時に対処する。このモデルは、潜在的な治療薬などの異なる化合物の研究、および遺伝子組み...
開示事項
著者たちは何も開示する必要はない。
謝辞
この作品は、フィンランドアカデミー(助成金25013080481および25013142041(I.J.)、286377および295814(M.P.)、287907(T.J.))、パイビッキとサカリ・サルベルク財団(M.P.)によって資金提供されました。 T.J.)、フィンランド医学財団(T.P.)、競争国家研究タンペレ大学病院の専門家責任領域(助成金9V049および9X044(M.P.)、9X011および9V010(T.J.))、フィムラボ研究所の専門家責任領域の競争国家研究ファイナンス(助成金X51409(I.J.))、テイズ支援財団(I.J.、M.P.、T.J.)、タンペレ結核財団(I.J.、M.P.、T.J.)、フィンランド文化財団(M.V.)、パウロ財団(T.P.)、フィンランド癌協会(M.P.)、エミール・アールトネン財団(T.P.)。
資料
| Name | Company | Catalog Number | Comments |
| 1000 ul RPT XL Graduated Filter Tip (Sterile), Refill | Starlab | S1182-1730-C | |
| 300 ul RTP Graduated Filter Tip (sterile), Refill | Starlab | S1180-9710-C | |
| 7,12-Dimethylbenz[a]anthracene (DMBA) | Sigma | D3254-100MG | Harmful if swallowed and may cause cancer. Store protected from light. |
| Acetone | Sigma | 1000141011 | Evaporates rapidly and is inflammable. |
| Attane vet 1000 mg/g | Piramal Critical Care Limited | Liquid isoflurane for inhalation | |
| Battery-Operated Clipper Isis | Albert Kerlb GmbH | GT421 | For shaving the fur |
| CONTRAfluran-Restgasfilter | ZeoSys GmbH | For anesthesia | |
| Linex Nature N1030 Ruler 30 cm | Staples Business Advantage | 60383 | For measuring papillomas |
| Medium CO2 Chamber 300 x 200 x 200mm - Red | VetTech Solutions Ltd | AN045AR | For sacrifice |
| Mekasoft | Mekalasi | 23008 | Table cover |
| Mice (Balb/c JRj) | Janvier labs | Other strains also possible | |
| Mice (C57BL/6JRj) | Janvier labs | Other strains also possible | |
| Panasonic Lumix DMC-FS5 Digital Camera | Panasonic | ||
| Paraformaldehyde | Merck | 30525-89-4 | For histology samples |
| Phorbol 12-myristate 13-acetate aka 12-Otetradecanoylphorbol-13-acetate (TPA) | Enzo | BML-PE160-0001 | |
| Precision balance PLJ-C/PLJ-G | KERN & SOHN GmbH | PLJ 600-3CM | |
| Pre-Set CO2 System-2 Chamber-S/S Housing | VetTech Solutions Ltd | AN044BX | For sacrifice |
| RNAlater | Qiagen | 76104 | For nucleic acid samples |
| Tacta pipette 100-1000 ul | Sartorius | LH-729070 | |
| Tacta pipette 20-200 ul | Sartorius | LH-729060 | |
| UNO Anaesthetic Key Filler | Scintica instrumentation inc. | For anesthesia | |
| UNO Face Mask for Mouse | Scintica instrumentation inc. | For anesthesia | |
| UNO FM2200 Flowmeter | Scintica instrumentation inc. | For anesthesia | |
| UNO Gas Exhaust Unit | Scintica instrumentation inc. | For anesthesia | |
| UNO Induction Box | Scintica instrumentation inc. | For anesthesia | |
| UNO200VAP Vaporizer | Scintica instrumentation inc. | For anesthesia |
参考文献
- DiGiovanni, J. Multistage carcinogenesis in mouse skin. Pharmacology & Therapeutics. 54 (1), 63-128 (1992).
- Abel, E. L., Angel, J. M., Kiguchi, K., DiGiovanni, J. Multi-stage chemical carcinogenesis in mouse skin: fundamentals and applications. Nature Protocols. 4 (9), 1350-1362 (2009).
- Perez-Losada, J., Balmain, A. Stem-cell hierarchy in skin cancer. Nature Reviews. Cancer. 3 (6), 434-443 (2003).
- Bonham, K., et al. Activation of the cellular Harvey ras gene in mouse skin tumors initiated with urethane. Molecular Carcinogenesis. 2 (1), 34-39 (1989).
- Quintanilla, M., Brown, K., Ramsden, M., Balmain, A. Carcinogen-specific mutation and amplification of Ha-ras during mouse skin carcinogenesis. Nature. 322 (6074), 78-80 (1986).
- Nelson, M. A., Futscher, B. W., Kinsella, T., Wymer, J., Bowden, G. T. Detection of mutant Ha-ras genes in chemically initiated mouse skin epidermis before the development of benign tumors. Proceedings of the National Academy of Sciences of the United States of America. 89 (14), 6398-6402 (1992).
- Morris, R. J. A perspective on keratinocyte stem cells as targets for skin carcinogenesis. Differentiation. 72 (8), 381-386 (2004).
- Chung, Y. W., Kim, H. K., Kim, I. Y., Yim, M. B., Chock, P. B. Dual function of protein kinase C (PKC) in 12-O-tetradecanoylphorbol-13-acetate (TPA)-inducec manganese superoxide dismutase (MnSOD) expression: activation of CREB and FOXO3a by PKC-alpha phosphorylation and by PKC-mediated inactivation of Akt, respectively. The Journal of Biological Chemistry. 286 (34), 29681-29690 (2011).
- Su, Z., et al. Tumor promoter TPA activates Wnt/β-catenin signaling in a casein kinase 1-dependent manner. Proceedings of the National Academy of Sciences of the United States of America. 115 (32), 7522-7531 (2018).
- Swann, J. B., et al. Demonstration of inflammation-induced cancer and cancer immunoediting during primary tumorigenesis. Proceedings of the National Academy of Sciences of the United States of America. 105 (2), 652-656 (2008).
- Wang, L., Yi, T., Zhang, W., Pardoll, D. M., Yu, H. IL-17 enhances tumor development in carcinogen-induced skin cancer. Cancer Research. 70 (24), 10112-10120 (2010).
- He, D., et al. IL-17 mediated inflammation promotes tumor growth and progression in the skin. PLoS One. 7 (2), 32126 (2012).
- Roussel, L., et al. IL-17 promotes p38 MAPDK-dependent endothelial activation enhancing neutrophil recruitment to sites of inflammation. Journal of Immunology. 184 (8), 4531-4537 (2010).
- Wanqiu, H., Young-Hee, J., Hyun, S. K., Byung, S. K. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibition cellular apoptosis and cytotoxic T cell function. Journal of Virology. 88 (15), 8479-8489 (2014).
- Yusuf, N., et al. Antagonistic roles of CD4+ and CD8+ T-cells in 7,12-dimethylbenz(a)anthracene cutaneous carcinogenesis. Cancer Research. 68 (10), 3924-3930 (2008).
- Gong, L., et al. Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase. Molecular Cancer. 12 (1), 154 (2013).
- Vestweber, D., Wessel, F., Nottebaum, A. F. Similarities and differences in the regulation of leukocyte extravasation and vascular permeability. Seminars in Immunopathology. 36 (2), 177-192 (2014).
- Woodworth, C. D., et al. Strain-dependent differences in malignant conversion of mouse skin tumors is an inherent property of the epidermal keratinocyte. Carcinogenesis. 25 (9), 1771-1778 (2004).
- Tennenbaum, T., et al. The suprabasal expression of alpha 6 beta 4 integrin is associated with a high risk for malignant progression in mouse skin carcinogenesis. Cancer Research. 53 (20), 4803-4810 (1993).
- Hennings, H., Shores, R., Mitchell, P., Spangler, E. F., Yuspa, S. H. Induction of papillomas with a high probability of conversion to malignancy. Carcinogenesis. 6 (11), 1607-1610 (1985).
- Auto, Y., et al. Time-Series Analysis of Tumorigenesis in a Murine Skin Carcinogenesis Model. Scientific Reports. 8 (1), 12994 (2018).
- Park, H., et al. Bone marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Reeves, M. Q., Kandyba, E., Harris, S., Del Rosario, R., Balmain, A. Multicolour lineage tracing reveals clonal dynamics of squamous carcinoma evolution from initiation to metastasis. Nature Cell Biology. 20 (6), 699-709 (2018).
- Dao, V., et al. Prevention of carcinogen and inflammation-induced dermal cancer by oral rapamycin includes reducing genetic damage. Cancer Prevention Research. 5, 400-409 (2015).
- Yeong, L. T., Abdul Hamid, R., Saiful Yazan, L., Khaza’ai, H., Mohtarrudin, N. Low dose triterpene-quinone fraction from Ardisia crispa root precludes chemical-induced mouse skin tumor promotion. BMC Complementary and Alternative Medicine. 15 (1), 431 (2015).
- Kong, Y. H., Xu, S. P. Salidroside prevents skin carcinogenesis induced by DMBA/TPA in a mouse model through suppression of inflammation and promotion of apoptosis. Oncology Reports. 39 (6), 2513-2526 (2018).
- Jung, M., Bu, S. Y., Tak, K. H., Park, J. E., Kim, E. Anticarcinogenic effect of quercetin by inhibition of insulin-like growth factor (IGF)-1 signaling in mouse skin cancer. Nutrition Research and Practice. 7 (6), 439-445 (2013).
- Hu, Y. Q., Wang, J., Wu, J. H. Administration of resveratrol enhances cell-cycle arrest followed by apoptosis in DMBA-induced skin carcinogenesis in male Wistar rats. European review for medical and pharmacological sciences. 13, 2935-2946 (2016).
- Schweizer, J., Loehrke, H., Hesse, B., Goerttler, K. 7,12-Dimethylbenz[a]anthracene/12-O-tetradecanoyl-phorbol-13-acetate-mediated skin tumor initiation and promotion in male Sprague-Dawley rats. Carcinogenesis. 3 (7), 785-789 (1982).
- Vähätupa, M., et al. T-cell-expressed proprotein convertase FURIN inhibits DMBA/TPA-induced skin cancer development. Oncoimmunology. 5 (12), 1245266 (2016).
- May, U., et al. Resistance of R-Ras knockout mice to skin tumour induction. Scientific Reports. 5, 11663 (2015).
- Krajewska, M., et al. Image analysis algorithms for immunohistochemical assessment of cell death events and fibrosis in tissue sections. The Journal of Histochemistry and Cytochemistry. 57 (7), 649-663 (2009).
- Järvinen, T. A., Ruoslahti, E. Target-seeking antifibrotic compound enhances wound healing and suppresses scar formation in mice. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21671-21676 (2010).
- Schwarz, M., Münzel, P. A., Braeuning, A. Non-melanoma skin cancer in mouse and man. Archives of Toxicology. 87 (5), 783-798 (2013).
- Slaga, T. J. SENCAR mouse skin tumorigenesis model versus other strains and stocks of mice. Environmental Health Perspectives. 68, 27-32 (1986).
- Goerttler, K., Loehrke, H., Schweizer, J., Hesse, B. Systemic two-stage carcinogenesis in the epithelium of the forestomach of mice using 7,12-dimethylbenz(a)anthracene as initiator and the phorbol ester 12-O-tetradecanoylphorbol-13-acetate as promoter. Cancer Research. 39 (4), 1293-1297 (1979).
- Topping, D. C., Nettesheim, P. Promotion-like enhancement of tracheal carcinogenesis in rats by 12-O-tetradecanoylphorbol-13-acetate. Cancer Research. 40, 4352-4355 (1980).
- Wille, J. J. Circadian rhythm of tumor promotion in the two-stage model of mouse tumorigenesis. Cancer Letters. 190 (2), 143-149 (2003).
- Lee, Y. S., et al. Inhibition of skin carcinogenesis by suppression of NF-κB dependent ITGAV and TIMP-1 expression in IL32γ overexpressed condition. Journal of Experimental & Clinical Cancer Research. 37 (1), 293 (2018).
- Kiss, A., et al. Cell type-specific p38δ targeting reveals a context-, stage-, and sex-dependent regulation of skin carcinogenesis. International Journal of Molecular Sciences. 20 (7), 1532 (2019).
- Tomo-o, I., et al. Positron emission tomography imaging of DMBA/TPA mouse skin multi-step tumorigenesis. Molecular Oncology. 4 (2), 119-125 (2010).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454 (7203), 436-444 (2008).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews. Clinical Oncology. 12 (10), 584-596 (2015).
- Hennings, L., et al. Malignant conversion and metastasis of mouse skin tumors: a comparison of SENCAR and CD-1 mice. Environmental Health Perspectives. 68, 69-74 (1986).
- Gómez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Ouhtit, A., Ananthaswamy, H. N. A model for UV-induction of skin cancer. Journal of Biomedicine and Biotechnology. 1 (1), 5-6 (2001).
- Day, C. -. P., Marchalik, R., Merlino, G., Michael, H. T. Mouse models of UV-induced melanoma: genetics, pathology, and clinical relevance. Laboratory Investigation. 97 (6), 698-705 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved